El propósito fue evaluar la respuesta inflamatoria a la implantación del material Bioceramic en tejido subcutáneo de ratas. Se utilizaron nueve ratas machos Wistar (Rattus norvegicus) a las que les implantaron cuatro tubos de dentina rellenos con cemento sellador Bioceramic y un tubo vacío como grupo control. Se analizaron en tres periodos de tiempo (96 horas, 10 y 21 días). Los animales fueron sacrificados por sobredosis y las muestras obtenidas se procesaron mediante tinción con hematoxilina y eosina para ser analizadas microscópicamente. Los resultados mostraron a las 96 horas inflamación moderada en 75% y severa en 25%. 10 días después disminuyó la inflamación de moderada (67%) a severa (25%). En el periodo final de 21 días se observó inflamación moderada a leve (50%). Se concluye que existió inflamación de moderada a severa en los periodos iniciales, disminuyó a leve en el último periodo. Bioceramic presenta una aceptable respuesta biológica en tejido subcutáneo de ratas.
The aim of the present article was to assess inflammatory response caused by implantation of Bioceramic material in rats’ subcutaneous tissue. Nine male Wistar rats were used (Rattus Norvegicus) to which four dentin tubes filled with Bioceramic sealing cement material and one empty tube (control group) were implanted. Results were analyzed in three time periods (96hours, 10 and 21 days). Animals were sacrificed by anesthetic overdose. Obtained samples were processed by hematoxylin and eosin staining in order to be analyzed with microscope. Results after 96hours revealed moderate inflammation in 75% of all cases and severe inflammation in 25% of all cases. Ten days later, inflammation decreased from moderate (67%) to mild (25%). At the final period of 21 days, moderate to mild inflammation was observed (50%). It was concluded that there was presence of moderate to severe inflammation at initial periods which decreased to mild inflammation at the final period. «Bioceramic» brand material exhibits acceptable biological response in rats’ subcutaneous tissues.
La introducción de materiales biocerámicos en odontología ha desencadenado nuevas interacciones de estudios de materiales de referencias originales; los biomateriales en endodoncia tienen un papel importante ya que entran en contacto directo con el ligamento periodontal y el hueso alveolar a través del foramen apical, fracturas radiculares, perforaciones radiculares u obturaciones retrógradas. Se compone de silicatos de calcio, óxido de zirconio, fosfato monobásico de calcio, hidróxido de calcio, agentes de relleno y espesantes.1,2
El cemento Bioceramic es un material biocerámico premezclado que se diseñó como cemento de silicato.1 Posee buena radiopacidad, pH de 12.9,3 estabilidad dimensional, mínima contracción, tiempo de trabajo de cuatro horas y no es reabsorbible en el interior del conducto radicular.4 Su presentación es en forma de polvo/líquido, pasta/pasta y más recientemente premezclado en jeringa. En algunos trabajos se investigaron sus propiedades biológicas, físico-químicas, citotoxicidad, pH, radiopacidad, liberación de iones de calcio de los cementos biocerámicos.5–12
Zhang et al. (2009) demostraron que el cemento iRoot SP conocido como Bioceramic elimina todas las bacterias dentro de los dos minutos de contacto. Los autores consideran que el efecto antibacteriano potente puede ser por una combinación de su alto pH, naturaleza hidrófila y su difusión activa de hidróxido de calcio.6 Candeiro et al. (2012) demostraron que Bioceramic presenta radiopacidad menor que AH-Plus, posee un pH alto y mayor liberación de iones de calcio;10 sin embargo, ambos selladores cumplen la norma ISO 6876/2001. Han y Okiji (2013) compararon el ProRoot-MTA blanco, Biodentine y Bioceramic, con respecto a la capacidad de producir apatita y liberar iones de calcio. Biodentine y ProRoo-MTA blanco liberaron más iones de calcio que Bioceramic.11 Zhang & Peng (2010) cultivaron fibroblastos de ratón y les colocaron los tres cementos selladores Bioceramic, ProRoot-MTA y AHPlus. El AH-Plus se mostró más tóxico para los fibroblastos en comparación con ProRoot MTA blanco y Bioceramic, con toxicidad intermedia.7
En cultivo celular Zoufanet al. (2011) demostraron que el GuttaFlow y Bioceramic poseen citotoxicidad menor que AH Plus y Tubli-Seal.8 Loushine et al. (2011) demostraron que AH-Plus y Bioceramic presentaron citotoxicidad severa a las 24 horas. Sin embargo, con AH-Plus disminuyó gradualmente mientras que Bioceramic permaneció moderadamente tóxico en un periodo de seis semanas.9
En la literatura existen pocos trabajos que evalúen la biocompatibilidad de los cementos biocerámicos en tejido conjuntivo. Por lo tanto, el propósito del trabajo es evaluar la respuesta inflamatoria de Bioceramic en tejido subcutáneo de ratas.
MATERIAL Y MÉTODOSSe utilizaron nueve ratas machos Wistar (Rattus norvegicus) con un peso de entre 200-300 gramos, distribuidas en tres grupos de tres ratas cada uno. A cada animal se le implantaron tres tubos de dentina de 5mm de longitud 0.5 de diámetro, obtenidos de raíces distales y palatinas de molares los cuales fueran rellenados con Bioceramic (Endosequence BC Sealer) de acuerdo con las indicaciones del fabricante para su preparación, el tubo vació se utilizó como grupo control.
Los tubos de dentina fueron desinfectados en glutaraldehído al 2.2% por 12 horas y esterilizados en autoclave antes del procedimiento quirúrgico. Se rellenaron los tubos con Bioceramic y se dividieron en tres grupos de acuerdo al periodo de tiempo analizado (96 horas, 10 y 21 días). Los animales fueron anestesiados con una dosis de 0.001mg/kg de peso de clorhidrato de ketamina (Cheminova, México-D.F.) por vía intraperitoneal retirándose el pelaje del dorso y previa antisepsia con isodine (Dermodine, Morelos, México). Se realizaron tres incisiones de aproximadamente 5mm con hoja de bisturí número 15 (Denti-Lab, Cdo. de México-México) en la parte dorsal anterior y posterior. Se realizó la divulsión y se implantaron longitudinalmente los tubos rellenos de Bioceramic y los vacíos en los animales. Se suturó con hilo de nylon 6.0 (Ethicon, México-D.F.). Los animales fueron sacrificados a las 96 horas, 10 y 21 días con sobredosis de anestesia (clorhidrato de ketamina, Cheminova, México-D.F.), obteniéndose tejido para su estudio con una biopsia excisional alrededor del área del implante y se fijaron en formol al 10%. Se retiró el tubo con una incisión sobre su eje longitudinal y se desalojó sin tocar los extremos del tejido. Se obtuvieron 48 muestras para el procesado histotécnico correspondiente. Las secciones fueron seriadas de 5μm de espesor que se tiñeron con hematoxilina y eosina para observarlas en el microscopio de luz óptica a 40X. En la evaluación de la respuesta inflamatoria se observó la presencia de células inflamatorias como polimorfonucleares neutrófilos, linfocitos, macrófagos, eosinófilos, células plasmáticas y gigantes próximas a la apertura del tubo atribuyéndose los escores: 0-ausencia, 1-leve, 2-moderada y 3-severa. Las muestras fueron interpretadas por un especialista en patología y se sometieron al análisis estadístico.
RESULTADOSFue analizado un total de 48 muestras. 32 con cemento Bioceramic y 16 de los tubos vacíos.
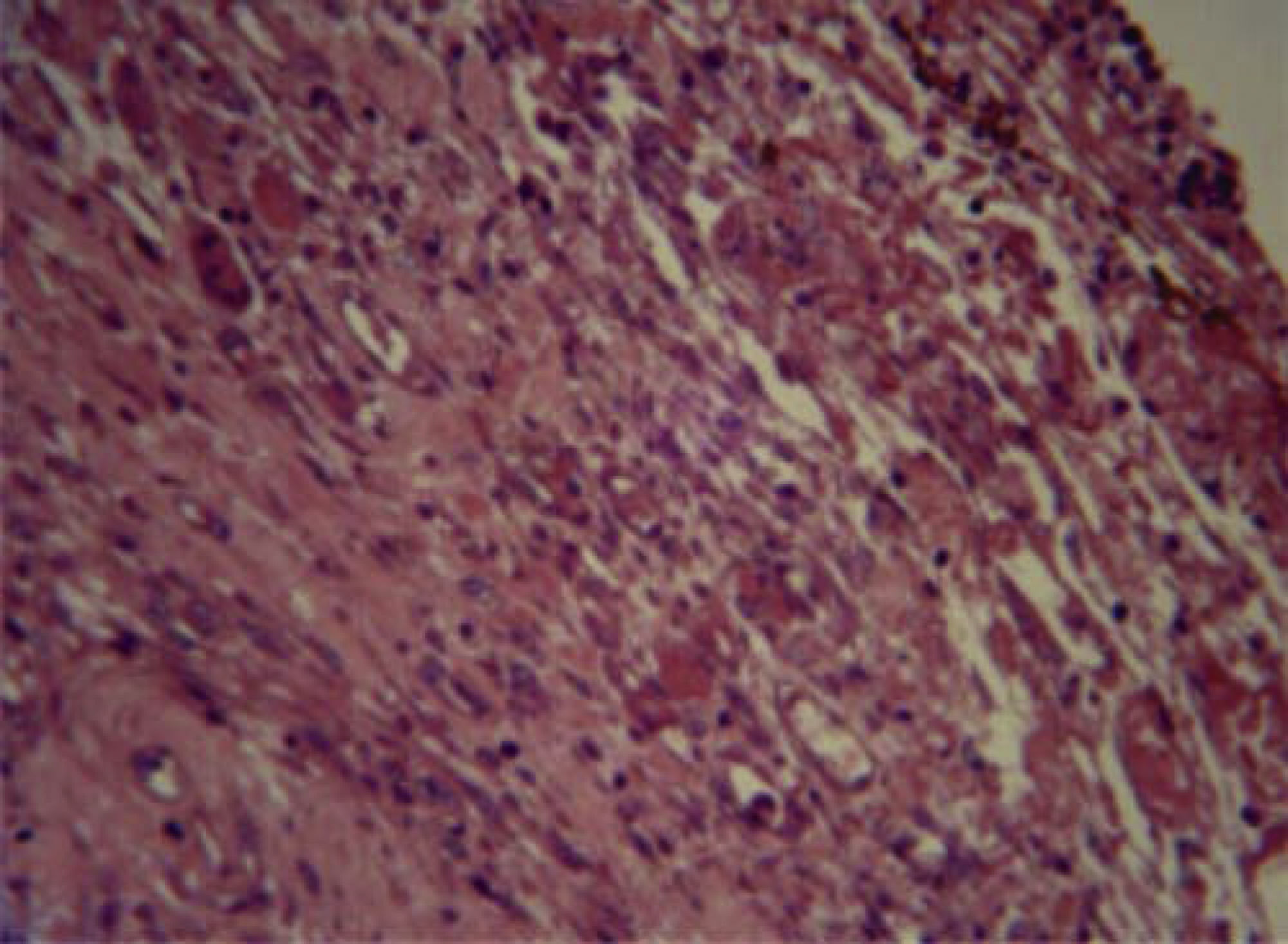
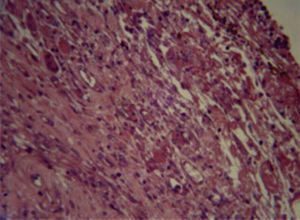
En la respuesta tisular con Bioceramic a las 96 horas se observaron neutrófilos, macrófagos, células plasmáticas y congestión vascular de forma moderada (Figura 1).
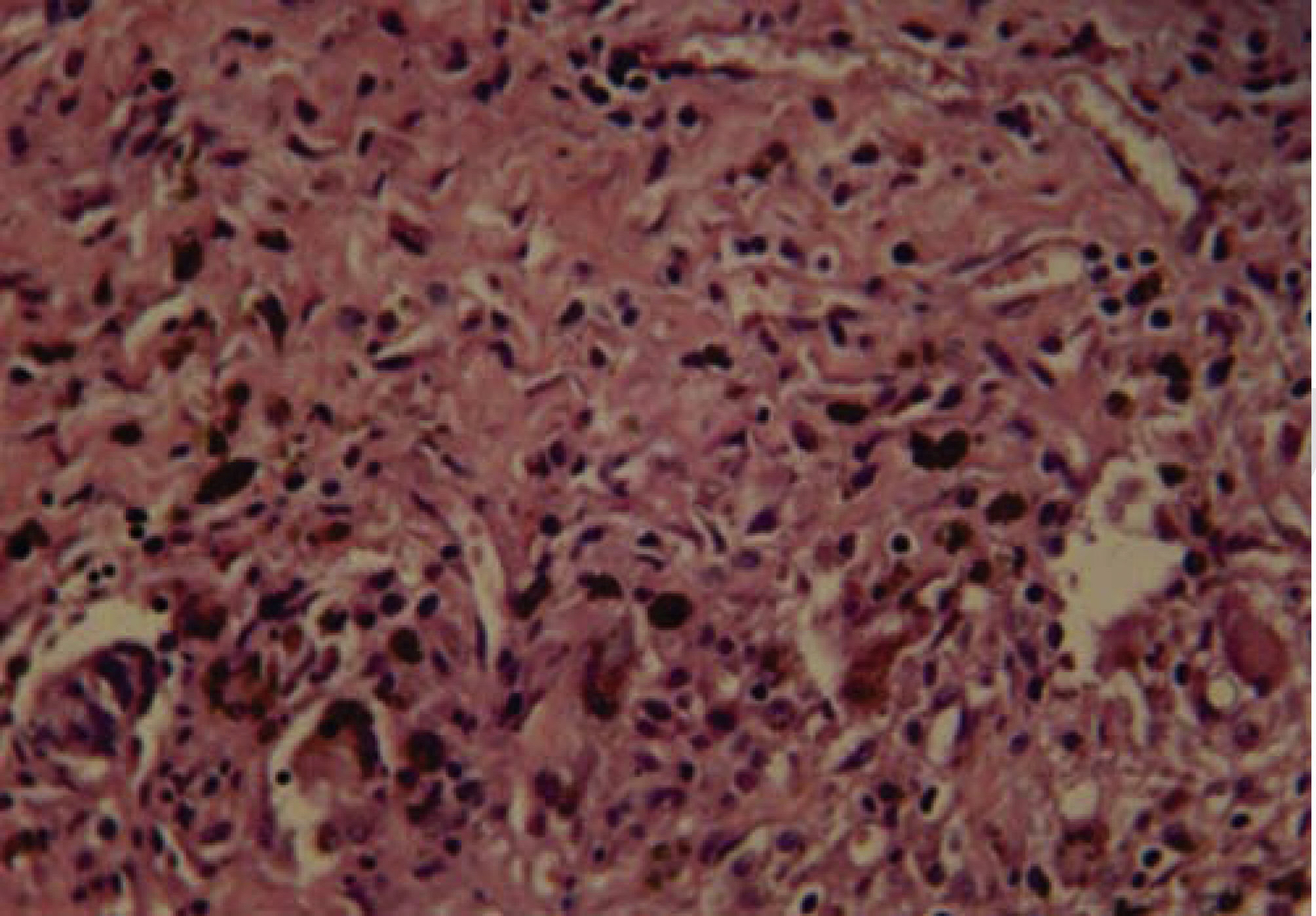
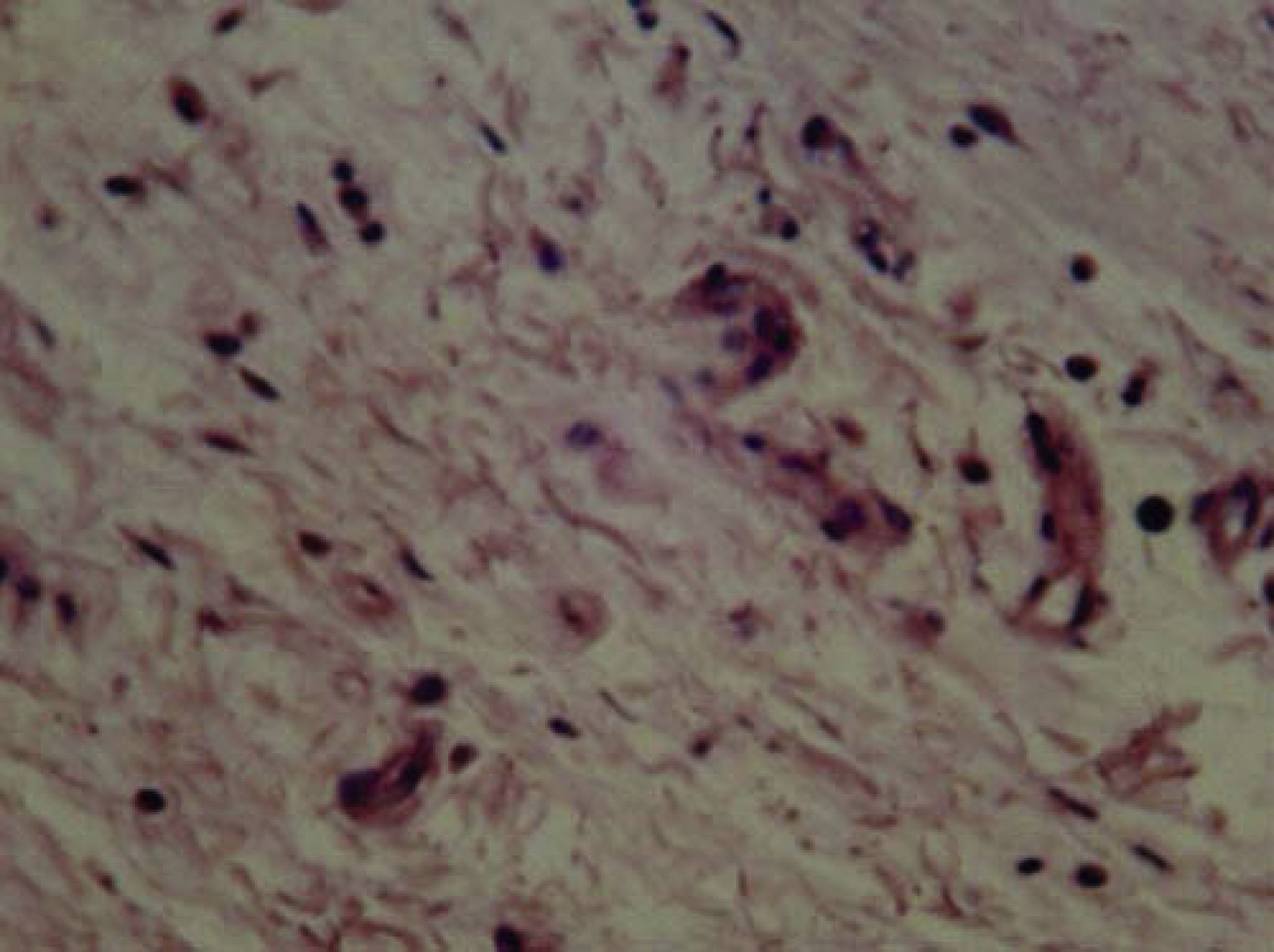
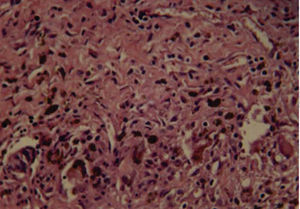
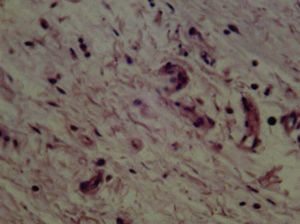
A los 10 días se observó presencia de linfocitos, células plasmáticas, escasos eosinófilos y fibroblastos (Figura 2) y a los 21 días se observaron fibroblastos, colágeno y escasas células inflamatorias, en su mayoría linfocitos (Figura 3).
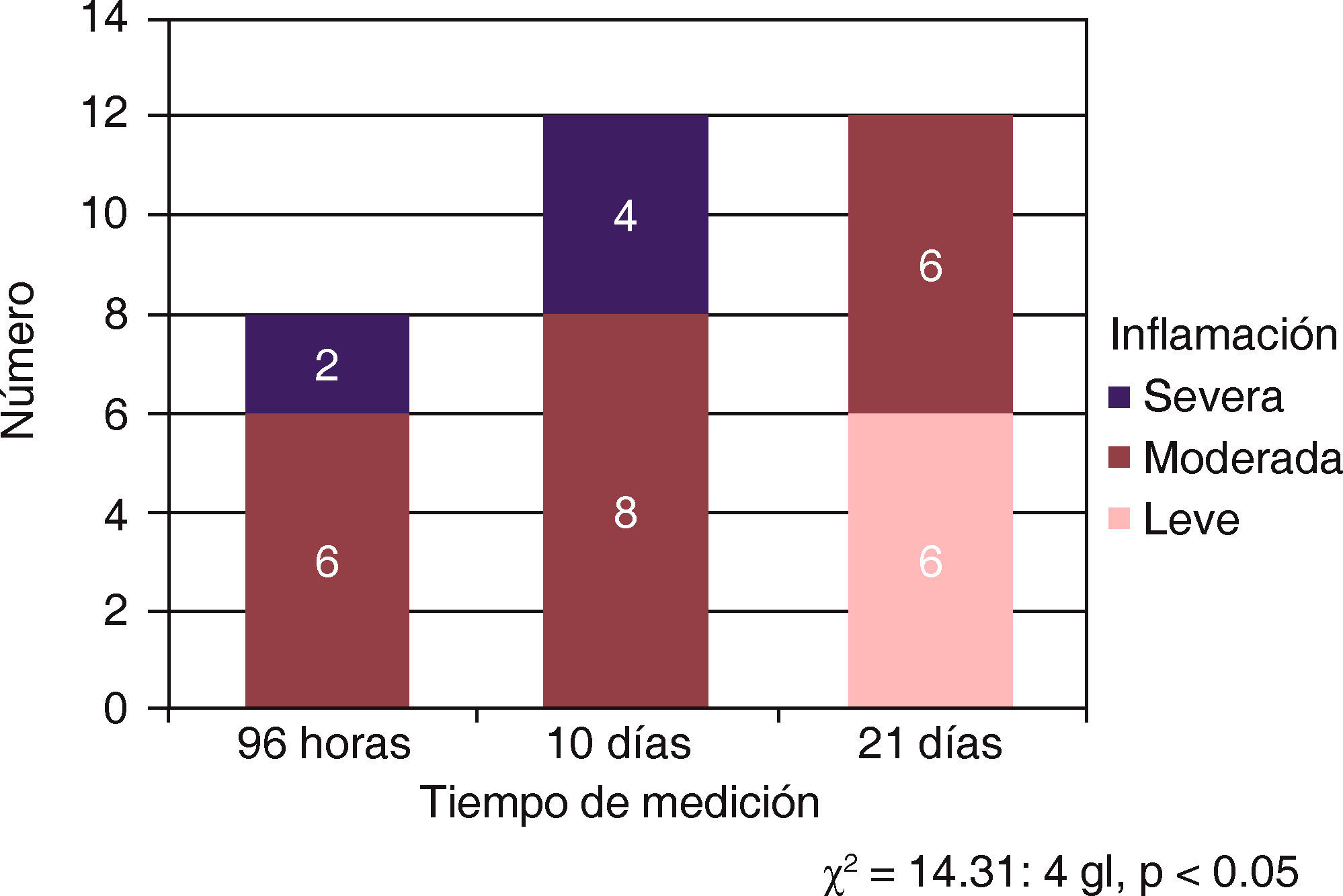
Se afirma que existe una tendencia a la disminución de la inflamación a mayor tiempo del material implantado, en virtud de que a las 96 horas y 10 días predomina la inflamación moderada y severa, mientras que a los 21 días existió inflamación leve y moderada. El grupo control no presentó daño tisular asociado a la presencia del tubo de dentina, considerándose como normal la respuesta inflamatoria.
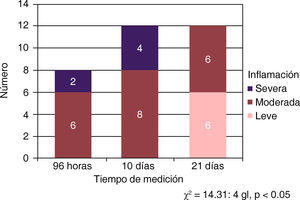
El análisis estadístico con chi cuadrada (χ2) permitió determinar que existió diferencia significativa entre los tres periodos de tiempo (χ2 = 14.31: 4 gl, p < 0.05) lo que permite afirmar que la inflamación tiende a disminuir significativamente conforme pasa el tiempo. La presencia del tubo de dentina no causó reacción alguna que pudiera atribuirse a su presencia. En el análisis estadístico con chi cuadrada (χ2) no existió diferencia significativa (χ2 = 0.356; 2 gl; p > 0.05) entre los tres tiempos de medición. La inflamación leve y moderada se presentó con la misma frecuencia en los tres tiempos de evaluación (Figura 4).
DISCUSIÓNLa biocompatibilidad expresa la habilidad que tiene un material o substancia de convivir con los tejidos del huésped. Esta prueba puede ser obtenida in vitro analizando su toxicidad por medio de cultivo celular,13 las cuales pueden ser odontoblastos, fibroblastos, macrófagos u osteoblastos. Es simple de realizar, económica y es posible estandarizarla. Un material es considerado citotóxico cuando impide la adherencia celular, conduce a una serie de alteraciones drásticas y morfológicas en la célula, lo que disminuye la viabilidad celular.13 De acuerdo con la recomendación ISO 10993-5, la superficie en prueba o bien el medio debe tener 1.25-6.0cm2, la cual ocasiona una mayor superficie de contacto con el material de lo que ocurre en el diámetro de un foramen que es de 0.2-0.3mm. Por este motivo, los estudios de citotoxicidad in vitro tienen que ser interpretados cuidadosamente. Sin embargo, de acuerdo con protocolos clínicos, son utilizados para las pruebas de toxicidad de biomateriales.13,14 Los estudios in vivo comprenden la utilización de animales experimentales como el mono, ratas y perros. En estudios realizados en tejido subcutáneo de ratas con materiales provenientes de los silicatos como el MTA demostraron ser menos irritantes,15–17 lo que permite apreciar es que este modelo de investigación es adecuado para realizar pruebas primarias de toxicidad, como fue empleado en este estudio, sin embargo, en diferentes periodos de tiempo.
Los tubos de polietileno y de dentina son utilizados para implantar materiales en tejido subcutáneo de ratas y en el presente estudio se observó la tolerancia del tejido al tubo de dentina, mismo que no presentó daño tisular asociado a la presencia del mismo, considerándose como normal la respuesta inflamatória.13,18
La respuesta tisular a las 96 horas: se observaron neutrófilos, macrófagos, células plasmáticas y congestión vascular de forma moderada, la cual disminuyó a los 10 días. A los 21 días se observaron fibroblastos, colágeno y escasas células inflamatorias, en su mayoría linfocitos. Esto permite afirmar que existe una tendencia a la disminución de la inflamación a mayor tiempo del material implantado, en virtud de que a las 96 horas y 10 días predomina la inflamación moderada y severa, mientras que a los 21 días existió leve y moderada respuesta inflamatoria. En el presente estudio se utilizó el cemento Bioceramic en presentación pasta pre-mezclada. Loushine et al. (2011) evaluaron el tiempo de endurecimiento, microdureza del cemento de silicato premezclado (Bioceramic Endo Sequence Sealer) en presencia de diferentes mezclas (0-9 wt%) y en contacto con células MC3T3-E1. Ambos selladores mostraron severa citotoxicidad a las 24 horas. AH-Plus disminuyó gradualmente y se mostró no citotóxico, mientras que Bioceramic permaneció moderadamente citotóxico durante el periodo de seis semanas. Sin embargo, hacen falta más estudios que evalúen la correlación entre el tiempo de endurecimiento de Bioceramic y el grado de toxicidad.9
Ma et al., 2011 evaluaron la citoxicidad del cemento EndoSequence Root Repair Material (ERRM) en la presentación premezclado, MTA, IRM y Cavit en cultivo de fibroblastos gingivales, encontraron resultados similares para el MTA y ERRM.19 En otro estudio, Zhang & Peng (2010) implantaron el cemento Bioceramic, ProRoot MTA y AH-Plus en cultivo de fibroblastos y observaron que AH-Plus fue más tóxico en comparación con los otros materiales a base de silicatos.7 El Bioceramic presentó toxicidad intermedia, lo que explica que puede estar relacionada con el tipo de célula empleada, debido a que los cementos selladores liberan subproductos citotóxicos que causan irritación de los tejidos antes de fraguar por completo y ocasionan retraso e impiden la cicatrización. Loushine et al. (2011) en cultivo de osteoblastos de ratón cultivados (MC3T3-E1) expuestos a los cementos AH-Plus y Bioceramic demostraron toxicidad severa a las 24 horas.9 El Bioceramic permaneció moderadamente tóxico por seis semanas y la inflamación disminuyó de moderada a leve a los 21 días. Como se apreció en este trabajo que la respuesta inflamatoria disminuyó de moderada a leve en el periodo de 96 horas a 21 días se puede traducir que al obturar en dientes de pacientes, existirá una inflamación aguda como ocurre ante la exposición de materiales y que disminuirá, inclusive si se encuentra en tejidos periapicales.
La respuesta pulpar y periapical en dientes de perros después de pulpotomía y protección directa con Biodentine fue evaluada y comparada con MTA por medio de análisis radiográfico, histológico e histomicrobiológico. Biodentine presentó compatibilidad y permitió la formación de tejido mineralizado después de pulpotomía en todas las muestras con similar morfología e integridad a las formadas con MTA.20 Lo que demuestra que en presencia de tejido conectivo Bioceramic es compatible y a pesar de mostrar inflamación inicial, presenta reparación de tejidos e induce la mineralización. En otro estudio Mori et al. (2014) implantaron en tejido subcutáneo de ratas Biodentine, MTA e IRM. Los animales fueron sacrificados a los 7, 14 y 21 días. Biodentine mostró inflamación moderada a los siete días. A los 14 y 30 días, el proceso inflamatorio fue menor e insignificante, lo que demostró la biocompatibilidad de Biodentine.21 En este presente trabajo Bioceramic a los 10 días predominó inflamación moderada y severa, mientras que 21 días fue leve y moderada.
En otro estudio Liuet al. (2015) evaluaron los efectos de Bioceramic (iRoot BP Plus-Innovative Bioceramix Inc, Vancouver, Canada) como protector pulpar in vitro e in vivo. Observaron que iRoot BP Plus mostró buena biocompatibilidad con tejido pulpar e indujo la proliferación de células pulpares y reparación con tejido mineralizado. iRoot BP plus puede ser empleado en la terapia pulpar,22 comprobado en este estudio en que el implante de tubos de dentina rellenos de Bioceramic permite una compatibilidad tolerable por el organismo, que si se considera que la pulpa es tejido conectivo, es posible inferir que tendrá una respuesta adecuada en tejido pulpar humano.
CONCLUSIÓNEl cemento Bioceramic en la presentación premezclada presentó una respuesta inflamatoria aceptable y con características de biocompatibilidad en tejido subcutáneo de ratas.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam
Profesor del Centro Universitario de Ciencias de la Salud, Universidad de Guadalajara, México. Práctica privada en Endodoncia.
Especialista en Endodoncia, egresada de la Escuela Militar de Graduados de Sanidad, Universidad del Ejército y Fuerza Aérea, México.
Especialista en Patología Bucal, adscrita a la Unidad de Especialidades Odontológicas, Secretaría de la Defensa Nacional, México.
Profesor de Endodoncia de la División de Estudios de Postgrado, Universidad Nacional Autónoma de México, México. Práctica privada en Endodoncia.