El hipoclorito de sodio (NaOCl) es el agente químico más utilizado como solución irrigadora durante la terapia endodóntica. Es altamente tóxico cuando se extruye a tejido periapicales. En endodoncia la hemolisis causada por el NaOCl ha quedado demostrada utilizando diferentes modelos, sin embargo poca o ninguna evidencia se tiene de las alteraciones morfológicas en la membrana celular de los eritrocitos.
ObjetivoProponer un modelo experimental que permita evaluar las alteraciones morfológicas que sufren los eritrocitos cuando son expuestos a NaOCl utilizado en la práctica odontológica mediante microscopia electrónica de barrido de alta resolución (MEB).
Material y métodosSe obtuvieron 20mL de sangre periférica y se depositaron en tubos con anticoagulante EDTA (ácido etilendiaminotetraacético). Se realizaron lavados con solución amortiguadora de fosfatos (solución Evan's). Se prepararon diferentes diluciones de la muestra de eritrocitos (1:1, 1:2, 1:4, 1:8 y 1:16). Se obtuvieron 100μL de cada una de estas diluciones y se confrontaron con 100μL de NaOCl 5.25% de uso odontológico (Viarzoni-T, Medental®). Se tomaron 0.5μL de estas muestras para depositarse en un portamuestra de aleación Zn-Cu, el cual se sometió a un proceso de metalización de baño de iones de Cu por el método antiguo llamado Sputtering. Obteniendo microfotografías por MEB.
ResultadosSe lograron observar eritrocitos con alteración de tipo anisocitosis y poiquilocitosis (estomatocitos, eliptocitos, esferocitos y discocitos). También se observaron algunas características estructurales de cristales de NaOCl.
ConclusiónEste modelo experimental permitió evaluar los cambios morfológicos que sufren los eritrocitos cuando son expuestos a NaOCl 5.25%.
Sodium hypochlorite (NaOCl) is the chemical agent most frequently used as irrigation solution during endodontic therapy. When extruded to periapical tissue, it is highly toxic. In endodontics, hemolysis caused by NaCOl has been proven using different models, nevertheless, there is little or no evidence of morphological alterations in the cellular membrane of erythrocytes.
ObjectiveTo propose an experimental model which might allow to assess morphological alterations suffered by erythrocytes when they are exposed to NaOCl used in the dental practice by means of high resolution scanning electron microscopy (SEM).
Materials and methodsIn the present study, 20mL of peripheral blood were obtained and deposited in tubes with EDTA (ethylenediaminetetraacetic acid) anticoagulant. Rinses were conducted with a phosphate buffer solution (Evan's solution). Several dilutions of the erythrocyte sample were prepared (1:1, 1:2, 1:4, 1:8 and 1:16); 100μL of each of these dilutions was obtained to be then confronted with 100μL of dental use 5.25% NaOCl (Viarzoni-T, Medental®); 0.5μL of these samples were taken to then be deposited in a sample holder made of Zn-Cu alloy which was subjected to a process of Cu ion metallization bath, following the old Spluttering method. Microphotographs were obtained with SEM.
ResultsErythrocytes with alteration type anisocytosis and poikilocytosis (stomatocytes, elliptocytes and discocytes) were observed. Some structural characteristics of NaOCl crystals were equally observed.
ConclusionThis experimental model allowed assessment of morphological changes experienced by erythrocytes when exposed to 5.25% NaOCl.
El hipoclorito de sodio (NaOCl) es el agente químico más utilizado como solución irrigadora durante la terapia endodontica,1,2 debido a su actividad antimicrobiana de amplio espectro,3 capacidad de disolver tejido vital y necrótico,4,5 además de presentar una baja viscosidad facilitando su penetración en el sistema de conductos radiculares.6 Se emplea a diferentes concentraciones que van desde 0.5% hasta 6.0%7 siendo las concentraciones de 2.5% y 5.25% las más recomendadas por la literatura para su uso como irrigante.8–10 Su mecanismo de acción antimicrobiano se explica por reacciones de neutralización de aminoácidos y cloraminación, mientras que la disolución de materia orgánica se debe a procesos de saponificación producto de la degradación de lípidos y ácidos grasos.11
Contrario a sus ventajas, el NaOCl por sí solo no presenta la capacidad de remoción de smear layer de las paredes del conducto, además desmineraliza la dentina e induce la corrosión de instrumentos endodónticos.12–14 Sin embargo, la citotoxicidad del NaOCl es la propiedad que demanda al clínico tener mayor precaución durante su uso. La extrusión de este irrigante hacia el tejido periapical causa hemólisis, ulceración, inhibición en la migración de neutrófilos, así como daño en células endoteliales y fibroblastos.15–17 Lo que clínicamente se manifiesta con dolor, ardor, edema y hematoma.18
La biocompatibilidad de los materiales en endodoncia es determinada por varios parámetros como genotoxicidad, mutagenicidad, carcinogenicidad, histocompatibilidad, efectos antimicrobianos y citotoxicidad. Los estudios en cultivos celulares han sido empleados por más de 30 años en la evaluación de las reacciones de citotoxicidad inducidas por los materiales endodónticos.19
Entre los métodos utilizados para determinar la citotoxicidad se incluye la determinación de las alteraciones de la morfología celular por microscopia de luz, microscopia confocal y microscopia electrónica de barrido (MEB).19 Evaluaciones realizadas con MEB se han limitado a demostrar alteraciones principalmente sobre líneas celulares de fibroblastos y periodontales.20–23
En otras áreas médicas la microscopia electrónica de barrido ha permitido evaluar anormalidades de la membrana celular de hematíes.24 Si bien en endodoncia la hemólisis causada por el NaOCl ha quedado demostrada utilizando diferentes modelos,25 poca o ninguna evidencia se tiene de las alteraciones morfológicas en la membrana celular de los eritrocitos al contacto con soluciones de NaOCl de uso odontológico. Por lo tanto, el propósito del presente estudio es proponer un modelo experimental que permita evaluar las alteraciones morfológicas que sufren los eritrocitos cuando son expuestos a NaOCl utilizado en la práctica odontológica mediante MEB.
MATERIAL Y MÉTODOSObtención de muestra biológicaSe seleccionó un individuo masculino de 31 años de edad sin registro de datos patológicos de importancia, del cual se obtuvieron 20mL de sangre periférica y se depositaron en tubos de vidrio estéril con anticoagulante EDTA. Se centrifugaron a 2,000 rpm/5 minutos, retirando el plasma por medio de micropipetas de 100-1,000 μL (Spinreact®). Para el paquete celular se realizaron tres lavados con solución de Evan's (solución amortiguadora de fosfatos PBS, Allerstand® registro 0027 R98 SSA, Lote: 407-360, México, D.F.) en proporción 2:1. Realizando una suspensión final de hematíes 2:1 con PBS.
Preparación de diluciones de hematíesCon la suspensión de hematíes se realizaron diferentes diluciones con PBS: 1:1, 1:2, 1:4, 1:8 y 1:16, en microtubos de propileno (Eppendorf®) con capacidad de 1.5mL (Figuras 1 y 2). Entonces, se obtuvieron 100 μL de cada una de estas diluciones y se confrontaron con 100 μL de NaOCl 5.25% de uso odontológico (Viarzoni-T, Medental®). De cada una de las confrontaciones con NaOCl 5.25% se tomaron 0.5 μL y se depositaron en un portamuestra de aleación Zn-Cu con diámetro y altura de 1cm. Las muestras fueron atemperadas durante un periodo de 30 días.
Posteriormente, se sometieron a un proceso de metalización de baño de iones de Cu por el método antiguo llamado Sputtering durante 15 minutos, el cual consistió en el bombardeo de la superficie de la muestra de hematíes con iones de Cu para formar láminas delgadas, esto con la finalidad de permitir el flujo de electrones emanados del haz del filamento favoreciendo el análisis morfológico de los hematíes. Para ello se empleó el equipo Vacuum Coating, modelo s150, marca: Sputter Coating. Este proceso de metalización por iones de Cu es parte fundamental en el desarrollo del modelo experimental celular que se propone, para valorar la morfología de los hematíes expuestos a NaOCl 5.25% de uso odontológico.
Para analizar la morfología de hematíes se obtuvieron imágenes a magnitudes de 100x, 250x, 500x, 1,000x y 5,000x en el modo de electrones secundarios retrodispersados empleando un microscopio electrónico de barrido de campo de alta resolución JEOL JSM-7600F. Además, se realizaron diferentes espectrogramas de la superficie en diferentes áreas de los hematíes, obteniendo espectros de energía dispersiva (EDS) a través del Microanalizador Bruker Xflash 6130 (Figura 3). Así mismo, se obtuvo el porcentaje en peso de los elementos que conforman la muestra de hematíes, estos análisis fueron determinados únicamente en imágenes a 1,000x.
Las imágenes obtenidas de cada una de las muestras fueron analizadas por médicos especialistas expertos en el Área de Hematología.
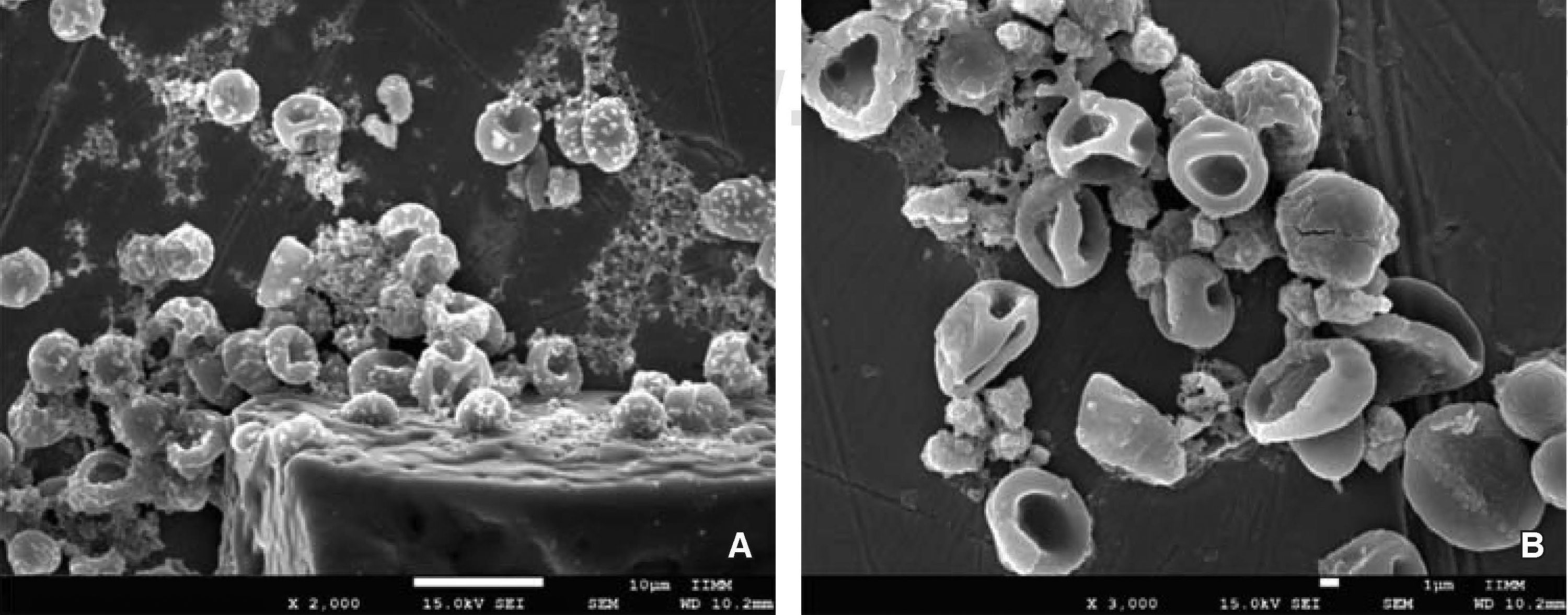
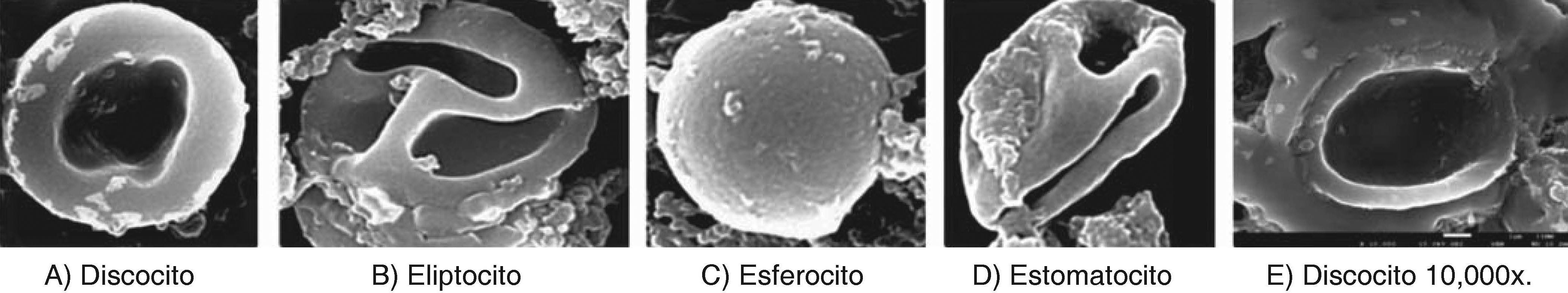
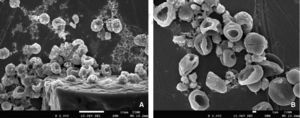
RESULTADOSDentro de las anormalidades que sufrieron los eritrocitos al exponerse con NaOCl 5.25% de uso odontológico se lograron observar glóbulos rojos con distintos tamaños que indican anisocitosis, así mismo, se detectaron formas anormales características de una poiquilocitosis (Figura 4). Entre las principales variaciones de la poiquilocitosis se identificaron estomatocitos, eliptocitos, esferocitos y discocitos (Figura 5). Además este modelo experimental permitió identificar algunas características estructurales de cristales de NaOCl (Figura 6).
Alteraciones morfológicas de eritrocitos expuestos a NaOCl 5.25% de uso odontológico, mediante imágenes obtenidas por microscopia electrónica de barrido de alta resolución. A) Discocito: disco bicóncavo sin núcleo. B) Eliptocito: forma elíptica con extremidades redondeadas y paredes laterales poco abombadas. C) Esferocito: eritrocito esférico con denso contenido de hemoglobina sin claro o halo central. D) Estomatocito: eritrocito con una zona central elongada en forma de boca. E) Discocito a 10,000x en donde se observa daño estructural a nivel de la membrana plasmática.
Se ha observado que los modelos de experimentación in vitro han aportado información valiosa, permitiendo mejorar la comprensión de diversos fenómenos biológicos. El presente modelo experimental que emplea la microscopia electrónica de barrido de alta resolución permitió evaluar las alteraciones morfológicas de la membrana de eritrocitos expuestos a NaOCl 5.25% de uso odontológico, identificando con mayor frecuencia anormalidades características de anisocitosis y poiquilocitosis (estomatocitos, eliptocitos, esferocitos y discocitos). De acuerdo con Wang, et al,26 el eritrocito es un modelo in vitro relativamente simple para evaluar la citotoxicidad de sustancias químicas. Los estudios realizados en eritrocitos, durante las últimas décadas, han permitido el desarrollo de conocimiento a detalle acerca de las alteraciones en la función de glóbulos rojos, así como también los desórdenes en su membrana, ya sea por factores externos, hereditarios o patológicos.27 Por esta razón, es importante evaluar las alteraciones morfológicas de los eritrocitos cuando se exponen a soluciones de NaOCl de uso odontológico.
Ionescu-Zanetti et al.28 y Bierbaum et al.,29 mencionan el proceso de lisis que sufren los eritrocitos, a través del proceso de saponificación, en donde se ha observado que los lisofosfolípidos han demostrado porar la membrana hasta inducir su muerte cuando se adiciona con medios extracelulares. Esta poración permite que iones pequeños permeen la membrana y contenga proteínas aniónicas más grandes en el citoplasma. Los iones pequeños asociados con moléculas de agua, penetran la célula creando una presión osmótica positiva, lo que provoca una lisis osmótica coloidal; esto conlleva a la transición de discocitos y posteriormente de esferocitos antes de la muerte celular, estas formas también fueron reportadas en el presente estudio. Por otra parte, se encontraron formas características de eliptocitos y estomatocitos. Estas anormalidades del eritrocito podrían depender de la viscosidad del fluido citoplasmático y de la rigidez de su membrana celular, las cuales se ven afectadas por los cambios en el potencial Redox y/o disminución de la oxidación en algunas de sus proteínas citoesqueletales: espectrina y anquirina.30 Estas proteínas se consideran de gran importancia para mantener la arquitectura de su membrana.31
El presente modelo experimental que utiliza microscopia electrónica de barrido de alta resolución permitió identificar las alteraciones que sufre la membrana plasmática de los eritrocitos, este modelo podría ser implementado para valorar la biocompatibilidad entre diversas soluciones irrigadoras convencionales utilizadas para el tratamiento de conductos radiculares.
CONCLUSIÓNEl presente modelo experimental permitió evaluar los cambios morfológicos que sufren los eritrocitos cuando son expuestos a NaOCl 5.25%. Por lo que se considera que dicho modelo podría utilizarse para analizar la biocompatibilidad de futuras soluciones químicas que se puedan emplear tanto en el campo de la endodoncia como en otras áreas de estomatología, ya que se considera un modelo viable y de fácil reproducción.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam
Cirujano Dentista, Especialista en Endodoncia, Profesor de Asignatura «B».
Cirujano Médico Partero, Especialista en Hematología, Profesor de Asignatura «B».