El cianoacrilato de butilo es un material de síntesis de tejidos, presenta innumerables ventajas como un tiempo de aplicación corto, fácil ejecución, carácter hemostático, bacteriostático, biodegradable y una adecuada fuerza tensil.
ObjetivoEvaluar histológicamente la biocompatibilidad del cianoacrilato de butilo en el lomo de rata en comparación con la seda negra trenzada y la poliglactina 910.
Materiales y métodosSe emplearon 36 ratas albinas de raza Wixtar. Se dividieron aleatoriamente en 4 grupos (A, B, C y D) correlacionados con los periodos de sacrificio (3º, 7º, 14º y 21º día) respectivamente. Se realizaron 3 incisiones de 2 cm de longitud en el lomo de rata. Los parámetros histológicos fueron: infiltrado inflamatorio de células polimorfonucleares, fibroblastos jóvenes y engrosamiento de la epidermis.
ResultadosEl cianoacrilato de butilo ocasionó menor infiltrado polimorfonuclear en comparación con los otros materiales utilizados. Los picos de proliferación fibroblástica en los grupos tratados con cianoacrilato de butilo fueron superiores al resto. El engrosamiento de la epidermis mostró la alta capacidad mitótica de los queratinocitos para remodelar el epitelio. Al 14º y 21º día, la mayoría de los tejidos tratados con cianoacrilato de butilo ya se encontraban totalmente remodelados en comparación con el resto.
ConclusionesEl cianoacrilato de butilo es un material biocompatible con los tejidos, permitiendo disminuir el tiempo de cicatrización de los mismos.
N-Butyl-cyanoacrylate is a tissue-synthesis material. It offers countless advantages: short application time, easy execution, as well as possessing hemostatic character. This material is bacteriostatic, biodegradable, and exhibits suitable tensile strength.
ObjectiveThe objective of the present paper was the histological evaluation of n-butyl-cyanoacrylate biocompatibility on rats dorsum back (spine), compared to braided black silk and Polyglactin 910.
Materials and MethodsThirty six Wixtar albino rats were used for the procedure. They were randomly divided into four groups (A, B, C, D) related to the time of sacrifice (3rd, 7th, 14th and 21st day) respectively. On the rats’ spine, three 2 cm long incisions were performed. Histological parameters were as follows: polymorphonuclear cell inflammatory infiltrate, young fibroblasts and epidermis thickening.
ResultsN-butyl-cyanoacrylate caused lesser polymorphonuclear infiltrate when compared to other used materials. Fibroblast proliferation peaked in groups treated with n-butyl-cyanoacrylate when compared to the rest. Epidermis thickening showed high mitotic ability of keratocytes to remodel epithelium. At the 14th and 21st days most tissues treated with N-Butyl-cyanoacrylate were found to be completely remodeled when compared to the rest.
ConclusionN-butyl-cyanoacrylate was shown to be the most biocompatible material, since it elicited shortest healing time.
Los cianoacrilatos (CAC) son adhesivos tisulares cuyo objetivo es lograr la correcta coaptación de los bordes de la herida quirúrgica consiguiendo la cicatrización.1 Los cianoacrilatos fueron sintetizados por primera vez en 1949 por Ardis. Posteriormente en 1959, Coover relató las propiedades adhesivas de los mismos; estos compuestos son empleados en cirugía desde los años sesenta y setenta, siendo actualmente utilizados en cirugías gastrointestinales, abdominales, traumatológicas, oftalmológicas, cardiovasculares, otorrinolaringológicas, plástica y bucal maxilofacial.2-6
Químicamente los cianoacrilatos pertenecen a la familia de los alquilcianoacrilatos (CH2 = C(CN)COOR). La diferencia entre ellos radica en la composición de la cadena lateral. Tenemos cianoacrilatos de cadena corta (etil, metil) y de cadena larga (butil y octil).1-3 Los cianoacrilatos se obtienen de la síntesis del formaldehído con cianoacetato en presencia de calor y llevados al vacío. El monómero formado es destilado, lográndose un compuesto puro y atóxico. Al entrar en contacto con un medio húmedo o con la sangre, los cianoacrilatos inician una reacción de polimerización entre la cadena lateral del cianoacrilatos y las proteínas séricas de los fluidos, formándose microscópicamente un enrejado tridimensional, teniendo como metabolitos resultantes el cianoacetato y el formaldehido. Macroscópicamente se aprecia una película delgada y sólida que mantiene los bordes de la herida o incisión cerrada.2-5
El cianoacrilato ideal tiene innumerables ventajas, tales como el tiempo de aplicación, una mínima cicatriz, fácil ejecución, además de tener un carácter hemostático, bacteriostático y biodegradable.1-4 Además, este compuesto ostenta una adecuada fuerza tensil contra fluidos biológicos y mantiene los tejidos unidos durante todo el proceso de cicatrización, sin alterar la inmunología del mismo.7
La biocompatibilidad de este compuesto ha sido tema de interés de numerosas investigaciones, dado que, al ser un compuesto químico y liberar metabolitos, puede ocasionar los siguientes cambios histológicos: infiltrado inflamatorio exacerbado, reacción a un cuerpo extraño, áreas necróticas en los tejidos circundantes, fibrosis cicatrizal en la neoformación de tejido conjuntivo y génesis de vasos sanguíneos. Todas estas alteraciones influyen en el proceso de cicatrización, fase fundamental para la neoformación de tejidos. Los cianoacrilatos (CAC) son utilizados en el selle de hemorrágicas esofágicas, en el sellado de fístulas bilio-hepato-cutáneas, en la síntesis de laceraciones cutáneas pediátricas y en el sellado de membranas timpánicas perforadas; son utilizados en cirugía bucal maxilofacial en procedimientos tales como sutura de exodoncias de dientes retenidos, injertos de tejidos blandos y entre otros.2-8 Sin embargo, los resulta-dos obtenidos en dichas investigaciones no son del todo claros debido, probablemente, a las diferentes metodo-logías utilizadas y a la diferente composición química que presenta cada adhesivo tisular o a no llevar un control estricto en cuanto a los periodos de cicatrización de los tejidos, tomando un mayor o menor número de días para los estudios histológicos respectivos. Por lo tanto, el objetivo de este estudio fue evaluar histológicamente la biocompatibilidad del cianocrilato de butilo (CAC-B) en el lomo de rata, en comparación con la seda negra trenzada y la poliglactina 910.
Materiales y métodosLa población estuvo conformada por 36 ratas albinas de raza Wixtar, con edad de 10 a 12 semanas y con un peso de 150–200 gr respectivamente. Fueron divididos aleatoriamente en 4 grupos de 9 especímenes cada uno (A, B, C y D) correlacionado con los periodos de sacrificio (3º, 7º, 14º y 21º día) respectivamente.
Los animales fueron mantenidos y manipulados siguiendo las normas del Bioterio del Instituto de Investigación de la Facultad de Medicina Humana de la Universidad de San Martín de Porres. Este trabajo fue aprobado por el Instituto de Investigación de la Facultad de Odontología de la Universidad de San Martín de Porres. Éstos fueron sometidos bajo las mismas condiciones ambientales de temperatura y humedad en jaulas metabólicas individualizadas. Los especímenes recibieron 3-6 gr de alimento balanceado y 3–7 mL agua potable filtrada.
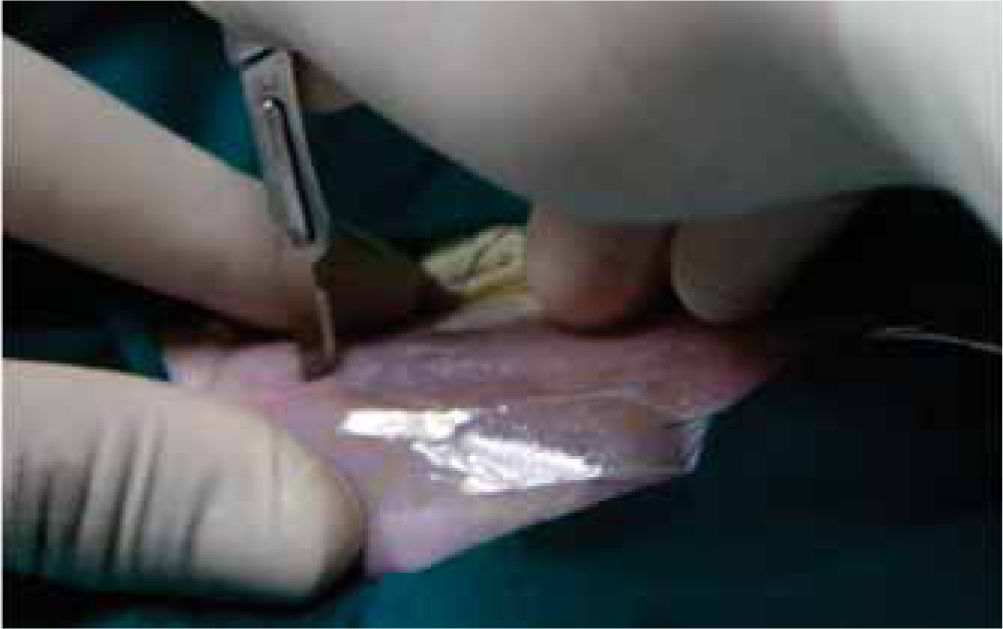
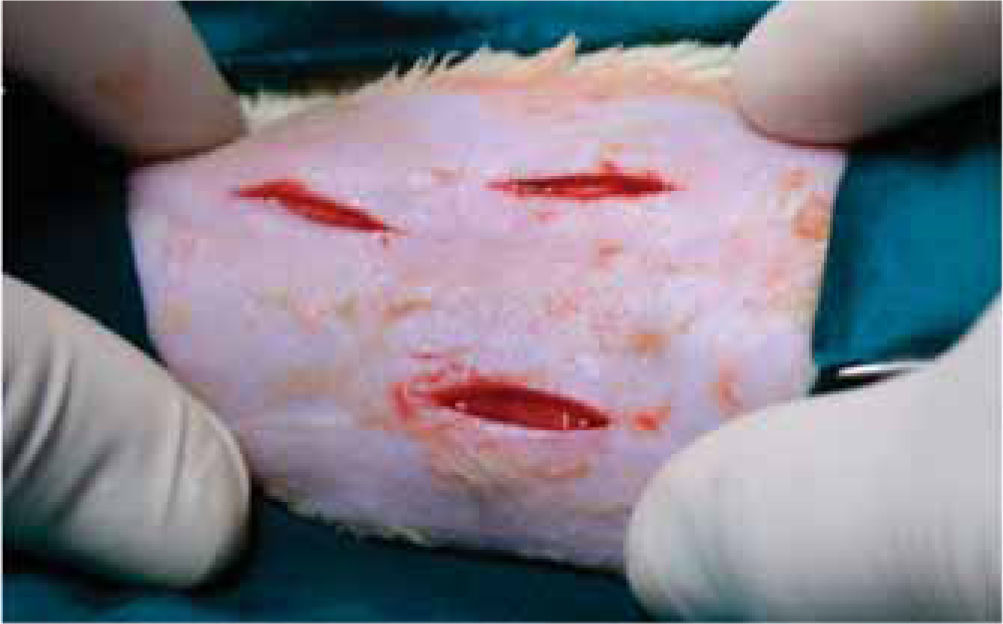
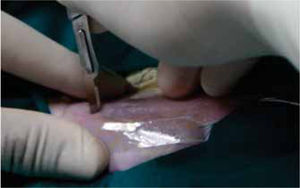
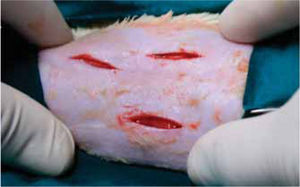
Fueron anestesiados a través de la administración intraperitoneal de pentobarbital sódico (HALATAL®), en una dosis de 1 mL/2.5 kg de peso. Se les ubicó en decúbito ventral en el posicionador especialmente diseñado para la investigación. Mediante la utilización de una guía quirúrgica de plástico (Figuras 1y2) para estandarizar la muestra, se realizaron 3 incisiones en el lomo de la rata, de 2 cm de longitud cada una, separadas entre sí por 2 cm (Figura 3).
Posteriormente se realizó la síntesis de tejidos de cada una de ellas, utilizándose en todos los grupos un material distinto para cada incisión: cianoacrilatos de butilo (2 gotas) e hilos de sutura seda negra trenzada 5/0 (SNT) y poliglactina 910 5/0 respectivamente. Los animales fueron sacrificados al 3º, 7º, 14º y 21º días, por destroncamiento cervical.
Las muestras de tejidos obtenidas fueron fijadas, procesadas e incluidas en parafina; posteriormente fueron realizados los cortes con micrótomo de 6 μm. Seguidamente, fue realizada la coloración de hematoxilina y eosina para ser sometidos a un análisis histopatológico en microscopio óptico de alto poder (40X).
La metodología utilizada para la investigación fue el conteo de campos visuales (CV) de alto poder (40X), evaluando lo siguiente: número de CV de Infiltrado inflamatorio de células polimorfonucleares (leve: 0-1 CV, moderado: 2-3 y severo: 4 o más CV.); presencia/ausencia de fibroblastos jóvenes y engrosamiento de la epidermis.
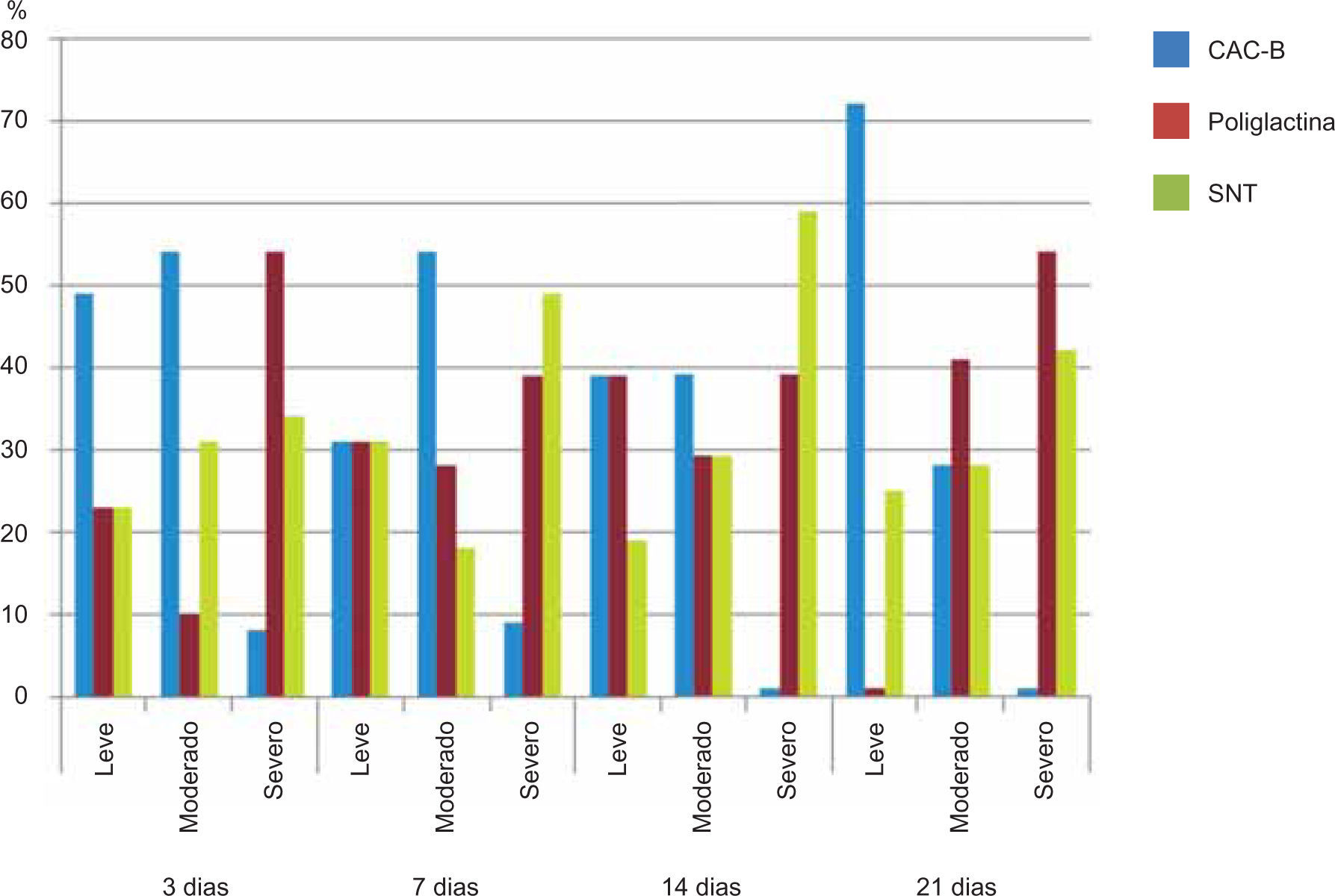
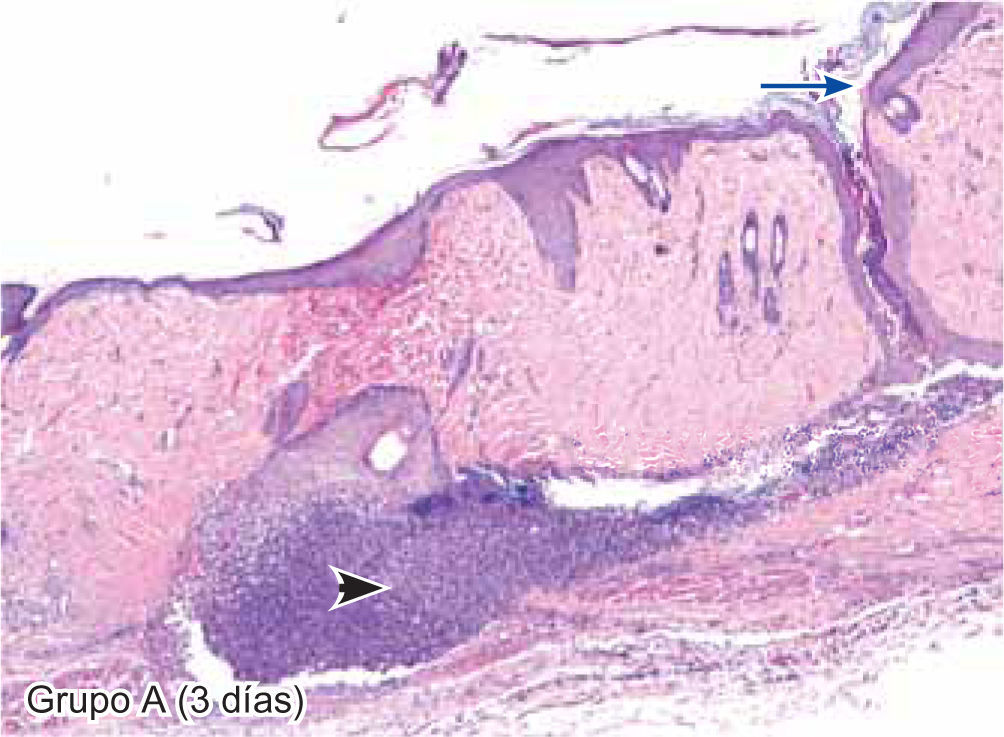
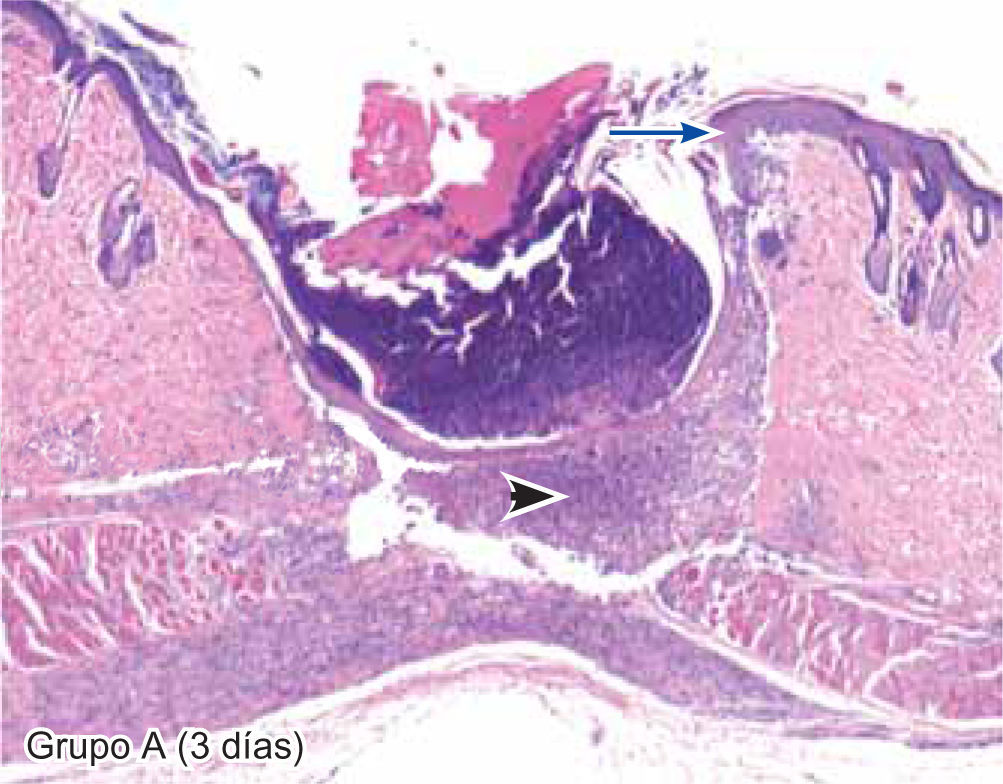
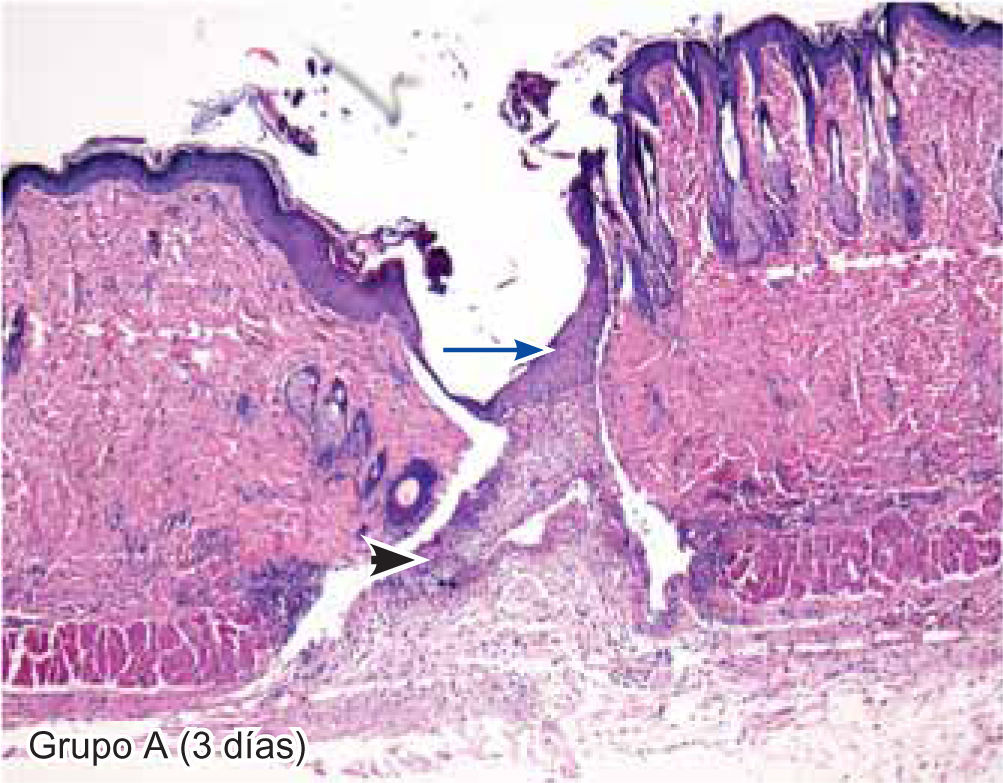
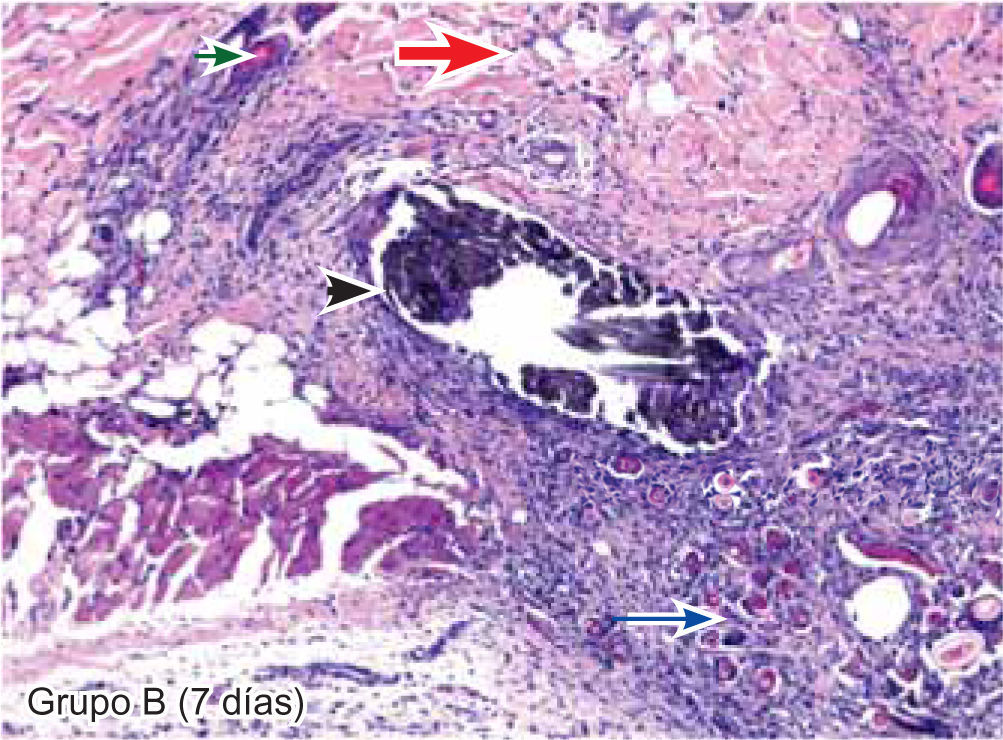
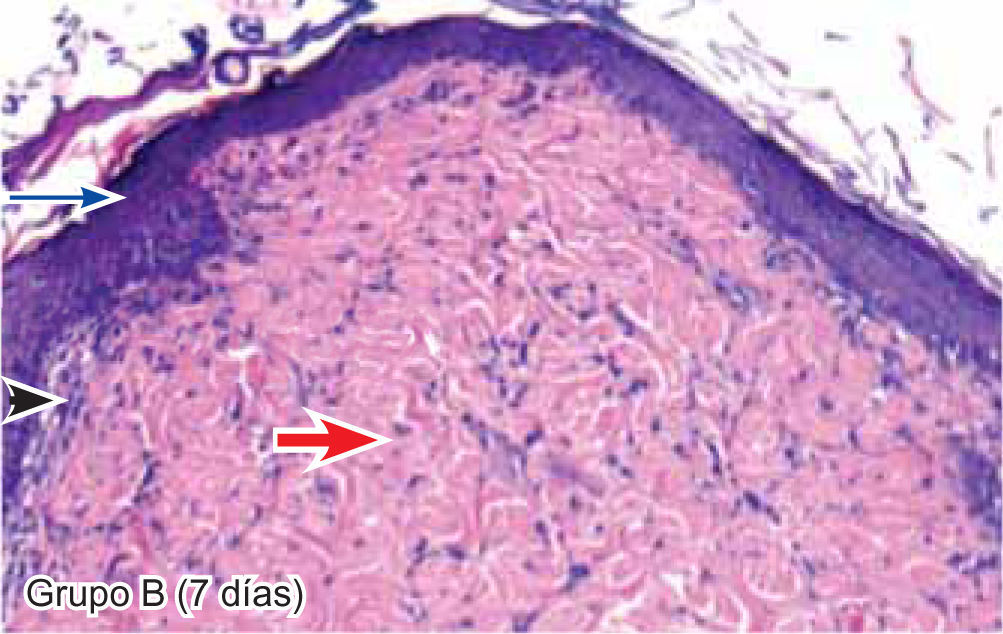
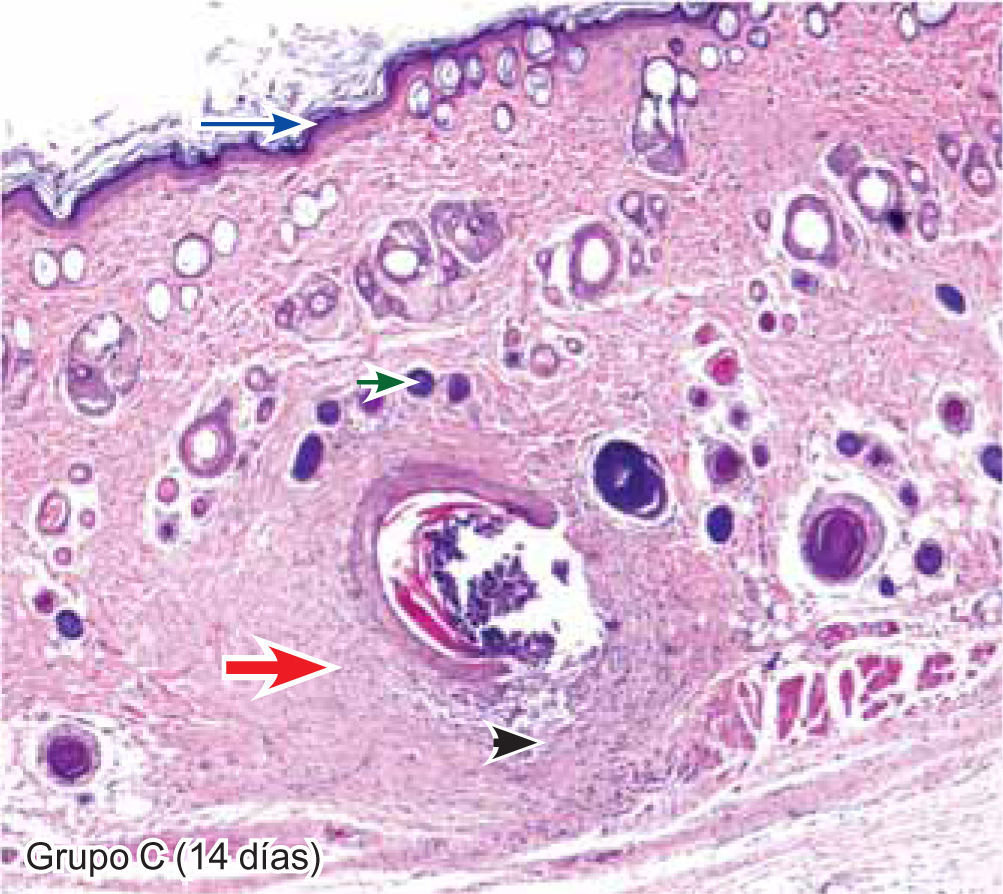
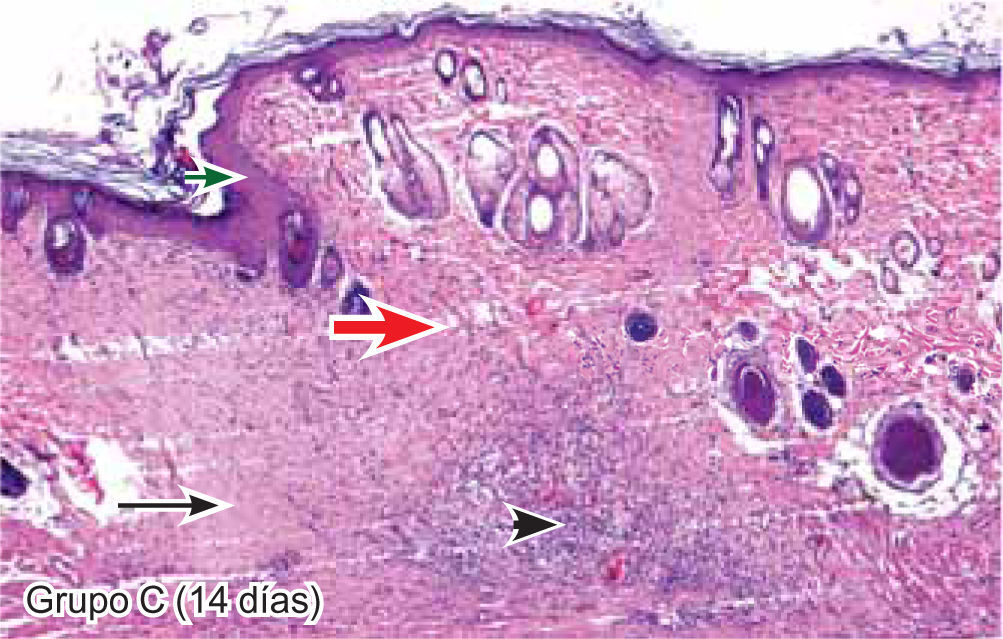
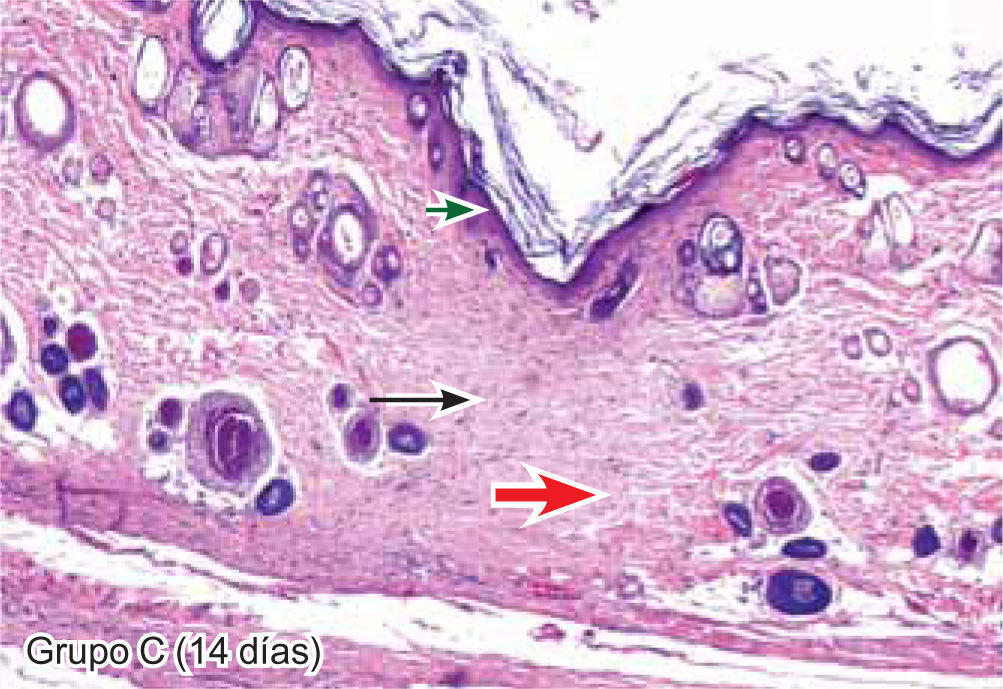
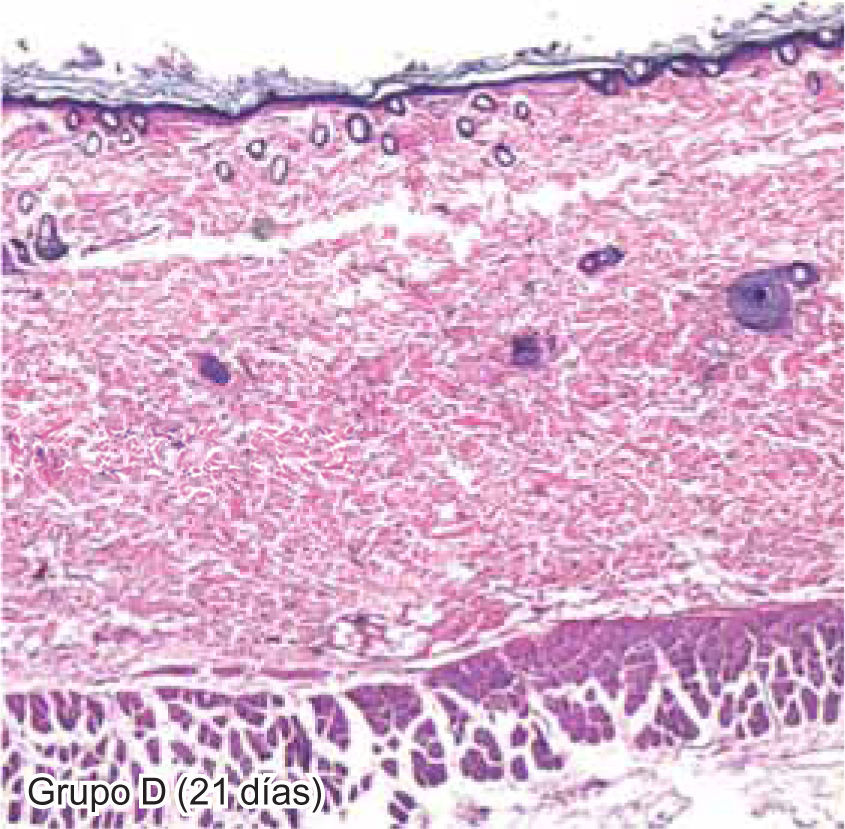
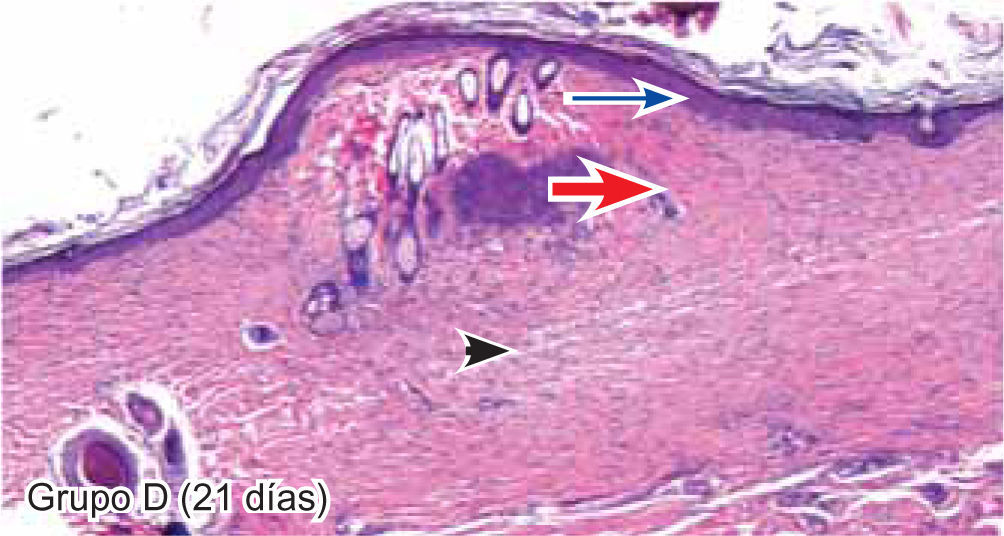
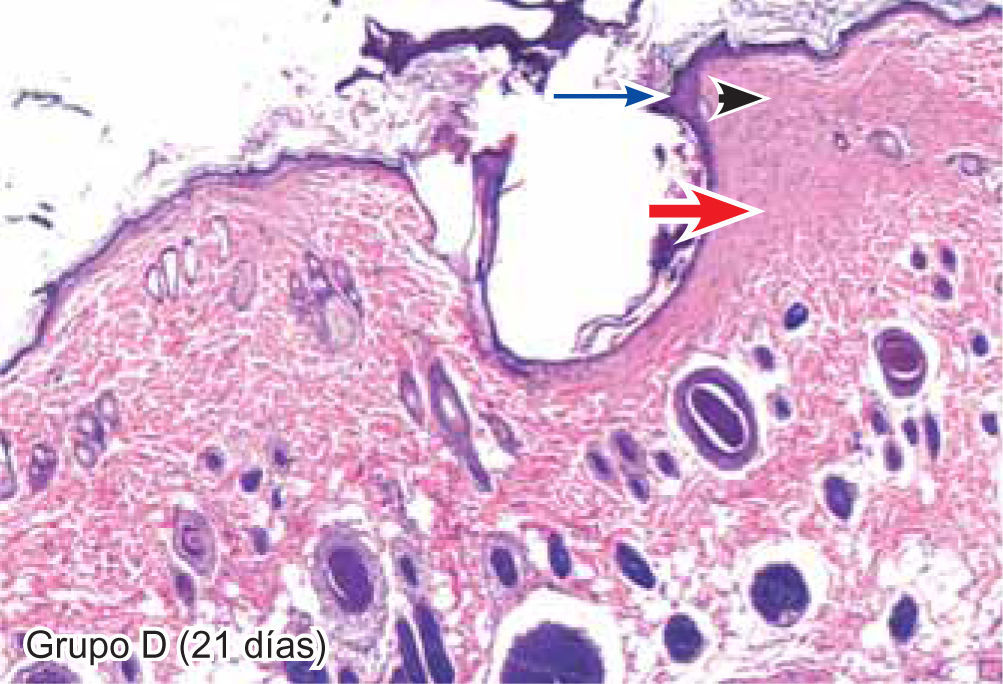
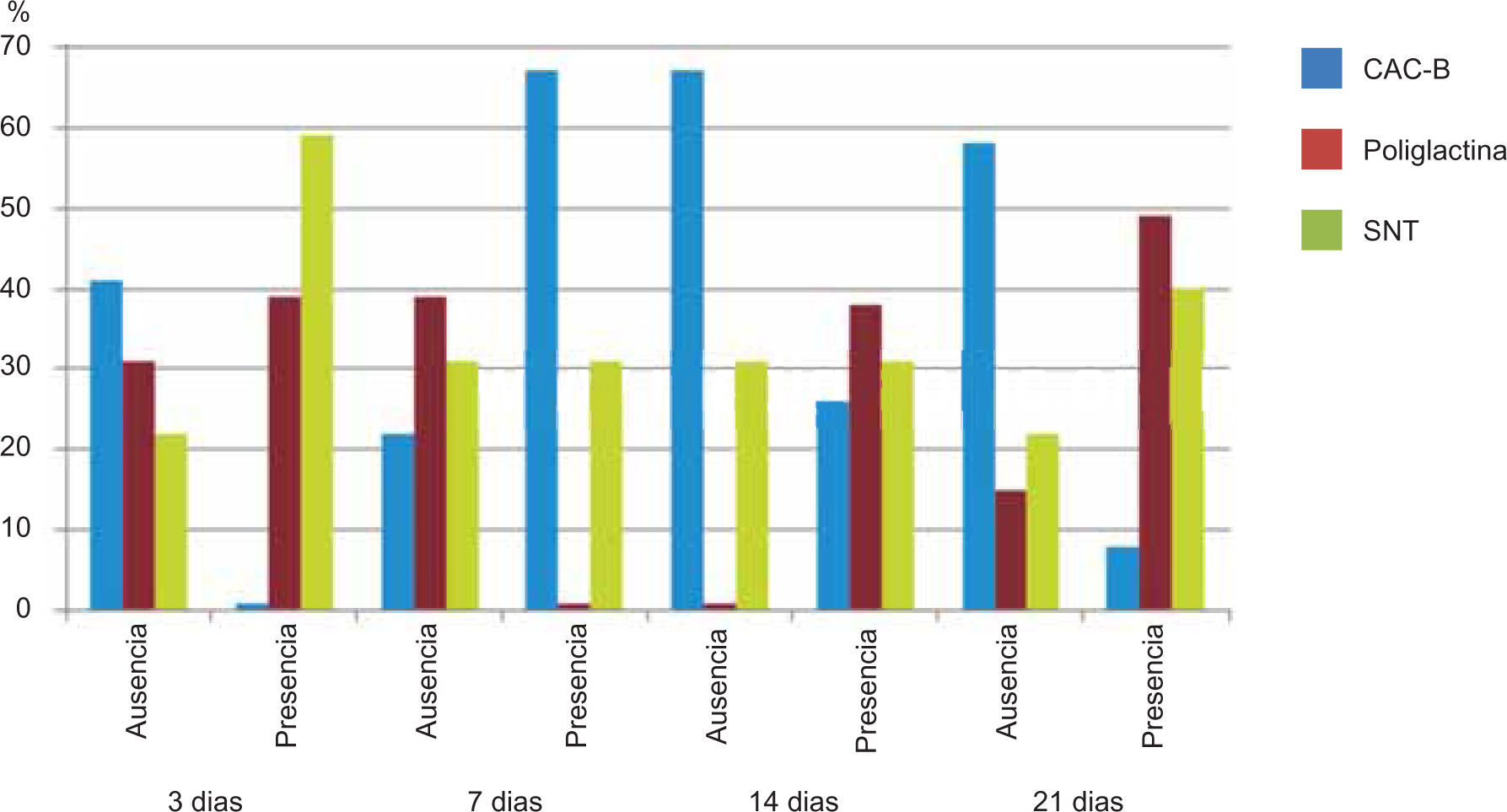
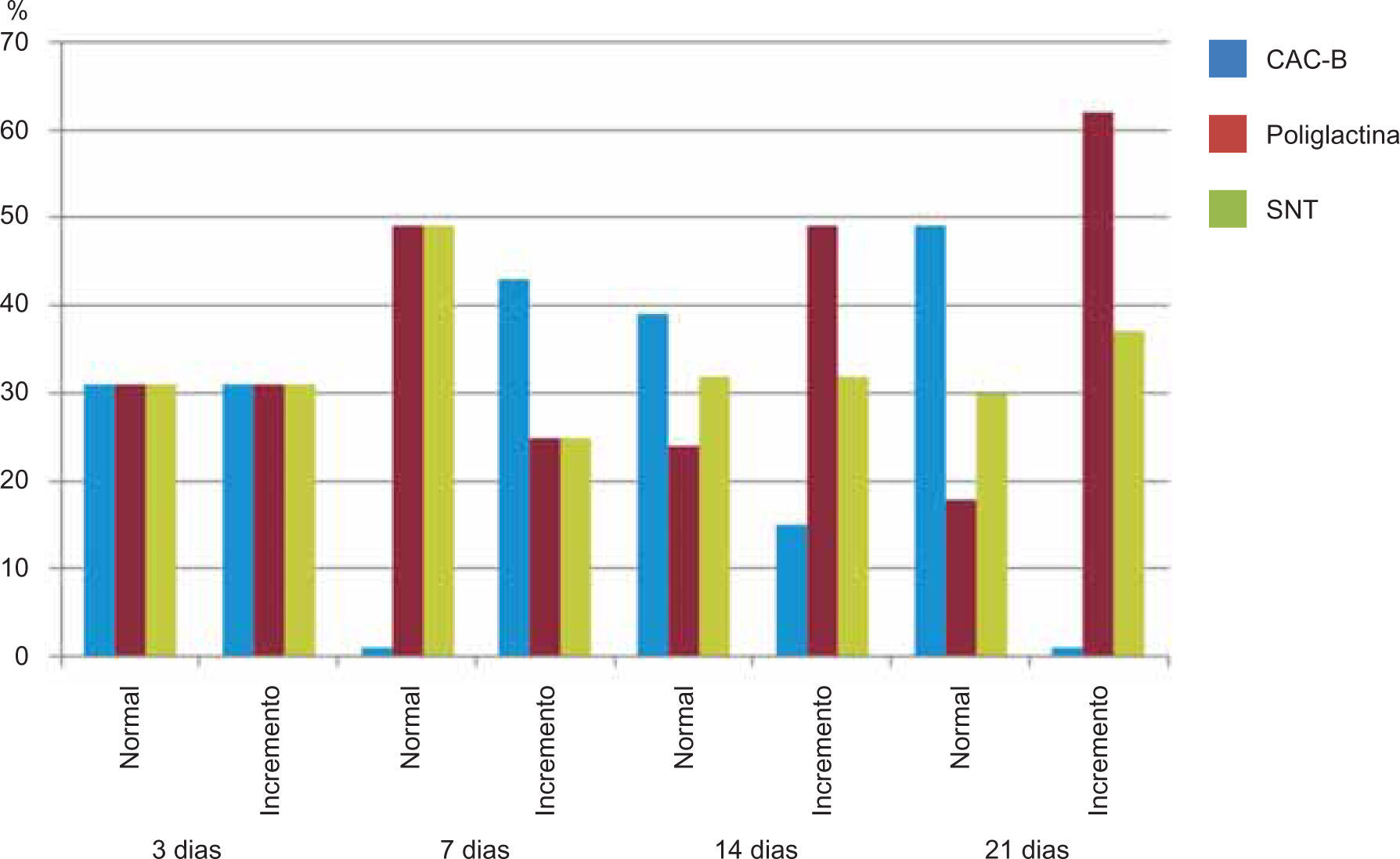
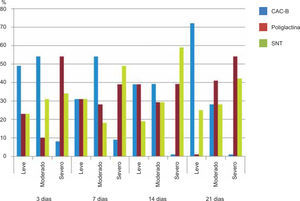
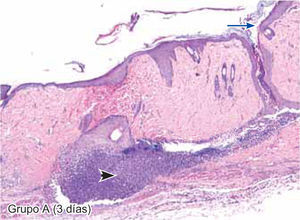
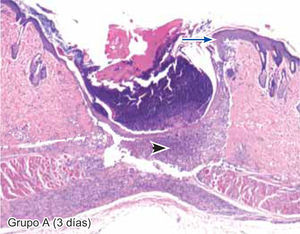
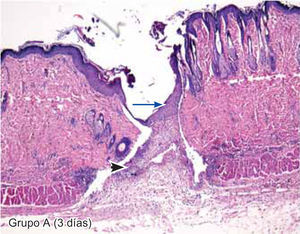
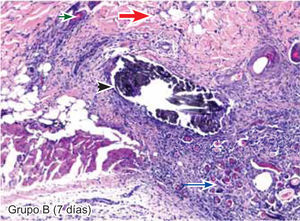
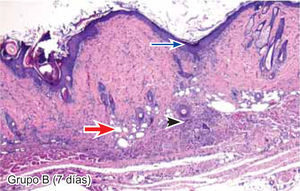
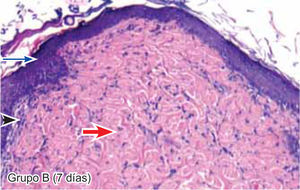
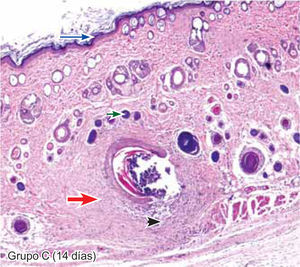
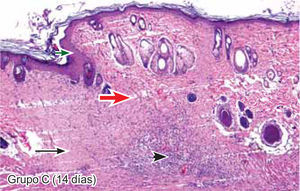
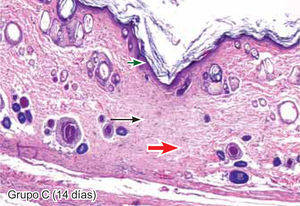
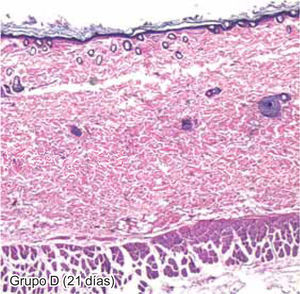
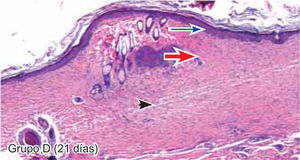
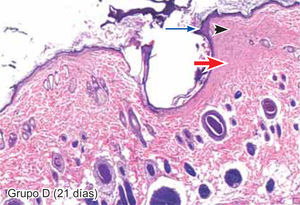
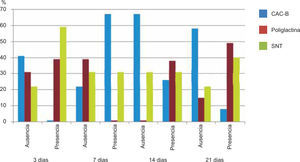
ResultadosEvaluación histopatológicaAl tercer día se observó que el 54% de los casos que presentaron un infiltrado polimorfonuclear severo pertenecían al grupo de poliglactina 910 (Figuras 4y5) en comparación con el 37% de SNT (Figura 6) y el 9% de CAC-B (Figura 7). En el séptimo día, el 50% de los casos que presentaban un infiltrado polimorfonuclear severo pertenecían al grupo de SNT (Figuras 4y8) seguido de la poliglactina 910 con un 40% (Figura 9). Por último el CAC-B con10% (Figura 10). Durante el 14º día, el 40% de los casos suturados con SNT (Figura 11) y el 60% de los casos suturados con poliglactina 910 (Figura 12) aún presentaban infiltrados polimorfonucleares severos a diferencia de los tejidos sintetizados con CAC-B, los cuales no presentaban ningún caso con infiltrado inflamatorio severo (Figura 13). En el día 21º día no se evidenció infiltrados polimorfonucleares severos como respuesta al CAC-B (Figura 14) a diferencia de los casos suturados con poliglactina 910 (Figura 15) y la SNT (Figura 16), los cuales aún representaban el 56% y 44% de los casos respectivamente.
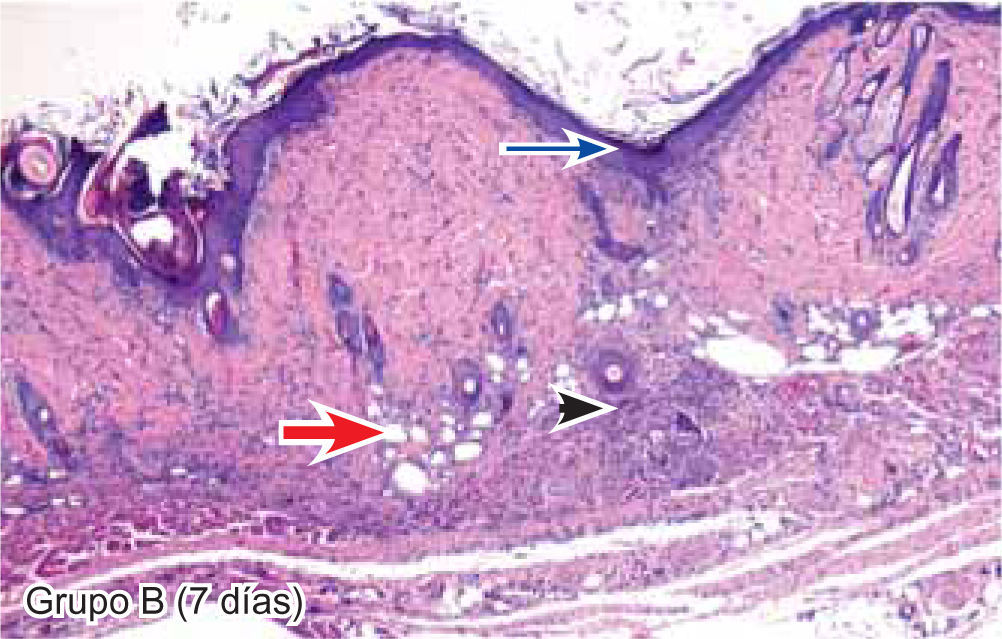
Tejido suturado con SNT. Se aprecia infiltrado polimorfonuclear leve (cabeza de flecha), fibras colágenas gruesas y fibroblastos jóvenes (flecha gruesa), desarrollo de folículos pilosos y glándulas sebáceas (flecha corta), además de engrosamiento normal de la epidermis (flecha larga) (4X).
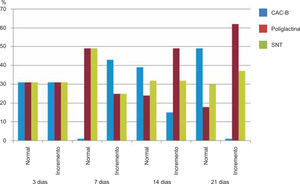
Respecto a la presencia de fibroblastos jóvenes, en el 7º día se observó que el 67% de los especímenes que los presentaban, pertenecían al grupo de CAC-B (Figuras 10y17). Mientras que la poliglactina 910 representó el 33% (Figura 9) y la SNT no presentó ningún caso (Figura 8). Al 14º día, el 39% de los casos correspondientes al grupo de poliglactina 910, presentaban fibroblastos jóvenes (Figura 12), la SNT (Figura 11) y el CAC-B (Figura 13) representaron el 33% y 28% de los casos respectivamente.
Finalmente al 21º día, solamente el 8% de los casos correspondientes al grupo de CAC-B, evidenciaban fibroblastos jóvenes (Figura 14) en comparación con la SNT (Figura 16) y la poliglactina 910 (Figura 15), los cuales representaban el 42% y 50% respectivamente de los casos en proceso de remodelación.
El engrosamiento de la epidermis durante el tercer día fue observado en el 50% del total de los casos suturados con los 3 materiales de síntesis (Figuras de la 5a7), mientras que en el otro 50% no se evidenció cambio alguno (Figura 18). Al séptimo día el 46% de los casos correspondientes al grupo de CAC-B evidenció engrosamiento de la epidermis (Figura 10). La poliglactina 910 (Figura 9) y la SNT (Figura 8) representaron cada uno de ellos, el 27% de los casos. En el 14º día, el 17% de los especímenes correspondientes al grupo de CAC-B, presentaban engrosamiento de la epidermis (Figura 13) a diferencia de los grupos tratados con SNT (Figura 11) y poliglactina 910 (Figura 12) cuyos porcentajes fueron 33 y 50%respectivamente. Al 21º día, en ningún espécimen correspondiente al grupo de CAC-B se evidenció incremento alguno de la epidermis, pudiéndose observar los tejidos completamente cicatrizados (Figura 14). Caso opuesto ocurrió en los grupos correspondientes a la SNT (Figura 16) y la poliglactina 910 (Figura 15) cuyos porcentajes representaron el 38 y 62%, respectivamente (Figuras 18y19).
Existe una gran variedad de materiales de síntesis absorbibles y no absorbibles, los cuales pueden ser de origen animal o sintético, y a su vez, pueden presentar un diseño monofilamentar y multifilamentar.8 Los cianoacrilatos son considerados una alternativa de los materiales de síntesis tisular. Entre ellos, el cianoacrilato de butilo es el más biocompatible; este dato fue corroborado de acuerdo a la metodología utilizada en esta investigación, ya que no se evidenciaron áreas de necrosis e infiltrado inflamatorio exacerbado o adecuada fluidez, además de observarse un buen control de la hemostasia durante el acto quirúrgico y carácter bacteriostático.9-11 Debido a las propiedades mencionadas, se eligió este producto; sin embargo, Moretti y colaboradores1 implantaron subcutáneamente tres cianoacrilatos: etil-cianoacrilato, alfa-cianoacrilato y cianoacrilato de butilo, mediante una esponja embebida del mismo. Se comparó la reacción tisular de los tres y el resultado fue favorable para el alfa cianoacrilato, quién demostró poseer mejor biocompatibilidad. En comparación con nuestra investigación, éste fue confrontado con sutura en piel, asemejando lo que acontece en la práctica clínica.
Según De Souza y cols.15 en la búsqueda de contribuir con un proceso de cicatrización eficaz donde el material de síntesis no sea una interferencia para la biología celular de la misma, el cianoacrilato de butilo permite un intercambio metabólico a nivel de tejido epitelial y conectivo, ya que no ocasiona el microtrauma originado por la aguja del hilo, la cual desencadena una reacción inflamatoria mayor. En esta investigación no solamente se corroboró lo anteriormente mencionado, sino también, que la permanencia de los hilos de sutura en los tejidos retardó el proceso de cicatrización a los 14 y 21 días, a pesar de haberse utilizado un hilo absorbible, ya que el mismo organismo con el afán de eliminar el cuerpo extraño, secreta células inflamatorias polimorfonucleares para expulsar los hilos, alargándose el periodo de remodelación tisular.12,13
Cada fase de la cicatrización presenta un determinado tipo de células para realizar una función. Así en el 3º día que corresponde a la fase inflamatoria aguda a nivel del tejido epitelial, se observó en todos los casos un aumento del grosor de la epidermis; en el tejido conectivo se observó que la poliglactina 910 presenta un mayor número de casos de infiltrado polimorfonuclear severo, mientras que el cianoacrilato de butilo y la seda negra trenzada sólo presentaron infiltrados polimorfonucleares de leves a moderados. Caso contrario ocurrió con Yaltirik y cols.3 quienes determinaron que la poliglactina 910 era el compuesto que menor infiltrado polimorfonuclear originaba al 3º día. Probablemente esto se debió a que éste fue comparado con el Catgut crómico, el cual induce a una respuesta inflamatoria aguda mayor debido a su origen bovino, y con el nailon que adicionalmente al microtrauma de la aguja, origina una mayor fricción tisular, traduciéndose en una mayor respuesta polimorfonuclear en un estadio agudo.
En el 7º día correspondiente a una tiempo de transición entre la fase inflamatoria y proliferativa de la cicatrización, a nivel de tejido conectivo, todavía se apreciaron células polimorfonucleares en menor número de campos visuales, pero además de éstas, se observaron a los fibroblastos jóvenes formando un tejido conectivo laxo, que es un tejido conectivo joven con fibras de colágeno delgadas que se engrosarán constantemente hasta madurar. Sin embargo, Kulkarni y cols.5 en su investigación todavía evidenciaron al 7º día gran cantidad de células polimorfonucleares de un grado moderado a severo predominantemente, pero no se observó ningún fibroblasto joven; mientras que en esta investigación en el 13% del total de los casos estudiados ya presentaban las mencionadas células. Esto se debería a que en la metodología utilizada por estos autores, las incisiones fueron intraorales a nivel de la papila dental, tornándose difícil la toma de una porción mínima de las mismas, además de no tomar 1.5 cm de margen a ambos lados de las incisiones para poder observar los cambios histológicos en su totalidad. Además de lo mencionado, se considera como factores agregados el acúmulo de placa e higiene, haciendo que la fase inflamatoria se haya extendido y llegándose a apreciar recién al 21º día, fibroblastos jóvenes y mayor cantidad de tejido conectivo denso.2,14-15
Al llegar netamente al 14ºdía correspondiente a la fase proliferativa de la cicatrización, no se evidenciaron casos que presentaron infiltrados inflamatorios severos en los tejidos suturados con CAC-B. La ausencia de fibroblastos jóvenes en el 65% de los mismos evidenció el proceso de maduración del tejido conectivo. En lo que concierne al engrosamiento de la epidermis, Kulkarni y cols.5 y Moretti y asociados1 no consideraron este parámetro para sus respectivas investigaciones, además de no tener un grupo de estudio al 14ºdía. Yaltirik y cols.6 sólo evaluaron hasta cumplir los 7 días; Kulkarni y cols.5 y Moretti y cols.1 evaluaron el segundo control al 21º día. Al no tener un control, no se puede evaluar la proliferación fibroblástica propiamente dicha, ya que desde el punto de vista fisiológico, éste es el punto más alto de actividad de los mismos. En esta investigación, durante los días 7º y 14º días en las láminas histológicas, se evidenció gran proliferación fibroblástica y se pudo determinar las diferencias que origina cada material de síntesis en la fase proliferativa.
Respecto al 21ºdía, el proceso de cicatrización se encuentra en una fase final o de remodelación, en el cual la ausencia de fibroblastos jóvenes nos indica que éstos en su mayoría se encuentran totalmente maduros. Existen diversas investigaciones que utilizan diferentes periodos de evaluación, como Yaltiriky cols.3 quienes evaluaron la cicatrización en los primeros 7 días no cubriendo la fase proliferativa ni remodeladora de los tejidos. Moretti y asociados,1 al contrario, dejaron los materiales de síntesis por un periodo de hasta 45 días, originndo una gran cantidad de his tiocitos debido al excesivo tiempo de exposicion. Los macrófagos encapsulan todo elemento ajeno al organismo, formando una célula grande, multinucleada, denominada histiocito.1-4,12-15 Este histiocito migrará hasta el estrato córneo de la epidermis para su posterior eliminación, por lo que se deduce que no todos los histiocitos formados, necesariamente van a ser originados por el material de síntesis mismo, sino debido al prolongado tiempo de exposición a los tejidos, lo cual fue confirmado por nuestro estudio.
Un dato adicional e innovador que se tomó en cuenta en esta investigación, ya que se evidenció en todas las láminas, es el engrosamiento de la epidermis. Este engrosamiento se ha producido debido al incremento del número de queratinocitos, los cuales por mitosis se reproducen con el fin de colaborar con la cicatrización.
La epidermis de las ratas albinas consta de 3 capas bien definidas. Al 3º y 7º días, todas las capas estarán notoriamente aumentadas de tamaño debido a la alta actividad mitótica que se presente en este estrato y a los queratinocitos en su intento de reparación. Mientras que al 14º y 21º día paulatinamente volverá al grosor normal, ya que el proceso de cicatrización está concluyendo. Esto no pudo evidenciarse en los grupos tratados con hilos de sutura ya que, todavía existe un infiltrado polimorfonuclear que está fagocitando al material de síntesis, retrasando la fase proliferativa y remodeladora de la misma.
El tiempo de cicatrización en los tejidos tratados con CAC-B fue menor y sirvió como una barrera contra la penetración de microorganismos, reduciendo el tiempo de coaptación de tejidos y ser biodegradable, no siendo necesaria su remoción días después.
Habiendo demostrado las propiedades que presenta el CAC-B en este estudio en piel de animales de experimentación, se recomienda realizar más investigaciones clínicas en humanos a nivel intrabucal sobre el comportamiento que presenta este producto al tratarse de un medio diferente y que está asociado a otras condiciones orgánicas como pH salival, sustancias orgánicas y la probable influencia de fuerzas musculares linguales que podrían ocasionar una dehiscencia.
ConclusionesDe acuerdo con la investigación y metodología utilizada podemos concluir:
- 1.
El cianoacrilato de butilo es un material biocompatible, el cual permitió la cicatrización normal de los tejidos incididos.
- 2.
El infiltrado polimorfonuclear de los tejidos en los cuales se empleó el CAC-B, disminuyó considerablemente en comparación con la SNT y la poliglactina 910 durante los intervalos estudiados.
- 3.
La aparición de los fibroblastos jóvenes, en los cuales se empleó el CAC-B, fue notablemente superior al resto, observándose en menor tiempo tejido conectivo denso reparativo.
- 4.
El engrosamiento de la epidermis disminuyó considerablemente en los tejidos tratados con CAC-B en comparación a la SNT y la poliglactina 910.
Se agradece a la Dra. Esperanza Ayón Haro por la contribución en la corrección del manuscrito.
Facultad de Odontología Universidad de San Martín de Porres.