El adenoma pleomórfico es considerado el tumor benigno más frecuente de las glándulas salivales y se caracteriza histológicamente por presentar tanto elementos epiteliales como mesenquimales. El presente estudio tiene como objetivo reportar un caso clínico de adenoma pleomórfico en paladar de grandes dimensiones de un paciente masculino de 45 años de edad, tratado en la Unidad de Cirugía Buco-Maxilofacial del Hospital General del Este «Dr. Domingo Luciani» quien inicia enfermedad actual, hace 17 años aproximadamente presentando un aumento de volumen progresivo en paladar. Se planificó quirúrgicamente para una maxilectomía de Brown tipo II B y colocación de placa obturadora. En un control postoperatorio de 10 meses se evidenció formación de tejido en la región del lecho quirúrgico de aspecto similar a la mucosa circundante sin señales de recidiva con presencia de fístula oro-nasal de aproximadamente 2cm de diámetro. Actualmente se encuentra en programación de cierre de la misma con colgajos locales y posterior rehabilitación protésica.
Pleomorphic adenoma is considered the most frequent benign tumor found in the salivary glands. Histologically it is characterized by presenting epithelial as well as mesenchymal elements. The present study targets the report of a clinical case of a large size pleomorphic adenoma found in a 45 year old patient. The patient was treated at the Oral and Maxillofacial Surgery Unit of the Eastern General Hospital «Dr. Domingo Luciani». The patient reported onset of the disease approximately 17 years before, with a progressive volume increase in the palate. A surgical Brown type II B maxillectomy was planned, with placement of a shutter plate. At a 10 month post-surgery control, tissue formation was observed in the region of the surgical bed, this formation exhibited similar appearance to the surrounding mucosa, with no signs of recurrence and presence of an oral-nasal fistula measuring approximately 2cm in diameter. Presently, the patient is programmed to receive a fistula closure procedure by means of local flaps as well as subsequent prosthetic rehabilitation.
El adenoma pleomórfico (AP) es considerado el tumor benigno más frecuente de las glándulas salivales representando el 60%.1–3 Es también conocido como tumor mixto debido a que implica una amplia mezcla de elementos ductales y mioepiteliales en un solo tumor.4 El término «pleomórfico» hace referencia a la amplia variabilidad de la diferenciación parenquimatosa y estromal mostrada por las células tumorales.2
Aproximadamente el 80% de los AP se desarrollan en la glándula parótida5 generalmente en el polo inferior del lóbulo superfi cial,2,6 el 10% se presenta en la glándula submandibular y 10% en las glándulas salivales menores5 en donde la región palatina representa el 60%, seguido por el labio superior en un 20% y la mucosa bucal 10%.4
La Organización Mundial de la Salud (OMS)5 reportó en el año 2005, que la incidencia anual de esta lesión es de 2.4-3.05 por cada 100,000 individuos, generalmente entre la cuarta y quinta década de vida1,2 con una edad promedio de 46 años.5
Clínicamente se presenta como una tumoración indolora, de crecimiento lento, consistencia firme7 y dimensiones variables entre 2 y 6cm de diámetro7,8 asociada generalmente al lóbulo superficial de la glándula parótida o/a la mucosa palatina posterior2-8 y en menor frecuencia inciden en tejido glandular no salival del conducto auditivo externo, tejido mamario y conducto lagrimal.1
En un estudio imagenológico tipo tomografía computarizada (TC) usualmente se observa como una imagen circunscrita, con márgenes definidos, de densidad similar a los tejidos adyacentes a la lesión sin un patrón homogéneo.1,9 En la glándula parótida se presenta una imagen de bordes lobulados a diferencia de las imágenes en glándula submandibular y glándulas salivales menores. La cápsula de la lesión difícilmente puede ser detectada al igual que la reabsorción de hueso lindante.9
En una resonancia magnética (RM) la lesión se presenta bien circunscrita de heterogeneidad variable dependiendo de la ponderación en T1 o T2. El contraste entre la lesión y el tejido circundante tiende a ser alto en T1 (67%) y en T2 (90%)1,9 por lo que la cápsula es altamente detectada en ponderación T2 (87-90%) y difícilmente detectada en ponderación T1 (33%).9 Los bordes de la lesión se presentan lobulados tanto en la glándula parótida como en la glándula submandibular a diferencia del paladar el cual se presenta de bordes lisos habitualmente.9
En cuanto a las características microscópicas, existe un amplio espectro de hallazgos histológicos debido a la expresión de características variables epiteliales y mesenquimales, de ahí el término «pleomórfico».1,4,5,10 El AP se presenta como una lesión encapsulada cuando se desarrolla en glándulas salivales mayores, a diferencia de las glándulas salivales menores donde habitualmente, existe una cápsula incompleta1,4,5 y en la mayoría de los casos se muestran estructuras similares a dedos de guante que se extienden hacia el interior de la misma formando nódulos satélites los cuales se mantienen unidos al tumor mediante un istmo.5
Las células de origen epitelial dan lugar a estructuras ductales y están estrechamente mezcladas con elementos mesenquimales que pueden desarrollar cambios mixoides,7 hialinos, cartilaginosos u óseos.1,5,10 Las células mioepiteliales constituyen a menudo un gran porcentaje de las células tumorales y tienen una morfología variable, algunas veces pueden apreciarse de forma angular o fusiforme, otras son de forma redondeada y muestran un núcleo excéntrico con citoplasma eosinófi lo, hialinizado lo que asemeja a las células plasmáticas.4 Estas células mioepiteliales características son predominantes en los tumores que surgen en las glándulas salivales menores.4
El tratamiento de este tipo de lesiones va a depender de la localización y del tamaño de la misma, por lo tanto, la excisión quirúrgica es el tratamiento predilecto. 1,3–5,7 Diversos autores2,4,11 describen la parotidectomía parcial con identifi cación y preservación del ner vio facial en AP que se ubican en el lóbulo superfi cial de la glándula parótida. Por el contrario, en tumores que se encuentren en el lóbulo profundo es necesaria la realización de una parotidectomía total.3,4
Los tumores del paladar duro generalmente son extirpados incluyendo el periostio y la mucosa adyacente. 3,4,7
PRESENTACIÓN DE CASO CLÍNICOPaciente masculino de 45 años de edad natural y procedente de Caracas, quien acude a la Unidad de Cirugía Buco-Maxilofacial del Hospital General del Este «Dr. Domingo Luciani» por presentar un aumento de volumen progresivo en paladar, con una evolución de 17 años aproximadamente refiriendo disfagia y disnea.
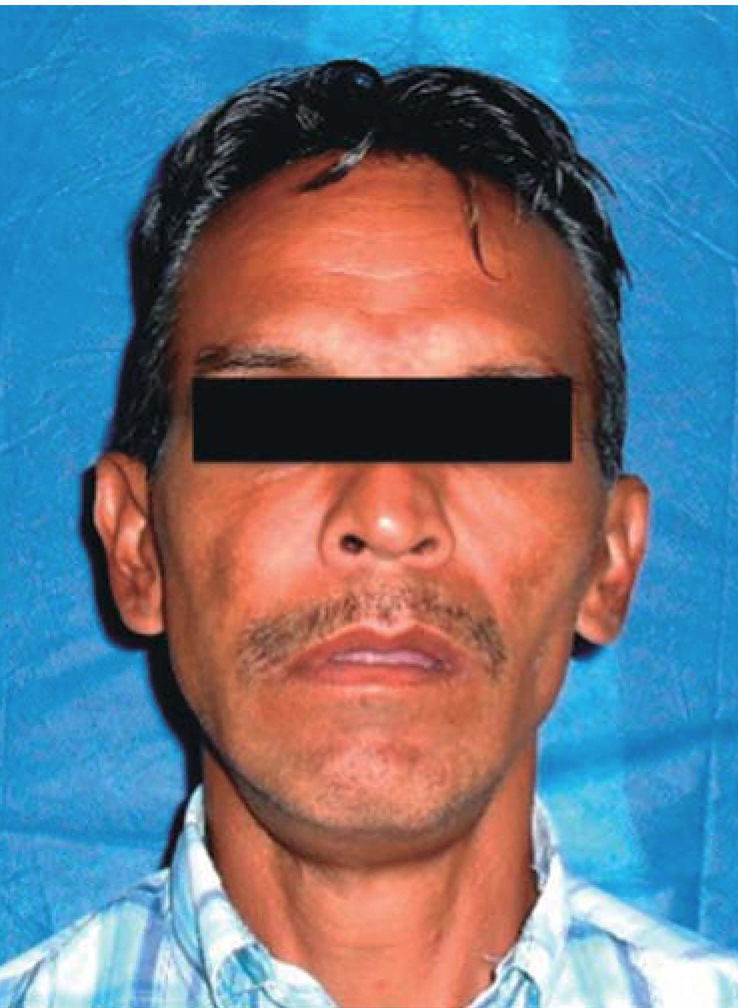
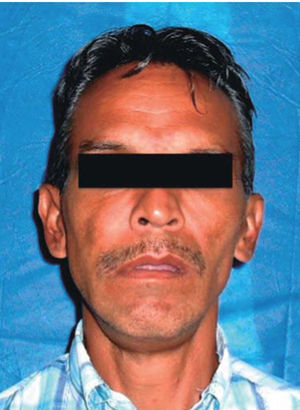
Al examen físico se evidencia una asimetría facial a expensas de tercio medio facial a predominio de hemicara derecha con presencia de incompetencia labial (Figura 1). En una exploración endonasal fue posible observar obstrucción total de ambas fosas nasales por la presencia de la lesión tumoral.
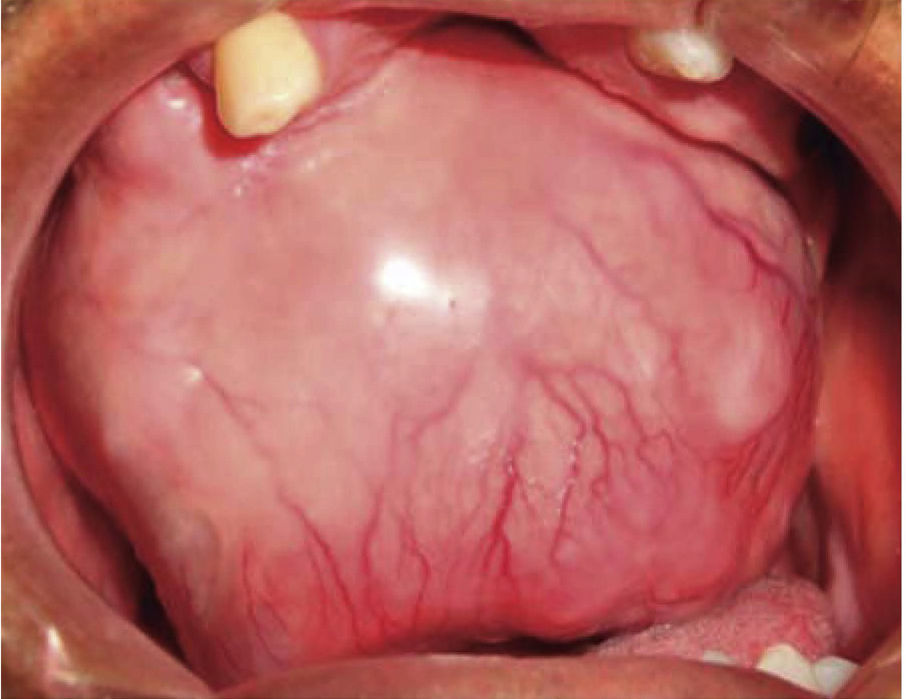
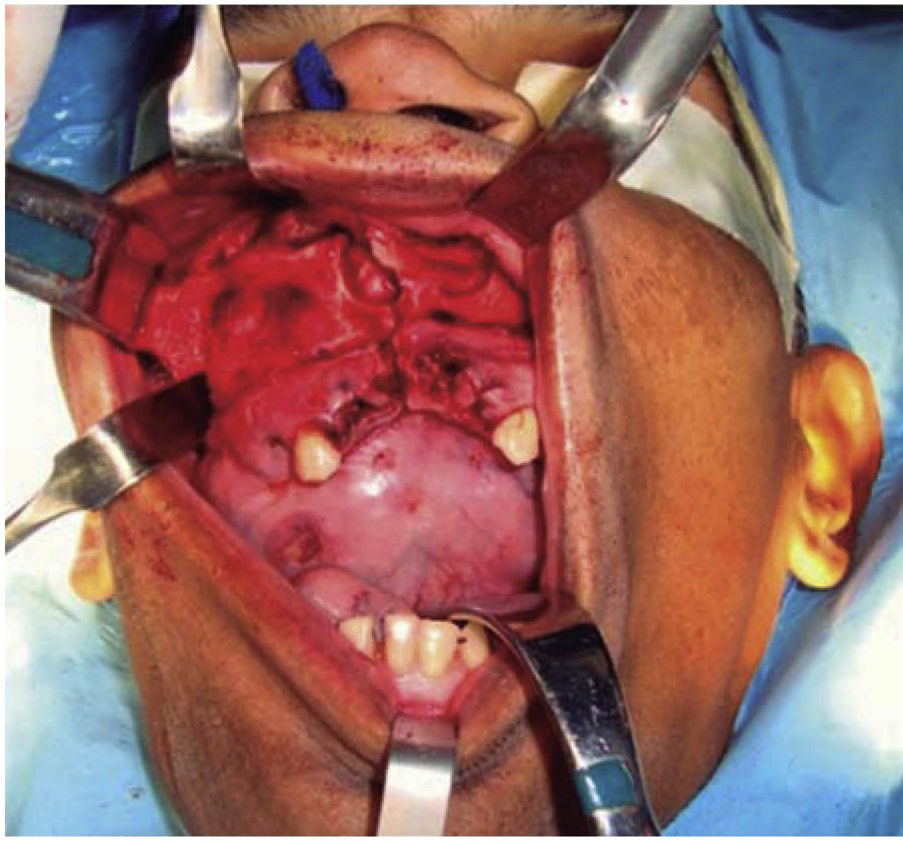
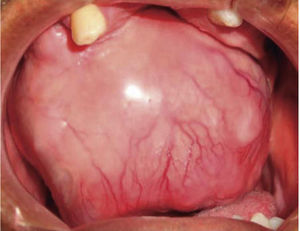
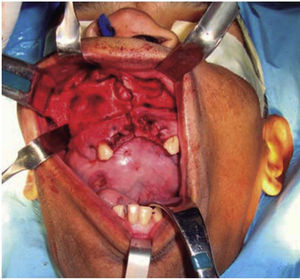
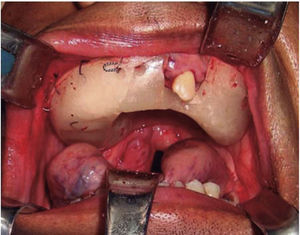
A nivel intraoral se evidenció edentulismo parcial bimaxilar, higiene bucal deficiente con presencia de restos radiculares múltiples, lesión tumoral de 9 × 9cm de longitud aproximadamente, recubierta por una mucosa similar a la mucosa oral de superficie lisa con tramado vascular en toda la extensión de la lesión, firme e indolora a la palpación que abarcaba gran parte de la cavidad bucal produciendo impedimento para realizar funciones de masticación, deglución, respiración y fonación (Figura 2).
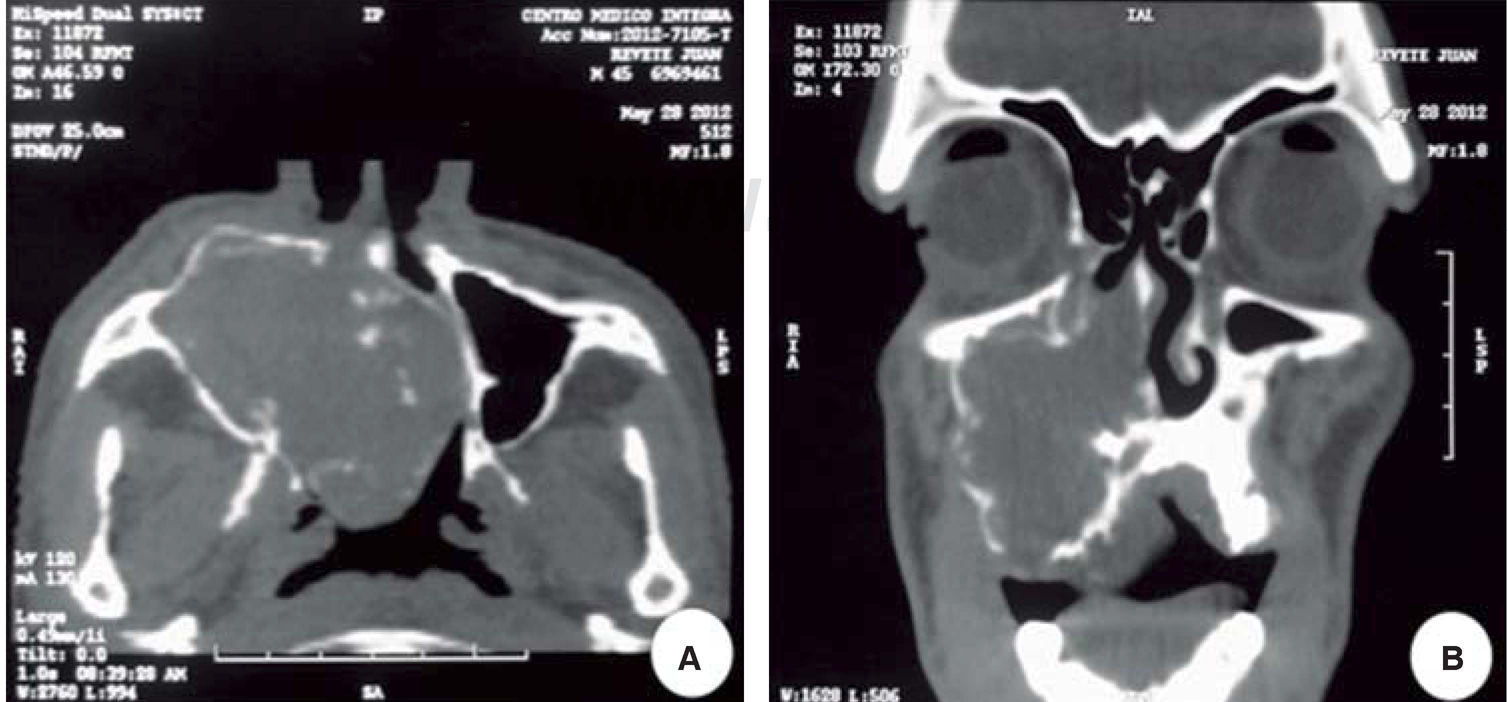
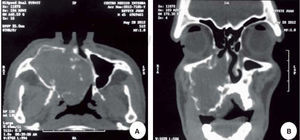
Se solicitó tomografía computarizada donde fue posible observar en un corte axial, una lesión ocupante de espacio, isodensa con respecto a los tejidos blandos adyacentes, ubicada en la hemiarcada maxilar derecha involucrando el antro maxilar, cornetes nasales, septum y región nasofaríngea (Figura 3A). En un corte coronal se observó lesión isodensa con bordes hiperdensos ubicada en antro maxilar derecho, que invade fosas nasales obstruyendo la vía aérea, respetando piso de órbita ipsilateral (Figura 3B).
Tomografía computarizada: A) corte axial donde se evidencia lesión ocupante de espacio ubicada en la hemiarcada maxilar derecha involucrando el antro maxilar, cornetes nasales, septum y región naso-faríngea. B) Corte coronal donde se observa lesión isodensa ubicada en antro maxilar derecho, que invade fosa nasal ipsilateral.
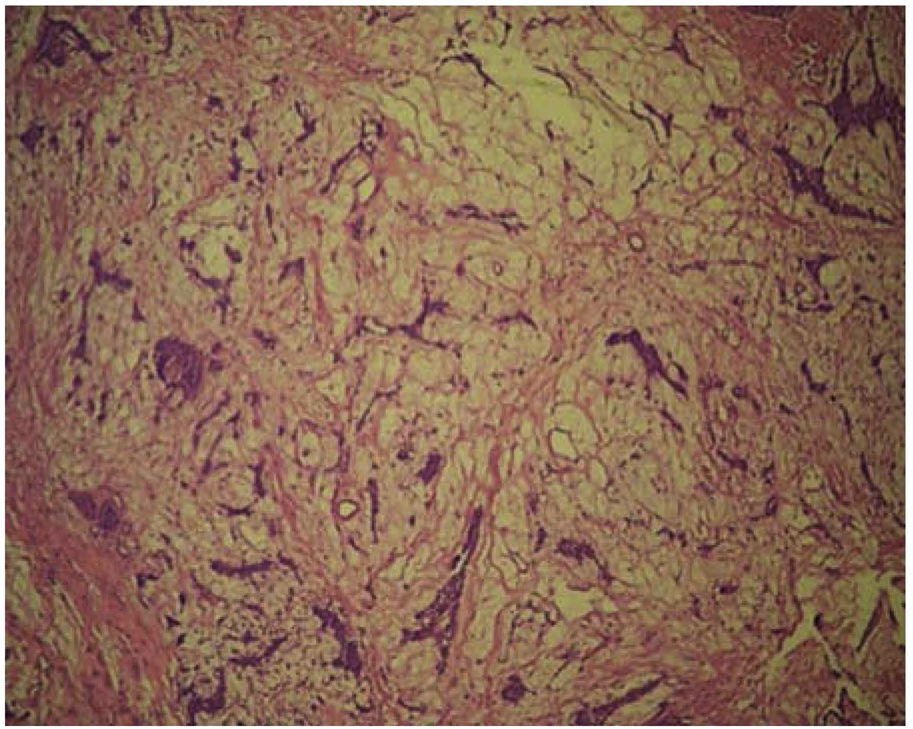
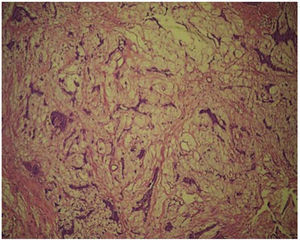
Se decide realizar biopsia incisional bajo anestesia local y la muestra obtenida fue enviada para estudio histopatológico dando como resultado «adenoma pleomórfico» (Figura 4).
La planificación quirúrgica del caso consistió en garantizar la vía aérea a través de una traqueostomía bajo anestesia local y sedación, debido a la imposibilidad de intubación naso u orotraqueal por la obstrucción que generaba la lesión.
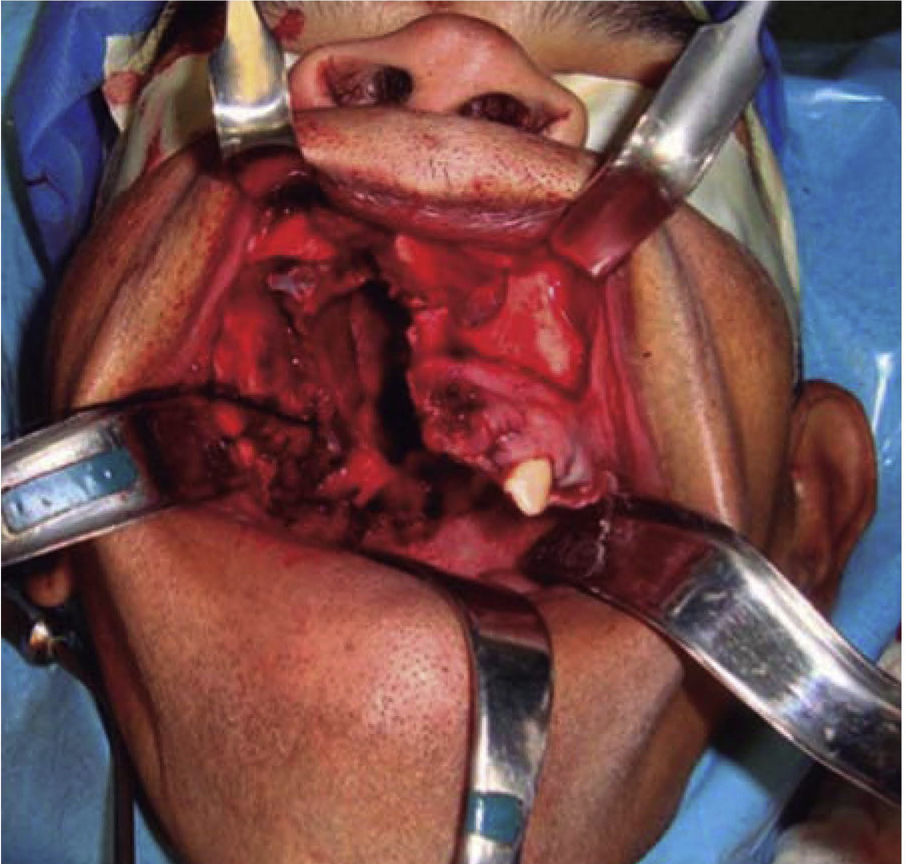
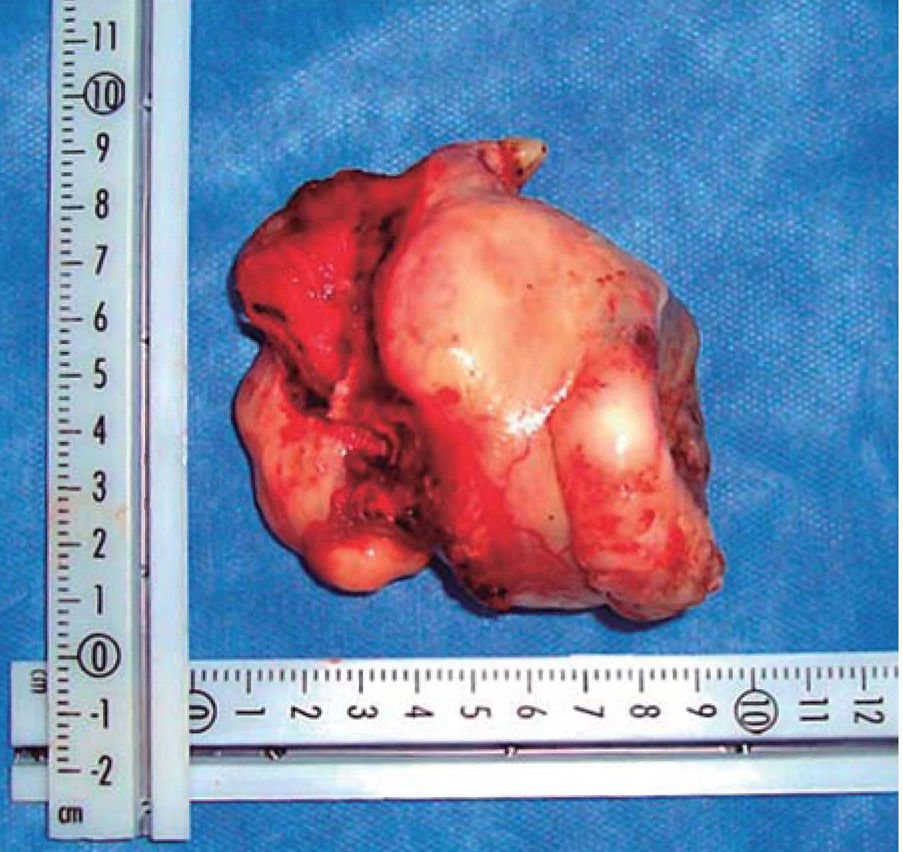
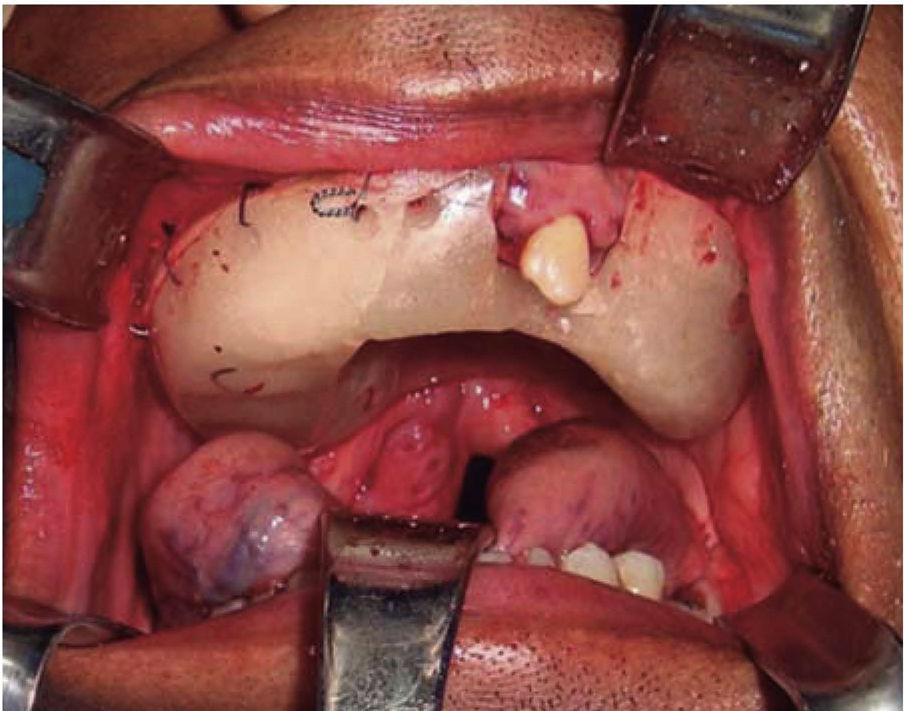
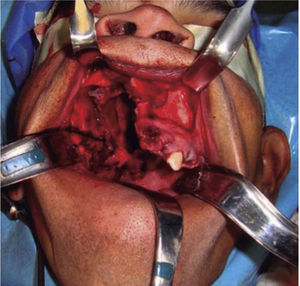
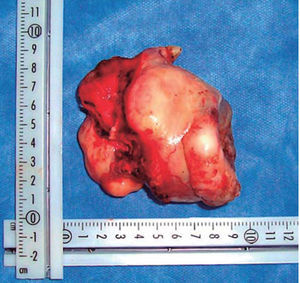
Una vez garantizada la vía aérea, se procedió bajo anestesia general balanceada, a través de un abordaje intraoral mediante una incisión circunvestibular superior, a la elevación de un colgajo mucoperióstico para exponer la pared anterior y lateral de seno maxilar derecho, se demarcó la maxilectomía de Brown tipo II B (Figura 5) con ayuda de fresa 702 completando la osteotomía con cincel y martillo (Figura 6) obteniendo una muestra de 9 × 9 × 10cm (Figura 7) generando una comunicación oro-naso-antral. Se procedió posteriormente a la suspensión con alambre calibre 0.6mm de la placa obturadora maxilar con la finalidad de evitar el colapso de los tejidos blandos además de guiar la cicatrización de las posibles fístulas oro-nasales durante la primera fase del tratamiento (Figura 8).
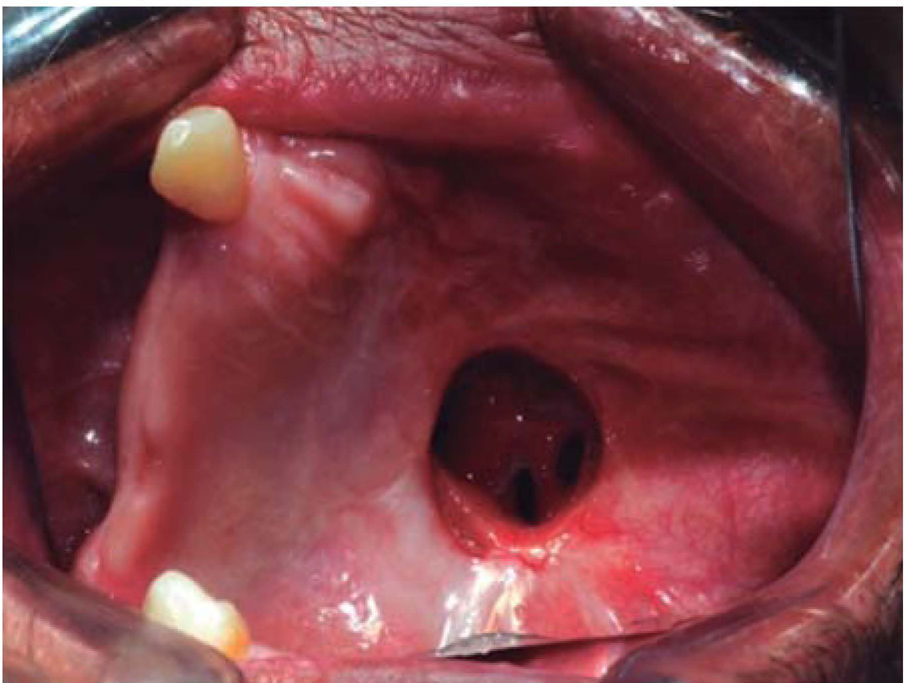
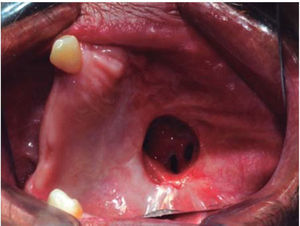
En un control postoperatorio de un mes fue retirada la placa obturadora observándose una mucosa oral en proceso de cicatrización de aspecto similar a la mucosa adyacente con presencia de fístula oro-naso-antral de 5cm diámetro aproximadamente y la hemiarcada maxilar contralateral remanente se encontraba de buen aspecto. A los 10 meses de la resección quirúrgica se evidenció formación de tejido en la región del lecho quirúrgico con presencia de fístula oro-nasal de aproximadamente 2cm de diámetro (Figura 9).
DISCUSIÓNEl adenoma pleomórfico es considerado como la patología benigna más común de las glándulas salivales representando del 45 al 74% de las mismas.8 Al presentarse en glándulas salivales menores, se ubica con mayor frecuencia en la región de paladar.4 Dependiendo de la localización, el AP puede variar de tamaño, generalmente se presenta como una tumoración asintomática que raramente excede los 6cm de diámetro.8 Debido al crecimiento lento de la lesión, si ésta no es tratada en su etapa inicial puede alcanzar grandes dimensiones4,8 llegando a comprometer funciones vitales como la respiración, la alimentación y fonética, similar a lo evidenciado en nuestro caso en donde el tumor alcanzó dimensiones de 9 × 9 × 10cm.
El manejo de la vía aérea en este tipo de pacientes es crucial para el éxito del tratamiento. Autores como Haspel et al.12 en un estudio retrospectivo, describen la traqueostomía como la técnica indicada para garantizar la vía aérea en manos de personal calificado en pacientes con trauma maxilofacial y cirugía de tumores de cabeza y cuello, en los cuales recomiendan la realización de la técnica posterior a la resección de la lesión para predecir el edema del cuello y la posición de la tráquea. Debido a la ubicación y tamaño de la lesión se decidió en nuestro caso, planificar la traqueostomía prequirúrgica debido a la difi cultad para garantizar una vía aérea mediante intubación convencional.
El tratamiento del AP varía dependiendo de la localización y extensión de la lesión. Lingam et al.1 describen la excisión quirúrgica como el tratamiento predilecto. Estudios han demostrado que la enucleación no está indicada debido a su alta tasa de recurrencia, reportada entre 2 y 45%.6 Esto puede deberse, microscópicamente, a la ausencia focal de la cápsula que rodea la lesión y/o a la formación de nódulos satélites por la invaginación del epitelio hacia la misma.1,6
En nuestro caso se decidió realizar maxilectomía de Brown tipo II B debido al gran tamaño que presentó la lesión y a la invasión de la misma hacia estructuras anatómicas adyacentes sin involucrar piso de órbita ipsilateral y maxilar contralateral.13
En presencia de lesiones de gran tamaño diversos autores14,15 refieren el uso de abordajes extraorales para la excéresis de estos tumores.
Las técnicas tradicionales extraorales como el abordaje de Weber-Ferguson permiten una buena exposición quirúrgica; sin embargo, posee la desventaja de producir cicatrices externas.14,15 Ante la presencia de patologías benignas, se sugiere la realización de abordajes intraorales con el fin de evitar complicaciones estéticas faciales.
En nuestro caso, se decidió realizar un abordaje intraoral para osteotomía Lefort I, ya que permite una amplia visión bilateral y simétrica de fosas nasales y senos maxilares para la exposición de la lesión mediante osteotomías maxilares.
Se han descrito otros tipos de abordaje para la resección de tumores en la región oro-faríngea como la técnica del degloving mediofacial propuesto por Casson et al16,17 en 1974. Autores como Buchwald et al.18 consideran que este abordaje debe ser usado como la primera opción en maxilectomía medial y en algunos casos de maxilectomía radical.
En cuanto a las alternativas de reconstrucción inmediata, Kreeft et al.19 describen la colocación de obturadores y reconstrucciones protésicas para devolver la función al paciente posterior a la realización de maxilectomías concordando con el tratamiento realizado en nuestro caso.
Autores como Genden et al.20 y Germain et al.21 defienden la realización de colgajos libres, ya que permiten reconstruir grandes defectos además de hacer frente a los problemas de la prótesis de obturación: fuga nasal, limpieza y el refinamiento protésico constante. Se debe tomar en cuenta que la reconstrucción con colgajos libres implica una complejidad del procedimiento como consecuencia de tiempos quirúrgicos prolongados asociado a la necesidad de contar con un equipo multidisciplinario y terapia intensiva postoperatoria, lo que conlleva cirugías de altos costos. Por el contrario, la fabricación de una prótesis obturadora acorta el tiempo de cirugía de manera signifi cativa y ofrece la posibilidad de rehabilitación dental inmediata adecuada.
En conclusión, el AP es una lesión de crecimiento lento y progresivo motivo por el cual si no se realiza tratamiento en su etapa inicial, puede alcanzar grandes dimensiones.
El tratamiento indicado es la resección quirúrgica de la lesión debido a que éste presenta una alta tasa de recidiva. Asimismo, el abordaje quedará siempre a juicio del cirujano y dependerá del tamaño y localización; sin embargo, se sugiere realizar abordajes conservadores como el abordaje intraoral, el cual nos permite realizar la resección del tumor sin comprometer la estética del paciente devolviéndole la función de manera inmediata.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam