¿ INTRODUCCIÓN
En México, el carcinoma de próstata (CaP) ocupa actualmente el segundo lugar en frecuencia dentro de las neoplasias del sexo masculino, únicamente superado por el cáncer de piel y es la segunda causa de muerte en hombres después del cáncer de pulmón.1 Más de 200 000 hombres en los Estados Unidos son diagnosticados anualmente con CaP y casi 30000 mueren cada año por esta enfermedad. En 2006, en los Estados Unidos de Norte América, se presentaron 234460 casos nuevos, y 27350 hombres murieron por esta enfermedad.2
La elevada incidencia y prevalencia de CaP se debe a múltiples factores. Estos factores de riesgo incluyen la edad, historia familiar y la raza. Las exposiciones ambientales también desempeñan un papel importante. Aunque la exacta exposición que incrementa el CaP no es clara, la dieta (especialmente la que es rica en grasas animales, como las carnes rojas, así como la que contiene bajos niveles de antioxidantes como el Selenio y la vitamina E), el trabajo ligado a químicos industriales, infecciones de transmisión sexual, y prostatitis crónicas han sido implicadas en diferentes grados.3
La incidencia del CaP es más alta en las personas de color de Estados Unidos de Norteamérica, seguidos por los caucásicos de ese mismo país. Los asiáticos del este, residentes en su territorio, tienen la incidencia más baja en comparación con los que residen en los Estados Unidos, pero estos a su vez, muestran menor incidencia en comparación con los europeos, caucásicos y raza negra.4
La detección del CaP ha mejorado mucho, principalmente debido a la introducción del antígeno prostático específico, el ultrasonido transrectal de próstata y las técnicas de biopsia.5 El CaP está relacionado en 80% a 90 % con factores genéticos y factores ambientales, sin embargo los posibles argumentos que explican su asociación con el CaP, son aún deficientes.6
Recientemente, la inducción de estrés oxidativo por medio de especies reactivas de oxígeno y las especies reactivas de nitrógeno que se generan durante la inflamación se han vinculado con el CaP.7 Estos hallazgos sugieren que los antioxidantes deberían regular este estrés y probablemente desempeñen un papel significativo en la prevención del CaP. La catalasa en una enzima que está presente principalmente en los peroxisomas de las células de los mamíferos. Es una enzima tetramérica dispuesta en cuatro subunidades de 60 kDa, las cuales contienen en su centro activo un grupo hemo y NADPH. La catalasa tiene dos actividades enzimáticas dependiendo de la concentración de H2O2. Si la concentración de H2O2 es alta, la catalasa actúa catalíticamente, removiendo el H2O2 y produciendo H2O y O2 (reacción catalítica). Sin embargo, frente a bajas concentraciones de H2O2 y en presencia de un adecuado donador de hidrógeno, por ejemplo, el etanol, metanol, fenol, y otros, la catalasa actúa peroxídicamente, removiendo H2O2, pero oxidando su substrato (reacción de peroxidación).8
La superóxido dismutasa (SOD1 citosólica), es una enzima homodimérica cuyo peso molecular es de ~32,000 daltons, contiene un átomo de cobre y uno de zinc en cada subunidad 16; estos dos átomos se encuentran anclados al residuo histidina número 6120. Las subunidades son estabilizadas por un puente disulfuro intracatenario, asociado por fuerzas no covalentes. Esta enzima requiere Cu y Zn para su actividad biológica, y la pérdida de Cu ocasiona su completa inactivación, conduciendo en muchos casos al desarrollo de enfermedades. Esta enzima tiene un gran significado fisiológico y un potencial terapéutico.9
Con base en lo anterior, y debido al papel que estas enzimas tienen en la regulación del estrés oxidativo, se decidió evaluar su expresión en el CaP y en la HPB.
¿ MÉTODO
Sujetos de estudio: La recolección de muestras para HPB se llevó a cabo del mes de diciembre del 2005 a abril del 2007, seleccionando las muestras de los pacientes registrados en la libreta de cirugía del Servicio de Urología del Hospital Central Militar y que cumplieron con los criterios de inclusión, exclusión y eliminación.
Para el CaP los sujetos de estudio comprendieron los tejidos obtenidos del almacén de Patología del Hospital Central Militar correspondientes a los casos de cáncer de próstata sucedidos en el periodo comprendido entre 1999 y 2003, de acuerdo con los criterios de inclusión, exclusión y eliminación.
Criterios de inclusión: a). Pacientes con diagnóstico de CaP con síndrome obstructivo urinario bajo de la vía urinaria; b). Pacientes con diagnóstico de HPB con indicación de resección transuretral prostática (RTUP) y prostatectomía radical.
Criterios de exclusión: a). Pacientes que no autorizan participar en el procedimiento; b). Pacientes que no sean candidatos a RTUP.
Criterios de eliminación: a). Insuficiente cantidad de tejido; b). Tejido que en el traslado, sufra desnaturalización del material genético.
La cantidad de tejido necesaria para la investigación, fue de uno hasta cinco gramos; la obtención de las muestras se hizo inmediatamente después de la realización de la intervención quirúrgica; el tiempo de traslado que se tomó como máximo fue de una hora, desde la obtención de la muestra hasta su traslado al laboratorio de Biología Molecular de la Escuela Médico Militar, donde se mantuvieron a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants).
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH = 7.4) y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 mm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glucoproteínas de la membrana celular.
Los cortes fueron incubados con ácido peryódico durante cinco minutos y lavados con agua destilada. Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos y contrateñidos con hematoxilina por 30 segundos. El perfil histológico de cinco campos seleccionados aleatoriamente (tres ratas por grupo experimental) fueron registrados utilizando el software KS-300 (Carl Zeiss, Jena, Germany). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica las secciones de tejido (3 mm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos; la actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC a una dilución 1:200 de anticuerpo monoclonal contra catalasa y anticuerpo monoclonal contra SOD1 en solución TRIS Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS los cortes fueron contrateñidos con hematoxilina. Todos los cortes fueron incubados bajo las mismas condiciones con la misma concentración de anticuerpo y en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especimenes fueron examinados por el microscopio de luz Axiovert 200M (Carl Zeiss, Jena, Germany). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss, Jena, Germany). Este equipo detecta automáticamente las células positivas determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1 584 000 m2). Los resultados fueron expresados como porcentaje.
Análisis de los datos: Los datos de la inmunorreactividad de catalasa y SOD1, fueron analizados con la prueba t de Student y los datos se expresaron como media ± desviación estándar, se compararon ambos grupos (CaP y HPB) y se consideró un valor de p < 0.05, como diferencia estadísticamente significativa. Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prisma versión 3.32.
¿ RESULTADOS
De un total de 80 pacientes se obtuvieron las muestras biológicas para la realización de la inmunohistoquímica. Cuarenta pacientes tenían diagnóstico histopatológico establecido de CaP, 40 pacientes tuvieron diagnóstico establecido de HPB.
En el grupo de pacientes con diagnóstico de CaP, la edad promedio fue de 65.3 años y la concentración de antígeno prostático específico preoperatorio de 11.9 ng/mL; el puntaje en la escala de Gleason fue de dos en un caso (2%), de tres en un caso (2%), de cuatro en siete casos (18%), de cinco en seis casos (15%), de seis en seis casos (15%), de siete en 10 casos(25%), de ocho en seis casos (15%) y de nueve en tres casos (8%). A todos los casos (100%), se les realizó prostatectomía radical, por diagnóstico de cáncer clínicamente localizado.
En el grupo de pacientes con diagnóstico establecido de HPB (40 pacientes), hubo un promedio de edad de 67.5 años. El promedio de concentración de antígeno prostático específico preoperatorio fue de 5.8 ng/mL, a los 40 pacientes se les realizó resección transuretral de próstata.
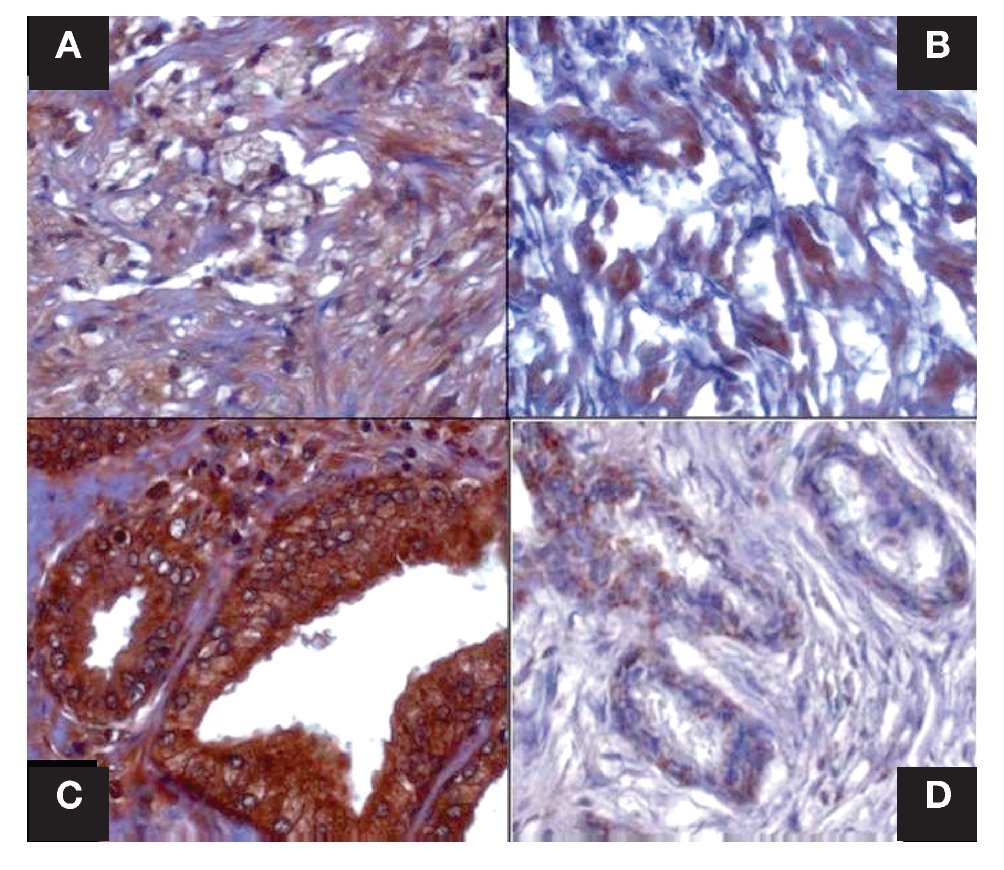
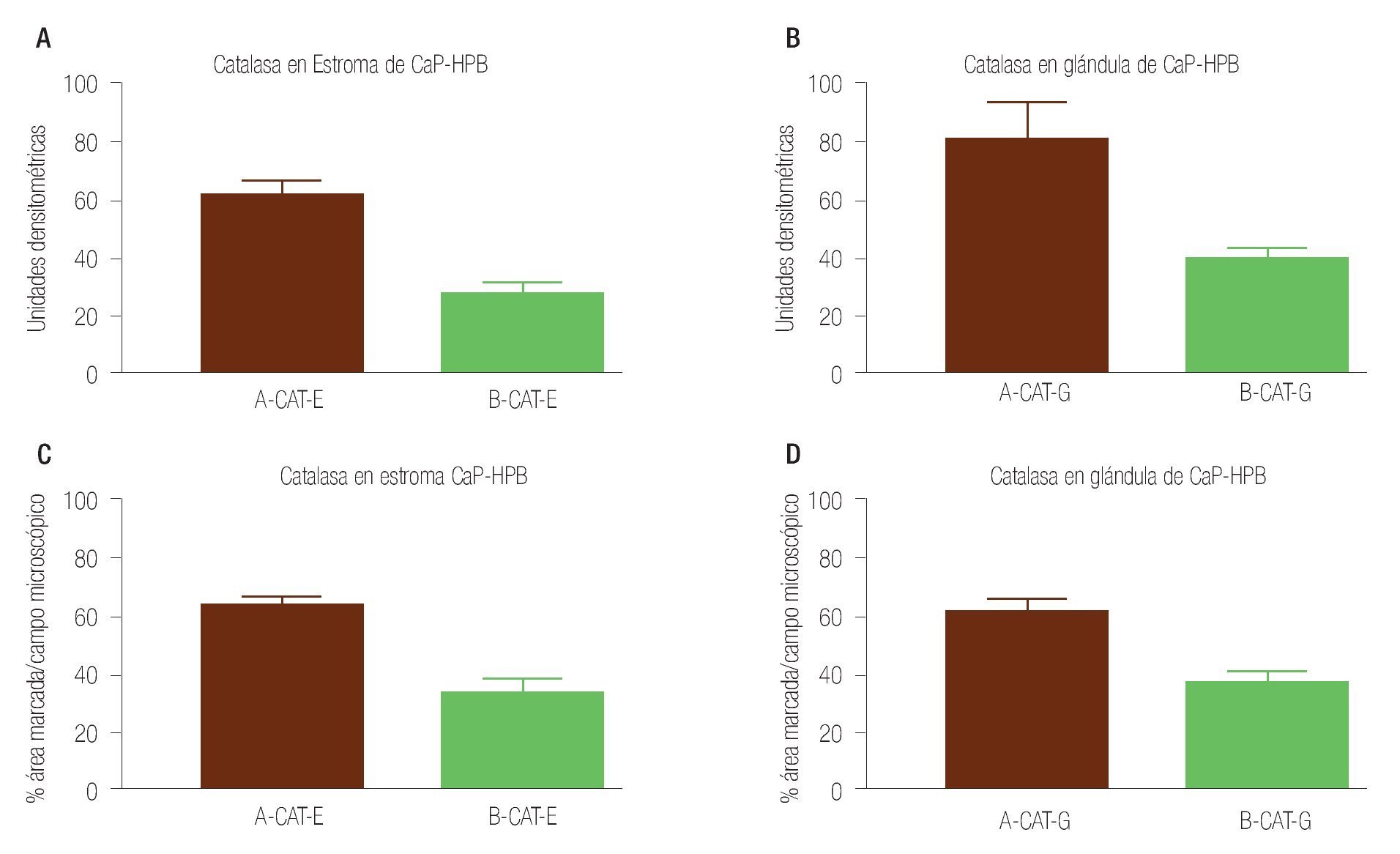
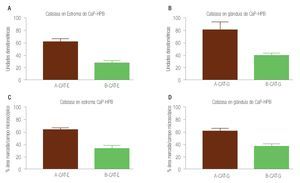
La inmunorreactividad de la catalasa en estroma se vio aumentada en los tejidos de CaP al ser analizados estos datos con los datos de estroma de HPB (p = 0.0001), por otro lado los resultados de la inmunorreactividad del porcentaje de área marcada por campo (400x), mostraron un aumento en CaP; valor de p = 0.0001 (Imágenes 1 y 3 paneles A y B). Los datos de la inmunorreactividad en las glándulas del tejido de CaP y de HPB, se compararon encontrando aumento en CaP, con valor de p = 0.0012; y al comparar las aéreas marcadas por campo microscópico (400x) de inmunorreactividad, se evidenció un aumento en CaP, con valor p = 0.0001), relación de inmurreactividad 2.7:1 (Imágenes 1 y 3, paneles C y D).
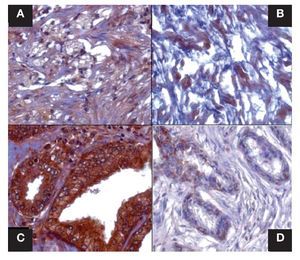
Imagen 1. Localización inmunohistoquímica de catalasa en estroma y glándulas de CaP y HPB. Se presentan cortes histológicos donde se observa la marca de catalasa, en (A) estroma de CaP, en (B) estroma de HPB, en (C) glándula de CaP y en (D) glándula de HPB. Se percibe disminución evidente de la intensidad de la marca en "B y D"; tanto en porcentaje de área marcado por campo como densito métricamente. A y B p = 0.0001 densidad y p = 0.0001 área marcada por campo; C y D p = 0.0012 densidad y p = 0.0001 área marcada por campo. Las figuras son representativas (n =40), (x400).
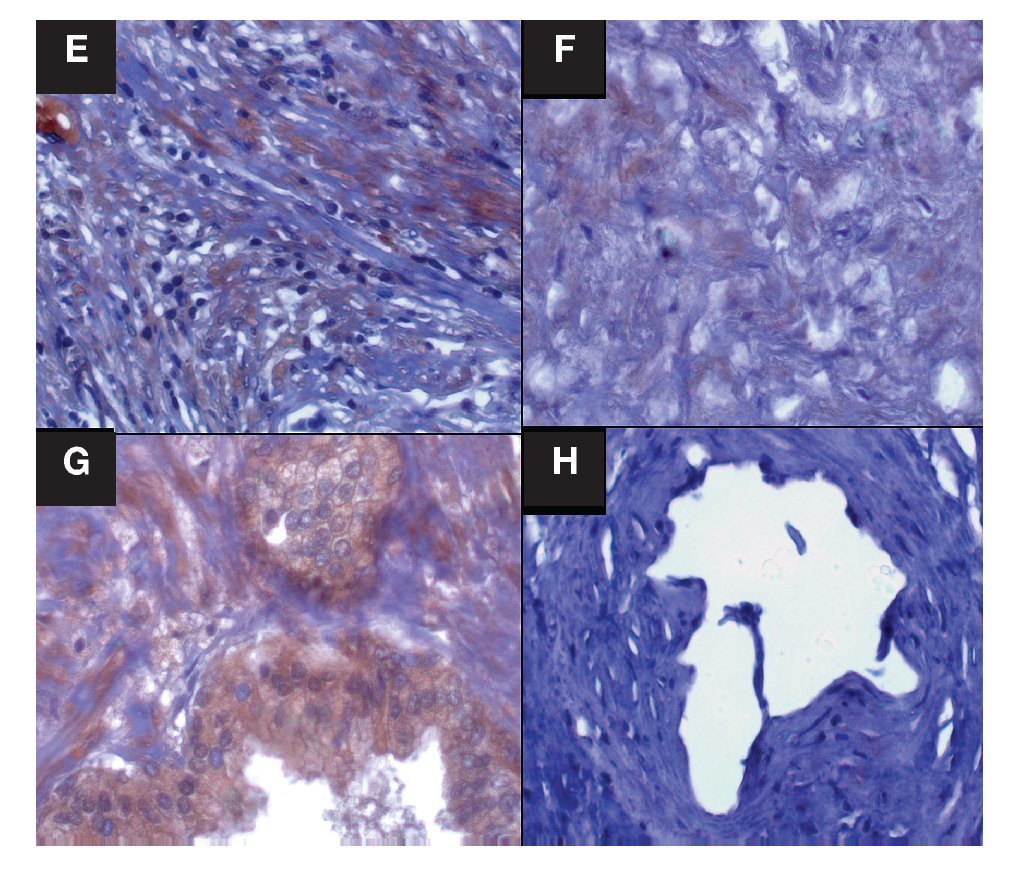
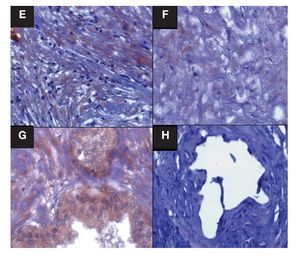
Imagen 2. Localización inmunohistoquímica SOD1 en estroma y glándulas de CaP y HPB. Las imágenes son cortes histológicos donde se observa la marca de SOD1, en (E) estroma de CaP, en (F) estroma de HPB, en (G) glándula de CaP y en (H) glándula de HPB. Las flechas indican la inmunorreactividad positiva. Se observa disminución evidente de la intensidad de la marca en "E y G"; tanto en porcentaje de área marcado por campo, como densitométricamente. E y F p = 0.0001 densidad y p = 0.0001 área marcada por campo, G y H p = 0.0005 densidad y p = 0.0001 área marcada por campo. Las figuras son representativas (n =40), (x400).
Imagen 3. Determinación por inmunohistoquímica de catalasa en estroma de cáncer de próstata e hiperplasia prostática. En (A) estroma de cáncer de próstata, en (B) estroma de hiperplasia prostática, en ambos grupos (n = 40) se determinó el valor densitométrico por campo (x400) y se analizaron los valores (p = 0.0001) con aumento significativo de la inmunorreactividad a catalasa en cáncer de próstata. Determinación por inmunohistoquímica de catalasa en glándula de cáncer de próstata e hiperplasia prostática. En (C) glándula de cáncer de próstata, en (D) glándula de hiperplasia prostática, en ambos grupos (n = 40) se determinó el valor densitométrico por campo (x400) y se analizaron los valores (p = 0.0012) con aumento significativo de la inmunorreactividad a catalasa en cáncer de próstata.
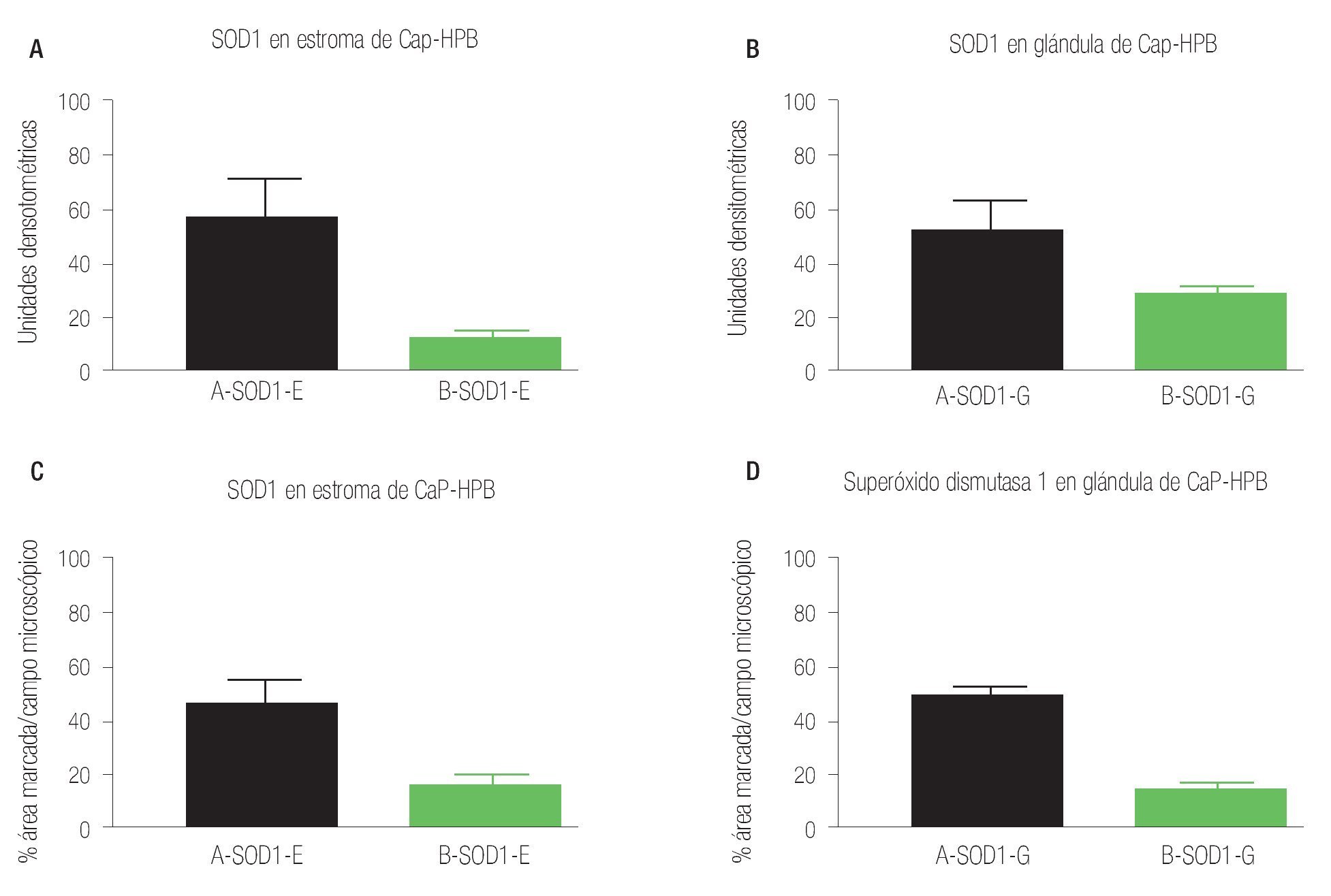
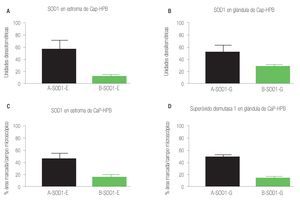
La inmunorreactividad de la enzima antioxidante SOD1 en el estroma de tejidos de CaP, se vio aumentada al ser analizados estos datos con los tejidos de estroma de HPB (p = 0.0001), mientras que los resultados de la inmunorreactividad del porcentaje de área marcada por campo (400 x), mostraron un aumento en los tejidos de CaP, con valor de p = 0.0001 (Imágenes 2 y 4, paneles A y B). Los datos de la inmunorreactividad de la SOD1 en glándulas de tejido tanto en CaP como de HPB, se compararon encontrando aumento en CaP, con valor de p = 0.0005, y al comparar el tejido glandular de las aéreas marcadas por campo microscópico de inmunorreactividad (400 x), se encontró un aumento en CaP p = 0.0001), relación de inmunorreactividad 2.3:1 (Imágenes 2 y 4, paneles C y D).
Imagen 4.Determinación por inmunohistoquímica de SOD1 en estroma de cáncer de próstata e hiperplasia prostática. En (A) estroma de cáncer de próstata, en (B) estroma de hiperplasia prostática, en ambos grupos (n = 40) se determinó el valor densitométrico por campo (x400) y se analizaron los valores (p = 0.0001) con aumento significativo de la inmunorreactividad a SOD1 en cáncer de próstata. Determinación por inmunohistoquímica de SOD1 en glándula de cáncer de próstata e hiperplasia prostática. En (C) glándula de cáncer de próstata, en (D) glándula de hiperplasia prostática, en ambos grupos (n = 40) se determinó el valor densitométrico por campo (x400) y se analizaron los valores (p = 0.0005) con aumento significativo de la inmunorreactividad a SOD1 en cáncer de próstata.
¿ DISCUSIÓN
En este estudio encontramos que los niveles de expresión de SOD1 y catalasa, fueron mayores en CaP que en tejido con HPB. Nuestros hallazgos contradicen los resultados inmunohistoquímicos de Baker y colaboradores, quienes usaron los mismos anticuerpos; ellos encontraron disminución de la inmunorreactividad de estas enzimas,10 en tanto, nosotros encontramos tanto en estroma como en tejido glandular un aumento importante de la enzima catalasa y de la SOD1, la inmunorreactividad de las dos enzimas se incrementó en forma difusa tanto en estroma y en tejido glandular de los tumores, posiblemente la expresión de estas enzimas se encuentra alterada en ambos tejidos, por el mismo efecto oxidante o incremento del desbalance oxidativo provocado por un incremento en la producción de radicales libres.11
No hay métodos estandarizados para medir el estado de estrés oxidativo global en humanos, es decir que ninguno de los llamados biomarcadores del estrés oxidativo consiguen de forma aislada una valoración precisa del estrés oxidativo que puede ser directamente aplicado a la clínica, por lo cual debemos tomar en cuenta que la determinación de la expresión de enzimas antioxidantes en los tejidos constituye sólo una aproximación a la medición del estado de oxidaciónreducción de dichos tejidos.
La expresión de las proteínas antioxidantes esta inducida a nivel transcripcional por el estrés oxidativo, por lo que se hace evidente en nuestro estudio ya que las concentraciones de ambas enzimas se incrementan.12 Por ello, podemos inferir que el aumento en los niveles de expresión de las enzimas antioxidantes en el carcinoma prostático indica que existe una respuesta al estrés oxidativo en las células de dicho tejido.
Sabemos que el estrés oxidativo es un contribuyente o un factor de riesgo para el carcinoma prostático, por lo que nuestro estudio es congruente con esta hipótesis, concepto que se sugiere al considerar al estrés oxidativo como una característica común de varias condiciones patológicas, en las que se incluye el carcinoma prostático. La primera de tales entidades patológicas la vemos en el envejecimiento y en varios tipos de cáncer, los cuales están asociados con este factor,13 estado en el que el equilibrio o balance oxidante/antioxidante cambia, conduciendo hacia el estrés oxidativo. La mitocondria es la mayor fuente intracelular de especies reactivas de oxígeno y ella misma es también vulnerable al daño oxidativo que probablemente produce los problemas del envejecimiento humano. La producción de especies reactivas de oxígeno y los radicales libres en la mitocondria está aumentada durante el envejecimiento como resultado del incremento permanente en el flujo de electrones del alterado sistema de respiración celular. El daño oxidativo celular y las mutaciones resultantes del ADN mitocondrial (ADNmt) pueden causar una declinación adicional de las funciones celulares y tisulares. La acumulación de mutaciones somáticas del ADNmt a través del estrés oxidativo parece ser el mayor contribuyente del envejecimiento humano relacionado con los desórdenes degenerativos, incluyendo la enfermedad prostática.14 Otra condición importante es la exposición a andrógenos, lo cual ha sido ampliamente asociado con el desarrollo de CaP y es un medio por el cual se altera el equilibrio oxidante/antioxidante de las estirpes histológicas de la próstata. Niveles fisiológicos de andrógenos son capaces de incrementar el estrés oxidativo en células sensibles a andrógenos en el CaP. La evidencia sugiere que esto es debido en parte al incremento de la actividad mitocondrial. Los andrógenos también alteran los niveles de glutatión intracelular y la actividad de ciertas enzimas detoxificantes, como la g-glutamil transpeptidasa, que es importante para el mantenimiento del equilibrio oxidante/antioxidante celular.14.
El efecto de los andrógenos en las células del CaP, incluye a la estimulación de la producción de antígeno prostático específico. El efecto de los andrógenos en la generación de especies reactivas de oxígeno es mediado, en parte, por el antígeno prostático específico. Otras condiciones que se relacionan con el CaP y que están asociadas con un aumento en la generación de especies reactivas de oxígeno son el tabaquismo, la dieta y los tóxicos ambientales.
Finalmente podemos decir que el aumento de estas enzimas, puede ser estudiada y ser considerada para evaluar la evolución de esta enfermedad, sirviendo como marcadores pronósticos, así como la valoración del tratamiento en determinados pacientes y con ello a su vez poder ayudar en la conducta terapéutica del médico tratante.
¿ CONCLUSIONES
La expresión densitométrica y de porcentaje de área marcada por grupo de enzimas antioxidantes de catalasa y de SOD1, se encuentra incrementada en los tejidos de cáncer de próstata en comparación con los tejidos de hiperplasia prostática.
Los resultados sugieren fuertemente la aplicación de SOD1 y CAT como marcadores tumorales de tejido prostático, y por otro lado nos indican que las células tumorales en el CaP se encuentran bajo estrés oxidativo, lo que puede generar cambios genéticos continuos que se manifiestan como un aumento en las anormalidades cromosómicas y en las mutaciones, lo que a su vez puede propiciar la génesis y propagación tumoral.
Correspondencia: Dr. Carlos Emmanuel Estrada Carrasco.
Hospital Central Militar, Sección de Urología. 2° Piso, 2ª Sección. Boulevard Adolfo López Mateos y Avenida Ejército Nacional, sin número. Delegación Miguel Hidalgo. México, D.F.
Teléfono: 55 573100. Extensiones 1535, 1305 y 1704.
Correo electrónico:dr.carlos_estrada@hotmail.com