¿DATOS ACTUALES DE RELEVANCIA
A menudo, los trastornos endocrinológicos y urológicos se correlacionan, como por ejemplo la litiasis y el cáncer de próstata.1
La incidencia mundial de cáncer de próstata varía en forma considerable desde 8 hasta 103 casos por 100 000 habitantes así como su mortalidad, desde 2 hasta 32 por 100 000 habitantes. En México, la incidencia es de 23 casos por 100 000 habitantes y la mortalidad de 7 casos por 100 000 habitantes, lo que de manera proporcional corresponde a 30.4% anual de los pacientes con diagnóstico de cáncer de próstata. Por su parte, en el mundo se observa una mortalidad desde 8.7% en Estados Unidos hasta 46.5% en Malasia, que a grandes rasgos ubica a México por arriba de la media de mortalidad.2,3
En Europa se diagnostican cerca de 2.6 millones de nuevos casos de cáncer al año y el cáncer de próstata constituye 11% de todos los cánceres en varones, así como 9% de todas las causas de cáncer en la Unión Europea.4
En Estados Unidos, el cáncer de próstata es el tumor más frecuente en el varón y representa 25% del total de casos nuevos de todos los cánceres y el segundo lugar como causa de muerte atribuible a cáncer, por lo que alrededor de 1 de cada 6 varones en Estados Unidos será diagnosticado con cáncer de próstata y 1 de cada 34 fallecerá por esa causa. Gracias al tamizaje temprano del paciente, ha disminuido la incidencia a 1.6% por año desde 1990-2005.3
En México, el cáncer es la segunda causa de muerte y el cáncer de próstata representa el segundo lugar en frecuencia, precedido por el de pulmón.5
¿ LA PRÓSTATA COMO ÓRGANO ENDOCRINO
Cerca de las 10 semanas de gestación, la estructura ductal de la próstata proviene del tejido epitelial del seno urogenital y es llevada dentro del mesénquima presente justo por debajo de la vejiga.6
La próstata es una glándula compuesta por tejido tubuloinfundibular, en el cual se encuentran las células epiteliales organizadas en una zona basal y una apical. Las primeras muestran diferenciación moderada y contienen cantidades variables de receptores de andrógenos y poca producción de antígeno prostático específico (PSA, por sus siglas en inglés), mientras que las apicales están bien diferenciadas y siempre son positivas a los receptores de andrógenos y a la producción de PSA.
Desde el punto de vista anatómico se identifican tres zonas: la zona periférica, que corresponde a 70% del volumen de la próstata adulta joven, la zona central, que abarca 25%, y la zona de transición, que corresponde al 5% restante. Se sabe que 70% de los carcinomas de próstata se originan en la zona periférica, 10% a 20% en la zona de transición y 5% a 10% en la zona central.7
El 95% de los cánceres de próstata corresponde a adenocarcinomas que crecen en la región acinar y cerca de la región ductal. Otros tipos histológicos incluyen los carcinomas acinar intratubular, ductal, de células pequeñas, o de patrón cirrótico, mucinoso, y al cáncer parecido a células renales.
Los cánceres de células pequeñas tienen características neuroendocrinas que se pueden diferenciar por marcadores como la enolasa, la sinaptofisina y la cromogranina A.8
La clasificación histológica del cáncer de próstata se hace con base en la escala de Gleason, la cual evalúa el grado de arquitectura bajo un aumento 10x y 40x. Se distinguen cinco patrones de crecimiento, desde los bien diferenciados hasta los pobremente diferenciados, donde el patrón 1 corresponde a los bien diferen ciados, con formación glandular discreta, y el patrón 5 a los mal diferenciados con pérdida de la arquitectura glandular. El resultado del índice de Gleason se obtiene de la suma de los dos patrones de crecimiento predominantes en la biopsia con valores desde 2 hasta 10. Esta escala también tiene fines pronósticos, y así los tumores con Gleason menor de 7 tienen mejor pronóstico, y los que suman más de 8 tienen peor pronóstico.9,10
De los factores de riesgo para el cáncer de próstata la edad es el más importante, y la herencia parece ocupar un lugar destacado en este contexto. Si dos o más familiares de primer grado están afectados, el riesgo se incrementa 5 a 11 veces (algunas de estas alteraciones se encuentran en los genes RNASEL, MSR-1, AR, CYP-17, SDR-5A2, así como alteraciones somáticas de GSTP-1, NKX-3.1, PTEN, CDKN-18, AR).11
En series de autopsias, se ha encontrado cáncer en 0, 5, 10, 41 y 63% de varones de la tercra, cuarta, quinta y séptima décadas, respectivamente.12 Esto contrasta con la incidencia clínica del cáncer de próstata (CaP), lo que sugiere que hay factores exógenos que afectan la progresión del llamado cáncer de próstata latente al clínico.
Los carcinógenos más importantes de la dieta son abundante en las carnes rojas, en especial cuando la carne se cocina a altas temperaturas, lo que produce la formación de aminas aromáticas hetorocíclicas (PhIP). La dieta baja en vitamina E, el selenio y los isoflavinoides, que actuarían como factores protectores, también son factores bien estudiados. También se ha descrito que altos niveles de licopeno, procedentes de la ingesta de tomates, reducen el riesgo de cáncer de próstata.11
Como es bien sabido, la próstata como otros órganos sexuales accesorios reciben estimulación durante su desarrollo, mantenimiento y función secretora a través de ciertas hormonas y factores de crecimiento. Entre ellos, la principal es la testosterona, que debe convertirse en la próstata en dihidrotestosterona (DHT) por medio de la reductasa alfa-5, la cual contribuye a su crecimiento y desarrollo.
Desde 1955, Grayhack descubrió que es necesaria la intervención de la prolactina para la formación completa de la glándula; en ratones con inhibición de prolactina durante el desarrollo embrionario, sólo se desarrolla 80% de la próstata.13
Es importante para la comprensión del cáncer de próstata hormonorrefractario y diseminado la relación entre el receptor de andrógenos y las vías de señalización producidas por la prolactina. Lo anterior está dando pie a la generación de protocolos de investigación de tratamientos con antiprolactinémicos14,15 y otros tratamientos a nivel genómico en busca de mejorar la supervivencia frente a este tipo de cánceres.
Ello justifica el desarrollo breve de los tópicos antes descritos, para ver más adelante su relación final.16
¿ PAPEL DE LA PROLACTINA EN LA PRÓSTATA
La prolactina es una hormona producida por la hipófisis anterior en las células del lactotropo, y su gen localizado en el cromosoma 617 parece provenir del mismo gen de la hormona del crecimiento (GH) y del lactógeno placentario (PLH) por su gran homología con ellas.18 La prolactina es un polipéptido de 199 aminoácidos que contiene tres puentes disulfuro y circula en varios tamaños: monomérico (pequeña), dimérico (grande) y en formas poliméricas (grande-grande). La forma monomérica es la más bioactiva.19
Dentro de la próstata, la prolactina actúa tras unirse a su receptor, el cual pertenece a la superfamilia de los receptores de citocinas 1 y se localiza en el cromosoma 5; además posee dos dominios que se encuentran separados en la forma de reposo y que una vez unida la prolactina se homodimerizan. De esta forma se produce la señalización intracelular por medio de la vía de las cinasas JAK-STAT.20,21
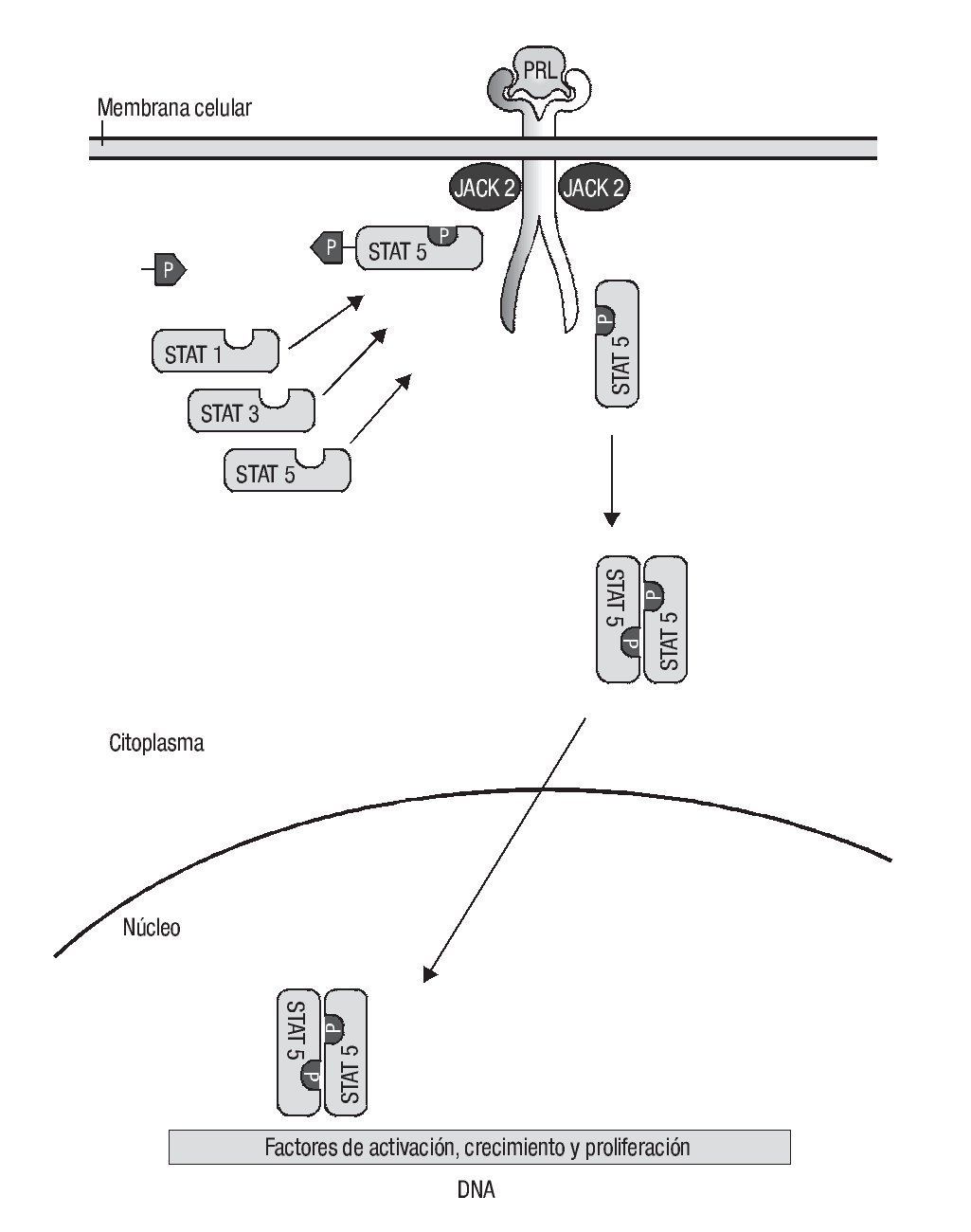
Una vez que la prolactina se une a su receptor, que posee actividad de cinasa de tirosina, se fosforila a JAK-2 y a STAT-1, 3, 5a y b; en un paso ulterior se forman dímeros de STAT-5a/b y se translocan al núcleo para actuar sobre los motivos de DNA, que a su vez activan las secuencias promotoras de la proliferación, diferenciación y supervivencia de las células prostáticas, ya sean células prostáticas normales como malignas (Imagen 1).21,22
Imagen 1. Señalización de la prolactina. Una vez que la prolactina se une sobre su receptor, que posee actividad de cinasa de tirosina, se fosforila a JAK-2 y a STAT-1, 3, 5a y b, luego se forman dímeros de STAT-5a/b y se translocan al núcleo para actuar sobre los motivos de DNA que activarán secuencias promotoras de la proliferación, diferenciación y supervivencia.
En la adaptación de las células cancerosas a la falta de hormonas intervienen dos mecanismos importantes: el primero es el de la amplificación y mutación del receptor de andrógenos y el segundo, el de la activación de las vías de señalización (proteincinasa (JAK-2-STAT-5a/b) por hormonas peptídicas (prolactina).23,24
Si bien están muy poco entendido los mecanismos moleculares que promueven la progresión del cáncer de próstata hormonorefractario y la enfermedad diseminada, parecer ser critico el papel que desempeña la prolactina, sobre todo en estos tipos.
Existe evidencia significativa de que hay acción paracrina y sobre todo autocrina de la prolactina, es decir que hay producción endógena prostática de prolactina, y se ha demostrado que en tumores de próstata de alto grado hay sobreexpresión de receptores de prolactina (Imagen 1).25
¿ RECEPTOR DE ANDRÓGENOS PROSTÁTICOS
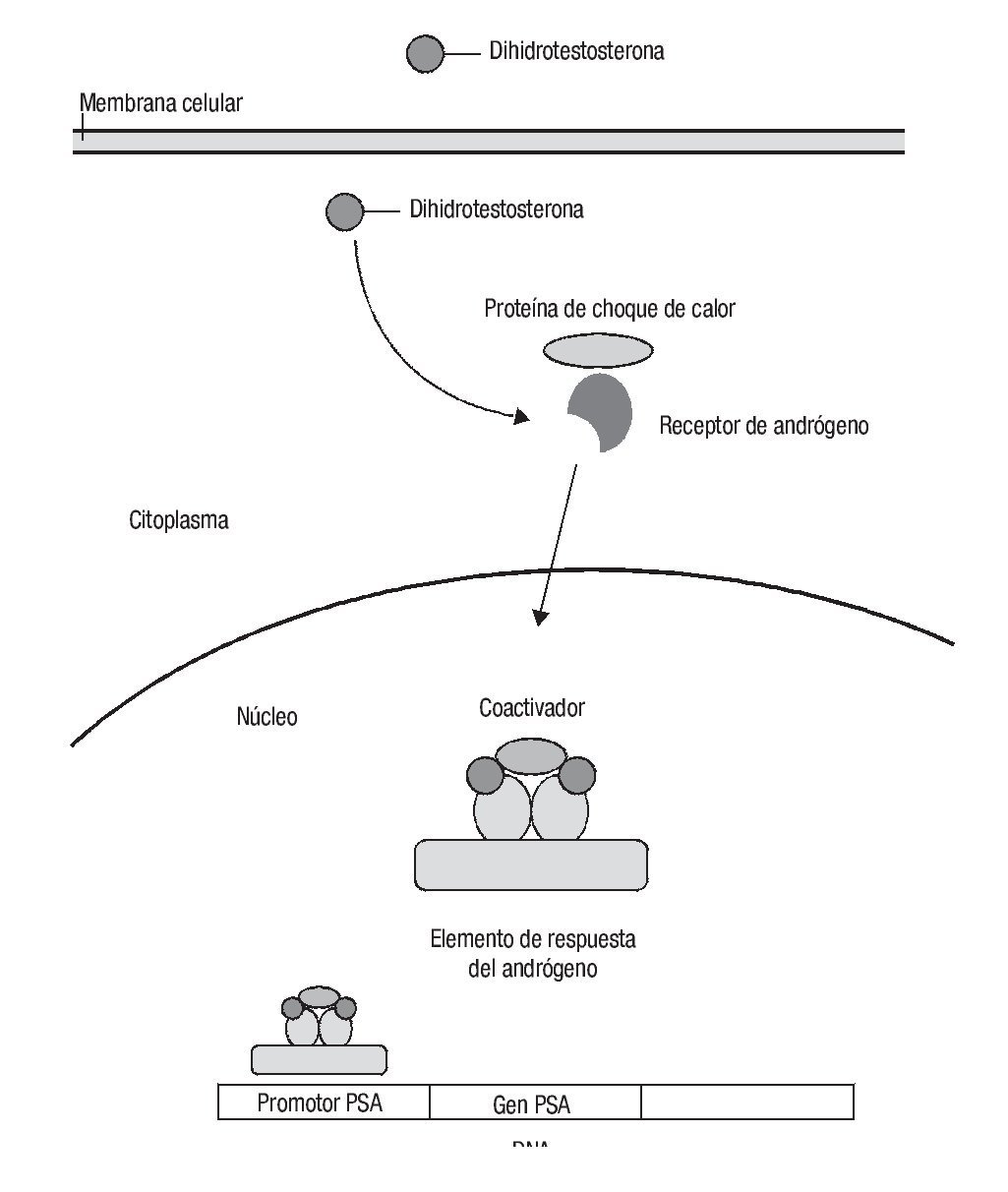
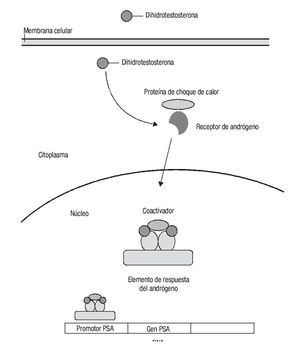
Los andrógenos actúan a través del receptor de andrógenos y se requieren para el desarrollo y función de la próstata. Se puede considerar un eje hipotálamo-hipófisis-gónada-próstata, ya que al producirse LHRH se sintetiza FSH y LH, que a su vez actúan en las células de Leydig para que produzcan testosterona. Ésta se transporta a la próstata, donde la reductasa alfa-5 la convierte en dihidrotestosterona, que es un metabolito más activo. Ambas ejercen su acción al unirse a su receptor en el citoplasma, al que fosforilan, para después transportarse al núcleo, donde ejercen su acción transcripcional cuando se unen a su cofactor y al elemento de respuesta al andrógeno para la proliferación diferenciación y supervivencia prostática.26 Este mecanismo también interviene en la producción de antígeno prostático específico (PSA) (Imagen 2).27
Imagen 2. Señalización de la dihidrotestosterona. La dihidrotestosterona ejerce su acción al unirse a su receptor en el citoplasma, al que fosforila y después es transportado al núcleo, donde ejerce su acción transcripcional tras unirse a su cofactor y al elemento de respuesta al andrógeno para la proliferación, diferenciación y supervivencia prostática.
El recién descrito no es el único mecanismo por el cual se activa el receptor de andrógenos, que también puede ser fosforilado, es decir activado por medio de otras vías intracelulares, como la de las cinasas Smad/ Akt/MAPK producidas por TGF-, IL-6 e IGF-I.28
Como se menciona más adelante, también su actividad se ve influenciada por vías intracelulares producidas por la prolactina, aunque esto sólo ocurre en células prostáticas normales.
Existen alrededor de 50 mutaciones del gen del receptor de andrógenos que dan lugar a una actividad hormonal desmesurada y descontrolada del receptor o bien a su inactivación incompleta (Imagen 2).28
¿ FUNCIÓN DE STAT-5 A/B EN EL CÁNCER DE PRÓSTATA
El STAT-5 es uno de los siete miembros de la familia de factores de trascripción STAT y consiste en dos proteínas distintas pero con alta homología de 94 kDa (STAT-5a) y de 92 Kd (STAT-5b).29
El STAT-5 a/b es el producto de la fosforilación del STAT-5 a y b por medio de JAK un vez que la prolactina se une a su receptor, y es de suma importancia el papel que juega en el cáncer de próstata, sobre todo en el hormonorrefractario. Se ha demostrado que la actividad de STAT-5a/b está incrementada hasta en 65% en las células cancerosas independientes de andrógeno, como lo demostró en su estudio Tommi J y colaboradores. El autor construyó un vector de adenovirus que da por resultado la pérdida del sitio de activacion transcripcional de STAT-5a, lo que bloquea de manera efectiva la acción tanto de STAT-5a como de 5b, una situación que a su vez induce la apoptosis en las células cancerosas.24
Se ha demostrado la utilidad de STAT-5a/b como predictor de tumores de alto grado y de recurrencia.30
¿ INTERRELACIÓN DE VÍAS DE SEÑALIZACIÓN (STAT-5A/B Y AR)
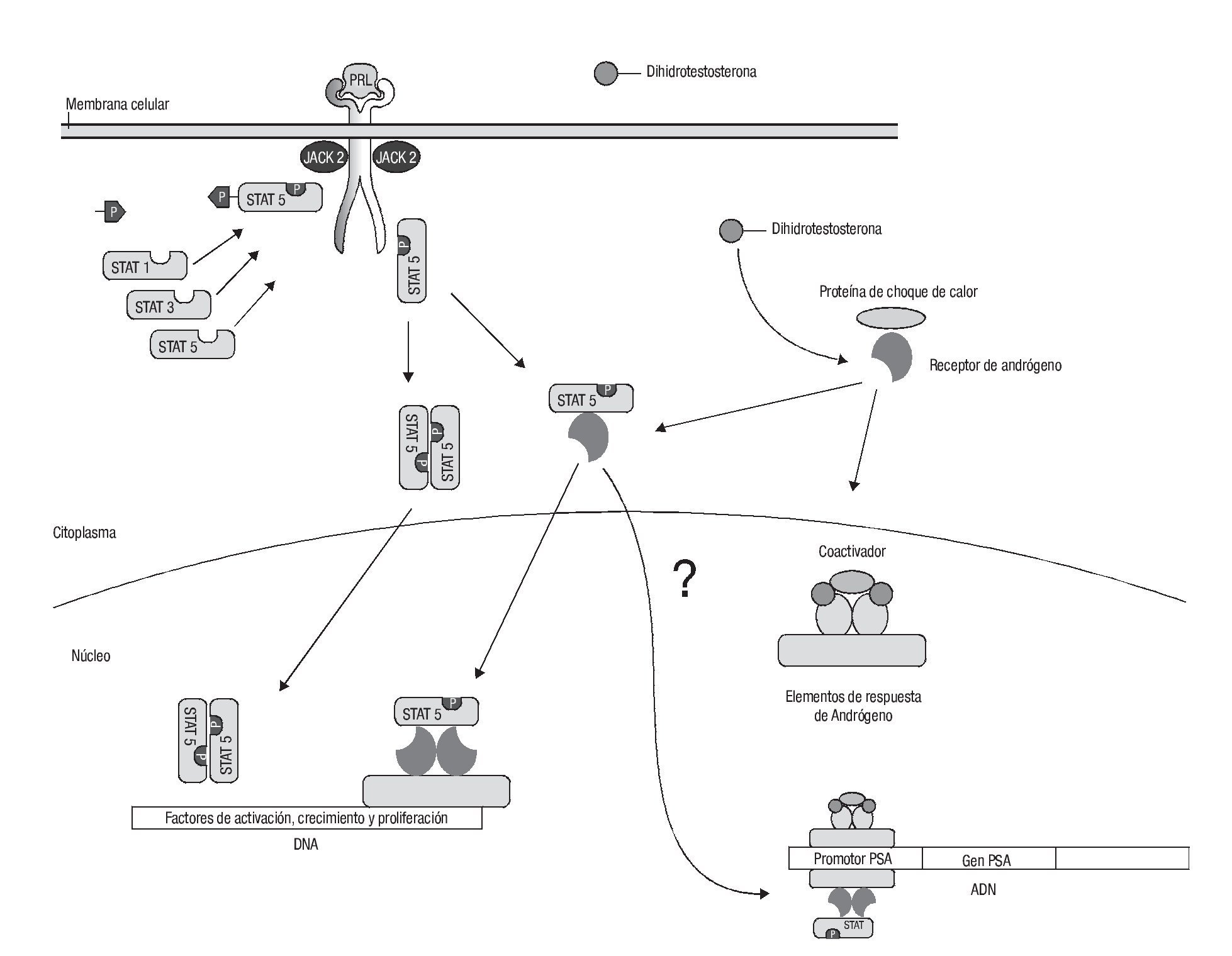
Como se menciona antes por separado, la acción e importancia que tienen el STAT 5 y el receptor de andrógenos (AR) en el papel que juegan en el desarrollo del cáncer de próstata y además su relevancia clínica en el hormonorrefractario se ha comprobado evidencia de que ambas vías, tanto la de prolactina como la de los andrógenos, tienen un punto final en común. Estos datos fueron detallados en un estudio realizado por Shyh-Han Tan y colaboradores.16
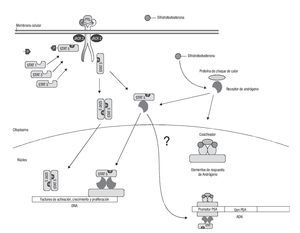
En ese estudio se demostró que STAT-5a/b y la secuencia del gen AR interactúan tanto en forma indirecta como directa. Se demostró que AR incrementa la actividad transcripcional de STAT-5a/b así como su translocación intranuclear en las células cancerosas, y lo contrario también es cierto, es decir que en presencia de STAT-5a/b se incrementa la actividad transcripcional de AR así como su translocación al núcleo. Todavía resulta más interesante la interacción física entre ambos que da por resultado un complejo nuevo con actividad transcripcional (Imagen 3).16
Imagen 3. Interrelación de vías de señalización. Una vez formados los productos STAT-5b, éste se une con el receptor de andrógenos y forman un complejo nuevo que se transloca al núcleo y activa las secuencias de activación, diferenciación y proliferación celular prostática sin necesidad de que la dihidrotestosterona se una al receptor de andrógenos. No se sabe si también por este mecanismo se produciría PSA.
¿ USO CLÍNICO
Está descrito en años previos el uso de antiprolactinémicos, en especial bromocriptina, para el tratamiento del CaP independiente de andrógeno con resultados poco satisfactorios.14,31
En la actualidad se han creado terapias genómicas en busca de la reducción de mediadores intracelulares clave y una de las más importantes se dirige a la familia STAT, tanto a STAT-3 como a STAT-5. Para el caso de STAT-3, se han desarrollado técnicas que introducen sondas de DNA que acaban por acoplarse al DNA celular durante la replicación, lo que se traduce en un efecto final inhibitorio directo de STAT-3, lo que produce apoptosis.32 Se han desarrollado sondas de DNA que se introducen al genoma y generan productos de STAT-5b sin sitios catabólicos.33
En fecha reciente se recurrió al uso de c7Me-IEITC (etiltiocianato), una sustancia que disminuye la vías intracelulares reguladas por cinasas prooncogénicas así como factores de trascripción (STAT-3, IKK y NF- B), que causa una rápida pérdida del potencial de membrana mitocondrial, la inactivación de PARP-1 y la activación consiguiente de las caspasas. Este medicamento se ha probado tanto en cáncer de ovario como en el neuroblastoma con resultados prometedores, pero con gran cantidad de efectos secundarios.34 Sin embargo, no se ha hecho uso de este medicamento en el cáncer de próstata, donde por las características antes descritas podría ser útil, al menos en teoría.
¿CONCLUSIONES
El descubrimiento del nuevo complejo STAT-5-AR podría identificarse en pacientes con cáncer de próstata y crear nuevas líneas de tratamiento en aquellos pacientes en que resulte positivo.
La prolactina parece jugar un papel importante en el cáncer de próstata, sobre todo en los tumores hormonorrefractarios.
Se han desarrollado terapias genómicas para la inhibición de estos complejos (STAT-3, 5), así como el bloqueo de múltiples vías de señalización intracelular y la activación de otras con el uso de etiltiocinato.
Finalmente, falta desarrollar estudios de este tipo de terapias aplicadas en humanos y, en el caso del etiltiocianato, su uso en pacientes con cáncer de próstata.
Correspondencia:
Dr. Miguel Ángel Mendoza Romo.
V. Carranza 1080, Col. Centro, C.P. 78000. San Luis Potosí, SLP.
Teléfono: (01) 444 811 3646.