“Malacoplaquia” es un término derivado de raíces griegas que significa “placa suave”. Es una enfermedad inflamatoria crónica poco común con afección frecuente de la vejiga y raramente del riñón, donde se clasifican como un seudotumor renal. El objetivo del presente trabajo es exponer un caso de malacoplaquia en riñón, tratado con nefrectomía parcial laparoscópica.
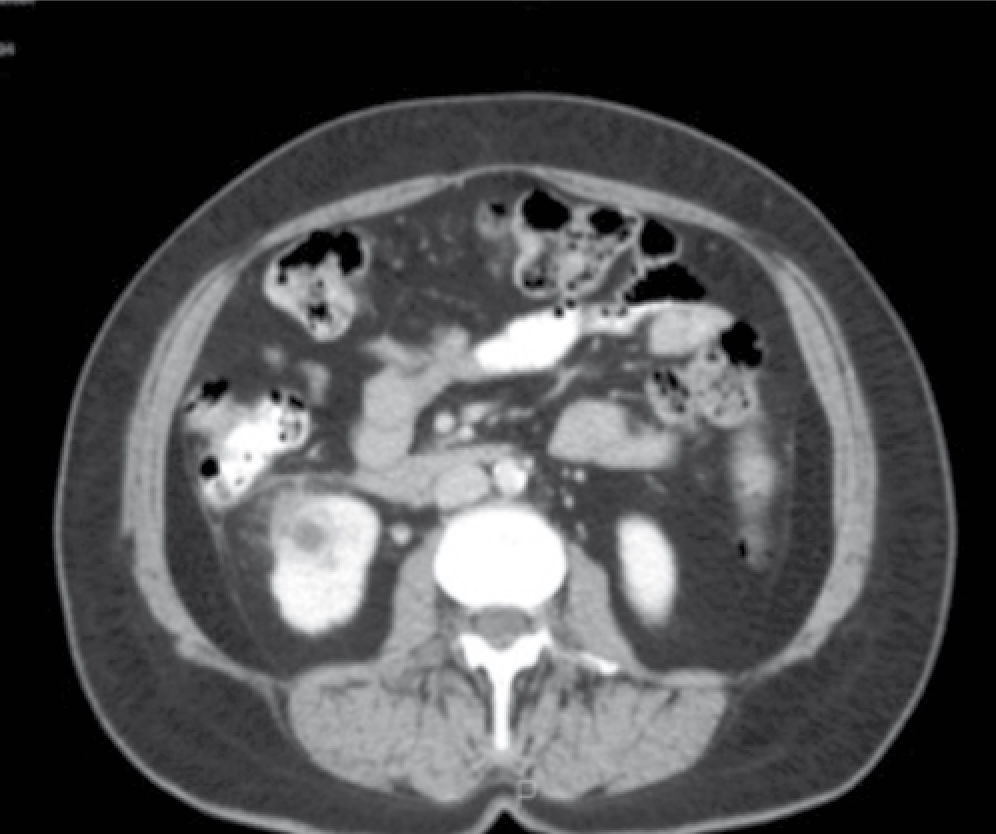
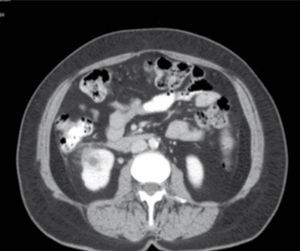
Presentamos el caso de una paciente femenina de 68 años de edad, con diabetes mellitus tipo 2 (DM2) y cuadros repetitivos de infecciones de vías urinarias. En la tomografía computarizada (TC) se observó una masa sólida renal derecha de 25 x 25mm, con reforzamiento tras la administración del material de contraste. Se llevó a cabo nefrectomía laparoscópica transperitoneal sin incidentes. El reporte histopatológico final fue: malacoplaquia renal.
La malacoplaquia renal es una entidad poco frecuente, en donde el diagnóstico definitivo es histopatológico, se clasifica clínica y radiológicamente como un seudotumor renal, ya que puede ser confundido con una neoplasia renal.
The term “malacoplakia” comes from the Greek malakos and plakos, meaning “soft plaque”. It is an uncommon chronic inflammatory disease that often involves the bladder, but rarely the kidney. When this latter organ is affected, it is classified as a renal pseudotumor. The aim of this article was to present a case of renal malacoplakia treated by laparoscopic partial nephrectomy.
A 68-year-old woman presented with type 2 diabetes mellitus (DM2) and recurrent urinary tract infections. A computed tomography (CT) scan revealed a contrast-enhanced solid renal mass measuring 25 x 25mm. Laparoscopic transperitoneal nephrectomy was performed without incidences. The final histopathologic report was renal malacoplakia.
Renal malacoplakia is uncommon and the definitive diagnosis is histopathologic. It is classified clinically and radiologically as a renal pseudotumor and should not be confused with renal neoplasia.
La neoplasia renal es una entidad común, ya caracterizada tanto clínica como radiológicamente por su incidencia y prevalencia en el grupo de las lesiones sólidas de riñón. Se diagnostica fácilmente mediante imágenes de rutina. Existen parámetros y criterios radiológicos bien establecidos, para un diagnóstico casi certero. Sin embargo, se sabe mucho menos acerca de las lesiones que imitan una neoplasia renal (en el ámbito clínico, radiológico e histopatológico), por lo que muchas veces el resultado histopatológico dista mucho de los hallazgos preoperatorios. Estas tumoraciones se pueden componer de tejido renal normal o benigno, se conocen como seudotumores renales. Aunque lesiones comunes, como abscesos y los quistes renales pueden ser diagnosticados con confianza en imágenes, presentaciones atípicas de tales entidades comunes y ciertas entidades poco frecuentes pueden simular neoplasias renales y de esta forma, derivar en una resección innecesaria a causa de la preocupación de malignidad.
Presentación del casoFemenina de 68 años de edad, con diabetes mellitus tipo 2 (DM2) de 10 años de evolución tratada con insulina NPH, control regular de su glicemia, conocida en el Servicio de Urología por infecciones de vías urinarias recurrentes, con abandono frecuente de esquemas de antimicrobianos. A la exploración física sólo se evidencia sobrepeso, resto irrelevante. Dentro de su protocolo de estudio se encontró una lesión sólida hipoecoica en ultrasonido, por lo que se completa valoración de estudio con tomografía computarizada (TC) abdominopélvica simple y contrastada. Sus estudios de laboratorio y gabinete clínico fueron: examen general de orina con pH 7.1, proteínas +, eritrocitos 2 x campo, leucocitos 20-25 x campo, bacterias abundantes, sin cristales, urocultivo (+) 100,000 UFC/mL de Escherichia coli (E. coli), resistente a fluoroquinolonas y trimetoprim sulfametoxazol (TMP/SMX), sólo sensible a cefalosporinas de segunda y tercera generación; química sanguínea con glicemia de 143mg/dL, creatinina sérica 1.2mg/dL, ácido úrico 6mg/dL, depuración de creatinina en orina de 24horas en 77mL/min con albuminuria presente; biometría hemática completa; perfil hepático y tiroideo dentro de valores normales. Citología urinaria y uretrocistograma normales. Se realiza TC para estudio de tumoración renal derecha reportándose: tumoración sólida derecha en polo inferior que mide 25 x 25mm de diámetro, registrando 24 UH en estudio simple y 57 UH en estudio contrastado, que discrepa en la cápsula renal con reforzamiento heterogéneo, exofítico (fig. 1). Por este motivo es sometida a nefrectomía parcial laparoscópica transperitoneal.
Se utilizó técnica transperitoneal, ya previamente descrita. Tiempo de isquemia caliente 22minutos, sangrado transoperatorio 150cc, tiempo quirúrgico 140minutos. Presentó creatinina sérica postoperatoria de 1.2mg/dL. Ningún incidente. Por parte del Servicio de Patología se realizó tinción de ácido peryódico de Schiff, demostrándose el hallazgo de cuerpos de Michaelis-Gutmann, llegándose al diagnóstico de malacoplaquia.
DiscusiónUna serie de entidades son capaces de imitar la neoplasia renal. Algunas, como los quistes renales y los abscesos pueden ser diagnosticados con gran certeza radiológica y sin métodos invasivos. Desafortunadamente, muchas lesiones renales son capaces de mimetizar radiológicamente a la neoplasia renal y por la misma incertidumbre muchas lesiones son resecadas atendiendo a nomogramas que predicen la probabilidad de malignidad1. Estas lesiones son conocidas como seudotumores renales, lesiones que “imitan” estrechamente la neoplasia renal. Los seudotumores renales pueden ser clasificados dependiendo del tejido que contengan, por ejemplo, tejido del desarrollo, enfermedad granulomatosa, enfermedades infecciosas, padecimientos vasculares o incluso fusión esplenorrenal1-5. Algunos seudotumores pueden remedar hematomas, angiomiolipomas y como ya se mencionó, al carcinoma de células renales.
Las infecciones agudas o crónicas que dan lugar a un absceso renal pueden plantear dificultades diagnósticas, simulando malignidad radiológicamente y durante la operación; ya que el proceso inflamatorio extenso puede invadir los tejidos blandos perirrenales6,7. Al examen patológico, las lesiones se caracterizan por la presencia de formación de abscesos con grados variables de entorno reactivo y cambios de reparación. Los microorganismos causales pueden ser bacilos Gram negativos o Gram positivos, incluyendo especies de Actinomyces. Los abscesos de actinomicetos contienen gránulos de azufre que puede facilitar el diagnóstico. La categoría de infecciones incluye: enfermedad granulomatosa, sarcoidosis, pielonefritis xantogranulomatosa, pielonefritis crónica focal y malacoplaquia.
Común en nuestro medio es la pielonefritis xantogranulomatosa; que es el resultado final de la uropatía obstructiva secundaria a litiasis renal. Típicamente, el riñón afectado aumenta de tamaño y se excluye funcionalmente.
Aunque los estudios de imagen proporcionan un diagnóstico preciso en hasta el 90 % de los casos, algunos seudotumores no se pueden distinguir de lesiones malignas, particularmente cuando el proceso es segmentario o focal en lugar de difuso. Los hallazgos radiológicos de la malacoplaquia suelen ser muy sugestivos de malignidad, la mayoría de la veces8,9.
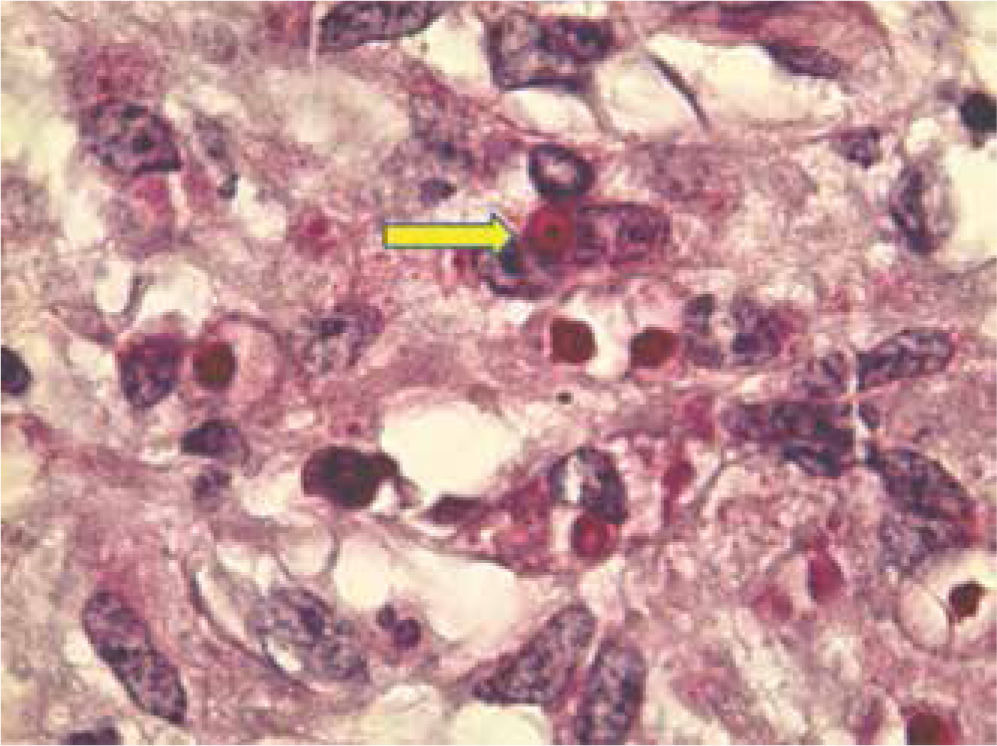
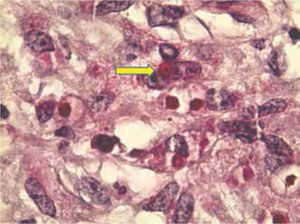
Microscópicamente, también es dificultoso su diagnóstico histopatológico (cabe mencionar que desde un punto de vista quirúrgico el proceso inflamatorio extensamente pueden invadir los tejidos blandos perirrenales y confundir al cirujano con un carcinoma invasor), porque estas lesiones se caracterizan por la presencia de formación de abscesos con grados variables de entorno reactivo y cambios de reparación. La malacoplaquia se compone de una gran cantidad de polimorfonucleares (inflamación aguda) y células que representan un proceso inflamatorio crónico, incluyendo abundantes macrófagos, espumosos, cargados de lípidos; una característica que imparte un color amarillo a la tumoración10 (fig. 2).
La malacoplaquia es una lesión inflamatoria crónica que puede producir destructivas masas nodulares, las cuales pueden confundirse con neoplasia como se ilustra en esta figura (flecha amarilla). El nódulo se compone de histiocitos con elementos inflamatorios mezclados. La respuesta inflamatoria, en particular, la infección por bacterias Gram negativas, más frecuentemente Escherichia coli, puede resultar en malacoplaquia. La sustitución del parénquima renal por el infiltrado inflamatorio nodular es evidente (ácido peryódico de Schiff, 100x, magnificación original).
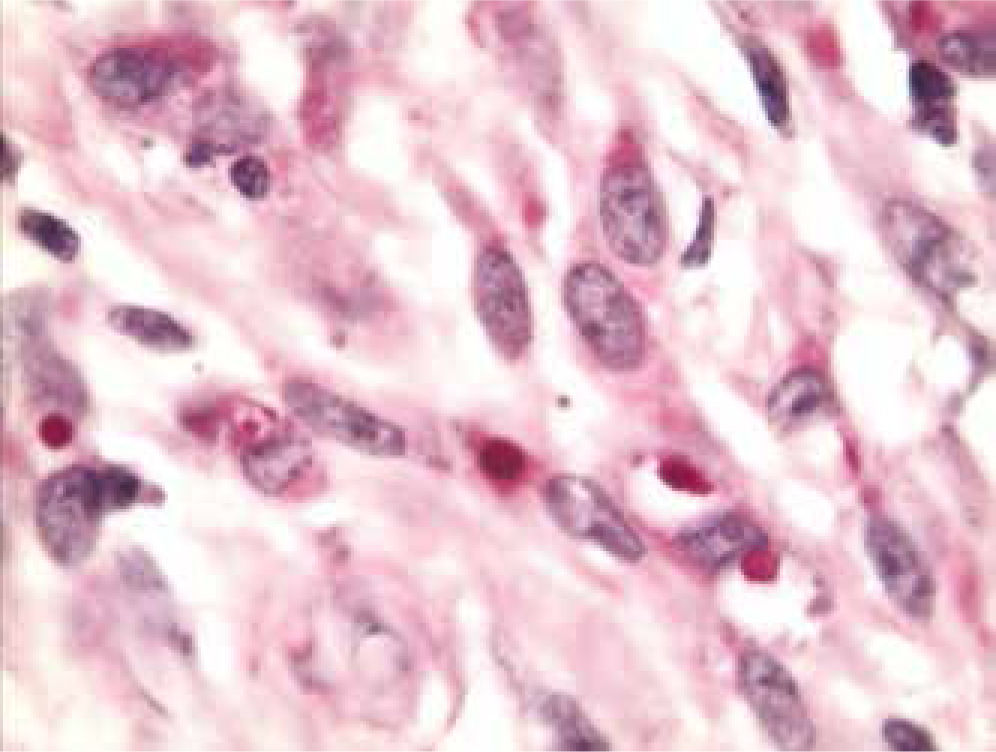
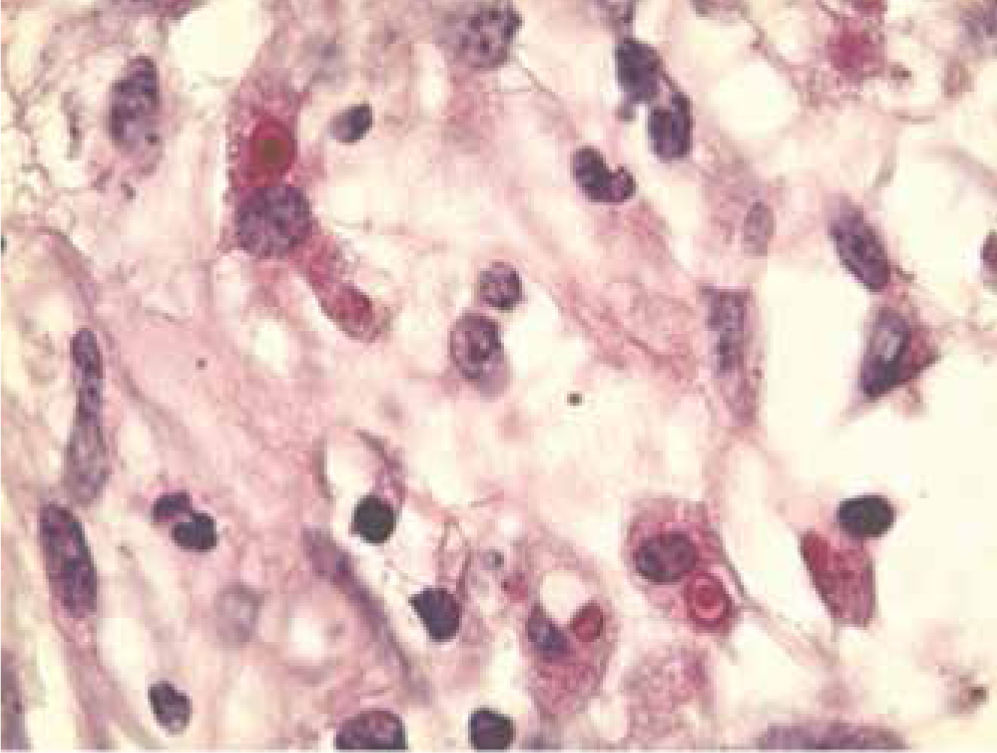
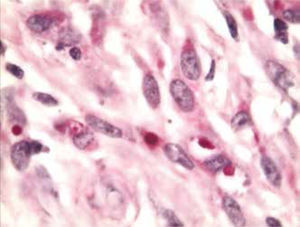
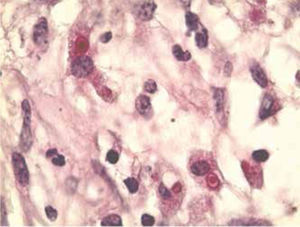
La malacoplaquia representa una forma poco frecuente de las enfermedades crónicas inflamatorias, con un distintivo histopatológico característico8-10. El diagnóstico sólo se puede determinar histológicamente. Las estructuras conocidas como cuerpos de Michaelis-Gutmann son el marcador de diagnóstico clave. Von Hansemann fue en realidad el primero en ver la enfermedad en 1901 en un caso humano de malacoplaquia (figs. 3 y 4), después de haber leído acerca de una patología similar en una revista veterinaria. Después se analizó el caso con su asistente Gutmann, quien luego colaboró en el estudio de la enfermedad con el bioquímico experto Michaelis. Von Hansemann publicó su estudio en 1903, un año después Gutmann y Michaelis. Ambas publicaciones fueron en alemán, las traducciones pobres probablemente expliquen la confusión en la documentación histórica. Hoy en día, las células de von Hansemann (histiocitos eosinófilos) y los cuerpos de Michaelis-Gutmann (inclusiones intracitoplasmáticas basófilas) se reconocen como el sine qua non de la enfermedad11,12.
Las características de los cuerpos de Michaelis-Gutmann sin una apariencia de diana laminosa y las células de von Hansemann se ilustran aquí. Los cuerpos de Michaelis-Gutmann en ocasiones pueden estar calcificados en casos avanzados y representar el resultado final de bacterias imperfectamente digeridas, previamente ingeridas por macrófagos que han degenerado (ácido peryódico de Schiff, 100x).
La patogenia exacta de malacoplaquia es aún desconocida. Una teoría muy común es la de los macrófago anormales; porque su respuesta tiene un defecto en la función lisosomal. Se ha sugerido que los macrófagos en la malacoplaquia son capaces de fagocitar pero incapaces de digerir las bacterias. Existe un acuerdo general de que un paciente con malacoplaquia tiene una enfermedad subyacente que implique un nivel anormal o una respuesta inmune alterada, y que los microorganismos también desempeñan un papel en la patogénesis, especialmente la E. coli que se encuentra en más de 80 % de casos. Antes de 1990, la malacoplaquia era una enfermedad grave con una alta tasa de mortalidad y una pobre recuperación de la función renal. En ese momento, la nefrectomía presentaba el tratamiento recomendado de elección. En los años 90´s, las quinolonas, antibióticos con penetración intracelular alta, fueron adoptados como el tratamiento de elección para esta enfermedad.
La malacoplaquia puede afectar muchos órganos y tejidos blandos pero es más frecuente en el tracto urinario inferior. Sin embargo, la afectación del parénquima renal es poco frecuente y representa el 15 % de los casos del tracto urinario. La malacoplaquia renal en pacientes con aloinjertos sólo rara vez afecta al aloinjerto renal en sí, y hasta la fecha son pocos los reportes que se tienen.
ConclusionesLa malacoplaquia en una enfermedad granulomatosa infrecuente, que puede producir seudotumores renales en pacientes inmunocomprometidos; debe ser un diagnóstico diferencial ante la presencia de una tumoración renal sólida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.