INTRODUCCIÓN
CARCINOMA SUPERFICIAL DE VEJIGA
El cáncer de vejiga es la segunda causa más común de cáncer del tracto urinario y ocupa una de las primeras 10 causas tumorales en el ser humano.1 Cerca de 70% de los carcinomas de vejiga se presenta sin evidencia histológica de invasión de las capas musculares de la pared vesical.2 La mayor parte de estos tumores corresponde a carcinomas de células transicionales con diferentes grados de diferenciación histológica (I a III). El carcinoma superficial de vejiga incluye el carcinoma in situ (Tis), el tumor confinado al epitelio (Ta) y los tumores que invaden la lámina propia (T1).3,4 Es una enfermedad heterogénea con una evolución natural variable. En un extremo se encuentra el carcinoma Ta de bajo grado, que presenta un bajo porcentaje de progresión; en el otro se halla el tumor T1 de alto grado, que muestra un alto potencial de malignidad y un significativo nivel de progresión y muerte por la enfermedad. Alrededor de 70% de los tumores superficiales vesicales se presenta en la forma de lesiones Ta, 20% como T1 y 10% como Tis.5 Se han estudiado diferentes características de estas malformaciones para tratar de predecir el comportamiento incierto que presentan; éstas incluyen características patológicas, análisis citológico y marcadores biológicos o moleculares.
TRATAMIENTO INICIAL
El paso crítico inicial consiste en efectuar la resección endoscópica completa de los tumores visibles. Es imperativo incluir en la pieza la base del tumor, así como parte de la capa muscular de la pared vesical para obtener información histológica adecuada del tumor. Una proporción de 60% a 70% de los tumores superficiales de vejiga recurre y 20% a 30% de estos defectos progresa a un estadio o grado mayor del inicial.2 El elevado porcentaje de recurrencia y lo impredecible del patrón de progresión han hecho necesaria la aplicación de terapia adyuvante al tratamiento quirúrgico inicial de estas tumoraciones.
TERAPIA INTRAVESICAL
Los objetivos de la aplicación de fármacos dentro de la cavidad vesical son:
1. Erradicar la enfermedad existente que no pudo controlarse por vía endoscópica, como el carcinoma in situ que es casi siempre un proceso difuso o los tumores papilares con base amplia que no pudieron resecarse en forma completa.
2. Prevenir las recurrencias en pacientes con riesgo. Algunos factores son predictivos de recurrencia, como el grado de profundidad del tumor, la multiplicidad, el tamaño de la masa, la presencia de Tis concomitante y el tiempo entre un tumor y su primera recurrencia.
3. Prevenir la progresión en pacientes con riesgo. Se define la progresión como el desarrollo de invasión a músculo o metástasis. Se presenta en 20% a 30% de los tumores superficiales de vejiga. Hay también factores predictivos de progresión, entre ellos el grado de la tumoración, la invasión a la lámina propia y la presencia de Tis.
A través del tiempo se han utilizado diferentes agentes citotóxicos intravesicales, como tiotepa, mitomicina C, doxorrubicina y epirrubicina. El papel de la quimioterapia intracavitaria para disminuir la recurrencia y la progresión está bien definido, aunque no existe un consenso acerca de cuáles son el mejor fármaco, el esquema de aplicación y la dosis suministrada.6
DESARROLLO DE BCG
La vacuna de BCG es un cultivo de bacterias vivas atenuadas del bacilo de la tuberculosis.7 En 1904, Nocard aisló el Mycobacterium bovis de una mastitis tuberculosa de vaca. En 1908, Albert Calmette y Camille Guérin lograron que los cultivos de esta bacteria perdieran de forma gradual su virulencia y después de 231 generaciones cultivadas en un periodo de 13 años, obtuvieron cepas totalmente avirulentas. A esta cepa especial de M. bovis se le denominó bacilo de Calmette-Guérin (BCG).8
Diferentes subcepas se han creado después de esta primera a partir de 1921 y se han distribuido por una gran cantidad de países; las cepas utilizadas de manera más amplia en la actualidad son la Connaught, Pasteur, Tice y Tokio.8-10
En 1929, Pearl fue el primero en sugerir el uso del BCG como una terapia para el cáncer al observar que los pacientes con tuberculosis tenían menor frecuencia de cáncer.11 Holmgren trató en 1935 a individuos con cáncer a base de tuberculina y BCG y reportó variaciones de la regresión tumoral.12 Infortunadamente, un año más tarde, debido a un error de laboratorio, se vacunaron a niños alemanes con una cepa virulenta del bacilo tuberculoso que ocasionó el llamado desastre de Lüebeck, en el que murieron más de 70 de ellos por la enfermedad. Tuvieron que pasar 30 años para volver a mostrar interés en la propiedad antineoplásica de la vacuna.
En 1966, Coe y Feldman demostraron que la vejiga era capaz de reaccionar al estímulo antigénico con una hipersensibilidad de tipo retardada y la consideraron el órgano ideal para instituir inmunoterapia local.13 Esto estableció las bases del razonamiento teórico de la inmunoterapia intravesical tópica.
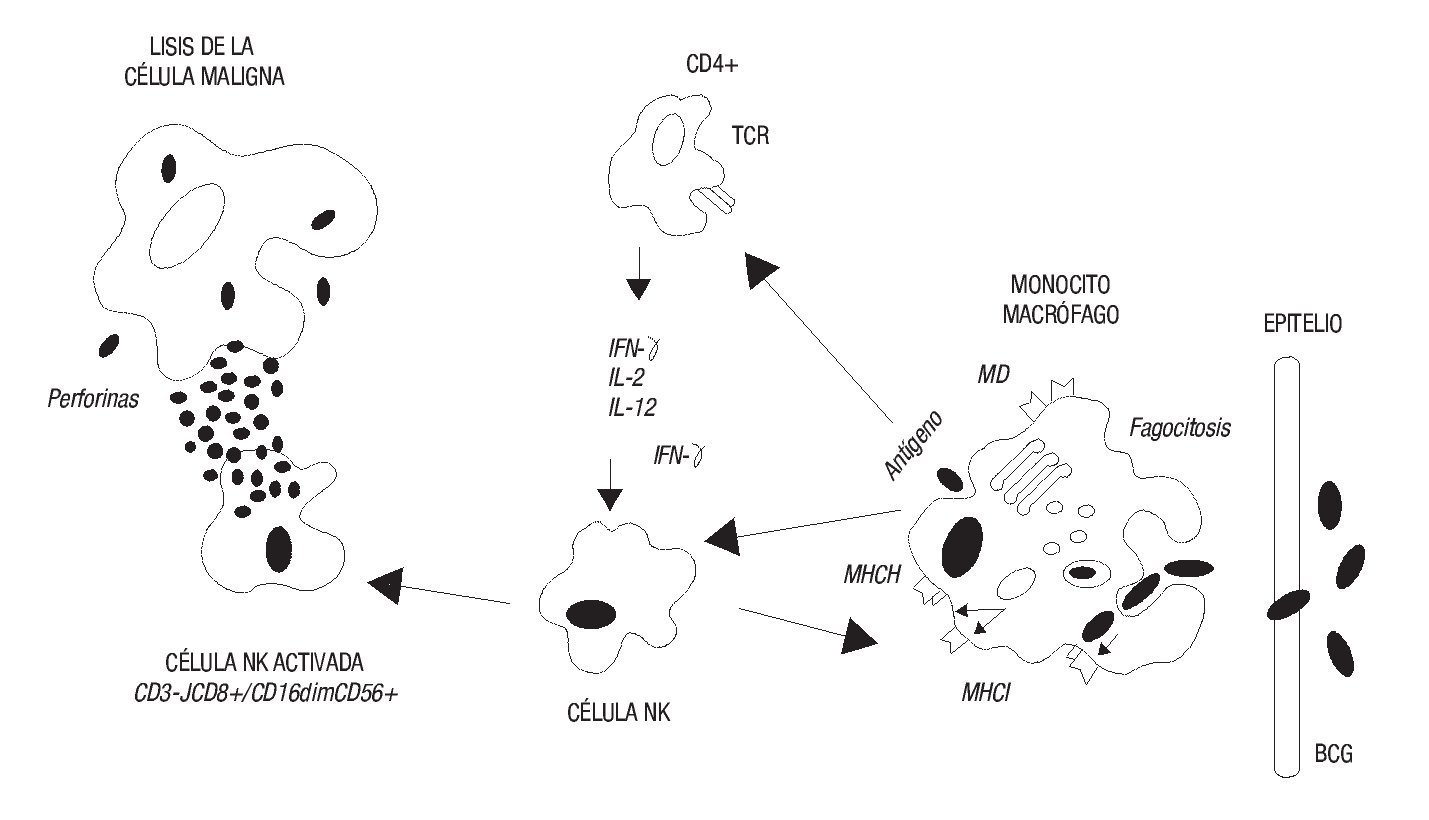
Morton describió en 1970 la regresión del melanoma maligno posterior a la inyección intralesional de BCG.14 En 1971, el trabajo sistemático de Zbar en el National Cancer Institute fue de vital importancia para las aplicaciones futuras del BCG en oncología; este investigador, con la utilización de un modelo animal de hepatocarcinoma, demostró que la administración de BCG en células tumorales inducía una inhibición significativa del crecimiento del tumor. Además, estableció las reglas básicas para la inmunoterapia óptima de los tumores con BCG: mejor respuesta de los tumores localizados respecto de los diseminados, masa tumoral lo más pequeña posible antes del comienzo de la inmunoterapia, y aseguramiento del contacto directo y el tiempo apropiado entre la célula tumoral y el BCG. También señaló que la dosis óptima efectiva de BCG para la aplicación local o intratumoral para conseguir respuesta antitumoral debía ser de 106 a 108 unidades formadoras de colonia (UFC) (Imagen 1).15,16
Imagen 1. Mecanismo de acción antitumoral del bacilo de Calmette-Guérin durante la fagocitosis por los macrófagos del huésped.
En 1976, Morales refirió que estas condiciones estaban presentes en su totalidad en el cáncer superficial de vejiga y demostró una disminución de la recurrencia en nueve pacientes tratados.17
En 1990, la Food and Drug Administration (FDA) aprobó el usó del BCG para el tratamiento del cáncer superficial de vejiga.18
MECANISMO DE ACCIÓN
La inmunoterapia con BCG provoca una reacción inmunitaria local masiva caracterizada por la expresión inducida de citocinas en la orina y tejido vesical y una migración de monocitos y granulocitos, así como células mononucleares a la pared vesical.19
Al momento de la instilación intravesical, el BCG se fija al urotelio a través de la fibronectina20 y al mantenerse en contacto por un tiempo apropiado con la pared vesical, en donde se encuentran presentes los monocitos y granulocitos, éstos fagocitan a los bacilos y activan en el interior de la célula la producción de una variedad considerable de citocinas, entre las que se encuentran el factor de necrosis tumoral alfa (FNT-a), factor estimulante de colonias de granulocitos, interferón gamma (IFN-g), interleucinas (IL)-1, IL-2, IL-5, IL-6, IL8, IL-10, IL-12 e IL18, así como el desarrollo de antígenos de membrana como el HLA-DR, CD25 y la molécula 1 de adhesión intracelular.9 La producción de antígenos de membrana dentro de los monocitos también se presenta en el urotelio y éste expresa el complejo principal de histocompatibilidad clase II (CMH-II). La presencia de los antígenos de membrana en los monocitos activa a las células colaboradoras CD4 y éstas producen IL-2 e IFN-g, los cuales activan a su vez a las células efectoras o asesinas naturales (NK). Una vez activadas estas células, las subpoblaciones celulares CD8+/CD16dim y la CD56+ lisan el tumor por medio de la producción de perforinas (Imagen 1).21
Es importante señalar que estos cambios en la vejiga de los pacientes pueden mantenerse por más de un año después del primer contacto con el bacilo, pero por lo regular disminuyen después de tres a seis meses, lo cual provee las bases racionales para la terapia de mantenimiento.22
UTILIDAD DEL BCG EN EL CÁNCER SUPERFICIAL DE VEJIGA
DOSIS
La dosis óptima de BCG no ha sido identificada; sin embargo, la dosis estándar se ha establecido en 120 mg por sesión de instilación con la que se logra obtener una cifra de 106 unidades formadoras de colonia reportada como la dosis mínima de efectividad terapéutica (23x Zbar 71, 24x Ratliff 86).
INSTILACIÓN
Para la reconstitución del BCG se mezcla una dosis de 120 mg en 50 mL de solución salina al 0.9% y se instila a través de un catéter uretral en la vejiga. Antes de la aplicación se debe descartar infección del tracto urinario e introducir el catéter en forma atraumática. Los pacientes deben retener el líquido en la vejiga durante una o dos horas con rotaciones cada 15 minutos en posiciones prona, supina y lateral con el objetivo de que la solución entre en contacto con toda la superficie de la mucosa vesical.8
ESQUEMAS TERAPÉUTICOS
La inmunoterapia intracavitaria con BCG consta de un esquema de inducción seguido de uno de mantenimiento. El esquema óptimo de administración del BCG aún no se ha definido.
Se necesita un esquema de inducción para el desarrollo de la reacción inmunológica en la vejiga. Éste se inicia de la segunda a la cuarta semanas tras la práctica de la RTUTV y puede aplicarse hasta la semana sexta en caso necesario.7 El esquema de aplicación semanal por seis semanas se tomó de una manera arbitraria. La mayoría de los pacientes desarrolla una respuesta inmunológica adecuada con seis aplicaciones. Algunos pueden requerir menos, pero otros necesitan también más aplicaciones. Se ha demostrado que un segundo ciclo de inducción durante otras seis semanas ayuda a aquellos pacientes que no responden al primer ciclo.24, 25
El esquema de mantenimiento también es motivo de controversia. Los estudios iniciales de resultados con este esquema aplicado en forma mensual o trimestral durante dos años, no mostraron un beneficio claro que justificara el incremento de los efectos adversos por la terapia misma.26 El esquema de mantenimiento más utilizado es el que propusieron Lamm y el Southwest Oncology Group (SWOG): una instilación semanal de inducción por seis semanas seguidas por un curso de una instilación semanal por tres semanas a los tres y seis meses, con posterior instilación semanal por tres semanas cada seis meses hasta los tres años.21 Otros esquemas incluyen la administración intravesical semanal por tres semanas a los tres, seis, 12, 18, 24, 30 y 36 meses.27 Sin embargo, el tiempo óptimo de estas dosis de mantenimiento, sean mensuales, trimestrales o aun anuales, todavía no se homogeniza.
REDUCCIÓN DE LA DOSIS
Los esfuerzos por disminuir la toxicidad de la vacuna BCG mientras se mantiene una alta eficacia, se encuentran actualmente en estudio en todas las poblaciones de pacientes tratados con ella. Algunos estudios sugieren que dosis bajas del BCG pueden ser tan efectivas como la dosis habitual, dado que desciende de manera considerable la toxicidad de la vacuna.
Un estudio prospectivo aleatorizado del grupo oncológico español reveló una disminución notoria de la toxicidad con bajas dosis de BCG sin alterar la eficacia. Un total de 500 pacientes con TaG2-3, T1G1-3 y Tis se aleatorizó para recibir 81 mg (Connaught) y 27 mg. La toxicidad presentada en el grupo de alta dosis fue mucho mayor. No hubo diferencia estadística en la recurrencia (18% y 19%) o progresión (2.4% y 4.8%) después de un seguimiento medio de 18.6 meses; sin embargo, el grupo de dosis baja presentó peores recurrencias en pacientes con Tis (31% vs 12%). Esto objeta la verdadera eficacia de la dosis baja en este tipo de pacientes. El estudio de Morales, que compara la dosis de instilación de BCG (120 mg vs 60 mg), sugiere que es necesaria la dosis alta y por lo tanto más tóxica para erradicar el Tis, mientras que la dosis baja puede ser adecuada para prevenir las recurrencias.8 Mugiya y colaboradores suministraron una dosis de 40 mg de BCG intravesical en 43 pacientes con Tis y concluyeron que la respuesta completa se observó en el 84% de los pacientes en quienes el porcentaje libre de recurrencia fue de 72.4% después de tres años y 61.9% después de cinco años; la media de respuesta completa fue de 37.5 meses; en consecuencia, estos especialistas señalaron que esta dosis para Tis es efectiva y segura.28
La mayoría de los estudios sugiere que puede ser benéfico disminuir la dosis de BCG en los pacientes con tumores de riesgo bajo o intermedio, pero no en los sujetos con tumores de alto riesgo o Tis.
BCG PARA ENFERMEDAD RESIDUAL
Una de las mejores demostraciones de la capacidad antitumoral de la vacuna BCG se observa cuando se aplica a pacientes con tumor residual por un tratamiento endoscópico incompleto o cuando se instituye en forma de tratamiento primario en lugar de la resección endoscópica (inmunorresección).29 Mientras que el efecto ablativo de un curso inicial de BCG en tumores papilares residuales varía de 15% a 70%, la respuesta total es consistente y aproximada al 60% si se utiliza por lo menos un curso adicional de ésta. Estos estudios han demostrado sólo una caída marginal de la respuesta con el tiempo, pero es difícil de valorar debido al uso de distintos esquemas de mantenimiento. En 2007 Hall encontró que los niveles de recurrencia en todos los grupos de riesgo de cáncer superficial de vejiga con RTUTV sola fue de 55%, mientras que al añadir BCG con esquema de inducción único se observó una recurrencia de 36% y con terapia de mantenimiento de 29%.30,31
* RECURRENCIA
La recurrencia del tumor se define como el desarrollo de algunos focos de tumor superficial (Ta, T1, Tis) en cualquier sitio de la vejiga durante el seguimiento. La progresión de tumor se define como el desarrollo de un tumor musculoinvasivo (T2 o mayor) en cualquier sitio de la vejiga durante el seguimiento.27
El BCG reduce el riesgo de falla del tratamiento a corto y largo plazos en comparación con la quimioterapia intravesical, como lo señaló Bohle en 2003 en un estudio comparativo entre BCG y mitomicina C que incluyó a 1 421 pacientes tratados con BCG y 1 328 tratados con mitomicina C, con un seguimiento promedio de 26 meses; el BCG demostró que sólo 29% de los pacientes tratados con la vacuna presentaron recurrencia contra 46% de los tratados con mitomicina C.32 En 2005 Sylvester, después de analizar siete estudios aleatorizados que incluyeron a 203 pacientes con respuesta completa, mostró que 34% de ellos tratados con BCG presentó recurrencia, contra 50% de aquéllos tratados con quimioterapia (OR, 0.47, p = 0.0008).33
En el estudio de Shahin y colaboradores, un análisis retrospectivo de 153 pacientes tratados con BCG intravesical con estadio T1 grado 3 de cáncer de vejiga, se analizaron la recurrencia, progresión y sobrevida de estos casos. El total de pacientes se dividió en dos grupos, 92 tratados con RTUTV más BCG y 61 tratados con RTUTV sola. Se infundió una dosis de 120 mg de BCG con dos horas de estancia en la vejiga. El seguimiento medio fue de cinco años y se reconoció una recurrencia de la enfermedad en 70% de los pacientes tratados con BCG y 75% de los individuos sometidos a RTUTV sola. La media de tiempo de recurrencia fue de 38 meses para los tratados con BCG y 22 meses en los sujetos tratados con RTUTV sola (p = 0.19). El tumor progresó en 33% de los pacientes con BCG y en 36% con RTUTV sola. Los autores concluyeron que la terapia intravesical con BCG después de la RTUTV para estadio T1 grado 3 retrasa la recurrencia y la cistectomía, pero no altera el resultado final de la evolución natural de la enfermedad.34
PROGRESIÓN
La verdadera reducción de la progresión de la enfermedad es difícil de demostrar en pruebas clínicas individuales con BCG, en particular debido a los porcentajes de episodios bajos y los tiempos prolongados de seguimiento. Un protocolo español no aleatorizado mostró una reducción del riesgo relativo de progresión de 0.3 con la terapia de BCG. Asimismo, Solsona reportó un porcentaje de progresión del 12% para BCG contra 29% para la quimioterapia, con diferencia estadísticamente significativa; el análisis completo de las dos pruebas aleatorizadas muestra riesgo elevado para la terapia intravesical.35
En el meta-análisis de Sylvester que incluyó 24 estudios con información de la progresión de 4 863 pacientes con una media de seguimiento de 2.5 años se observó una progresión en 260 pacientes (9.8%) de un total de 2 658 enfermos tratados con BCG, mientras que ésta se presentó en 304 pacientes (13.8%) de 2 205 que no recibieron BCG (p = 0.001), con un rango de reducción de la progresión en el grupo de BCG de 27%.36
Peyromaure analizó en 2003 la recurrencia, progresión y sobrevida en 57 pacientes con estadio T1 grado 3 de cáncer de vejiga, con seguimiento de 53 y un esquema de BCG de seis semanas de inducción y tres semanas a los tres, seis, 12, 18, 24, 30 y 36 meses, posterior a la RTUTV, y llegó a la conclusión de que la terapia de BCG es efectiva como tratamiento conservador para los individuos con estadio T1 grado 3 de vejiga, con unos porcentajes de recurrencia y progresión de 42.1 y 22.8, respectivamente.37
SOBREVIDA LIBRE DE ENFERMEDAD
En 2005 Sylvester analizó nueve estudios aleatorizados de BCG en comparación con mitomicina C, epirrubicina y adriamicina, y mitomicina con adriamicina, y encontró que de 298 pacientes tratados con BCG 203 (61.8%) tuvieron una respuesta completa inicial tres meses después de la terapia respecto de 158 (51.5%) tratados con algún otro agente quimioterapéutico.38
Griffiths y colaboradores, analizaron el tratamiento en el Tis de vejiga de 1987 a 1997 en 135 pacientes con biopsia confirmatoria; este grupo suministró un esquema de seis semanas de inducción de BCG: 23 pacientes con Tis, 37 con Tis relacionado con Ta y 75 pacientes con Tis vinculado con T1. La media de seguimiento fue de 41 meses. En estos grupos, los porcentajes de respuesta completa a tres meses fueron de 74%, 70% y 75%, respectivamente. Los porcentajes promedio de progresión a cinco años fueron de 20%, 18% y 49%, de manera respectiva. El porcentaje de sobrevida específico del cáncer fue de 83%, 86% y 59%, respectivamente. Se llegó a la conclusión de que un curso de BCG es efectivo para el Tis primario y el Tis relacionado con Ta, pero es subóptimo en pacientes con Tis vinculado con T1.39
CONTRAINDICACIONES PARA LA TERAPIA CON BCG
Pueden clasificarse en absolutas y relativas. El primer grupo incluye a pacientes inmunocomprometidos o inmunosuprimidos; administración de la vacuna inmediatamente después de la resección transuretral, con base en el riesgo de intravasación y muerte séptica; antecedentes personales de sepsis por BCG; hematuria macroscópica; cateterización traumática e incontinencia total. El segundo grupo incluye infección del tracto urinario; enfermedad hepática; antecedentes personales de tuberculosis y edad avanzada.40
COMPLICACIONES
El tratamiento con BCG es bien tolerado por los pacientes y se ha registrado una incidencia de complicaciones menores, por debajo de 5%.41 La BCG no puede instilarse inmediatamente después de la RTUTV por su elevado porcentaje de complicaciones sistémicas. Las complicaciones locales consisten de forma primaria en síntomas de vaciamiento y síntomas irritativos locales. Las complicaciones sistémicas de la inmunoterapia por BCG son menos comunes y por lo general, ocurren después de la cateterización traumática y durante la cistitis recurrente. La fiebre se reporta en 2.9% de los pacientes, artralgias en 0.5% y la sepsis en 0.4%.42,43
Se han informado las siguientes complicaciones infrecuentes en órganos a distancia: la hepatitis relacionada con BCG es una complicación rara después de su instilación intravesical y sólo se han reportado cinco casos de hepatitis por BCG; se desconoce su causa aunque tiende a considerarse una reacción de hipersensibilidad.44 El desarrollo de una masa renal granulomatosa después de la instilación intravesical de BCG es otro efecto potencialmente serio que ocurre en el 0.1% de los pacientes y los mecanismos de acción son sobre todo el reflujo vesicoureteral o los implantes sistémicos.45 La infección del aneurisma aórtico secundario a la administración de BCG intravesical es en extremo rara y una complicación potencialmente letal de esta inmunoterapia en pacientes con cáncer de vejiga.41 La neumonitis intersticial es una complicación secundaria a la terapia intravesical con BCG y se observa en 0.7% de los pacientes sometidos a este tratamiento.46 Se han publicado siete casos en la bibliografía de la lengua anglosajona de osteomielitis por BCG seguida de aplicación intravesical.47
En presencia de síntomas alarmantes (fiebre elevada con escalofrío y malestar general), es recomendable reducir la dosis de BCG a la mitad y administrar 300 mg de isoniazida diarios, con inicio el día anterior y durante tres días en cada instilación. Los antiinflamatorios no esteroideos y los anticolinérgicos suelen ser útiles en el tratamiento de estos sujetos. Hay que destacar que el tratamiento antifímico parece no interferir con el efecto antitumoral de la BCG. Cuando los efectos secundarios son graves es conveniente suspender el tratamiento con BCG y establecer una triple terapia antifímica durante un periodo de tres a seis meses (isoniazida, 300 mg diarios; rifampicina, 600 mg diarios; etambutol, 1 200 mg diarios). Si se diagnostica sepsis, es preferible utilizar como tratamiento de choque la cicloserina (250 a 500 mg dos veces por día) hasta que el paciente se estabilice entre tres y siete días, ya que este fármaco puede inhibir el crecimiento de los bacilos en 24 horas.48,49
CONCLUSIONES
El carcinoma superficial de vejiga es un padecimiento frecuente con un comportamiento biológico incierto. El tratamiento inicial de este tipo de tumores es la resección transuretral de los tumores visibles. La aplicación de la vacuna de BCG ha demostrado ser un tratamiento adyuvante eficaz en el control de los tumores de vejiga en esta etapa clínica. Con ella se han alcanzado niveles de respuesta completa comparables en algunos casos a los de la quimioterapia intracavitaria en algunas series y mejores en otras. El tiempo de recurrencia y la progresión de los tumores en esta etapa clínica son mejores respecto de la RTU sola o en comparación con otros quimioterapéuticos. La dosis de 120 mg ha demostrado ser la más efectiva en el tratamiento de los tumores de comportamiento agresivo, incluido el Tis. Un régimen de inducción semanal por seis semanas, seguido por otro esquema de mantenimiento trisemanal por tres meses y luego cada seis meses por tres años, mantiene una respuesta inmunitaria antitumoral adecuada en el paciente que recibe la instilación de la vacuna. La toxicidad alcanzada con los esquemas repetidos de BCG ha propiciado la búsqueda de menores dosis con la misma efectividad.
Correspondencia: Dr. Hugo Arturo Manzanilla García.
Querétaro 147-401, Col. Roma C.P. 06700, México, D.F.
Correo electrónico:hamanzanilla@gmail.com