¿ INTRODUCCIÓN
La prostatectomía radical (PR) ha demostrado un excelente control del cáncer en la mayoría de los hombres con la enfermedad clínicamente localizada.
Cada año, en los EEUU, aproximadamente 30 000 hombres pueden tener recurrencia del cáncer de la próstata después de la prostatectomía radical.1
El análisis de numerosas series de pacientes sometidos a prostatectomía radical ha mostrado que en más de 30% de los pacientes, se puede presentar falla bioquímica, representada únicamente por elevación del antígeno prostático específico (APE). La mayoría de las recaídas ocurre en los primeros cinco años prácticamente en 95% de los casos.2 Estas recaídas pueden ser explicadas por el hecho de que a pesar de que ha habido un cambio del cáncer a etapas tempranas y tumores de volúmenes menores, de 38% a 52% de los pacientes sometidos a prostatectomía radical tienen enfermedad extra-prostática en el examen histológico de la pieza quirúrgica.3,4
La disponibilidad del APE como un marcador para el tratamiento de esta falla ha permitido observar el tiempo de progresión; sin embargo, son necesarios de 10 a 15 años para averiguar la verdadera tasa de progresión clínica del cáncer después de la PR. El doctor Pound, trata de mostrar la historia natural de la progresión de la enfermedad en el tiempo en que se inicia la elevación del APE posterior a la prostatectomía radical. En 1999 este autor realizó un estudio retrospectivo del seguimiento clínico a un grupo de 1997 hombres sometidos a prostatectomía radical por el mismo cirujano, sin ningún tratamiento adyuvante, hasta tener metástasis documentadas clínicamente.5
Posteriormente, en el año 2003, se actualizaron los resultados de este mismo estudio, pero se documentaron 3262 pacientes de entre 1982 a 2003, con un seguimiento medio de 10 años (dos meses a 21 años). De estos 3263 pacientes, 329 tuvieron falla bioquímica en el curso de los primeros cinco años (> 0.2 ng/mL del APE). De estos 329, 144 pacientes (44%) desarrollaron metástasis a distancia en un intervalo medio de siete años.6
Dentro de las variables relacionadas con la progresión de la enfermedad se encontró que el tiempo de la elevación del APE, el valor de la suma de Gleason y el tiempo de duplicación del APE fueron factores predictivos de probabilidad y tiempo del desarrollo de las metástasis.
El tiempo medio de muerte causa específica por cáncer de próstata, fue de cinco años después de haberse desarrollado las metástasis.
Factores predictivos del fracaso posterior a la prostatectomía radical:
a) APE pre-operatorio.
b) Duplicación del APE pre-operatorio.
c) Etapa clínica.
d) Número de biopsias positivas.
e) Etapa patológica (pieza quirúrgica)
- Márgenes positivos.
- Extensión prostática establecida.
- Invasión a vesículas seminales.
- Suma de Gleason.
De todos estos factores pronósticos, únicamente el estado de los márgenes quirúrgicos puede ser influenciado por la técnica quirúrgica.
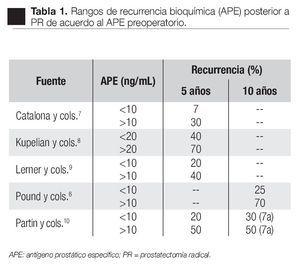
APE preoperatorio: De acuerdo con algunos autores6,7-10 el nivel preoperatorio es uno de los factores pronósticos más importantes respecto a la recurrencia o falla bioquímica (Tabla 1).
Duplicación del APE preoperatorio: La velocidad del APE por año antes del diagnóstico (3 2 ng/mL) ha identificado pacientes de alto riesgo de recurrencia y progresión de la enfermedad.11
Etapa clínica: La determinación de la etapa clínica en el EDR junto con otros factores pronósticos es incluida actualmente en los nomogramas que permiten predecir la etapa patológica y la recurrencia bioquímica.9,12,13
Etapa patológica: Una vez obtenida la pieza quirúrgica hay una relación inversa entre la etapa patológica y la tasa de recurrencia libre de falla bioquímica.5,79,10,14
El análisis de la pieza quirúrgica, márgenes quirúrgicos positivos (MQS+), extensión extra-prostática establecida, invasión a vesículas seminales, suma de Gleason, son los factores pronósticos independientes más importantes.
Estado de los márgenes: La presencia de células tumorales en el margen entintado de la pieza quirúrgica de prostatectomía radical se considera como márgenes positivos. Se han informado MQS+ en 24% a 39% de las piezas quirúrgicas de la prostatectomía radical en pacientes con cáncer clínicamente localizado.15-19 Un MQS+ se ha reconocido como un signo pronóstico adverso. Entre 30% y 40% de pacientes con MQS+ presentan recurrencia posterior a la prostatectomía radical. Weeder y Soloway20 en una revisión de varias series importantes, evidenciaron que 28% de los pacientes después de PR, presentaban MQS+, y que el estado de los mismos representó un factor pronóstico independiente para la recurrencia bioquímica. Paulson y colaboradores informaron que en los pacientes con márgenes positivos, 40% de ellos murieron de cáncer de próstata a 13.5 años comparado con 10% si los márgenes fueron negativos.21 Kupelian y colaboradores, analizaron retrospectivamente 423 pacientes en etapas clínicas T1-T2, sometidos a prostatectomía radical; observaron que 78% de los pacientes estaban libres de falla bioquímica con márgenes negativos, en contraste de 37% si tenían márgenes positivos; asimismo, informaron sobrevida libre de falla local a cinco años en 96% del grupo de márgenes negativos contra 87% si MQS+.22
El sitio y número de MQS+ también es importante. Se ha demostrado que el impacto de éstos sobre la sobrevida libre de recurrencia, es específico al sitio del margen.
Los márgenes en la base de la vejiga o en los bordes postero-laterales de la próstata o múltiples positivos se asocian con tiempo más corto de recurrencia.20,23
Los apicales son los más frecuentes, ya que el cáncer tiende a extenderse hacia el ápex, además de que en la parte posterior del mismo está ausente la cápsula.
En tumores en etapa pT2, un margen apical positivo, es de mejor pronóstico que un margen positivo de la base o postero-lateral de la próstata; uno apical positivo, puede no progresar.24
Stamey16 describió dos tipos de MQS+:
Asociados a la extensión extra-capsular del cáncer.
Aquellos creados por la escisión quirúrgica inadvertida del cirujano a través de la cápsula de un cáncer confinado a la glándula.
En algunas series, la incisión dentro del cáncer es común; en promedio de 61% a 73% de los sitios de MQS+.15-17
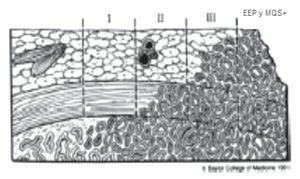
En la mayoría de las series, los MQS+ son informados únicamente en los sitios de extensión extra-prostática establecida (Imágenes 1 y 2).15
Imagen 1. I. Cáncer confinado, II. Penetración en la cápsula (confinado), III. Extensión extra-capsular (perforación capsular) equivalente a extensión del tumor en el tejido peri-prostático que generalmente es asociado a márgenes quirúrgicos positivos.
Imagen 2. A. Cáncer confinado, B. Penetración en la cápsula (confinado), C. Extensión extra-capsular (perforación capsular) equivalente a extensión del tumor en el tejido peri-prostático que generalmente es asociado a márgenes quirúrgicos positivos.
En uno de los informes del Departamento de Patología del Hospital Metodista y la Escuela de Baylor de Medicina,25 señalan que la incisión capsular fue responsable en 29% de los pacientes con MQS+.
Como ya se mencionó, el ápex es un sitio común para asentamiento del tumor y de márgenes positivos por la ausencia de cápsula, sobre todo en la parte posterior, lo cual favorece la incisión dentro del tumor.
En la serie de informes del Departamento de Patología del Hospital Metodista, 37% de los sitios de MQ+ sin extensión extra-prostática, fueron de la parte media de la próstata, en forma tal que el ápex no es el único sitio potencial de escisión capsular dentro del tumor.25
La amplia variación en la frecuencia de MQS+ sin extensión extra-prostática se ha explicado por la diferencias en las técnicas de patología para procesar las piezas quirúrgicas de la prostatectomía radical,15 o diferencias en la técnica quirúrgica de la disección del ápex.26
El Dr. Epstein procesa sus piezas quirúrgicas con cortes cada dos a tres milímetros, a diferencia de otros patólogos que lo hacen cada cinco milímetros, lo que permite identificar más márgenes positivos. Como los MQS+ ocurren más frecuentemente en el ápex y en los bordes postero-laterales (sitio de los paquetes neuro-vasculares), algunos autores han modificado sus técnicas, logrando resecar parte o todo el paquete neuro-vascular cuando existe indicación efectuando una disección amplia alrededor del ápex especialmente en su parte posterior, donde no hay cápsula. Con esto el Dr. Scardino ha disminuído la incidencia de sus márgenes positivos de 24% a 8% en sus recientes series quirúrgicas.25
Se ha estudiado el significado de los MQS+ en presencia o ausencia de extensión extra-capsular, así como su relación a otras alteraciones patológicas como el grado de Gleason, volumen tumoral invasión o no a vesículas seminales.17,27
Pacientes con MQS+ sin extensión extra-capsular, mostraron un excelente pronóstico, similar a aquellos con cáncer confinado a la glándula prostática; éstos pacientes pueden ser vigilados y no necesitar tratamiento adyuvante.
En un estudio del Hospital Metodista de Houston, se trató a 23 pacientes con MQS+ sin extensión extra-capsular; fueron seguidos por un tiempo medio de cinco años y ninguno de ellos mostró evidencia de recurrencia en ese tiempo, comparado a 41% ± 24% de aquellos con márgenes positivos y extensión extra-capsular.25
En la Clínica Mayo,28 evidenciaron una correlación significativa entre los márgenes quirúrgicos y la extensión extra-prostática establecida. La sobrevida libre de progresión a cinco años en un grupo de 355 pacientes sometidos a prostatectomía radical y linfadenectomía pélvica bilateral entre 1986 y 1993 fue de 78% para aquellos pacientes con sólo márgenes positivos, y para aquellos con márgenes positivos y extensión extra-prostática fue de 55%.
Pacientes con márgenes quirúrgicos positivos tienen poco impacto en el pronóstico de los pacientes si otros signos pronósticos adversos están presentes tales como Gleason alto o invasión a vesículas seminales.
Epstein y colaboradores,15 analizaron el pronóstico de los pacientes con MQS+ con extensión extra-capsular y el grado de Gleason en piezas quirúrgicas de pros-tatectomía mostrando que el grado de Gleason y los márgenes quirúrgicos afectaron el pronóstico.
Varios estudios, han investigado la relación de la extensión del margen positivo y el pronóstico de los hombres sometidos a PR. Epstein y colaboradores señalan cuatro tipos de márgenes: 1) negativo, 2) equívoco (cuando la superficie tiene un aparente daño y el tumor ha alcanzado los bordes entintados), 3) focalmente positivos (cuando el sitio involucrado se encuentra limitado y presente en una o dos áreas); y 4) extensos cuando existen múltiples márgenes positivos presentes en diferentes sitios.29 Existe una proporción progresiva de recurrencia o falla desde la categoría negativa a la categoría extensiva.
En un estudio retrospectivo (1991 a 1999), con 117 pacientes del MD Anderson Cancer Center en Texas,30 se revisaron las piezas patológicas de prostatectomía radical con MQS+. Se revisó la extensión de los mismos mediante la suma del total de las longitudes de las áreas con MQS+. Se realizó un seguimiento posterior a PR promedio de 43 meses sin tratamiento adyuvante. El porcentaje de sobrevida global libre de progresión bioquímica fue de 74.6%; sin embargo, cuando se evaluó la sobrevida libre de progresión con base en la longitud del margen positivo, se encontró que en los hombres con margen mayores de tres milímetros, tienen una sobrevida libre de progresión significativamente más baja (52.4%), vs. aquellos con márgenes de un milímetro (80.2%) o de uno a tres milímetros (87.2%). Los autores de este estudio concluyeron que la longitud agregada del margen positivo, fue significativamente asociada con la progresión bioquímica de la enfermedad.
La invasión a vesículas seminales por adenocarcinoma de próstata está asociada con un pronóstico pobre de la enfermedad. Generalmente, el tumor que invade la vesícula seminal (IVS) es voluminoso, con alta incidencia de extensión extra-capsular y con cierta frecuencia metástasis a ganglios linfáticos regionales.
El Dr. Makoto Ohori del Hospital Metodista de Houston, Texas, presentó los resultados detallados del mecanismo y pronóstico de la invasión a VS por el CaP. Describe tres patrones patológicos de IVS; en el tipo I, la invasión ocurrió a lo largo de los conductos eyaculadores a las vesículas seminales. El tipo II hay invasión directa a través del plano tisular entre la base de la próstata y las vesículas seminales; en el tipo IIb, la extensión es a través de la cápsula con extensión extra-prostática establecida, hay invasión al tejido adiposo areolar peri-seminal y posteriormente a las vesículas seminales, el tipo III se caracterizó por el hallazgo de un foco tumoral aislado en la pared de la vesícula seminal sin evidencia de invasión al conducto eyaculador o presencia de extensión extra-capsular adyacente. De acuerdo con estos patrones, el pronóstico fue diferente encontrando que en su estudio el mecanismo de invasión en el tipo III tiene una sobrevida libre de progresión similar a los pacientes con extensión extra-capsular sin invasión a las VS.31
Localización de la enfermedad persistente o recurrente: Importante es diferenciar una recurrencia local de una progresión distante si se contempla un tratamiento adicional. Lo difícil en ocasiones es distinguir a los pacientes con una recurrencia local aislada de aquellos con metástasis distantes ocultas que desafortunadamente no se beneficiarían de la terapia de salvamento.
Examen digital rectal (EDR): No es confiable para detectar o reconocer persistencia del cáncer de próstata; en la mayoría de las series de prostatectomía radical de seguimientos largos con recurrencia clínica local el EDR fue diagnóstico en menos de 5%.32-35
Es difícil obtener una verdadera incidencia de la recurrencia local, por las limitaciones de los métodos habituales de diagnóstico, cuando el APE es elevado y el EDR es normal.
Biopsia de la anastomosis uretro-vesical: La posibilidad de obtener una biopsia positiva sobre la base de un APE detectable en el postoperatorio con o sin tacto rectal anormal es de 30% a 50%.36,37 Si se realizan múltiples biopsias, habrá más posibilidad de obtener una biopsia positiva.38 Los parámetros clínicos que pueden predecir un biopsia positiva es un APE postoperatorio mayor de 1 ng/mL y una etapa pT3 (márgenes quirúrgicos positivos, extensión extra-prostática establecida). Una biopsia negativa no excluye recurrencia local y una biopsia positiva no excluye enfermedad sistémica.
Estudios de imagen: Las diferentes modalidades de imagen con la que contamos en la actualidad carecen de sensibilidad y especificidad para identificar enfermedad loco regional, especialmente en etapas tempranas de la recurrencia, cuando el cáncer es de baja carga y más susceptible a tratamiento.
La TC y la RMN tienen un valor muy limitado, a menos que los niveles del APE sean muy altos.39
La gammagrafía ósea igualmente es negativa, a menos que se alcancen niveles de APE de 30 ng/mL o más.36
Cinética del APE y suma de Gleason en la pieza quirúrgica: La velocidad del incremento del APE ha sido utilizada para predecir el sitio de las recurrencias.40-41
Si el APE no alcanza niveles indetectables después de la PR o llega a tener valores elevados antes del primer año de la PR, la recurrencia de la enfermedad probablemente es sistémica. Asimismo, si después de la cirugía la velocidad es mayor de 0.75 ng/mL por año y el APE se dobla en un tiempo antes de los seis a diez meses se puede pensar en falla sistémica. Lo contrario si la velocidad es de menos de 0.75 ng/mL por año y el APE empieza a ser detectable uno o dos años después de la cirugía, la recurrencia clínica probablemente sea local. El Dr. Partin y colaboradores,40 con el análisis de los datos de pacientes después de prostatectomía radical, reporta que la velocidad del APE de ± 0.75 ng/ mL por año fue visto en 94% de los pacientes con recurrencia local, mientras que una velocidad mayor a 0.75 ng/mL por año estuvo presente en 46% de los pacientes con enfermedad metastásica.
La suma de Gleason se ha relacionado con el sitio de la recurrencia. Pounds y colaboradores5 mencionan que pacientes con suma de Gleason de menos de siete, cuando recurren, ésta es local; cuando la suma de Gleason es de siete o más la recurrencia es por enfermedad sistémica.
Este mismo autor en una reciente comunicación,6 señaló que los pacientes con suma de Gleason de siete o menos, que tenían recaída después de los dos años y el PSA se dobló en un tiempo mayor de 10 meses, tenían probabilidades de tener sobrevida libre de metástasis a tres años 95%, a cinco años en 92% y a siete años en 87%, en contraste en los pacientes que tuvieron recaída antes de los dos años con suma de Gleason mayor de siete y un APE con duplicación (TD APE) antes de los dos años, la sobrevida libre de metástasis fue a tres años de 54%, a cinco años 30% y 21% a siete años.
Prostascint (RIS) radio-inmuno-centellografía con anticuerpos monoclonales marcados con indio 111: Estos anticuerpos monoclonales reconocen una glucoproteína de membrana específica de la próstata que únicamente se expresa en el epitelio de las células prostáticas.
Al tiempo de su aprobación por la FDA (Administración de Drogas y Alimentos de los EEUU), para la evaluación de los pacientes con falla bioquímica post PR la sensibilidad fue de 72%, especificidad de 72% y certeza global de 68%.42
Murphy y colaboradores,43 en un estudio de 100 pacientes consecutivos después de falla a PR o radioterapia encontraron captación del radioactivo en: 43% en el lecho prostático, 20% ganglios regionales, 32% ganglios linfáticos distantes. La sensibilidad para la detección del cáncer fue buena, pero el promedio del APE en estos pacientes fue de 40.5 ng/mL.
Kahan y colaboradores44 en un estudio de 32 pacientes sometidos a prostatectomía radical y que presentaron elevación del APE, 23 de ellos tuvieron un escaneo positivo fuera de la fosa prostática; de estos, 30% tuvieron respuesta a la radioterapia de salvamento, en contraste con una respuesta de 70% si el escaneo fue negativo en sitios fuera del lecho prostático.
Aunque las imágenes con el Prostascint pueden ser de valor la sensibilidad y especificidad están lejos de ser lo ideal, ya que la mayoría de los informes señalan sensibilidad y especificidad del rango de 50% a 70%, para ambos parámetros.
PET (Tomografía por Emisión de Positrones): Inicialmente se empleó el F18-FDG PET para estudiar a pacientes con recurrencia del cáncer prostático y se encontró que este trazador tenía alta sensibilidad en pacientes con cáncer de próstata muy agresivo. Como ya se indicó, lo ideal es detectar la recurrencia de la enfermedad en etapa temprana para determinar el tratamiento más apropiado; el pronóstico dependerá si la enfermedad está localizada o diseminada. El ACE 11 PET (acetato carbono) tiene una alta sensibilidad, superior al F18-FDG PET para la detección del cáncer recurrente de la próstata.45
En un estudio de Oyama y colaboradores de la Escuela de Medicina de la Universidad de Washington, los hallazgos de los estudios fueron positivos en 59% de los casos (27 de 46 estudios), en pacientes con antígeno mayor de 3 ng/mL y sólo en 4% de los pacientes, con un APE ± 3 ng/mL.46
Una limitante del PET para la detección temprana de la enfermedad, es su resolución espacial que es muy baja y es de aproximadamente ocho milímetros.
Opciones de tratamiento: La importancia clínica de la recurrencia del APE después de la prostatectomía radical, es un tema de controversial; cuando éste se eleva después de la cirugía, genera un dilema en forma tal que 50% de los urólogos recomiendan observación, 30% recomendó alguna forma de supresión androgénica y 20% radioterapia.47 Esto refleja la falta de consensos en el tratamiento de los pacientes con falla del APE después de la PR.
Radioterapia: La radioterapia puede ser administrada:
Como tratamiento adyuvante generalmente tres meses después de la PR en pacientes con signos patológicos tales como márgenes positivos o extensión extra-capsular establecida.
Como terapia de salvación al tiempo de la recurrencia bioquímica o clínica.
El tiempo adecuado de la radioterapia para pacientes con cáncer de próstata en etapa pT3, márgenes positivos de la pieza quirúrgica de la PR, ha sido motivo de constantes debates de tiempo atrás entre los que proponen la terapia adyuvante, la cual es aplicada sobre la base de los hallazgos histopatológicos y aquellos que apoyan la radioterapia de salvación, que la indican cuando se detecta recaída bioquímica o clínica. Los argumentos a favor de una a otra postura han sido de limitada solidez por que los estudios retrospectivos que se tienen no son confiables pues se han realizado en poblaciones de pacientes heterogéneos no randomizados.
Radioterapia adyuvante: Sus indicaciones potenciales:
APE detectable posoperatorio post PR.
Márgenes quirúrgicos positivos.
Extensión tumoral extra-prostática.
Invasión a vesículas seminales.
De éstas, los pacientes con márgenes positivos son los que tienen mayor éxito con la terapia adyuvante. Asimismo, los pacientes que son sometidos a radioterapia sin incremento del APE con la enfermedad microscópica residual, se benefician de la terapia adyuvante temprana.48-51 Los márgenes quirúrgicos positivos teóricamente han demostrado ser un predictor de recurrencia después de la PR, varios grupos han reportado un moderado impacto del estado de los márgenes y la posibilidad de recurrencia.52,53
Numerosos estudios no aleatorizados, han sido publicados para juzgar del valor de la RT adyuvante en pacientes con enfermedad localmente avanzada demostrada en el espécimen quirúrgico estos estudios han mostrado que la RT adyuvante fue capaz de erradicar la enfermedad residual en el lecho prostático y reducir la tasa de recaída local.48,54-56
Lennernas y colaboradores,57 revisaron 417 artículos de 1990 a 2002, en los que se manejó radioterapia posoperatoria después de la PR. No hubo estudios aleatorizados, pero la RT mostró tener un efecto benéfico sobre el control local, especialmente en la enfermedad pT3 (márgenes quirúrgicos positivos, invasión a vesículas seminales, suma de Gleason alta). No se menciona beneficio en la sobrevida global.
En un estudio retrospectivo de la clínica Mayo, Leibovich y colaboradores58 de 3701 prostatectomías radicales, realizadas entre 1987 y 1996 en pacientes que tenían etapa patológica pT2. De este grupo: 816 tenía un solo margen positivo; se seleccionaron 76 para recibir radioterapia tres meses después de la cirugía y se compararon con otros 76 pacientes de los 816 que estaban en observación. Se valoró que ambos grupos fueron muy similares en relación al sitio del margen positivo, edad, APE preoperatorio, suma de Gleason y ploidía del DNA. A los que recibieron terapia adyuvante se les aplicó un promedio de 63 Gy (rango 50 a 68 Gy). En el análisis global, la taza libre de recurrencia bioquímica o clínica para el grupo que recibió RT adyuvante, fue de 88% ± 5% contra 59% ± 11% en el grupo control de observación. Este estudio mostró en forma estadísticamente significativa, la mejoría clínica de la terapia adyuvante.
En varias series publicadas, la tasa libre de falla bioquímica con RT adyuvante en pacientes con márgenes positivos, fue de 70% a 90% a cinco años y de 60% a 10 años.20,58,59
Respecto a la enfermedad pT3, existe un mejor control local con la RT adyuvante 90% vs. 60% a cinco años, y la tasa de recaída bioquímica parece ser más baja de 90% vs. 40% a cinco años59-63 en pacientes en observación.
Radioterapia de salvamento (RTS): Para muchos pacientes con recurrencia del cáncer después de la PR, la RT constituye una terapia potencial de curación; sin embargo, los registros del Comité de Investigación Estratégica para el Cáncer de Próstata (CAPSURE), indican que menos de 50% de los pacientes que recibieron un tratamiento secundario por recaída después de la PR, recibieron RTS;64 la mayoría de ellos recibieron bloqueo androgénico, tratamiento que no ofrece posibilidades de cura.
El urólogo es renuente a tratar a los pacientes con terapia de salvamento porque estudios previos han reportado su baja efectividad en pacientes con cáncer con signos agresivos como son la recurrencia e incremento rápido del antígeno en un tiempo corto después de la PR y suma de Gleason de alto grado y que pudieran tener enfermedad metastásica oculta.2 En este estudio, (CAPSURE) se encontró que 54% de los urólogos recomiendan la observación del paciente que tiene elevación del APE, difiriendo la radioterapia hasta que se haya demostrado una recurrencia local. Consecuentemente estos urólogos refieren en una minoría a los pacientes a terapia adyuvante y de salvamento dentro de los tres años siguientes a la cirugía.64
La ausencia de estudios clínicos randomizados para apoyar el beneficio de la terapia adyuvante o de salvación afecta la decisión del urólogo de no referirlos para su tratamiento, sobre todo aquellos pacientes que puedan responder a la terapia de salvamento. Las indicaciones para la radioterapia de salvamento pueden ser consideradas en tres escenarios.
Recurrencia local clínicamente palpable o por biopsia probada (o ambas).
Antígeno prostático específico persistentemente detectable.
Elevación retardada del antígeno prostático sin evidencia de enfermedad clínica después de niveles indetectables de APE post prostatectomía.
La indicación de la RTS, en la forma más temprana en el inicio de la elevación del APE tiene los mejores efectos sobre la sobrevida libre de falla bioquímica o clínica.64-67
Existen buenos resultados de la TS cuando esta es administrada ante las primeras evidencias de progresión de la enfermedad, esto es justo cuando el APE se empieza a incrementar por arriba de los valores detectables. Un APE alto mayor a 2 ng/mL previo a la radioterapia, ha mostrado una influencia negativa en los resultados de estos pacientes sometidos a radioterapia.65
La ASTRO (Sociedad Americana de Radio Oncología Terapéutica) ha concluido, que el punto de corte del APE debe ser 1.5 ng/mL.66 Sin embargo, estudios retrospectivos considerando el APE post-cirugía, cuando éste se incrementó entre 0.5 a 1.0 ng/mL los resultados fueron mejores. En el estudio de Stephenson, los pacientes que recibieron tratamiento con antígenos bajos ± 0.6 ng/mL, mostraron mejores resultados que en pacientes con niveles de APE entre 0.6 ng/mL y 2 ng/mL.65
Es importante que, cuando se propone RT en pacientes que apenas inician la elevación del APE (-0.4 ng/mL) tener la certeza de que esta elevación es real, para evitar el riesgo de un sobre-tratamiento, esto es debido a que algunos pacientes después de la pros-tatectomía radical pudieran tener tejido prostático residual benigno que pudiera generar valores detectables de APE después de PR. Es por eso que algunos autores sugieren tomar como nivel de corte hasta 0.4 ng/mL.67
Un abordaje más selectivo sería monitorear al paciente con pruebas ultrasensibles del APE para demostrar la elevación del mismo y dar tratamiento antes que llegue a 1 ng/mL y probablemente antes de 0.5 ng/ mL.68
Es importante la identificación de aquellos pacientes que puedan responder a la terapia de salvamento, por lo que es necesario tener guías o lineamientos para predecir si la elevación del APE representa un tumor confinado al lecho prostático o si hay sospecha de enfermedad sistémica.
En efecto, hay que tomar en cuenta otras variables para identificar la enfermedad con alto riesgo de progresión que puedan ocurrir antes de la TS como ya se ha mencionado y que son: un APE alto preoperatorio, Gleason de alto grado, el doblamiento rápido del APE y los hallazgos de patología (múltiples márgenes positivos con invasión a VS), ya que pacientes con tumores con estos signos tienen el riesgo de tener metástasis tempranamente antes de la PR o por la enfermedad residual pélvica.
Los estudios de Stephenson y colaboradores,65 demostraron que pacientes con suma de Gleason entre ocho y 10, tiempo de duplicación del APE más menos 10 meses, un nivel del APE por arriba de 2 ng/mL antes de la radioterapia con márgenes positivos e invasión a vesículas seminales fueron signos predictores de progresión después de la TS. Es un hecho de observación confirmado en varios estudios, que los márgenes quirúrgicos positivos constituyen un predictor importante de respuesta favorable a la RTA.57,58
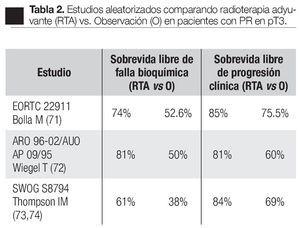
En el año 2005, fueron publicados los resultados de tres importantes estudios clínicos randomizados, que han demostrado sin ambigüedad que en la presencia de extensión extra-capsular con o sin márgenes positivos o invasión a vesículas seminales, la radioterapia adyuvante fue significativamente mejor que la observación con tratamiento, retardado hasta la falla bioquímica (Tabla 2).69-72
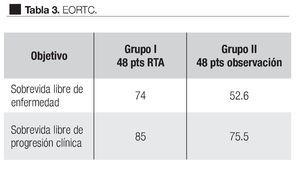
En el estudio realizado por la EORCT 22911 (Organización Europea para la Investigación y Tratamiento del Cáncer),69 se reclutaron de noviembre de 1992 a diciembre de 2001, 1005 pacientes de 37 instituciones, quienes después de ser sometidos a prostatectomía radical retro-púbica, 503 (-17= 486) pacientes fueron randomizados a seguir una política de observación y 502 (-20= 482) a recibir RTA, 60 Gy con radioterapia convencional durante seis semanas generalmente a los tres meses de la PR. El seguimiento medio para ambos grupos fue de cinco años; hay que señalar que 37 pacientes del primer grupo y 20 del segundo no fueron elegibles; la recurrencia local fue documentada por EDR y la progresión bioquímica; ésta se tomó como un incremento de 0.2 ng/mL medido en tres ocasiones por lo menos cada dos semanas; asimismo fueron documentados los efectos colaterales de la radioterapia de acuerdo a las escalas de la OMS. La sobrevida libre de progresión bioquímica para el grupo radiado (131 puntos) fue significativamente mejor en el grupo de pacientes que recibieron radioterapia inmediata después de la PR, comparada con el grupo de pacientes sometidos a observación activa, 74% vs. 52.6% respectivamente; la sobrevida libre de progresión clínica fue significativamente más alta, 85.5% para el grupo radiado y 75.5% para el grupo de observación (p = 0.0009) (Tabla 3). La falla loco-regional fue más baja (p < 0.0001) en el grupo que recibió radiación postoperatoria. El tratamiento benefició a todos los grupos de riesgo. Un total de 351 pacientes tuvieron falla, 220 en el grupo de observación y 131 en el grupo de terapia adyuvante. Con bien a señalar que 207 pacientes de los 486 del grupo de radiación a 163 se les ofreció tratamiento activo: 100 recibieron RTS y 63 tratamiento hormonal. Aunque en el grupo de observación, el doble murió por causa del cáncer, los autores consideran que se requiere un seguimiento más largo para evaluar si la RTA pudiera influir en la ocurrencia de metástasis a distancia, sobrevida o ambos. La toxicidad grado tres fue poco frecuente y no diferente en ambos grupos: en el grupo de observación fue de 2.6% y en el grupo postoperatorio radiado fue de 2.4%.
Otro estudio aleatorizado fue realizado por Wiegel y colaboradores (ARO 96-02/AUO AP 09/95).70 Reclutaron 385 hombres con cáncer prostático, sometidos a prostatectomía radical con enfermedad pT3. Recibieron radioterapia adyuvante 193 pacientes, promedio 60 Gy y 192 fueron asignados aleatoriamente a observación. El punto final del estudio fue la sobrevida libre de falla bioquímica; el seguimiento medio fue de 40 meses. Los resultados fueron: 81% (108 pacientes que recibieron terapia adyuvante) con sobrevida libre de recurrencia bioquímica vs. 60% (153 pacientes que estuvieron en el grupo de observación). Los efectos adversos de la radioterapia de grado dos fueron de 3%. La conclusión de este estudio fue que la radioterapia adyuvante en los pacientes con cáncer de próstata pT3 reduce significativamente el riesgo de progresión bioquímica después de la prostatectomía radical.
Otro estudio que recientemente fue diseñado para comparar tratamiento de radioterapia adyuvante y la sola observación en pacientes con extensión extra-prostática después de la prostatectomía radical, es el de Lan Thompson y colaboradores (SWOG 8794),71,72 a nivel multi-institucional. Lo iniciaron el 15 de agosto de 1988 e incluyó 425 casos con cáncer prostático patológicamente avanzado (extensión prostática establecida, márgenes quirúrgicos positivos, invasión a vesículas seminales), a los cuales se les había practicado prostatectomía radical con linfadenectomía pélvica.
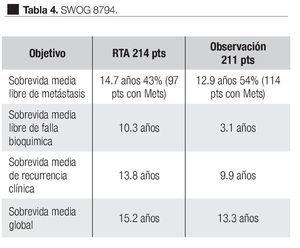
El objetivo primario fue determinar si la terapia adyuvante mejoró la sobrevida libre de metástasis en pacientes con pT3 N0 M0; los objetivos secundarios fueron la sobrevida libre de recurrencia bioquímica, sobrevida global y complicaciones. En este estudio, 214 hombres fueron asignados al azar para recibir 60 a 64 Gy a la fosa prostática y 211 a observación. El seguimiento medio fue de 10.6 años. En el segundo análisis de este estudio,72 de los 211 hombres del grupo de observación, 114 (54%) había muerto o tenían enfermedad metastásica y la sobrevida media libre de metástasis fue de 12.9 años. De los 214 hombres del grupo de RT, 93 pacientes (43%) habían alcanzado este punto, la sobrevida media libre de metástasis fue de 14.7 años. La sobrevida media libre de falla bioquímica fue de 10.3 años para el grupo de radioterapia vs. 3.1 años para el grupo observación. La sobrevida media de recurrencia clínica fue de 13.8 años para el grupo de radioterapia y 9.9 años para el grupo de observación. Respecto a la sobrevida global de los 211 pacientes en el grupo de observación, 110 (52%) habían muerto y de los 214 de tratamiento adyuvante, 88 pacientes (41%) murieron. La sobrevida media global en el grupo de observación fue de 13.3 años y en el de terapia adyuvante fue de 15.2 años (Tabla 4). El número de casos con enfermedad pT3 que debe ser tratado con radioterapia adyuvante para prevenir una muerte en un seguimiento medio de 12.6 años, fue de 9.1. En relación con los pacientes en observación, de 211 recibió RTS 70 (33%), ya fuera por elevación del APE o por recurrencia local. Conviene señalar que 35% de los pacientes de este estudio, tenían APE detectable después de la PR, en forma tal que por definición el tratamiento debe de ser considerado más como una terapia de salvamento que un tratamiento adyuvante. El análisis de este estudio los autores señalan dos puntos importantes. La primera, está relacionada a las observaciones obtenidas del estudio cruzado de los grupos dado que un tercio de los hombres del grupo de observación recibieron tratamiento de salvamento al tiempo de falla del APE o recaída local. De esta forma se pudo comparar la terapia adyuvante inmediata con los pacientes que recibieron tratamiento al tiempo de la recurrencia de la enfermedad (RTS). La segunda, es que aunque hay un beneficio de la radioterapia en pacientes que tienen APE detectable después de PR la sobreviva libre de metástasis es significativamente inferior para aquellos pacientes que recibieron radioterapia adyuvante cuando el APE era indetectable. Las conclusiones de estos autores indican que la RT adyuvante después de la PR en hombres con pT3 N0 M0 de cáncer de próstata reducen significativamente el riesgo de recurrencia del APE, metástasis y significativamente mejoran la sobrevida.
Del análisis de estos tres estudios aleatorizados, se pueden notar datos que son discordantes: en los grupos de observación del SWOG S8794 y en el del EORTC 22911, 35% y 15% de los pacientes respectivamente, tenían APE detectable posPR. Además las poblaciones fueron muy heterogéneas respecto a las variables de clasificación; los grados de Gleason fueron más bajos comparados con los grupos de los estudios contemporáneos. Asimismo, el volumen tumoral de los pacientes de la década 1980 - 1990 fueron mayores que los que se detectan en la actualidad con los pacientes con CaP (la mayoría T1c).
Las dosis de radiación fueron modestas (60 Gy a 64 Gy) con equipo convencional. En la actualidad las dosis de radiación se han incrementado con las nuevas técnicas de radioterapia tridimensional conformacional escalada y de intensidad modulada. Aunque la RTA en estos estudios mostró beneficio para todos los subgrupos, en términos de sobrevida libre de progresión bioquímica y clínica, los estudios EORTC 22911 y el ARO 96-02/AUO AP 09/95) tienen un seguimiento muy corto para demostrar beneficios en la sobrevida global.
En el grupo EORTC, el tiempo de la terapia de salvamento fue retardado hasta tener o demostrar recurrencia local, lo cual también resulta tardío para obtener buenos resultados con la radioterapia de salvamento, pues los pacientes podrían tener metástasis en ese momento, sobre todo si se tratara de pacientes con extensión extra-prostática, márgenes positivos, suma de Gleason alto que pudieran tener ya metástasis microscópicas ocultas no detectables con estudios de imágenes habituales.
Ofrecer radioterapia adyuvante a todos los pacientes con pT3, condicionaría que un número de pacientes estarían sobre-tratados. En los brazos de observación del EORCT, 56.6% de los pacientes y en el SWOG 38% de los pacientes no tuvieron recaída bioquímica por lo tanto una proporción significativa, probablemente 50% de los pacientes se estarían exponiendo a un sobre-tratamiento con la RTA, exponiéndolos a potencialmente efectos adversos y un mayor costo en su tratamiento.
Para muchos clínicos, si no es que para la mayoría que se enfrentan con un paciente con evidencia de enfermedad extra-prostática posprostatectomía y en quien el APE es indetectable, la estrategia más común es efectuar un seguimiento con el APE e indicar la RT cuando el APE es detectable o alcance un umbral determinado (1.5 ng/mL ASTRO). Existen datos que indican que este abordaje de la TS pude colocar al paciente en un alto riesgo de metástasis y muerte. A la fecha, los estudios clínicos no han demostrado que la RTS después de la cirugía reduzca significativamente el riesgo de metástasis o significativamente mejoren la sobrevida global.68,71
Esta práctica de esperar a que el APE sea detectable mientras es asociado a una superior calidad de vida inicialmente y pocos pacientes recibían la RT, los riesgos posteriores disminuyen la calidad de vida y salud debido a que recibirán una mayor carga de terapias así como un mayor número de metástasis y muertes.
Investigadores de la Universidad Johns Hopkins notaron que menos de 20% de los hombres permanecen libres de una segunda progresión bioquímica dentro de los cinco años siguientes a la radioterapia de salvamento, lo cual pone en cuestión la utilidad de tal abordaje.73
Tratamiento hormonal adyuvante en combinación con RT: No hay un papel estándar para la terapia hormonal concomitante en pacientes sometidos a radioterapia adyuvante o de salvamento después de la elevación del APE posterior a la PR.
La supresión androgénica y la RT externa parecen tener un efecto aditivo sobre el control local por la inducción de apoptosis, como se ha demostrado en estudios de investigación experimental y clínica.74,75 En estos estudios experimentales usando tumores de próstata en ratas Dunning R3327-G se mostró que hay una interacción supra-aditiva entre la supresión androgénica y la radiación, y que el mecanismo de acción es a través de la modulación de la apoptosis. Los efectos eran superiores cuando la supresión androgénica precedía a la radiación. El tratamiento hormonal adyuvante a la radioterapia con agonista LHRH significativamente ha mejorado la sobrevida global en pacientes con cáncer clínicamente localizado o localmente avanzado cuando se ha comparado con la sola RT.
Numerosos estudios clínicos, con asignación aleatoria, han sido realizados por la RTOG: el estudio 8610,76-78 el 85-31,79 el estudio 9202:80 (Grupo Oncológico de Radioterapia) y el estudio EORTC 2286381 han mostrado los beneficios de la combinación de la RT y el tratamiento hormonal en la sobrevida libre de enfermedad en el cáncer prostático en etapa clínica T3.
El estudio RTOG 8610 (del Grupo Oncológico de Radioterapia), fue el primer estudio clínico fase III randomizado para evaluar la supresión androgénica neo adyuvante (SAN) en combinación con radioterapia externa (RTE) en hombres con cáncer de próstata localmente avanzado con un curso corto de supresión androgénica aplicado dos meses antes y durante la RT.
En 1995, fue reportado un primer análisis de este estudio76 y en 2001 se publicó un segundo informe de seguimiento más completo.77 En 2007, se publicaron los resultados a largo plazo de este estudio clínico.78 Fue un estudio estrictamente clínico basado en el EDR para pacientes con tumores palpables de 2.5 cm o más, sin evidencia de metástasis a distancia (gammagrafía ósea y tele de tórax) con o sin ganglios pélvicos regionales afectados (linfangiografía, TC de pelvis y exploración física).
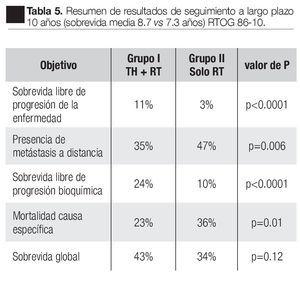
Entre 1987 y 1991, 456 pacientes fueron evaluados con tumor T2-4; en el grupo I, 226 pacientes recibieron goserelina de 3.6 mg cada cuatro semanas y flutamida 250 mg tres veces al día por dos meses antes y dos meses durante la radiación. En el grupo II, 230 pacientes sólo recibieron RTE 65 a 70 Gy a la próstata y de 40 Gy a 46 Gy a ganglios pélvicos regionales. El punto primario del estudio fue el control loco-regional, evaluado por persistencia de lesión palpable más allá del segundo año o biopsia positiva dos años o más después del estudio. Objetivos secundarios fue la sobrevida libre de progresión de la enfermedad y sobrevida global hasta la fecha de la muerte. Los resultados fueron: sobrevida global estimada a 10 años con tiempo medio de sobrevida (8.7 vs. 7.3 años) fue de 43% vs. 34% en el grupo I y II respectivamente, diferencias no significativas; ninguna diferencia significativa en mortalidad especifica al a enfermedad en 10 años 23% y 33% en el grupo I-II. Libre de metástasis a distancia 35% vs. 47%; sobrevida libre de enfermedad 11% vs. 3% y sobrevida libre de falla bioquímica 24% vs. 10% (Tabla 5).
En el grupo combinado hubo una mejoría significativa en todos los objetivos. En el análisis de los grupos, mostró que el beneficio fue superior en el grupo combinado en los pacientes con suma de Gleason bajo, dos a seis. Contrariamente en los pacientes con Gleason siete a 10, este tratamiento no tuvo un efecto significativo en el control loco regional y sobrevida.
El estudio RTOG 85-31,79 fue realizado para señalar la ventaja potencial de la supresión androgénica, seguida de radiación externa convencional en pacientes de alto riesgo de cáncer prostático localmente avanzado en etapa clínica o patológica T3 y con ganglios regionales clínica o patológicamente demostrados. Entre al año de 1987 y 1992, se reclutó a 977 pacientes, de los cuales 945 fueron analizados. De éstos, 477 se asignaron aleatoriamente a tratamiento combinado, RT con TH (grupo I) y 468 con sólo RT (grupo II) y TH iniciado en la recaída clínica. El TH consistió en Goserelina 3.6 mg subcutánea, aplicada cada cuatro semanas, con inicio en la última semana de radiación y continuando en forma indefinida o hasta la presencia de signos de progresión de la enfermedad; la dosis de radiación total fue de 65 Gy a 70 Gy; 44 Gy a 50 Gy a la pelvis y 20 Gy a 25 Gy a la próstata. En los pacientes tratados quirúrgicamente (PR) la dosis de radiación fue de 60 Gy a 65 Gy.
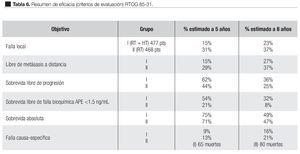
En 1998, con un seguimiento medio de seis años, los resultados de este estudio mostraron una mejor respuesta en el control local de la enfermedad y la sobrevida libre de progresión en los pacientes que recibieron tratamiento hormonal adyuvante. Una mejoría significativa se observó en particular en el subgrupo de pacientes de alto riesgo con Gleason ocho a 10. El resumen de la eficacia de los objetivos finales se observan en la Tabla 6.
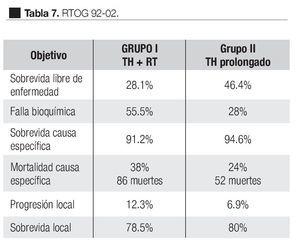
El estudio RTOG 92-02 fase III, se realizó para evaluar los resultados del tratamiento hormonal de supresión androgénica adyuvante después de citoreducción hormonal adyuvante y radioterapia para pacientes con cáncer de próstata localmente avanzado.
De 1992 a 1995, fueron evaluados 1514 pacientes con cáncer localmente avanzado de la próstata, T2c, T4 con niveles de APE menores de 150 ng/mL. Todos los pacientes recibieron desde dos meses antes a la RT, acetato de goserelina 3.6 mg subcutánea cada cuatro semanas y flutamida 250 mg tres veces al día y hasta el término de radioterapia. Para la radioterapia se aplicaron 65 Gy a 70 Gy a la próstata y de 44 Gy a 50 Gy a los ganglios linfáticos regionales.
Estos 1514 pacientes se asignaron al azar en dos grupos: el primer grupo de 271 pacientes sólo recibió el curso corto de hormonoterapia más la radioterapia. El segundo grupo, de 743 pacientes, continuó con el tratamiento hormonal de Goserelina 3.6 mg subcutánea mensualmente por dos años. El seguimiento medio fue de 5.8 años. Los resultados se muestran en la Tabla 7. Como puede observarse, el grupo de pacientes que recibieron tratamiento prolongado mostró mayor eficacia en todos los objetivos excepto en la sobrevida global que no fue significativa (80.8% vs. 78.5% p = 0.73). Sin embargo, en el análisis de los subgrupos, los pacientes con Gleason de ocho a 10, mostraron ventaja significativa en la sobrevida global y en la sobrevida causa específica en el grupo de pacientes con TH prolongado.
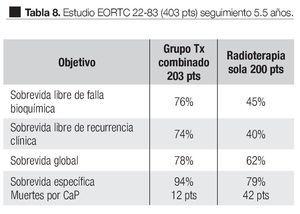
En el estudio EORTC 228381 realizado entre 1987 y 1995, 415 pacientes con CaP localmente avanzado, T1-2 GIII o T3-4 N1 M0. De este estudio 403 pacientes fueron evaluados; 200 pacientes fueron randomizados al grupo de RT y 203 al grupo combinado de RT y TH. Seguimiento medio de 66 meses. El tratamiento de RT fue de 70 Gy con la técnica convencional, 50 Gy a la pelvis y 20 Gy a la próstata. El tratamiento hormonal fue con acetato de Goserelina 3.6 mg subcutánea mensualmente por tres años (tiempo seleccionado empíricamente) y Acetato de Ciproterona 150 mg por un mes. Los resultados se muestran en la Tabla 8.
D´Amico y colaboradores,82 realizaron un estudio clínico prospectivo que incluyó 200 pacientes con: cáncer de próstata de alto riesgo con APE mínimo de 10 ng/mL y máximo de 40 ng/mL, suma de Gleason no menor de siete y evidencia de enfermedad extra-prostática, comparando RT externa tridimensional conformal (RTC - 3D) sola y en combinación de seis meses de supresión androgénica, agonistas GNRLH cada mes y un anti-andrógeno no esteroideo por un mes.
Después de un seguimiento medio de 5.4 años, los pacientes asignados al azar a RTC - 3D y terapia hormonal, tuvieron una significativa sobrevida más alta 88% vs. 78% que con sólo RT y una mortalidad causa específica más baja.
En otro estudio randomizado de largo seguimiento del Programa de Cáncer Temprano (EPC), Bicalutamida 150 mg, un anti-andrógeno no esteroideo administrado por tres años con seguimiento medio de 7.2 años en pacientes con cáncer de próstata localmente avanzado no metastásico tratados con radioterapia concomitante y adyuvante, se observó una disminución significativa del riesgo de progresión en 44% y del riesgo de muerte en 35% comparado con los pacientes que solo recibieron RT.83
Los tres estudios randomizados del RTOG: 86-10, 85-31C, 92-02T y el 22 83 del EORTC y el estudio de D´Amico, así como el del programa del cáncer temprano, mostraron efectos benéficos en la sobrevida global del control local de la enfermedad en el tratamiento combinado de tratamiento hormonal y RT.
En los estudios 92-02, 85-31 y 22-83, la mejoría fue más notable en los pacientes de alto riesgo, es decir con suma de Gleason ocho a 10 cuando el tratamiento hormonal fue más prolongado. Todos los estudios, claramente han mostrado el beneficio en la mejoría del control local de la enfermedad, mejoría libre a progresión clínica a bioquímica y de metástasis a distancia en pacientes con adenocarcinoma localmente avanzado de alto grado, los resultados del grupo EORTC muestran un beneficio en la sobrevida global en todos los grupos estratificados. Otro señalamiento es que desde el punto de vista clínico la supresión androgénica adyuvante a cirugía en los pacientes con cáncer de próstata localmente avanzado ha demostrado ser efectiva en el pronóstico de los pacientes.
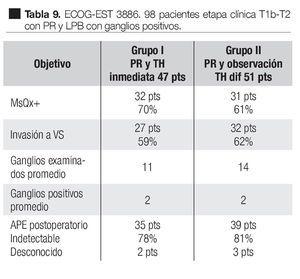
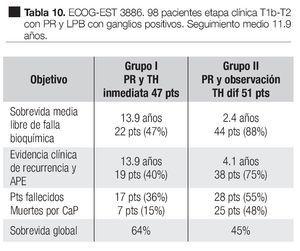
En un estudio clínico prospectivo aleatorizado del Grupo Oncológico Cooperativo del Este, EST 3886 Messing y colaboradores83 encontraron que la sobrevida fue mayor con tratamiento hormonal adyuvante a largo tiempo después de la cirugía, que con la cirugía sola. En este estudio, 98 hombres elegibles fueron sometidos a PR y linfadenectomía pélvica bilateral por cáncer de la próstata clínicamente localizado T1b-T2 y fueron conformados aquellos que tenían metástasis en los ganglios linfáticos. Un grupo de 47 casos fueron aleatoriamente asignados a supresión androgénica inmediata y continua, Goserelina 3.6 mg subcutánea mensual u orquiectomía bilateral, según la elección del paciente. En un segundo grupo de 51 pacientes, fueron randomizados a observación y tratamiento hormonal diferido en la recaída clínica. Seguimiento medio de 11.9 años. En las Tablas 9 y 10 se pueden observar las características de los pacientes y los resultados de este estudio. La terapia hormonal de supresión androgénica inmediata después de la PR y LPB, mejoró la sobrevida y redujo el riesgo de recurrencia de los pacientes con ganglios positivos por cáncer prostático. Este estudio también demostró los beneficios de la terapia hormonal temprana, comparada con la diferida.
En el estudio RTOG 8351,79 se hizo el análisis de un subgrupo de hombres en los que se realizó PR; 139 pacientes tenían indicación para tratamiento adyuvante (extensión extra-prostática e invasión a vesículas seminales). De éstos, 71 recibieron tratamiento adyuvante con RT, 60 Gy a 65 Gy y supresión androgénica con análogos por seis meses y 68 sólo RT. La sobrevida libre de falla bioquímica a cinco años fue de 65% para el grupo combinado vs. 42% para el grupo que sólo recibió RT.
Otro estudio clínico retrospectivo no aleatorizado es el realizado por Eulau, Stamey y colaboradores de la Escuela de Medicina de la Universidad de Stanford,84,85 para evaluar si el tratamiento hormonal con RTA a la PR en pacientes con cáncer localmente avanzado, tenía impacto en la sobrevida de falla bioquímica, en la sobrevida libre de recurrencia clínica y sobrevida global. Se revisaron los expedientes de 105 pacientes consecutivos, tratados con RTA después de PRR entre 1985 y 1995 con un seguimiento medio de 4.5 años. De estos 105 pacientes, 31 recibieron supresión androgénica con análogos LHRH y anti-andrógenos por seis meses, iniciados dos meses antes de la RTA y 74 pacientes sólo RT. La dosis de esta última fue de 60 Gy a 70 Gy para la fosa prostática. Los factores de riesgo potenciales (APE preoperatorio, suma de Gleason y el estado de los ganglios) no fueron muy diferentes en ambos grupos. La sobrevida libre de falla bioquímica en el grupo de tratamiento combinado fue mayor 56% vs. 37% (dos mediciones consecutivas del APE de más de 0.07 ng/ mL). La sobrevida libre de recurrencia clínica también fue mayor para el grupo combinado 100% vs. 70% a cinco años. En sus conclusiones, estos autores sugieren que el bloqueo androgénico transitorio y la radioterapia adyuvantes a la prostatectomía radical, pueden mejorar la recaída bioquímica y clínica en comparación con la radioterapia sola.
Con toda esta información detallada basada en conocimientos científicos no se puede negar que los tratamientos combinados, es decir, cuando se agrega radioterapia u hormonoterapia a los pacientes con canceres patológicamente localmente avanzados (pT3a -pT3b), estos pacientes tienen un mejor pronóstico.
Basados en estos mismos conocimientos científicos, radioterapia y hormonoterapia adyuvantes en pacientes con pT3a - pT3b pueden ser una opción válida. Estudios prospectivos al respecto son necesarios.
Conociendo lo pobres resultados de la terapia de salvación al tiempo de la recurrencia bioquímica o clínica en pacientes con cáncer prostático sometidos a PR, el grupo RTOG ha proyectado dos estudios prospectivos randomizados:
El RTOG P0011. Es un estudio aleatorizado, fase III de radioterapia adyuvante para cáncer prostático de alto riesgo pT2, 3 N0. El tamaño de la muestra es de 1398 pacientes y en el brazo uno se aplican agonistas LHRH por dos años, un mes inicial de antiandrógenos (flutamida o bicalutamida) y concomitantemente radioterapia 63 cGy a 66 cGy, iniciando en forma concomitante a la radioterapia. Y en un segundo brazo sólo radioterapia adyuvante 63 a 66 cGy.
El segundo estudio, RTOG 9601 en fase III, aleatorizado con radioterapia con o sin Casodex 150 mg en pacientes en etapa pT3N0 con elevación del APE posterior a PR. El tamaño de la muestra es de 810 pacientes en el brazo I. RT 64.8 Gy + Casodex 150 mg por dos años y en el brazo II. Radioterapia más placebo.
Hasta la fecha (2010) no tenemos conocimiento de los resultados de estos estudios.
¿ CONCLUSIONES
1. En grandes series de la comunidad internacional de hombres sometidos a PR, un tercio de ellos pueden tener MQS+.
2. Ante la presencia de un MQS+ en la pieza quirúrgica de PR, debe demostrarse la existencia de extensión extra-prostática establecida.
3. MQS+ es únicamente significativo en pacientes con extensión extra-prostática y no en aquellos en que el tumor está confinado a la glándula
4. MQS+ es el único factor de riesgo que puede ser causado en forma inadvertida por el cirujano.
5. MQS+, extensión extra-prostática e invasión a vesículas seminales, son factores de riesgo a tener falla bioquímica y por lo tanto, progresión clínica de la enfermedad.
6. El óptimo tratamiento de los pacientes con enfermedad extra-prostática posterior a la PR aún no se ha establecido.
7. Los MQS+ son predictores de recurrencia local, y estos pacientes son los que mejor responden a la radioterapia adyuvante.
8. La radioterapia adyuvante se ha usado por más de tres décadas para reducir el riesgo de la enfermedad.
9. La radioterapia adyuvante para pacientes con cáncer de próstata pT3 reduce significativamente el riesgo de progresión bioquímica y clínica.
10. Las evidencias basadas en el conocimiento científico han mostrado que la radioterapia y hormonoterapia adyuvantes en pacientes con enfermedad patológica pT3 tienen un impacto positivo en la sobrevida libre de falla bioquímica, sobrevida libre de recurrencia clínica y sobrevida global.
11. Para los otros grupos de pacientes, el monitoreo cuidadoso y ante la primera evidencia de elevación de la APE (0.2 ng/mL), ofrecer la terapia de salvación y no esperar a que el APE alcance valores de 1.0 ng/mL o 1.5 ng/mL, ya que estos pacientes están en riesgo de desarrollar metástasis y morir por la enfermedad.
12. Estos tratamientos deben ser discutidos con los pacientes y manejados según la preferencia de los mismos.
Correspondencia: Dr. Elías Zonana Farca.
calle Gelati n° 29, 11850, San Miguel Chapultepec, 1a sección. México, Distrito Federal.
Teléfonos: 55 5516 8306 y 55 5516 8306.
Correo electrónico: dr_zonana@msn.com