Describir la relación entre la obesidad y la agresividad en cáncer de próstata (CaP) en población mexicana.
Materiales y métodosSe obtuvieron datos de manera retrospectiva del expediente electrónico de 167 pacientes de CaP. Se agruparon por índice de masa corporal (IMC), edad, Gleason, estadio clínico (EC), y por grupos de acuerdo a la clasificación D’Amico. Se correlacionaron las variables (IMC, antígeno prostático específico [PSA], EC, Gleason) y se analizaron usando modelos estadísticos.
ResultadosSe analizaron 167 pacientes con CaP con una edad promedio de 69.4años, PSA pre-biopsia promedio de 25.36ng/ml, el 45, el 22.75 y el 5.3% presentaron sobrepeso, obesidad gradoi y obesidad gradoii, respectivamente; el 25.7% dentro de su peso. Gleason 6: 41.91%, de los que el 47.9% se clasificó como cT1c. El 11.37, el 23.95 y el 64.67% fueron clasificados por D’Amico como riesgo bajo, intermedio y alto, respectivamente. Aquellos con un IMC>25kg/m2 presentaron un mayor riesgo de CaP de alto riesgo (OR: 1.027), p=0.46, y aquellos con un IMC>25kg/m2 presentaron mayor riesgo de Gleason 8-10 (OR: 1.310), p=0.23. Encontramos una relación entre el IMC>25kg/m2 y PSA<20ng/ml (OR: 1.14), p=0.36. Así, la relación de IMC>25kg/m2 y PSA>20ng/ml se encontró una asociación negativa (OR: 0.87), p=0.35. Identificamos que realmente no existe una diferencia significativa entre IMC y EC cT (OR: 0.89), p=0.15.
ConclusionesLos pacientes obesos tienen un riesgo mayor de CaP de agresivo. Estos presentaron un PSA más bajo, y los pacientes con sobrepeso y obesidad presentaron un Gleason mayor. Esto nos permitirá tomar mejores decisiones preventivas y terapéuticas en hombres con CaP con sobrepeso y obesidad.
To describe the relation between obesity and prostate cancer (CaP) aggressiveness in a Mexican population.
MethodsData was collected retrospectively from the electronic medical files of 167 patients with CaP. They were grouped according to body mass index (BMI), age, Gleason score, clinical stage, and D’Amico classification. The variables were correlated (BMI, prostate-specific antigen [PSA], clinical stage, Gleason score) and were analyzed using statistical models.
ResultsA total of 167 patients with CaP were studied. The mean age was 69.4 years and mean pre-biopsy PSA was 25.36ng/m. Overweight was present as Grade I and Grade II obesity in 45% and 22.75% of the patients, respectively, and 25.7% were within their normal weight range. A total of 41.9% of the patients had a Gleason score of 6 and 47.9% of the tumors were classified as stage cT1c. According to the D’Amico classification, 11.37% of the patients were considered at low risk for aggressive CaP, 23.95% at intermediate risk, and 64.67% were at high risk. Those patients with a BMI > 25kg/m2 presented with a greater risk for high-risk CaP (OR 1.027; P=.46) and those with a BMI>25kg/m2 had a greater risk for a Gleason score of 8-10 (OR 1.310; P=.23). We identified a relation between BMI>25kg/m2 and PSA<20ng/mL (OR 1.14; P=.36) and a negative association between BMI>25kg/m2 and PSA>20ng/mL (OR 0.87; P=.35). No significant difference was found between BMI and clinical stage (OR 0.89; P=0.15).
ConclusionsObese patients are at a higher risk for aggressive CaP; they presented with a lower PSA and the overweight and obese patients had a higher Gleason score. These data will enable us to make better preventive and therapeutic decisions in overweight and obese men with CaP.
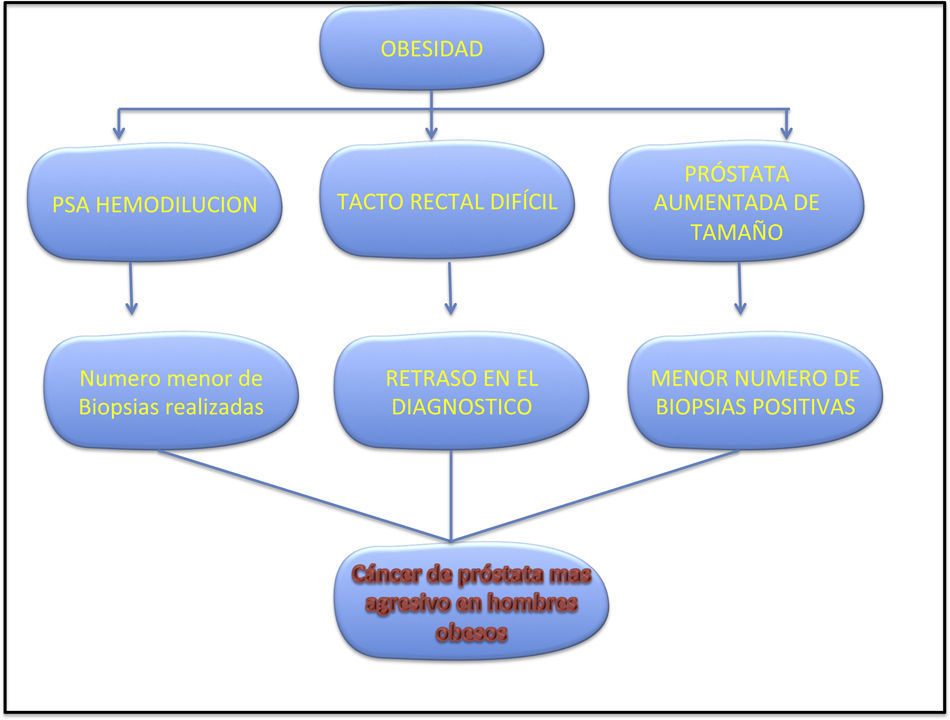
La obesidad es un problema mayor de salud pública. El 32.8% de la población mexicana la padece, y el 67.2% de los adultos mayores de 40años tienen sobrepeso u obesidad, de acuerdo con un estudio realizado en julio del 2013 por la FAO. En países industrializados como Estados Unidos actualmente el 70% de los adultos mayores de 40años tienen sobrepeso y el 30% son obesos1–2. La obesidad es el segundo factor de riesgo para tumores sólidos, solo después del tabaco, y se asocia con un tercio de las muertes relacionadas con cáncer en 20123. También se relaciona con un aumento en la mortalidad de todos los tipos de tumores, incluido el cáncer de próstata (CaP)4. La incidencia de CaP tuvo un aumento del 2% anual desde 1995 hasta 2001; actualmente existe un estimado de 241,174 casos nuevos CaP diagnosticados en 2012, los cuales representan el 29% de casos nuevos de cáncer en varones, con una mortalidad en 2012 que representó 28,170 muertes4. La relación de CaP y obesidad es controversial; algunos estudios muestran una disminución de CaP en población obesa, mientras que otros sugieren una relación con CaP de alto grado y enfermedad fatal5. Una posible teoría que explica esto es la presencia de niveles más bajos de testosterona, lo que provoca niveles bajos de antígeno prostático específico (PSA), así como la hemodilución de este, teniendo como resultado una detección menor de CaP en población obesa6. Numerosos estudios han sugerido que la obesidad constituye un obstáculo en el cribado del cáncer en general, y los pacientes obesos pueden presentar una enfermedad localmente avanzada oculta mientras los niveles de PSA permanecen relativamente bajos (fig. 1). Un estudio de cohorte con 5,041 hombres con CaP clínicamente localizado (Davies et al.) demostró que los obesos son tratados incluso de manera más agresiva que los no obesos (80% vs 71, p<0.01), y que la elección del tratamiento puede variar dependiendo del grado de obesidad6,7.
En este contexto nosotros estudiamos una cohorte para corroborar estos hallazgos. Nuestro objetivo es examinar la relación entre el índice de masa corporal (IMC), el CaP de alto riesgo, el nivel de PSA pre-biopsia, la suma de Gleason y el estadio clínico (EC) en hombres con diagnóstico de CaP obtenido por biopsia transrectal (BTRP) en el Centro Médico Nacional «20 de Noviembre». Estudiamos la relación entre IMC (sobrepeso, obesidad y obesidad severa) y CaP de alto riesgo, así como una relación inversa entre PSA prebiopsia e IMC, y también una relación directa entre el EC, la suma de Gleason y D’Amico y el IMC de manera independiente.
Materiales y métodosDurante el periodo comprendido entre marzo de 2011 a julio de 2012 se obtuvieron datos de manera retrospectiva del expediente electrónico a través del sistema integral de administración hospitalaria (SIAH 2.0) en el Centro Médico Nacional «20 de Noviembre». Se incluyeron 167 pacientes varones con diagnóstico de CaP obtenido a través de BTRP guiada por ultrasonido, obtenidas con el protocolo de toma de biopsias de nuestro hospital y revisadas por el servicio de anatomopatología del CMN «20 de Noviembre». Tomando en consideración las variables de IMC (calculado con el peso en kilogramos dividido entre la altura en metros al cuadrado [kg/m2]), se agruparon de la siguiente manera: peso normal 18.5-24.9kg/m2, sobrepeso 25.0-29.9kg/m2 (nos referiremos a este grupo de pacientes con sobrepeso agrupándolos en obesos, a menos de que se describa lo contrario), obesidad gradoi 20-34.9kg/m2, obesidad gradoii >35kg/m2 (adaptado WHO-2004)8, PSA pre-biopsia, EC, suma de Gleason. Se agrupó a los pacientes por edad (40-60,61-80, >80años), suma de Gleason (6, 7 y 8-10), PSA (2-4ng/ml, 4.1-10ng/ml, >10-20ng/ml, >20ng/ml), EC (cT1c, cT2a-b-c y T3 N0 M0) usando los criterios de D’Amico correspondiente a bajo riesgo (Gleason 6, cT1c-cT2a, PSA≤10ng/ml), riesgo intermedio (Gleason 7, cT2b, PSA >10ng/ml-≤20ng/ml) y alto riesgo (Gleason 8-10, cT2c-cT3a, PSA >20ng/ml) (tabla 1). No se incluyeron los pacientes que presentaron PSA>100ng/ml, con antecedente oncológico (otro primario) o que recibieron algún tratamiento hormonal antes de la BTRP (análogos de GNRH, antagonista de GNRH, antiandrógenos esteroideos o no esteroideo), variantes histológicas diferentes a adenocarcinoma de próstata, cT4 o con evidencia clínica de actividad tumoral metastásica (p.ej., dolor óseo) y pacientes clasificados con suma de Gleason<5. Se correlacionaron las variables antes mencionadas, utilizando las siguientes pruebas: correlación p, Chi cuadrado, Fisher's test. El análisis estadístico se realizó con GraphPad Prism 6.0 y IBM SPSS statistics 19.
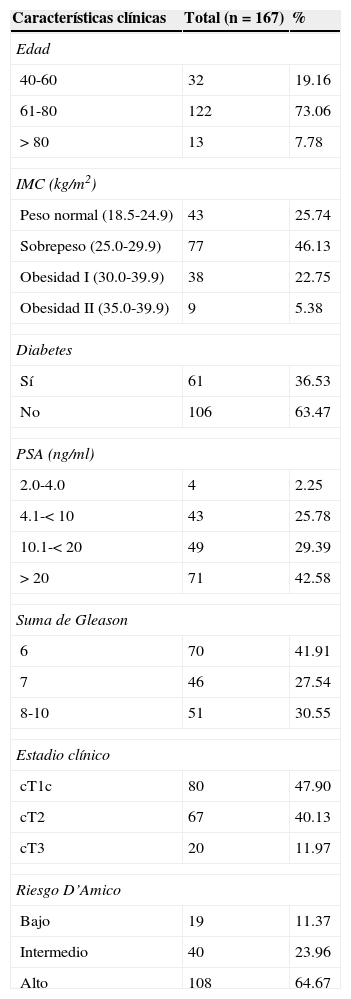
Características clínicas
| Características clínicas | Total (n=167) | % |
|---|---|---|
| Edad | ||
| 40-60 | 32 | 19.16 |
| 61-80 | 122 | 73.06 |
| > 80 | 13 | 7.78 |
| IMC (kg/m2) | ||
| Peso normal (18.5-24.9) | 43 | 25.74 |
| Sobrepeso (25.0-29.9) | 77 | 46.13 |
| Obesidad I (30.0-39.9) | 38 | 22.75 |
| Obesidad II (35.0-39.9) | 9 | 5.38 |
| Diabetes | ||
| Sí | 61 | 36.53 |
| No | 106 | 63.47 |
| PSA (ng/ml) | ||
| 2.0-4.0 | 4 | 2.25 |
| 4.1-< 10 | 43 | 25.78 |
| 10.1-< 20 | 49 | 29.39 |
| > 20 | 71 | 42.58 |
| Suma de Gleason | ||
| 6 | 70 | 41.91 |
| 7 | 46 | 27.54 |
| 8-10 | 51 | 30.55 |
| Estadio clínico | ||
| cT1c | 80 | 47.90 |
| cT2 | 67 | 40.13 |
| cT3 | 20 | 11.97 |
| Riesgo D’Amico | ||
| Bajo | 19 | 11.37 |
| Intermedio | 40 | 23.96 |
| Alto | 108 | 64.67 |
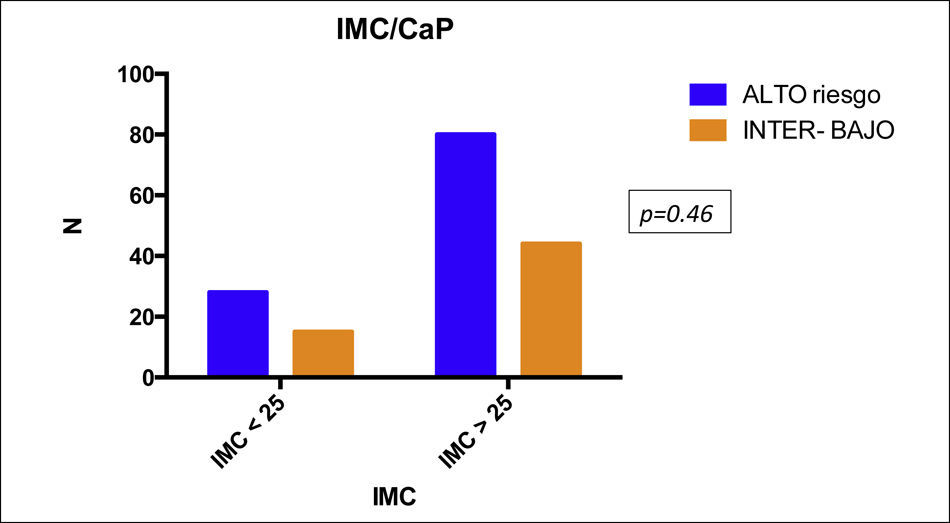
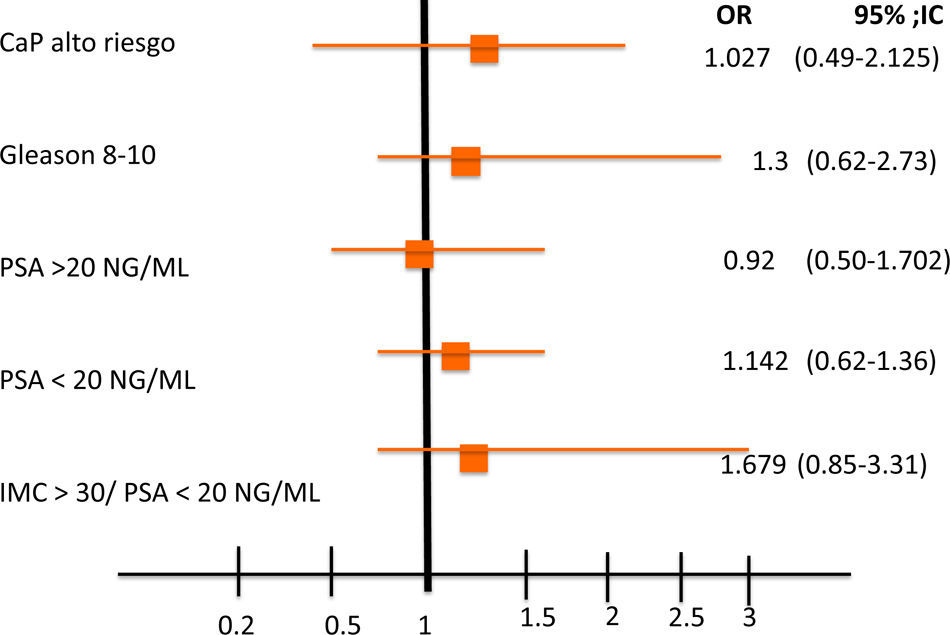
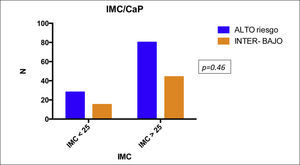
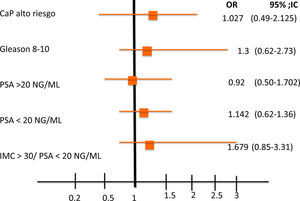
Se analizaron 167 pacientes con CaP con una edad promedio de 69.4 (52-91) años. La media del valor de PSA pre-biopsia fue de 25.36ng/ml (2-85). El 45% de los pacientes tenían sobrepeso, el 22.75% obesidad gradoi y el 5.3% presentaban obesidad gradoii; el 25.7% se encontraban dentro de su peso. El 41.91% presentaban Gleason 6 (3+3) y el 47.9% se clasificaron como cT1c. También se incluyeron pacientes diabéticos (36.0%) y no diabéticos (63.47%), aunque esto no fue tomado en cuenta al momento del análisis. Una vez que se realizó la estratificación por criterios D’Amico, el 11.37, el 23.95 y el 64.67% fueron clasificados como riesgo bajo, intermedio y alto, respectivamente (tabla 1). Al estratificar a los pacientes de acuerdo al IMC, observamos que, aquellos pacientes con un IMC >i25kg/m2 tenían un riesgo mayor para CaP de alto riesgo (OR: 1.027; IC95%: 0.49-2.125), p=0.46 (fig. 2). Al evaluar los pacientes con un IMC>25kg/m2 y Gleason 8-10, presentaron un riesgo ligeramente mayor (OR: 1.310; IC95%: 0.62-2.73), p=0.23 (fig. 3); encontramos una relación inversa en entre el IMC>25kg/m2 y la presentación de PSA<20ng/ml (OR: 1.14; IC95%: 0.62-1.36), p=0.36 (fig. 3). Así, al evaluar a pacientes con IMC>25kg/m2 y PSA>20ng/ml se encontró una asociación negativa (OR: 0.87; IC95%: 0.50-1.76), p=0.35 (fig. 3). Al clasificar a los pacientes por EC cT identificamos que no existe una diferencia significativa entre IMC y EC cT (OR: 0.89, IC95%: 0.22- 1.8), p=0.15 (fig. 3), lo que podría estar en relación con la dificultad de establecer el diagnóstico al momento de realizar el tacto rectal en pacientes obesos, como se ha mencionado de manera anecdótica. De manera global, al analizar el IMC encontramos resultados que parecen indicar aumento de riesgo en la severidad de la enfermedad a pesar de ser una asociación débil, pero como se mencionó antes confiere cierto riesgo.
DiscusiónEl riesgo de CaP y obesidad se ha evaluado en varios estudios, mostrando resultados mixtos9–12. Veierod et al.9, Engeland et al.10, Andersson et al.11 y Putnam et al.12 han demostrado un aumento en el riesgo de CaP en pacientes con sobrepeso y obesidad, aunque algunas de estas asociaciones fueron débiles. Sin embargo, otros estudios prospectivos realizados por Schuurman et al.13, Macinnis et al.14, Nilsen et al.15 y Rodríguez et al.16 no encontraron correlación entre CaP y un IMC elevado, a diferencia de nuestro estudio, donde sí encontramos una asociación positiva (OR: 1.027; IC95%: 0.78-1.30), p=0.46. Recientemente un estudio realizado por Giovannucci et al.17 encontró una relación inversa entre obesidad y riesgo de CaP, pero solo para aquellos hombres <60años o aquellos con antecedentes familiares de CaP en primer grado. Debido a estos resultados conflictivos, Macinnis et al.14 realizaron un metaanálisis con una población de 55,521 pacientes, tomando en cuenta variables independientes; IMC>25kg/m2 se relacionó con un aumento en el riesgo de CaP (RR: 1.05; IC95%: 1.01-1.08) por cada aumento de 5kg/m2. Tomando en cuenta aquellos estudios que reportaran resultados por estadio de enfermedad, la relación fue mayor para aquellos con enfermedad localmente avanzada que en aquellos con enfermedad clínicamente localizada (RR: 1.11; IC95%: 1.01-1.23, y(RR: 0.96; IC95%: 0.89-1.03, respectivamente). La cintura como variable independiente mostró un resultado positivo (RR 1.05; IC95%: 1.02-1.09) por cada 10cm de incremento, pero la evidencia fue menor para el peso (RR: 1.01; IC95%: 0.97-1.04). Estos resultados indican una asociación débil pero aun así un riesgo mayor CaP en pacientes obesos, particularmente para aquellos con enfermedad localmente avanzada14. La mayoría de los estudios reportados examinaban de manera global al CaP, sin diferenciar en estadio o grado. Cuando se examina de manera individual por estadio y grado surge un patrón interesante, y específicamente 3 estudios prospectivos han mostrado resultados similares. El primero, realizado por Freedland et al., demostró en 69,991 varones que el IMC se asocia de manera inversa con CaP de bajo riesgo (RR: 0.84; IC95%: 0.66-1.06), pero mostró una correlación positiva en CaP de alto riesgo (RR: 1.22; IC95%: 0.96-1.55) y riesgo de enfermedad metastásica o CaP fatal (RR: 1.54; IC95%: 1.06-2.23). Un dato interesante fue que en aquellos pacientes que perdieron 5kg comparado con aquellos que se mantuvieron en su peso se identificó una disminución de riesgo de CaP de alto riesgo (RR: 0.58; IC95%: 0.42-0.79)18–20. Sin embargo, Gong et al., en el PCLT en 10,258 varones que se sometieron a BTRP, al comparar hombres con IMC<25 con hombres obesos con IMC>30 encontraron una reducción del 18% de CaP de bajo grado (Gleason<7) (OR: 0.82; IC95%: 0.69-0.98) y un 29% de riesgo de CaP de alto grado (Gleason>7) (OR: 1.29; IC95%: 1.01-1.67) en los pacientes con IMC>30, o alternativamente un 78% de riesgo de CaP con Gleason 8-10 (OR1.78; IC95%: 1.10-2.87) en los mismos pacientes21. Esto sugiere que la obesidad se asocia con un riesgo menor de enfermedad de bajo grado pero con un riesgo de enfermedad de alto grado o de enfermedad avanzada. Pueden existir varias razones que hagan la detección de CaP en pacientes obesos más difícil: se ha documentado que los hombres obesos tienden a realizarse menos cribados que los varones no obesos; sin embargo, estudios recientes realizados por Scales et al.21 en 57,827 hombres mayores de 40años demostraron que los hombres obesos se realizaron con más frecuencia el PSA que aquellos con peso normal (62.1% vs 56.1%, p<0.001), así como la mayoría de los hombres obesos tenían al menos un PSA el año previo (44.2% vs 38.2%, p<0.001). Después de realizar un análisis sociodemográfico arrojaron los mismos resultados: los hombres obesos se realizaron el PSA con mayor frecuencia (OR: 1.46; IC95%: 1.33-1.61) y tenían al menos un PSA un año previo, que aquellos hombres con peso normal (OR: 1.42; IC95%: 1.30-1.55)21. Se reporta de manera anecdótica que la realización del tacto rectal en estos pacientes es más difícil que en los no obesos, lo que podría conducir directamente a una tasa menor de diagnóstico de CaP, lo que podría explicar en nuestro estudio la relación con CaP y EC elevado (OR: 0.67; IC95%: 0.27-1.67)5. En tercer lugar, numerosos reportes muestran que el nivel de PSA presenta niveles inferiores en pacientes obesos que en pacientes no obesos. Aunque un estudio reciente realizado por Hutterer et al.22 en 616 pacientes no muestra tal asociación, una posible explicación a esto es el nivel de PSA con una media de 1.0ng/ml, un promedio de IMC de 25.8 (p=0.3). Freedland et al.23 no encontraron asociación entre IMC y el PSA en varones que se someten a prostatectomía radical. Otro factor relacionado al riesgo de CaP avanzado en hombres obesos se ha sugerido que es la presencia de niveles bajos de PSA; existen varias teorías, y una posibilidad es que los hombres obesos tienen niveles bajos de testosterona, provocando una disminución en la producción de PSA, debido a que la producción de este se encuentra sometida al control androgénico, y el PSA que se libera y pasa al suero se encuentra probablemente hemodiluido por un mayor volumen circulante, provocando niveles bajos de este24. Pero independientemente de estas posibles explicaciones, los hombres obesos pueden tener niveles bajos de PSA y subsecuentemente menos probabilidad de someterse a BTRP, llevando a su vez a menos detección de cáncer (fig. 4). Sin embargo, el hecho de que algunos estudios demuestren resultados mixtos, con predominio de que la obesidad se asocia a una disminución de CaP de bajo grado y un riesgo aumentado de presentar CaP de alto riesgo, sugiere que aún existen algunos factores biológicos que no son completamente entendidos.
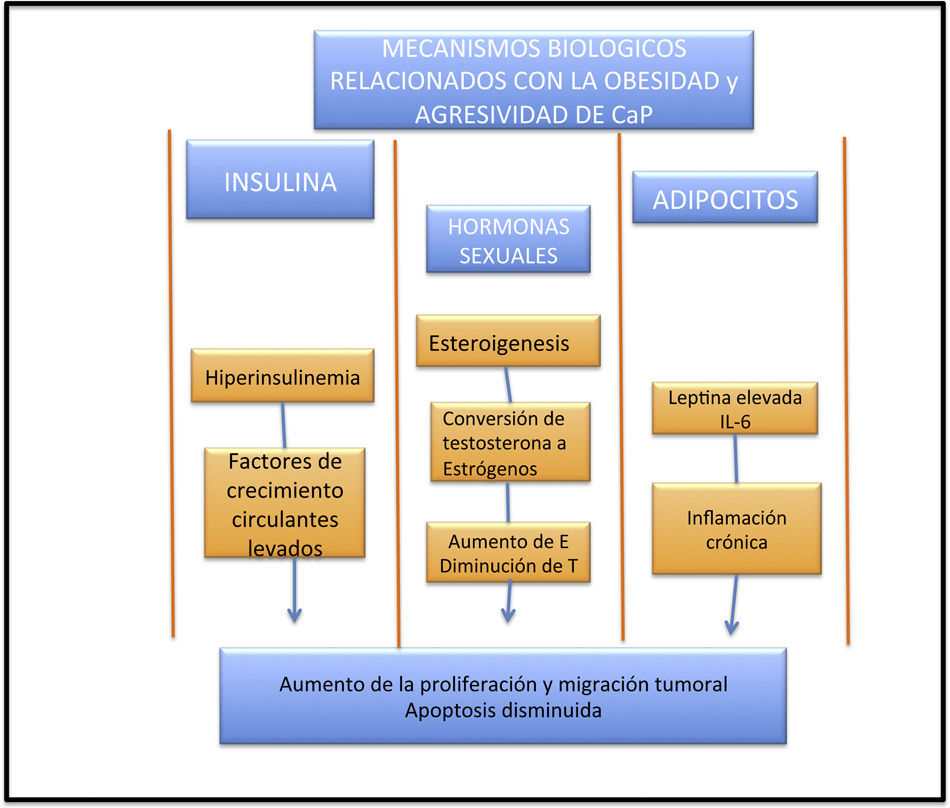
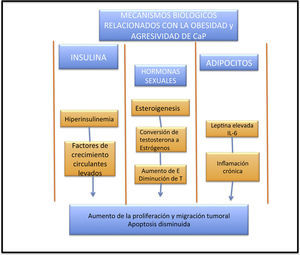
Se han propuesto 3 mecanismos para explicar la asociación de CaP y obesidad25. El eje IGF-1/insulina ha sido implicado en la tumorogénesis, y el CaP no es la excepción. La hiperinsulinemia inducida por la dieta ha demostrado que produce un crecimiento acelerado del tumor en modelos animales, y las células de CaP comúnmente expresan este tipo de receptores, sugiriendo que podría tener un efecto en varones con CaP a través de este mecanismo25. Un estudio realizado por Cox et al.26 demuestra que los niveles elevados de péptidoC se correlacionan con concentraciones elevadas de insulina, lo que se traduce en un riesgo mayor de mortalidad en pacientes con CaP. La obesidad y la hiperinsulinemia se relaciona con niveles de IGF-1 circulantes elevados, lo cual es un factor patogénico reconocido en varios tipos de tumores. Los niveles de IGF-1 han sido ligados en un reciente metaanálisis realizado por Renehan et al.27, en que se encontró un mayor riesgo de presentar CaP (RR: 1.49; IC95%: 1.14-1.95) en pacientes con IGF-1 elevados. Sin embargo, en el estudio más grande hasta la fecha, realizado por Rowlands et al.28 y que incluye 110,000 pacientes, tomando solo como variable el PSA no se encontró una relación con niveles de IGF-1 elevados (RR: 0.99; IC95%: 0.93-1.04), p=0.62. Una posible explicación a estos resultado contrastantes con el IGF-1 es que tal vez juegue un rol en la progresión a enfermedades clínicamente palpables. En relación a esto, puede ser que el IGF-1 se encuentre asociado a CaP de alto grado y tumores agresivos, y no a tumores indolentes que solo son detectados a través del PSA (fig. 1).
La obesidad se relaciona con niveles bajos de andrógenos. Estos juegan un papel importante en el crecimiento y desarrollo prostático, pero existe un gran debate en la influencia de los andrógenos y el CaP. Roddam et al.29 no encontraron en su metaanálisis una relación causal entre los niveles de hormonas endógenas y el riesgo de CaP (RR: 0.86; IC95%: 0.75-0.98), p=0.01. Morgentaler30 demostró que los varones de mayor edad presentan CaP agresivo, y estos hombres tienden a tener niveles de testosterona bajos. A pesar de todos estos resultados, el mecanismo preciso por lo cual ocurre esto aún es desconocido. La obesidad produce inflamación subclínica crónica mediada a través de adipocinas. La leptina se encuentra elevada en pacientes obesos y produce una actividad pro-tumoral, la cual afecta a las líneas celulares del CaP, induciendo proliferación, inhibiendo la apoptosis e incrementando la migración de estas. En contraste con esto, la adiponectina se encuentra disminuida de manera importante en pacientes con CaP metastásico versus aquellos con CaP localizado. Un estudio prospectivo realizado por Li et al.31 demostró que niveles elevados de adiponectina predisponen a un menor riesgo de presentar CaP de alto grado (RR: 0.25; IC95%: 0.07-0.87, p=0.02), así como a una menor mortalidad (RR: 0.39; IC95%: 0.17-0.85), p=0.02. La obesidad se encuentra asociada a la elevación de varias interleucinas, en especial la interleucina-6, cuya fuente principal de producción es el tejido adiposo. Las células de CaP producen interleucina-6 y expresan su receptor, permitiendo que respondan de una manera pleiotrópica, proinflamatoria y de manera autocrina en pacientes con CaP, y se ha llegado a establecer una relación con la progresión de la enfermedad. Existen un sinnúmero de alteraciones metabólicas en relación con la obesidad y el CaP, y hay un gran trabajo por hacer para dilucidar por completo el vínculo entre obesidad y CaP32–33.
ConclusiónLa asociación epidemiológica entre obesidad y CaP, en particular CaP agresivo, es un tema muy interesante debido a la importancia y relevancia de ambas enfermedades y al gran número de hombres afectados. Más allá de la edad, de la historia familiar y de la raza existen pocos factores de riesgo bien establecidos para CaP. Es por eso que la identificación de algunas características en los pacientes obesos con CaP podría ser importante para determinar qué pacientes podrían presentar un CaP más agresivo. En el presente estudio pudimos identificar una relación entre sobrepeso y obesidad con el riesgo de CaP agresivo (D’Amico alto riesgo). Los pacientes con sobrepeso y obesidad tienen un PSA más bajo que aquellos pacientes con peso normal, lo que explica un retraso en el diagnóstico y presentarse de inicio una enfermedad más avanzada. Observamos que los pacientes con sobrepeso y obesidad tienden a tener un Gleason mayor, y a su vez estos pacientes presentan más comorbilidades asociadas, lo que puede empeorar el pronóstico de forma independiente. Nuestro estudio no se encuentra libre de limitaciones, ya que no todos nuestros resultados fueron estadísticamente significativos. Encontramos un aumento sutil entre CaP agresivo e IMC elevado, por lo que sugerimos que deben realizarse más estudios prospectivos para validar estos resultados. Al paso del tiempo, tendremos un mejor entendimiento etiológico de los mecanismos ligados al CaP agresivo y la obesidad, lo que nos permitirá tomar mejores decisiones preventivas y terapéuticas en todos los hombres con CaP con sobrepeso y obesidad.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.