El cáncer de vejiga es la neoplasia maligna más común del tracto urinario. El 75% son tumores no invasores y 25% son invasores. La recurrencia y progresión es de 50%–70% y 10%–15% a 5 años, respectivamente; el 60% mueren a 5 años a pesar del tratamiento.
ObjetivoDeterminar si los nomogramas predictivos publicados para cáncer de vejiga, pueden ser aplicados de manera certera en nuestra población.
Material y métodoSe analizaron los expedientes con diagnóstico de cáncer de vejiga del 2007–2013 y se aplicaron 6 diferentes nomogramas de cáncer de vejiga. Se compararon los resultados predichos por el nomograma y la evolución del paciente.
ResultadosSe incluyeron sesenta pacientes con cáncer de vejiga. El 36% con tumores invasores y 64% superficiales. Doce pacientes tuvieron recurrencias en seguimiento con promedio a 3.3 años, y el nomograma predijo una recurrencia a 5 años de 52%. Se predijo una progresión de 17% a 5 años, y en nuestros pacientes se presentó en 22%. La sobrevida global según el nomograma era de 70% a 5 años, y en nuestra serie hubo mortalidad de 4.5% a 3.1 años.
DiscusiónLos nomogramas estudiados parecen no funcionar de manera exacta dentro de esta población, lo cual puede ser por diferencias étnicas, en las etapas clínicas iniciales y en el acceso a la salud o por tratarse de un estudio retrospectivo.
Bladder cancer is the most common neoplasia of the urinary tract. Seventy-five percent of the tumors are noninvasive and 25% are invasive. There is a 50%–70% recurrence and progression rate, and at 5 years it is 10%–15%. Sixty percent of the patients die after 5 years despite treatment.
AimsTo determine whether the published predictive nomograms for bladder cancer are accurate for the Mexican population.
MethodsThe case records of patients diagnosed with bladder cancer within the time frame of 2007–2013 were analyzed and 6 different bladder cancer nomograms were applied. The predictive nomogram results were compared with patient progression.
ResultsSixty patients were included in the study; 36% presented with invasive tumors and 64% with superficial tumors. Twelve of the patients had recurrence during the follow-up at a mean of 3.3 years. The nomogram predicted a recurrence rate at 5 years of 52%. The disease progression prediction at 5 years was 17% and in our patients it was 22%. The nomogram predicted an overall survival of 70% at 5 years and in our case series, there was a 4.5% mortality rate at 3.1 years.
ConclusionsThe nomograms studied do not appear to function with precision within the population studied, which may be due to ethnic differences, dissimilarity in the initial clinical stages and in the access to healthcare, or due to the retrospective study design.
El cáncer de vejiga es la neoplasia maligna más común del tracto urinario, siendo el séptimo cáncer más común en los hombres y el número 17 en las mujeres. La incidencia mundial es de 9 por cada 100,000 hombres y de 2 por cada 100,000 mujeres1. En Latinoamérica, el cáncer de vejiga tiene una incidencia de 5.6 por cada 100,000 habitantes; en México corresponde al 14.4% de los cánceres genitourina-rios, ubicándose como el cuarto más frecuente2. La mortalidad en varones es de 3 por cada 100,000 y en mujeres de 1 por cada 100,000 con muy alta variación geográfica debido al acceso desigual a los servicios de salud1. La incidencia del cáncer de vejiga y la mortalidad han descendido en los últimos años debido a la disminución en la exposición a los agentes causales como el tabaquismo y a la mejoría en los sistemas de salud3–5.
El tabaquismo es el factor de riesgo más importante para el cáncer de vejiga, encontrándose presente en el 50% de los casos6,7. El tabaco contiene aminas aromáticas e hidrocarburos policíclicos aromáticos que se excretan vía renal. La exposición ocupacional a las aminas aromáticas, hidrocarburos policíclicos aromáticos y los hidrocarburos clorinados, corresponde al 10% de los casos de cáncer de vejiga y se presenta en la industria de la pintura, metales y petróleo8. Otros factores de riesgo para el desarrollo de cáncer de vejiga incluyen la exposición a radiación ionizante, uso de ciclofosfamida y pioglitazona, así como por esquisto-somiasis3.
Aproximadamente 75% de los pacientes se presentan con cáncer de vejiga confinado a la mucosa (Ta, CIS) o submucosa (T1), que se agrupa en una categoría conocida como cáncer de vejiga no músculo-invasor3.
Los tumores no músculo-invasores pueden ser manejados con resección endoscópica transuretral y terapia intravesical con BCG. La recurrencia de estos tumores es de 50%–70% y el riesgo de progresión de 10%–15% a 5 años8–10. De los pacientes con tumores músculo-invasores, hasta 50% de ellos tienen metástasis a distancia dentro de los primeros 2 años, y 60% mueren a 5 años a pesar del tratamiento11,12. La progresión de la enfermedad a un estado metastásico medible ocurre en promedio 1.2 años después de la cistectomía radical, y es fatal en la mayoría de los pacientes a pesar de una alta tasa inicial de respuesta a la quimioterapia11,12.
Es necesario tener una forma de estimar de manera acertada la posibilidad de éxito en los tratamientos, las tasas de complicaciones y la morbilidad a largo plazo, para ofrecer consejo adecuado al paciente y que las decisiones se tomen con la mejor información posible13.
De manera tradicional la toma de decisiones se lleva a cabo basada en la experiencia personal del médico tratante, sin embargo, esta manera no es imparcial y está sujeta a factores subjetivos y objetivos que pueden comprometer la decisión en cada una de las fases del tratamiento14–17.
Para tratar de resolver estas limitaciones y para obtener las predicciones más precisas y confiables, se han desarrollado herramientas pronósticas y predictivas basadas en modelos estadísticos. En general, estos modelos predictivos han demostrado ser equiparables o mejores que el juicio clínico para predecir los resultados de la enfermedad18. Sin embargo, el juicio del médico sigue siendo muy importante para medir las variables que se utilizarán dentro de los modelos predictivos, así como para la interpretación de los resultados y la aplicación de los mismos19.
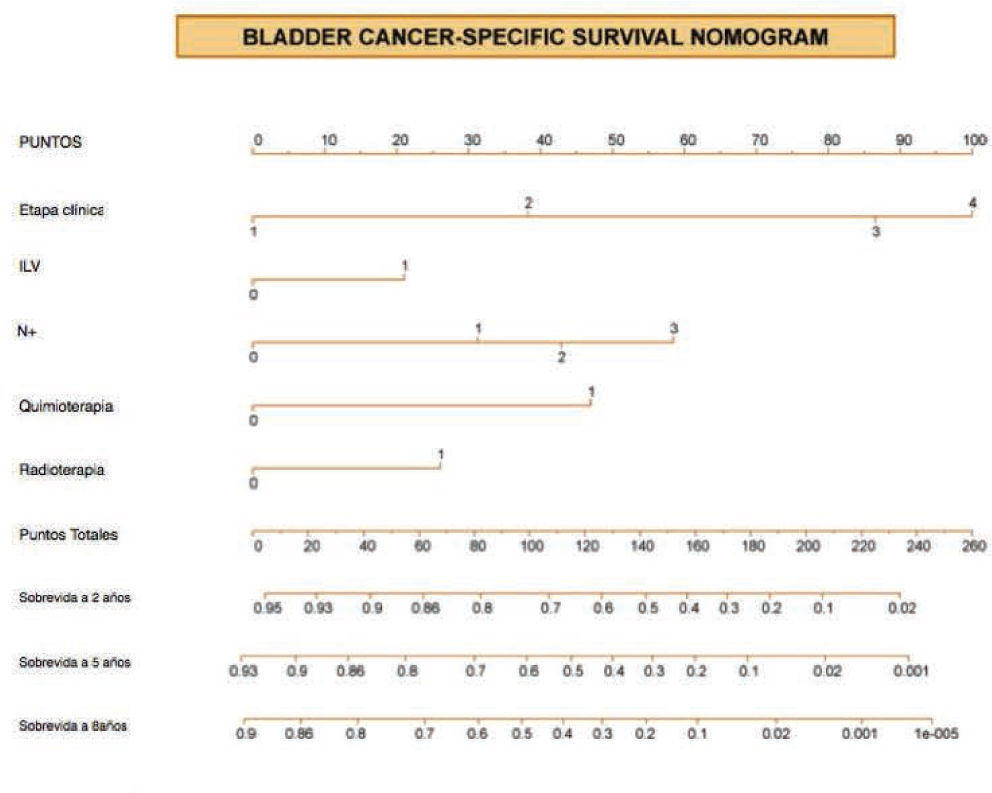
De acuerdo a la definición estricta, un nomograma es un método de cálculo gráfico que puede estar basado en cualquier tipo de función como regresión logística o modelos Cox de regresión20,21. El nomograma usualmente incorpora variables continuas o categóricas. El efecto de las variables en el resultado de interés es representado en forma de ejes, y se le atribuyen puntos de acuerdo a la importancia pronós-tica o predictiva de la variable de interés (fig. 1).
El eje de puntos totales es usado para estimar el efecto combinado de todas las variables en la probabilidad del resultado. El formato del nomograma es único porque permite combinar múltiples variables, ya sea continua o categórica en un solo modelo. El índice de concordancia cuantifica la habilidad del nomograma para identificar entre 2 pacientes escogidos al azar, cuál de ellos va a recurrir primero. Un índice de 0.5 representa que no hay capacidad de discriminar y un valor de 1.0 representa que hay una discriminación perfecta19.
La exactitud predictiva es el valor más importante a estudiar dentro de un nomograma y, ésta debe de ser evaluada y validada de manera externa a la población con la cual se creó el nomograma. Ningún modelo predictivo es perfecto y la exactitud aceptada en general varía de 70% a 80%19.
Un modelo predictivo debe de ser generalizable, ya que las características del modelo y del paciente pueden variar, y en caso de que así sea, la exactitud del modelo disminuirá. Se debe realizar una validación externa con pacientes de características diferentes a las de los pacientes que se utili-zaron para producir el modelo. Antes de usar un nomograma el médico debe decidir si el nomograma se aplica a su paciente, dependiendo de las características usadas22–26. Las limitantes de la generalización de un nomograma pueden estar relacionadas a diferencias en las características de la población, o ser debidas a migraciones de estado o de grado, así como a diferentes criterios de inclusión o exclusión. La mayoría de los nomogramas se crean utilizando poblaciones de un solo centro hospitalario, y por lo tanto pueden no ser aplicables de manera generalizada19.
El primer nomograma para cáncer de vejiga fue publicado en el 200527, en un estudio multinacional, los autores desarrollaron un nomograma que estima el riesgo de recurrencia y progresión en tumores no músculo-invasores, con una exactitud de 0.848 para evaluar la recurrencia de manera generalizada y sentó las bases para el desarrollo de los nomogramas a seguir.
Las herramientas para una adecuada predicción de la evolución de los pacientes con cáncer de vejiga son extremadamente importantes, porque pueden afectar la toma de decisiones en el uso de terapia multimodal. Debido al gran número de modelos predictivos es importante entender los mecanismos bajo los cuales trabajan y, las ventajas y desventajas de cada uno. Desafortunadamente no existen estudios aleatorizados prospectivos que demuestren de manera clara que el uso de nomogramas mejora el tratamiento del paciente, sin embargo, mientras estos estudios no se realicen, los nomogramas son la mejor opción para la toma de decisiones por parte de los médicos y los pacientes28–31.
El objetivo del presente trabajo es determinar si los nomogramas predictivos internacionales publicados para cáncer de vejiga, pueden ser aplicados de manera certera en nuestra población.
Material y métodoSe revisaron los expedientes de los pacientes con diagnóstico de cáncer urotelial de vejiga desde 2003 a 2013, incluyendo pacientes con tumores músculo-invasores y tumores no músculo-invasores. Los datos de estos pacientes se introdujeron en un total de 6 diferentes nomogramas32–35, y se compararon las predicciones que se obtuvieron de los nomogramas con la evolución real del paciente. Se evaluó la recurrencia y progresión a un año y 5 años de los tumores no músculo-invasores, así como el riesgo de enfermedad local-mente avanzada en la cistectomía radical, el riesgo de metástasis ganglionares en la cistectomía radical, el riesgo de recurrencia a 5 años, de mortalidad cáncer-específica a 5 años y la mortalidad total en los tumores músculo-invasores. Se utilizaron medias, medianas y porcentajes para realizar la comparación.
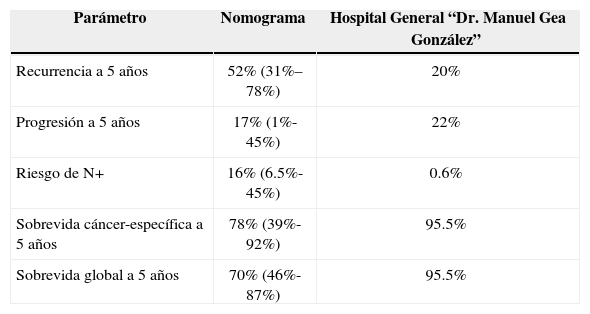
ResultadosSe encontraron un total de 60 pacientes con diagnóstico de cáncer de vejiga, con un promedio de edad al momento del diagnóstico de 62 años; 78% hombres y 22% mujeres. El 36% de los pacientes con tumores músculo-invasores y 64% con tumores superficiales (tabla 1). Un total de 12 pacientes (20%) tuvieron recurrencias durante el seguimiento con tiempo promedio de 3.3 años y 4 de ellos habían recibido BCG, mientras que en promedio el nomograma (EORTC) había predicho una recurrencia a 5 años de 52%. Se predijo una progresión de tumores no músculo-invasores de un 17% a 5 años, y en nuestros pacientes se presentó en 22%. El nomograma de predicción de riesgo de enfermedad localmente avanzada en la cistectomía radical fue acertado cuando el riesgo fue superior a 90%, pero en valores menores a 50% no hubo correlación. La capacidad de los nomogramas para predicción del riesgo de metástasis linfáticas no fueron acertadas, ya que sólo se presentaron metástasis positivas en una paciente a pesar de que el riesgo promedio de enfermedad N+ fue de 16.3%. La sobrevida cáncer específica a 5 años de los pacientes operados calculada por los nomogramas fue de 78% a 5 años y la sobrevida global de 70% a 5 años, mientras que en nuestra serie hubo una mortalidad global y cáncer específica de 4.5% en un promedio de 3.1 años en los pacientes operados (tabla 2).
Resultados comparativos entre nomogramas y nuestra base de datos
| Parámetro | Nomograma | Hospital General “Dr. Manuel Gea González” |
|---|---|---|
| Recurrencia a 5 años | 52% (31%–78%) | 20% |
| Progresión a 5 años | 17% (1%-45%) | 22% |
| Riesgo de N+ | 16% (6.5%-45%) | 0.6% |
| Sobrevida cáncer-específica a 5 años | 78% (39%-92%) | 95.5% |
| Sobrevida global a 5 años | 70% (46%-87%) | 95.5% |
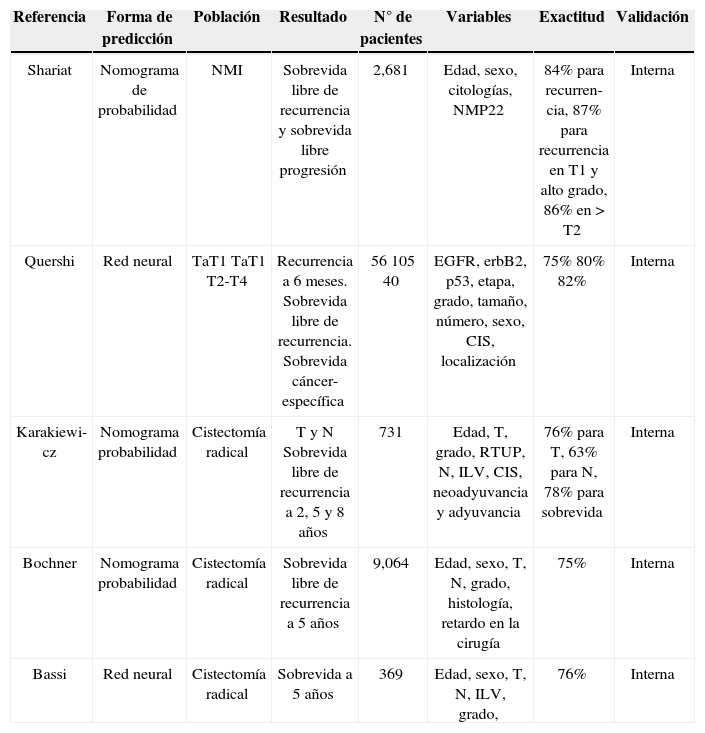
Shariat et al. en el 2005 propuso un nomograma de probabilidad en más de 2,000 pacientes, estudiando la sobrevida libre de recurrencia y la sobrevida libre de progresión con una exactitud del 87%, pero con validación interna única-mente27.
Karakiewickz et al. en 2006 publicó un nomograma de probabilidad en pacientes manejados con cistectomía radical, prediciendo el estado de T y N en el resultado patológico y la sobrevida libre de recurrencia, con una exactitud del 78% y una validación interna29.
Bochner et al. en 2006 publicó un nomograma de probabilidad para pacientes manejados con cistectomía radical en más de 9,000 pacientes con una exactitud del 76% y con validación interna, en el cual se trató de predecir la sobrevida libre de recurrencia a 5 años30.
Bassi et al. publicó el último gran nomograma en 2007, con uno de red neural artificial en 369 pacientes manejados con cistectomía radical evaluando la sobrevida libre de recurrencia a 5 años con una exactitud del 76% y con valida-ción interna31 (tabla 3).
Nomogramas de cáncer de vejiga
| Referencia | Forma de predicción | Población | Resultado | N° de pacientes | Variables | Exactitud | Validación |
|---|---|---|---|---|---|---|---|
| Shariat | Nomograma de probabilidad | NMI | Sobrevida libre de recurrencia y sobrevida libre progresión | 2,681 | Edad, sexo, citologías, NMP22 | 84% para recurren- cia, 87% para recurrencia en T1 y alto grado, 86% en > T2 | Interna |
| Quershi | Red neural | TaT1 TaT1 T2-T4 | Recurrencia a 6 meses. Sobrevida libre de recurrencia. Sobrevida cáncer-específica | 56 105 40 | EGFR, erbB2, p53, etapa, grado, tamaño, número, sexo, CIS, localización | 75% 80% 82% | Interna |
| Karakiewi- cz | Nomograma probabilidad | Cistectomía radical | T y N Sobrevida libre de recurrencia a 2, 5 y 8 años | 731 | Edad, T, grado, RTUP, N, ILV, CIS, neoadyuvancia y adyuvancia | 76% para T, 63% para N, 78% para sobrevida | Interna |
| Bochner | Nomograma probabilidad | Cistectomía radical | Sobrevida libre de recurrencia a 5 años | 9,064 | Edad, sexo, T, N, grado, histología, retardo en la cirugía | 75% | Interna |
| Bassi | Red neural | Cistectomía radical | Sobrevida a 5 años | 369 | Edad, sexo, T, N, ILV, grado, | 76% | Interna |
NMI: no músculo-invasor; EGFR: receptor del factor de crecimiento epidérmico; ILV: invasión linfovascular; RTUP: resección transuretral de próstata; CIS: carcinoma in situ.
Podemos ver así que en la mayoría de los nomogramas publicados sólo se hicieron validaciones internas y con poblaciones muchas veces de un solo centro hospitalario o de una sola región del país32–35. Nuhn et al.36, realizó una validación externa de un nomograma realizado en los Estados Unidos y lo aplicó a una población multinacional y multiinstitucional. En 2,501 pacientes estudiados encontró que los modelos eran aplicables, pero que subestiman las prediccio-nes reales de la misma manera que en nuestro estudio.
La heterogeneidad en las poblaciones de pacientes (ejemplo: diferencias étnicas, raciales, genéticas, ambientales, factores de riesgo), o diferencias en las estrategias interhospitalarias, de médicos tratantes o del protocolo de seguimiento pueden provocar una pobre calibración del nomograma en cuestión. Para poder introducir nomogramas realizados en Estados Unidos y Europa se deben antes de validar y calibrar con diferentes tipos de población, de preferencia de manera prospectiva y con pacientes de todos los grupos raciales y étnicos.
Se debe de considerar también que la mayoría de los no-mogramas aquí estudiados y de los aplicados en la mayoría de los Servicios de Urología del país, no toman en cuenta nuevos factores de riesgo ahora ya reconocidos que pueden impactar el pronóstico del paciente como el tiempo entre el diagnóstico y la cirugía, tamaño tumoral, hidronefrosis, el estatus del margen quirúrgico, número de ganglios removidos y la densidad ganglionar37,38. Los nomogramas no son validos tampoco para tumores no uroteliales por lo que no se pueden aplicar en este tipo de tumores y se deberán de crear nuevos nomogramas que los incluyan. La aplicación de nuevas tecnologías y descubrimientos moleculares se deben de introducir en nomogramas y después a su vez validar los mismos.
Una limitante de nuestro estudio es el carácter retrospectivo y el largo tiempo de estudio de los pacientes, a través del cual ha habido cambios en la estadificación y en las técnicas quirúrgicas realizadas lo que puede cambiar también los resultados. Sin embargo, el propósito de este estudio es reflejar un escenario del mundo real y de la práctica diaria en un servicio de urología en México donde los nomogramas juegan un papel importante para la toma de decisiones.
ConclusionesEn nuestra serie los nomogramas estudiados parecen no funcionar de manera adecuada dentro de esta población, lo cual puede ser por diferencias étnicas en la cual se desarrollaron los modelos, sin embargo también podrían ser por diferencias en las etapas clínicas iniciales y en el acceso a la salud o por tratarse de un estudio retrospectivo, sin embargo, sienta las bases para la necesidad de un estudio de validación prospectivo conjunto o para el desarrollo de modelos de predicción propios y ajustados a la población mexicana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.