• Antecedentes
Los dispositivos de filtración para control de la presión en los pacientes con glaucoma, desde el diseño propuesto por el Dr. Molteno1 hasta los más actuales, presentan varias características básicas comunes, entre las cuales la fundamental se relaciona con la conformación del sistema para lograr extraer el humor acuoso de la cámara anterior hacia el espacio subconjuntival. Esta característica básica es el contar con un plato receptáculo y un tubo de conexión entre la cámara anterior y ocasionalmente a la cámara vítrea2 y dicho plato receptáculo, que habitualmente se coloca en un plano escleral subtenoniano.
La idea fundamental es justamente, que el exceso de presión intraocular sea liberado hacia el dispositivo mediante el tubo que conecta las dos instancias, de ahí que se convierte en una situación de primordial interés que el tubo esté, topográficamente hablando, en una buena ubicación en la cámara que se va a descomprimir y el trayecto se encuentre íntegro en una situación que garantice la no comunicación con el exterior para que no exista la posibilidad de contaminación del dispositivo y se proteja el globo ocular de una eventual infección.
Esta situación se ha intentado lograr mediante técnicas que tienen por finalidad cubrir el trayecto del tubo. Las propuestas han sido tan diversas que se ha practicado la aplicación de esclera de ojo donante o el uso de membranas varias, tales como pericardio heterólogo liofilizado y otras más, para cubrir su trayecto extracamerular, con la intención de mantenerlo aislado del contacto eventual con el exterior y a la vez proteger a la conjuntiva del frote que pudiera originar el tarso superior, durante el parpadeo sobre el trayecto del tubo que corre por debajo de ella.
Esta reparación meramente protectora ocular no tendría mayores problemas si el sistema inmunológico no ejerciera la función para la que fue diseñado y que es, en esencia, identificar, aislar y destruir todas las proteínas que sean ajenas a las originales de la zona.3 El problema reviste una magnitud importante, ya que es factible que al reabsorberse los tejidos aplicados sobre el trayecto del tubo, puede hacer que la conjuntiva que lo recubre se desgaste, adelgace y perfore. La posibilidad de extrusión de los tubos de los implantes en el posoperatorio mediato cuando el recubrimiento se hace con tejidos heterólogos, pudiera llegar a cifras tan preocupantes como de hasta un 5.6%.4
La idea entonces de tratar de no estimular el aparato inmunológico cubriendo el tubo con tejido del propio individuo (autólogo), que minimice las posibilidades de extrusión, surge como una posibilidad para este tipo de cirugía. Ahora bien, ese tejido propio tendría que dejar cubiertas algunas necesidades para ser el idóneo. Algunas de esas necesidades son inherentes a su constitución histológica, como puede ser el tener cierta resistencia a la fricción; no reaccionar fácilmente a la inflamación y que posea una vasculatura propia que garantice evitar la posibilidad de necrosis por isquemia entre otras y, por otro lado, que cubra otros requisitos que son necesarios desde el punto de vista del manejo del propio tejido, como por ejemplo, que no se encuentre en alguna ubicación o estructura anatómica de difícil acceso quirúrgico y que no sea una estructura vital de la zona de donde tendría que ser removida.
Algunos investigadores han propuesto utilizar diversos tejidos, de los cuales, el que más viabilidad podría tener por cubrir la mayor parte de los requisitos antes descritos, sería el tejido aponeurótico, el cual requiere de poco aporte vascular y se encuentra en todos los tendones musculares del cuerpo. La aponeurosis además, no se vería realmente debilitada en su función si se removiera un fragmento pequeño en proporción al tamaño total de la misma pero, la dificultad estriba en que hay que acudir a ella, seguramente en alguna región anatómica lejana al ojo y practicar en la zona elegida, una incisión que involucra obligadamente la piel y el tejido celular subcutáneo; que por seguro ameritará también la cauterización de vasos sangrantes, y que requerirá obligadamente del conocimiento de técnicas de disección y reparación quirúrgica de estructuras anatómicas no oculares.
Todo ese entorno hace que técnicamente sea un problema agregado al implante, que además de alargar el tiempo quirúrgico del procedimiento, va acompañada de agresión a otra instancia anatómica y no solamente al ojo a operar. Una posibilidad más lógica para resolver este problema con tejido autólogo y sin necesidad de acudir a otra instancia anatómica -ya que se encuentra en el mismo ojo, y que puede comportarse tan firme y resistente como la aponeurosis, y que además se encuentra justamente en el trayecto del tubo que debemos de proteger y aislar del exterior, es la esclerótica. No requiere de un soporte extra para su vascularización y en condiciones normales reacciona favorablemente a los materiales biocompatibles como el silicón (de lo que está hecho el tubo de los dispositivos), sin presentar fenómeno inflamatorio de importancia.
La forma más fácil y práctica de utilizar esa esclerótica como protectora del tubo, es practicando una tunelización por la que pase dicho tubo y comunique al cuerpo de los dispositivos con la cámara anterior. La tunelización debe respetar la integridad de la epiesclera al practicarse, ya que es la parte del espesor de la esclerótica que tiene mayor resistencia al frote.5
• Técnica
Debido a las características histológicas de la esclera y a sus relaciones anatómicas hacia la cara interna con la coroides y hacia la cara externa con la Tenon, y a la relación transicional hacia adelante con el limbo, el hacer una tunelización a través de ella resulta sencillo y cómodo, permitiendo en un solo paso y un solo trayecto, comunicar el cuerpo valvular con la cámara anterior.
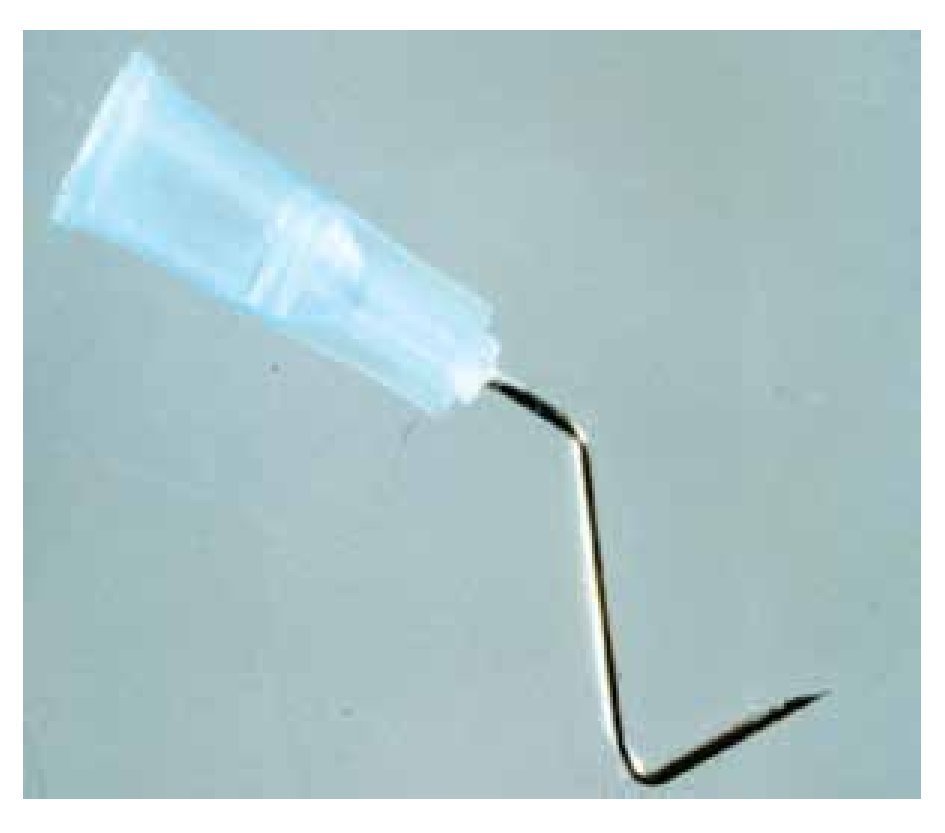
El inicio del túnel debe ubicarse a unos 4 a 6 mm del limbo, utilizando para este procedimiento una aguja hipodérmica calibre N° 23 doblada (Figura 1), conectada a una jeringa con viscoelástico, de tal manera que el abordaje a la esfera ocular sea a la manera de una tangente y no de una secante.
Figura 1. Aguja hipodérmica calibre 23, con los dobleces para tunelizar la epiesclera.
Para lograr esto, se practica un primer doblez en el extremo distal de la aguja, como a unos 6 mm del bisel, el cual tendrá que estar hacia la zona del doblez. La aguja debe doblarse hasta que forme un ángulo agudo con el bisel hacia adentro de unos 60°, justamente para tratar de evitar que la aguja tenga la tendencia a comportarse geométricamente como una secante a la esfera ocular, ya que el bisel tendrá siempre la tendencia a escapar del ojo y no a perforarlo.
Después de este primer paso se practica un segundo doblez cerca del pivote de dicha aguja, en sentido contrario al primer doblez y lo suficiente como para que esta zona de la aguja y la consecuente jeringa a la que tendrá que estar conectada, no obstaculicen visualmente el trayecto mientras se está practicando la tunelización subepiescleral.
La profundidad del túnel en la esclerótica debe ser poca (ya dijimos apenas subepiescleral), ya que la zona más compacta y de mayor resistencia, inclusive al frote, es la epiesclera.5 La tunelización debe ser vigilada y seguida durante su práctica por todo el trayecto hasta el limbo, debido a que si se profundiza demasiado podría provocar una falsa vía a la coroides o cuerpo ciliar. Se aconseja que se vaya observando el trayecto de la aguja por transparencia hasta llegar al limbo. Hasta aquí todo el procedimiento ha sido visualizado fácilmente. En el momento en que se llega a la zona de transición con la córnea (limbo), hay que hacer una corrección en la dirección del túnel ya que el arco de curvatura de la córnea es diferente al de la esfera escleral. En este momento lo que se debe hacer es levantar la jeringa, hasta que se observe que la porción de la aguja que está en el túnel, queda en plano paralelo al iris. Una vez logrado esta posición, se debe perforar el limbo hasta penetrar a la cámara anterior. Debe hacerse notar que el limbo es la zona de mayor resistencia a la tunelización y que penetrar a la cámara anterior, requerirá de una fuerza un poco mayor. Es conveniente, para evitar una entrada muy abrupta, que no se pierda la paciencia y se agregue un poco más de fuerza solamente, para que el bisel de la aguja cumpla su cometido de disecar lateralmente y permitir que en un breve periodo de tiempo la punta de la aguja se visualice en la cámara anterior.
Una vez con el bisel en la cámara anterior hay que procurar introducir todo el bisel para abocardar ligeramente la zona del cambio de dirección del túnel, y permitir que el tubo de silicón pase con menos dificultad a la cámara anterior. En el momento que estamos en la cámara anterior, conviene inyectar un poco de material viscoelástico y al sacar la aguja del túnel, procurar seguir inyectando para que las paredes del plano de disección (túnel) se dilaten y se mantengan un poco más abiertas para poder pasar en su momento el tubo con más facilidad.
El tubo se debe recortar con el bisel hacia arriba en la mayoría de las ocasiones, teniendo muy en cuenta que dicho bisel permanecerá en la cámara anterior y que si estuviera hacia abajo o a los lados, la posibilidad que por gradiente de presión se pueda adherir al iris es mayor. La cantidad de tubo que se debe dejar en la cámara anterior va a depender del paciente y del tipo de glaucoma. En términos generales, debe quedar a 2 o 3 mm del limbo. Nuestra tendencia actual es no dejar el tubo en un plano perpendicular al plano de la pupila sino lo más tangencial posible, por lo que resulta en ocasiones difícil calcular los milímetros a los que se debe cortar el tubo. Una estrategia para calcular esto, es colocar el tubo sobre el limbo siguiendo el trayecto del túnel y medir con un compás, calculando que de la cantidad que midamos va a quedar con un milímetro más en la cámara anterior; dicho de otra manera si medimos 2 mm sobre el limbo, en la cámara anterior realmente quedarán 3 mm del tubo.
Posteriormente, se deberá de proceder a meter el tubo, procurando que la introducción sea lenta y pausada para impedir que el pico del bisel se atore en las paredes del túnel. En el momento en el que la punta del bisel alcanza al limbo, tendrá que acompañar al cambio de dirección que presenta el túnel mismo por lo que pudiera ser conveniente, si este momento se dificulta, deprimir con la otra mano la zona del limbo al mismo tiempo que la mano comandante empuja el tubo hacia la cámara. Esto hará que el bisel encuentre más fácilmente el cambio de la trayectoria.
Una vez visualizado el tubo en la cámara anterior, se debe forzar a introducirlo todo, de tal manera que el trayecto escleral se encuentre sin holguras. El dejar holgado el tubo favorece el movimiento del mismo sobre el túnel y esto a su vez, pudiera hacer que los bordes del túnel se aflojen, quitándole estabilidad al dispositivo, favoreciendo una posible extrusión por movimientos no deseados de dicho tubo sobre el lecho escleral y el recubrimiento conjuntivo-tenoniano.
Estos detalles de la técnica que podrían resultar de primera vista como complicados, en la práctica de los primeros procedimientos realmente muestran su sencillez. Es reconocido por todos los cirujanos que practican nuestra técnica que la curva de aprendizaje es corta, mucho más corta que aquella que implica la aplicación de un injerto para recubrir el tubo y, por supuesto, más corta que la curva de aprendizaje de una trabeculectomía convencional.
De nada sirve que se preconice una técnica si no se muestran los resultados. Basta con mencionar que en nuestra práctica general en el Departamento de Glaucoma del Hospital de la Asociación para Evitar la Ceguera en México, la incidencia de extrusión de tubos en implante de válvula de Ahmed fue del 0.4%, en una serie de 912 casos operados con un seguimiento de más de siete años.6
Existen otros artículos que muestran resultados parecidos con respecto a extrusiones con nuestra técnica, comparada con otros autores que practican injerto de tejido para recubrir el trayecto del tubo.7-9 La técnica de tunelización subepiescleral en estos momentos, cuenta con una gran cantidad de adeptos como técnica básica en los implantes de glaucoma a nivel nacional e internacional, y creo que los resultados a lo largo del tiempo están haciendo que la comunidad glaucomatológica en general, considere que esta variante de inserción del tubo a la cámara anterior es la más segura, simple y barata, sin despertar mecanismos básicos de defensa inmunológica, ni agresión quirúrgica secundaria en otras zonas del organismo, haciendo por lo tanto, que la técnica integral del implante sea más rápida, menos agresiva y más confiable.
Correspondencia:
Vicente García Torres
N° 46, Barrio San Lucas, Delegación Coyoacán,
C.P. 04030, México D.F., México. Teléfono: 1084 1400.
Correo electrónico: fegica@hotmail.com