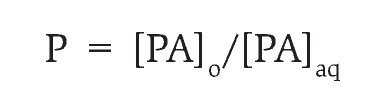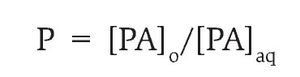¿ Introducción
La biodisponibilidad de los fármacos antiglaucomatosos en solución oftálmica, depende de su capacidad para atravesar la córnea. Para lograr su acción, es necesario alcanzar el sitio de acción en concentración óptima. En el caso particular de medicamentos tópicos oftálmicos, el fármaco debe cruzar barreras hidrofílicas y lipofílicas para alcanzar el tejido blanco. El epitelio corneal y el endotelio son barreras lipofílicas, mientras que el estroma es solamente permeable a compuestos hidrofÍlicos. La permeabilidad a diferentes entidades químicas es mayor si un fármaco presenta regiones hidrofóbicas e hidrofílicas en la misma molécula. Esto es característico de los ácidos y bases débiles, los cuales pueden existir en una forma no iónica soluble en lípidos como en una forma iónica soluble en agua. Además, la renovación continua de la película lagrimal crea un obstáculo importante para prevenir que sustancias químicas de diferente índole penetren al interior del ojo. Este razonamiento permite considerar que los principios activos en soluciones oftálmicas tienen concentraciones altas.1
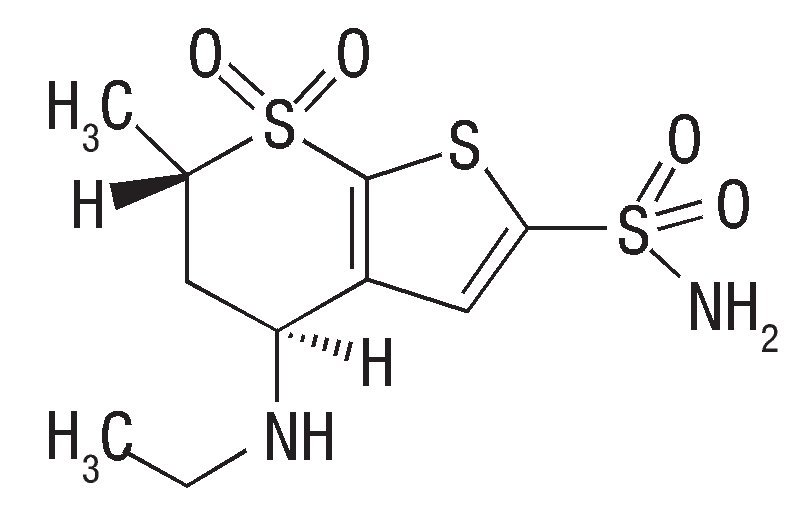
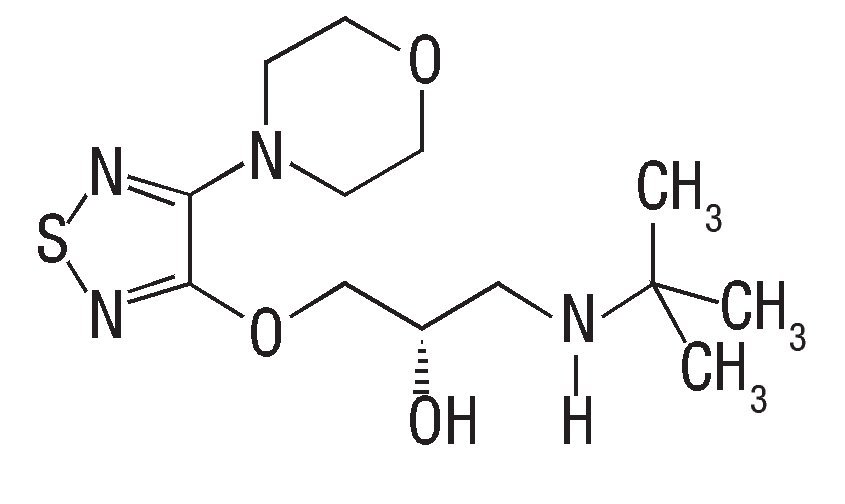
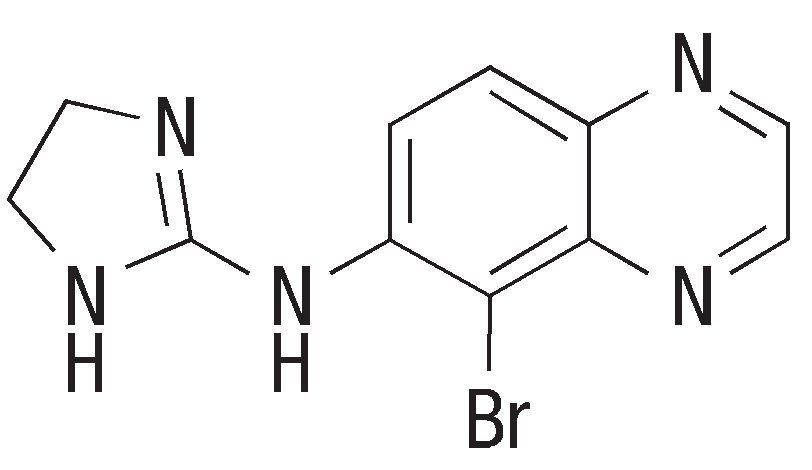
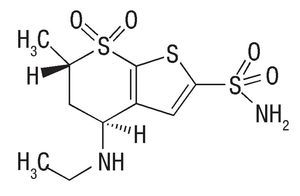
Tanto la dorzolamida, el timolol y la brimonidina son medicamentos hipotensores, comúnmente usados en el tratamiento de la hipertensión ocular y glaucoma. La dorzoalmida ([4S,6S]-2-etilamino-4 -metil-5,5- d ioxo -5λ,7- ditiobiciclo [4.3.0] nona-8,10-di en-8-sulfonamida), es un inhibidor de la anhidrasa carbónica (Figura 1A), que tiene su efecto en la inhibición de la síntesis del bicarbonato y como consecuencia, reduce la formación del HA. En caso del timolol (S)-1-(tert-butilamino)-3-[(4-morfolin-4-il-1,2,5-tiadiazol-3-il)oxi]propan-2-ol), un bloqueador adrenérgico beta (AD-β), reduce la producción del HA mediante el bloqueo de los receptores adrenérgicos en el cuerpo ciliar (Figura 1B). La brimodinina (tartrato de 5-bromo-N-[4,5-dihidro-1H-imidazol-2-il] quinoxalin-6-amina), un agonista selectivo de los receptores adrenérgicos alfa 2 (AD-2α), (Figura 1C), disminuye la síntesis del HA por la reducción del AMP cíclico (cAMP) e incrementa el flujo uveoescleral del mismo.2-4
¿Figura 1A. Estructuras químicas de dorzolamaida.
¿Figura 1B. Estructuras químicas de timolol.
¿Figura 1C. Estructuras químicas de brimonidina.
En oftalmología, la dinámica de cómo un fármaco llega a su blanco terapéutico es un tema controversial, fundamentalmente por la poca accesibilidad para medir las concentraciones en las diferentes estructuras oculares en un paciente, adicional a su mecanismo específico de irrigación sanguínea.
El paso de un soluto a través de una membrana, tiene como limitante la velocidad de difusión en la bicapa lipídica, lo cual está caracterizado por el coeficiente de difusión. Sin embargo, una forma experimental para conocer la concentración de un soluto en una solución acuosa y su compartimiento adyacente, como lo es una membrana, es calcular del Coeficiente de Partición entre dos solventes inmiscibles. El Coeficiente de Partición es la relación entre la afinidad del soluto en un sistema solvente/agua. Un soluto muy polar tendrá un valor de partición muy pequeño, mientras que uno hidrofóbico tendrá valores mayores que la unidad; por lo tanto, la velocidad de difusión de un soluto, depende proporcionalmente de la diferencia de su concentración. Estos datos son importantes durante el diseño de productos de aplicación oftálmica ya que ayuda a predecir su comportamiento al ser aplicado en la superficie ocular.5,4
El glaucoma es una enfermedad ocular caracterizada por un patrón específico con daño del nervio óptico, frecuentemente asociado con el incremento de presión intraocular (PIO).4,7 Este daño al nervio óptico, se traduce en una pérdida gradual y permanente de la visión si no se trata.3,4,7,8 Se ha estimado que hay 60.5 millones personas en el mundo con glaucoma de ángulo abierto (GAA) en 2010, y se incrementará a 79.6 millones en 2020. El beneficio de la reducción de la PIO en pacientes con hipertensión ocular (HTO) y glaucoma ha sido demostrado en múltiples ensayos clínicos aleatorizados.7
Los principales blancos terapéuticos para el tratamiento del glaucoma están relacionados con la inhibición de la producción del HA y el incremento del flujo uveoescleral.3,8
En este trabajo se determinó el coeficiente de partición y la concentración máxima que se logra en el HA de los principios activos contenidos en una solución oftálmica denominada Krytantek Ofteno® (tartrato de brimonidina 0.2%, dorzolamida 2.0% y timolol 0.5%).
¿ Métodos
Para la evaluación del Coeficiente de Partición, se realizó por quintuplicado (n = 5) la determinación de la concentración de los principios activos después de mezclar 15 mL de la solución oftálmica Krytantek Ofteno® y 15 mL de 1-octanol (1:1). Las mezclas fueron agitadas durante una hora exactamente con un agitador mecánico. Después de este tiempo, se permitió la separación de ambas fases, recolectándose fase acuosa (inferior) y posteriormente valorada para cada uno de los activos indicados con anterioridad. La metodología que se utilizó fue desarrollada y validada internamente. La cantidad correspondiente a la fase orgánica fue calculada por diferencia de lo encontrado en la solución madre, que no recibió tratamiento.
En el caso de la evaluación de la concentración de los compuestos en el HA se usaron conejos albinos de la raza Nueva Zelanda, machos, entre dos y 3 kg de peso y edad entre 10 y 15 semanas. El modelo animal fue manejado bajo condiciones controladas de alimentación, ciclos de luz/oscuridad, acorde a las directrices de la Declaración de la Association for Reserach in Vision and Ophthalmology (ARVO) y los lineamientos nacionales (NOM-062-ZOO-1999) para Uso de animales en investigación oftálmica y visual.9.10
El HA fue recolectado mediante paracentesis con jeringas de insulina, las muestras fueron congeladas a -20°C, inmediatamente después de obtenerlas y almacenadas de esta manera hasta su análisis. Las muestras fueron analizadas por cromatografía líquida de alta resolución (HPLC). El aparato utilizado fue un Agillent 1100 con un detector de arreglo de diodos a una longitud de onda de 254 nanómetros (nm) para brimonidina y dorzolamida y 295 nm para timolol. La columna fue una Zorbax Extend C-18, con dimensiones de 4.6 x 250 milímetros (mm) y un tamaño de partícula de cinco micras (μ). La fase móvil consistió en una mezcla de acetonitrilo y amortiguador de fosfatos en una proporción 44/56. El amortiguador contenía lauril sulfato de sodio (SDS) 5 miliMolar (mM), acidificado con ácido fosfórico a un pH de 2.50. El volumen de inyección fue 20 microlitros (μL) de muestra y el automuestreador se mantuvo a temperatura de 5°C.
El instrumento de prueba fue una solución oftálmica comercialmente conocida como Krytantek Ofteno®, fabricada por Laboratorios Sophia, la cual fue aplicada sobre la córnea en dosis única de 30 μL. De acuerdo con la concentración de cada uno de los principios activos en el producto, las cantidades totales aplicadas fueron: 0.60 mg de dorzolamida; 0.15 mg de timolol y 0.06 mg de tartrato de brimonidina. Los tiempos estudiados fueron 15, 30, 60, 90, 120 y 180 min con n = 10 para cada uno de los tiempos.
¿ Resultados
Coeficiente de partición: El coeficiente de partición fue determinado con la siguiente ecuación:
En la que [PA]o es la concentración del fármaco en la fase orgánica y [PA]aq corresponde a la concentración del fármaco en la fase acuosa.6,11
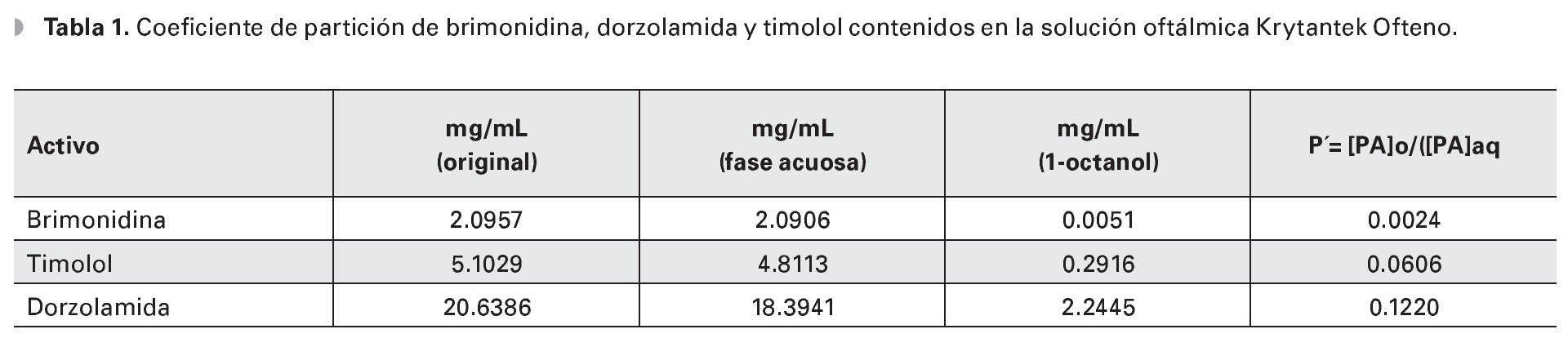
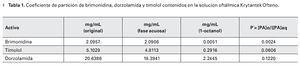
Los resultados señalan que los tres compuestos son altamente solubles en soluciones acuosas en el orden brimonidina>timolol>dorzolamida (Tabla 1). Por ello se prevé que después de la aplicación oftálmica la solución se integrará a la película lagrimal y el transporte de los principios activos a través de la córnea dependerá de la concentración, el vehículo que contiene a los fármacos y el pH.
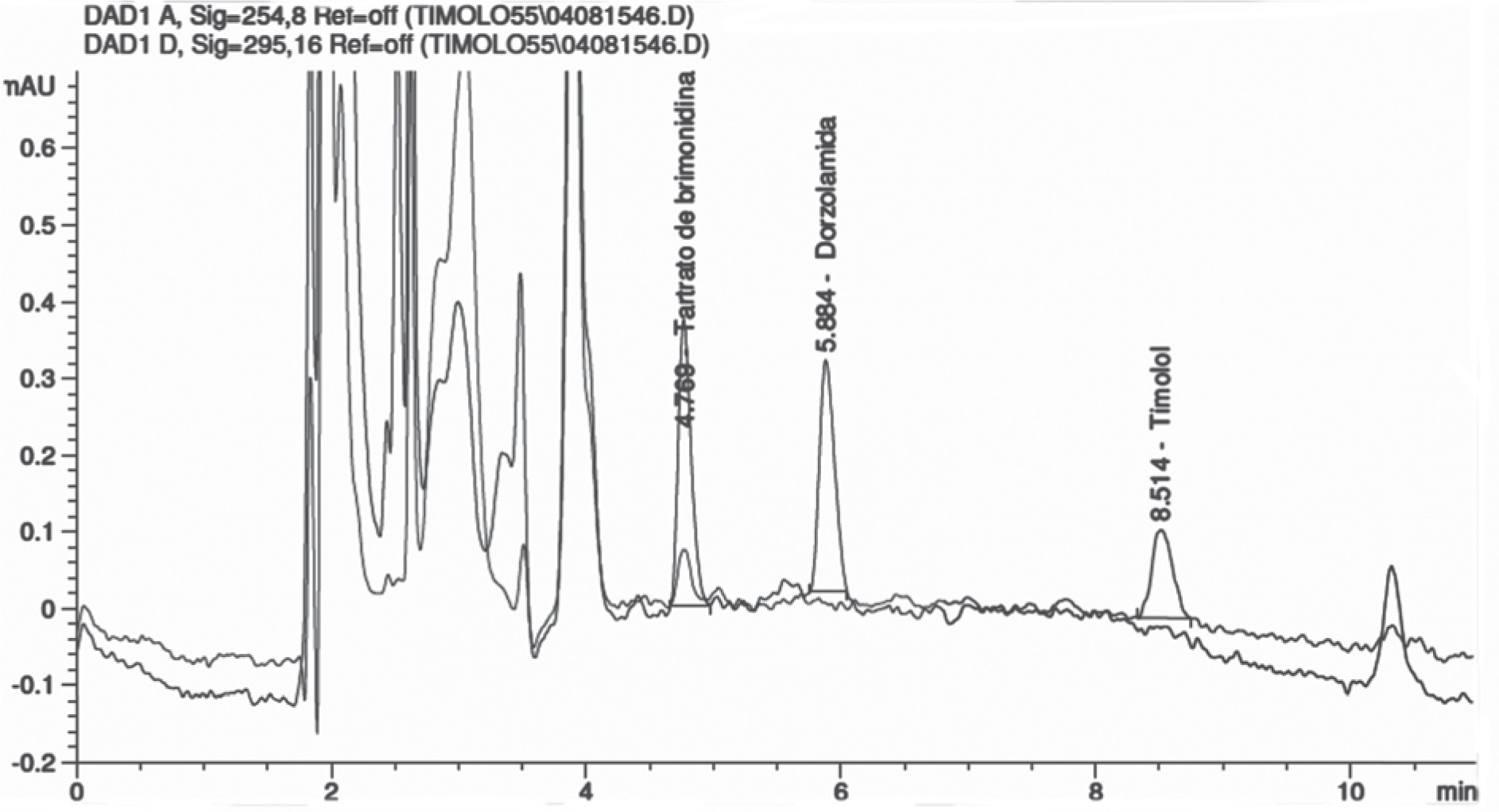
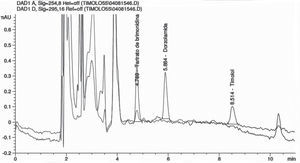
Un cromatograma tipo, obtenido para la determinación de los tres principios activos en el HA se muestra en la Figura 2.
¿Figura 2. Cromatograma tipo obtenido por HPLC de los principios activos determinados en el humor acuoso. Se muestra a los 4.7 minutos el pico correspondiente a Tartrato de Brimonidina, a los 5.8 minutos el pico de Dorzolamida y a los 8.5 minutos se muestra el pico de Timolol.
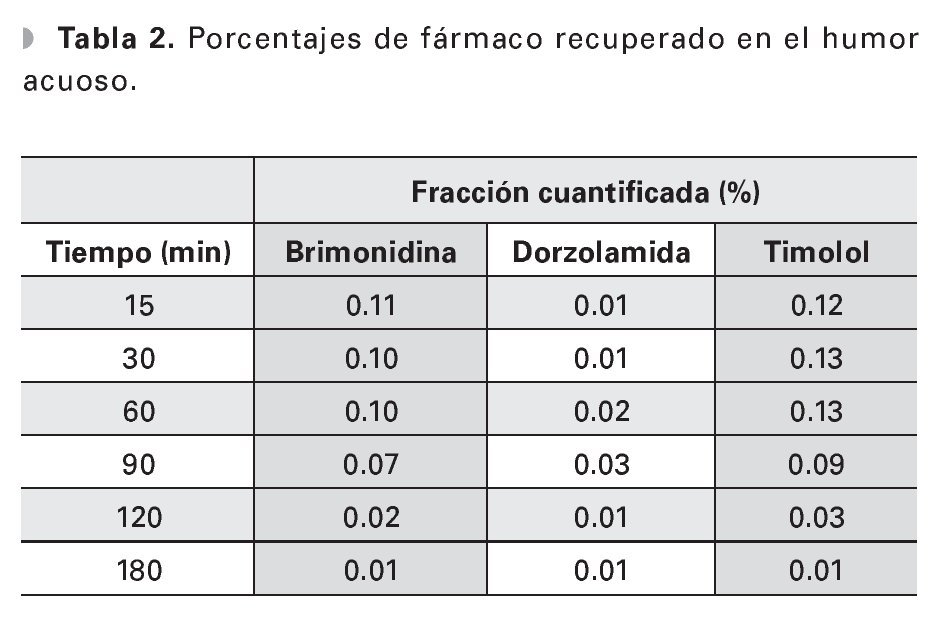
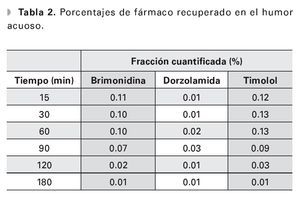
Los datos de la fracción absorbida expresada en porcentaje recuperado con respecto a la cantidad instilada para cada fármaco en 30 μL y considerando un volumen promedio de HA de 250 μL se muestra en la Tabla 2.
Fracción cuantificada % =
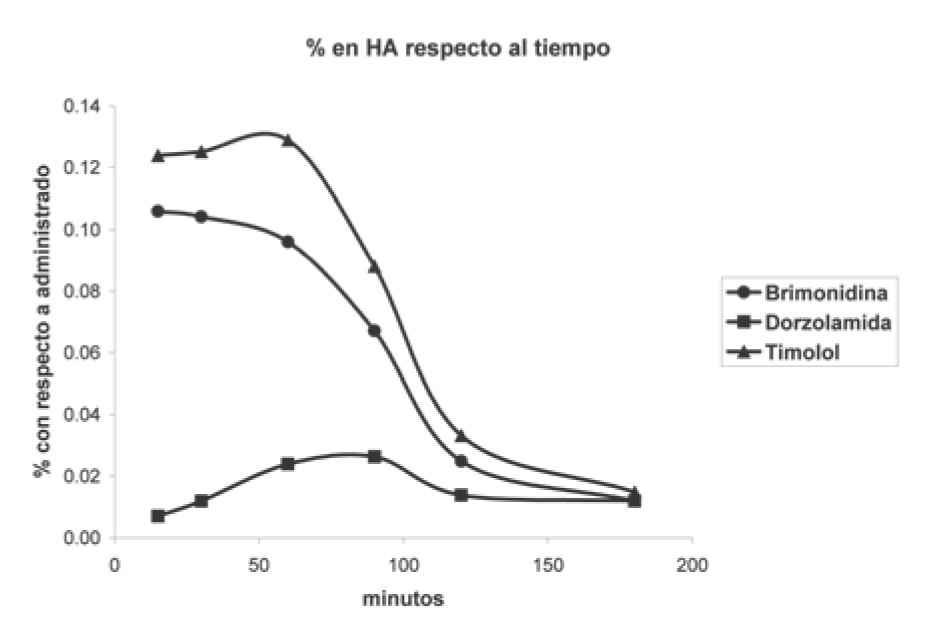
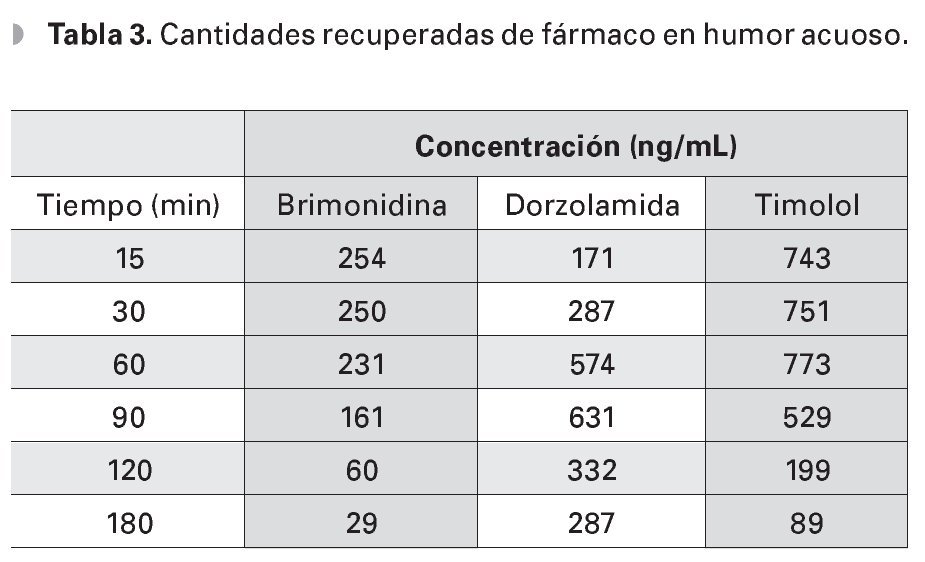
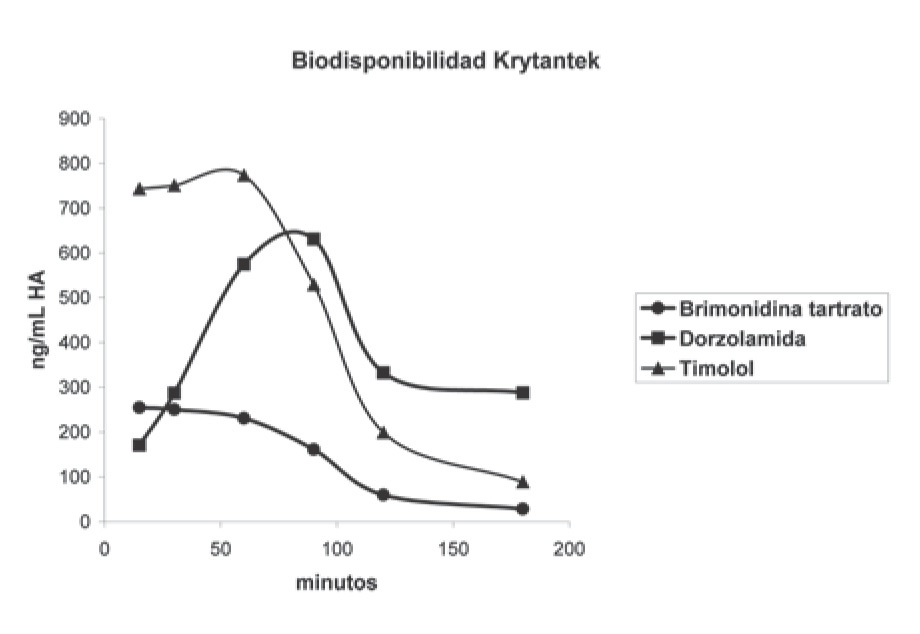
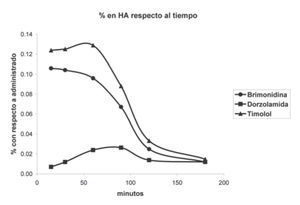
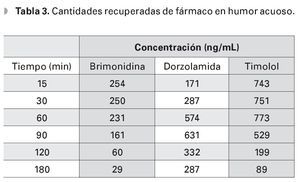
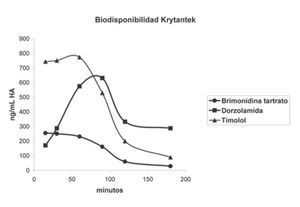
En la Figura 3 se muestra el porcentaje recuperado de los principios activos en función de la cantidad total administrada con respecto al tiempo. En la Tabla 3 y la Figura 4 se muestra la concentración de los activos con respecto al tiempo expresado en ng/ml de HA.
¿Figura 3. Fracción recuperada en % en tiempos específicos de los fármacos provenientes del Krytantek Ofteno® después de la instilación única en la superficie corneal.
¿Figura 4. Abundancia relativa de cada fármaco en el humor acuoso con respecto al tiempo posterior a la instilación de un volumen fijo de Krytantek Ofteno®.
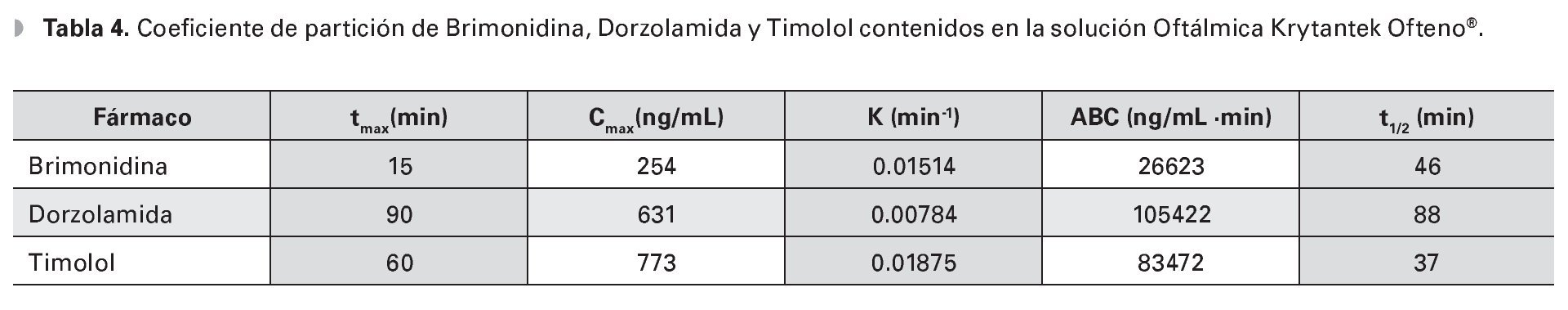
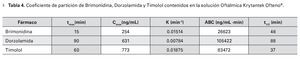
Cálculo de parámetros farmacocinéticos: Con base en los datos previos, se calcularon diferentes parámetros farmacocinéticos, los cuales se muestran en la Tabla 4, en donde tmax (min) indica el tiempo donde se logra la concentración máxima y su cálculo corresponde a datos interpolados de la gráfica; Cmax (ng/mL) indica la concentración máxima alcanzada en el HA y su cálculo corresponde a datos interpolados de la gráfica; K (min-1) indica la constante de eliminación del compuesto considerando las ecuaciones para un sistema de un solo compartimento y primer orden de reacción y t1/2 (min) indica el tiempo en minutos de vida media para los fármacos, considerando las ecuaciones para un sistema de un solo compartimento y primer orden de reacción, ABC (ng/mL·min) indica el área bajo la curva que entrega una medida de la cantidad y el tiempo que un fármaco permanece en el tejido considerando las ecuaciones para un sistema de un compartimiento y primer orden de reacción.
¿ Discusión
Con base a los resultados de este estudio, podemos observar que los tres fármacos en la combinación fija son capaces de pasar a través de la córnea hasta el humor acuoso. La concentración relativa de cada uno dependerá de diversas variables como: la concentración de los principios activos, el pH y la composición del vehículo. Se determinó la vida media de los activos, los cuales fueron 46, 88 y 37 minutos para brimonidina, dorzolamida y timolol respectivamente. Se puede observar que la brimonidina es un fármaco que pasa rápidamente logrando una concentración máxima a los 15 minutos, seguido de timolol a los 60 minutos y finalmente dorzolamida, a los 90 minutos. Como se ha demostrado por este grupo de investigación, esta combinación tiene un efecto clínico importante disminuyendo la PIO en pacientes mexicanos.7 Se determinó el porcentaje biodisponible de cada uno de los fármacos en el humor acuoso con valores de 0.1% para el caso de la brimonidina, 0.03% para el caso de la dorzolamida y 0.13% para el timolol. Estas diferencias se dan por los diferentes coeficientes de partición, propiedades fisicoquímicas y el efecto del vehículo que las contiene. Podemos concluir que los tres principios activos que contiene Krytnatek Ofteno® tienen un mecanismo de reacción de primer orden en su paso desde la superficie corneal hasta el humor acuoso.
¿ Conclusión
Con base en los resultados de este estudio, podemos observar que los tres fármacos en la fórmula de Krytantek Ofteno® son biodisponibles. Además se concluye que los tres principios activos que contiene Krytantek Ofteno®, tienen un mecanismo de reacción de primer orden en su paso desde la superficie corneal hasta el humor acuoso y su biodisponibilidad es consistente con su efectividad clínica.
Correspondencia: Paseo del Norte 5255 Guadalajara, Technology Park, Zapopan Jalisco, CP 45010.
Teléfono: 00521 (33) 3001 4200, ext. 1126.
Correo electrónico: invesmol@sophia.com.mx.