¿ Introducción
El glaucoma durante el embarazo representa una eventualidad clínica muy rara, por lo que plantea problemas notables desde el punto de vista terapéutico y constituye un pequeño reto incluso para el especialista más experto.1-4 Por otro lado, la angustia y preocupación asociadas al uso de medicamentos por parte de la futura madre, contribuyen a que la cuestión se complique todavía más. El problema será todavía más evidente en el futuro, a causa de la tendencia por parte de las nuevas generaciones a postergar el embarazo.5-10
En este artículo hemos querido examinar los aspectos que caracterizan a este viejo dilema, proporcionando una serie de indicaciones que nos parecen útiles para afrontar mejor este tipo de casos.
¿ Hipertensión ocular y embarazo
Muchos estudios coinciden en observar una disminución mínima de los milímetros de mercurio en la presión intraocular (PIO) durante el embarazo, mientras que según algunos autores tal eventualidad se mantendría durante los nueve meses; otros consideran que sólo se daría durante los últimos cuatro o cinco, aunque también proseguiría bastante tiempo después, durante el período del posparto.1,10-13
Dado que tal situación favorable se reduce lentamente tras el parto, es necesario controlar la PIO con frecuencia.11
Se ha propuesto un amplio abanico de hipótesis para explicar este comportamiento de la PIO, como por ejemplo el incremento del flujo (también uveoscleral), determinado probablemente por modificaciones hormonales. De hecho, el aumento de los niveles de progesterona podría estar relacionado con el de la PIO.
Otro mecanismo sugerido contempla la reducción de la presión venosa epiescleral asociada a la disminución general de la misma a nivel de las extremidades superiores durante el embarazo. La producción de líquido, en cambio, parece constante a lo largo de todo este periodo. Por otro lado, la acidosis metabólica presente en el embarazo también podría explicar la reducción de la PIO.
Distinto es el caso del glaucoma agudo o de ángulo estrecho, que lógicamente precisa un tratamiento paraquirúrgico como la iridectomía, de casi total seguridad y que se puede realizar previamente al embarazo, aunque hasta la fecha sólo se ha documentado un único caso durante el parto, en una paciente con probables crisis subagudas no diagnosticadas previamente.14
Así, las mujeres embarazadas con glaucoma de ángulo abierto preexistente, a menudo experimentan una disminución de la PIO durante este periodo; a pesar de ello, a veces es necesario suministrar igualmente una terapia y entonces el problema radica en qué fármaco elegir.15-19
¿ Epidemiología del glaucoma en el embarazo
Por los escasos estudios que han analizado la prevalencia del glaucoma en sujetos menores de 40 años, a partir de las observaciones efectuadas en los países escandinavos (en las ciudades de Halsingland en 1981 y en Goteborg en 1976), se calcula que el porcentaje está entre 0% y 0.02%, con un ligero predominio del sexo femenino que, sin embargo, no se ha evidenciado en todas las poblaciones examinadas.19,20 El glaucoma juvenil de ángulo abierto, sería el tipo predominante entre las mujeres en edad fértil;5 resulta difícil extrapolar de estos datos un porcentaje fiable de los casos de cualquier tipo de glaucoma durante el embarazo, por lo que sería necesario realizar más estudios al respecto.
¿ Gestión del glaucoma en el embarazo y durante la lactancia
Implantar cualquier tipo de terapia durante el embarazo, representa siempre un hecho de extrema dificultad, ya sea por las implicaciones psicológicas vividas por la mujer respecto a los daños potenciales sobre el feto (algunas mujeres llegan, de hecho, a rechazar incluso la cafeína, los edulcorantes artificiales u otros alimentos sin ningún tipo de prueba científica que confirme su peligrosidad, incluyendo obviamente a todos los fármacos considerados como "enemigos públicos número uno"), ya sea por los riesgos substanciales y reales a los que el mismo feto puede verse realmente expuesto, como en el caso de la talidomida.
Lamentablemente, sin duda se ha observado que hay muy pocos datos respecto al uso de fármacos antiglaucoma durante el embarazo; los datos resultan aún menos concretos si tenemos en cuenta el periodo de la lactancia.
Parece claro que la causa principal de tal carencia deriva evidentemente de la imposibilidad de efectuar, por obvios motivos éticos, estudios controlados en mujeres embarazadas o puérperas: los únicos datos reportados relacionados con este tema pertenecen a mujeres que se han sometido a la terapia porque desconocían su estado, o porque no consultaron a un oculista durante su embarazo.
Desde el momento en que el suministro tópico determina en cada caso una absorción sistémica del fármaco, la barrera hematoplacentaria puede ser atravesada por esta sustancia con todo lo que conlleva en términos de teratogénesis.
Por lo tanto, sería oportuno valorar cuidadosamente en cada caso, el riesgo/beneficio o evitar terapias durante el primer trimestre (es decir en el momento de la diferenciación de los órganos internos y de los miembros), a pesar de que a menudo esto no sea posible puesto que el embarazo puede pasar inadvertido incluso hasta el segundo o el tercer mes en mujeres con ciclos menstruales irregulares.
Los datos acerca del riesgo teratógeno por fármacos antiglaucomatosos tópicos en el ser humano son, sin embargo, muy escasos, y los que se han obtenido sobre animales, a menudo pueden no ser fidedignos, tanto para bien como para mal, como el ejemplo de la talidomida, no teratógena para ratas y ratones en hasta cuatro veces la dosis eficaz para el ser humano.21-23
Los compuestos liposolubles con un peso molecular menor de 700 dalton pasan fácilmente a la circulación fetal; si consideramos que la mayoría de los fármacos antiglaucomatosos se administran a la mitad de dicho valor, la naturaleza del problema resulta evidente. Por otro lado, los fármacos serán excretados por los riñones en el líquido amniótico deviniendo, por consiguiente, nuevamente ingeribles y reabsorbibles, con un incremento de la exposición fetal.
Puesto que muchas sustancias son expulsadas por la leche materna en concentraciones más o menos similares a las del plasma, incluso durante el periodo postparto, es preciso prestar extrema atención al suministro de fármacos antiglaucomatosos, si bien los datos publicados al respecto son contradictorios.
Una encuesta llevada a cabo recientemente en Gran Bretaña (2007) entre expertos británicos, ha evidenciado que 26% de las personas encuestadas ya se había tratado un glaucoma durante el embarazo, prosiguiendo el tratamiento en curso en la mayoría de los casos (71%) o interrumpiéndolo en los casos restantes. Los tratamientos más utilizados eran betabloqueadores (45%) y prostaglandinas (33%). Lamentablemente el análisis no proporcionaba datos relativos a la evolución de los embarazos en cuestión.24
¿ Categorías farmacológicas
Los fármacos a utilizar durante el embarazo suelen clasificarse en cuatro categorías, según las indicaciones proporcionadas por la FDA y relativas al riesgo fetal durante los primeros trimestres, como se muestra a continuación:
A. Los estudios controlados en mujeres no han demostrado riesgos para el feto durante el primer trimestre o sucesivamente.
B. Los estudios efectuados en animales no han registrado riesgos para el feto, pero no hay de estudios controlados en mujeres embarazadas.
C. Los estudios efectuados en animales han registrado riesgos para el feto y no hay estudios controlados en mujeres embarazadas, o bien los estudios tanto en mujeres como en animales son insuficientes. El fármaco se suministra solamente si el beneficio potencial para la mujer supera el riesgo potencial para el feto.
X. Hay pruebas evidentes de riesgo para los fetos humanos.
Dados los datos precedentes, es evidente que, en este caso no existen fármacos administrables en la categoría A, es decir la más segura.25
¿ Betabloqueadores (categoría C)
Se deben utilizar con precaución durante el embarazo; suspender de dos a tres días antes del parto por los potenciales efectos que puedan tener sobre la musculatura uterina. Hay algunos casos descritos en los que se ha suministrado esta substancia sola o en combinación con otras (pilocarpina y acetazolamida) durante el embarazo sin que se produjeran efectos colaterales, pero también hay una publicación que describe un caso que se asoció a bradiarritmia fetal. No se dispone de datos suficientes para la prescripción en gel.24,26
Diversos betabloqueadores de uso oftálmico común podrían atravesar la placenta.27 A pesar de la escasez de datos sobre la toxicidad maternofetal, estos fármacos suelen prescribirse con relativa seguridad.24,28 La American Academy of Pediatrics ha autorizado el uso del timolol durante la lactancia, a pesar de recibir algunas críticas por su tendencia a concentrarse en la leche materna.29-34 Hay dos estudios recientes donde se han valorado las concentraciones en la leche materna y los efectos sobre el peso de los neonatos: se ha determinado que el uso tópico del timolol proporciona una concentración en la leche materna de 0.24 ng/ mL, concluyendo que tal dosis difícilmente puede causar efectos colaterales sistémicos en un neonato sano,32 mientras que, ajustando las variables consideradas (entre ellas: sexo del bebé, número de hijos, semanas de embarazo, edad de la madre, hipertensión y diabetes, nivel económico, etc.), se ha encontrado que el uso de betabloqueadores no aumenta de manera significante el riesgo de bajo peso, comparándolos con otros fármacos antiglaucomatosos utilizados.34
¿ Parasimpaticomiméticos
Pilocarpina, categoría C: Si bien en la literatura no se describen casos con efectos colaterales, incluso en combinación con otros fármacos (timolol), debe utilizarse con precaución durante el embarazo y suspenderse antes del parto porque potencialmente puede producir hipertermia, agitación y convulsiones neonatales. Estudios practicados en animales describen anomalías en las extremidades y en el hocico.22,23,34 Existe una actividad colinérgica bien documentada de la placenta humana, pero sus funciones todavía no se han comprendido bien;35 por otra parte, no se observa si los agonistas colinérgicos oculares ejercen alguna influencia sobre la funcionalidad placentaria o sobre el ámbito hormonal.36 No se dispone de datos suficientes durante la lactancia. Los fármacos siguientes son poco utilizados en la actualidad:
Carbacol, categoría C: Estudios realizados en animales muestran defectos vertebrales y cefálicos.22 No se dispone de datos suficientes durante la lactancia.
Ecotiofato, categoría C: Depresor potencial de la actividad de las pseudocolinesterasas en el neonato.23 No se dispone de datos suficientes durante la lactancia.
Demecario, categoría X: Teratógeno y tóxico durante el embarazo.22-23 No utilizarlo en ningún caso.
¿ Agonistas adrenérgicos
En esta categoría se encuentran los únicos dos fármacos clasificados por la FDA en la categoría B, dado que por sus componentes se ha demostrado la ausencia de efectos teratógenos en los animales incluso en dosis elevadas (brimonidina e dipivefrina).11,12,25 De todos modos, no se han realizado estudios controlados durante el embarazo y la lactancia en ninguno de los casos.37-40
Epinefrina, categoría C: Se han dado casos de buena tolerancia durante el primer trimestre sin efectos colaterales sobre el feto. Sin embargo, su suministro sistémico está asociado a anoxia fetal e inhibición de la contractibilidad uterina. Se desaconseja su uso durante el embarazo.37-39,41,42 No se dispone de datos suficientes durante la lactancia.
Dipivefrina, categoría B: Los estudios efectuados en ratas y conejos no muestran efectos sobre el feto.38,39 No se dispone de datos suficientes durante la lactancia.
Brimonidina, categoría B: Los estudios efectuados en ratas y conejos con dosis 100 veces superiores a las plasmáticas humanas tras el uso tópico no presentan efectos sobre el feto. Atraviesa la placenta en concentraciones reducidas. Siempre en estudios animales se ha comprobado la presencia del fármaco en la leche materna, pero no se dispone de datos en la especie humana.38
Apraclonidina, categoría C: En conejos presenta efectos embriocidas con dosis 60 veces superiores a las previstas para el ser humano.38,40 No se dispone de datos suficientes durante la lactancia.
¿ Inhibidores de la anhidrasa carbónica (IAC)
Los riesgos relativos de los IAC tópicos son incluso menos evidentes que los sistémicos, dada su insignificante presencia en el torrente circulatorio después de dicha modalidad de suministro.13,21
No obstante, no hay estudios suficientes que pongan en evidencia sus efectos colaterales sobre la capacidad de reproducción o sobre el desarrollo fetal. Considerando la escasez de datos respecto a su seguridad, se recomienda el uso de los IAC tópicos con extrema cautela durante el embarazo y de forma limitada durante el segundo y el tercer trimestre.21,22,25
Acetazolamida, categoría C: Se han documentado casos de suministro de esta sustancia durante el embarazo sin efectos colaterales, incluso en combinación con otros fármacos (timolol), como se ha dado un caso de acidosis tubulointersticial transitoria en el nacimiento tras el uso del fármaco por parte de la madre. Los estudios realizados en animales describen episodios teratógenos, por lo que se recomienda precaución durante el primer trimestre.34,43-46
Durante la lactancia pueden presentarse efectos colaterales metabólicos y renales, pero la American Academy of Pediatrics ha autorizado su uso en combinación con el timolol, por lo que todavía es una cuestión a debatir.8-10,45
Dorzolamida, categoría C: No se han observado malformaciones en ratas con dosis 125 veces superiores a la recomendada para el ser humano, mientras que en conejos se han producido defectos vertebrales con dosis 31 veces superiores. Utilícese con precaución durante el embarazo. Los estudios realizados en ratas han evidenciado una reducción del peso corporal en los neonatos amamantados por la madre tras administrarle una dosis de dorzolamida 94 veces superior a la recomendada para el ser humano, pero no se dispone de datos sobre la especie humana.43-44
Brinzolamida, categoría C: Los estudios realizados en conejos han producido toxicidad materna ocular y alteraciones fetales con dosis 125 superiores a la recomendada para el ser humano. Utilícese con precaución durante el embarazo. Los estudios en ratas han evidenciado una reducción del peso corporal en los neonatos amamantados por la madre tras administrarle una dosis de brinzolamida 132 veces superior a la recomendada para el ser humano, pero no se dispone de datos sobre la especie humana.43-44
¿ Derivados de la prostaglandina
Respecto a la evidente bioactividad de dichos compuestos durante el embarazo, es preciso; sin embargo, llevar a cabo más estudios para definir su seguridad y, por lo tanto, deben utilizarse con precaución;47-50 algunos autores desaconsejan totalmente su uso.51
Hay dos artículos en los que se ha descrito la experiencia humana con los análogos de la prostaglandina, reportando un total de 10 casos sin efectos colaterales en el feto.48,50
Latanoprost, categoría C: Los estudios realizados en conejos han reportado dosis embriocidas equivalentes a 16 veces la máxima dosis recomendada para el ser humano, aunque en cuatro camadas de 16 no se han producido efectos colaterales ni siquiera con una dosis 80 veces superior. De los casos descritos, es el único análogo en el que se describieron 10 casos de embarazo llevados a cabo de forma regular y sin interrupción de la terapia.48,50 No obstante, debe utilizarse siempre con precaución durante el embarazo; no se dispone de datos suficientes durante la lactancia.47,49-51
1. Prostona, no se comercializa en Europa; todavía no se ha publicado ningún dato.
2. Bimatoprost, categoría C, no se han realizado estudios en mujeres embarazadas ni durante la lactancia; utilícese con precaución.49,51
3. Travoprost, categoría C, no se han realizado estudios en mujeres embarazadas ni durante la lactancia; utilícese con precaución.49,51
4. Tafluprost, categoría C, no se han realizado estudios en mujeres embarazadas ni durante la lactancia; utilícese con precaución.52
¿ Estudios clínicos con evidencia científica por el glaucoma durante el embarazo
Debido a la escasa frecuencia de casos en la bibliografía, se encuentran relativamente pocas publicaciones al respecto y es evidente que aún menos son del tipo peer-reviewed (revisada por pares), en cuanto hay obvias implicaciones éticas que se aplican cuando se habla de mujeres embarazadas.
En esta revisión, nos hemos basado en los artículos peer-reviewed publicados hasta abril de 2010 y también en las publicaciones realizadas por autores que han utilizado estrictos criterios en analizar los resultados clínicos. Revisamos la literatura biomédica en inglés de los últimos 50 años, buscando las palabras clave: Glaucoma and pregnancy, intraocular pressure and pregnancy, IOP and pregnancy, glaucoma and nursing.
La búsqueda ha sido limitada a los artículos en idioma inglés o las publicaciones con un resumen en inglés. Hemos encontrado un total de 753 publicaciones en los archivos electrónicos y hemos seleccionado 19 citas que encajaban perfectamente o posiblemente en los criterios de inclusión.
No se han incluido resúmenes de ponencias en congresos, por no estar peer-reviewed.
Estudios ulteriores se han identificado posteriormente valorando la bibliografía disponible.
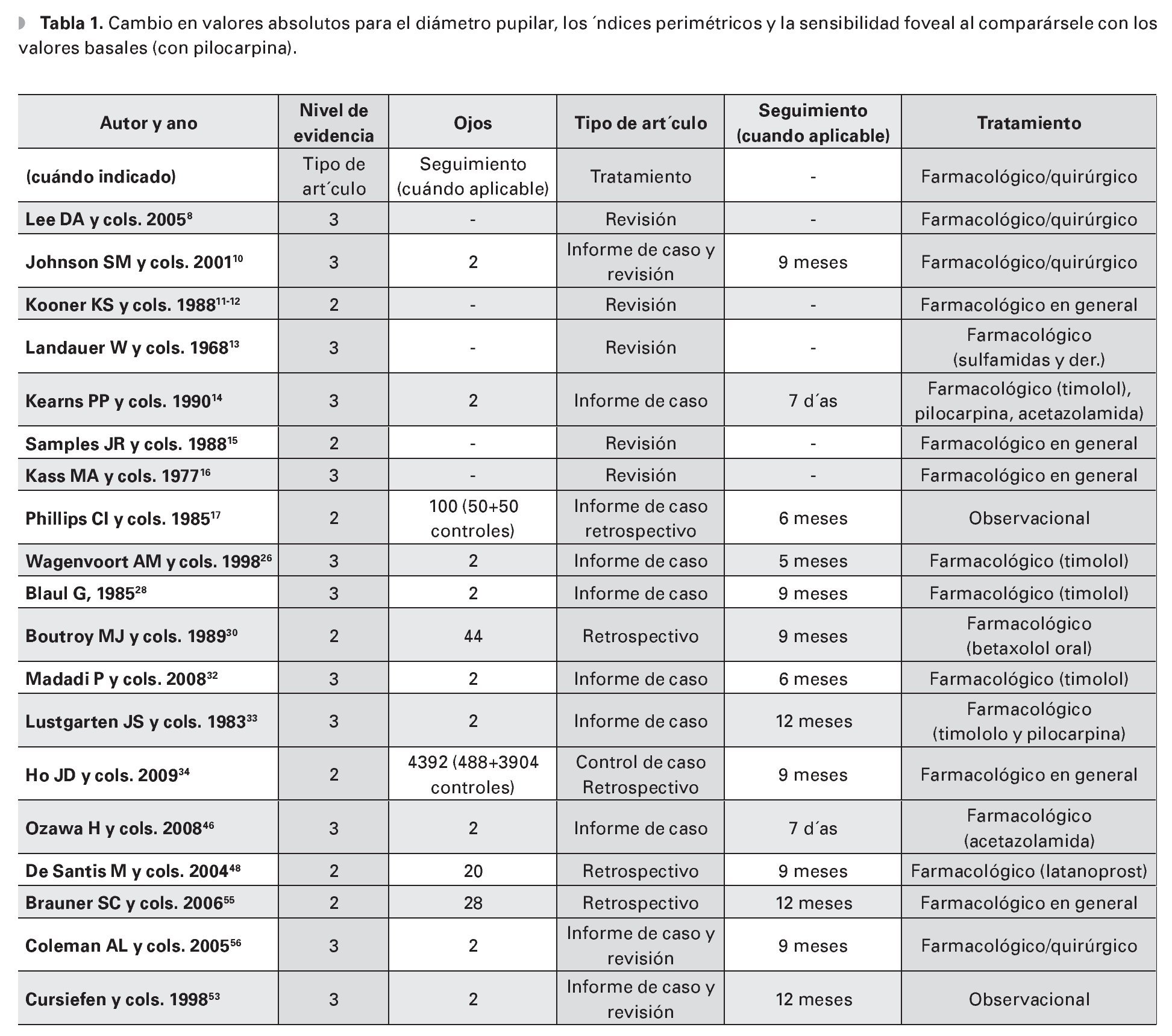
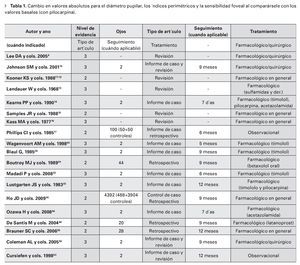
Se han asignado niveles de evidencia a cada artículo según los criterios desarrollados por el Centro Británico por la Medicina Basada en la Evidencia (British Centre for Evidence-based Medicine). El nivel uno se asigna a los estudios clínicos prospectivos (well designed and well conducted prospective clinical trials), el nivel dos a los estudios retrospectivos, caso-control u otros estudios de cohorte (well designed case-control and other cohort studies and retrospective studies), el nivel tres a los estudios de series de casos, case-report o estudios de cohorte o case-control menos estructurados (case series, case reports and less structured cohort and case-control studies).
Informaciones procedentes de la FDA durante el procedimiento de aplicación preventa han sido etiquetadas como nivel dos.
Es evidente que por motivos éticos no se encuentran artículos de nivel uno por la imposibilidad a realizar estudios prospectivos durante el embarazo, mientras que son muchos más los estudios clasificados como nivel tres.
En la Tabla 1 se muestran los datos obtenidos de la literatura peer-reviewed y de las publicaciones más selectas.
¿ Conclusiones
Partiendo de lo aquí expuesto, consideramos oportuno dar algunas directrices (o más bien buenos consejos) sobre la gestión de la terapia antiglaucomatosa durante el embarazo:51,53-58
1. El embarazo es esencialmente un periodo de hipotonía ocular, por lo que el simple control frecuente de la PIO puede ser una solución óptima.
2. Evitar, de ser posible, la terapia durante el primer trimestre.
3. La argón trabeculoplastía, la trabeculotomía extemporánea o la cirugía filtrante previa a la gravidez son alternativas válidas al tratamiento médico.
4. En caso de imposibilidad de interrupción de la terapia médica, se buscará la dosis mínima eficaz, practicando a la vez la oclusión de los puntos lagrimales de tres a cinco minutos después de su aplicación.
5. En caso de que sea necesario proseguir la terapia médica, valorando caso por caso y con las debidas limitaciones arriba mencionadas, y según las publicaciones aparecidas hasta la fecha, parece prudente aconsejar el uso de los fármacos tópicos siguientes en una escala decreciente de uso: brimonidina, latanoprost/timolol, pilocarpina, dorzolamida.24-36,48,54-57
6. Examinar con atención el riesgo-beneficio informado y discutirlo con el paciente.
Correspondencia: Giacomo De Benedetti. 7, Parque Alcolea
20013 San Sebastián, Guipúzcoa, España.
Teléfono: +3494 3437 100, Fax: +3494 3287 443.
Correo electrónico: gdebenedetti.ss@quiron.es.