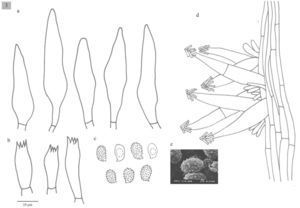
El objetivo de este trabajo es contribuir al conocimiento del género Melanoleuca en México. Se aportan nuevos datos sobre su distribución geográfica y se proporciona una descripción detallada de cada una de las especies estudiadas. Se consultaron herbarios de México y el extranjero, los cuales fueron estudiados morfológica y filogenéticamente mediante un analisis multigénico. Como resultado se describen 4 especies nuevas (M. communis, M. herrerae, M. jaliscoensis y M. longisterigma), se incluyen dibujos de las estructuras microscópicas y se presenta una clave taxonómica para la identificación de 9 taxa mexicanos. La información que se tiene acerca de este grupo se basa sólo en listados taxonómicos y no ha habido ningún intento previo por estudiar este género detalladamente, por lo que este estudio representa una gran contribución para el conocimiento sistemático de Melanoleuca en Norteamérica y para el conocimiento taxonómico de los macromicetos en México.
The goal of this work is to contribute to the knowledge of the genus Melanoleuca in Mexico providing new data about its geographic distribution and a detailed description of species. Specimens from Mexican and foreign herbaria were studied morphologically and phylogenetically performing a multi-gene sequence analysis. As a result, we describe 4 new species (M. communis, M. herrerae, M. jaliscoensis, and M. longisterigma), including line drawings, and provide a taxonomic key to 9 taxa of Melanoleuca that occur in Mexico. Considering the lack of information on this genus in Mexico and the fact that no detailed study had been previously developed, this work presents contributions to the systematics of Melanoleuca in North America and to the taxonomic knowledge of macromycetes in Mexico.
El género Melanoleuca Pat. pertenece al grupo de los Agaricales; es reconocido por poseer un basidioma tricolomatoide, píleo de convexo a deprimido, estípite central, generalmente fibriloso, sólido y carente de velo, láminas adnadas-emarginadas, delgadas, blancas a amarillentas, en ocasiones con tonos rosáceos y esporada blanca. Sus esporas son subglobosas a elipsoides con pared delgada, hialinas a amarillentas, cubiertas con verrugas amiloides y generalmente presentan cistidios, que pueden ser de 2 tipos: urticoides o lageniformes, aunque algunas especies no presentan cistidios. Son saprótrofos y de hábito solitario o gregario. La mayoría de las especies crecen en bosques templados y dunas de arena, pero también se pueden encontrar algunas en bosques tropicales (Singer, 1986; Boekhout, 1999).
Murrill (1914) publicó la descripción de 119 especies en Norteamérica, las cuales fueron revisadas por Pfister (1984), quien concluyó que solo 6 pertenecen realmente al género Melanoleuca. Singer (1986) consideró 48 especies a nivel mundial, mientras que Bon (1978) reconoció 65 solo en Europa. Boekhout (1999) publicó una revisión de Holanda utilizando un concepto de especie más flexible, lo que le llevó a agrupar especies que Bon había separado y considerarlas como variaciones de una misma especie. En Norteamérica se reconocen 19 especies (Smith, 1944; Smith y Rea, 1944; Thiers, 1958; Gillman y Miller, 1977; Singer, 1989; Matheny y Vellinga, 2009), y en el mundo se considera que existen alrededor de 50 especies (Kirk et al., 2008). En México hasta ahora se conocen 7 especies:M. brevipes, M. cognata, M. exscissa, M. grammopodia, M. melaleuca, M. strictipes, y M. yucatanensis (Herrera y Guzmán, 1961; Sánchez-León, 1961; Martín del Campo, 1968; Guzmán, 1972; 1982; 1983; 1986; Valdés-Ramírez, 1972; Mendiola, 1974; Frutis y Guzmán, 1983; Martínez Alfaro et al.,1983; Bon, 1984; Courtecuisse y Pfister, 1984; Pérez-Silva y Aguirre-Acosta, 1985; 1986; Zarco, 1986; Pérez-Silva et al., 2006; Sánchez-Jácome y Guzmán-Dávalos, 2011).
Debido a los escasos estudios taxonómicos enfocados a este grupo y a las múltiples interpretaciones de las especies, es difícil establecer una cifra precisa del número de especies. Cabe recalcar que solo en Europa se han publicado monografías que incluyen descripciones detalladas e ilustradas de las especies; mientras en México y el resto de América la información que se tiene acerca de este grupo se basa solo en listados taxonómicos y no ha habido ningún intento previo de estudiar éste género detalladamente.
El objetivo de este trabajo fue contribuir al conocimiento taxonómico del género Melanoleuca en México, aportando nuevos datos sobre su distribución geográfica y proporcionando una descripción detallada de cada una de las especies estudiadas. Adicionalmente se describen 4 especies nuevas y se presenta una clave taxonómica para los taxa mexicanos conocidos.
Materiales y métodosMuestreo taxonómico: se revisaron ejemplares de Melanoleuca depositados en las siguientes colecciones mexicanas de hongos: Herbario de la Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional (ENCB), Herbario de la Facultad de Ciencias, Universidad Nacional Autónoma de México (FCME), Herbario del Instituto de Botánica de la Universidad de Guadalajara (IBUG), Herbario del Instituto de Biología, UNAM (MEXU), Herbario del Centro de Investigaciones en Ciencias Biológicas de la Universidad Autónoma de Tlaxcala (TLXM), Herbario del Instituto de Ecología, A. C. en Xalapa, Ver. (XAL), así como de las siguientes colecciones extranjeras: Herbario de la Universidad de Tennessee, USA (TENN) y Herbario de la Universidad de Gotemburgo, Suecia (GB). Para los ejemplares del Herbario FCME, se consultó el catálogo fotográfico de Cifuentes. A pesar de que el enfoque de este trabajo fue en los taxa mexicanos, se revisaron ejemplares extranjeros para comparar las especies europeas con las mexicanas y de esta forma estar seguros de si se trataba o no de las mismas especies.
Los ejemplares se estudiaron por medio de las técnicas utilizadas en micología para observar y medir estructuras como: esporas, basidios y cistidios (Largent et al., 1977). Posteriormente se determinaron morfoespecies utilizando claves taxonómicas (Gillman y Miller, 1977; Bon, 1991; Watling y Turnbull, 1998; Boekhout, 1999; Horak, 2005; Vesterholt, 2008). Del total de los materiales revisados se seleccionaron algunos ejemplares para llevar a cabo la extracción del DNA, excluyendo aquellos con datos de colecta insuficientes y/o en malas condiciones para la extracción. En algunos casos se contó con varios especímenes recolectados en el mismo sitio y cuyas características morfológicas eran similares, por lo que se seleccionó solo un ejemplar para los análisis filogenéticos. Por último se elaboró una clave taxonómica de los ejemplares mexicanos. Las referencias de los colores se basaron en la guía de color Methuen (Kornerup y Wanscher, 1978).
Técnicas moleculares: para la extracción de DNA genómico se usaron entre 10 y 50mg de basidioma deshidratado, con 4 protocolos distintos: método de CTAB (bromuro de cetiltrimetilamonio; Gardes y Bruns, 1993) y los kits de extracción E.Z.N.A.® Fungal DNA (Omega Bio-tek, Doraville, Georgia), E.Z.N.A.® High Performance Fungal DNA (Omega Bio-tek) y DNeasy® Plant Mini kit (QIAGEN, Valencia, California). Se amplificaron las regiones ITS (espaciador interno transcrito), nLSU (subunidad grande del ribosoma) y rpb1(subunidad mas grande de la RNA polimerasa II) en volúmenes de 25 o 50μl, usando los siguientes cebadores: ITS1F, ITS2, ITS3, 5,8SR, ITS4, ITS4B, LR0R, LR5, LR16, LR7 (Gardes y Bruns, 1993; White et al., 1990; Vilgalys y Hester, 1990; http://www.biology.duke.edu/fungi/mycolab/primers.htm). Para amplificar la región rpb1 se diseñaron cebadores específicos para Melanoleuca: Mint2F (5'-GGTTGCGTGGTGAAATGG-3') y Mex2R (5'-GGCATCACSGTCAGAATCATCC-3'). Los productos de PCR fueron purificados con el kit QIAquick (QIAGEN) siguiendo las instrucciones del fabricante. Las reacciones de secuenciación se prepararon en volúmenes de 10μl usandoBigDye® Terminator v3.1 (Applied Biosystems, Foster City, California). Los mismo cebadores utilizados para a amplificación fueron empleados para llevar a cabo las reacciones. La secuenciación se llevó a cabo en secuenciadores automáticos de capilar modelos ABI 3100 y ABI 3730.
Análisis filogenéticos: las secuencias obtenidas se editaron y ensamblaron con Sequencher 4.9 (Gene Codes, Ann Arbor); éstas fueron depositadas en la base de datos de GenBank (Cuadro 1). Como grupo externo se utilizaron secuencias de Pluteus Fr.y Volvopluteus Vizzini, Contu y Justo, disponibles en GenBank (Cuadro 1). La elección del grupo externo se basó en análisis filogenéticos previos que proponen que Melanoleuca forma parte de un clado denominado Pluteoide, dentro del cual se encuentran Pluteus y Volvopluteus (Moncalvo et al., 2002; Matheny et al., 2006; Garnica et al., 2007; Justo et al., 2011).
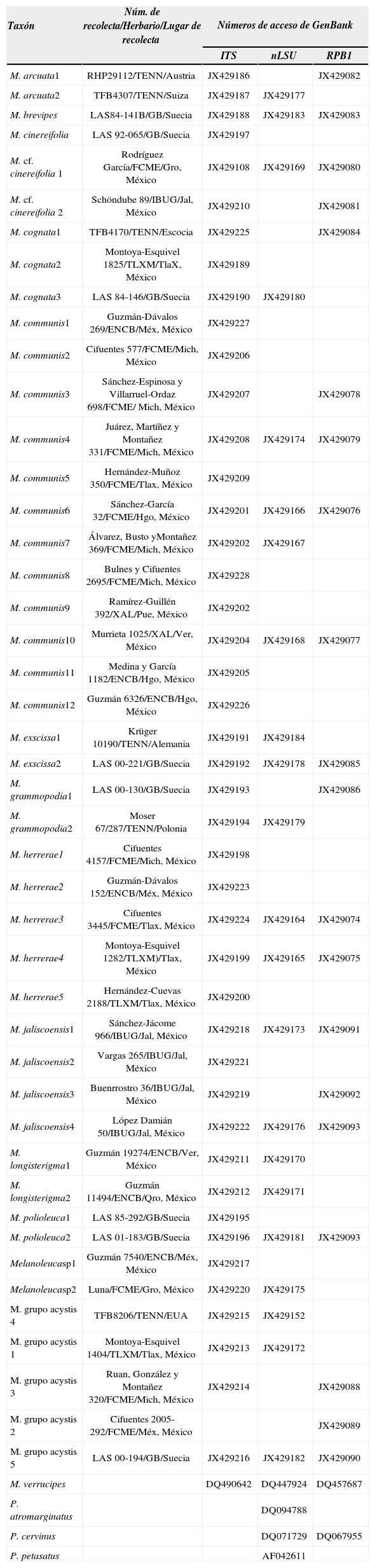
Números de GenBank de las secuencias incluidas en el análisis filogenético
| Taxón | Núm. de recolecta/Herbario/Lugar de recolecta | Números de acceso de GenBank | ||
|---|---|---|---|---|
| ITS | nLSU | RPB1 | ||
| M. arcuata1 | RHP29112/TENN/Austria | JX429186 | JX429082 | |
| M. arcuata2 | TFB4307/TENN/Suiza | JX429187 | JX429177 | |
| M. brevipes | LAS84-141B/GB/Suecia | JX429188 | JX429183 | JX429083 |
| M. cinereifolia | LAS 92-065/GB/Suecia | JX429197 | ||
| M. cf. cinereifolia 1 | Rodríguez García/FCME/Gro, México | JX429108 | JX429169 | JX429080 |
| M. cf. cinereifolia 2 | Schöndube 89/IBUG/Jal, México | JX429210 | JX429081 | |
| M. cognata1 | TFB4170/TENN/Escocia | JX429225 | JX429084 | |
| M. cognata2 | Montoya-Esquivel 1825/TLXM/TlaX, México | JX429189 | ||
| M. cognata3 | LAS 84-146/GB/Suecia | JX429190 | JX429180 | |
| M. communis1 | Guzmán-Dávalos 269/ENCB/Méx, México | JX429227 | ||
| M. communis2 | Cifuentes 577/FCME/Mich, México | JX429206 | ||
| M. communis3 | Sánchez-Espinosa y Villarruel-Ordaz 698/FCME/ Mich, México | JX429207 | JX429078 | |
| M. communis4 | Juárez, Martíñez y Montañez 331/FCME/Mich, México | JX429208 | JX429174 | JX429079 |
| M. communis5 | Hernández-Muñoz 350/FCME/Tlax, México | JX429209 | ||
| M. communis6 | Sánchez-García 32/FCME/Hgo, México | JX429201 | JX429166 | JX429076 |
| M. communis7 | Álvarez, Busto yMontañez 369/FCME/Mich, México | JX429202 | JX429167 | |
| M. communis8 | Bulnes y Cifuentes 2695/FCME/Mich, México | JX429228 | ||
| M. communis9 | Ramírez-Guillén 392/XAL/Pue, México | JX429202 | ||
| M. communis10 | Murrieta 1025/XAL/Ver, México | JX429204 | JX429168 | JX429077 |
| M. communis11 | Medina y García 1182/ENCB/Hgo, México | JX429205 | ||
| M. communis12 | Guzmán 6326/ENCB/Hgo, México | JX429226 | ||
| M. exscissa1 | Krüger 10190/TENN/Alemania | JX429191 | JX429184 | |
| M. exscissa2 | LAS 00-221/GB/Suecia | JX429192 | JX429178 | JX429085 |
| M. grammopodia1 | LAS 00-130/GB/Suecia | JX429193 | JX429086 | |
| M. grammopodia2 | Moser 67/287/TENN/Polonia | JX429194 | JX429179 | |
| M. herrerae1 | Cifuentes 4157/FCME/Mich, México | JX429198 | ||
| M. herrerae2 | Guzmán-Dávalos 152/ENCB/Méx, México | JX429223 | ||
| M. herrerae3 | Cifuentes 3445/FCME/Tlax, México | JX429224 | JX429164 | JX429074 |
| M. herrerae4 | Montoya-Esquivel 1282/TLXM)/Tlax, México | JX429199 | JX429165 | JX429075 |
| M. herrerae5 | Hernández-Cuevas 2188/TLXM/Tlax, México | JX429200 | ||
| M. jaliscoensis1 | Sánchez-Jácome 966/IBUG/Jal, México | JX429218 | JX429173 | JX429091 |
| M. jaliscoensis2 | Vargas 265/IBUG/Jal, México | JX429221 | ||
| M. jaliscoensis3 | Buenrrostro 36/IBUG/Jal, México | JX429219 | JX429092 | |
| M. jaliscoensis4 | López Damián 50/IBUG/Jal, México | JX429222 | JX429176 | JX429093 |
| M. longisterigma1 | Guzmán 19274/ENCB/Ver, México | JX429211 | JX429170 | |
| M. longisterigma2 | Guzmán 11494/ENCB/Qro, México | JX429212 | JX429171 | |
| M. polioleuca1 | LAS 85-292/GB/Suecia | JX429195 | ||
| M. polioleuca2 | LAS 01-183/GB/Suecia | JX429196 | JX429181 | JX429093 |
| Melanoleucasp1 | Guzmán 7540/ENCB/Méx, México | JX429217 | ||
| Melanoleucasp2 | Luna/FCME/Gro, México | JX429220 | JX429175 | |
| M. grupo acystis 4 | TFB8206/TENN/EUA | JX429215 | JX429152 | |
| M. grupo acystis 1 | Montoya-Esquivel 1404/TLXM/Tlax, México | JX429213 | JX429172 | |
| M. grupo acystis 3 | Ruan, González y Montañez 320/FCME/Mich, México | JX429214 | JX429088 | |
| M. grupo acystis 2 | Cifuentes 2005-292/FCME/Méx, México | JX429089 | ||
| M. grupo acystis 5 | LAS 00-194/GB/Suecia | JX429216 | JX429182 | JX429090 |
| M. verrucipes | DQ490642 | DQ447924 | DQ457687 | |
| P. atromarginatus | DQ094788 | |||
| P. cervinus | DQ071729 | DQ067955 | ||
| P. petasatus | AF042611 | |||
Los alineamientos se llevaron a cabo con el programa MAFFT 6.717 (Katoh y Toh, 2008); posteriormente se ajustaron manualmente en MacClade 4.08 (Maddison y Maddison, 2005). Para concatenar las secuencias de distintos genes en una sola matriz se utilizó el programa SeaView 4.2.3 (Gouy et al., 2010).
La matriz se dividió en varias particiones para poder asignar diferentes parámetros de sustitución nucleotídica a cada región génica analizada. Las particiones fueron las siguientes: ITS, nLSU, rpb1-intrón, rpb1-exón 1a y 2a posición de los codones y rpb1-exón 3a posición de los codones.
El análisis filogenético consistió en el método de Máxima Verosimilitud empleando el programa RAxML 7.0.4 (Stamatakis, 2006a), aplicando el algoritmo para bootstrap rápido con 1000 réplicas, utilizando una aproximación CAT (Stamatakis, 2006b) y el modelo de sustitución nucleotídica GTRGAMMA, cuyos parámetros fueron calculados independientemente para cada partición. El programa RAxML solo aplica el modelo de sustitución nucleotídica GTR, el cual está justificado por el autor por el hecho de que un modelo complejo lleva a obtener un árbol con un valor de verosimilitud mayor al que se obtiene con modelos más simples, además de que una leve sobre-parametrización de los datos no afecta la topología en los nodos con mayor soporte y que los modelos mas simples proporcionan únicamente ventajas en cuanto a tiempo computacional (Stamatakis, RAxML Manual 7.0.4).
Los valores de bootstrap ≥ 70% fueron considerados significativos (Felsenstein, 1985).
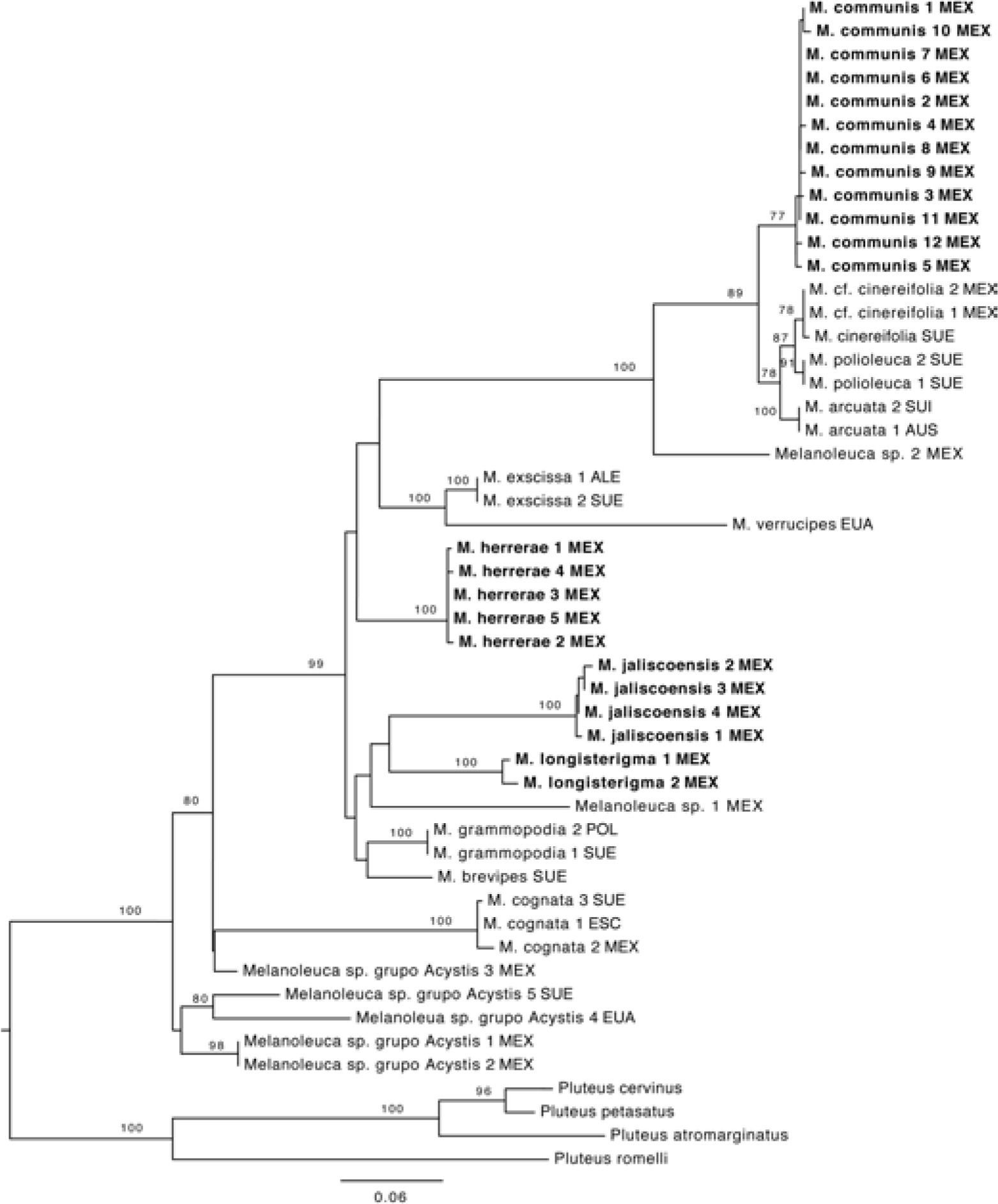
ResultadosLos ejemplares incluidos en este estudio se distribuyen principalmente en el centro del país, en los estados de México, Guerrero, Hidalgo, Jalisco, Querétaro, Michoacán, Tlaxcala y Veracruz, en bosques de coníferas, bosques mesófilos de montaña y pastizales. Se encontraron 8 especies, de las cuales 4 son especies nuevas y 2 más posibles candidatas, que por el momento no se describen.
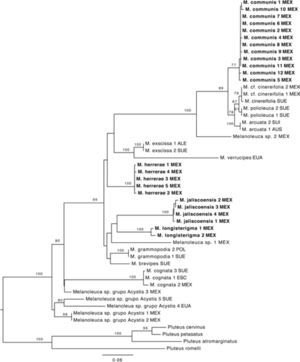
En la reconstrucción filogenética se recuperaron los clados terminales con un fuerte soporte, lo cual permite delimitar las especies, además muestra que la mayor parte de las especies mexicanas, aunque presentan morfología similar a las europeas, son filogenéticamente distintas (Fig. 1), lo cuál se confirma con las diferencias en el hábitat. Se demuestra que la mayoría de los nombres europeos utilizados antes de este trabajo para ejemplares mexicanos son inapropiados, tal como ha ocurrido con otros Agaricales de América (Lim et al., 2003; Vellinga et al., 2003; Hughes et al., 2007).
Árbol filogenético obtenido del análisis de máxima verosimilitud (nLSU, ITS, rpb1), los valores de bootstrap ≥ 70% se indican arriba de las ramas. Los nombres en negritas indican las especies nuevas. ALE= Alemania, AUS= Austria, ESC= Escocia, EUA= Estados Unidos de América, MEX= México, SUE= Suecia.
En el caso de los ejemplares que no presentan cistidios no fue posible delimitar las especies. A pesar de que se separan 3 clados terminales, los valores de soporte no son muy altos; adicionalmente, los caracteres morfológicos y ecológicos no presentan variación suficiente, por lo que no se puede justificar su delimitación. Para este estudio dichos taxa son considerados como un grupo parafilético de especies y se nombran grupo Acystis, haciendo referencia al subgénero Acystis Bon, que incluye a las especies de Melanoleuca sin cistidios.
DescripcionesMelanoleuca cf. cinereifolia (Bon) Bon, Docums. Mycol. 9(no. 33): 71. 1978
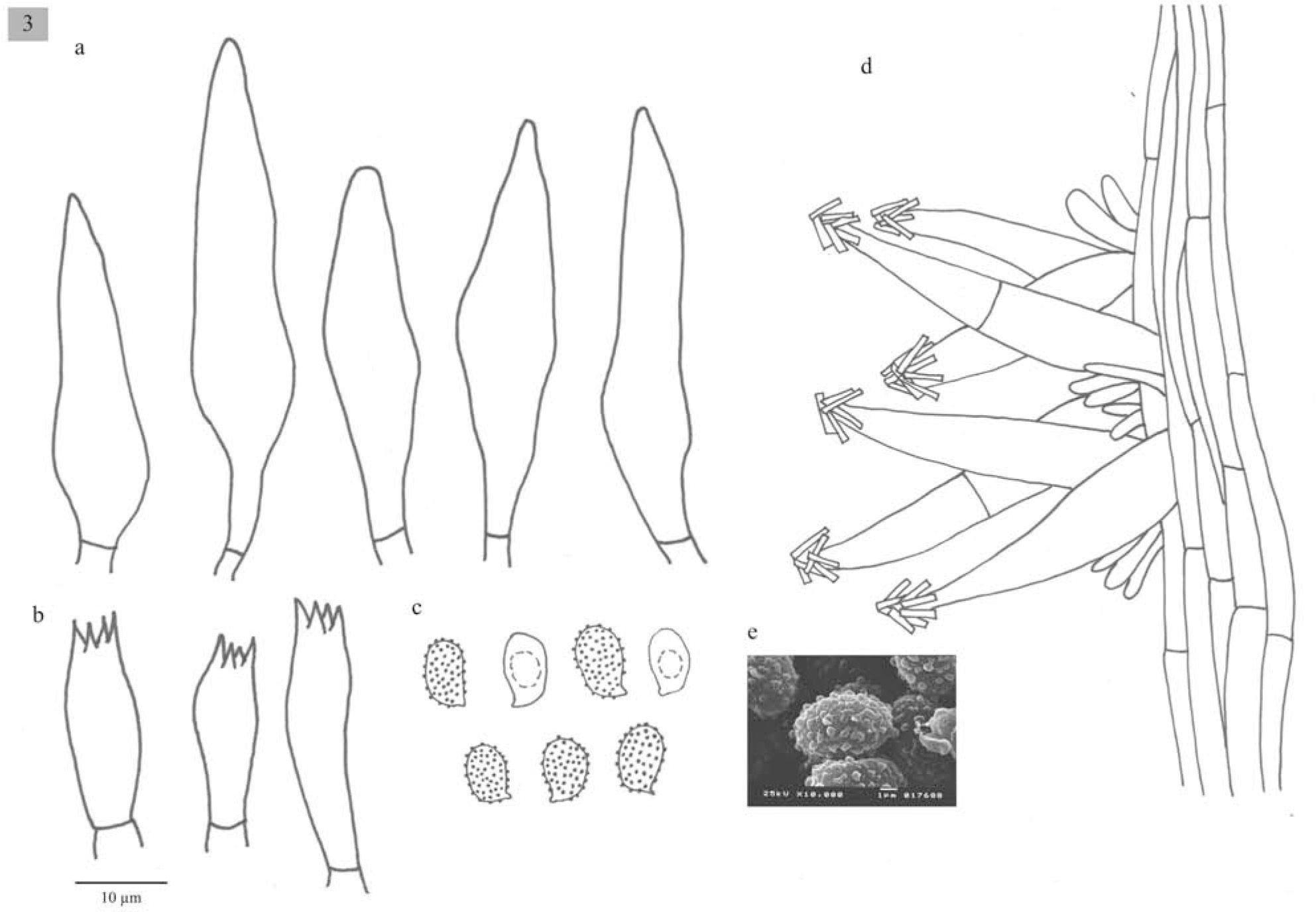
Píleo de 35–50mm de diámetro, de plano-convexo a plano, margen recto, de color café-grisáceo (5C3), aclarándose hacia el margen, superficie lisa y húmeda. Láminas sinuadas, muy juntas, anchas, blancas, borde liso. Estípite 40×3mm, cilíndrico, sólido, de color café-grisáceo (5C3), más claro hacia el ápice, con estrías longitudinales, carnoso-fibroso. Contexto de color café grisáceo, cambia a color café-chocolate al maltratarse.
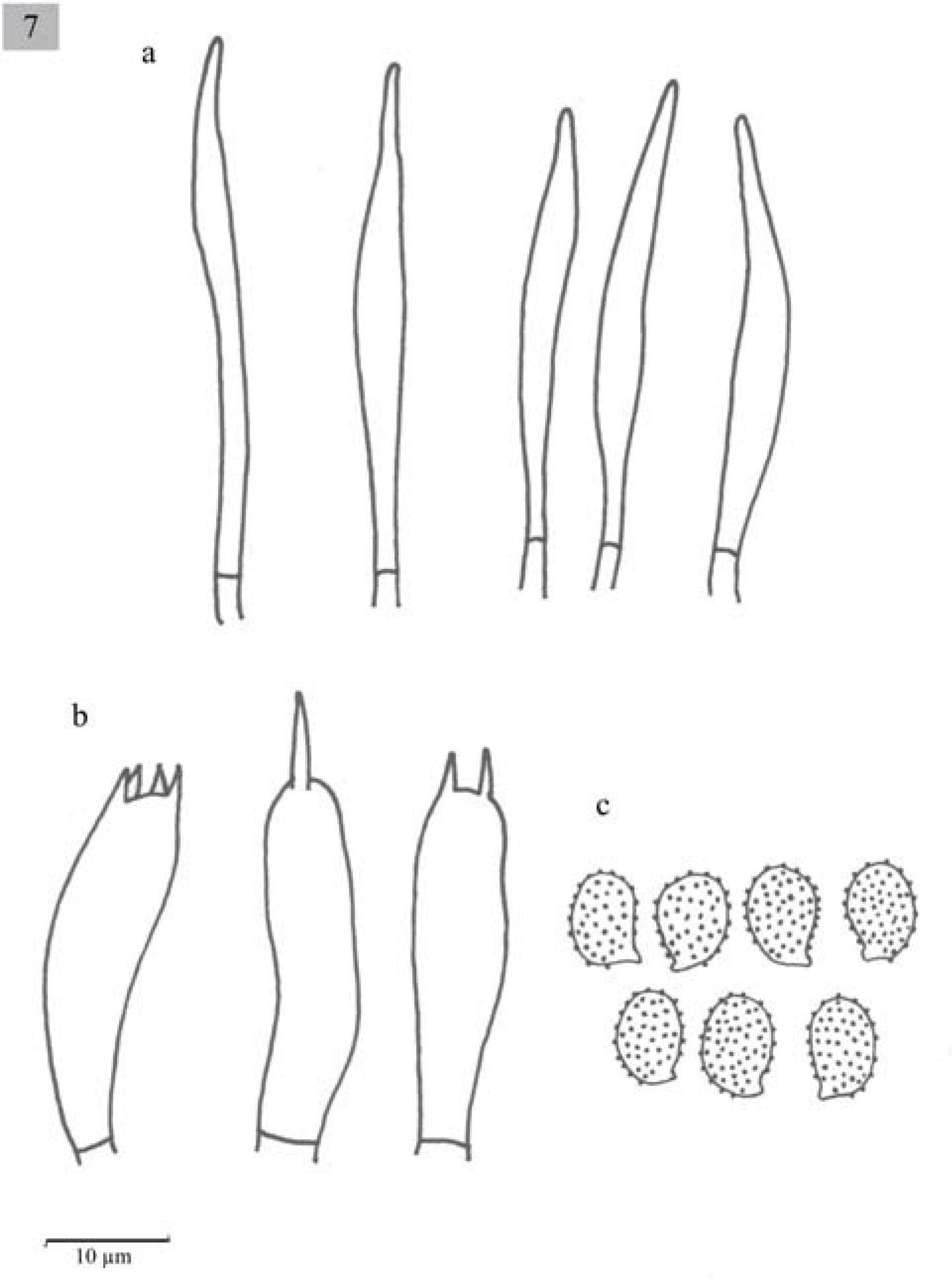
Esporas de 7–8×4–5μm, Q=1.4–2, elipsoides a oblongas, con ornamentaciones en forma de verrugas aisladas, amiloides, hialinas. Basidios de (20.6−)23−31(− 33)x8(−10)μm, tetraspóricos, clavados. Queilocistidios de (41−)49−64(−59.1)x(8−)10−13(−12.8)μm, fusiformes y lageniformes, con cristales en el ápice. Pleurocistidios similares a los queilocistidios.
Resumen taxonómicoHábito y hábitat. Solitario, en bosque mesófilo de montaña.
Distribución en México. Jalisco y Guerrero.
Material examinado:México. Guerrero: municipio Leonardo Bravo, km 4.5 entre el Carrizal y Atoyac, Chichihualco, Rodríguez-García s/n (FCME 11225). Jalisco: municipio Zapotlán El Grande, cañón El Floripondio, J. Schöndube 89.C. Aguilar 20. P. Corona 42. S. Gallo 24 (IBUG). Suecia. Bohuslän: Uddevalla, Forshälla, Sund, LAS92-065 (GB).
Comentarios taxonómicos: Melanoleuca cinereifolia originalmente fue descrita para Europa; usualmente se desarrolla en dunas de arena donde crece la planta Ammophila arenaria. Los caracteres morfológicos y moleculares muestran que los ejemplares mexicanos pertenecen a esta especie. Sin embargo, el tipo de vegetación en que fue recolectado el ejemplar mexicano fue bosque mesófilo de montaña y el hábito de crecimiento no es un estípite semienterrado como el taxón europeo, por lo tanto el hecho de que se trate de la misma especie es algo sorpresivo. Las secuencias de ITS del ejemplar europeo y los mexicanos presentan 100% de similitud; la posibilidad de contaminación al momento de extracción del DNA y amplificación se ha descartado completamente, ya que los materiales fueron estudiados en distintos momentos y laboratorios. Desafortunadamente no fue posible obtener la secuencia de rpb1 del ejemplar europeo y no pudimos comparar esta región. Al no existir suficiente evidencia de que estos ejemplares pertenezcan a la misma o distintas especies se consideran como comparables al taxón europeo.
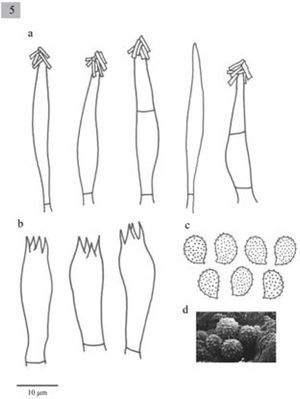
Melanoleuca cognata (Fr.) Konrad y Maubl., Icon. Select. Fung. 3(2): pl. 271. 1927.
Píleo de 42–56mm de diámetro, plano convexo con un pequeño umbo en el centro, color amarillo mostaza (4B5), superficie higrófana y lisa. Láminas sinuadas, subadheridas o libres, juntas, blanquecinas con tonos rosáceos, se oscurecen en ejemplares maduros. Estípite de 50–160x5–14mm, cilíndrico, sólido, de color blanco a amarillo champagne (4B4), con estrías longitudinales de color amarillo rubio (4C4), fibroso-carnoso. Contexto blanquecino a amarillo champagne (4A2, 4B4). Olor dulce. Sabor insípido a agradable.
Esporas de 7–9x4–5μm, Q=1.4−1.6(−2), elipsoides a oblongas, generalmente oblongas, con ornamentaciones en forma de verrugas, amiloides, hialinas. Basidios de 20.5−30(−33.5)x7.5(−10)μm, tetraspóricos, clavados. Queilocistidios de 51.5−64(−77.5)x10–13(−20)μm, lageniformes, algunos fusiformes con cristales en el ápice. Pleurocistidios similares a los queilocistidios.
Resumen taxonómicoHábito y hábitat. Solitario o gregario, en bosque de Pinus-Quercus.
Material estudiado. México. Tlaxcala: municipio Huamantla, cañada Grande, ladera E volcán La Malinche, Parque Nacional La Malinche, A.Montoya-Esquivel 1825 (TLXM). Escocia. Perthshire: Loch preserve, Tulloch Moor, TFB4170 (TENN). Suecia. Västergötland: Trollhättan, Götalunden, Hedeäng, LAS85-146 (GB). Distribución en México. Tlaxcala.
Comentarios taxonómicos. Esta especie se llegó a considerar cercana a M. arcuata, ya que esta última presenta láminas con tonos crema, mientras que en M. cognata son de tonos rosáceos. Sin embargo, los cistidios en M. cognata son fusiformes-lageniformes más grandes que en M. arcuata y con un ápice agudo. En general es una especie fácil de identificar y muy común en Europa, los ejemplares mexicanos se compararon con ejemplares colectados en Escocia y Suecia y se comprobó que pertenecen a la misma especie.
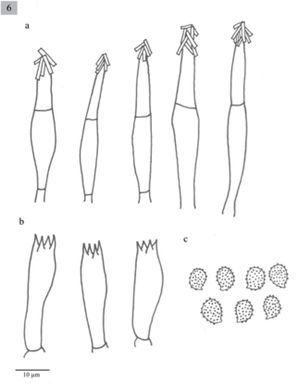
Melanoleuca communis Sánchez-García y Cifuentes sp. nov. MycoBank MB 804157
Tipo. México: Hidalgo, San Miguel el Cerezo, Parque Nacional El Chico, Valle de Los Enamorados, Parque Nacional el Chico, M. Sánchez-García 32 (Holotipo: FCME, Isotipo: TENN).
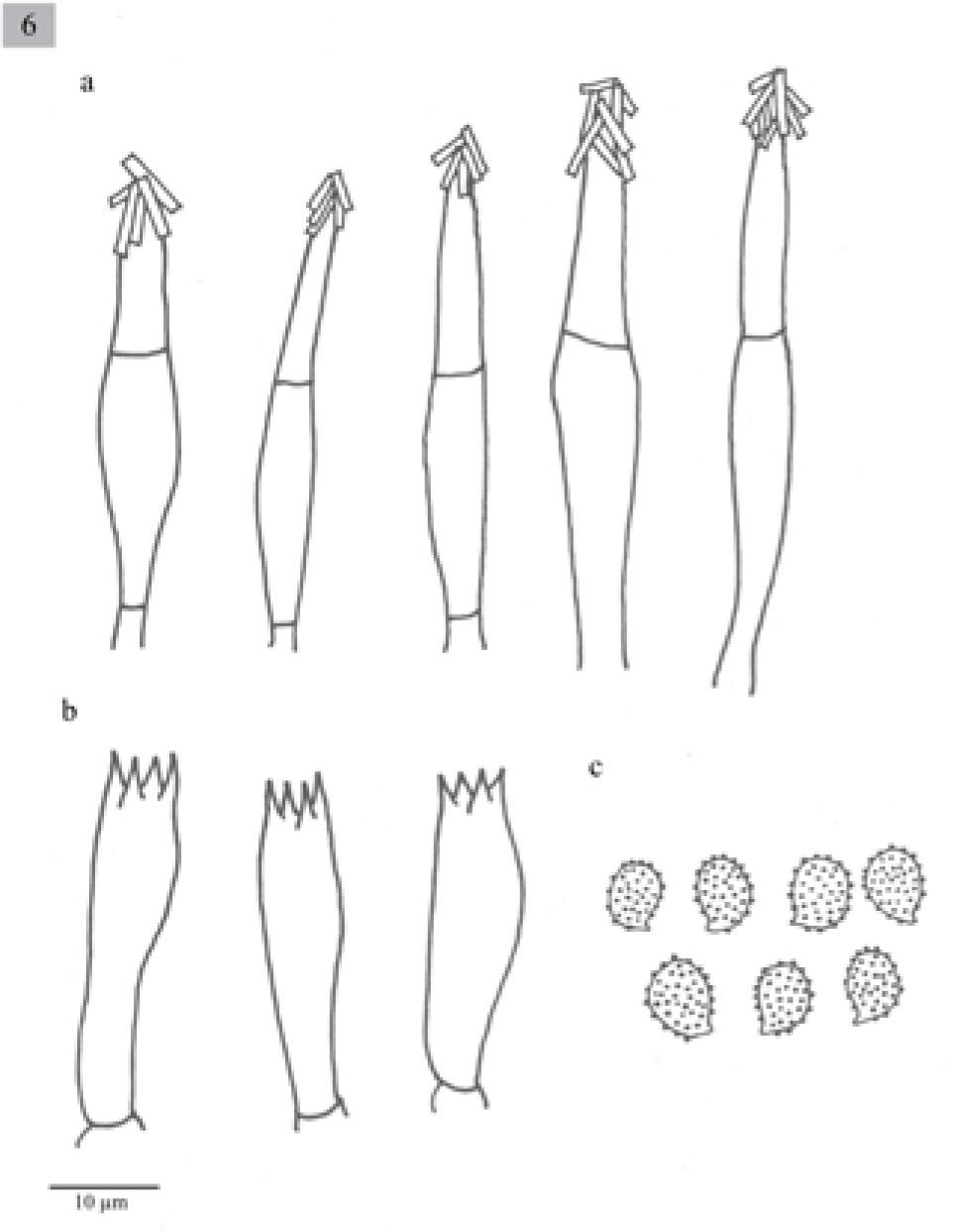
Pileus 28–160mm diameter, plane-convex to plane, sometimes umbonate, margin decurved, brown (5D5, 5E5, 5F5-8, 6E6, 5F4-6) slightly paler or yellowish-brown towards the margin (4C5, 5C3-5, 5D3-7, 5E4-6, 6D4), surface moist, glabrous. Lamellae sinuate, uncinate or adnate, close to crowded, white to yellowish (1-4A2) with entire edges. Stipe 40–170x4-12(−18)mm, cylindrical to slightly attenuated towards the base, solid, white to pale yellow (4A2-B4, 5D4-E4), with yellowish longitudinal striates(4C4, 5C2-3, 5D4-E4), fleshy-fibrous. Context white, sometimes brown-beige or grayish (4A2, 5C2, 6B3). Smell sweetish, pleasant, sometimes absent. Taste farinaceous, bitter, sometimes absent. Spores 6–9(−10)×4–5(−6)μm, Q=(1.2–)1.4–1.8 (−2), ellipsoid to oblong, ornamented with amyloid, isolated warts, hyaline. Basidia (18−)21–31(−39)×(5–)8(−10)μm, clavate, tetrasporic. Cheilocystidia (26–)51–77(−90)×8-18(−21)μm, fusiform, sometimes lageniform usually with crystals at the apices. Pleurocystidia similar to cheilocystidia. Caulocystidia (75−)80–90(−100)×(10−)15–20(−23)μm, fusiform, usually in clusters, sometimes septate and with crystals in the apex. Lamellar trama parallel. In coniferous forests (Abies, Abies-Pinus, Pinus-Quercus and Abies-Juniperus).
Píleo de 28–160mm, plano-convexo a plano, en algunas ocasiones umbonado, margen decurvado, de color café (5D5, 5E5, 5F5-8, 6E6, 5F4-6) aclarándose hacia el margen a color café amarillento (4C5, 5C3-5, 5D3-7, 5E4-6, 6D4), superficie húmeda, glabra. Láminas sinuadas, uncinadas, o adheridas, juntas a muy juntas, blancas a amarillentas (1-4A2), borde liso. Estípite 40–170×4–12(−18)mm, cilíndrico, generalmente ensanchándose un poco hacia la base, sólido, blanco a amarillo pálido (4A2-B4, 5D4-E4), con fibrillas longitudinales de color café amarillento (4C4, 5C2-3, 5D4-E4), carnoso-fbroso. Contexto blanco, color café beige, o grisáceo (4A2, 5C2, 6B3). Olor dulce, agradable, a veces inapreciable. Sabor farináceo, amargo, a veces inapreciable.
Esporas de 6–9(−10)×4-5(−6)μm, Q =(1.2−)1.4–1.8 (−2), elipsoides a oblongas, ornamentadas con verrugas aisladas, amiloides, hialinas. Basidios de (18−)21–31(−39)×(5−)8(−10)μm, clavados, tetraspóricos. Queilocistidios de (26−)51-77(−90)×8-18(−21)μm, fusiformes y algunos lageniformes, en general presentan cristales en el ápice. Pleurocistidios similares a los queilocistidios. Caulocistidios (75−)80–90(−100)×(10−)15–20(−23)μm, fusiformes, usualmente en grupos, algunos septados y con cristales en el ápice. Trama lamelar paralela.
Resumen taxonómicoHábito y hábitat. Gregario, en bosques de Abies, Abies-Pinus, Pinus-Quercus y Abies-Juniperus.
Material examinado. México. Distrito Federal: delegación Cuajimalpa, zona oriental del Desierto de los Leones, G. Guzmán 4246 (ENCB). Km 43–44 carretera México-Cuernavaca, E. Chinchilla 17008 (MEXU). Estado de México: Parque Nacional de las Lagunas de Zempoala, carretera a Chalma, L.Guzmán-Dávalos 269 (ENCB). Volcán Popocatepetl, Jones 123 (ENCB). La Marquesa, Parque Nacional Miguel Hidalgo, Mitastein s.n. (ENCB). La Marquesa-Chalma, R. Lamoche y E. Pérez 8456 (MEXU). Mpio. Amanalco, km 39 carretera Toluca-Amanalco-Valle de Bravo, Agua Bendita, Ortega-Lechuga 2 (FCME 3299). Hidalgo: San Miguel el Cerezo, Parque Nacional El Chico, L. Guzmán-Dávalos 709 (ENCB). Valle de Los Enamorados, Parque Nacional El Chico, M.Sánchez-García 32 (FCME). Mpio. Epazoyucan, Peñas Largas, Medina y García 1182 (ENCB). Mpio. Pachuca, km 10 carretera Pachuca-Tampico, Parque Nacional El Chico, L.Pérez-Ramírez 533 (FCME 14898). Mpio. Mineral del Monte, Pueblo Nuevo, E. Pérez y R. Lamoche 1002 (MEXU). Michoacán: desviación hacia Angangueo, cerro de la pirámide, ladera sur, J. Cifuentes 577 (FCME 1677). Mpio. Angangueo, km 3.5 de la desviación a Tlalpujahua carretera El Oro-Angangueo, Sánchez-Espinosa y J. Villarruel-Ordaz 698 (FCME 17166). Reserva Especial de la Biósfera de la Mariposa Monarca, Juárez, Martínez y Montañez 331 (FCME 17514). Álvarez, Busto y Montañez 369 (FCME 17688). Mpio. Ciudad Hidalgo, km 186, carretera Toluca-Morelia, Márquez s.n. (FCME 11556). Mpio. Zinapécuaro, Laguna Larga Zona de Protección Forestal Los Azufres, Bulnes y J. Cifuentes 2695 (FCME 13897). Puebla: municipio Teziutlán, finca La Magdalena al S de Teziutlán, F. Ramírez-Guillén 392 (XAL). Tlaxcala: municipio Tlaxco, El Rosario km 4.5, Parque Recreativo El Rodeo, Hernández-Muñoz 350 (FCME 5311). Veracruz: Parque Nacional Cofre de Perote, Conejos a la Cumbre, D.Murrieta 1025 (XAL).
Distribución en México. Distrito Federal, Estado de México, Hidalgo, Michoacán, Puebla, Tlaxcala y Veracruz.
Etimología. Esta especie resultó ser la más común en todos los herbarios mexicanos visitados, por lo que se le dio este nombre haciendo referencia a esta particularidad.
Comentarios taxonómicos. En este grupo se encuentran ejemplares que presentan basidiomas de distintos tamaños, con píleos que van desde 28 hasta 160mm de diámetro. En un principio se llegó a considerar que dicha variación podría indicar que se trataba de más de una especie; sin embargo, en este estudio se presenta evidencia micromorfológica, molecular y ecológica que muestra que todos los ejemplares pertenecen a una sola especie y que el tamaño del basidioma puede considerarse como un caracter con alta plasticidad fenotípica. Por otro lado, se observa que aunque los materiales europeos y mexicanos presentan similitudes morfológicas, el análisis filogenético muestra que son especies distintas.
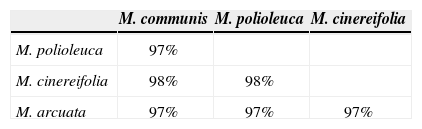
Melanoleuca communis se agrupa en un clado con M. arcuata, M. cinereifolia y M. polioleuca (Fig. 1). El porcentaje de similitud entre los 4 taxa es de 97–98% (Cuadro 2), mientras que el porcentaje de similitud intraespecífica es de mas de 99%. Nilsson et. al (2008) demostraron que la variación intraespecífica en basidiomicetes varia entre 0.3 y 17%, por lo que es difícil establecer un porcentaje único para delimitar especies; sin embargo, comparando la variación intraespecífica con la variación interespecífica en este clado, junto con información ecológica (hábitat) y geográfica podemos concluir que se trata de 4 especies distintas, sugiriendo convergencia morfológica, como ha sido documentado en otros grupos de hongos (Hibbett et al., 1997; Petersen y Hughes, 1999).
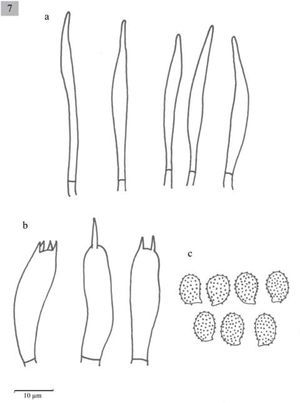
Melanoleuca herrerae Sánchez-García y Cifuentes sp. nov. MycoBank MB 804158
Tipo. México: Estado de México, municipio Amanalco, km 39 carretera Toluca-Amanalco-Valle de Bravo, Agua Bendita, J. Cifuentes 3445 (holotipo: FCME, isotipo: TENN).
Pileus 12-55mm diameter, convex to plane-convex, slightly depressed at the center, margin incurved, yellowish brown to dark brown (5E5, 5E4), surface smooth and dry. Lamellae adnate to decurrent, close to crowded, whitish (4A2, 4B3), with entire edges. Stipe 30–60x3-7mm, slightly attenuated towards the base, solid, yellowish brown, longitudinally striate. Context concolorous with the pileus surface, white in the interior. Smell pleasant, aromatic. Taste herbaceous. Spores 7–9×4-5μm, Q=1.4–1.8, ellipsoid, ornamented with amyloid warts, hyaline. Basidia 20.6–36x7.7–10μm, clavate, tetrasporic and sometimes bisporic. Cheilocystidia (38.5−)41–56.5x7.7–10μm, urticoid, sometimes with a transversal septum. Pleurocystidia scarce, similar to cheilocystidia, sometimes very difficult to observe. Lamellar trama parallel. In Quercus and Abies-Juniperus forests.
Píleo de 12 a 55mm de diámetro, convexo a planoconvexo, ligeramente deprimido en el centro, margen incurvado, de color café-amarillento a café oscuro (5E5, 5E4), superficie lisa y seca. Láminas adheridas a decurrentes, juntas a muy juntas, blanquecinas (4A2, 4B3), borde liso. Estípite de 30–60×3-7mm, ligeramente atenuado hacia la base, sólido, de color café-amarillento, cubierto de estrías longitudinales muy finas, fibroso. Contexto concoloro a la superficie del píleo, blanco hacia el centro. Olor agradable, aromático. Sabor a hierba.
Esporas de 7–9×4–5μm, Q=1.4–1.8, elipsoides, ornamentadas con verrugas amiloides, hialinas. Basidios de 20.6–36×7.7–10μm, clavados, tetraspóricos y a veces bispóricos. Queilocistidios de (38.5−)41-56.5×7.7-10μm, urticoides, algunos con un septo transversal. Pleurocistidios similares a los queilocistidios pero muy escasos y en ocasiones no se observan fácilmente. Trama lamelar paralela.
Resumen taxonómicoMaterial examinado. México. Estado de México: Amecameca-Tlamacas, L. Guzmán-Dávalos 152 (ENCB). Mpio. Amanalco, km 39 carretera Toluca-Amanalco-Valle de Bravo, Agua Bendita, J. Cifuentes 3445 (holotipo en FCME, isotipo en TENN). Michoacán: municipio Angangueo, Llano de las Papas, Reserva Especial de la Biosfera de la Mariposa Monarca, J. Cifuentes 4157 (FCME 15688). Tlaxcala: municipio Panotla, 1km al E de San Francisco Temezontla, Hernández-Cuevas 2188 (TLXM). A. Montoya-Esquivel 1282 (TLXM).
Hábito y hábitat. Gregario, en bosques de Quercus y Abies-Juniperus
Distribución en México. Estado de México, Michoacán y Tlaxcala.
Etimología. El epíteto específico se asignó en honor al Dr. Teófilo Herrera, uno de los fundadores de los estudios taxonómicos de hongos en México.
Comentarios taxonómicos. Cinco ejemplares mexicanos recolectados en el Estado de México, Michoacán y Tlaxcala, presentan características macro y micromorfológicas similares a las de M. exscissa (Fr.) Singer; sin embargo, estos especímenes se agrupan en un clado distinto con un fuerte soporte. El tipo de vegetación en donde se encuentran los integrantes de ambos clados también es similar, ya que se distribuyen en bosques templados, pero la asociación frecuente con Abies religiosa, árbol endémico de México, sugiere divergencia por hábitat congruente con la divergencia filogenética. A pesar de las similitudes morfológicas que estos ejemplares comparten con M. exscissa, pueden considerarse especies distintas con base en la posición filogenética (Fig. 1) y en la distribución geográfica.
Melanoleuca jaliscoensis Sánchez-García, Cifuentes y Guzm.-Dáv. sp.nov. MycoBank MB 804159
Tipo. México: Jalisco, municipio Zapopan, jardín del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA), Universidad de Guadalajara, Las Agujas Nextipac, G. López-Damián 50 (holotipo: IBUG, isotipo: FCME, TENN).
Pileus 65–100mm diameter, plano-convex to plane, margin decurved, pale yellowish-brown, darker in some areas, surface hygrophanous, smooth. Lamellae adnexed, sometimes decurrent, close, whitish. Stipe approximately 100mm, central, clavate, solid, smooth, concolorous with the pileus, fibrose. Context whitish. Smell fungoid. Spores (6−)7–8×5(−6)μm, Q=1.3–1.6, ellipsoid, ornamented with amyloid, warts, hyaline. Basidia (23−)25.7–30.8(33.4)×7.7μm, clavate, tetrasporic. Cheilocystidia (33.4−)36–43.6(−49)×(5−)7.7μm, urticoid, with a transversal septum and crystals at the apex. Lamellar trama parallel. In Pinus-Quercus forests or in perturbed temperate areas.
Píleo de 65 a 100mm de diámetro, plano-convexo a plano, margen decurvado, de color amarillo-café claro, en algunas áreas con tonos más oscuros, superficie higrófana y lisa. Láminas subadheridas, algunas decurrentes, juntas, blanquecinas. Estípite aproximadamente 100mm, central, clavado, sólido, liso, concoloro al píleo, fibroso. Contexto blanquecino. Olor fúngico.
Esporas de (6−)7–8×5(−6)μm, Q=1.3–1.6, elipsoides, con ornamentaciones en forma de verrugas, amiloides, hialinas. Basidios de (23−)25.7–30.8(33.4)×7.7μm, clavados, tetraspóricos. Queilocistidios de (33.4−)36–43.6(−49)×(5−)7.7μm, urticoides con un septo transversal y cristales en el ápice. Pleurocistidios escasos, difíciles de observar, similares a los queilocistidios. Trama lamelar paralela.
Resumen taxonómicoHábito y hábitat. Gregario, en bosques de Pinus-Quercus o en jardín en una zona templada.
Material examinado. México. Jalisco: municipio Zapopan, jardín del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA), Universidad de Guadalajara, Las Agujas, Nextipac, M. G. Buenrrostro 36 (IBUG). G. López-Damián 50 (holotipo en IBUG, isotipos en FCME y TENN). M. R. Sánchez-Jácome 966 (IBUG). Km 120 carretera Guadalajara-Autlán, El Mirador, Sierra de Quila, O. Vargas 265 (IBUG).
Distribución en México. Jalisco.
Etimología. El epíteto específico deriva de Jalisco, estado de donde provienen los 4 ejemplares estudiados.
Comentarios taxonómicos. Esta especie se distribuye en el estado de Jalisco, se caracteriza por presentar queilocistidios urticoides que se pueden observar fácilmente, la mayoría con un septo y cristales en el ápice, y los pleurocistidios son similares a los queilocistidios. Presenta similitudes con M. grammopodia (Bull.) Murrill; sin embargo, esta última no posee pleurocistidios. Otra especie similar es M. exscissa, pero el tamaño del basidioma es menor al de estos ejemplares, además de ser filogenéticamente distinta; M. exscissa se agrupa en un clado con M. verrucipes, mientras que M. jaliscoensis forma un clado distinto con otras 2 especies mexicanas: M. longisterigma y Melanoleuca sp1 (Fig. 1). Por lo que al no coincidir con ninguna otra descripción y por la evidencia filogenético, se considera una especie nueva.
Melanoleuca longisterigma Sánchez-García y Cifuentes sp. nov. MycoBank MB 804160
Tipo. México. Veracruz: carretera Puebla-Xalapa, cerca de la desviación a Oriental, límite con Puebla, antes de Totalco, G. Guzmán 19274 (holotipo: ENCB, isotipo: FCME, TENN).
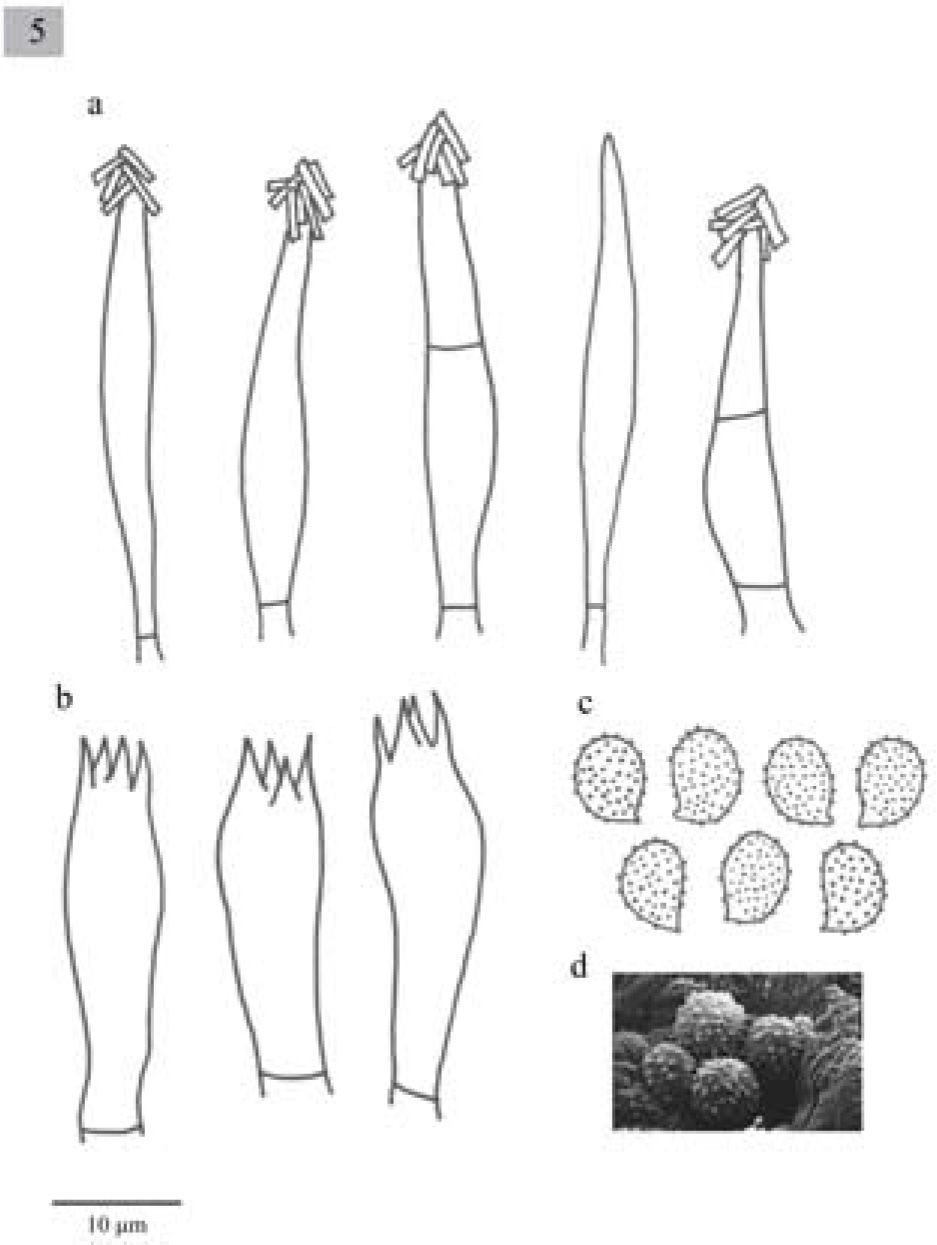
Pileus 10–50mm diameter plane, umbonate to slightly depressed, margin decurved, pale grayish-brown, surface smooth and dry. Lamellae sinuate, close, whitish. Stipe 20–60×4–9mm, central or eccentric, cylindrical somewhat broadening towards apex, solid, concolorous with the pileus surface, fleshy-fibrous. Context withish. Smell fungoid, pleasant. Spores 8–10×5–6μm, Q=1.3-1.8, ellipsoid to oblong, ornamented with amyloid, warts, hyaline. Basidia (28−)33.5–43.7×7.7–10μm, clavate, tetrasporic, but also monosporic and bisporic with long sterigmata. Cheilocystidia 33–40(−45)×5–7μm, urticoid, very difficult to observe. Pleurocystidia absent. Lamellar trama parallel. In grasslands.
Píleo de 10–50mm de diámetro, plano, umbonado a ligeramente deprimido, margen decurvado, de color café grisáceo claro, superficie lisa y seca. Láminas sinuadas, juntas, blanquecinas. Estípite 20–60×4-9mm central o excéntrico, cilíndrico y en algunos casos más ancho hacia el ápice, sólido, liso a estriado, blanquecino o concoloro con el píleo, carnoso-fibroso. Contexto blanquecino. Olor fúngico, agradable.
Esporas de 8–10×5–6μm, Q=1.3–1.8, elipsoides a oblongas, con ornamentaciones en forma de verrugas, amiloides, hialinas. Basidios de (28−)33.5–43.7×7.7–10μm, clavados, tetraspóricos, aunque también se observan mono y bispóricos, con esterigmas largos. Queilocistidios urticoides 33–40(−45)×5–7μm, muy difíciles de observar. Pleurocistidios ausentes. Trama lamelar paralela.
Resumen taxonómicoHábito y hábitat. Gregario, en pastizales.
Material examinado. México. Querétaro: entre San Juan del Río y Querétaro, G. Guzmán 11494 (ENCB). Veracruz: carretera Puebla-Xalapa, cerca de la desviación a Oriental, límite con Puebla, antes de Totalco, G. Guzmán 19274 (holotipo en ENCB, isotipos en FCME y TENN).
Distribución en México. Querétaro y Veracruz.
Etimología. El epíteto específico hace referencia a los esterigmas inusualmente largos que presenta esta especie, especialmente cuando los basidios son monospóricos.
Comentarios taxonómicos: esta especie se caracteriza por presentar basidios mono-y bispóricos. Aunque algunas especies de Melanoleuca presentan basidios bispóricos no se habían reportado monospóricos, ni con esterigmas tan largos, por lo que estos ejemplares se consideran como una especie nueva.
Melanoleuca sp. 1
Píleo de 50–82mm de diámetro, convexo con un pequeño umbo a plano-convexo, color anaranjado-café (5C3) a café oscuro (6F7, 6E6), superficie radialmente fibrilosa. Láminas sinuadas, juntas, blanquecinas (4A2), con borde liso. Estípite de 70–105×4–9mm, cilíndrico a clavado, sólido, color anaranjado-café (6C4), estriado longitudinalmente, fibroso-carnoso. Contexto blanquecino (4A2). Olor inapreciable. Sabor desagradable, amargo.
Esporas de 7–9×4–5μm, Q=1.4–1.8 (−2.2), elipsoides a oblongas, por lo general oblongas con ornamentaciones en forma de verrugas aisladas, algunas son alargadas y otras redondas, amiloides, hialinas. Basidios de (28−)33.5–39(−41)×7.5–10.5μm, 7.5–10.5μm, tetraspóricos, clavados. Queilocistidios de 51–69×8–10μm, urticoides, con cristales en el ápice. Pleurocistidios ausentes.
Resumen taxonómicoHábito y hábitat. Solitario, en bosque mesófilo de montaña.
Material examinado. México. Guerrero: municipio Chilpancingo de los Bravo, cañada de La Perra, Omiltemi, Luna s/n (FCME 13510).
Distribución en México. Guerrero.
Comentarios taxonómicos. Este ejemplar es similar a M. grammopodia, ya que presenta caracteres macromorfológicos similares, como un estípite estriado longitudinalmente y un píleo umbonado. En cuanto a los caracteres micromorfológicos se caracterizan por la presencia de queilocisitidios urticoides y la ausencia de pleurocistidios. La diferencia que tiene este ejemplar con respecto a M. grammopodia es en el tamaño de los cistidios, los cuales miden 51–90×7.5–10μm en este espécimen, mientras que los de M. grammopodia son más pequeños (25–50×5–10μm). Otra diferencia es el tipo de vegetación en que se encuentran, M. grammopodia en bosques templados mientras que este ejemplar fue recolectado en bosque mesófilo de montaña del estado de Guerrero. Este taxón se puede considerar como una especie nueva, sin embargo el material se considera insuficiente, por lo que por ahora no se puede describir.
Melanoleuca sp. 2
Píleo liso, de color moreno gris, superficie lisa. Láminas sinuadas, juntas, blancas, con borde liso o aserrado. Estípite cilíndrico, algo bulboso, concoloro al píleo.
Esporas de (6−)7-8×4–5μm, Q=(1.2−)1.4–1.75, amiloides, ornamentadas, elipsoides a oblongas. Basidios de 28–37.5×7.7–10μm, tetraspóricos, clavados. Queilocistidios de 48–51×3–4μm, urticoides, algunos con un septo transversal, muy difíciles de observar. Pleurocistidios no observados.
Resumen taxonómicoHábitat. En bosque de Pinus
Material examinado. México. Estado de México: antigua carretera México-Río Frío, cerca de Llano Grande, G. Guzmán 7540 (ENCB).
Distribución en México. Estado de México.
Comentarios taxonómicos. Corresponde a un ejemplar mexicano recolectado en el Estado de México. Es similar a M. rasilis (Fr.) Singer, por las características que presenta; sin embargo, esta última tiene láminas grisáceas. Otra especie similar es M. iris Kühner, aunque el tamaño del píleo es mayor, de 6–7.5cm y el de este ejemplar mide 4cm de diámetro. Las características de este ejemplar no corresponden con ninguna especie descrita y se muestra filogenéticamente distinta (Fig. 1); sin embargo, sólo se encontró un ejemplar que carece de suficientes datos de colecta, por lo que no se describe como nueva.
Melanoleuca yucatanensis Guzmán y Bon, Docums Mycol. 14(53): 6. 1984.
Píleo de 15–35mm de diámetro, convexo a un poco plano o subcóncavo, de color café grisáceo, superficie seca y glabra. Láminas subadnadas, juntas, blancas o blanquecinas a amarillentas. Estípite de 20–40×1–2mm, blanco a blanquecino, glabro. Contexto blanquecino. Olor inapreciable.
Esporas de (5.2−)6–7×4.5–6(−6.7)μm, globosas o subelipsoides, con ornamentaciones en forma de verrugas, amiloides, hialinas. Basidios de 16.5-28.5×9-10.5μm, tetraspóricos, clavados. Queilocistidios de 31.5-55.5×4.5-9μm, urticoides, con un septo transversal en medio y cristales en el ápice. Pleurocistidios similares a los queilocistidios pero sin cristales en el ápice.
Hábito y hábitat. Solitario, en bosque tropical perennifolio.
Distribución en México. Quintana Roo.
Comentarios taxonómicos. Es la única especie descrita previamente como endémica de México (Guzmán, 1982), aunque recientemente ha sido reportada en Italia (Fontenla et al., 2003). Se reconoce fácilmente por su tamaño pequeño y por los cistidios urticoides. No se obtuvieron secuencias de los ejemplares estudiados de esta especie, por lo que no incluyó en el análisis filogenético.
Grupo AcystisDentro de este grupo se incluyeron los ejemplares que carecen de cistidios (ver comentarios taxonómicos en esta sección y discusión)
Píleo de 28–56mm, plano-convexo a plano, ligeramente umbonado, centro color café oscuro (6F4-6, 5E4-5) a café claro (5D4) y en el margen café claro (5D4-6) a café oscuro (6E4), margen levantado, superficie lisa, seca o húmeda, en algunos casos es higrófana. Láminas adheridas o emarginadas, de juntas a muy juntas, blanquecinas a marfil (4A2, 4B3). Estípite de 28–93×3-7mm, cilíndrico, algunas veces ensanchado hacia la base, blanquecino (4A2) a color café claro (5B3, 5D4), con estrías longitudinales de color café (6E4), carnoso-fibroso. Contexto blanco. Olor inapreciable a agradable dulce. Sabor en ocasiones fúngico.
Esporas de 6–8(−9)×4–6μm, Q=1.2–1.4(−1.8), elipsoides con ornamentaciones en forma de verrugas aisladas, amiloides, hialinas. Basidios de (20−)30-39×810μm, tetraspóricos, clavados. Cistidios ausentes.
Resumen taxonómicoHábito y hábitat. Gregario, en bosques de Abies-Juniperuso Abies-Pinus.
Material examinado. Estados Unidos. Alaska: Anchorage County, Anchorage, Pop Carr Park, TFB8206, 17- septiembre-1995 (TENN 053873). Juneau County, Juneau, Bridget Point State Park, TFB8241 (TENN 053993). Idaho: Kootenai County, Beauty Creek Drainage, Coeur d'Alene, TFB5599 (TENN 052497). México: Estado de México: El Capulín, Nevado de Toluca, J. Cifuentes 2005–252 (FCME 22462). Michoacán: municipio Angangueo, Reserva Especial de la Biosfera de la Mariposa Monarca (REBMM), Ruan, González y Montañez 320 (FCME 17526). Tlaxcala: 5–6km al E de San Francisco Xavier Mina, ladera SE del volcán La Malinche, Parque Nacional La Malinche, A.Montoya-Esquivel 1404 (TLXM). Suecia. Gotland: Gotland, Viklau, nara fornborgen VSV Viklaus kyrka, LAS00-194 (GB).
Distribución en México. Estado de México, Michoacán y Tlaxcala.
Comentarios taxonómicos. Se han descrito alrededor de 12 especies de Melanoleuca sin cistidios (Bon, 1991; Gillman y Miller, 1977); sin embargo, las descripciones no son detalladas y carecen de información importante, por lo que es necesario comparar los especímenes sin cistidios con los ejemplares tipo para poder saber con certeza de qué especie se trata. Para no generar mayor confusión taxonómica, se decidió considerar por el momento a estos ejemplares como parte del grupo Acystis (grupo parafilético).
Aunque los estudios filogenéticos muestran que es muy probable que existan varias especies dentro de este grupo, no se encontraron caracteres morfológicos, ecológicos o geográficos que permitan delimitarlas. Por lo que se sugiere un estudio más detallado que incluya un tamaño de muestra mayor, incluyendo ejemplares de diferentes partes del mundo.
Clave para identificar las especies de Melanoleuca en México.
- 1a.
Cistidios ausentes……Grupo Acystis
- 1b.
Cistidios presentes……2
- 2a.
Cistidios urticoides……3
- 2b.
Cistidios lageniformes o fusiformes……8
- 3a.
Queilocistidios presentes y pleurocistidios ausentes……4
- 3b.
Queilo- y pleurocistidios presentes, aunque los pleurocistidios son escasos*……6
- 4a.
Basidios monospóricos, bispóricos y tetraspóricos. Píleo de color café crema claro, liso, umbonado a ligeramente deprimido. Estípite central o excéntrico, liso a estriado……M. longisterigma
- 4b.
Basidios únicamente tetraspóricos……5
- 5a.
Píleo de aproximadamente 30mm de diámetro, liso o color moreno gris. Láminas con bordes lisos o aserrados. En bosques de pino. Melanoleuca sp……2
- 5b.
Píleo de 50–80mm de diámetro, convexo a plano convexo de color café-amarillento. Láminas con borde liso. En bosque mesófilo de montaña. Melanoleuca sp……1
- 6a.
En selva mediana subperennifolia. Píleo de 15 a 35mm de diámetro, convexo a plano subcóncavo, glabro, seco, de color café-grisáceo. Estípite de 20–40×1–2mm……M. yucatanensis
- 6b.
En bosques de coníferas……7
- 7a.
Píleo de 65 a 100mm de diámetro……M. jaliscoensis
- 7b.
Píleo de 12 a 55……mm de diámetro……M. herrerae
- 8a.
Láminas con tonos rosáceos y se tornan más obscuras, hasta ocráceas en ejemplares maduros……M. cognata
- 8b.
Láminas blanquecinas……9
- 9a.
Píleo de 35 a 50mm de diámetro, plano-convexo a plano, de color gris claro. Caulocistidios nunca con un septo transversal, distribuidos uniformemente. En bosque mesófilo de montaña……M. cf. cinereifolia
- 9b.
Píleo de 28 a 160mm de diámetro, plano-convexo y en algunas ocasiones con un pequeño umbo, de color café oscuro a café claro. Caulocistidios a veces con septo transversal y formando pequeños grupos de 10 a 30 cistidio. En bosques de coníferas……M. communis
*Los pleurocistidios urticoides a veces son difíciles de observar, por lo que se recomienda realizar cortes muy delgados y hacer varias preparaciones, para saber con certeza si estas estructuras están o no presentes.
La mayoría de las especies mexicanas se distribuyen a lo largo del Eje Volcánico Transmexicano, que es una zona de gran riqueza biológica y donde se registra una importante cantidad de especies endémicas (Morrone, 2005), por lo que el hecho de encontrar especies nuevas en esta zona es algo común en distintos grupos de organismos (Corona et al., 2007; Villaseñor y Ortiz, 2007).
A pesar de que una gran parte de las especies mexicanas resultaron ser nuevas no se debe descartar el posible uso de nombres europeos para ejemplares mexicanos, pues en algunos casos sí se trata de las mismas especies, como M. cognata o casi idéntica como M. cf. cinereifolia, taxa descritos para Europa que se encontraron en México. Aunque no debe dejarse de lado el hecho de que puedan ser especies introducidas, para lo que serían necesarios estudios filogeográficos que permitan conocer su distribución original y posibles mecanismos de dispersión (ej. Vizzini et al., 2009). Por este motivo recomendamos analizar cada caso por separado y tratar con cuidado los nombres Europeos para ejemplares de América, especialmente de la región neotropical.
Melanoleuca melaleuca (Pers.) Murrill ha sido considerada por algunos autores como una especie que posee cistidios fusiformes y lageniformes (Gillman y Miller, 1977; Pegler, 1977; Bon, 1991; Fontenla et al., 2003), mientras otros la tratan como una especie carente de cistidios (Kühner, 1978; Watling y Turnbull, 1998; Boekhout, 1999; Horak, 2005; Vesterholt, 2008).
En 1887, cuando Patouillard describió el género Melanoleuca, basó su descripción en Agaricus melaleucus Pers., que denominó M. vulgaris Pat. Posteriormente, Murrill (1911) renombró a esta especie M. melaleuca, dando una descripción más detallada que la original, pero basándose en ejemplares recolectados en EUA; en dicha descripción tampoco mencionó la presencia o ausencia de cistidios.
En 1953 Kühner y Romagnesi en su Flore analytique de champignons supérieurs, consideraron a M. melaleuca como una especie con cistidios prominentes. Posteriormente, Kühner (1978) cambió de opinión y la consideró carente de cistidios, argumentando que los ejemplares recolectados y descritos en esta publicación eran muy parecidos a la ilustración que Fries (1867) presentó en su obra Icones selectae Hymenomycetum nondum delineatorum como el típico A. melaleucus. Kühner correlacionó la presencia de cistidios con un píleo pruinoso y la ausencia de dichas estructuras con un píleo glabro.
Fontenla et al. (2003) designaron un neotipo de M. melaleuca el cual posee cistidios, indicando que la ornamentación del píleo no esta correlacionada con la presencia de los cistidios y que el epíteto ha sido usado por la mayoría de los autores para referirse al taxón con cistidios. Es claro que esta especie ha sido objeto de discusión entre la comunidad micológica; sin embargo, la designación de un neotipo pone fin a la disputa, proporcionando un panorama preciso acerca de los caracteres morfológicos que definen a este taxón.
A pesar de que el nombre M. melaleuca ha sido usado para denominar a ejemplares mexicanos, en este trabajo no se encontró ningún ejemplar que corresponda a este taxón; por lo que se recomienda analizar cuidadosamente los ejemplares de Melanoleuca para evitar el uso inadecuado de nombres europeos.
A los curadores de los herbarios ENCB, IBUG, GB, MEXU, TLXM y XAL por las facilidades otorgadas para la consulta de sus colecciones. A CONACyT y al posgrado en Ciencias Biológicas por brindar el apoyo y facilidades a MSG para llevar a cabo este proyecto. Al programa de Becas Mixtas CONACyT por otorgar el apoyo económico a MSG para realizar una estancia de investigación en la Universidad de Tennessee. A la Dra. Claudia Segal, Dra. Luisa Alba-Lois y a la M. en C. Beatriz Rodarte por su ayuda en la obtención de las secuencias. A la M. en C. Laura Márquez por el servicio de secuenciación. A la Dra. Silvia Espinosa por la obtención de fotografías al microscopio electrónico de barrido. A Joshua Birkebak por su ayuda en la elaboración de los dibujos. Este proyecto fue financiado por los proyectos PAPIIT-IN218008, PAPIIT-IN207311 y por la Universidad de Tennessee.