Las especies del género Tuber han recibido escasa atención taxonómica en México, a pesar de su gran importancia ecológica y económica. A la fecha, 10 especies han sido descritas para el país. En este estudio se describen por primera vez para la micobiota Mexicana a Tuber canaliculatum, T. gibbosum y T. malacodermum. Las especies fueron determinadas por una combinación de características principalmente morfológicas y ecológicas. Así mismo, se presenta una clave dicotómica de las especies conocidas y descritas para México.
Species in the genus Tuber have received little taxonomic attention in Mexico, despite its great ecological and economic importance. Only 10 species have been described for Mexico. In this study, Tuber canaliculatum, T. gibbosum, and T. malacodermum are described for the first time for the Mexican mycobiota. These species are distinguished by a combination of morphological and ecological characteristics. Illustarations and a dichotomic key are presented for the known described species from Mexico.
Originalmente todas las verdaderas trufas eran consideradas en el Orden Tuberales (Gilkey, 1916) hasta que su validez fue cuestionada por Trappe (1979). Recientes análisis moleculares muestran que las trufas corresponden al menos a 5 o 6 linajes independientes, dentro del Orden Pezizales y están representadas en 55 géneros, de los cuáles sólo 5 pertenecen a la Familia Tuberaceae (Tuber, Choiromyces, Dingleya, Labyrinthomyces y Reddellomyces) (O'Donnell et al., 1997; Lsssoe y Hansen, 2007).
El género Tuber fue acuñado por P. Micheli en 1729 siendo la especie tipo T. brumale Vittad. (Vittadini, 1831; Montecchi y Sarasini, 2000). Las especies del género Tuber, son de importancia ecológica y económica (Moreno-Arroyo et al., 2005; Mello et al., 2006; Tedersoo et al., 2006; Lsssoe y Hansen, 2007; Trappe et al., 2009). Crecen en asociación simbiótica micorrízica con árboles de gimnospermas y angiospermas incluyendo varias especies de orquídeas (Wurzburger et al., 2001; Bidartondo et al., 2004; Walker et al., 2005; Shefferson et al., 2008).
Además, sus especies forman parte de la dieta de pequeños mamíferos roedores, así como de venados, osos, jabalíes y de invertebrados, como insectos y caracoles, entre otros dispersores importantes para la diseminación de sus propágalos (McGraw et al., 2002; Hochberg et al., 2003; Maser et al., 2008).
Regularmente las especies del género Tuber son económicamente importantes porque algunas de ellas han sido cultivadas para consumo humano (e.g. Tuber borchii Vittad., T. melanosporum Vittad., entre otras) y esta actividad se ha convertido en la base de una industria multimillonaria, principalmente en Europa pero no existe en México (Palenzona et al., 1972; Mischiati y Fontana, 1993; Moreno-Arroyo et al., 2005; Paolocci et al., 2006; Guevara et al., 2008; Trappe et al., 2009).
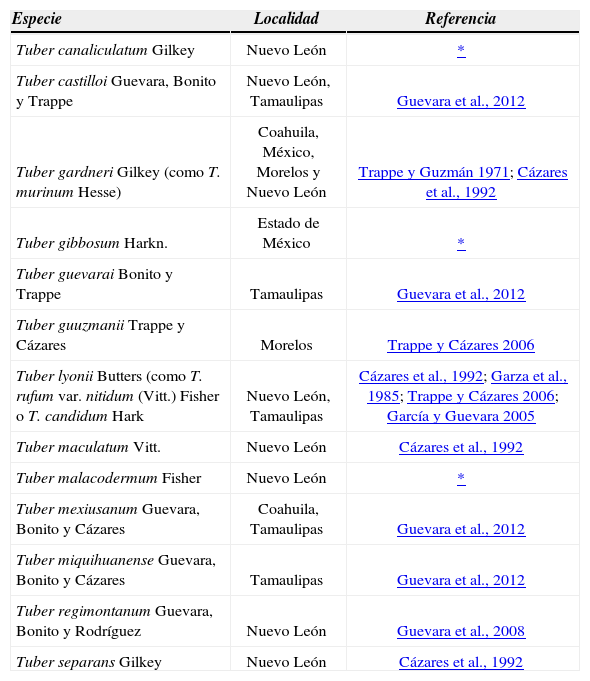
Kirk et al. (2008) mencionan que se conocen 86 especies del género Tuber en el mundo. Más de 60 especies de Tuber han sido descritas principalmente de los bosques templados del oeste de EUA (Trappe et al., 2009). Para México, hasta antes de la presente investigación, sólo habían sido citadas 10 especies (Cuadro 1). A pesar de la alta diversidad de hongos macromicetos que se estima existen en México, las especies de Tuber citadas para el país representan sólo el 16% de las descritas para E.U (Trappe y Guzmán, 1971; Garza et al., 1985; Cázares et al., 1992;Trappe et al., 1996; García y Guevara, 2005; Trappe y Cázares, 2006; Guevara et al., 2008; Guevara et al., 2012).
Especies de Tuber conocidas y descritas para México
| Especie | Localidad | Referencia |
|---|---|---|
| Tuber canaliculatum Gilkey | Nuevo León | * |
| Tuber castilloi Guevara, Bonito y Trappe | Nuevo León, Tamaulipas | Guevara et al., 2012 |
| Tuber gardneri Gilkey (como T. murinum Hesse) | Coahuila, México, Morelos y Nuevo León | Trappe y Guzmán 1971; Cázares et al., 1992 |
| Tuber gibbosum Harkn. | Estado de México | * |
| Tuber guevarai Bonito y Trappe | Tamaulipas | Guevara et al., 2012 |
| Tuber guuzmanii Trappe y Cázares | Morelos | Trappe y Cázares 2006 |
| Tuber lyonii Butters (como T. rufum var. nitidum (Vitt.) Fisher o T. candidum Hark | Nuevo León, Tamaulipas | Cázares et al., 1992; Garza et al., 1985; Trappe y Cázares 2006; García y Guevara 2005 |
| Tuber maculatum Vitt. | Nuevo León | Cázares et al., 1992 |
| Tuber malacodermum Fisher | Nuevo León | * |
| Tuber mexiusanum Guevara, Bonito y Cázares | Coahuila, Tamaulipas | Guevara et al., 2012 |
| Tuber miquihuanense Guevara, Bonito y Cázares | Tamaulipas | Guevara et al., 2012 |
| Tuber regimontanum Guevara, Bonito y Rodríguez | Nuevo León | Guevara et al., 2008 |
| Tuber separans Gilkey | Nuevo León | Cázares et al., 1992 |
La taxonomía de las trufas es particularmente difícil debido a la delimitación de las especies dentro de los grupos (Halász et al., 2005; Bonito et al., 2010a). Sus características morfológicas en muchos casos son confusas, por su variación debido a factores edáficos y ambientales, así como genéticos. En estos casos los datos ecológicos y los análisis moleculares pueden dar información complementaria sobre su ubicación taxonómica, sin embargo, no siempre es sencillo.
Existe una gran controversia acerca de la posición taxonómica y filogenética de algunas de las especies recientemente colectadas en México y EUA, y sobre la aplicación de nombres de especies que fueron descritas de Europa a especies que prosperan en Norteamérica (Harkness, 1899; Gilkey, 1954; Trappe, 1979: Trappe y Cázares, 2000). Recientemente, algunos análisis moleculares de las especies de Tuber demostraron que ejemplares del noreste, centro y sur de México son genéticamente diversos (Bonito et al., 2010a; Guevara et al., 2012).
En esta investigación, Tuber canaliculatum Gilkey, T. gibbosum Harkn. y T. malacodermum E. Fisch., son descritas por primera vez para la micobiota mexicana. Se utilizaron características morfológicas y aspectos ecológicos para distinguir estas especies. Esta revisión tiene como objetivo contribuir al conocimiento de la biodiversidad, ecología y biogeografía de las especies del género Tuber de México. En el presente trabajo se hace una descripción completa de las 3 especies anteriormente mencionadas, se proporcionan comentarios taxonómicos de las especies previamente citadas para el país y una clave taxonómica para la determinación de las 13 especies de Tuber que se reconocen para México.
Materiales y métodosRecolección de ejemplares. En esta investigación se estudiaron más de 100 ascomas de Tuber spp., la mayoría se recolectó recientemente (en el otoño de 2008, 2009 y 2010) y otros son especímenes que ya se encontraban depositados en los herbarios de OSC y del ITCV (http://www.nybg.org/bsci/ih/ih.html). Los ejemplares recolectados proceden de la sierra Madre Oriental de Tamaulipas (El Diente, sierra de San Carlos, San José y La Joya de Gómez Farías, Miquihuana), Nuevo León (montaña de Chipinque, Santa Catarina, Puerto Genovevo, Santiago), Coahuila (La Siberia, Arteaga), Veracruz (Cofre de Perote). Además de la sierra Madre Occidental, Jalisco (Parque Nacional La Primavera, volcán Tequila) y algunas localidades del centro de México (Puebla, Tlaxcala, Estado de México). Los ecosistemas forestales dominantes en donde se recolectó, fueron principalmente bosques mixtos de encino-pino y abeto. Todos los especímenes fueron herborizados y preservados siguiendo las recomendaciones de Castellano et al. (1989). Posteriormente fueron depositados en el Herbario José Castillo Tovar (ITCV) con duplicados en los herbarios de Oregon State University (OSC), Universidad de Duke (DUKE) y Fungal Biodiversity Centre (CBS), Holanda.
Observaciones morfológicas. Para la determinación taxonómica se siguieron los métodos de Gilkey (1916, 1939, 1954), Pegler et al. (1993) y Montecchi y Sarasini (2000), entre otros. Los cortes a mano fueron montados en KOH 5%, agua y reactivo de Melzer. Las estructuras microscópicas de los especímenes se midieron y se fotografiaron en un microscopio compuesto marca Carl Zeiss (Axistar) y en un estereoscopio de la misma marca con una cámara Canon Power Shot G5.
DescripcionesTuber canaliculatum Gilkey, Mycologia 12 (2): 99, 1920
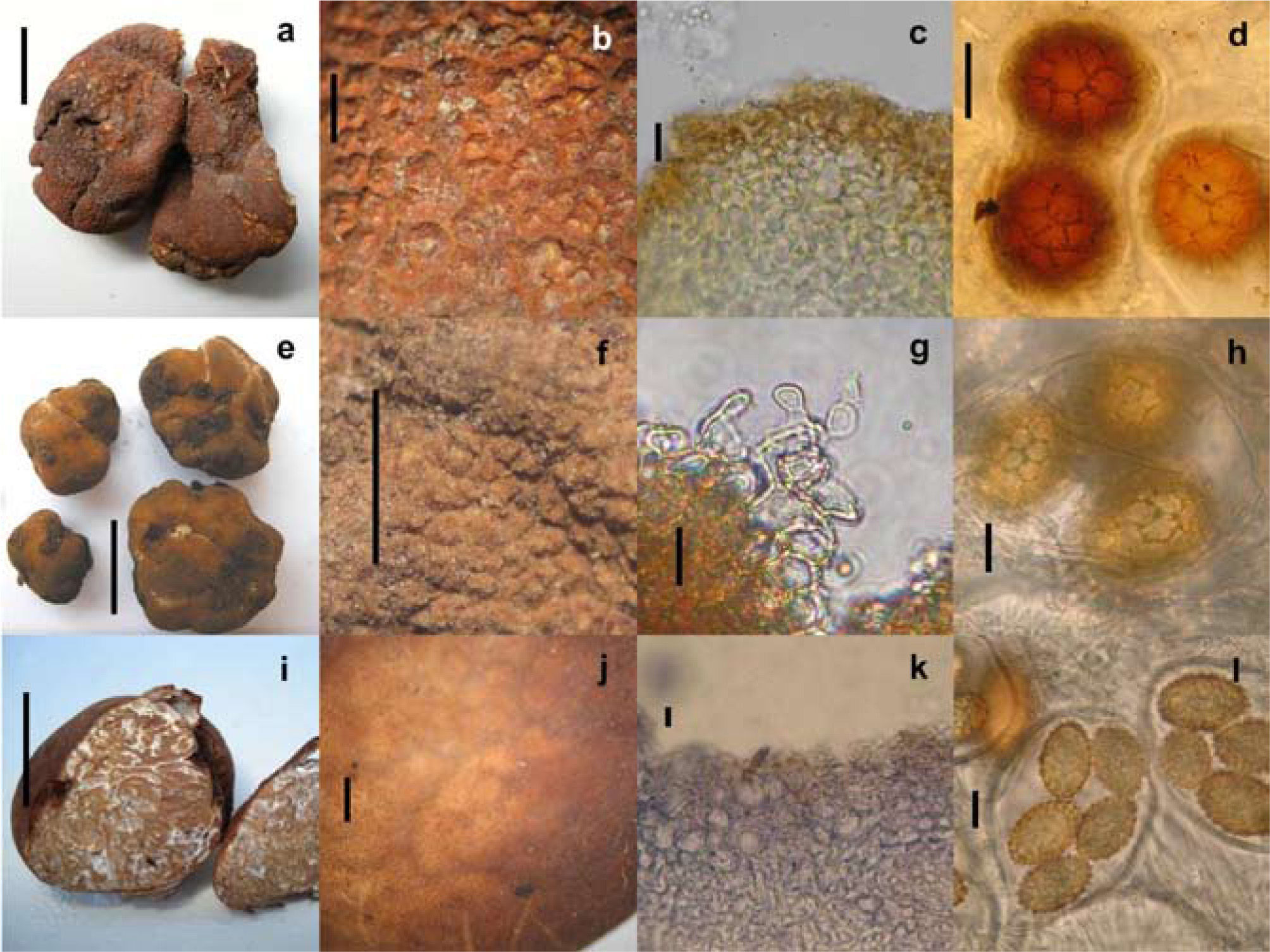
Tuber canaliculatum: a, ascoma (barra= 1cm); b, peridio (barra= 1mm); c, epicutis pseudoparenquimatoso (barra= 10μm); d, ascosporas en asca (barra= 20μm). Tuber gibbosum: e, ascomas (barra= 1cm); f, peridio (barra= 1mm); g, cistidios versiformes con pared celular irregular (barra= 10μm); h, ascosporas en ascas (barra= 15μm). Tuber malacodermum: i, ascoma (barra= 1cm); j, peridio (barra= 1mm); k, epicutis pseudoparenquimatoso (barra= 20μm); l, ascosporas en asca (barra= 10μm).
Ascoma de 32×28×22mm, globoso a irregular, ligeramente lobado, sólido y muy quebradizo. Peridio de 0.5mm de ancho, café rojizo, naranja rojizo a color ladrillo, desprendible parcialmente, con verrugas piramidales de varios tamaños en todo el ascoma, escamas angulares o papilas (de 1-2 papilas por mm.) con puntas redondas o planas, con surcos no profundos hacia la base, negativo con el KOH. Gleba sólida, café a café obscuro o negrusca, con venas blancas a crema, marmoleada. Olor a nuez, sabor no registrado.
Peridio de 500–1 500μm de grosor. Capa más externa (epicutis) pseudoparenquimatosa de 600–1 500μm de ancho, hifas de 3–16μm diam. angulares o isodiamétricas, café rojizo a café obscuro, pared gruesa (2–4μm), en algunas áreas con hifas postrada y entrelazadas (prosénquima), de pared gruesa, café obscuro en KOH, con algunas hifas claviformes aisladas de 4–5μm de ancho, presentes entre las verrugas. Capa interna (subcutis) de 100–250μm de ancho, fácilmente distinguible de la capa externa, hifas de 2–4μm de ancho al septo, hialinas en KOH. Venas formadas por hifas entrelazadas hialinas de 2–4μm de ancho al septo, de pared delgada. Ascas de 75–125×75–110μm. piriformes a ampliamente elipsoides, con o sin un pequeño pedicelo, ascas biesporadas más anchas que largas, de pared gruesa (2 μm), con 1, 2 y 3 ascosporas por asca. Ascosporas de 30–62×30–52μm sin ornamentación, alvéolos de 5–11μm de longitud, ascosporas muy maduras con una subreticulación presente, globosas, subglobosas a ampliamente elipsoides de 3–5 alveolos a lo largo de la longitud de la ascospora, 3–4 transversal, 1 ascospora en una asca miden de 50–62×45–52μm (Q= 1.1.1.3), con 2 de 32–44×32–41μm (Q= 1.0- 1.1), con 3 de 30–35×30–4μm (Q= 1.0-1.0), naranja rojizo, café rojizo a café obscuro en KOH.
Resumen taxonómico. Nuevo León: camino a El Diente, municipio de Santa Catarina, hipogeo, solitario, en bosque de pino-encino, 13 septiembre 1981, R. Valenzuela 149 (ENCB) (duplicado ITCV y OSU).
Comentarios taxonómicos. Esta especie puede ser reconocida por presentar 2 ascosporas por asca y por el color café o anaranjado rojizo del peridio y con escamas piramidales angulares. Concuerda macroscópicamente con la descrita por Gilkey (1939) y Trappe et al. (2007) salvo el tamaño de las ascosporas ligeramente más grandes de 48–72×40–52. Tuber canaliculatum es similar a T. linsdalei Gilkey, pero esta última tiene un peridio café a café grisáceo y escamas más pequeñas; también es afín a T. irradians Gilkey y T. murinum R. Hesse, pero ambas especies presentan ascoma café grisáceo y ascosporas elipsoides con 5-14 alveolos a lo largo de la ascospora (Trappe, com pers.). El ejemplar “R. Valenzuela 149” fue citado por Castillo (1987) para el estado de Nuevo León como Tuber sp.
Tuber castilloi Guevara, Bonito y Trappe, Mycologia (doi 10.3852/12-087), 2012
Resumen taxonómico. Nuevo León: localidad cañón de Puerto Genovevo, municipio de Santiago, hipogeo, solitario, bajo Quercus rysophylla en bosquemixto de pino- encino, 25 Junio 1985, E. Cázares 149 (ITCV holotipo, OSC 130902 isotipo). E. Cázares 142 (ITCV Paratipo). Tamaulipas: localidad sierra de San Carlos, municipio de San Carlos, 8 Junio 1985, J. García 4739 (ITCV).
Comentarios taxonómicos. Tuber castilloi es parecido a T. guevarai por el color amarillo crema a café claro de sus ascomas y por la estructura del peridio, pero T. guevarai tiene ascosporas más pequeñas, de 36–55×28μ42m (Q= 1.2-1.3), mientras que en T. castilloi son de 27–63×20–40μm (Q= 1.4-2.3), y por presentar de 10–12 finas papilas o verrugas por mm en el peridio (Guevara et al., 2012). Tuber castilloi también tiene dermatocistidios, como algunas especies europeas, tales como T. puberulum Berk. y Br., T. rapaeodorum Tul. y C. Tul. y T. borchii Vittad., pero en T. castilloi el rango de tamaño varia de 27–42×3–4μm, mientras que en las especies europeas miden de 60–110×4–9μm para T. puberulum, y entre 35–80×3–5μm para ambas T. rapaeodorum y T. borchii (Lange, 1956; Pegler et al., 1993). Un análisis molecular ubica a T. castilloi dentro del clado Maculatum junto con T. guevarai. La variación interespecífica entre estas 2 especies es >2.6%, y la variación intraespecífica en T. castilloi es <1.0%. La base de datos de las secuencias génicas de las ectomicorrizas provenientes de la localidad tipo confirma que T. castilloi forma ectomicorriza con diferentes especies de Quercus (Guevara et al., 2012).
Tuber gardneri Gilkey [='gardnerii'], Univ. Calif. Publ. Bot. 6 (11): 317, 1916
Resumen taxonómico. Coahuila: localidad cerro del Mercado, municipio de Castaños, hipogeo, solitario a gregario bajo Quercus sp. en bosquede encino, 17 mayo 1981, García 3004 (ITCV). Nuevo León: Santiago, El Cercado, 19 marzo 1983, Moreno 1 (ITCV).
Comentarios taxonómicos: Los especímenes García 3004 (ITCV) y Moreno 1 (ITCV) fueron citados por Cázares et al. (1992) como T. murinum; sin embargo, esta especie es sólo de distribución europea (Trappe et al., 2006). También Trappe y Guzmán (1971) citaron a T. murinum para México, pero como comentan Trappe y Cázares (2006), T. gardneri es el nombre correcto para los ejemplares americanos. Tuber gardneri puede ser reconocida por su tamaño pequeño, peridio de color café amarillento, finamente verrucoso, ascosporas con hasta 14 alveolos a lo largo de la ascospora y ascas con pared celular muy gruesa.
Tuber gibbosum Harkn., Proc. Calif. Acad. Sci., Ser. 3, 1: 273, 1899
Ascoma de 5–23×4–16×3–11mm, subterráneo, subgloboso, irregular, lobado o giboso, amarillo crema, café naranja, café rojizo cambiando a café obscuro con el trato, finamente verrucoso o granuloso con 5–8 verrugas por 1mm, sólido, frágil, seco, sésil. Peridio no desprendible de <0.5mm de ancho, con una o varias fisuras basales de color blanco a crema, los surcos o depresiones se continúan hacia dentro de las venas en la gleba. Negativo en KOH. Gleba marmoleada, blanca a gris, venas blancas, algunas venas terminando en el peridio. Olor fúngico o similar a papas crudas, sabor no registrado.
Peridio de 110–350μm de ancho. Capa externa (epicutis) pseudoparenquimatosa de 62–250μm de ancho, hifas de 5–30μm diámetro, versiformes, angulares o isodiamétricas, en otras áreas las hifas están arregladas perpendicularmente al epicutis, hialinas a café rojizo en masa en KOH, de pared gruesa (2μm). Pelos hifales versiformes, cistidios de 53–97×4–5μm a la base, atenuándose hacia la punta, algunas con septos, solitarias o en grupos, quebradizas, de pared delgada, hialinas en KOH. Otras hifas erectas claviformes, cilindricas, o sinuadas, con el grosor de la pared celular irregular dando la apariencia de nudos o espinas. Otras hifas globosas o constrictas que emergen de hifas isodiamétricas de 3–10μm de ancho. Capa interna (subcutis) de 50–225μm de ancho, postradas y entrelazadas, gradualmente mezclándose hacia la gleba, hialinas en KOH y azul de tripano, hifas de 2–5μm de ancho al septo. Algunos especímenes inmaduros presentaban hifas vermiformes, postradas, cilindricas a lo largo del subcutis, de pared gruesa. Venas formadas por hifas hialinas, entrelazadas, de pared delgada. Ascas de 62–95×57–77μm, globosas, subglobosas a ampliamente elipsoides, sin pedicelo, hialinas en KOH, amarillentas a café claro en Melzer, pared delgada, (pared celular en ascas inmaduras hasta de 7.5μm de grosor), 1–5 (– 6) ascosporas por asca. Ascosporas de 23–58×18–48μm sin ornamentación, subgloboseas, globosas a ampliamente elipsoides, alveolos de 2–7 um de longitud, con 7–10 alveolos a lo largo de la ascospora, 5–6 transversal. Tamaño de ascosporas en ascas con una ascospora es de 42–58×27–48μm (Q=1.1–1.5), con 2 de 25–52×23–40μm (Q=1.0–1.6), con 3 de 27–40×20–30μm (Q=1.0–1.4), con 4 de 23–38×18–28μm (Q=1.1–1.7), con 5 de 25–32×18–25μm (Q=1.0–1.3), amarillentas a café claro en KOH y reactivo de Melzer. Alveolos poligonales (4–6 lados), pared celular de 2–3μm de grosor.
Resumen taxonómico. Estado de México: esta especie se conoce del noroeste de EUA y del Parque Nacional Nevado de Toluca, carretera Toluca-Temascaltepec, localidad La Puerta, asociada a abetos. Subterráneo, gregario en bosquede Abies religiosa Kunth Schltdl. et. Cham., a 3 065.m. 19°11. 66' N, 99°48. 53' O, 29 julio 2010, Guevara 1110 (ITCV), 11 julio 2008, Guevara 993 (ITCV). Suelo volcánico.
Comentarios taxonómicos. Esta especie se caracteriza por estar asociada primeramente con pináceas, además de presentar hifas en el epicutis con pared celular irregular. Nuestro material concuerda con Bonito et al. (2010c) quienes redescribieron a T. gibbosum al estudiar su holotipo. Esta especie es muy similar a T. castellanoi G. Bonito y Trappe, pero esta última tiene ascosporas más pequeñas de 20–44×18–38μm, cistidios ausentes en el peridio y asociada principalmente con Pseudotsuga menziesii (Mirb.) Franco, aunque también ha sido encontrada cerca de Abies concolor (Gord. et. Glend.) Lindl., Pinus lambertiana Dougl., P. ponderosa Laws. and Quercus spp. (Bonito et al., 2010c). Esta especie también es similar a T. puberulum Berk. y Broome y T. rapaeodorum Tul y C. Tul., ambas de Europa pero la primera especie tiene cistidios más grandes de 60–110×4–9μm mientras que la segunda más pequeños de 35–80×3–5μm (Lange, 1956; Montecchi y Sarasini, 2000; Pegler et al., 1993).
Tuber guevarai Bonito y Trappe, Mycologia (doi 10.3852/12-087), 2012
Resumen taxonómico. Tamaulipas: localidad cerro El Diente, municipio de San Carlos, hipogeo, solitario, bajo Quercus sp., en bosque de encino, 8 Junio 1985, G. Guevara 180 (ITCV holotipo, OSC isotipo).
Comentarios taxonómicos. Tuber guevarai es parecido a T. castilloi (ver el apartado de Comentarios taxonómicos en T. castillo para las diferencias). También es similar a las especies europeas T. rapaeodorum and T. borchii en la estructura peridial, pero T. rapaeodorum tiene dermatocistidios dispersos de 56–80 (–115)μm de largo y ascosporas globosas, mientras que T. guevarai tiene dermatocistidios de 20–60×2–4×μm de largo y ascosporas subglobosas a elipsoidales, y T. borchii también tiene dermatocistidios de 50–80×μm de largo (Lange 1956; Pegler et al., 1993; Mello et al., 2000; Halász et al., 2005; Guevara et al., 2012). Además, las ascosporas ampliamente elipsoides de T. guevarai distinguen esta especie de T. californicum Harkn. que tiene ascosporas globosas. Estudios moleculares ubican a T. guevarai dentro del grupo Maculatum y como especie hermana a T. castilloi. Las secuencias obtenidas de raices micorrizads provenientes de la localidad tipo confirman su asociación con Quercus.
Tuber guzmanii Trappe y Cázares International Journal of Medicinal Mushrooms 8 (3): 279, 2006
Figs. 1a, b; 2 a, b; 3, 4
Resumen taxonómico. Morelos: km 10 hacia el norte por la carretera vieja Cuernavaca-México, hipogeo, solitario a gregario bajo Quercus sp., en bosque de encino-quercus y pino-encino, 12 septiembre 1972, J. Trappe 3474 (holotipo XAL, isotipo OSC 111942). Paratipo: J. Trappe 3480 y 3481 (XAL, MEXU, OSC 111943).
Comentarios taxonómicos. Esta especie es única por su gran diversidad en la forma de las ascas, presencia o ausencia de pedicelo, variación en su pared celular que se engrosa al madurar y por tener un gran amplio intervalo de tamaño y formas de las ascosporas (subglobosas a estrechamente elipsoides). Debido a esta última característica puede ser confundido con T. besseyi Gilkey, una especie de los bosques del noroeste de los EUA y Canadá (Trappe y Cázares, 2006), de la cual se diferencia porque ésta última tiene ascosporas estrechamente elipsoides que pueden medir hasta 18μm más largas que anchas en ascas con una o 2 ascosporas. También es similar a T. monticola Harkn. (=T. monticulum), pero ésta presenta ascosporas en su mayoría subglobosas o globosas, que rara vez son más de 7μm más largas que anchas.
Tuber lyonii Butters, Bot. Gaz. 35: 431, 1903 (=Tuber texense Heimsch, Mycologia 50: 657, 1958
Resumen taxonómico. Nuevo León: municipio de Garza Garcia, Chipinque, E. Cázares y J. García, 24 septiembre 1983 (ITCV como Tuber rufum var. nitidum, OSC58767, 58774); Santiago, camino Camotera-Potrero Redondo, E. Cázares 89, 17 septiembre 1983 (ITCV como Tuber rufum var. nitidum, OSC 58764); Santiago, cañón de Puerto Genovevo, E. Cázares, 8 octubre 1982, 17 octubre 1982, 13 noviembre 1982, J. García, 23 octubre 1983 (ITCV como Tuber rufum var. nitidum, OSC 58758, 58759, 58760, 58761, 58762); Santiago, cañón del Tejocote, E. Cázares, 16 septiembre 1983 (ITCV como Tuber rufum var. nitidum, OSC 58766); Santiago Col. Los Pescadores, E. Cázares, 8 octubre 1983 (ITCV Tuber rufum var. nitidum, OSC 58763); Santiago, El Barro, J. García, 27 noviembre 1983 (UNL y ITCV como Tuber rufum var. nitidum, OSC 58771, 58772); Santiago El Cercado, J. García, 8 octubre 1983 (ITCV como Tuber rufum var. nitidum, 58773); El Ranchito, J. García, 14 septiembre 1983 (ITCV como Tuber rufum var. nitidum, OSC 58768, 58769, 58770); Tamaulipas: Cd. Victoria, El Madroño, J. García, 20 octubre 1988, (ITCV como Tuber rufum var. nitidum, OSC 58776); La Palma, Carr. Cd. Victoria-Soto La Marina, J. García, 22 octubre 1984 (ITCV como Tuber rufum var. nitidum, OSC 58775). Subterráneo, gregario en bosque de encino a 900–1 450m.
Comentarios taxonómicos. Esta especie fue descrita para el noreste de México como Tuber rufum var. nitidum por Cázares et al. (1992); sin embargo, Trappe et al. (1996) estudiaron el holotipo de T. lyonii, así como recolectas de T. texense Heimsch, material mexicano y canadiense, y concluyeron que T. lyonii es sinónimo de T. texense al igual que las recolectas mexicanas y canadienses, por lo que es una especie de amplia distribución. Tuber lyonii es muy parecida a T. malacodermum pero esta última se diferencia por el tamaño de las células pseudoparenquimatosas del peridio que miden de 10–25 (–70)μm de ancho mientras que en T. lyonii miden de 6–10μm. También es similar a T. spinoreticulatum Uecker y Burds. pero se diferencia porque esta última especie presenta la superficie del ascoma con escamas hasta 1mm de ancho (Trappe et al., 1996).
Tuber maculatum Vittad., Monog. Tuberac. (Milano): 45, 1831
Resumen taxonómico. Nuevo León: Santiago, cañón de Puerto Genovevo, 23 octubre 1983, Patlán 1 (ITCV), hipogeo, solitario, bajo Quercus rysophylla Weath. en bosquede encino.
Comentarios taxonómicos. Esta especie fue descrita por primera vez para Norteamérica por Cázares et al. (1992) y posteriormente por Trappe y Cázares (2000). Tuber maculatum se caracteriza por presentar un epicutis prosenquimatoso compuesto principalmente de células postradas, alargadas de pared gruesa, paralelas a la superficie del peridio (Pegler et al., 1993; Trappe y Cázares 2000; Halasz et al., 2005). El concepto de Tuber dryophilum Tul. y Tul. de Gilkey, T. australe Spegazzini de Argentina y T. clarei Gilkey de Australia, resultaron ser T. maculatum (Trappe y Cázares 2000). Aunque T. maculatum ha sido citada recientemente de Norteamérica, fuera de su distribución original de Europa, Australia y Asia, algunos estudios moleculares recientes han demostrado que existen al menos 8 especies en el complejo (clado) maculatum y algunas son especies nuevas que están sólo presentes en Norteamérica (Trappe y Cázares, 2000, Bonito et al., 2010a).
Tuber malacodermum Fisher, Verh. Naturf. Ges. Basel 35: 49, fig. 9, 1923
Ascoma de 15–20×7–17×7–15mm, subgloboso a ovoide, rojizo, ferruginoso o café obscuro, sésil. Peridio liso en algunas áreas a finamente areolado, con pequeñas escamas (10–12 en 1mm), seco. Peridio desprendible, sin dermatocistidios y con surcos claros a cafés. Gleba blanquecina, crema-grisáceo a café claro, marmoleada con venas blancas. Olor fúngico y sabor no registrado. Peridio de 750μm de grosor, capa externa (epicutis) pseudoparenquimatosa de 50–150μm de ancho, las células de 5–30 (–68)μm de ancho, versiformes a angulares o isodiamétricas, hialinas a café rojizo en KOH, las paredes hasta 5μm de grosor. Capa interna (subcutis) de 88–500μm de ancho, bien delimitada del epicutis, hifas entrelazadas, hialinas de 4–6μm ancho al septo. Venas de la gleba formada por hifas hialinas, entrelazadas de 2–7μm de ancho al septo, pared delgada, algunas hifas infladas, entrelazadas y sinuadas. Ascas de 63–100×3655μm incluyendo el pedicelo, ampliamente claviformes a subglobosas, hialinas en KOH, pared celular de 4μm de grosor, amarillentas a cafés en reactivo de Melzer, con un pedicelo bifurcado, a veces constrictas y sinuadas a la base. Pared celular formada por 3 capas fácilmente visibles en KOH y azul de tripano.
Ascosporas elipsoides a ampliamente elipsoides; excluyendo la ornamentación. Tamaño de ascosporas en ascas con una ascospora miden de 28–40×16–24μm (Q=1.3–2.0), con 2 ascosporas de17–33×14–20μm (Q=1.2–1.9), con 3 de 20–28×14–18μm (Q=1.4–1.6), con 4 de16–25μ 13–17μm (Q=1.1–1.7), con 5 de 17–21×13–17μm (Q=1.1–1.5), en muchas ascosporas las espinas esta conectadas por líneas basales que le dan la apariencia de subreticulación, espinas hasta 4μm de alto, derechas o curvas, hialinas in KOH. Las ascosporas son amarillas o amarillo naranja a café rojizo en KOH y reactivo de Melzer, de pared gruesa.
Resumen taxonómico. Nuevo León: camino al Paraje del Oso, El Barro, municipio de Monterrey, hipogeo, gregario, en bosque de encino con Quercus canbyi Trel., Q. polymorpha Schltdl. et Cham., Q. laeta Liebm. y Arbutus xalapensis Kunth., a 1 400m, 6 agosto 2007, Guevara 908 (ITCV 908).
Comentarios taxonómicos. Tuber malacodermum es muy similar a T. lyonii pero difiere del primero en tener hifas isodiamétricas en el epicutis de 4–10μm de diámetro. Esta especie es también similar a T. spinoreticulatum de EUA, pero se distingue en que esta última tiene la superficie del ascoma con escamas hasta 1mm de ancho (Trappe et al., 1996). Actualmente, 3 especies de Tuber (T. malacodermum, T. lyonii y T. spinoreticulatum) tienen ascosporas equinuladas con las espinas conectadas por líneas bajas en la superficie de la ascospora formando un retículo parcial o completo.
Tuber mexiusanum Guevara, Bonito y Cázares, Mycologia (doi 10.3852/12-087), 2012
Resumen taxonómico. Tamaulipas: localidad cerro El Diente, municipio de San Carlos, hipogeo, solitario a gregario en bosque de encino con Quercus canbyi, Q. rysophylla, Q. clivicola, Q. virginiana, Q. sartorii Q. polymorpha, y Arbutus xalapensis, en suelo de origen volcánico con roca del cretácico, Guevara 181 (holotipo ITCV, isotipo OSC). Coahuila: localidad La Siberia, municipio de Arteaga, hipogeo, solitario, en bosquede coniferas con encinos, 30 Sept. 1983, García 3785 (ITCV Paratipo, OSC). En EUA crece asociado con Populus deltoides Guevara s/n (ITCV).
Comentarios taxonómicos. Esta especie es cercanamente parecida a T. guevarai pero esta última tiene ascosporas más anchas de 18–55x16–42μm y de 10–12 finas verrugas por 1mm en el peridio mientras que T. mexiusanum tiene ascosporas de 15–50x12–36μm y de 4–7 verrugas por mm. Tuber mexiusanum también es similar a T. borchii, T. puberulum y T. rapaeodorum, descritas de Europa, pero estas especies tienen dermatocistidios más grandes en un intervalo de 50–110 (–115) de largo (Lange, 1956; Pegler et al., 1993; Mello et al., 2000). Estudios moleculares ubican a T. mexiusanum dentro del clado Maculatum y especie hermana de un taxón no descrito de Tuber proveniente de raíces de una orquídea Epipactis sp. de Quebec, Canada (Bidartondo et al., 2004; Guevara et al., 2012). La variación interespecífica del ITS entre T. mexiusanum y T. guevarai es >2.1%. Las secuencias obtenidas de raíces micorrizadas recolectadas en México y EUA confirman que T. mexiusanum forma micorrizas con Quercus spp. y Populus deltoides de Tennessee y Carolina del Norte. Tuber mexiusanum tiene un amplia distribución geográfica y de hospederos (Guevara et al., 2012).
Tuber miquihuanense Guevara, Bonito y Cázares, Mycologia (doi 10.3852/12-087), 2012
Resumen taxonómico. Tamaulipas: localidad La Joya, municipio de Miquihuana, hipogeo, solitario, en bosquemixto de pino-encino con Quercus greggii, Quercus miquihuanensis, Arbutus xalapensis, Pinus montezumae y P. hartweggii en suelo calcáreo a 3 025m de altitud, 16 Sept. 2006, Guevara 885 (ITCV holotipo, isotipo OSC); San José, rancho El Cielo, municipio de Gómez Farías, solitario en bosque mesófilo de montaña a 1 450m, 8 Julio 1984, García 4026 (ITCV Paratipo),
Comentarios taxonómicos. Tuber miquihuanense es similar a T. canaliculatum pero esta última especie tiene las ascosporas globosas y más largas de 48–72×40–52μm, mientras que T. miquinuanense tiene ascosporas 40–50×30–39μm. También es parecida a T. irradians Gilkey, por tener ambas especies células peridiales alineadas radialmente pero T. irradians difiere en tener ascosporas elipsoides de 40–56×36–48μm y de 1– 3 ascosporas por asca (Gilkey 1939, 1954). Estudios moleculares ubican a T. miquihuanense como taxón hermano de una especie de Armenia (Badalyan et al., 2005; Guevara et al., 2012), determinado como T. scruposum Hesse. La colección de Armenia tiene ascosporas más pequeñas de 25–40×20–25μm y esta asociado principalmente con Carpinus betulus, Tilia cordata y Fagus orientalis (Badalyan et al., 2005). La variación interespecífica del ITS entre las 2 especies es de >2.6% (Guevara et al., 2012).
Tuber regimontanum Guevara, Bonito y Rdz., Rev. Mex. Micol, 26: 17–20, figs.1–5, 2008
Resumen taxonómico. Nuevo León: sierra de Picachos, municipio de Higueras, hipogeo, gregario, bajo Quecus polymorpha en bosquede encino y a un lado de río intermitente, pH del suelo 8, 23 agosto 2007, geoposición 26°05.81' N, 99°56. 6' O, Guevara 909 (ITCV holotipo, isotipo OSU y Duke).
Comentarios taxonómicos. Tuber regimontanum es similar a la trufa negra europea T. melanosporum y a la especie asiática T. indicum, pero la especie europea tiene ascosporas de 28–32×16–21μm de color café obscuro a negruzco mientras que la asiática tiene ascosporas de 20–35 (–40)× 15–30 (–35)μm, de color café claro, mientras que T. regimontanum tiene ascosporas de 33–55 (-62)×23–31μm (Montecchi y Sarasini, 2000; Riousset et al., 2001, Guevara et al., 2008). Solamente se conoce de la localidad tipo.
Tuber separans Gilkey. Univ. Calif. Publ. Bot. 6 (11): 315, pl. 29, fig. 19, 916
Resumen taxonómico. Nuevo León: Santiago, cañón de Puerto Genovevo, hipogeo, solitario, en bosque de encino bajo Quercus rysophylla Weath. a 1 400m, 13 marzo 1983, Cázares 34 (ITCV, OSC).
Comentarios taxonómicos. Esta especie fue citada para México por Cázares et al. (1992). Se distingue por presentar en las hifas más externas del peridio pared celular hialinas y el subcutis no se diferencia de la gleba ambas compuestas de hifas de 3–5μm de ancho. Tuber separans puede ser confundida con T. irradians pero esta última presenta las hifas del peridio con pared celular más obscuras (cafes) y el subcutis se diferencia bien de la gleba con hifas de 5–8μm de ancho. Gilkey (1939) distingue T. argenteum Gilkey de T. separans por el número de alveolos y forma de la ascospora. En la primera especie el número de alveolos va de 9–10 a lo largo de la ascospora y de 8–9 a lo ancho, y las ascosporas algo elongadas mientras que la segunda especie presenta un número de alveolos variable y la forma de las ascosporas ampliamente elipsoides. Estudios moleculares recientes, con ascomas y raíces con ectomicorrizas de México, han demostrado que existen varias especies emparentadas con T. separans (Bonito et al., 2009 y 2010a).
Clave de las especies de Tuber reconocidas para México
- 1.-
Ascosporas equinuladas …… 2
- 1.-
Ascosporas alveoladas …… 4
- 2.-
Peridio café obscuro a negro con verrugas piramidales …… T. regimontanum
- 2.-
Peridio crema, café claro a café rojizo, liso a finamente areolado …… 3
- 3.-
Células del epicutis infladas y abundantes de 6–10μm de diámetro …… T. lyonii (complejo)
- 3.-
Células del epicutis infladas de 10–25 (–68)μm de diámetro …… T. malacodermum
- 4.-
Peridio verrucoso con puntas, angulares o planas, café o rojo …… 5
- 4.-
Peridio no verrucoso, liso o con escamas redondeadas, amarillo a café rojizo …… 6
- 5.-
Epicutis de 600–1500μm de ancho, ascosporas de 30–62×45–52μm, globosas …… T. canaliculatum
- 5.-
Epicutis de 110–360μm de ancho, ascosporas de 20–50μ20–39μm, subglobosas …… T. miquihuanense
- 6.-
Superficie del peridio glabro, sin cistidios en forma de punta …… 7
- 6.-
Superficie del peridio pubescente, con cistidios en forma de punta …… 9
- 7-
Epicutis prosenquimatoso …… T. maculatum
- 7-
Epicutis pseudoparenquimatoso …… 8
- 8.-
Ascosporas de 27–68× 22–50μm sin ornamentación …… T. guzmanii
- 8.-
Ascosporas de 28–48×24–30μm …… T. gardneri
- 9.-
Ascoma rojizo, giboso, cistidios con pared celular irregular, creciendo con Abies religiosa …… T. gibbosum
- 9.-
Ascoma amarillo crema, no giboso, cistidios aciculiformes, creciendo con Quercus spp …… 10
- 10.-
Células del peridio con paredes hialinas …… T. separans
- 10.-
Células del peridio con paredes café rojizo …… 11
- 11.-
Ascosporas hasta 63μm de largo, en ascas con una ascospora …… T. castilloi
- 11.-
Ascosporas menos de 55μm de largo …… 12
- 12.-
Peridio hasta 360μm de grueso, 5–7 escamas/mm, células peridiales de hasta 38μm de diámetro. …… T. mexiusanum
- 12.-
Peridio de <220μm, 10–12 escamas /mm, células peridiales de hasta 30μm de diámetro …… T. guevarai
Las especies del género Tuber están distribuidas desde el norte hacia el centro y sur de México, a través de la sierra Madre Oriental, Occidental, Eje Neovolcánico y sierras sureñas de México. Su distribución va desde los estados de Tamaulipas, Nuevo León, Coahuila, Durango, Estado de México, Michoacán, Jalisco, Puebla, Tlaxcala, Veracruz hasta la sierra del Norte de Chiapas, y hacia el norte, su distribución continúa por las zonas boscosas templadas de EUA y Canadá (Bonito et al., 2010a). El género Tuber es el segundo grupo más común, en cuanto a número de recolectas se refiere, de los hongos hipogeos después del género Hysterangium. La especie de Tuber más común en el noreste de México es T. lyonii, que crece asociada con Quercus spp. mientras que las especies más raras son T. guevarai y T. regimontanum, pues solamente se conocen de la localidad tipo; T. regimontanum es al parecer, endémica de la sierra de Picachos. Con las 3 especies aquí tratadas el número de especies conocidas y descritas para México aumenta a 13, lo que equivale a un 21% con respecto a las conocidas para EUA. Sin embargo, de los 9 clados conocidos del género Tuber para el mundo, México (con las 13 especies citadas) tiene representantes en 6 de esos clados, lo que constituye un 66% (Bonito et al., y 2010a). Por ejemplo, T. gibbosum, especie asociada a A. religiosa endémica del centro de México, pertenece al clado /gibbosum, que comprende a un grupo de 4 especies asociadas solamente a coníferas (comúnmente Pseudotsuga spp.) de la región noroeste de EUA (Bonito et al., 2010c) (Figs. 1e-h). Tuber regimontanum, una trufa similar a la trufa negra europea, se agrupa molecularmente con T. melanosporum (Europa), T. indicum (China), T. brumale (Europa), T. pseudoexcavatum Y. Wang, G. Moreno, Riousset, Manjon y G. Riousset (China) en el clado /melanosporum. Junto con este clado, T. lyonii y T. malacodermum, también presentes en México, forman otro grupo en el clado /rufum junto con otras especies de ascosporas equinuladas (Bonito et al., 2010a, 2010b). Además, T. canaliculatum forma un pequeño grupo junto con T. macrosporum Vittad., en el clado/macrosporum (Bonito et al., 2010a). Tuber maculatum, T. gardneri junto con T. castilloi, T. guevarai, T. mexiusanum y T. miquihuanense se agrupan con T. whetstonense J. L. Frank, D. Southw. y Trappe, en el clado/maculatum (Bonito et al., 2009; 2010a; Guevara et al., 2012). Y por último, T. guzmanii, T. separans (y otras especies no descritas que están en estudio) se agrupan con otras taxones de Europa, America y China en el clado /puberulum, que es un grupo de trufas con ascosporas alveoladas (Bonito et al., 2010a, 2010c).
Por otra parte, la mayoría de los especímenes estudiados tienen una preferencia por hospederos de angiospermas (Quercus spp., Alnus spp. y Arbutus sp.) y pocas con gimnospermas (Pinus spp., Abies spp. y Pseudotsuga sp.). Los ejemplares determinados como T. malacodermum fueron encontrados en bosque de encino con Q. canbyi, Q. polymorpha, Q. laeta y A. xalapensis, mientras que T. canaliculatum se recolectó en bosque mixto de pinoencino y T. gibbosum siempre fue encontrado asociado con A. religiosa. Esto concuerda con lo reportado por Bonito et al. (2010c), quienes reportan además como hospederos a otras especies de monocotiledóneas del género Epipactis y especies dicotiledóneas de Quercus, Carya, Lithocarpus y Populus asociadas a Tuber spp. Tuber regimontanum crece con Q. polymorpha en bosques de encino; T. lyonii siempre crece asociado con Quercus spp. principalmente, pero puede ser micorrízico de Carya illinoensis (Wangenh.) K. Koch; C. ovata (Mill.) K. Koch, Crataegus sp., Tilia americana L., T. maculatum se encuentra comúnmente bajo Q. rysophylla en bosques de encino, además de 4 familias y 6 géneros, Pinaceae (Abies, Pinus, Pseudotsuga), Betulaceae (Corylus), Fagaceae (Quercus spp.) y Salicaceae (Populus spp., Salix); Tuber gardneri crece en bosques de encino bajos Quercus sp.; T. guzmanii está asociado a los bosques mixtos de pinoencino y de Quercus subtropicales. Tuber separans está asociado a Q. rysophylla en bosques de encino. Tuber castilloi crece asociado a bosques de encino-pino, con Arbutus xalapensis, Juglans sp., Pinus spp., Prunus sp., Quercus laceyi, Q. polymorpha, Q. rugosa y Q. rysophylla. Tuber miquihuanense crece en bosques de pino-encino, con Arbutus xalapensis, Pinus montezumae, P. hartweggii, Quercus gregii y Q. miquihuanensis (especies endémicas); es la especie que crece a mayor altitud (3 021m snm) junto con T. gibbosum (3065 msnm). Tuber mexiusanum y T. guevarai se recolectaron en bosques de México con los siguientes elementos florísticos, Arbutus xalapensis, Quercus cambyi, Q. clivicola, Q. rysophylla, Q. sartorii, Q. virginiana y coníferas, con Pinus-Abies y Pseudotsuga; en EUA, T. mexiusanum se asocia con Populus deltoides (Trappe y Guzmán, 1971; Cázares et al., 1992; Trappe et al., 1996; Trappe y Cázares, 2000, 2006; Guevara et al., 2008; Bonito et al., 2010c; Guevara et al., 2012).
Morfológicamente, las especies de Tuber descritas en el presente trabajo son parecidas a las europeas. Sin embargo, en los casos de T. gibbosum y T. malacodermum, los especímenes holotipo son de bosques naturales del noreste de EUA y Alemania respectivamente, los cuales son geográficamente distantes y ecológicamente diferentes de los sitios en México, por lo cual pensamos que es necesario un análisis del ADN detallado que incluya varios genes y mayor resolución para la corroboración de nuestras observaciones. Por último, sobre el origen del género Tuber, Jeandroz et al. (2008) estimaron el tiempo de divergencia mediante un análisis de reloj molecular global, concluyendo que la radiación del género se inició hace 140 a 271 millones de años (dependiendo del gen analizado) y que el género se originó en Europa o estaba ampliamente disperso en Eurasia. También estimaron los tiempos de divergencia de los nodos principales dentro del género Tuber. Se identificaron 5 clados en el mundo (grupo /aestivumn, /excavatum,/rufum, /melanosporum y /puberrulum). Tres grupos están representados en Norteamérica, melanosporum, puberulum y rufum. Se calculó que el nodo basal más antiguo, el clado 1 grupo /aestivum, tiene una divergencia aproximada de 140 a 160 millones de años (ma). El clado II (/excavatum surgio hace 111 ma, clado III (/rufum) más 70 ma, clado IV (/melanosporum) emergió entre 25– 80 ma, mientras que el clado V es el más reciente y corresponde al grupo /puberulum con 65–53 millones de años aproximadamente. Además, señalaron que Asia podría haber sido una ruta migratoria terrestre a través del estrecho de Bering a Norteamérica de algunas especies del género Tuber (Jeandroz et al., 2008). Nuevos estudios morfológicos y moleculares de las trufas de Asia, deberán llenar el vacío en nuestro entendimiento sobre la taxonomía, biogeografía y ecología del género Tuber.
El primer autor agradece a la DGEST (Dirección General de Educación Superior Tecnológica, SES, PROMEP y CONACyT) por el apoyo económico para llevar a cabo esta investigación. Así mismo, se agradece a Ricardo Valenzuela-Garza (Instituto Politécnico Nacional), Fidel Landeros-Jaime (Universidad Autónoma de Querétaro), Rosario Medel-Ortiz (Universidad Veracruzana) y Santiago Chacón-Zapata (Instituto de Ecología, A. C.) por sus cometarios y sugerencias. A Gregory Bonito (Universidad de Duke) y James Trappe (Universidad Estatal de Oregon) por su apoyo en esta investigación.