Se presenta el registro de las especies de invertebrados marinos que habitan la costa rocosa intermareal de Montepío, Veracruz, identificados hasta ahora. La información se obtuvo de las colectas realizadas en los últimos 10 años por parte de la Colección Nacional de Crustáceos y los registros adicionales se obtuvieron de la información publicada. El listado de especies incluye las formas de vida en relación con el sustrato, criptofauna o epifauna, así como su tipo de distribución en las 2 principales regiones zoogeográficas marinas para el golfo de México: Carolineana y Caribeña; se incluyen también las especies que sólo se encuentran en el golfo de México. El listado incluye 195 especies pertenecientes a 9 grupos, de los cuales Crustacea es el más diverso con 73 especies, seguido por Mollusca con 69 y Echinodermata con 18; los grupos con menor riqueza específica fueron: Chelicerata con 2 especies y Platyhelminthes y Sipuncula con una sola especie cada grupo. Del total de especies 74 son nuevos registros de localidad y 7 nuevos registros para Veracruz. Para la porción mexicana del golfo de México se han reportado 5 517 especies de invertebrados, y se estima entonces que el 3.5% de este total se puede encontrar en Montepío. La epifauna presentó mayor riqueza específica (70%) que la criptofauna (30%), que se compone principalmente de moluscos, poliquetos y sipuncúlidos. Se observó una mayor afinidad tropical en la composición de especies obtenida; sin embargo, un número importante de especies presenta una afinidad subtropical o Carolineana (86) y 51 especies se distribuyen únicamente en el golfo de México.
A list of the marine invertebrate species identified until now from the rocky intertidal shore at Montepío, Veracruz, is presented. The information was obtained from 10 years of collections made by the Colección Nacional de Crustáceos and additional records were compiled from published information. The species list includes the life form in relation to the substrate, epifauna or criptofauna, as well as its type of distribution considering the 2 main zoogeographic provinces recognized for the Gulf of Mexico: Carolinean and Caribbean; the species found only in the Gulf of Mexico are also noted. The list includes 195 species belonging to 9 groups of which Crustacea is the most diverse with 73 species, followed by Mollusca with 69 and Echinodermata with 18; the less diverse groups were Chelicerata with 2 species and Platyhelminthes and Sipuncula with 1 species each. Seventy-four species represent new locality records and 7 are new records for Veracruz. A total of 5 517 invertebrate species have been reported for the Mexican portion of the Gulf of Mexico, thus 3.5% of this total can be found in Montepio. More species were part of the epifauna (70%) than the criptofauna (30%) which is composed mainly by molluscs, polychaetes and sipunculids. A larger tropical affinity was observed in the obtained species composition; however, an important number of species are more subtropical or Carolinean (86) and 51 species occur only in the Gulf of Mexico.
La zona rocosa intermareal (ZRI) es un hábitat propicio para el establecimiento de una gran variedad de invertebrados porque ofrece un sustrato en el que se crean espacios y microambientes que pueden ser rápidamente colonizados. Además de la complejidad estructural dada por el sustrato, posee una heterogeneidad temporal a varias escalas, al ser un lugar sujeto a diversos cambios en las condiciones de temperatura, luz, pH, humedad y salinidad (Britton y Morton, 1989). La ZRI es un hábitat que también puede verse como un sistema con estabilidad temporal, ya que el sustrato rocoso puede persistir por largo tiempo (Salazar-Vallejo y González, 1990).
Los organismos que se establecen en la ZRI pueden clasificarse como criptofauna o epifauna. La criptofauna son aquellos animales que se mimetizan y/o esconden en el sustrato mediante su coloración, aspecto o comportamiento (Raffaelli y Hawkins, 1999; Galván-Villa, 2011). En la ZRI las especies de la criptofauna pueden clasificarse a su vez como anidadoras u horadadoras, dependiendo de si generan oquedades en la roca o solamente llegan a ocupar los espacios disponibles (Moran y Reaka-Kudla, 1991a). El balance entre estos 2 tipos de especies puede ser interpretado de diferentes maneras para conocer el estado de la comunidad (Reaka-Kudla, 2001).
La epifauna la componen aquellos organismos que viven en la superficie de las rocas, ya sea adherida o moviéndose libremente sobre ella (Sarmiento et al., 2000). En los pocos inventarios de invertebrados intermareales hechos en México no se ha hecho la distinción entre criptofauna y epifauna.
Los inventarios de invertebrados en la ZRI que se han llevado a cabo en México son en casi su totalidad sobre un phylum o grupo biológico específico (e. g., Hernández et al., 2010). Al realizarse inventarios sobre un solo grupo quedan preguntas interesantes acerca de las interacciones entre distintos phyla, así como la diversidad y densidad reales que se presentan en los sitios estudiados. Es posible que los cambios en diversidad y densidad de un grupo estén asociados a las fluctuaciones de otro grupo totalmente distinto que genera espacios o sustratos habitables o que indirectamente compite con el grupo de interés. De esta manera, el siguiente paso en el estudio de los invertebrados de la ZRI debería ser el utilizar un enfoque en el cual se evalúen las poblaciones de varios grupos o phyla simultáneamente. Este estudio tiene como propósito el hacer disponible la información de la mayoría de los invertebrados de la ZRI de una localidad como Montepío, en la región de Los Tuxtlas, Veracruz, México, que ha sido estudiada intensamente durante la última década (Álvarez et al., 1999, 2011; Valero-Pacheco et al., 2007; Hernández y Álvarez, 2007; Celis y Álvarez, 2008; Argüelles et al., 2009, 2010; Hernández et al., 2010, 2012).
La zona del Atlántico oeste que abarca el golfo de México, está zoogeográficamente dividida, siguiendo el enfoque más conservador, en 2 provincias: Carolineana, que incluye las aguas estadounidenses del golfo de México hasta Cabo Rojo en la laguna de Tamiahua, Veracruz y Caribeña, que incluye al Caribe mexicano, y que se extiende al sur desde los cabos Cañaveral y Romano en Florida y Cabo Rojo, en México, hacia el límite norte del delta del río Orinoco, Venezuela (Córdova et al., 2009). Dentro del golfo de México se han propuesto otras provincias, pero éstas se basan en un solo grupo biológico (e. g., crustáceos decápodos; Boschi, 2000) y por lo tanto, no se toman aquí en cuenta. En realidad la parte mexicana del golfo de México puede considerarse como una gran zona de transición entre la fauna tropical y la subtropical o templada, aunque algunos autores fijen límites más precisos (Briggs, 1974).
Los estudios en nuestro país sobre invertebrados son muy amplios. Sin embargo, los listados de especies que incluyen diversos grupos son pocos. Un enfoque es el de catalogar a los diferentes grupos biológicos por separado, por ejemplo, Felder y Camp (2009) que han compilado la diversidad de la biota del golfo de México, y otro, como el del presente estudio, es el de catalogar el mayor número de especies de una sola localidad.
Este estudio busca registrar todas las especies de invertebrados marinos que habitan la costa rocosa intermareal de Montepío, Veracruz. El presente estudio es único en su tipo, ya que no se ha realizado algo similar para ninguna localidad costera de México en donde se considere a diversos taxa de invertebrados marinos, por lo cual, las comparaciones quedan pendientes. Este listado incluye grupos que han sido poco estudiados en este ambiente como Platyhelminthes, Sipuncula y Pycnogonida, que no habían sido previamente estudiados en la zona.
Materiales y métodosÁrea de estudio. La playa rocosa de Montepío se ubica en el municipio de San Andrés Tuxtla, Veracruz (18°28'31” N, 95°17'58” O) (Fig. 1). Se encuentra situada en el sur del golfo de México, abarca la parte tropical meridional del golfo y se considera una cuenca semicerrada con corrientes tropicales (Wilkinson et al., 2009). Es una zona costera formada por la desembocadura de los ríos Col y Máquinas. En esta zona el aporte de materia orgánica se sedimenta sobre roca basáltica proveniente del volcán San Martín (Álvarez et al., 1999), por lo tanto, la zona es rica en nutrientes, aunque el agua presente turbidez por la influencia de los ríos (Hernández y Álvarez, 2007). La comunidad de invertebrados se desarrolla sobre un antiguo derrame de lava que penetra al mar cerca de 60m a partir de la playa con profundidades de hasta 1.5m.
Área de estudio Montepío, Veracruz, México. Tomado de Inegi, 2003.
En la zona, la temperatura de la superficie marina promedio es de 24 a 25°C en invierno y de 28 a 28.5°C en verano, con una precipitación anual de más de 4 500mm. Aun cuando llueve todo el año, hay una época de lluvias que va de junio a febrero; una época de secas de marzo a mayo y otra en que se generan frentes fríos conocidos como “nortes” de octubre a marzo (Hernández et al., 2010). El régimen de mareas en esta región es mixto y diurno (Salas-De León y Monreal-Gómez, 1997; Wilkinson et al., 2009), con una amplitud máxima de cerca de 30cm.
Construcción del listado. La información sobre la presencia de las especies en Montepío se compiló a partir de las colectas realizadas en los últimos 10 años por parte de la Colección Nacional de Crustáceos (CNCR) del Instituto de Biología, Universidad Nacional Autónoma de México y se complementó con información de las especies registradas para esta localidad de diversas fuentes bibliográficas. Se comprobó la sistemática de cada grupo empleando bases de datos digitales: EOL, ITIS, OBIS, WoRMS; Appeltans, et al., 2012; y la literatura correspondiente para corregir sinonimias y usar el arreglo taxonómico más actual. Se identificaron organismos que se encontraban en la CNCR, pero que no habían sido revisados con ayuda de las claves correspondientes (Abbott, 1974; García-Cubas, 1981; Child, 1992; Abbott y Morris, 1995; Álvarez et al., 1999; Veron, 2000a, 2000b, 2000c; Varela et al., 2002; García-Cubas y Reguero, 2004; Durán-González et al., 2005; González-Muñoz, 2005, 2009; Valdés et al., 2006; De León-González et al., 2009).
El listado de especies incluye información acerca de si los organismos pertenecen a la criptofauna o a la epifauna. Estos datos se obtuvieron de los datos de colecta y, en su caso, de la fuente bibliográfica de donde se obtuvo el registro. Asimismo, se distingue la afinidad zoogeográfica de la especie considerando su intervalo de distribución y las 2 principales provincias zoogeográficas marinas reconocidas para el golfo de México: Carolineana y Caribeña. Se destacan también las especies que sólo se encuentran en el golfo de México.
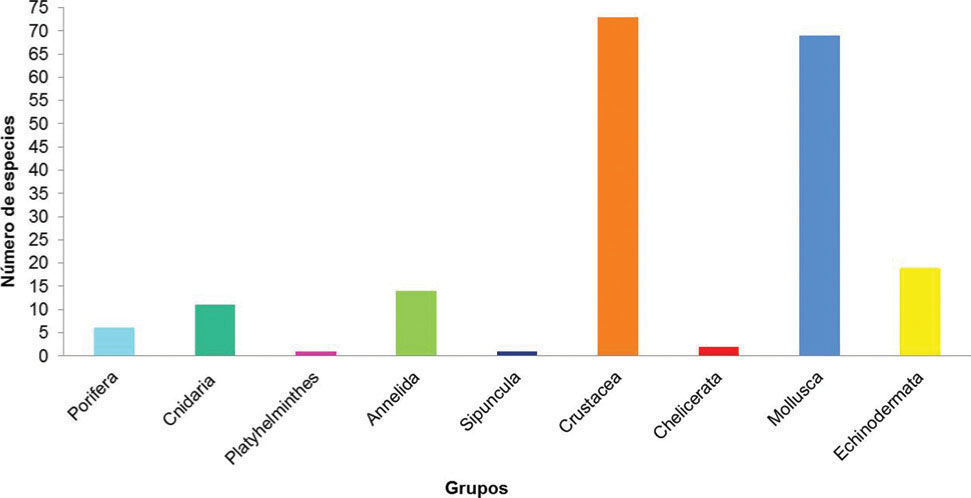
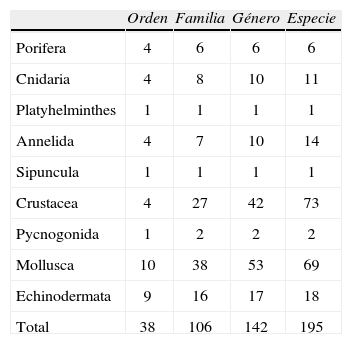
ResultadosEl listado actual de los invertebrados de la zona rocosa intermareal de Montepío, Veracruz incluye 195 especies pertenecientes a 9 grupos taxonómicos, de los cuales Crustacea es el más diverso con 73 especies, seguido por Mollusca con 69 y Echinodermata con 19. Los grupos con menor riqueza específica fueron Chelicerata con 2 especies, así como Platyhelminthes y Sipuncula con 1 sola especie en cada uno (Cuadro 1; Fig. 2).
Representación por orden, familia, género y especies de cada phylum registrado en la zona intermareal de Montepío, Veracruz
| Orden | Familia | Género | Especie | |
| Porifera | 4 | 6 | 6 | 6 |
| Cnidaria | 4 | 8 | 10 | 11 |
| Platyhelminthes | 1 | 1 | 1 | 1 |
| Annelida | 4 | 7 | 10 | 14 |
| Sipuncula | 1 | 1 | 1 | 1 |
| Crustacea | 4 | 27 | 42 | 73 |
| Pycnogonida | 1 | 2 | 2 | 2 |
| Mollusca | 10 | 38 | 53 | 69 |
| Echinodermata | 9 | 16 | 17 | 18 |
| Total | 38 | 106 | 142 | 195 |
En cuanto a los hábitos de vida se encontró una mayor cantidad de especies pertenecientes a la epifauna (139 spp.) que a la criptofauna (57 spp.), en donde Crustacea presentó 30 especies, Mollusca 11, Annelida 14, Platyhelminthes 1 y Sipuncula 1 (Cuadro 2).
Lista de especies de invertebrados registrados en la zona intermareal de Montepío, Veracruz, México. En la primera columna se presenta la ubicación taxonómica de las especies, sin incluir todas las categorías existentes para dar uniformidad a la información. La segunda columna se refiere a si la especie es parte de la epifauna (E) o de la criptofauna (C). La tercera columna registra la afinidad biogeográfica de la especie: carolineana (C), tropical-caribeña (T) o si se distribuye dentro del golfo de México (G) con una afinidad biogeográfica incierta. La cuarta columna indica si el registro es nuevo para la localidad (L), para Veracruz (V) o para el golfo de México (G). La quinta columna es la fuente, y se cita la referencia donde se cita la especie o aparece un * si es un dato de este estudio
| Especie | Forma de vida | Afinidad | Registro | Fuente |
| Phylum Porifera Grant, 1836 | ||||
| Clase Demospongiae Sollas, 1885 | ||||
| Orden Spirophorida Bergquist y Hogg, 1969 | ||||
| Familia Suberitidae Schmidt, 1870 | ||||
| Aaptos pernucleata (Carter, 1870) | E | C, T | Gómez-López, 2011 | |
| Familia Tetillidae Sollas, 1886 | ||||
| Acanthotetilla gorgonosclera van Soest, 1977 | E | T | Gómez-López, 2011 | |
| Orden Hadromerida Topsent, 1894 | E | T | Gómez-López, 2011 | |
| Familia Niphatidae van Soest, 1980 | ||||
| Amphimedon compressa Duchassaing y Michelotti, 1864 | E | T | Gómez-López, 2011 | |
| Familia Callyspongiidae de Laubenfels, 1936 | E | T | Gómez-López, 2011 | |
| Callyspongia eschrichtii Duchassaing y Michelotti, 1864 | E | T | Gómez-López, 2011 | |
| Orden Astrophorida Sollas, 1887 | ||||
| Familia Geodiidae Gray, 1867 | ||||
| Geodia papyracea Hechtel, 1965 | E | T | Gómez-López, 2011 | |
| Orden Haplosclerida Topsent, 1928 | ||||
| Familia Chalinidae Gray, 1867 | ||||
| Haliclona (Soestella) caerulea (Hechtel, 1965) | E | C, T | Gómez-López, 2011 | |
| Phylum Cnidaria Hatschek, 1888 | ||||
| Clase Hydrozoa Owen, 1843 | ||||
| Subclase Hydroidolina Collins y Marques, 2004 | ||||
| Orden Siphonophora Eschscholtz, 1829 | ||||
| Suborden Cystonectae Haeckel, 1887 | ||||
| Familia Physaliidae Brandt, 1835 | ||||
| Physalia physalis (Linnaeus, 1758) | E | C | L | * |
| Clase Anthozoa Ehrenberg, 1834 | ||||
| Subclase Hexacorallia Haeckel, 1866 | ||||
| Orden Actiniaria Hertwig, 1882 | ||||
| Familia Actiniidae Rafinesque, 1815 | ||||
| Actinostella flosculifera (Le Sueur, 1817) | E | T | L | * |
| Bunodosoma granuliferum (Le Sueur, 1817) | E | T | L | * |
| Familia Phymanthidae Andres, 1883 | ||||
| Phymanthus crucifer (Le Sueur, 1817) | E | T | L | * |
| Familia Stichodactylidae Andres, 1883 | ||||
| Stichodactyla helianthus (Ellis, 1768) | E | T | L | * |
| Orden Scleractinia Bourne, 1900 | ||||
| Familia Faviidae Gregory, 1900 | ||||
| Diploria clivosa (Ellis y Solander, 1786) | E | T | L | * |
| Familia Siderastreidae Vaughan y Wells, 1943 | ||||
| Siderastrea radians (Pallas, 1766) | E | A | L | * |
| Orden Zoantharia de Blainville, 1830 | ||||
| Familia Sphenopidae Hertwig, 1882 | ||||
| Palythoa caribaeorum (Duchassaing y Michelotti, 1860) | E | A | L | * |
| Protopalythoa variabilis (Duerden, 1898) | E | G | L | * |
| Familia Zoanthidae Rafinesque, 1815 | ||||
| Zoanthus pulchellus (Duchassaing y Michelotti, 1860) | E | A | L | * |
| Zoanthus sociatus (Ellis, 1768) | E | G | L | * |
| Phylum Platyhelminthes Gegenbaur, 1859 | ||||
| Clase Rhabditophora Ehlers, 1985 | ||||
| Orden Polycladida Lang, 1884 | ||||
| Suborden Cotylea Lang, 1884 | ||||
| Superfamilia Pseudocerotoidea Faubel, 1984 | ||||
| Familia Pericelidae Laidlaw, 1902 | ||||
| Pericelis sp. | C | L | * | |
| Phylum Annelida Lamarck, 1809 | ||||
| Clase Polychaeta Grube, 1850 | ||||
| Subclase Aciculata Rouse y Fauchald, 1997 | ||||
| Orden Eunicida Dales, 1962 | ||||
| Familia Eunicidae Dales, 1962 | ||||
| Eunice filamentosa Grube, 1856 | C | C, T | L | * |
| Eunice sp. | C | T | * | |
| Palola siciliensis (Grube, 1840) | C | C, T | L | * |
| Orden Phyllodocida Dales, 1962 | ||||
| Familia Nereididae Lamarck, 1818 | ||||
| Perinereis elenacasoi Rioja, 1947 | C | C, T | * | |
| Pseudonereis gallapagensis Kinberg, 1865 | C | C, T | * | |
| Familia Hesionidae Grube, 1850 | ||||
| Kefersteinia cirrata (Keferstein, 1862) | C | C, T | L | * |
| Familia Crysopetalidae Ehlers, 1864 | ||||
| Bhawania goodei Webster, 1884 | C | L | * | |
| Familia Syllidae Grube, 1850 | ||||
| Syllis gracilis Grube, 1840 | C | C, T | L | * |
| Syllis variegata (Grube, 1860) | C | C, T | L | * |
| Syllis gerlachi (Hartmann-Schröder, 1960) | C | T | L | * |
| Opisthosyllis arboricola Hartmann-Schröder, 1959 | C | G | L | * |
| Subclase Canalipalpata Rouse y Fauchald, 1997 | ||||
| Orden Terebellida Rouse y Fauchald, 1997 | ||||
| Familia Terebellidae Grube, 1850 | ||||
| Loimia medusa (Savigny in Lamarck, 1818) | C | C, T | L | * |
| Polycirrus sp. | C | |||
| Orden Sabellida Linnaeus, 1767 | ||||
| Familia Sabellidae Johnston, 1865 | ||||
| Bispira sp. | C | * | ||
| Phylum Sipuncula Rafinesque, 1814 | ||||
| Clase Phascolosomatidea Gibbs y Cutler, 1987 | ||||
| Orden Phascolosomatida Gibbs y Cutler, 1987 | ||||
| Familia Phascolosomatidae Stephen y Edmonds, 1972 | ||||
| Antillesoma antillarum (Grube, 1858) | C | G | V | * |
| Phylum Arthropoda Latreille, 1829 | ||||
| Subphylum Crustacea Brünnich, 1772 | ||||
| Clase Maxillopoda Dahl, 1956 | ||||
| Subclase Thecostraca Gruvel, 1905 | ||||
| Infraclase Cirripedia Burmeister, 1834 | ||||
| Superorden Thoracica Darwin, 1854 | ||||
| Orden Sessilia Lamarck, 1818 | ||||
| Familia Chthamalidae Darwin, 1854 | ||||
| Chthamalus fragilis Pilsbry, 1916 | E | C | Álvarez et al., 2011 | |
| Familia Tetraclitidae Gruvel, 1903 | ||||
| Tetraclita floridana Pilsbry, 1916 | E | G | Álvarez et al., 2011 | |
| Tetraclita stalactifera Lamarck, 1818 | E | C, T | Álvarez et al., 2011 | |
| Superfamilia Balanoidea Leach, 1817 | ||||
| Familia Balanidae Leach, 1817 | ||||
| Balanus sp. | E | Álvarez et al., 2011 | ||
| Subfamilia Megabalaninae Newman, 1979 | ||||
| Megabalanus tintinnabulum (Linnaeus, 1758) | E | C, T | Álvarez et al., 2011 | |
| Especie | Forma de vida | Afinidad | Registro | Fuente |
| Clase Malacostraca Latreille, 1802 | ||||
| Subclase Eumalacostraca Grobben, 1892 | ||||
| Superorden Peracarida Calman, 1904 | ||||
| Orden Amphipoda Latreille, 1816 | ||||
| Suborden Gammaridea Latreille, 1803 | ||||
| Familia Ampithoidae Stebbing, 1899 | ||||
| Ampithoe sp. | E | Álvarez et al., 2011 | ||
| Familia Corophiidae Leach, 1814 | ||||
| Corophium sp. | E | Álvarez et al., 2011 | ||
| Ericthonius sp. | E | Álvarez et al., 2011 | ||
| Lembos sp. | E | Álvarez et al., 2011 | ||
| Monocorophium tuberculatum (Shoemaker, 1939) | E | C | Álvarez et al., 2011 | |
| Familia Hyalidae Bulycheva, 1957 | ||||
| Allorchestes sp. | E | Álvarez et al., 2011 | ||
| Hyale sp. 1 | E | Álvarez et al., 2011 | ||
| Hyale sp. 2 | E | Álvarez et al., 2011 | ||
| Hyale sp. 3 | E | Álvarez et al., 2011 | ||
| Ptilohyale plumulosus (Stimpson, 1857) | E | C | G | * |
| Familia Ischyroceridae Stebbing, 1899 | ||||
| Ischyrocerus sp. | E | Álvarez et al., 2011 | ||
| Familia Melitidae Bousfield, 1973 | ||||
| Elasmopus pectenicrus (Bate, 1862) | E | C | Álvarez et al., 2011 | |
| Elasmopus spinidactylus Chevreux, 1908 | E | T | Álvarez et al., 2011 | |
| Elasmopus sp. 1 | E | Álvarez et al., 2011 | ||
| Elasmopus sp. 2 | E | Álvarez et al., 2011 | ||
| Maera inaequipes (Costa, 1851) | E | G | Álvarez et al., 2011 | |
| Maera sp. | E | Álvarez et al., 2011 | ||
| Familia Podoceridae Leach, 1814 | ||||
| Podocerus sp. | E | Álvarez et al., 2011 | ||
| Orden Isopoda Latreille, 1817 | ||||
| Suborden Cymothoida Wagele, 1989 | ||||
| Familia Cirolanidae Dana, 1852 | ||||
| Cirolana parva Hansen, 1890 | C | T | Álvarez et al., 2011 | |
| Colopisthus parvus Richardson, 1902 | C | C | Álvarez et al., 2011 | |
| Familia Corallanidae Hansen, 1890 | ||||
| Excorallana sexticornis (Richardson, 1901) | C | C, T | Álvarez et al., 2011 | |
| Excorallana tricornis (Hansen, 1890) | C | C, T | Álvarez et al., 2011 | |
| Excorallana sp. | C | Álvarez et al., 2011 | ||
| Suborden Sphaeromatidea Wagele, 1989 | ||||
| Familia Sphaeromatidae Latreille, 1825 | ||||
| Ischromene barnardi (Menzies y Glynn, 1968) | C | T | Álvarez et al., 2011 | |
| Paradella quadripunctata (Menzies y Glynn, 1968) | C | C, T | Álvarez et al., 2011 | |
| Orden Decapoda Latreille, 1802 | ||||
| Suborden Dendrobranchiata Bate, 1888 | ||||
| Superfamilia Penaeoidea Rafinesque, 1815 | ||||
| Familia Penaeidae Rafinesque, 1815 | ||||
| Farfantepenaeus aztecus (Ives, 1891) | E | C | L | * |
| Suborden Pleocyemata Burkenroad, 1963 | ||||
| Infraorden Caridea Dana, 1852 | ||||
| Superfamilia Alpheoidea Rafinesque, 1815 | ||||
| Familia Alpheidae Rafinesque, 1815 | ||||
| Alpheus bahamensis Rankin, 1898 | C | T | Álvarez et al., 2011 | |
| Alpheus bouvieri A. Milne-Edwards, 1878 | C | C, T | Álvarez et al., 2011 | |
| Alpheus cristulifrons Rathbun, 1900 | C | C | Álvarez et al., 2011 | |
| Alpheus formosus Gibbes, 1850 | C | C | Álvarez et al., 2011 | |
| Alpheus malleator Dana, 1852 | C | C | Álvarez et al., 2011 | |
| Alpheus normanni Kingsley, 1878 | C | C | Álvarez et al., 2011 | |
| Alpheus nuttingi (Schmitt, 1924) | C | T | Álvarez et al., 2011 | |
| Synalpheus brevicarpus (Herrick, 1891) | C | T | Álvarez et al., 2011 | |
| Synalpheus curacaoensis Schmitt, 1924 | C | T | Álvarez et al., 2011 | |
| Synalpheus frietzmüelleri Coutière, 1909 | C | C, T | Álvarez et al., 2011 | |
| Synalpheus scaphoceris Coutière, 1910 | C | C, T | Álvarez et al., 2011 | |
| Infraorden Anomura MacLeay, 1838 | ||||
| Superfamilia Paguroidea Latreille, 1802 | ||||
| Familia Diogenidae Ortmann, 1892 | ||||
| Calcinus tibicen (Herbst, 1791) | E | C, T | Álvarez et al., 2011 | |
| Clibanarius antillensis Stimpson, 1859 | E | T | Álvarez et al., 2011 | |
| Clibanarius tricolor (Gibbes, 1850) | E | T | * | |
| Clibanarius vittatus (Bosc, 1802) | E | C, T | Álvarez et al., 2011 | |
| Paguristes grayi Benedict, 1901 | E | C, T | Álvarez et al., 2011 | |
| Superfamilia Galatheoidea Samouelle, 1819 | ||||
| Familia Porcellanidae Haworth, 1825 | ||||
| Clastotoechus nodosus (Streets, 1872) | C | T | Álvarez et al., 2011 | |
| Megalobrachium soriatum (Say, 1818) | C | C, T | * | |
| Neopisosoma angustifrons (Benedict, 1901) | C | T | * | |
| Neopisosoma curacaoense (Schmitt, 1924) | E | G | G | * |
| Neopisosoma aff. dohenyi Haig, 1960 | E | G | G | * |
| Pachycheles rugimanus A. Milne Edwards, 1880 | C | C | Álvarez et al., 2011 | |
| Petrolisthes armatus (Gibbes, 1850) | C | C, T | Álvarez et al., 2011 | |
| Petrolisthes jugosus Streets, 1872 | C | T | Álvarez et al., 2011 | |
| Petrolisthes marginatus Stimpson, 1859 | C | G | Álvarez et al., 2011 | |
| Infraorden Brachyura Latreille, 1803 | ||||
| Sección Eubrachyura de Saint Laurent, 1980 | ||||
| Subsección Heterotremata Guinot, 1977 | ||||
| Superfamilia Eriphioidea MacLeay, 1838 | ||||
| Familia Eriphiidae MacLeay, 1838 | ||||
| Eriphia gonagra (Fabricius, 1781) | C | C, T | Álvarez et al., 2011 | |
| Familia Menippidae Ortmann, 1893 | ||||
| Menippe mercenaria (Say, 1818) | E | C | Álvarez et al., 2011 | |
| Menippe nodifrons Stimpson, 1859 | E | T | Álvarez et al., 2011 | |
| Familia Oziidae Dana, 1851 | ||||
| Ozius reticulatus (Desbonne y Schramm, 1867) | E | G | Álvarez et al., 2011 | |
| Superfamilia Majoidea Samouelle, 1819 | ||||
| Familia Majidae Samouelle, 1819 | ||||
| Microphrys interruptus Rathbun, 1920 | E | T | Álvarez et al., 2011 | |
| Mithraculus sp. | E | * | ||
| Superfamilia Pilumnoidea MacLeay, 1838 | ||||
| Familia Pilumnidae (Samouelle, 1819) | ||||
| Pilumnus dasypodus (Kingsley, 1879) | E | C, T | Álvarez et al., 2011 | |
| Superfamilia Portunoidea Rafinesque, 1815 | ||||
| Familia Portunidae Rafinesque, 1815 | ||||
| Arenaeus cribrarius (Lamarck, 1818) | E | C, T | * | |
| Callinectes larvatus Ordway, 1863 | E | T | L | * |
| Superfamilia Xanthoidea MacLeay, 1838 | ||||
| Familia Panopeidae Ortmann, 1893 | ||||
| Panopeus obesus Smith, 1869 | E | C, T | L | * |
| Familia Xanthidae MacLeay, 1838 | ||||
| Cycloxanthops vittatus (Stimpson, 1860) | E | T | G | * |
| Subsección Thoracotremata Guinot, 1977 | ||||
| Superfamilia Grapsoidea MacLeay, 1838 | ||||
| Familia Grapsidae MacLeay, 1838 | ||||
| Geograpsus lividus (H. Milne-Edwards, 1837) | E | T | L | * |
| Grapsus grapsus (Linnaeus, 1758) | E | C, T | * | |
| Pachygrapsus gracilis (De Saussure, 1858) | C | C, T | L | * |
| Pachygrapsus transversus (Gibbes, 1850) | C | C, T | Álvarez et al., 2011 | |
| Familia Plagusiidae Dana, 1851 | ||||
| Plagusia depressa (Fabricius, 1775) | E | C, T | * | |
| Superfamilia Ocypodoidea Rafinesque, 1815 | ||||
| Familia Ocypodidae Rafinesque, 1815 | ||||
| Ocypode quadrata (Fabricius, 1787) | E | C, T | Valero-Pacheco et al., 2007 | |
| Subphylum Chelicerata Heymons, 1901 | ||||
| Clase Pycnogonida Latreille, 1810 | ||||
| Orden Pantopoda Gerstäcker, 1863 | ||||
| Familia Ammotheidae Dohrn, 1881 | ||||
| Achelia sawayai Marcus, 1940 | E | C, T | V | * |
| Familia Phoxichilidiidae Sars, 1891 | ||||
| Anoplodactylus californicus Hall, 1912 | E | T | V | * |
| Phylum Mollusca Linnaeus, 1758 | ||||
| Clase Gastropoda Cuvier, 1795 | ||||
| Subclase Patellogastropoda Lindberg, 1986 | ||||
| Familia Lottidae Sowerby, 1834 | ||||
| Tectura cf. antillarum (Sowerby I, 1834) | C | A | L | * |
| Subclase Caenogastropoda (Cox, 1960) | ||||
| Orden Neogastropoda (Wenz, 1938) | ||||
| Superfamilia Buccinoidea Rafinesque, 1815 | ||||
| Familia Columbellidae Swainson, 1840 | ||||
| Mitrella ocellata (Gmelin, 1791) | C | A | L | * |
| Nitidella nitida (Lamarck, 1822) | E | A | Argüells et al., 2010 | |
| Familia Buccinidae Rafinesque, 1815 | ||||
| Busycon perversum (Conrad, 1840) | E | T | V | * |
| Gemophos tinctus (Conrad, 1846) | E | A | L | * |
| Cantharus sp. | E | * | ||
| Engina turbinella (Kiener, 1836) | E | A | Argüelles et at., 2010 | |
| Pisania pusio (Linnaeus, 1758) | E | A | L | * |
| Familia Nassariidae Iredale, 1916 (1835) | ||||
| Nassarius acutus (Say, 1822) | E | C,T | L | * |
| Nassarius albus (Say, 1826) | E | T | V | * |
| Familia Fasciolariidae Gray, 1853 | ||||
| Dolicholatirus sp. | E | |||
| Leucozonia nassa (Gmelin, 1791) | E | A | Argüelles et at., 2010 | |
| Leucozonia ocellata (Gmelin, 1791) | E | A | V | * |
| Pustulatirus virginensis (Abbott, 1958) | E | T | Argüelles et at., 2010 | |
| Superfamilia Olivoidea Latreille, 1825 | ||||
| Familia Olivellidae Troschel, 1869 | ||||
| Olivella minuta (Link, 1807) | E | T | L | * |
| Familia Olividae Latreille, 1825 | E | T | L | * |
| Oliva sayana Ravenel, 1834 | E | C,T | L* | * |
| Superfamilia Muricoidea Rafinesque, 1815 | ||||
| Familia Muricidae Rafinesque, 1815 | ||||
| Calotrophon sp. | E | * | ||
| Drupa sp. | E | * | ||
| Morula (Morula) nodulosa (C. B. Adams, 1845) | C | A | Rosenberg 2009 | |
| Stramonita biserialis (Blainville, 1832) | E | G | Argüelles et al., 2010 | |
| Stramonita floridana (Conrad, 1837) | E | A | Argüelles et al., 2010 | |
| Stramonita rustica (Lamarck, 1822) | E | A | L | * |
| Stramonita sp. | E | * | ||
| Familia Coralliophidae Chenu, 1859 | ||||
| Coralliophila caribaea Abbott, 1958 | E | A | L | * |
| Familia Mitridae Swainson, 1829 | ||||
| Mitra nodulosa (Gmelin, 1791) | C | A | L | * |
| Superfamilia Cancellarioidea Forbes y Hanley, 1851 | ||||
| Familia Cancellariidae Forbes y Hanley, 1853 | ||||
| Cancellaria reticulata (Linnaeus, 1767) | E | A | L | * |
| Superfamilia Conoidea Fleming, 1822 | ||||
| Familia Conidae Fleming, 1822 | ||||
| Conus sp. | E | * | ||
| Familia Pseudomelatomidae Morrison, 1966 | ||||
| Pyrgospira ostrearum (Stearns, 1872) | E | A | L | * |
| Pyrgospira tampaensis (Bartsch y Rehder, 1939) | E | A | L | * |
| Familia Terebridae Mörch, 1852 | ||||
| Hastula hastata (Gmelin, 1791) | E | A | V | * |
| Impages cinerea (Born, 1778) | E | C,T | Argüelles et al., 2010 | |
| Impages salleana (Deshayes, 1859) | E | A | Argüelles et al., 2010 | |
| Orden Caenogastropoda Cox, 1960 | ||||
| Superfamilia Cerithioidea Fleming, 1822 | ||||
| Familia Cerithiidae Fleming, 1822 | ||||
| Cerithium lutosum Menke, 1828 | C | A | Argüelles et al., 2010 | |
| Familia Planaxidae Gray, 1850 | ||||
| Subfamilia Fossarinae A. Adams, 1860 | ||||
| Columbella mercatoria Linnaeus, 1758 | E | A | Argüelles et al., 2010 | |
| Fossarus orbignyi P. Fischer, 1864 | C | A | L | * |
| Subfamilia Planaxinae Gray, 1850 | ||||
| Angiola lineata (Da Costa, 1778) | E | A | L | * |
| Planaxis sp. | E | |||
| Familia Modulidae P. Fischer, 1884 | ||||
| Modulus modulus (Linnaeus, 1758) | E | A | Argüelles et al., 2010 | |
| Familia Turritellidae Lovén, 1847 | ||||
| Vermicularia sp. | E | * | ||
| Superfamilia Epitonioidea Berry, 1910 (1812) | ||||
| Familia Epitoniidea S. S. Berry, 1910 | ||||
| Epitonium lamellosum (Lamarck, 1822) | E | Co | Argüelles et al., 2010 | |
| Orden Littorinimorpha Golikov y Starobogatov, 1975 | ||||
| Superfamilia Tonnoidea Suter, 1913 (1825) | ||||
| Familia Tonnidae Suter, 1913 (1825) | ||||
| Tonna galea (Linnaeus, 1758) | E | A | L | * |
| Familia Cassidae Latreille, 1825 | ||||
| Phalium sp. | E | * | ||
| Semicassis sp. | E | * | ||
| Familia Ranellidae Gray, 1854 | ||||
| Monoplex nicobaricus (Röding, 1798) | E | Co | L | * |
| Superfamilia Vermetoidea Rafinesque, 1815 | ||||
| Familia Vermetidae Rafinesque, 1815 | ||||
| Petaloconchus varians (D'Orbigny, 1839) | E | A | L | * |
| Superfamilia Naticoidea Guilding, 1834 | ||||
| Familia Naticidae Guilding, 1834 | ||||
| Polinices hepaticus (Röding, 1798) | E | A | Argüelles et al., 2010 | |
| Superfamilia Stromboidea (Rafinesque, 1815 | ||||
| Familia Strombidae (Rafinesque, 1815) | ||||
| Strombus alatus Gmelin, 1791 | E | C,T | Argüelles et al., 2010 | |
| Subclase Heterobranchia Gray, 1840 | ||||
| Familia Architectonicidae J. E. Gray in M. E. Gray, 1850 | ||||
| Heliacus cylindricus (Gmelin, 1791) | E | A | L | * |
| Superfamilia Pyramidelloidea Gray, 1840 | ||||
| Familia Pyramidellidae Gray, 1840 | ||||
| Odostomia sp. | E | * | ||
| Infraclase Opisthobranchia Milne-Edwards, 1848 | ||||
| Orden Cephalaspidea P. Fischer, 1883 | ||||
| Familia Haminoeidae Pilsbry, 1895 | ||||
| Haminoea antillarum (D'Orbigny, 1841) | E | A | L | * |
| Familia Bullidae Gray, 1827 | ||||
| Bulla occidentalis A. Adams, 1850 | E | A | L | * |
| Orden Anaspidea Fischer, 1883 | ||||
| Familia Aplysiidae Lamarck, 1809 | ||||
| Aplysia dactylomela Rang, 1828 | E | A | L | * |
| Aplysia fasciata Poiret, 1789 | E | A | L | * |
| Orden Nudibranchia (Cuvier, 1817) | ||||
| Familia Aeolidiidae (Gray, 1827) | ||||
| Berghia sp. | E | * | ||
| Spurilla neapolitana (Delle Chiaje, 1844) | E | A | L | * |
| Subclase Neritimorpha Golikov y Starobogatov, 1975 | ||||
| Orden Cycloneritimorpha | ||||
| Superfamilia Neritoidea Rafinesque, 1815 | ||||
| Familia Neritidae Rafinesque, 1815 | ||||
| Nerita tessellata Gmelin, 1791 | E | A | Argüelles et al., 2010 | |
| Subclase Vetigastropoda Salvini-Plawen, 1980 | ||||
| Superfamilia Trochoidea Rafinesque, 1815 | ||||
| Familia Turbinidae Rafinesque, 1815 | ||||
| Tegula fasciata (Born, 1778) | E | A | Argüelles et al., 2010 | |
| Astraea sp. | E | * | ||
| Lithopoma americanum (Gmelin, 1791) | E | C,T | L | * |
| Familia Calliostomatinae Thiele, 1924 (1847) | ||||
| Calliostoma euglyptum (A. Adams, 1855) | E | A | L | * |
| Clase Bivalvia Linnaeus, 1758 | ||||
| Subclase Pteriomorphia Beurlen, 1944 | ||||
| Orden Arcoida Stoliczka, 1871 | ||||
| Superfamilia Arcacea Lamarck, 1809 | ||||
| Familia Arcidae Lamarck, 1809 | ||||
| Acar domingensis (Lamarck, 1819) | C | C, T | L | * |
| Arca imbricata Bruguiere, 1789 | C | C, T | L | * |
| Barbatia cancellaria (Lamarck, 1819) | C | C, T | L | * |
| Familia Isognomonidae Woodring, 1925 | ||||
| Isognomon bicolor (C. B. Adams, 1845) | C | C, T | L | * |
| Isognomon radiatus (Anton, 1838) | C | C, T | L | * |
| Orden Mytiloidea Rafinesque, 1815 | ||||
| Superfamilia Mytilacea Rafinesque, 1815 | ||||
| Familia Mytilidae Rafinesque, 1815 | ||||
| Brachidontes cf. exustus (Linnaeus, 1758) | C | C, T | L | * |
| Modiolus americanus (Leach, 1815) | C | C, T | L | * |
| Lithophaga aristata (Dillwyn, 1817) | C | C, T | L | * |
| Orden Veneroida Gray, 1854 | ||||
| Familia Veneridae Rafinesque, 1815 | ||||
| Callista maculata (Linnaeus, 1758) | E | C, T | L | * |
| Phylum Echinodermata Bruguière, 1791 [ex Klein, 1734] | ||||
| Clase Asteroidea de Blainville, 1830 | ||||
| Superorden Valvatacea Blake, 1987 | ||||
| Orden Paxillosida Perrier, 1884 | ||||
| Familia Astropectinidae Gray, 1840 | ||||
| Astropecten articulatus (Say, 1825) | E | T | L | * |
| Astropecten cingulatus Sladen, 1833 | E | G | L | * |
| Orden Valvatida Perrier, 1884 | ||||
| Familia Asterinidae Gray, 1840 | ||||
| Asterinides folium (Lutken, 1860) | E | G | L | * |
| Familia Ophidiasteridae Verrill, 1870 | ||||
| Linckia guildingi Gray, 1840 | E | T | L | * |
| Clase Ophiuroidea Gray, 1840 | ||||
| Orden Ophiurida Müller y Troschel, 1840 | ||||
| Suborden Ophiurina Müller y Troschel, 1840 | ||||
| Infraorden Chilophiurina Matsumoto, 1915 | ||||
| Familia Ophiuridae Müller y Troschel, 1840 | ||||
| Ophiura fallax Cherbonnier, 1959 | E | G | L | * |
| Infraorden Ophiolepidina Ljungman, 1867 | ||||
| Familia Ophiolepididae Ljungman, 1867 | ||||
| Ophiolepis impressa Lütken, 1859 | E | G | L | * |
| Infraorden Gnathophiurina Matsumoto, 1915 | ||||
| Familia Ophiocomidae Ljungman, 1867 | ||||
| Ophiocoma echinata (Lamarck, 1816) | E | C | L | * |
| Familia Ophionereididae Ljungman, 1867 | ||||
| Ophionereis reticulata (Say, 1825) | E | C | L | * |
| Familia Ophiactidae Matsumoto,1915 | ||||
| Ophiactis savignyi (Müller y Troschel, 1842) | E | G | L | * |
| Infraorden Ophiodermatina Smith, Paterson y Lafay, 1995 | ||||
| Familia Ophiodermatidae Ljungman, 1867 | ||||
| Ophioderma appressa (Say, 1825) | E | C | L | * |
| Clase Echinoidea Leske, 1778 | ||||
| Subclase Cidaroidea Smith, 1984 | ||||
| Orden Cidaroida (Claus, 1880) | ||||
| Familia Cidaridae Gray, 1825 | ||||
| Eucidaris tribuloides (Lamarck, 1816) | E | C | L | * |
| Subclase Euechinoidea Bronn, 1860 | ||||
| Superorden Echinacea Claus, 1876 | ||||
| Orden Arbacioida Gregory, 1900 | ||||
| Familia Arbaciidae Gray, 1855 | ||||
| Arbacia punctulata (Lamarck, 1816) | E | C | L | * |
| Orden Camarodonta Jackson, 1912 | ||||
| Infraorden Echinidea Kroh y Smith, 2010 | ||||
| Superfamilia Odontophora Kroh y Smith, 2010 | ||||
| Familia Echinometridae Gray, 1855 | ||||
| Echinometra lucunter (Linnaeus, 1758) | E | G | L | * |
| Familia Toxopneustidae Troschel, 1872 | ||||
| Tripneustes ventricosus (Lamarck, 1816) | E | G | L | * |
| Infraclase Acroechinoidea Smith, 1981 | ||||
| Orden Diadematoida Duncan, 1889 | ||||
| Familia Diadematidae Gray, 1855 | ||||
| Diadema antillarum Philippi, 1845 | E | T | L | * |
| Clase Holothuroidea Blainville, 1834 | ||||
| Orden Aspidochirotida Grube, 1840 | ||||
| Familia Holothuriidae Ludwig, 1894 | ||||
| Holothuria (Cystipus) cubana Ludwig, 1875 | E | G | L | * |
| Holothuria (Semperothuria) surinamensis Ludwig, 1875 | E | G | L | * |
| Orden Apodida Brandt, 1835 | ||||
| Familia Synaptidae Burmeister, 1837 | ||||
| Euapta lappa (J. Müller, 1850) | E | C | L | * |
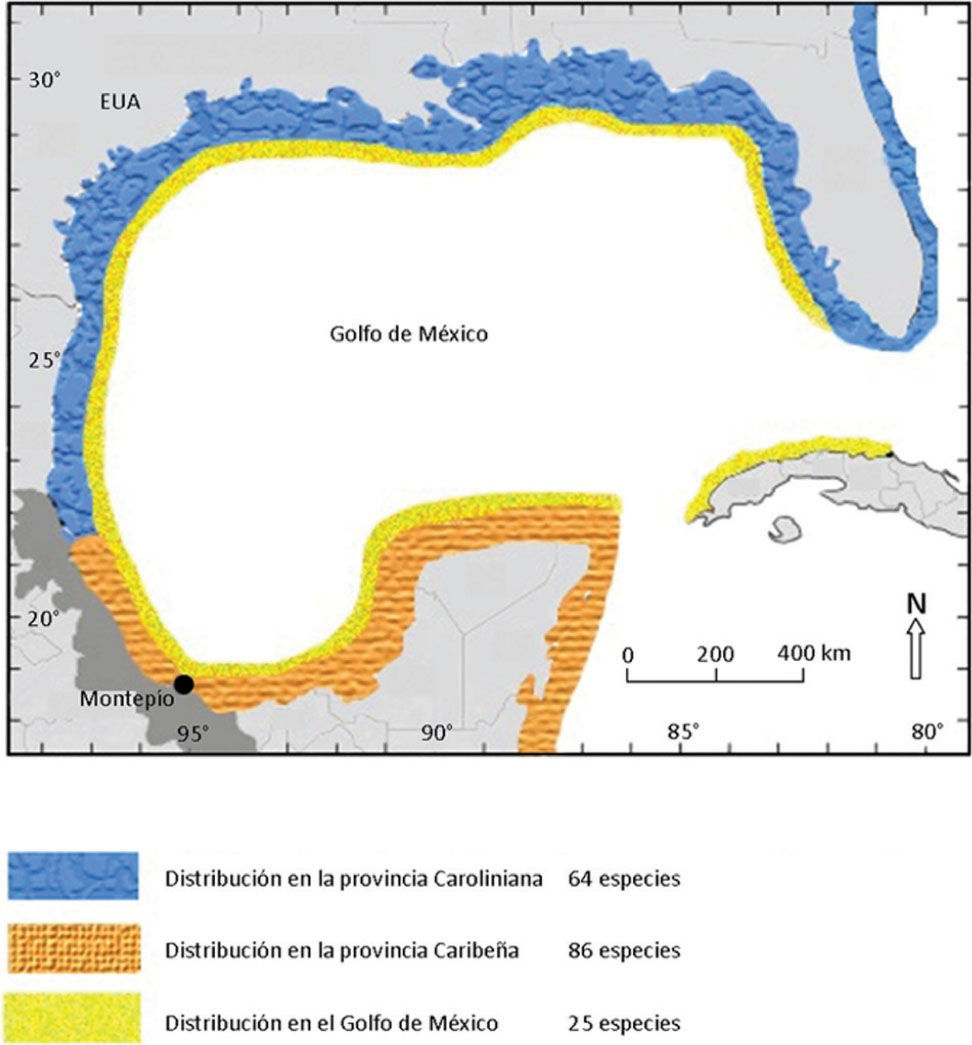
Se observó que la mayoría de los organismos encontrados son afines a la provincia Caribeña (Fig. 3). Sin embargo, también hay una influencia de la provincia Carolineana y del golfo de México en la distribución de la especies, describiendo una vez más que esta región occidental del golfo de México es una gran zona de transición.
Del total de especies registradas destacan 74 nuevos registros para la zona de estudio, distribuidos de la siguiente manera: Cnidaria 11, Platyhelminthes 1, Annelida 9, Mollusca 34 y Echinodermata 19 (Cuadro 2). Asimismo, se tienen 7 nuevos registros para Veracruz: Sipuncula 1 (Antillesoma antillarum [Grube, 1858]); Chelicerata 2 (Achelia sawayai Marcus, 1940, Anoplodactylus californicus Hall, 1912) y Mollusca 4 (Busycon perversum [Conrad, 1840], Nassarius albus [Say, 1826], Leucozonia ocellata [Gmelin, 1791], Hastula hastata [Gmelin, 1791]). Conforme avance el estudio de esta comunidad el número de registros únicos aumentará, ya que en 33 casos los organismos solamente pudieron ser identificados a nivel de género y entre éstos hay varias especies nuevas por describir.
DiscusiónPara situar en un contexto útil la información generada, se pueden citar otros inventarios como el de Felder y Camp (2009), quienes registraron para la porción mexicana del golfo de México 5 517 especies de invertebrados de los grupos taxonómicos que aquí se documentan. A partir de esta cifra se estima que el 3.5% de esta riqueza puede encontrarse en la comunidad de invertebrados marinos de la ZRI de Montepío, en tan sólo un área de aproximadamente 1 ha y, considerando profundidades de 0 a 1.5m. Este cálculo da idea de la importancia de conservar pequeñas comunidades que pueden albergar una diversidad considerable.
La estructura de la comunidad de Montepío depende de los cambios estacionales, ya que la época de nortes influye en la abundancia de algas, las cuales brindan alimento y refugio a diversas especies de invertebrados (Tait y Dipper, 1998). Estudios previos en esta localidad registraron que un 39% de las especies de crustáceos se reemplazan de un mes a otro, lo cual demuestra una fuerte influencia de los cambios estacionales en la estructura de la comunidad (Hernández y Álvarez, 2007). Adicionalmente, el intenso y constante reemplazo de especies deja ver que para obtener un mejor inventario hay que muestrear durante varios años para poder registrar a las especies raras que aparecen brevemente en la localidad.
Los grupos con mayor número de especies fueron Crustacea, seguido de Mollusca y Echinodermata. Los crustáceos son organismos unitarios que se distribuyen a lo largo de la zona intermareal y son favorecidos por la época de nortes, donde se asientan y reclutan especies raras. Los moluscos poseen una diversidad de formas considerable, colonizan todo tipo de ambientes y ciertas especies son muy tolerantes a cambios violentos (Brusca y Brusca, 2003; Moretzsohn et al., 2009). Es por ello que son capaces de utilizar y crear espacios en la roca y mantenerse ahí. Los equinodermos participan en la regulación de las poblaciones, son los principales competidores por espacio y alimento, además de ser importantes depredadores (Reaka, 1985, 1987).
En cuanto al tipo de hábitat, la epifauna presentó una mayor riqueza específica, probablemente debido a que la heterogeneidad de este microambiente proporciona una mayor variedad de espacios disponibles. En Montepío el espacio habitable dentro de la ZRI está dado por una concreción que se produce tomando como base un derrame de lava, de tal manera que se crea una capa de alrededor de 10cm que los organismos pueden colonizar. Esto contrasta con otros sustratos, como el de pedacería de coral o el mismo coral vivo, que pueden ser bioerosionados y perforados por una variedad de organismos (Morany Reaka-Kudla, 1991b; Gischler y Ginsburg, 1996). La concreción de la ZRI de Montepío está formada principalmente por esponjas, algas incrustantes, conchas de moluscos, tubos de anélidos y granos de arena. De esta manera, la matriz en donde vive la criptofauna es limitada y se observa una mayor diversidad de la epifauna.
En el Atlántico oeste se observa que muchas especies litorales tienen una amplia distribución, abarcando del extremo norte en la región de las Carolinas, en los Estados Unidos, al extremo sur, alcanzando el sur de Brasil (Briggs, 1974). Dentro de esta gran región existe un componente de afinidad tropical que se distribuye fundamentalmente en el Caribe y que está ampliamente distribuido en el suroeste del golfo de México. En este trabajo, se observó que la mayoría de las especies presentan una afinidad tropical o Caribeña, lo cual destaca la importancia que pueden tener las corriente marinas como vía de conexión hacia esta porción del golfo de México (Fenner, 2001; Fenner y Banks, 2004).
También se registraron especies que se ubican tanto en el golfo de México como en la parte noroeste del Atlántico, probablemente porque estuvieron conectados por un corredor en el pasado. Briggs (1974) menciona que Florida pudo haber estado inundada en la época interglacial del Pleistoceno o incluso antes, por lo que permitió un intercambio de especies tanto de clima cálido como de clima templado. Sin embargo, este evento parece ser un factor menor en la distribución actual de las especies que se distribuyen en el suroeste del golfo de México.
Montepío posee características que la hacen una zona de estudio particular, ya que la comunidad se regenera año con año después de la incidencia de nortes en la región, aumentando la posibilidad de asentamiento de especies raras que pueden competir por un sustrato (Hernández y Álvarez, 2007). Por ello, es importante mantener un monitoreo de la zona todo el año, ya que de esta forma es posible tener un registro de la variabilidad estacional de la comunidad.
Este tipo de estudios pueden utilizarse para establecer el estado de salud de la comunidad y pueden apoyar estudios sobre interacciones que permitan describir la variación en la composición de la comunidad. Destaca que una localidad muy pequeña puede albergar una cantidad importante de especies, sugiriendo que la conservación de pequeñas áreas a lo largo de la costa puede ser una estrategia viable para conservar la biodiversidad litoral.
Agradecemos al Dr. José Luis Villalobos-Hiriart de la Colección Nacional de Crustáceos del Instituto de Biología de la UNAM su apoyo para realizar el presente estudio.