Se describen e ilustran 2 especies nuevas para la ciencia del género Boletus encontradas en bosques de Quercus en los estados de Nuevo León y Tamaulipas, México: Boletus paulae y B. singeri. B. paulae pertenece a la secc. Luridi y B. singeri a la secc. Subpruinosi del género Boletus. Ambas especies son consideradas micorrizógenas, la primera con Quercus fusiformis y Q. polymorpha y la segunda con Q. canbyi. Los especímenes están depositados en los Herbarios ITCV y UNL con duplicados en F y ENCB. Además, se presentan claves para la determinación de las especies mexicanas de las secc. Luridi y Subpruinosi que crecen en México.
Two new species of the genus Boletus collected in a Quercus Forest from Nuevo León and Tamaulipas states, Mexico, are described and illustrated for the first time for science: Boletus paulae and B. singeri. Boletus paulae belongs to the sect. Luridi and B. singeri to the sect. Subpruinosi of the genus Boletus. Both species are considered mycorrhizal, the first with Quercus fusiformis and Q. polymorpha and the second with Q. canbyi. The specimens are deposited in the Herbaria ITCV and UNL with duplicates in F and ENCB Herbaria. Besides, keys are provided for determining Mexican species of the sect. Luridi and Subpruinosi that grow in Mexico.
Los Boletales son un orden monofilético de Agaricomycetes que incluye más de 1 316 especies descritas que están distribuidas tanto en zonas templadas como tropicales de todo el Mundo (Binder y Hibbett, 2006; Kirk et al., 2008). Estos hongos forman un grupo morfológicamente diverso de especies que incluye basidiomas con himenóforo poroide, laminar, liso, venoso y dentado o con formas estipitadas, sésiles, resupinadas y gasteroides hipogeas o epigeas (Grubisha et al., 2001; Binder y Hibbett, 2006). La mayoría de los Boletales obtienen sus fuentes de carbono por sus asociaciones micorrizógenas que forman con plantas de las familias Betulaceae, Fagaceae, Fabaceae, Ericaceae, Pinaceae y Salicaceae, entre otras (Newman y Reddell, 1987). Algunos son altamente apreciados por su valor comestible y otros son importantes ecológicamente como fuente de alimento para mamíferos y muchos insectos. Recientemente, Binder y Hibett (2006) realizaron el análisis filogenético del orden Boletales, en el cual reconocieron 6 subórdenes: Boletineae, Paxillineae, Sclerodermatineae, Suillineae, Coniophorineae y Tapinellineae, en donde los primeros 4 tienen hongos con forma boletoide. Bajo este nuevo criterio taxonómico, el género Boletus se incluye en el suborden Boletineae dentro de la familia Boletaceae y las características taxonómicas consideradas por Singer (1986) se mantienen para el mencionado género, aunque las hipótesis filogenéticas lo consideran como polifilético (Binder y Hibbett, 2006).
Entre los estudios que se han desarrollado en México sobre los hongos boletoides destacan los de García y Castillo (1981) sobre las especies de boletáceos de Nuevo León; Cappello y Cifuentes (1982) quienes estudiaron especies de Suillus del estado de Guerrero; Singer et al. (1990, 1991, 1992) sobre los Boletineae de México y Centroamérica; los de González-Velázquez y Valenzuela (1993, 1995, 1996) sobre los boletáceos del Estado de México, y los de García (1999) y García-Jiménez y Garza-Ocañas (2001) quienes registraron e inventariaron 212 taxa de Boletaceae s.l. para el país, lo que equivale al 16.1% de las especies actualmente conocidas en el Mundo.
Durante las estancias de investigación realizadas en 1988 y 1989 por el primer autor con el Dr. Rolf Singer en el Museo de Historia Natural de Chicago, se revisaron especímenes de los estados de Nuevo León y Tamaulipas que no concordaban con las especies descritas del género Boletus y años más tarde, entre 2005 y 2010 se realizaron diversos estudios en el estado Tamaulipas y se recolectaron más ejemplares de hongos boletoides correspondientes a los mismos taxones; por lo que el presente trabajo tiene como objetivo describir e ilustrar 2 especies nuevas del género Boletus para el país y de esta manera contribuir al conocimiento de la micobiota de México. Estas especies de acuerdo a la clasificación de Singer (1986) se ubican en las secc. Luridi y Subpruinosi, la primera caracterizada por tener hábito de tipo Boletus, esto es con poros pequeños y estípite robusto y ventricoso, el cual es finamente floccoso, furfuráceo, fibriloso o finamente a fuertemente reticulado y la superficie del píleo es seca o viscida, y usualmente tomentosa, pruinosa, velutinosa, granular o lisa, superficie de los poros de color rojo cuando jóvenes, decolorando en la madurez a anaranjado o oliváceo, contexto se mancha de azul al maltratarse; mientras que la segunda presenta hábito de tipo Xerocomus, esto es con poros grandes y estípite delgado y cilíndrico, con la superficie similar en ornamentación a la anterior, y el píleo es seco y floccoso, furfuráceo o fibriloso, contexto se mancha o no de azul al maltratarse. Se presentan claves dicotómicas para la determinación de las especies conocidas en México de ambas secciones (González-Velázquez y Valenzuela, 1993, 1996; García, 1999; García-Jiménez y Garza-Ocañas, 2001).
Materiales y métodosEn el presente trabajo se estudiaron 37 ejemplares que se depositaron en el Herbario Micológico “José Castillo Tovar” del Instituto Tecnológico de Ciudad Victoria (ITCV) y en el Herbario de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León (UNL) con duplicados en los herbarios del Museo de Historia Natural de Chicago (F) y de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB). Las siglas de los herbarios son de acuerdo con Thiers (2012). Para la caracterización macroscópica de los especímenes recolectados se siguieron los criterios de Largent et al. (1977) y Cifuentes et al. (1986). Los colores de los basidiomas mencionados en las descripciones de las especies se basan en la tabla de Kornerup y Wanscher (1978). Para el análisis microscópico de los ejemplares se utilizó KOH al 5% y reactivo de Melzer como medios de montaje y se realizaron cortes de las diferentes partes del basidioma para observar las esporas, basidios, cistidios, la disposición de las hifas del himenóforo, contexto y superficie del píleo y estípite; además se hicieron dibujos a escala de dichas estructuras.
DescripcionesBoletus paulae J. García, Singer y F. Garza-Ocañas sp. nov.
Diagnosis. Pileus 45–80mm latus, convexus, vividus ruber, ruber, vinaceus ruber vel brunneus ruber, siccus, primum laevis, dein velutino-tomentosus vel rimulosus. Hymenophorum tubulosum, adnexum vel depressum, ruber vel aurantio-ruber, flavum-arantiacum, caerluescens; pori angulati, 0.5–1mm latis; tubi flavus vel olivaceus, caerulescens. Stipes 40–65mm longus, 8–26mm crassus, furfuraceo-punctatus, vivide luteus ad apicem, vividus ruber, ruber, vinaceus ruber vel brunneus ruber, siccus. Contextus 10–17mm crassus, primum alvidus vel pallide luteus, fracta pallide ruber, dein caerulescens. Basidiosporis (8.8-) 9.6–12×4–5.2 (−5.6)μm, ellipsoidis vel fusoidis. Tramate hymenophorali typi boletorum. Pileipellis et stipitipellis tricodermialis. Hyphis haud fibuligeris. Ad terrum in quercetum silvae. México, Nuevo León, municipio de Santiago, El Cercado, 8.VI.1984, prope. J. García 4499 (holotypus ITCV, isotypus F, ENCB).
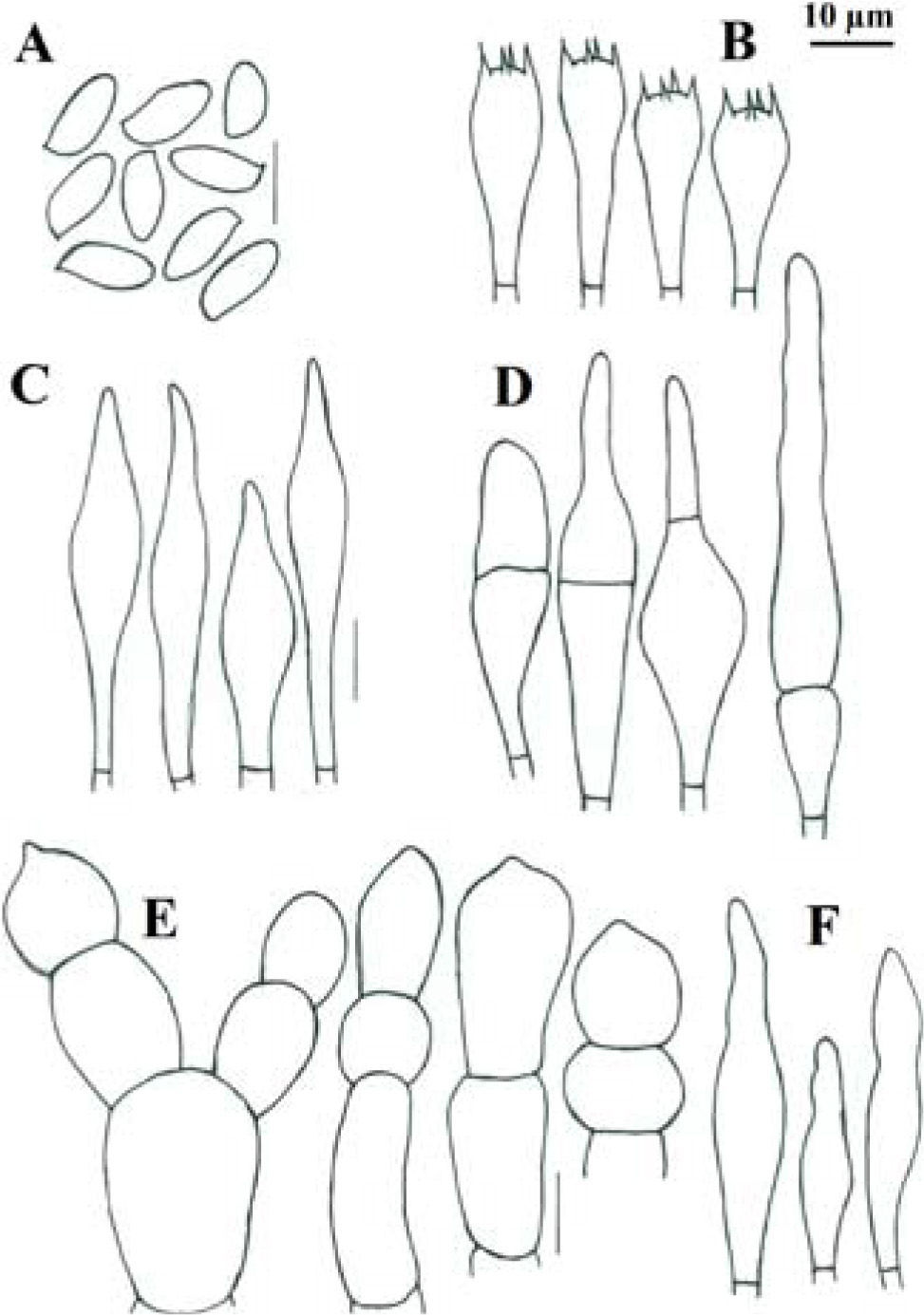
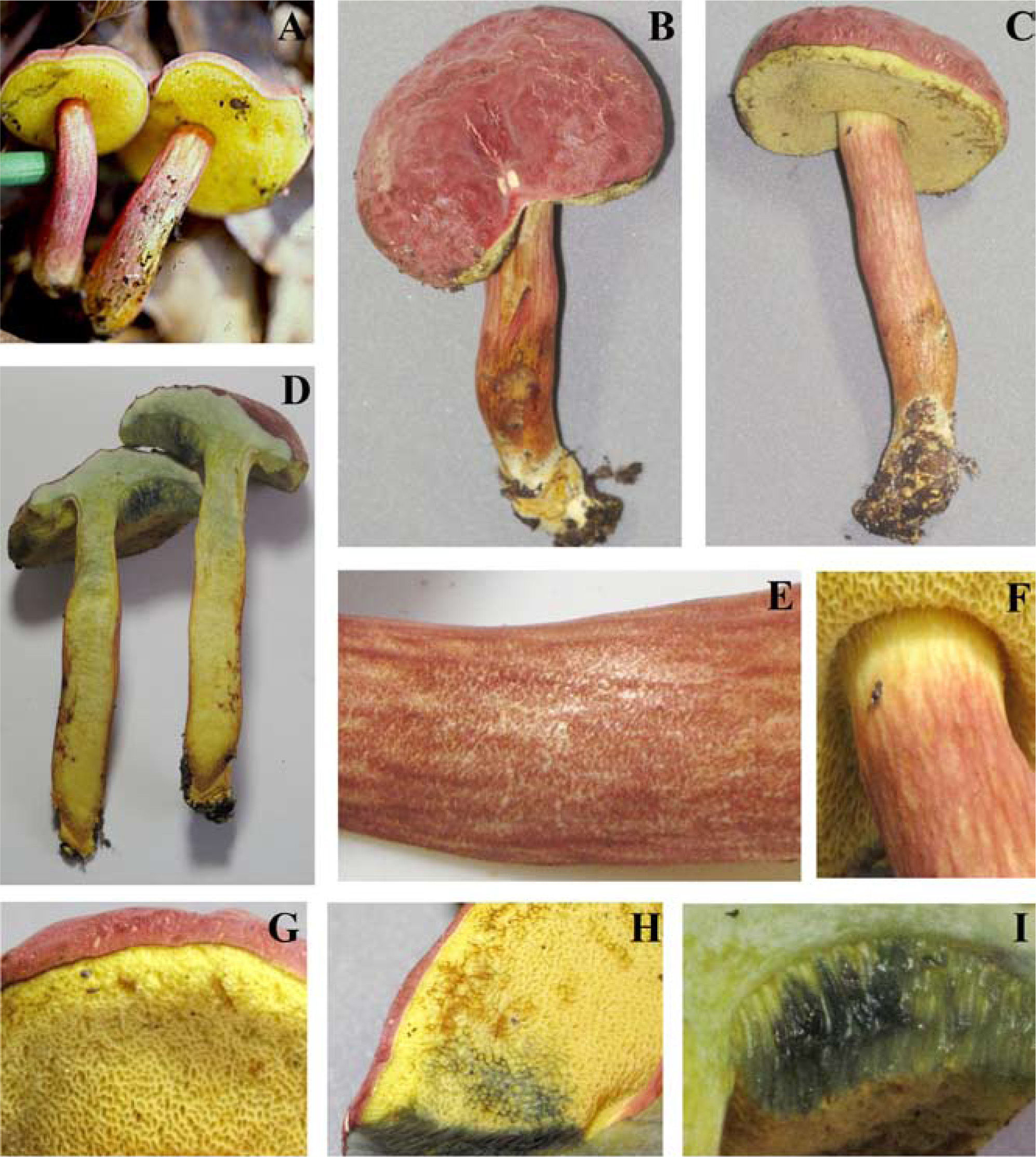
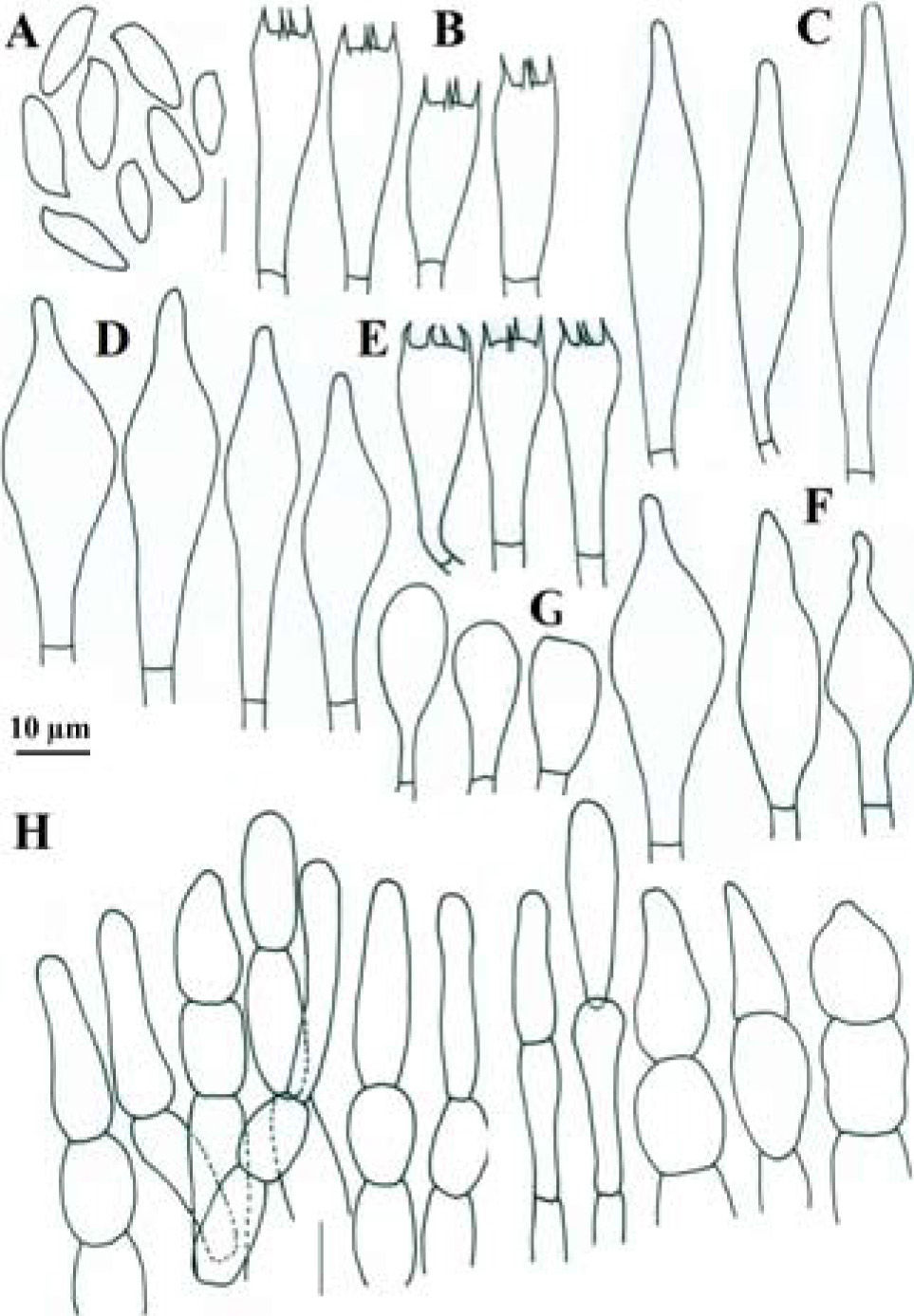
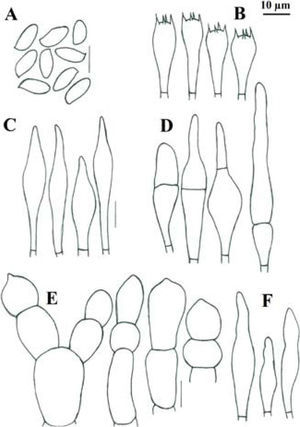
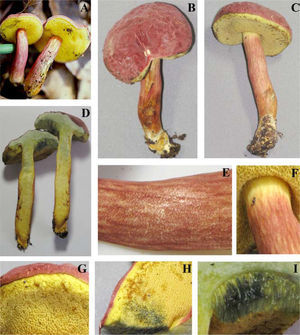
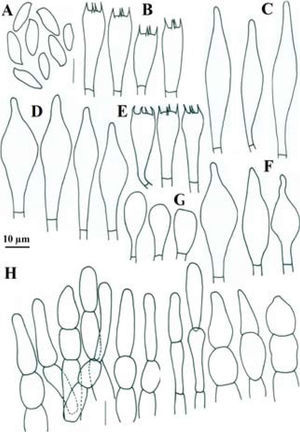
Píleo de 45–80mm de diámetro, convexo, de color rojo intenso (10A8, 11A8), rojo (11A6-7), rojo vináceo (11D8) a rojo frambuesa (10D7), en especímenes viejos o deshidratados es marrón violeta (11E8) o marrón (11F8), superficie seca, lisa o finamente tomentosa en especímenes jóvenes, ligeramente rimulosa a agrietada o rugulosa en especímenes maduros o viejos. Himenóforo tubuloso, adherido a subdeprimido; poros de 0.5–1mm de diámetro, angulares, alargados o algo laminares hacia el estípite, de color rojizo o anaranjados (7A5, 7A6, 8D6) al madurar, cianescentes al tocarse; tubos de 4–10mm de largo, de amarillo brillante (3A3-4) cuando joven, amarillo verdoso (1A8) u oliváceo (1E8), de color marrón rojizo (8E8) cuando viejo, cianescentes al exponerse. Estípite de 40–65×8–26mm, cilíndrico con la base ligeramente más ancha, algunos especímenes atenuándose hacia la base o hacia el ápice, amarillo brillante (4A7) en el ápice, rojizo vináceo (11D8) en su parte media, rojo púrpura (14A8) hacia la base, superficie seca, cubierta en su totalidad por furfuraciones muy conspicuas de color rojo vináceo (11D8), en algunos especímenes de aspecto fibriloso y longitudinalmente estriado de la parte media hacia la base, contexto sólido, amarillo pálido (4A4) a amarillo brillante (4A7), de color rojo (11A6-7) en los túneles causados por insectos, cianescente en algunas partes al exponerse. Micelio basal blanquecino-grisáceo. Contexto de 10–17mm de grosor, blanquecino a amarillo pálido (4A3) al cortarse, pronto se pone rosa pálido (11A3) con áreas rojizas bajo la cutícula y en los túneles de larvas de insectos, cianescente algunas partes al exponerse, consistencia carnosa y blanda, olor fungoide, agradable, sabor ligeramente ácido. Basidiosporas de (8.8-) 9.6–12×4–5.2 (−5.6)μm, media de Q=2.28μm, cilíndricas a fusoides u oblongas, con una depresión suprahilar, de color oliváceo en KOH y color miel pálido a marrón suboliváceo, inamiloides, lisas, de pared ligeramente gruesa de hasta 0.5μm. Basidios de 20–35×8–11.5μm, tetraspóricos, claviformes, hialinos a amarillo pálido en KOH. Pleurocistidios de 36–69×(6.5-)9–11μm, escasos, fusoide-ventricosos a subcilíndricos, amarillo pálido en KOH y solución de Melzer. Queilocistidios de 29–48×6–9μm, abundantes, subventricosos a fusoides, hialinos a amarillo pálido en KOH, con un contenido granuloso y amarillento en solución de Melzer; en el borde con células subglobosas o ampuláceas del tipo basidiolo, de 20–24×14–20μm, hialinas en KOH y con un contenido granuloso anaranjado en solución de Melzer. Trama himenoforal bilateral del tipo Boletus, con un estrato medio de hifas algo gelatinizadas, hialinas o pálido amarillentas en KOH y amarillo anaranjado en solución de Melzer, que miden de 5.2–14.2μm de diámetro y el estrato lateral de hifas cilíndricas hialinas en KOH, que miden de 10.4–16μm de diámetro, hifas sin fíbulas. Pileipellis un tricodermis, formado por un conjunto de hifas erectas más o menos en palisada, con células terminales subglobosas cortas o claviformes o subglobosas a mucronadas, de 8.8–34μm de diámetro, pálido amarillentas en KOH. Estipitipellis formado por un estrato himeniforme o subhimeniforme de dermatobasidios de 14–22×6.5–8.5μm, tetraspóricos, hialinos a amarillentos en KOH y de elementos cilíndricos o utriformes de 22×4–5.5μm y caulocistidios claviformes, fusiformes o ventricosos de cuello largo y ápice subagudo algunos con un septo intermedio de 27–70×5–13μm, hialinos o amarillo pálido, algunos granulosos en KOH.
Reacciones macroquímicas: el KOH sobre la superficie del píleo, el contexto y los poros reacciona cambiando a amarillo anaranjado, marrón amarillento o marrón rojizo; sobre la superficie del estípite cambia a color verdoso y luego a ocráceo. El NH4OH no reacciona sobre la superficie del píleo, pero en contexto, superficie del estípite y poros cambia a color verde.
Hábito y hábitat: esta especie crece gregario en el humus y mantillo, en bosques de Q. fusiformis Small y Q. polymorpha Schlecht. y Cham., en los encinares de zonas bajas (entre los 400 y 500m snm) o en el ecotono del encinar con selvas baja caducifolia o con matorral espinoso, o en los encinares de zonas altas (entre los 1 000 y 1 500m snm) en el ecotono con el bosque mesófilo de montaña o en los bosques de encino y encino-pino asociada a Q. polymorpha. Fructifica en los meses de abril a octubre. Se conoce de diferentes localidades de los estados de Nuevo León y Tamaulipas en el noreste de México. La especie está dedicada a Paula Imelda Morales-Flores, esposa del primer autor, lo cual fue sugerido en 1990 por el Dr. Rolf Singer (QEPD).
Material examinado: Nuevo León: municipio de Santiago, El Cercado, 1km hacia el poniente de la Colonia Pescadores, 8.VI.1984, J. García 4499 (holotipo ITCV, isotipo en F, ENCB), 17.VI.1984, J. García 4582, 4582-b (ITCV), 17-IX-1987, San Martín s/n. (ITCV), 23.X.1988, J. García y R. Singer 1988, J. García 6103, 6107 (ITCV), 11.VI.1991, J. García 7112 (ITCV); El Álamo, 7.VIII.1984, J. García 4420 (ITCV), El Cerrito, 4.VII.1981, R. Valenzuela 2105 (ENCB, ITCV); municipio de Juárez, río San Roque, 26.IX.1983, J. García 3161 (UNL, ITCV); municipio de Montemorelos, carretera Montemorelos-Linares, Puente Encadenado, 21.IX.1994, J. García 8997 (ITCV). Tamaulipas: municipio de Casas, 4km al poniente del km. 80 carretera de Cd. Victoria-Soto La Marina, rancho El Lajeadero, 18.VI.1987, J. García 5445 (ITCV), 1.VII.1993, J. García 8529, 8538 (ITCV), 28.IX.1993, J. García 8749, 6.X.1993, J. García 8778 (ITCV); municipio de Victoria, Altas Cumbres, 15.IX.1992, J. García 7426; El Madroño, 26.X.2005, J. García 14780; municipio de San Carlos, cerro El Diente, 13.IX.2003, J. García 14490; Las Mulas, 13.IX.2008, J. García 17470, 28.VII.2010, J. García 18590; municipio de Güémez, La Esperanza, 5.IX. 2004, J. García 14730; municipio de Gómez Farías, Ejido Alta Cima, 1.VII.2000, J. García 14314; La Alamillosa, 5.VI.2009, J. García 17920 (todos en ITCV).
Comentarios taxonómicos: Boletus paulae se distingue por el píleo de color rojo carmín o rojo rosáceo, los poros anaranjados cuando maduro, el estípite con notables furfuraciones rojizas y el contexto blanquecino a rosáceo con tonos rojizos que se mancha de azul al exponerse, por el tamaño de sus esporas. La especie pertenece a la secc. Luridi distinguible por el color rojo de los poros en especímenes jóvenes. Boletus bicolor var. borealis A. H. Sm. y Thiers es un hongo parecido, pero éste tiene el estípite liso y las esporas más grandes (11–15×4–5μm).Boletus carminiporus Bessette, Both y Dunaway presenta coloración similar pero su contexto se mancha muy ligeramente de azul, el estípite es distintamente reticulado y sus esporas son más pequeñas y angostas (Bessette et al., 2000). Boletus flammans Dick y Snell tiene colores rojos, los poros rojo fuerte; sin embargo, el estípite es reticulado al ápice y las esporas son más largas (10–18×3.5–6.5μm) que las de B. paulae. Boletus subvelutipes Peck y B. hypocarycinus Singer son también miembros de la secc. Luridi, en estos el píleo es marrón obscuro a marrón rojizo, el estípite es furfuráceo o los poros de un rojo ladrillo mientras que en B. paulae el píleo es rojo, los poros son anaranjados y el basidioma en general es menos robusto que los anteriores. Finalmente, B. dupainii es una especie afín que se parece en los colores del basidioma, pero se separa por tener la superficie del píleo víscida a glutinosa y las esporas de 12.8–14.4×4–5.6μm (Ortiz-Santana et al., 2007).
Boletus singeri J. García, E. Estrada-Castillón y R. Valenz. sp. nov.
Mycobank 804375
Diagnosis. Pileus 22–62mm latus, convexus, roseus, subroseus vel rubellus, siccus, primum velutinum, dein laevis vel rimulosum. Hymenophorus tubulosus, depressus, primus flavus, dein spadiceus vel olivasceus, locus contusus caerulescens, dein brunnescens; pori angulati, 0.3–0.5mm latis; tubi flavidus vel olivaceus, caerulescens. Stipes 4–61mm longus, 9–11mm crassus, furfuraceo-punctatus, luteus adapicem, roseus, subroseus velrubellus, siccus. Contextus 7–10mm crassus, primum alvidus vel pallide luteus, fracta caerulescens. Basidiosporis 11.4–14.4 (−15)×4.2–5.4 (6)μm, ellipsoidis vel fusoidis. Tramate hymenophorali typi boletorum. Pileipellis et stipitipellis tricodermialis. Hyphis haud fibuligeris. Ad terrum in quercetum silvae. México, Tamaulipas, municipio de Victoria, El Madroño, Km 151 Tula-Cd. Victoria, 24-IX-1985, prope. J. García 4966 (holotypus ITCV, isotypus F, ENCB).
Píleo de 22–62mm de diámetro, convexo, de color rosa (12A4-5) a rosa pastel (11A4), con tonos rojo pálido (9A3), rojo opaco (9C4), rojo grisáceo (9C5) a rojo marrón (9C6), superficie seca, finamente velutinosa en especímenes jóvenes, glabrescente a lisa cuando maduros, ligeramente agrietado en el margen dejando ver el contexto de color crema en especímenes maduros. Himenóforo tubuloso, depreso alrededor del estípite; poros de 0.3–0.5mm de diámetro, angulares, de color amarillo brillante (2A5) a amarillo pálido (2A3) cuando joven, después de color anaranjado ocráceo (5C7) a marrón oliváceo (4E6), se manchan de azul al tacto y después a marrón amarillento (5E8); tubos de 3–9mm de largo, amarillos (2A4) a oliváceos (4A6), se tiñen de azul rápidamente al exponerse. Estípite de 45–61×9–11mm, subcilíndrico, más delgado al ápice, de color amarilló pálido (2A3) al ápice y de color rosa (12A4-5) a rosa pastel (11A4), con tonos rojo pálido (9A3), rojo opaco (9C4), con algunos tonos marrón dorado (5D7) a anaranjado-marrón (5D5) hacia la base, superficie seca, densamente furfurácea-pustulada, furfuraciones de color rosáceo (12A4-5) a rojo vináceo (11D8); contexto sólido, amarillo pálido (4A4) a amarillo brillante (4A7), de color rojo (11A6-7) en los túneles causados por insectos, cianescente en algunas partes al exponerse. Contexto de 7–10mm de grosor, blando, blanquecino a amarillo pálido (2A3), se mancha rápidamente de azul al exponerse, en los canales producidos por insectos es rojo púrpura (14A8), olor fungoide, sabor dulce, en el estípite sus 3 cuartas partes inferiores son de color amarillo cadmio (2A8). Micelio basal blanco. Esporada olivácea. Basidiosporas de 11.4–14.4 (−15)×4.2–5.4 (−6)μm, media de Q=2.6, notablemente variables en tamaño, cilíndricas a fusiformes con depresión suprahilar, con ápice obtuso, de color oliváceo en KOH y color miel a marrón anaranjado y algunas rojizas en solución de Melzer. Basidios de 21.639×9–10.2μm, claviformes, tetraspóricos, hialinos o con un contenido granuloso amarillento en KOH, algo más amarillentos en solución de Melzer. Trama himenoforal bilateral del tipo Boletus, con un estrato medio de hifas amarillentas y un estrato lateral hialino en KOH, éstas miden de 5–9μm de diámetro, sin fíbulas. Pleurocistidios de 30–52×9–15μm, fusoide ventricosos, hialinos o algunos pálido amarillento en solución de Melzer. Queilocistidios de 35–65×8.4–10.2μm, fusoides o lanceolados, con ápice agudo o subagudo, hialinos en KOH y amarillo pálido en solución de Melzer. Pileipellis formado por un tricodermis de hifas entrelazadas, con elementos terminales variables en forma, desde cilíndricos, o cistidioides cortos, elipsoides a subglobosos, estos son amarillos en KOH y presentan un contenido amorfo, de color anaranjado en solución de Melzer, de 15–32×6–12μm, los elementos subterminales son predominantemente subisodiamétricos y algunos cilíndricos, hialinos en KOH de 12–20×7.8–11.4μm. Estipitipellis formado por un estrato himeniforme de dermatobasidios claviformes bi o tetraspóricos, amarillos en KOH y ligeramente más pigmentado en solución de Melzer de 24–28.8×9–11.4μm, dermatocistidios fusoides a fusoide-ventricosos, pálido amarillento en KOH y algo más amarillas en solución de Melzer, de 27–46×9–13.8, también algunos elementos del tipo basidiolos, claviformes con la misma coloración y de 18–38×7.8–9μm.
Reacciones macroquímicas: el KOH sobre el píleo reacciona a anaranjado ocráceo, sobre el contexto a color naranja a ocráceo, en los poros y superficie del estípite amarillo naranja. El NH4OH sobre la superficie del píleo reacciona rápidamente a color violáceo, e inmediatamente después de color ocráceo anaranjado a rojizo, en el contexto a amarillo ocráceo, en la superficie del estípite lentamente a ocráceo y en los poros a ocráceo.
Hábito y hábitat: esta especie crece gregario en el humus y mantillo de bosques de Q. canbyi Trel. Fructifica en los meses de julio a septiembre entre los 800 y los 1 200m de altitud. Se conoce sólo de 4 localidades del municipio de Victoria en el estado de Tamaulipas de la región noreste de México. La especie está dedicada al Dr. Rolf Singer por el valioso trabajo que realizó sobre el estudio de los boletáceos en el mundo.
Material examinado: Tamaulipas: municipio de Victoria, carretera Tula-Cd. Victoria, km 151, El Madroño, 24-IX-1985, J. García 4966 (holotipo ITCV, isotipo F, ENCB); 27-VIII-1989, J. García 6201, 16-IX-1990, J. García 6882 (ITCV, ENCB), 15-IX-1991, J. García 7425, 7427, 9535 (todos en ITCV); camino del Huizachal al Puerto Arrazolo, 29-VIII-1998, J. García 10995, 11003, 11032 (ITCV); cerca de la Iglesia, Altas Cumbres, 31-VII-2010, J. García 18350 (ITCV, ENCB); ejido Las Mulas, 13 IX-2008, J. García 17462; 8-VIII-2010, J. García 18393 (ITCV, ENCB).
Comentarios taxonómicos: Boletus singeri pertenece a la secc. Subpruinosi (s. str. Singer, 1986), se distingue por el color rosa a rosa vináceo característico del píleo y las conspicuas furfuraciones rosáceas del estípite, así como por su hábitat característico, bajo Q. canbyi en el estado de Tamaulipas. Boletus rubellus Krombh. es una especie común en el noreste y centro de México, la cual se distingue por presentar una coloración muy variable, el píleo es rojo fuerte al principio, el cual con la edad se atenúa a rojizo o rosáceo siendo conspicuamente areolado en la madurez, sus poros son más anchos, angulares, sus esporas son ligeramente más cortas y los elementos del pileipelis presentan incrustaciones en su pared. Boletus campestris A. H. Sm. y Thiers es una especie menos frecuente, ha sido registrado de Nuevo León (García, 1999), este también presenta colores rosáceos pero su estípite no es tan densamente furfuráceo y es de color crema anaranjado, sus esporas son más cortas y el pileipellis presenta las células terminales muy largas de hasta 80μm, y de hasta 11.2μm de diámetro y crece en bosques de Quercus y Pinus en sitios de alrededor de 2 200m snm (Smith y Thiers, 1971).
Cabe mencionar que García (1999) incluyó 65 especies del género Boletus que crecen en México, de las cuales 24 pertenecen a la secc. Luridi (7 con la categoría de sp., entre las que se incluye a B. paulae, aquí descrita), y 5 a la secc. Subpruinosi (1 nueva con la categoría sp., aquí descrita como B. singeri). A continuación se presentan claves de las especies de las secc. Luridi y Subpruinosi que se desarrollan en México, modificadas de García (1999), en donde se reconocen 18 de la primera sección y 5 de la segunda; dichas especies están validadas en el Index Fungorum.
Clave dicotómica para determinar las especies del género Boletus secc. Luridi que crecen en México.
- 1.
Estípite conspicuamente reticulado en todo o en las 2/3 partes superiores……2
- 1.
Estípite furfuráceo, liso o reticulado, sólo en el ápice……8
- 2.
Píleo de color rojo, rosáceo o blanquecino con tonos rosáceos……3
- 2.
Píleo en diversos tonos de color marrón……6
- 3.
Píleo de color rojo, con la superficie víscida a pegajosa……4
- 3.
Píleo de color rosa o blanquecino con tintes rosados, superficie seca……5
- 4.
Retículo del estípite prominente a alveolado……B. frostii
- 4.
Retículo del estípite ligero, no prominente, ni alveolado……B. floridanus
- 5.
Píleo y estípite de color rosa pálido, poros color rosa a rosáceo anaranjado……B. michoacanus
- 5.
Píleo de color blanquecino con tintes rosados, poros de color rojo-anaranjado a rojo carmín……B. eastwoodiae
- 6.
Estípite de color amarillo y fuertemente reticulado en las 2/3 partes superiores; de color marrón rojizo a rojo púrpura y liso a ligeramente pruinoso hacia la base……B. luridellus
- 6.
Estípite de color amarillo anaranjado con un retículo color rojo a rojo carmín en toda su extensión; de color rojo vináceo en la base……7
- 7.
Píleo ligeramente agrietado a areolado en el centro, de color marrón pálido a marrón grisáceos o marrón oliváceo, poros de color rojo sangre……B. rhodosanguineus
- 7.
Píleo liso a velutinoso, de color marrón vináceo, marrón-anaranjado a marrón-rojizo, poros de color rojo ladrillo……B. luridus
- 8.
Píleo de color rojo, rojo vináceo o rosado……9
- 8.
Píleo de color marrón rojizo, marrón obscuro o marrón vináceo……13
- 9.
Estípite liso o con finas estrías en el ápice, formando un seudoretículo, amarillento hacia el ápice y rojo púrpura hacia la base, poros de color amarillo a anaranjado……B. rubricitrinus
- 9.
Estípite de pruinoso, ligeramente o conspicuamente furfuráceo, poros de color mamey a rojo ladrillo o rojo carmín……10
- 10.
Píleo de color rosa a rosa vináceo, estípite con estrías longitudinales, ligeramente furfuráceo, de color rojo vináceo, con la base amarillenta……B. guatemalensis
- 10.
Píleo con diversos tonos de color rojo, estípite sin estrías longitudinales……11
- 11.
Estípite pruinoso, de color anaranjado a anaranjado rojizo, con la base rojiza, píleo de color rojo vináceo a rojo, decolora a marrón cuando viejo, poros de color mamey……B. subluridellus
- 11.
Estípite fuertemente furfuráceo, de color anaranjado rojizo a rojo, con furfuraciones de color rojo, píleo rojo intenso a rojo sangre……12
- 12.
Píleo con la superficie víscida, poros de color rojo ladrillo a rojo sangre……B. dupainii
- 12.
Píleo con la superficie seca, poros de color rojo pálido, anaranjado cuando maduro o viejo……B. paulae
- 13.
Píleo de color marrón amarillento con el margen amarillo brillante, estípite amarillo brillante, reticulado en el ápice, con furfuraciones de color anaranjadas hacia la base……B. fagicola
- 13.
Píleo enteramente de color marrón en varios tonos, estípite no reticulado en el ápice……14
- 14.
Estípite con estrías en el ápice y el resto liso, de color marrón rojizo, con la base tomentosa, píleo finamente rimoso, de color marrón, con algunos tonos rosáceos o de color durazno……B. amygdalinus
- 14.
Estípite de ligeramente a fuertemente furfuráceo……15
- 15.
Poros de color marrón anaranjado a marrón rojizo, píleo de color marrón rojizo a marrón obscuro, aterciopelado, ligeramente agrietado, estípite furfuráceo, de color amarillo pálido cuando joven, marrón a rojizo cuando maduro……B. vermiculosus
- 15.
Poros de color rojo ladrillo, píleo de color marrón amarillento, marrón canela, marrón castaño a marrón rojizo……16
- 16.
Estípite con la superficie fuertemente furfurácea, con furfuraciones prominentes y de color anaranjado, amarillo anaranjado y están distribuidas en toda su extensión sobre una superficie de color amarillo pálido, amarillo brillante en el ápice y de color rojo púrpura en su base, base con un tomento basal rojo púrpura a oliváceo……B. austrinus
- 16.
Estípite con la superficie ligeramente furfurácea, furfuraciones no prominentes y de color marrón rojizo……17
- 17.
Estípite de color amarillo brillante al ápice y con tintes rojizos, rojo vináceo en casi toda su extensión, sin tomento basal……B. hypocarycinus
- 17.
Estípite de color amarillo anaranjado brillante en su mitad superior y de color anaranjado rojizo o rojo púrpura en hacia la parte inferior, y marrón obscuro o negruzco en la base, presenta un tomento basal de color marrón púrpura……B. subvelutipes
Clave dicotómicas para determinar las especies del género Boletus secc. Subpruinosi que crecen en México.
- 1.
Píleo de color marrón oliváceo o marrón vináceo, contexto se mancha intensa y rápidamente de azul fuerte al exponerse……B. pulverulentus
- 1.
Píleo de color rosa pálido, anaranjado rojizo o rojo, contexto se mancha ligeramente o moderadamente de azul de manera rápida o lenta……2
- 2.
Estípite fuertemente furfuráceo, de color rosa pálido……B. singeri
- 2.
Estípite ligeramente furfuráceo, liso o estriado longitudinalmente, de color rojizo rosáceo o amarillo……3
- 3.
Pileipellis con células globosas de hasta 31μm de diámetro……B. subfraternus
- 3.
Pileipellis con células subglobosas, fusiformes a cilíndricas, de 6–13.6μm de diámetro……4
- 4.
Píleo de color rosa pálido, poros de 0.3–0.5mm de diámetro, esporas de pared gruesa, de 10–13.6 (-14.4)×5–6.4μm, pileipellis de células terminales cilíndricas a fusiformes, de 32–80×5–11.2μm……B. campestris
- 4.
Píleo de color rosa a rojo, poros de 0.5–1.5mm de diámetro, esporas de pared delgada de 11.2–13.6×4.4–5.6μm, pileipellis de células terminales elipsoides a cistidioides de ápice subagudo y con finas incrustaciones en su pared, de 26–44×8–13.2μm……B.fraternus
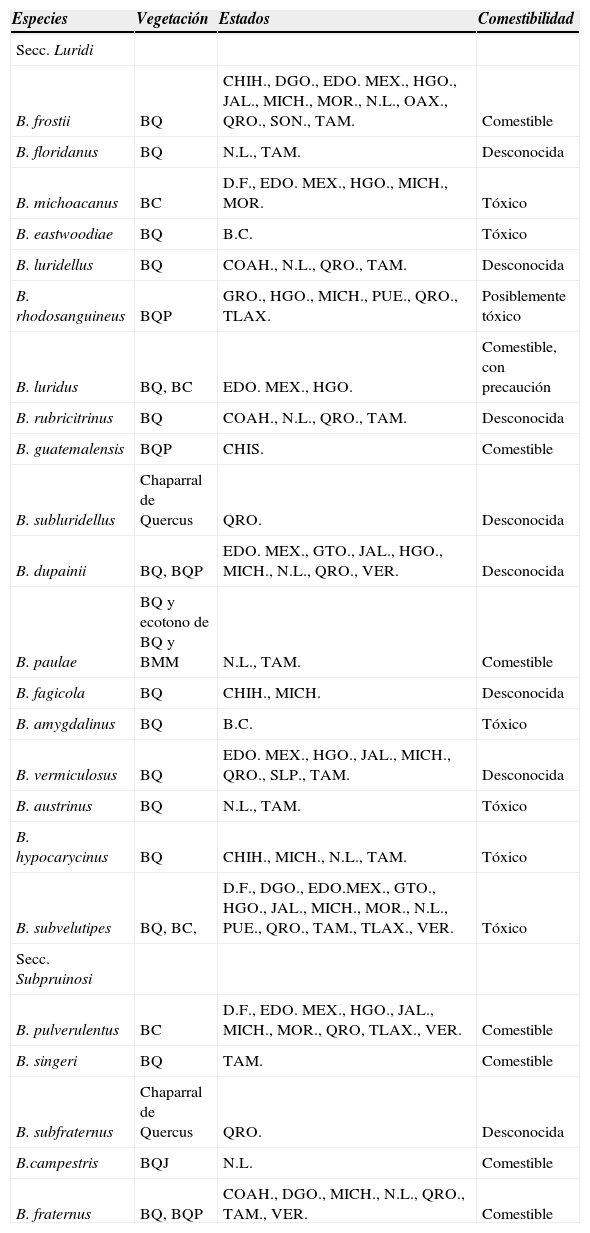
En el cuadro 1 se muestra la distribución geográfica de las especies del género Boletus secc. Luridi y secc. Subpruinosi que crecen en México, además de los tipos de vegetación donde se desarrollan y la comestibilidad o toxicidad que presentan éstas según los trabajos de González-Velázquez y Valenzuela (1993, 1996), García (1999), García-Jiménez y Garza-Ocañas (2001) y las recolecciones que los autores han realizado a través de todo el país. Las 18 especies de la secc. Luridi se recolectaron en 22 entidades federativas y las 5 especies de la secc. Subpruinosi se encontraron en 13. Los estados que presentaron el mayor número de especies, incluidas ambas secciones, fueron Querétaro y Tamaulipas con 11 especies, siguiéndole Michoacán y Nuevo León con 10, y después Hidalgo y Estado de México con 8 y 7, respectivamente; mientras que las especies que tuvieron una mayor distribución fueron B. subvelutipes que se recolectó en 14 estados, siguiéndole B. frostii que fue encontrado en 12, después B. pulverulentus que se localizó en 9 estados, B. dupainii en 8, y B. vermiculosus y B. fraternus en 7 entidades federativas. Por otro lado, en cuanto a los tipos de vegetación se puede observar claramente la preferencia de las especies de ambas secciones por los bosques de Quercus (incluido el chaparral de Quercus) con 15 para la secc. Luridi y 3 para la secc. Subpruinosi; además, 3 especies de la secc. Luridi y 1 de la secc. Subpruinosi se encontraron en el bosque de Quercus-Pinus y 1 de la secc. Subpruinosi en el bosque de Quercus-Juniperus y otra de la secc. Luridi en el ecotono del bosque de Quercus con el bosque mesófilo de montaña y finalmente, 3 de la secc. Luridi y 1 de la secc. Subpruinosi se encontraron en bosque de coniferas. Por otro lado, se reconocen sólo 4 especies comestibles de la secc. Luridi y 4 de la secc. Subpruinosi, entre ellas las especies descritas como nuevas en este trabajo y 6 especies tóxicas o posiblemente tóxicas, 1 es no comestible y de 7, se desconoce su comestibilidad.
Distribución de las especies de las secc. Luridi y Subpruinosi en los tipos de vegetación, entidades federativas y comestibilidad
| Especies | Vegetación | Estados | Comestibilidad |
|---|---|---|---|
| Secc. Luridi | |||
| B. frostii | BQ | CHIH., DGO., EDO. MEX., HGO., JAL., MICH., MOR., N.L., OAX., QRO., SON., TAM. | Comestible |
| B. floridanus | BQ | N.L., TAM. | Desconocida |
| B. michoacanus | BC | D.F., EDO. MEX., HGO., MICH., MOR. | Tóxico |
| B. eastwoodiae | BQ | B.C. | Tóxico |
| B. luridellus | BQ | COAH., N.L., QRO., TAM. | Desconocida |
| B. rhodosanguineus | BQP | GRO., HGO., MICH., PUE., QRO., TLAX. | Posiblemente tóxico |
| B. luridus | BQ, BC | EDO. MEX., HGO. | Comestible, con precaución |
| B. rubricitrinus | BQ | COAH., N.L., QRO., TAM. | Desconocida |
| B. guatemalensis | BQP | CHIS. | Comestible |
| B. subluridellus | Chaparral de Quercus | QRO. | Desconocida |
| B. dupainii | BQ, BQP | EDO. MEX., GTO., JAL., HGO., MICH., N.L., QRO., VER. | Desconocida |
| B. paulae | BQ y ecotono de BQ y BMM | N.L., TAM. | Comestible |
| B. fagicola | BQ | CHIH., MICH. | Desconocida |
| B. amygdalinus | BQ | B.C. | Tóxico |
| B. vermiculosus | BQ | EDO. MEX., HGO., JAL., MICH., QRO., SLP., TAM. | Desconocida |
| B. austrinus | BQ | N.L., TAM. | Tóxico |
| B. hypocarycinus | BQ | CHIH., MICH., N.L., TAM. | Tóxico |
| B. subvelutipes | BQ, BC, | D.F., DGO., EDO.MEX., GTO., HGO., JAL., MICH., MOR., N.L., PUE., QRO., TAM., TLAX., VER. | Tóxico |
| Secc. Subpruinosi | |||
| B. pulverulentus | BC | D.F., EDO. MEX., HGO., JAL., MICH., MOR., QRO, TLAX., VER. | Comestible |
| B. singeri | BQ | TAM. | Comestible |
| B. subfraternus | Chaparral de Quercus | QRO. | Desconocida |
| B.campestris | BQJ | N.L. | Comestible |
| B. fraternus | BQ, BQP | COAH., DGO., MICH., N.L., QRO., TAM., VER. | Comestible |
Con respecto a la clasificación del género Boletus en secciones o subgéneros ha sido muy variable según los autores y en el presente trabajo se tomo la que siguen Singer (1986) y Ortiz-Santana et al. (2007) por considerarlas las más apropiadas y por la gran experiencia de dichos autoras en el estudio de este grupo de hongos en diversas partes del mundo.
Muchos estudios regionales se están realizando para conocer mejor la micobiota mexicana y los hongos boletoides se incluyen generalmente; sin embargo, son necesarios trabajos detallados sobre este grupo particular de hongos en donde se realicen descripciones morfológicas para tener un mejor conocimiento de las especies y de la diversidad de este grupo en el país. García (1999) ha realizado estudios por diferentes regiones del país y en particular en el noreste de México y ha encontrado 17 especies de la secc. Luridi y 4 de la secc. Subpruinosi, además de un buen número de especímenes que no concuerdan con las especies descritas de estos grupos de hongos y aquí se describen 2 de estas especies, lo que da una idea de lo mucho que falta por conocer. Es importante mencionar que en este tipo de estudios a corto o mediano plazo, se pudieran integrar análisis morfológicos y moleculares y de esta manera reconocer la amplia diversidad de los hongos en México.
El primer autor agradece al CONACYT el apoyo para la realización de los estudios de doctorado en la Facultad de Ciencias Forestales de la UANL. A la red Internacional sobre Sistemática y Ecología en Comunidades Forestales y Cultivos, de SEP, ANUIES, DGEST- ITCV, UAT. A las autoridades de The Field Museum of Chicago, por su apoyo en los estudios sobre boletáceos de México en 1988 y 1989. Valenzuela agradece a la COFAA y al IPN el apoyo financiero otorgado mediante el proyecto SIP-20130034. A la Dra. Tania Raymundo la elaboración de la versión final de las láminas y figuras del presente trabajo.