El género Hydnotrya comprende alrededor de 13 especies de Ascomicetos hipogeos, secuestrados ectomicorrízicos distribuidos exclusivamente en bosques templados del hemisferio norte. En este trabajo se describe e ilustra por primera vez una especie de este género, Hydnotrya cerebriformis, para México. Esta especie se distribuye en el Eje Neovolcánico Transmexicano (Estado de México, Puebla y Tlaxcala) y Nuevo León a altitudes entre los 3,100 y 4,000m, donde se asocia a bosques de Pinus hartwegii, P.montezumae y Abiesreligiosa, principalmente.
The genus Hydnotrya is composed of around 13 ectomycorrhizal, hypogeous, sequestrated Ascomycetes distributed exclusively in temperate forests in the northern hemisphere. This work describes and illustrates for the first time a species of this genus, Hydnotrya cerebriformis, from Mexico. The species is distributed in the Transmexican Volcanic Belt (in the Estado de México, Puebla, and Tlaxcala) and the state of Nuevo León at altitudes between 3,100 and 4,000m, and associated mainly with Pinus hartwegii, P.montezumae, and Abies religiosa forests.
El género Hydnotrya (Berk. y Broome) pertenece a la familia Discinaceae (Ascomycetes), donde también se encuentran los géneros Discina (Fr.) Fr., Gymnohydnotrya B.C. Zhang y Minter y Gyromitra Fr. Trappe et al. (2009) mencionan que el género Hydnotrya se distingue por las siguientes características: ascocarpos irregulares, peridio liso o ligeramente escamoso, gleba hueca, con cámaras laberínticas y esporas elipsoides o globosas. La ornamentación de las esporas varía de espinas a verrugas, dando la apariencia de una epispora amorfa. La delimitación de especies en Hydnotrya ha dado lugar a reordenamientos sistemáticos en el pasado (Montecchi y Sarasini, 2000; Moser, 1963; Soehner, 1959). Por ejemplo, la especie tipo de Hydnotrya tulasnei (Berk.) Berk. y Broome, fue sinonimizada con Hydnotrya carnea (Corda) Zobel e Hydnotrya intermedia Buchholtz. El género Hydnotrya se distribuye exclusivamente en el hemisferio norte (Europa, Norteamérica y Asia). El repositorio Index Fungorum (2016) reporta 14 especies dentro del género Hydnotrya; sin embargo, Trappe (1975) menciona que tanto H.dysodes Kirschst. como H.yukoensis Gilkey son sinónimos de H.michaelis (E. Fisch.) Trappe, reduciendo el número de especies válidas a 12. Hydnotrya cerebriformis Herkn. e Hydnotrya michaelis están restringidas a bosques de coníferas; Stielow et al. (2010) mencionan que esto puede deberse a que las especies de Hydnotrya mantienen una asociación ectomicorrízica específica con coníferas.
Materiales y métodosLa recolecta de ejemplares, así como el estudio macro y microscópico de los materiales, se realizaron de acuerdo con las recomendaciones de Castellano, Trappe, Maser y Maser (1989). Los colores del material en fresco fueron descritos en términos generales por los recolectores, los cortes se realizaron manualmente utilizando una navaja y se montaron en hidróxido de potasio (KOH) al 5% y agua para su observación al microscopio óptico. La medición de las esporas tomó en cuenta tanto el diámetro de la espora así como la altura de la ornamentación (20 esporas elegidas al azar). Además, se revisaron y compararon ejemplares de herbario depositados en la colección micológica de la Oregon State University (OSC).
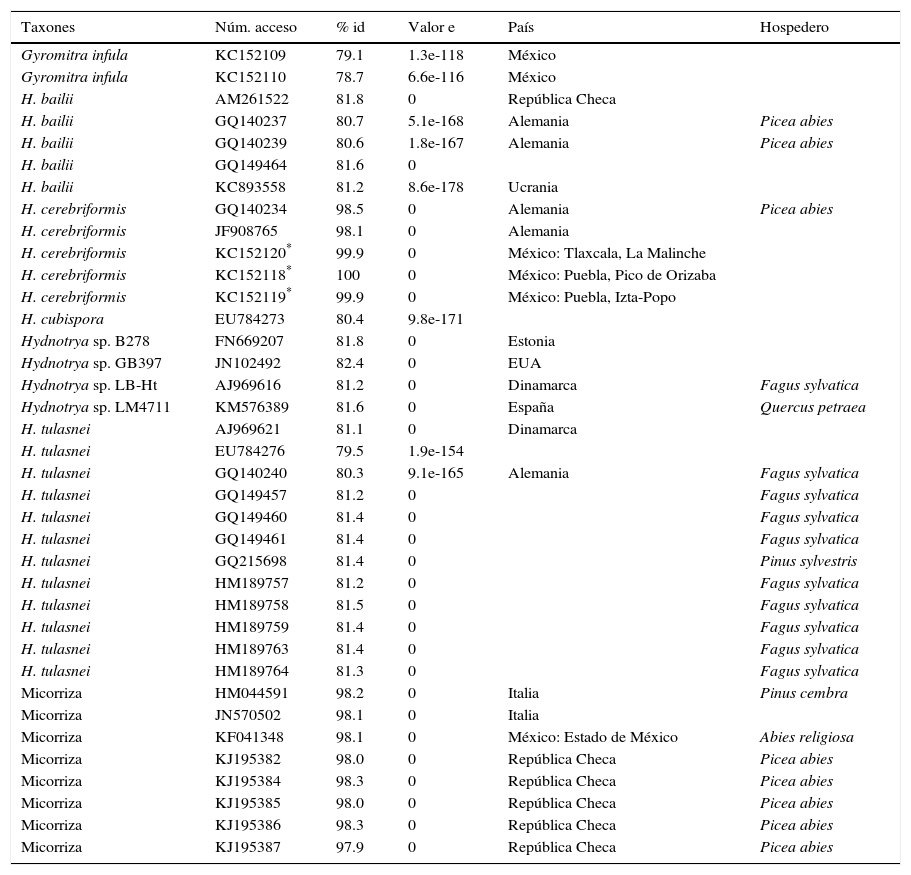
Se enviaron muestras de tejido al Centro Canadiense para el Código de Barras del ADN (CCDB) para la extracción, amplificación, secuenciación y obtención de los códigos de barras de la región de los espaciadores internos transcritos (ITS). Tanto para la amplificación del ADN como para su secuenciación se usaron los iniciadores universales ITS1 e ITS4 (White, Bruns, Lee y Taylor, 1990). Las secuencias de ADN se depositaron en GenBank con los números de registro KC152118, KC152119 y KC152120. Estas fueron editadas, alineadas y analizadas filogenéticamente en Geneious 7.1 (Biomatters, Nueva Zelanda). Para realizar el análisis filogenético se descargaron de GenBank las secuencias de Hydnotrya de los trabajos de Dzhagan, Alvarado y Shcherbakova (2015) y Stielow et al. (2010), así como las secuencias con una similitud nucleotídica igual o mayor al 80% (tabla 1). Las secuencias se alinearon con el algoritmo de Muscle y se analizaron por máxima verosimilitud y probabilidades bayesianas posteriores. Como grupo externo se eligió a Gyromitra infula (Schaeff.) Quél. (Stielow et al., 2010). En el análisis de máxima verosimilitud se usó PhyML (Guindon et al., 2010) con el modelo de substitución GTR, analizando la topología con BEST y optimizando la topología, el largo y el radio de las ramas; para probar el soporte de las ramas usamos bootstrap (MvB) con 1,000 réplicas. En el análisis bayesiano se usó MrBayes (Huelsenbeck y Ronquist, 2001) con el radio de variación gamma, GTR como modelo de sustitución con 4 cadenas de Monte Carlo sobre 1,000,000 de generaciones submuestreando cada 400 generaciones con un valor de temperatura de 0.2; se descartaron los primeros 100,000 árboles y se calcularon las probabilidades posteriores (Bpp).
Secuencias usadas en el análisis filogenético de Hydnotrya cerebriformis.
| Taxones | Núm. acceso | % id | Valor e | País | Hospedero |
|---|---|---|---|---|---|
| Gyromitra infula | KC152109 | 79.1 | 1.3e-118 | México | |
| Gyromitra infula | KC152110 | 78.7 | 6.6e-116 | México | |
| H. bailii | AM261522 | 81.8 | 0 | República Checa | |
| H. bailii | GQ140237 | 80.7 | 5.1e-168 | Alemania | Picea abies |
| H. bailii | GQ140239 | 80.6 | 1.8e-167 | Alemania | Picea abies |
| H. bailii | GQ149464 | 81.6 | 0 | ||
| H. bailii | KC893558 | 81.2 | 8.6e-178 | Ucrania | |
| H. cerebriformis | GQ140234 | 98.5 | 0 | Alemania | Picea abies |
| H. cerebriformis | JF908765 | 98.1 | 0 | Alemania | |
| H. cerebriformis | KC152120* | 99.9 | 0 | México: Tlaxcala, La Malinche | |
| H. cerebriformis | KC152118* | 100 | 0 | México: Puebla, Pico de Orizaba | |
| H. cerebriformis | KC152119* | 99.9 | 0 | México: Puebla, Izta-Popo | |
| H. cubispora | EU784273 | 80.4 | 9.8e-171 | ||
| Hydnotrya sp. B278 | FN669207 | 81.8 | 0 | Estonia | |
| Hydnotrya sp. GB397 | JN102492 | 82.4 | 0 | EUA | |
| Hydnotrya sp. LB-Ht | AJ969616 | 81.2 | 0 | Dinamarca | Fagus sylvatica |
| Hydnotrya sp. LM4711 | KM576389 | 81.6 | 0 | España | Quercus petraea |
| H. tulasnei | AJ969621 | 81.1 | 0 | Dinamarca | |
| H. tulasnei | EU784276 | 79.5 | 1.9e-154 | ||
| H. tulasnei | GQ140240 | 80.3 | 9.1e-165 | Alemania | Fagus sylvatica |
| H. tulasnei | GQ149457 | 81.2 | 0 | Fagus sylvatica | |
| H. tulasnei | GQ149460 | 81.4 | 0 | Fagus sylvatica | |
| H. tulasnei | GQ149461 | 81.4 | 0 | Fagus sylvatica | |
| H. tulasnei | GQ215698 | 81.4 | 0 | Pinus sylvestris | |
| H. tulasnei | HM189757 | 81.2 | 0 | Fagus sylvatica | |
| H. tulasnei | HM189758 | 81.5 | 0 | Fagus sylvatica | |
| H. tulasnei | HM189759 | 81.4 | 0 | Fagus sylvatica | |
| H. tulasnei | HM189763 | 81.4 | 0 | Fagus sylvatica | |
| H. tulasnei | HM189764 | 81.3 | 0 | Fagus sylvatica | |
| Micorriza | HM044591 | 98.2 | 0 | Italia | Pinus cembra |
| Micorriza | JN570502 | 98.1 | 0 | Italia | |
| Micorriza | KF041348 | 98.1 | 0 | México: Estado de México | Abies religiosa |
| Micorriza | KJ195382 | 98.0 | 0 | República Checa | Picea abies |
| Micorriza | KJ195384 | 98.3 | 0 | República Checa | Picea abies |
| Micorriza | KJ195385 | 98.0 | 0 | República Checa | Picea abies |
| Micorriza | KJ195386 | 98.3 | 0 | República Checa | Picea abies |
| Micorriza | KJ195387 | 97.9 | 0 | República Checa | Picea abies |
Núm. acceso: en GenBank; valor e: probabilidad de error en el alineamiento de las secuencias; %id: porcentaje de similitud nucleotídicas.
Los códigos de barras (NTECM043, NTECM175 y NTECM195) forman parte del proyecto «Neotropical Truffles», disponible a través de BOLD Systems (http://www.boldsystems.org). El material estudiado se encuentra depositado en los herbarios micológicos José Castillo Tovar del Instituto Tecnológico de Ciudad Victoria (ITCV), Herbario Nacional de México (MEXU) y la colección micológica del herbario de la Oregon State University (OSC).
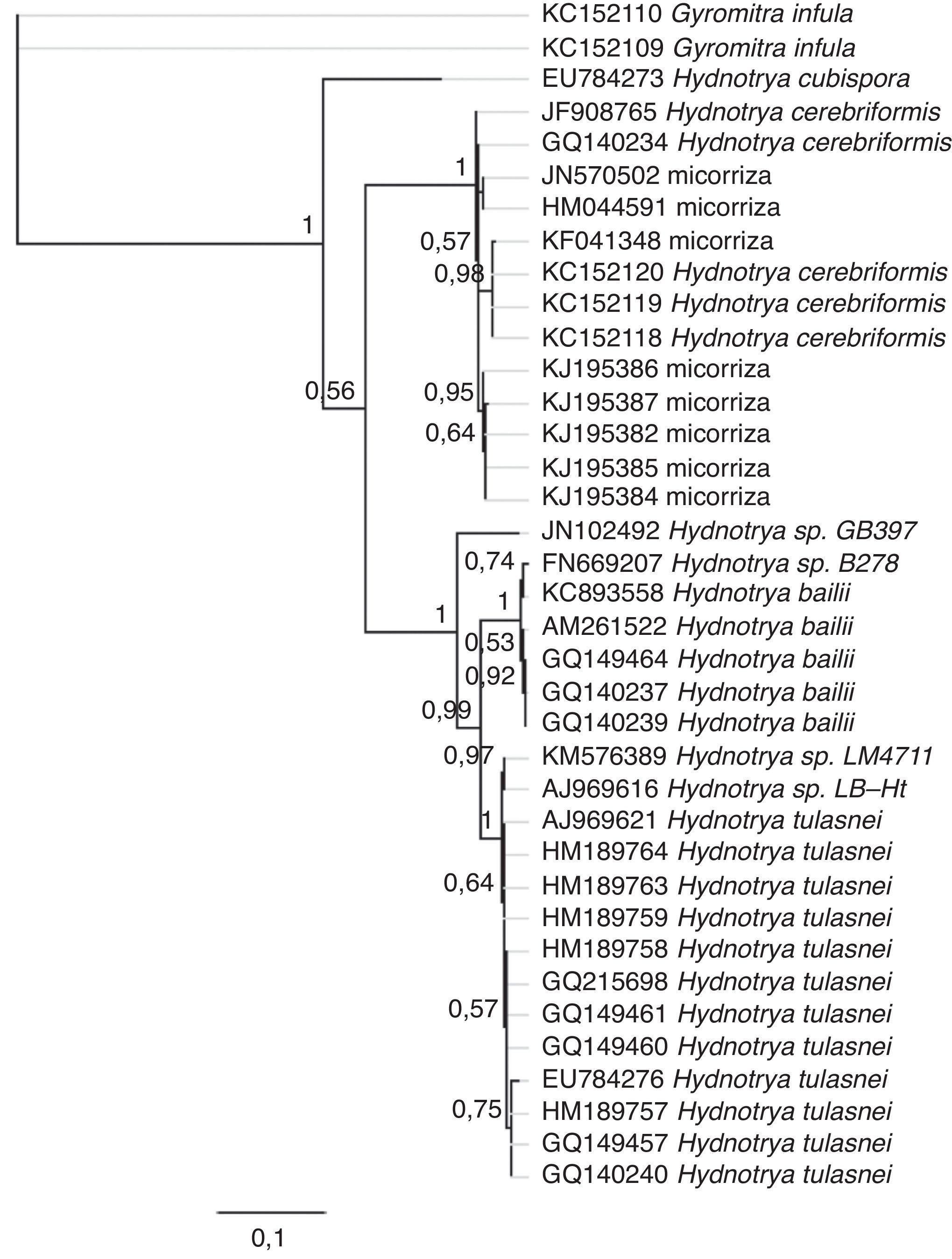
ResultadosLos análisis moleculares coincidieron con los datos morfológicos al situar las recolectas dentro del clado de H.cerebriformis. Tanto el análisis bayesiano (fig. 1) como el análisis de máxima verosimilitud (no incluido) colocaron las secuencias de los ejemplares mexicanos en un clado con alto nivel de soporte (Bpp=0.98, MvB=95) dentro un clado bien soportado (Bpp=1, MvB=66) que contiene todas las secuencias de H.cerebriformis tanto de material herborizado como de micorrizas.
Análisis filogenético de Hydnotrya cerebriformis realizado por medio de inferencia bayesiana con el modelo de sustitución de nucleótidos GTR. La barra representa el número de sustituciones por base. En cada nodo se muestran sus probabilidades posteriores después de 1,000,000 de generaciones de árboles. Las etiquetas de las ramas indican el número de acceso de la secuencia en GenBank y su identidad taxonómica.
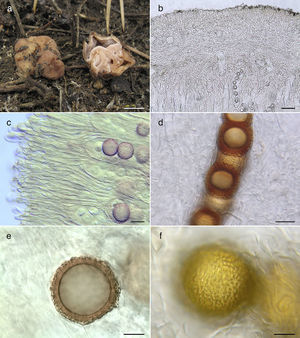
Hydnotrya cerebriformis (Tul. & C. Tul.) Harkn., Proc. Calif. Acad. Sci., Ser. 3, Bot. 1: 266 (1899) (fig. 2a-f).
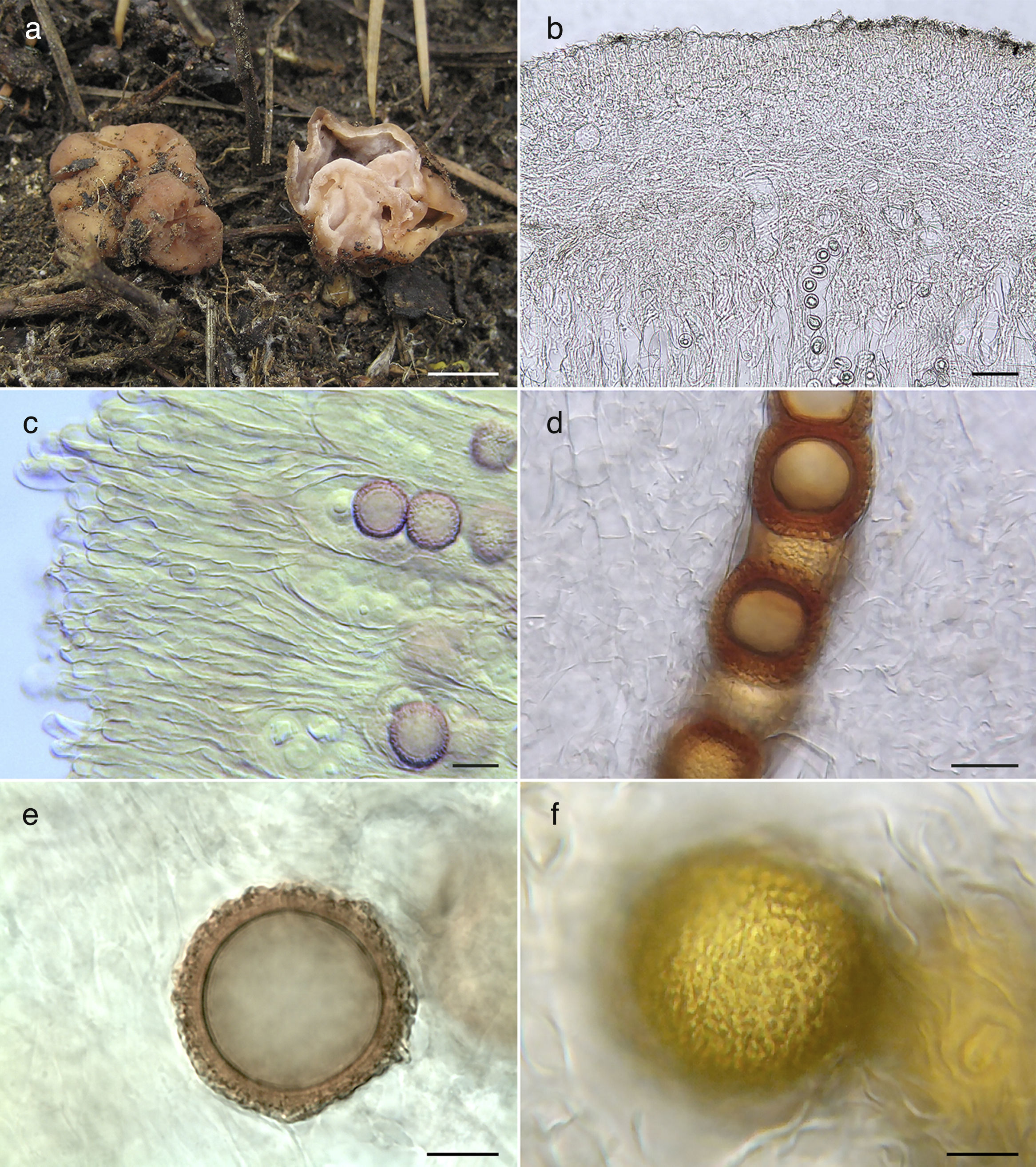
Características macro y microscópicas de Hydnotrya cerebriformis. a)ascomas MEXU (26498); b)sección transversal del peridio (MEXU 26498); c)paráfisis (MEXU 26498); d)esporas en ascas, con microscopía Nomarski (OSC 150003); e)espora mostrando la ornamentación, corte transversal (MEXU 26498); f)superficie de la espora, con microscopía Nomarski (MEXU 26498). Barras de escala: a=5mm, b=50μm, c=22μm, d=15μm, e y f=10μm.
Ascomas irregulares, lobulados, 10-35×10-20mm, cerebriforme, con cavidades que se comunican hacia la gleba. Peridio finamente pruinuoso-granuloso, de color café rojizo. Gleba con cámaras laberínticas compuestas por la invaginación y fusión de las paredes del ascocarpo, rosa claro en fresco (fig. 2a). Peridio 250-390μm de grosor, epicutis 50-90μm de grosor, compuesto por células capitadas, 40-60×14-28μm, hialinas, paredes <1μm de ancho, volviéndose más pequeñas cerca del subcutis, globosas, 15-20μm, hialinas, paredes <1μm de ancho (fig. 2b). Subcutis 200-300μm de grosor, compuesto por hifas hialinas, gelatinizadas, anastomosadas, compactas a laxas, 3-5μm en diámetro, paredes <1μm de ancho. Estructura himenial formada por ascas y paráfisis en un arreglo empalisado; paráfisis cilíndricas, 270-295×6-9μm, con el ápice redondeado y ensanchándose de 9-18μm de diámetro, hialinas, proyectándose por encima de las ascas hasta 120μm, formando un epitecio a lo largo del himenio en grupos, paredes <1μm de ancho (fig. 2c); ascas cilíndricas, 175-200×25-35μm, hialinas, paredes <1μm de ancho, octosporadas, uniseriadas (fig. 2d). Ascosporas globosas de 20-25μm de diámetro (x¿=22.85μm), excluyendo la ornamentación, de color café en KOH (fig. 2e) a café ámbar en esporas maduras (fig. 2f); paredes ±1μm de ancho. Ornamentación finamente verrugosa, verrugas de hasta 4μm de longitud.
Resumen taxonómicoEstado de México: La puerta, camino Toluca-Temascaltepec, Parque Nacional Nevado de Toluca, 19°11′23.92″N, 99°49′11.96″O, 3,100msnm, en bosques de Abies religiosa Lindl., hipogeo, gregario, 19 de septiembre de 2009, col. G. Guevara (GG1080, GG1082). Nuevo León: Cerro del Potosí, Galeana, en bosque mixto de Pinus hartwegii Lindl., Pinus ayacahuite Ehrenb. ex Schltdl., Abies vejarii Martínez, Pseudotsuga menziesii var. glauca (Beissn.) Franco, Populus tremuloides Michx., hipogeo, gregario, 6 de septiembre de 1985, col. J.G. Marmolejo (OSC 150001, 150002). Puebla: Parque Nacional Izta-Popo Zoquiapan, San Nicolás de los Ranchos, 19.11°N, 98.59°O, 3,364msnm, en bosque de Pinus montezumae Lamb., hipogeo, 5 de septiembre de 2009, col. R. Garibay-Orijel GO-2009-242 (MEXU 26188), número de acceso de GenBank KC152119, número de acceso de Bold Systems NTECM043. Parque Nacional volcán Pico de Orizaba, Chalchicomula de Sesma, 19.00°N, 97.32°O, 3,282msnm, en bosque de P.hartwegii y zacatonal, hipogeo, solitario, 18 de octubre de 2009, col. R. Garibay-Orijel GO-2009-455 (MEXU 26498), número de acceso de GenBank KC152118, número de acceso de Bold Systems NTECM175; Estación forestal, Zoquiapan, 7 de octubre 1985, col. J. Trappe (OSC 150000). Tlaxcala: Cañada central, Parque Nacional Volcán La Malinche, Huamantla, 19°29’08.40”N, 98°00’21.60”O, 3,200msnm, en bosque de A.religiosa, Pinus pseudostrobus Lindl. y Salix paradoxa Kunth y C.K.Schneid., hipogeo, gregario, septiembre 2007, col. M.E. Smith (OSC 150003, 150004). Parque Nacional Volcán La Malinche, Huamantla, 19.24°N, 98.03°O, 3,997msnm, en bosque de P.hartwegii y zacatonal, hipogeo, gregario, 29 de agosto de 2010, col. Roberto Garibay Orijel GO-2010-097 (MEXU 26518), número de acceso de GenBank KC152120, número de acceso de Bold Systems NTECM195.
Comentarios taxonómicosHarkness (1899) describió por primera vez H.cerebriformis de la siguiente manera: «Large, 3cm. in diam., color salmon, subrotund, smooth, brain-like markings upon the surface; gleba white or faintly citron, canals gyrose; hymenium covered with clavate villi between and extending beyond the asci; asci cylindrical, briefly stipitate; spores globose, brown, foveolate, 25μ in diam.». Los ejemplares estudiados concuerdan con la descripción anterior; sin embargo, las dimensiones de las esporas son acordes a las de Gilkey (1939), quien revisó el material tipo de esta especie. Gilkey (1939) probablemente incluyó la ornamentación en la medida de las esporas (25-32μm).
Esta especie se caracteriza por tener esporas globosas con una corona de verrugas distintiva, 3-4μm de altura, embebidas en una matriz amorfa, de color café en KOH y en agua, de aproximadamente 25μm de diámetro. Hydnotrya cerebriformis se distingue de H.tulasnei por la ornamentación de la espora, ya que la segunda posee una episporio amorfo que al madurar forma verrugas. Cabe mencionar que Hydnotryasp. ha sido citada para Tlaxcala, México, por Uribe-Arróyave (1998) en una tesis de licenciatura; sin embargo, ninguna especie del género ha sido descrita oficialmente en alguna revista científica. Primer registro del género para México.
DiscusiónHydnotrya cerebriformis ha sido citada de Norteamérica, Europa y Asia asociada a bosques de coníferas (Stielow et al., 2010) y vegetación riparia. Las secuencias de ADN de esta especie provienen principalmente de Alemania, República Checa e Italia, en donde forma micorrizas con Picea abies (L.) H.Karst. y Pinus cembra L. (tabla 1). En México ha sido recolectada principalmente en el Eje Neovolcánico Trasnmexicano y en el estado de Nuevo León en altitudes que van desde los 3,100 a los 4,000msnm. En estas zonas se asocia a bosques de coníferas, principalmente de A.religiosa, Pinus montezumae y P.hartwegii, hasta el límite de la vegetación en la montañas más altas del centro de México. Dentro del clado de los ejemplares mexicanos también se encuentra una secuencia ambiental (KF041348) (fig. 1) que presenta una similitud nucleotídica del 99.23% con los ejemplares de herbario y proviene de una micorriza de A.religiosa de bosques del Estado de México (Argüelles-Moyao et al., en prensa). Lo que indica que H.cerebriformis es recolectada frecuentemente en este tipo de bosques, ya que se halla asociada a las raíces de A.religiosa.
Si bien este trabajo contribuye al conocimiento sobre la taxonomía, distribución y biología de H.cerebriformis, consideramos que es necesario seguir realizando trabajos sobre este género, ya que es un taxón relativamente pequeño pero de importancia ecológica y gran relevancia al encontrarse asociada con árboles de alta montaña cuyo hábitat está amenazado por el calentamiento global. Adicionalmente, ya que solo algunas de sus especies presentan escasa variación morfológica, sería importante ampliar los análisis filogenéticos, donde se incluyan todas las especies del género, mayor número de marcadores moleculares y una amplia representación geográfica.
Agradecemos a la maestra Celia Elvira Aguirre Acosta, Eduardo Hernández-Navarro y Nohelia Guadalupe Pacheco Hoyos por su apoyo técnico. Gracias a Edith Hernández, Lucía Yelania Velasco, Mario Domínguez Gutiérrez, Mariana García Guzmán, Rodolfo Ángeles Argaiz por su apoyo en el trabajo de campo. La recolecta de los ejemplares fue financiada por el proyecto UCMEXUS-Conacyt 491. La secuenciación de los códigos de barras fue financiada por la red MEXBOL proyecto Conacyt 194045. Se agradece a los revisores por los comentarios y sugerencias.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.