Las comunidades de hongos ectomicorrízicos presentes en las zonas montañosas de México han sido poco estudiadas. En este trabajo se caracterizaron morfológica y genéticamente las ectomicorrizas asociadas a un bosque de Pinus hartwegii en el Parque Nacional Cofre de Perote. El estudio se realizó en 3 sitios de muestreo, se trazaron 4 transectos de 500m en cada sitio y se recolectaron 3 muestras de suelo cada 100m. Se extrajo el ADN de las ectomicorrizas, se amplificó y secuenció la región de los ITS. La identidad taxonómica de los hongos se obtuvo por su similitud nucleotídica contra las secuencias depositadas en GenBank. Se describen 14 morfotipos, entre los que se encuentran: Piloderma olivaceum, Cortinarius diasemospermus, C. mucosus, Hydnellum concrescens, Russula aff. betularum, Sebacina vermifera y Sistotrema confluens y los géneros Byssocorticium y Pseudotomentella. Estos hongos ectomicorrízicos tienen un alto potencial en planes de reforestación pues pueden favorecer la sobrevivencia de plántulas, ya que están adaptados a las condiciones ambientales locales.
Highland ecosystems ectomycorrhizal fungal communities have been scarcely studied in Mexico. In this work, we characterized morphologically and genetically the ectomycorrhizae associated to a Pinus hartwegii forest in the Cofre de Perote National Park, Veracruz. The study took place in 3 sampling sites; at each site, we established 4 transects of 500m. Every 100m we collected 3 soil samples. Fungal DNA was extracted from the ectomycorrhizae, and the ITS region amplified and sequenced. The taxonomic identity of the fungi was obtained by the nucleotide similarity to the sequences deposited in GenBank. We described 14 morphotypes, among these are: Piloderma olivaceum, Cortinarius diasemospermus, C. mucosus, Hydnellum concrescens, Russula aff. betularum, Sebacina vermifera, Sistotrema confluens and the genera Byssocorticium, and Pseudotomentella. These ectomycorrhizal fungi have high potential in reforestation plans, with possible benefits on seedling survival due to the fact that they are ecologically adapted to the local environmental conditions.
La simbiosis micorrízica es una asociación que se establece entre hongos y especies de plantas vasculares (Comandini, Rinaldi y Kuyper, 2012; Pérez-Moreno y Read, 2000; Rinaldi, Comandini y Kuyper, 2008). Los hongos ectomicorrízicos (HECM) absorben, movilizan y traslocan nutrientes como el fósforo, el nitrógeno, el agua y los micronutrientes del suelo hacia las plantas y de manera inversa las plantas aportan monosacáridos a los hongos (Agerer et al., 2012). Tradicionalmente la identificación de los HECM se realiza tomando en cuenta la morfología del esporoma o del morfotipo de la ectomicorriza o mediante el aislamiento de cepas. Sin embargo, en la mayoría de los HECM existe poca variación morfológica en sus micorrizas por lo que se hace necesario el uso de métodos combinados de morfología de las ectomicorrizas y secuencias de ADN, particularmente de la región de los interespaciadores ribosomales (ITS) (Peay, Kennedy y Bruns, 2008).
En México existen pocos trabajos en los que se describen morfotipos de ectomicorrizas asociadas a especies de Pinus. Uno de ellos es el de Carrera-Nieva y López-Ríos (2004) que describieron los morfotipos de Boletus clavipes, Laccaria laccata en Pinus patula y Suillus pseudobrevipes en P. greggii; asimismo, García-Rodríguez, Pérez-Moreno, Aldrete, Cetina-Alcalá y Vaquera-Huerta (2006) caracterizaron el morfotipo de Pisolithus tinctorius con Eucalyptus urophylla y P. greggii. Por otro lado, Valdés, Ambriz, Camacho y Fierros (2010) estudiaron P. tinctorius y Scleroderma texense en P. devoniana y P. pseudostrobus; Carrasco-Hernández (2010) describió los morfotipos de 3 especies de Laccaria y 3 de Hebeloma en P. pseudostrobus; a su vez, Carrasco-Hernández et al. (2010) y Jiménez-Ruiz (2011) describieron las micorrizas de L. laccata y L. proxima con P. patula y P. pseudostrobus. Galindo-Flores, Castillo-Guevara, Campos-López y Lara (2015) describieron las ectomicorrizas formadas entre Laccaria trichodermophora y Suillus tomentosus en P. montezumae. Los trabajos que han evaluado y descrito ectomicorrizas de muestras ambientales formadas por especies de pino de alta montaña son los siguientes: Perea-Estrada (2009) enlistó 52 morfotipos en bosques de Pinus hartwegii en el Parque Recreativo y Cultural del Desierto de los Leones y el Parque Nacional Zoquiapan, en los que identificaron a Cadophora finlandica y Cenoccocum geophillum, la especie más representativa. Reverchon, Ortega-Larrocea, Bonilla-Gosso y Pérez-Moreno (2012) describieron 52 morfotipos de HECM asociados a P. montezumae en la Sierra del Chichinautzin, identificando 46 unidades taxonómicas operacionales (OTU), siendo la familia Atheliaceae la más dominante en esa comunidad ectomicorrízica. Por último, Garibay-Orijel, Morales-Marañón, Domínguez-Gutiérrez y Flores-García (2013) caracterizaron morfológica y genéticamente 27 morfotipos de ectomicorrizas asociados a bosques de P. montezumae a lo largo de la Faja Volcánica Transmexicana, identificando 15 taxones como nuevos registros.
Por otra parte, los estudios micológicos en el Parque Nacional Cofre de Perote (PNCP) iniciaron hace más de 30 años, a la fecha se han citado aproximadamente 80 especies ectomicorrízicas. La mayoría de los estudios de HECM realizados en la zona se basan en la identificación de los basidiomas (Córdova-Chávez, Medel, Mata, Castillo y Vázquez-Ramírez, 2014; Guzmán y Villarreal, 1984; Medel, Baeza y Mata, 2012; Montoya-Bello, Bandala y Guzmán, 1987; Villarreal y Guzmán, 1985, 1986, 1987; Welden y Guzmán, 1978).
El deterioro del PNCP es significativo principalmente por el cambio climático, el cambio de uso del suelo, la tala clandestina y el pastoreo (García-Romero, Montoya, Ibarra y Garza, 2010; Gutiérrez y Trejo, 2014; Vázquez-Ramírez, 2014). El cambio climático disminuirá la distribución o fomentará la desaparición de especies que naturalmente habitan en zonas montañosas, como es el caso de P. hartwegii (Gutiérrez y Trejo, 2014).
Pinus hartwegii es un pino de alta montaña, que se distribuye en los limites arbóreos de los volcanes más altos del Eje Volcánico Transversal (Gernandt y Pérez-de la Rosa, 2014). Su rango de distribución va de los 3,000 a los 4,000m de altitud (Perry, 1991) y su superficie potencial en México es de 3.61 millones de hectáreas (Gutiérrez y Trejo, 2014). Bajo diferentes escenarios de cambio climático proyectados en 2050 y 2090, el área de distribución de esta conífera podría reducirse de un 49% hasta un 80% (Gutiérrez y Trejo, 2014; Sáenz-Romero et al., 2009; Viveros-Viveros et al., 2010).
Con el fin de contribuir a la conservación de esta especie, este trabajo se planteó el objetivo de estudiar la diversidad de HECM asociados al bosque de P. hartwegii para su uso posterior en los programas de reforestación.
Materiales y métodosEl PNCP se encuentra en la parte más elevada del volcán Cofre de Perote, teniendo como límites la cota de los 3,000m snm y la cima, la cual alcanza una altitud aproximada de 4,282m. Los tipos de vegetación presentes son: pinares mixtos, bosque de Abies religiosa (Kunth) Schltdl. y Cham, bosque de P. hartwegii y páramo de altura (Narave, 1985). Los bosques de P. hartwegii se localizan aproximadamente entre los 3,600 y los 4,000m snm, y constituyen el límite altitudinal superior de la vegetación arbórea, ubicándose en los límites con el páramo de altura (19°46′48″N, 97°9′7.2″O; 4,019m snm).
Se establecieron 3 sitios de muestreo: sitio 1 con exposición norte (3,589m snm) y regeneración natural; sitio 2 con exposición oeste (4,019m snm) expuesto a fuertes vientos y con regeneración natural y sitio 3 con exposición este (3,641m snm), con regeneración natural y obras de conservación de suelo. Los sitios seleccionados son rodales puros de P. hartwegii para descartar la presencia de otros hospederos ectomicorrízicos. Las raíces micorrizadas se recolectaron en los 3 sitios, trazando al azar 4 transectos de 500m en cada sitio, donde se establecieron 5 puntos de muestreo separados por 100m en cada transecto. En cada punto de muestreo se obtuvieron 3 muestras de suelo separadas 50cm entre sí. La capa orgánica fue removida y se recolectaron los primeros 15cm de suelo con tubos de pvc de un diámetro de 2.5cm. Las muestras se etiquetaron y colocaron en bolsas ziploc y se mantuvieron frías hasta su procesamiento, de acuerdo con la metodología propuesta por Argüelles-Moyao, Garibay-Orijel, Márquez-Valdelamar y Arellano-Torres (2016), modificada para las condiciones del bosque de P. hartwegii. Para separar las raíces micorrizadas, las muestras de suelo se tamizaron en un tamiz de 1mm y otro de 2mm de abertura de malla, lavando el suelo con agua corriente. Las raíces se colocaron en recipientes con agua destilada fría. Las raíces fueron disectadas en un microscopio estereoscópico, discriminando las raíces con micorrizas vivas (turgentes, con manto) de las muertas o no micorrizadas. Cada morfotipo se fotografió con una cámara Samsung WB100 y se describió de manera macroscópica tomando en cuenta el tipo de ramificación, el largo del sistema micorrízico, la forma de las puntas no ramificadas, la textura y el color de la superficie del manto, el color, los rizomorfos e hifas emanentes, siguiendo la metodología estándar (Agerer, 1991). Una vez caracterizadas, las micorrizas se colocaron en CTAB al 2% para preservar su ADN.
La extracción del ADN se realizó utilizando el kit XNAP (Sigma-Aldrich), usando 15μL de la solución de extracción con una muestra de micorriza de un tamaño aproximado de 1mm3, se incubó a 65°C por 10min y 95°C por 10min; posteriormente se añadieron 30μL de la solución de dilución y se dejó incubar 30min a temperatura ambiente antes de ser almacenado a 4°C (Garibay-Orijel et al., 2013). Para la amplificación por PCR se utilizó el kit Ruby Taq PCR Master Mix (Affymetrix, Inc.) siguiendo las instrucciones del fabricante. Los ciclos de la PCR fueron 1min inicial de desnaturalización a 94°C, seguido de 34 ciclos que constaron de 1min a 94°C de desnaturalización, 1min a 51°C de alineamiento de los iniciadores y 1min de extensión a 72°C, seguido de una extensión final de 8min a 72°C; los productos se almacenaron a 4°C (Izzo, Agbowo y Bruns, 2005). Se amplificó la región de los ITS, debido a que es la región aceptada como código de barras genético para los hongos (Schoch et al., 2012). Se utilizaron los iniciadores ITS1F e ITS4 pues son específicos para hongos y discriminan el ADN de la planta (Gardes y Bruns, 1993). Los productos de PCR se limpiaron con ExoSAP-IT (USB Corporation) y se sometieron a la reacción de secuenciación con Big Dye Terminator Kit (Applied Biosystems) bajo las condiciones recomendadas por los fabricantes. Cada producto de PCR se secuenció en ambos sentidos con los iniciadores de PCR en el Laboratorio de Biología Molecular de la Biodiversidad y la Salud del Instituto de Biología, UNAM. Las secuencias se editaron y alinearon en Geneious 7.0. Las OTU se constituyeron al 97% de similitud nucleotídica ya que de acuerdo con Peay et al. (2008) el 3% de las variación intraespecífica es el estándar en estudios de ecología molecular de ectomicorrizas. Para conocer la identidad de cada OTU, las secuencias consenso se compararon mediante BLAST con la base de datos en GenBank (NCBI) aceptando como conespecíficas solo aquellas cuya similitud nucleotídica fue igual o mayor que el 97%. Las secuencias representativas de cada OTU se registraron en GenBank (números de acceso KU871230-KU871244).
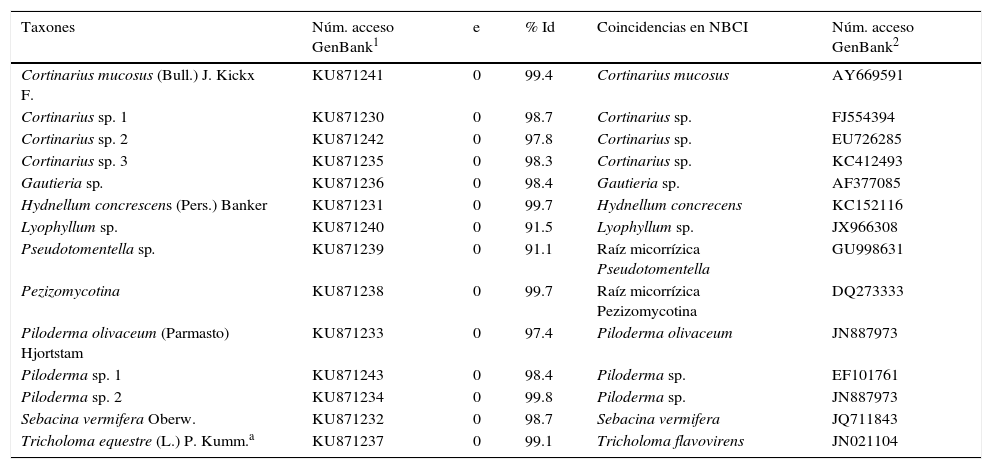
ResultadosSe identificaron 14 morfotipos de ectomicorrizas asociados al bosque de P. hartwegii en los sitios de estudio, de las cuales 13 son Basidiomicetos y una es Ascomiceto (tabla 1). Los géneros mejor representados fueron Cortinarius con 4 especies y Piloderma con 3 especies. A continuación se presenta la caracterización morfológica y genética de los 14 morfotipos más comunes asociados a bosques de P. hartwegii.
Identificación de las raíces micorrizadas por afinidad filogenética en GenBank.
| Taxones | Núm. acceso GenBank1 | e | % Id | Coincidencias en NBCI | Núm. acceso GenBank2 |
|---|---|---|---|---|---|
| Cortinarius mucosus (Bull.) J. Kickx F. | KU871241 | 0 | 99.4 | Cortinarius mucosus | AY669591 |
| Cortinarius sp. 1 | KU871230 | 0 | 98.7 | Cortinarius sp. | FJ554394 |
| Cortinarius sp. 2 | KU871242 | 0 | 97.8 | Cortinarius sp. | EU726285 |
| Cortinarius sp. 3 | KU871235 | 0 | 98.3 | Cortinarius sp. | KC412493 |
| Gautieria sp. | KU871236 | 0 | 98.4 | Gautieria sp. | AF377085 |
| Hydnellum concrescens (Pers.) Banker | KU871231 | 0 | 99.7 | Hydnellum concrecens | KC152116 |
| Lyophyllum sp. | KU871240 | 0 | 91.5 | Lyophyllum sp. | JX966308 |
| Pseudotomentella sp. | KU871239 | 0 | 91.1 | Raíz micorrízica Pseudotomentella | GU998631 |
| Pezizomycotina | KU871238 | 0 | 99.7 | Raíz micorrízica Pezizomycotina | DQ273333 |
| Piloderma olivaceum (Parmasto) Hjortstam | KU871233 | 0 | 97.4 | Piloderma olivaceum | JN887973 |
| Piloderma sp. 1 | KU871243 | 0 | 98.4 | Piloderma sp. | EF101761 |
| Piloderma sp. 2 | KU871234 | 0 | 99.8 | Piloderma sp. | JN887973 |
| Sebacina vermifera Oberw. | KU871232 | 0 | 98.7 | Sebacina vermifera | JQ711843 |
| Tricholoma equestre (L.) P. Kumm.a | KU871237 | 0 | 99.1 | Tricholoma flavovirens | JN021104 |
e: probabilidad de error en la identificación; Núm. acceso GenBank1: número de acceso de las secuencias producidas en este trabajo; Núm. acceso GenBank2: número de acceso de las secuencias similares en GenBank; % Id: porcentaje de similitud nucleotídica entre las secuencias.
Sistema micorrízico dicotómico con ramas rectas. Las puntas son cilíndricas de color café oscuro. El sistema es completamente de color café oscuro a negro, cubierto casi en su totalidad por un manto algodonoso y abundante, no se observan las células corticales. El manto es color blanco con hifas emanentes y cordones miceliales del mismo color. En algunas partes el manto se observa ligeramente amarillento. Su secuencia es similar en un 99.4% a C. mucosus AY669591.
Morfotipos de: A) Cortinarius mucosus, B) Cortinarius sp. 1, C) Cortinarius sp. 2, D) Cortinarius sp. 3, E) Gautieria sp., F) Hydnellum concrescens, G) Lyophyllum sp., H) Pezizomycotina, I) Piloderma olivaceum, J) Piloderma sp. 1, K) Piloderma sp. 2, L) Pseudotomentella sp., M) Sebacina vermifera, N) Tricholoma equestre.
Micorriza monopodial, no ramificada. Las puntas son blanquecinas, ligeramente infladas. El sistema completo es color café amarillo y cubierto casi en su totalidad por un manto muy grueso de apariencia algodonosa, color blanquecino a plateado. Presenta abundantes hifas emanentes largas y blanquecinas, así como cordones miceliales. Con agregados de suelo. Tiene una similitud del 98.7% con la secuencia de un clon no cultivado de Cortinarius sp. (FJ554394) de suelo en bosques perturbados de P. contorta en Canadá (Hartmann, Lee, Hallam y Mohn, 2009). No existen ejemplares voucher con secuencias similares en GenBank.
Cortinarius sp. 2 (fig. 1C)Sistema micorrízico dicotómico. Las terminaciones no ramificadas son rectas y las puntas ligeramente infladas de color café rojizo. El manto es delgado y deja ver las células corticales. La superficie del manto es reticulada, de color blanquecino. Tiene pequeños gránulos de suelo. Sin rizomorfos.
Cortinarius sp. 3 (fig. 1D)Sistema micorrízico dicotómico. Las terminaciones no ramificadas son rectas a dobladas. Las puntas son infladas de color café oscuro, amarillento hasta blanquecinas. El sistema completo es color amarillento y se torna café oscuro. El manto es grueso y de apariencia algodonosa, blanquecino a traslúcido. Tiene abundantes hifas emanentes traslúcidas. Sin rizomorfos. Presenta agregados de suelo. La secuencia es similar en un 98.3% a Cortinarius sp. (KC4112493) asociada a las raíces de Pinus sylvestris L. en Escocia (Jarvis, Woodward, Alexander y Taylor, 2013). El género Cortinarius está dentro de los géneros de HECM más frecuentemente recolectados en bosques de coníferas en Norteamérica y Europa (Sawyer, Chambers y Cairney, 1999).
Gautieria sp. (fig. 1E)Ramificación dicotómica desigual. Las terminaciones no ramificadas tienen forma irregular, cortas, no siempre de la misma longitud, a veces dobladas y de color café que se torna más amarillento antes de la punta. Cuando la raíz es joven, las puntas son de color amarillento translúcido y el manto es muy laxo y blanquecino, las células de la epidermis siempre son visibles. Al madurar, se desarrolla el manto, cubriendo a la raíz y volviéndose de color café oscuro a marrón. Las puntas hinchadas disminuyen con la edad. No presenta hifas emanentes ni rizomorfos. Su secuencia es similar en un 98.4% a la secuencia AF377085 de Gautieria sp. asociada a Pleuricospora fimbriolata (Bidartondo y Bruns, 2002) de California. En Veracruz hay 2 registros de Gautieria mexicana por Trappe y Guzmán (1971) sin precisar localidad y por Córdova-Chávez et al. (2014) en bosque de Pinus-Abies en el Cofre de Perote.
Hydnellum concrescens (fig. 1F)Sistema micorrízico monopodial a dicotómico. Cuando la micorriza se va desarrollando se observa cómo las puntas se van inflando y se vuelven redondeadas. Se cubren por un manto delgado, blanquecino de apariencia algodonosa, escaso. Las terminaciones no ramificadas son rectas y color café-amarillento. El resto del sistema micorrízico es de color café oscuro, lo rodea un manto traslúcido y muy delgado. Presenta gránulos de suelo adheridos. La secuencia es similar en un 99.7% a KC152116 de H. concrescens reportada para el Nevado de Toluca (Garibay-Orijel et al., no publicado). En Tamaulipas se registra H. concrescens en bosque de Quercus germana y Q. sartorii. En el Cofre de Perote solo se ha reportado H. suaveolens en bosque de Pinus-Abies (Córdova-Chávez et al., 2014).
Lyophyllum sp. (fig. 1G)Sistema micorrízico dicotómico. Las ramas son rectas de color café amarillento. Las puntas están infladas de color amarillo claro. El manto es abundante de apariencia lanosa pero transparente. Tiene agregados de calcio y suelo que se observan sobre la raíz micorrizada. Este ejemplar es similar a Lyophyllum decastes asociado a Quercus robur descrito por Agerer (1991) por presentar puntas infladas y cilíndricas blanquecinas a amarillentas y un manto algodonoso. Difieren en la forma de las terminaciones no ramificadas que en L. decastes asociado a Q. robur son sinuosas a tortuosas y en este morfotipo se describen rectas. Su secuencia es similar a un ejemplar voucher de Lyophyllum sp. (JX966308) en un 91.5% y debido a que no hay otras secuencias voucher mayores a este porcentaje se identificó hasta género.
Pezizomycotina (fig. 1H)Sistema micorrízico dicotómico. Las ramas son rectas. Puntas cilíndricas, negras. La micorriza es color café oscuro a negro hacia las puntas. El manto es liso, con hifas emanentes delgadas de color blanquecino a amarillento. Sin rizomorfos. Presenta gránulos de suelo. Secuencia similar en un 99.7% a una muestra ambiental de Pezizomycotina (DQ27333) en raíces de Lithocarpus densiflorus en California, EUA (Bergemann y Garbelotto, 2006).
Piloderma olivaceum (fig. 1I)Sistema micorrízico simple a dicotómico. Las ramas son rectas a ligeramente dobladas. Las puntas son cilíndricas poco infladas. El sistema micorrízico es color marrón a café oscuro en su totalidad. El manto es algodonoso y grueso, de color blanco a amarillento. Las células de la epidermis no son muy evidentes. Las hifas emanentes son escasas, cortas y de color blanquecino. Sin rizomorfos. Piloderma olivaceum y las demás especies de Piloderma descritas en este trabajo tienen similitudes con los morfotipos de Piloderma croceum con Picea, Pseudotsuga, Fagus (Agerer y Rambold, 2016). Presentan una ramificación dicotómica, con terminaciones ligeramente dobladas, cilíndricas, color amarillento. Con manto amarillento y abundante. La secuencia es similar en un 99.6% a una secuencia ambiental de P. olivaceum (JQ71194) en raíces de P. contorta var. latifolia en Canadá.
Piloderma sp. 1 (fig. 1J)Sistema micorrízico dicotómico con ambas ramas de longitud similar, rectas color amarillo claro. Las puntas están ligeramente infladas, son translúcidas de color blancuzco a amarillento. Las células de la epidermis son visibles hacia la parte basal del sistema. El manto es grueso de textura algodonosa, amarillo. Presenta hifas emanentes de color amarillo. Tiene gránulos de suelo. Su secuencia es similar en un 98.2% a Piloderma sp. (JQ393095) asociada a raíces de Arbutus menziesii, Oregón, EUA (Kennedy, Smith, Horton y Molina, 2012).
Piloderma sp. 2 (fig. 1K)Micorriza monopodial a dicotómica, con un eje principal y ramas cortas y rectas. Las puntas son cilíndricas y ligeramente infladas, color marrón. La mayor parte del sistema es color café oscuro a marrón, volviéndose negro hacia la parte más basal. Presenta un manto algodonoso a fibroso que no permite ver las células de la epidermis. El manto es color blanquecino a amarillento. Tiene pocas hifas emanentes blanquecinas. Sin rizomorfos. Tiene una similitud del 99.8% con Piloderma sp. (N887973) asociada a P. montezumae en la Sierra del Chichinautzin, México (Reverchon et al., 2012). Han sido descritas especies de Piloderma en bosques boreales y generalmente se encuentran explotando los recursos de la capa orgánica y mineral del suelo (Read, Leake y Pérez-Moreno, 2004).
Pseudotomentella sp. (fig. 1L)Ramificación dicotómica con terminaciones no ramificadas en forma recta, ligeramente dobladas y de color café oscuro. Las puntas son cilíndricas y de color café oscuro a amarillo oscuro. El manto cubre casi en su totalidad el sistema micorrízico y no es posible observar fácilmente las células corticales. La superficie del manto es granulosa, de color blanquecino con ligeras tonalidades plateadas. Tiene hifas emanentes cortas café claro. Sin rizomorfos. El morfotipo es similar a P. humicola con Picea abies (Agerer, 1991) por presentar puntas amarillas y un color café oscuro en todo el sistema micorrízico con pequeños gránulos, salvo que las raíces micorrizadas encontradas se tornan poco desarrolladas y el manto es más grueso y abundante. No hay secuencias voucher con similitud mayor al 91.6% en GenBank. Varias especies de este género han sido registradas en P. abies (Marino, Kõljalg y Agerer, 2007), Pinus radiata (Walbert, Ramsfield, Ridgway y Jones 2010), Quercus crassifolia, Q. laurina y otras especies de Quercus en Huizteco, sierra de Taxco que pertenece a la Faja Volcánica Transmexicana (Morris, Pérez-Pérez, Smith y Bledsoe, 2009).
Sebacina vermifera (fig. 1M)Micorriza monopodial pinada a dicotómica, las ramas no tienen la misma longitud, de color amarillo claro a café oscuro. Las ramificaciones son rectas. Las puntas son cilíndricas ligeramente infladas de color blancuzco. El manto se observa hacia las puntas, es liso y deja ver las células de la epidermis. No tiene hifas emanantes ni rizomorfos. Tiene similitud en un 98.7% con S. vermifera (JQ711843) asociada a raíces de P. contorta var. latifolia en Canadá. Secuencias similares de muestras ambientales de Sebacinaceae se reportaron asociadas a P. montezumae en la Faja Volcánica Transmexicana (Garibay-Orijel et al., 2013).
Tricholoma equestre (fig. 1N)Las raíces se ramifican dicotómicamente en ramas que crecen con la misma longitud. Las terminaciones no ramificadas tienen forma recta y son de color café amarillento. El manto es denso y blanquecino y cubre casi en su totalidad a la raíz. Las puntas son cilíndricas, no infladas, que van de color café claro a amarillento. Las células de la epidermis se observan parcialmente a través del manto en las partes ramificadas. La superficie del manto es laxa, algodonosa con abundantes hifas emanentes delgadas, blancas, cuando más maduras aparecen algunas hifas color amarillo. Con rizomorfos blancos. Presenta abundantes partículas adheridas a la micorriza. Nuestra descripción es similar al morfotipo descrito de Tricholoma auratum con Pinus (Agerer y Rambold, 2016), presenta manto abundante, blanco y con gránulos; la descripción de estos autores señala que el morfotipo puede ser coraloide, sin embargo, todos los morfotipos estudiados fueron simples o dicotómicos. Su secuencia es un 99.1% similar a una secuencia voucher de Tricholoma flavovirens (JN021104) recolectada de bosques templados de Ontario, Quebec y Maryland, Canadá. Actualmente el nombre válido para este taxón es T. equestre Peck y con ese nombre fue registrada la secuencia del morfotipo que aquí se describe. Esta especie fue citada previamente del Cofre de Perote en zonas de P. hartwegii (Córdova-Chávez et al., 2014), lo que confirma la presencia de esta especie en la zona de estudio.
DiscusiónLos datos aquí presentados indican que al menos 13 especies de basidiomicetos y una de ascomiceto forman la comunidad de HECM asociados a bosques de P. hartwegii en los sitos de muestreo en el PNCP. Las secuencias que generaron identificaciones hasta especie fueron: Cortinarius diasemospermus, C. mucosus, Hydnellum concrescens, Piloderma olivaceum, Russula aff. betularum, Sebacina vermifera y Sistotrema confluens. Respecto a los géneros Byssocorticium y Pseudotomentella, no se tenía registro de ellos para la zona de estudio. La familia Atheliaceae fue la mejor representada con 2 géneros y 5 especies: Byssocorticium sp., Piloderma olivaceum, Piloderma sp. 1, Piloderma sp. 2 y Piloderma sp. 3; debido a su bajo porcentaje de similitud con otras secuencias de Piloderma, es probable que estas últimas sean nuevas especies. El género que más especies presentó fue Cortinarius con 5 especies: C. diasemospermus, C. mucosus, C. sp. 1, C. sp. 2 y C. sp. 3. Tomando en cuenta la diversidad de la comunidad de HECM encontrada en el sitio de estudio, se observó que no existe similitud entre las especies encontradas en los bosques de P. hartwegii del desierto de los Leones y del Parque Nacional Zoquiapan (Perea-Estrada, 2009). Sin embargo, se encontraron algunas similitudes con la comunidad de HECM asociados a P. montezumae de la Sierra de Chichinautzin (Reverchon et al., 2012), principalmente con miembros de la familia Atheliaceae.
Las especies de HECM estudiadas en este trabajo tienen alto potencial para usarse en planes de reforestación de P. hartwegii en la zona, lo que incrementaría la sobrevivencia de las plántulas en campo, ya que esta conífera presenta una baja viabilidad de semillas, debido a algunos factores como la baja sobrevivencia de plántulas y la depredación por pequeños mamíferos (Murrieta-Hernández et al., 2014). Adicionalmente, el fuego desempeña un papel importante en la regeneración de estos bosques, debido a que favorece la apertura de los conos y al quemar la mayor parte de la materia orgánica permite a la semilla tener contacto directo con el suelo, incrementando su germinación (Viveros-Viveros et al., 2010). El fuego de igual manera es importante para los HECM, ya que algunas especies presentan propágulos resistentes al fuego (esporas, esclerocios y raíces micorrizadas), además, al adicionar carbón se incrementa la germinación de las esporas, permitiendo la remoción de algunos compuestos inhibitorios (Dahlberg, 2002). Aunque el régimen de incendios en la zona de estudio no se consideró, es importante mencionar que en el periodo 1995-2012 la tasa de transformación del PNCP fue del 0.91%, con una pérdida de área boscosa de 1,089ha, ocasionada por el incendio de 1998 (Conanp, 2012), afectando severamente la parte este (sitio 3) de nuestra zona de estudio. Los taxones de HECM estudiados no corresponden en su mayoría a lo registrado por Buscardo et al. (2010) y Garibay-Orijel et al. (2013) como hongos con propágulos resistentes al fuego, a excepción de taxones no determinados del género Cortinarius y Sebacina.
Por lo anterior y tomando en cuenta los posibles cambios en la vegetación de los bosques de P. hartwegii, a causa del calentamiento global (Gutiérrez y Trejo, 2014; Sáenz-Romero et al., 2009; Viveros-Viveros et al., 2010), los HECM representan una alternativa que a futuro puede ser utilizada para desarrollar estrategias de restauración, preservación e innovación tecnológica sobre coníferas restringidas a las partes altas de las montañas de México.
El primer autor agradece al Conacyt la beca otorgada para realizar los estudios de maestría en Ecología Forestal, al Laboratorio de Organismos Benéficos de la Facultad de Ciencias Agrícolas de la Universidad Veracruzana y al Laboratorio de Micología II del Instituto de Ecología (INECOL) las facilidades otorgadas para los trabajos moleculares. A Florencia Ramírez Guillén y Juan Lara Carmona su ayuda en la búsqueda de información. Se agradece el apoyo de Laura Márquez, de la Unidad de Secuenciación del Instituto de Biología (UNAM) por la secuenciación de las muestras. La secuenciación de ADN fue financiada por la Red Temática del Código de Barras de la Vida (MEXBOL) proyecto (251085).
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.