El éxito reproductivo de Caiman latirostris puede estar afectado por las modificaciones que se producen en las cáscaras durante el periodo de incubación de los huevos. Resulta importante conocer las estructuras que conforman la cáscara y los cambios que en ella ocurren. En este estudio se presentan descripciones de la estructura -forma y tamaño del huevo, ornamentación, espesor y estructura de la cáscara, tipo de unidades de cáscara, densidad y tamaño de poros-, y evidencias de los cambios producidos durante la incubación. Las modificaciones más importantes halladas en las cáscaras fueron: el adelgazamiento de la capa calcárea y el aumento del tamaño de los poros. La mayor parte de las modificaciones de la cáscara se produjeron, principalmente, a partir del segundo y tercer tercio del periodo de incubación.
Reproductive success of Caiman latirostris may be affected by changes in eggshells during the incubation period. Therefore, it is important to understand the structures and the changes of eggshells among incubation. In this study, we present descriptions of estructure -egg size and shape, ornamentation, estructure and thickness of eggshell, eggshell type units, density and size of pores- and the evidences of changes among incubation period. The most significant changes on the estructure eggshell were calcareous layer thinning and increasing pores sizes. These changes occurred from the second and last third of the incubation period.
En las últimas décadas se realizaron estudios que describen y comparan cáscaras y huevos de amniotas, tanto fósiles como actuales (Romero de Pérez y Ramírez Pinilla, 2002; Jackson et al., 2004; Deeming y Birchard, 2007). En el orden Crocodylia, se reportó que la forma de los huevos varía de elíptica a fuertemente elongada en algunas especies (Schmidt y Schonwetter, 1943; Ferguson, 1985). Los huevos de los cocodrilianos son pequeños en relación con la talla de la hembra, existiendo variaciones intraespecíficas que se relacionan al tamaño y edad de la hembra reproductora (Pooley y Gans, 1976; Ferguson, 1985; Larriera et al., 2004). La superficie externa de las cáscaras varía considerablemente entre las diferentes especies. Se encuentran huevos con la superficie lisa, ornamentada, erosionada y escamosa; además de una variación en el grado de calcificación (Deeming y Unwin, 2004).
La cáscara del huevo en los Crocodylia está compuesta por una capa calcárea rígida externa, de múltiples láminas muy finas de calcita; y una membrana testácea interna constituida por 2 capas proteicas (Gans y Huey, 1982; Kern y Ferguson, 1997; Fernández et al., 2013). Tanto la capa calcárea, como la membrana testácea son atravesadas por poros, los cuales en algunas especies son visibles a simple vista como en Alligator mississippiensis, mientras que en otras como en Caiman crocodilus, son difíciles de observar (Schmidt y Schonwetter, 1943). Algunos estudios mencionan que la estructura de la cáscara de los huevos puede experimentar cambios durante la incubación, por ejemplo, el adelgazamiento de la cáscara y el incremento en el número o tamaño de los poros (Jenkins, 1975; Ferguson, 1982).
Conocer los cambios que se producen en la ultraestructura de la cáscara de los huevos de los reptiles, es necesario para comprender los diferentes procesos fisiológicos que ocurren durante la incubación. Si se producen cambios en la cáscara, éstos podrían modificar el intercambio gaseoso entre el embrión y el medio externo, e incluso afectar el éxito de eclosión (Ferguson, 1985). El propósito del presente trabajo fue evaluar los cambios en la estructura de la cáscara de los huevos de C. latirostris, durante el periodo de incubación.
Materiales y métodosObtención de nidos e incubaciónEn este trabajo se estudiaron 52 cáscaras de huevos de C. latirostris, provenientes de 11 nidos naturales de la región norte de la provincia de Santa Fe (Argentina). Los nidos fueron colectados durante la temporada reproductiva 2009 y 2010. Posteriormente, se incubaron en las instalaciones del Proyecto Yacaré a una temperatura de 31±1° C.
Protocolo experimentalCon el objetivo de investigar la macroestructura al inicio de su incubación, los huevos fueron medidos en su eje mayor y menor (tamaño promedio±desviación estándar) con calibre Mituyo modelo “CD-6” C. Dividiendo el total del periodo de incubación en tercios -primer tercio: día 1 a 24; segundo tercio: día 25 a 49 y tercer tercio: día 50 a 74-. Se extrajeron y sacrificaron embriones de los nidos incubados y las cáscaras fueron empleadas para este estudio en distintos intervalos de la embriogénesis. En cada intervalo se separaron las cáscaras y se obtuvieron secciones de los extremos (de la región de los polos) y de la parte media del huevo (región del ecuador; Rhan et al., 1979). Al inicio de la incubación o primer tercio, se extrajeron secciones de las cáscaras de 15 huevos, estas secciones se estudiaron a fin de evaluar si existían o no diferencias entre los huevos de diferentes nidos al inicio de la incubación. Posteriormente y durante el segundo tercio se obtuvieron secciones de las cáscaras de 17 huevos, y durante el tercer tercio, secciones de las cáscaras de 20 huevos. Para evaluar los cambios producidos durante la incubación, se tomaron los siguientes datos, mediante la observación de las secciones de cáscara bajo lupa binocular: espesor de la cáscara, discriminando polo y ecuador, densidad de poros, cantidad de poros detectados/ tamaño de la muestra, en ambas zonas, diámetro mayor promedio de los poros, se midieron no más de 10 poros, y porcentaje de adelgazamiento; grosor medio inicial o 1° tercio - grosor medio final o 3° tercio*100; a fin de comparar con la literatura disponible. Con el total de los datos registrados durante cada tercio, se compararon las estructuras para observar los cambios durante la incubación. El espesor de ambas regiones de cada cáscara se midió con un calibre Mituyo modelo “CD-6” C (±0.1mm). Asimismo, se registró la densidad y tamaño de los poros, tanto del ecuador y del polo con una lupa binocular Nikon SMZ 645 con retículo milimetrado, durante cada tercio del periodo de incubación.
En 9 huevos se efectuaron cortes delgados en regiones del polo y del ecuador. Las muestras fueron procesadas según procedimiento descrito por Pooley (1979), Hirsch (1979, 1983, 1985) y Chinsamy y Raath (1992). Cada muestra fue inmersa y embebida en resina en una cámara hermética al vacío para eliminar elementos extraños alojados en los poros. Posteriormente, se cortó y pulió una de las superficies de la muestra para fijarla al portaobjeto. Luego, los cortes fueron observados con un microscopio óptico Nikon SMZ 645, para observar la microestructura de las unidades de cáscara. Finalmente, se completaron las descripciones con la observación de 2 cáscaras al microscopio electrónico de barrido SEM FEG NANO 230 donde se observó la ultraestructura de las mismas.
Análisis estadísticoCon las cáscaras obtenidas al inicio de la incubación, se estudió la macroestructura mediante análisis de varianza no paramétrico (Kruskal-Wallis), pues los datos no cumplieron con el supuesto de normalidad. Se analizó el tamaño de los huevos, ejes mayor y menor, entre nidos y se comparó el espesor de las cáscaras entre los nidos. A través de correlación de Spearman (rρ) se indagó si existe relación entre el tamaño del huevo y el espesor de la cáscara. Los análisis estadísticos fueron realizados utilizando InfoStat 2008 (Di Rienzo et al., 2008).
Mediante Kruskal-Wallis se evaluaron los cambios macroestructurales durante el periodo de incubación, comparando cada uno de los tercios, y posteriormente, se analizaron mediante correlaciones de Spearman los cambios producidos. Ya que los nidos sólo presentaron diferencias en el tamaño del eje menor de los huevos y no en el resto de las características estudiadas al inicio de la incubación, se decidió comparar los cambios producidos en las cáscaras sin discriminar entre nidos.
ResultadosCaracterísticas macro-estructurales de los huevosSe constató que los huevos de C. latirostris en la provincia de Santa Fe son elongados, blancos y rugosos. Las cáscaras están bien definidas por una membrana externa calcárea rígida y 2 internas flexibles de diferentes estructuras. Los huevos presentaron un eje mayor medio de 6.43±0.63cm; rango 4.3-7.3cm; y un eje menor medio de 4.23±0.22cm; rango 3.7-4.5cm. El tamaño de los huevos de C. latirostris varió entre los nidos en el eje menor (Kruskal-Wallis, H10, 51=18.07, p=0.012), pero no en el eje mayor (H10, 51=13.55, p=0.059).
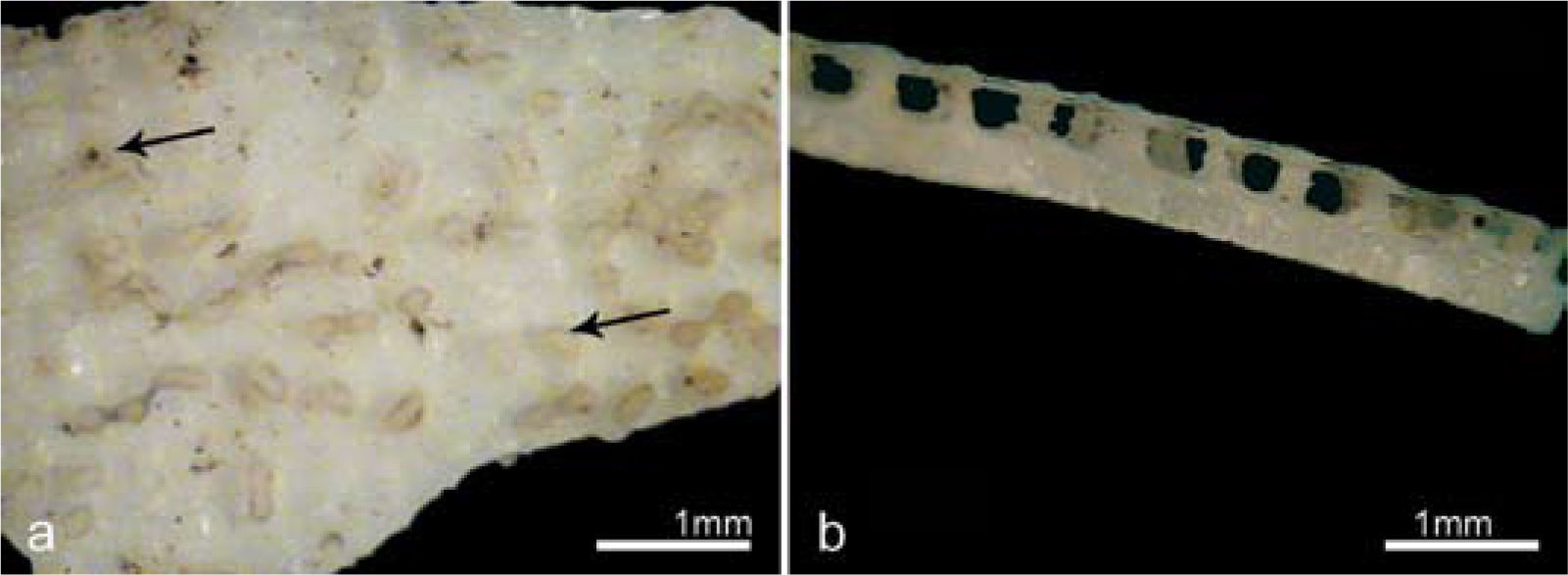
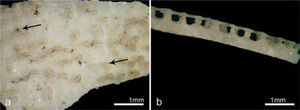
Características micro-estructurales y macro-estructurales de las cáscarasLa capa calcárea de la cáscara de C. latirostris está formada por delgadas láminas constituidas por cristales de calcita (Fig. 1). En la superficie externa de esta capa, los huevos presentan una ornamentación conspicua, integrada por columnas; dichas columnas están constituidas por los mismos depósitos concéntricos de calcita que forman las unidades de la cáscara. Las torres se forman cuando se interrumpe en ciertos intervalos la deposición continua de las capas que forman la cáscara (Fernández et al., 2013). Las láminas concéntricas que conforman cada torre se expanden a diferentes alturas y se conectan irregularmente con otra columna adyacente conformando la ornamentación (Figs. 1, 2). Entre las columnas se encuentran cráteres de forma cónica, cuya base se orienta hacia el exterior, y en el interior de estos cráteres aparecen los poros, los que atraviesan las capas del huevo.
Vista radial de la cáscara de C. latirostris, observado con microscopio electrónico de barrido. a, estructura de la cáscara formada por laminillas de calcio. Se observan en detalle las láminas que forman la cáscara; b, vista radial de la cáscara donde se observan en detalle las múltiples láminas de calcio que forman la unidad y la ornamentación de la cáscara (columnas).
a, cáscara observada con lupa binocular (15x). Se observa la superficie externa de la cáscara, la flecha superior señala el detalle de un cráter y un poro en su interior. La flecha inferior señala una de las torres que conforman la ornamentación característica de C. latirostris; b, vista radial de la cáscara con lupa binocular, se observa la ornamentación característica con las torres y sus expansiones laterales elevadas por sobre las unidades de la cáscara que la conforman.
Al inicio del estudio no se observaron diferencias entre los nidos para las variables estudiadas: espesor de la cáscara, densidad y tamaño de poros (Kruskal-Wallis, H5,14<8.98, p>0.049). Se halló que en la cáscara de los huevos, la densidad media de poros en la región del ecuador es 3 veces mayor que la densidad media de poros en los polos. No se encontró correlación entre la longitud del huevo y el espesor de la cáscara (Correlación de Spearman, rρ=0.35, p>0.16, longitud en ambos ejes).
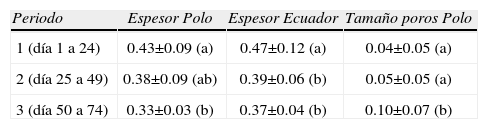
Durante el periodo de incubaciónEl espesor de la cáscara en el polo y en el ecuador fue diferente entre los tercios de incubación (Kruskal-Wallis, polo: H2,51=10.47, p=0.005; ecuador: H2,51=11.46, p=0.003; Cuadro 1). Durante el transcurso de la incubación se redujo el espesor en ambas regiones (Correlación de Spearman, rρ=-0.49, p=0.001). El porcentaje de adelgazamiento del espesor de la cáscara fue del 20%. Además, se encontró que el tamaño de los poros en los polos fue diferente entre tercios (Kruskal-Wallis, H2,51=6.92, p=0.027; Cuadro 1), ya que éstos incrementaron su tamaño durante la incubación (Correlación de Spearman, rρ=0.39; p=0.004). Siendo clara la diferencia entre el primero y el último tercio de incubación (Cuadro 1). Sin embargo, no se observaron cambios durante la embriogénesis, en la densidad de poros en el polo como en el ecuador, y en el tamaño de los poros en el ecuador (H2,51>23.2, p>0.10). En cuanto a la ultraestructura, se observaron 2 fragmentos con microscopio electrónico de barrido. Las unidades de cáscara están constituidas por cristales tabulares de calcita que crecen de manera radial, formando cuñas de contorno irregular.
Estructuras de las cáscaras en las que se evidenciaron diferencias (mm±desviación estandar) durante el transcurso de la incubación (en tercios). Letras distintas indican diferencias (p<0.05)
| Periodo | Espesor Polo | Espesor Ecuador | Tamaño poros Polo |
| 1 (día 1 a 24) | 0.43±0.09 (a) | 0.47±0.12 (a) | 0.04±0.05 (a) |
| 2 (día 25 a 49) | 0.38±0.09 (ab) | 0.39±0.06 (b) | 0.05±0.05 (a) |
| 3 (día 50 a 74) | 0.33±0.03 (b) | 0.37±0.04 (b) | 0.10±0.07 (b) |
El tamaño de los huevos de C. latirostris varió entre los nidos, ya que el diámetro del huevo depende del tamaño de la hembra reproductora (Larriera et al., 2004). Sin embargo, para esta especie, el nido de origen o el tamaño del huevo parecen no afectar el espesor de la cáscara, la densidad y el tamaño de poros.
Durante el desarrollo embrionario, uno de los cambios más notables en la cáscara fue el adelgazamiento del espesor de la capa calcárea tanto en la zona de los polos como en el ecuador. Este adelgazamiento representa aproximadamente un 20% del espesor de la cáscara, siendo mayor al adelgazamiento medio reportado para la cáscara de A. mississippiensis (13%; Ferguson, 1982; Wink et al., 1990a, 1990b). La reducción en espesor se podría deber a fenómenos de degradación intrínseca y/o extrínseca. En relación con la degradación intrínseca, Packard y Packard (1989) señalaron que la yema de huevo es un importante recurso de calcio para el embrión, particularmente en el segundo tercio de la incubación, aunque en el último tercio, el calcio sería movilizado desde la cáscara. El proceso de movilización de calcio reduciría el espesor de la cáscara e incrementaría su flexibilidad (Claessen, 1979). La reducción del espesor fue uno de los cambios observados en este estudio, ya sea durante el segundo tercio, en el espesor de la cáscara en el ecuador, como en el tercer tercio, en el espesor de la cáscara en el polo y tamaño de poros en el polo. Los cambios advertidos en las cáscaras de los huevos, desde la mitad del periodo de incubación hasta el nacimiento, corresponden con el crecimiento somático del embrión y con procesos de maduración ósea que requieren la incorporación de calcio (Oviedo-Rondón et al., 2008), similar a lo reportado para las especies estudiadas de crocodílidos (Ardila et al., 1999).
La degradación extrínseca es otro factor importante en el adelgazamiento de la cáscara, ya que la presencia de microorganismos, agua y dióxido de carbono en el material de nido erosiona la cáscara desde la superficie, deteriorando la ornamentación, aumentando el tamaño de las lagunas concéntricas y el tamaño de los poros (Ferguson, 1982; Whitehead, 1987). Caiman latirostris es una especie que nidifica en montículo, gran parte del nido está formado por material vegetal, hojas y ramas, tierra y arena, sumado a las deyecciones de la hembra (Larriera e Imhof, 2006). La descomposición de la materia orgánica, además de la humedad aportada por las precipitaciones, generan un ambiente propicio para el desarrollo de diversos microorganismos (bacterias y hongos, Piña et al., 2005; Núñez-Otaño et al., 2013). Ello podría contribuir a la degradación de las cáscaras bajo condiciones naturales. Algunos autores mencionan que tanto la degradación extrínseca como intrínseca aumentaría el tamaño de los canales de los poros, incrementando el intercambio de gases y de agua, entre el embrión y el medio exterior (Ferguson, 1981, 1982; Ackerman et al., 1985; Grenard, 1991). Otra función que puede cumplir la degradación de la cáscara sería la de debilitarla, facilitando la eclosión del embrión (Joanen y McNease, 1981; Bond et al., 1988), fenómeno reportado también en aves (gallinas y codornices; Ferguson, 1981; Bond et al., 1988). En futuros estudios sería interesante evaluar la tasa de intercambio de oxígeno entre el medio y el embrión durante su desarrollo.
En Alligator sinensis se registró que durante el periodo de incubación, en las cáscaras de los huevos se incrementan la cantidad y el tamaño de los poros (Chen y Liang, 1992). Sin embargo, en los huevos de C. latirostris varió el tamaño, pero no la densidad; aunque se observó una mayor densidad de poros en los polos que en el ecuador, como fue reportado en A. mississippiensis (Gans y Huey, 1982; Ferguson, 1982; Kern y Ferguson, 1997). El aumento en el tamaño de los poros facilitaría el intercambio de agua y de gases entre el medio y el embrión (Ferguson, 1982), sin comprometer la estructura de la cáscara.
Se concluye que la estructura de la cáscara de los huevos de C. latirostris sufre modificaciones durante el transcurso de la incubación. Los principales cambios son la reducción del espesor de la cáscara y el incremento del tamaño de los poros, hecho que es más evidente durante el segundo y el último tercio de la incubación. A partir de los datos aportados en el presente trabajo, se considera necesario realizar a futuro un estudio ultraestructural de la cáscara a lo largo del periodo de incubación para determinar cómo se degradan los cristales de calcita que conforman la cáscara y determinar el origen extrínseco o intrínseco del adelgazamiento de la misma.
Agradecemos al Proyecto Yacaré, Yacarés Santafesinos, Gobierno de la Provincia de Santa Fe/MUPCN. Al Lic. Diego Ponti por los cortes histológicos; a “Cacho” Cotaro, miembro de la Comisión de Energía Atómico (Bariloche) y a Cristina Gallego y Miguel Moreno-Aranza de la Universidad de Zaragoza (España) por las imágenes SEM. Apreciamos los comentarios y sugerencias del Dr. Carlos Piña, así como de 2 revisores anónimos. M. Simoncini, M. Fernández y J. Iungman son post-doctorantes de Conicet.