Se presenta una breve sinopsis sobre las características de los crustáceos decápodos y sobre las propuestas recientes de su clasificación. Sobre la base de una compilación exhaustiva de los registros de crustáceos decápodos en México, se estableció un listado de estas especies para las regiones continental, del Caribe, del golfo de México y del Pacífico mexicano. En total se contabilizaron 1 775 especies distribuidas en 537 géneros y 115 familias. Se estima que la fauna de decápodos de México representa el 11.9% del total mundial. Las familias con mayor riqueza son Alpheidae (7.4%) y Palaemonidae (5.5%), mientras que un total de 23 familias cuentan con una sola especie conocida en México. Del total, 1 597 especies (89.9%) son marinas y 178 dulceacuícolas (10.1%); de las especies marinas 46.7% se encuentran en el Pacífico, 31.4% en el golfo de México y 21.8% en el Caribe, habiendo un número importante que se distribuye en más de una de estas regiones. Debido al hecho de que la fauna marina de crustáceos decápodos de México es, en general, compartida con algunos otros países vecinos, el nivel de endemismo es relativamente bajo. Por el contrario, en el caso de la fauna de aguas dulces, se observa un nivel de endemismo muy alto; por ejemplo, en los cangrejos de agua dulce y acociles. Basados en proyecciones de otros autores se estima que se conocen actualmente sólo la mitad de las especies de crustáceos decápodos que hay en México.
A brief synopsis on the characteristics of decapod crustaceans and on recent classification proposals is presented. Through an exhaustive compilation of decapod crustacean records from Mexico, a species list was built for the continental, Caribbean, Gulf of Mexico and Pacific regions. A total of 1 775 species was obtained in 537 genera and 115 families. The Mexican decapod fauna represents 11.9% of the world’s total. The most species rich families are Alpheidae (7.4%) and Palaemonidae (5.5%), while a total of 23 families have only one known species in Mexico. Out of the total number of species, 1 597 (89.9%) are marine and 178 freshwater (10.1%); in turn, 46.7% of the marine species occur in the Pacific, 31.4% in the Gulf of Mexico and 21.8% in the Caribbean, with an important proportion of species occurring in more than one of these regions. Due to the fact that the marine decapod fauna of Mexico is, in general, shared with neighboring countries levels of endemism are low. In contrast, there is a very high level of endemism in the freshwater fauna, considering for example freshwater crabs and crayfishes. Based on projections proposed by other authors it is estimated that we now know only half of the species of decapods that occur in Mexico.
Los crustáceos se reconocen dentro de los artrópodos por tener un cuerpo con una cabeza con 5 segmentos y un tronco postcefálico multisegmentado que puede estar divido, con muchas variaciones, en tórax y abdomen, pueden presentar un caparazón, apéndices multiarticulados uni o birrámeos, con glándulas excretoras nefridiales en las antenas y las maxilas, mandíbulas multiarticuladas, respiración cutánea, branquial e inclusive “pulmonar” como en algunas formas semiterrestres, sistema excretor nefridial, sistema digestivo con ciegos gástricos y presencia de una larva nauplio con los ojos nauplio fusionados (Brusca y Brusca, 2003; Edgecombe, 2010). Dentro de la gran variedad de planes estructurales que se presentan en las 5 clases de Crustacea, en la clase Malacostraca se incluye a organismos cuyo arreglo corporal consiste en: un caparazón bien desarrollado que puede estar reducido secundariamente, un total de 19 segmentos (cabeza 5, tórax 8, abdomen 6), 0 a 3 maxilípedos, anténulas simples o divididas en 2 o 3 flagelos, antenas uni o birrámeas, ojos compuestos que pueden estar secundariamente reducidos, 5 pares de apéndices abdominales, 1 par de urópodos y los poros genitales se encuentran en la tercera somita torácica en hembras y en la quinta en machos (McLaughlin, 1980; Brusca y Brusca, 2003). La clase Malacostraca (sensuMartin y Davis, 2001) se ha organizado en 3 subclases: Phyllocarida que incluye a los leptostráceos que presentan 7 segmentos abdominales y apéndices torácicos birrámeos no especializados; Hoplocarida, en donde se ubica a los camarones mantis o estomatópodos, que tienen los 5 primeros pares de apéndices torácicos subquelados, sobresaliendo el segundo par como un fuerte apéndice usado para atacar presas; y Eumalacostraca, en donde no se presentan los 5 primeros pares de apéndices torácicos subquelados, con una amplia diversidad de formas. Esta subclase está organizada en 3 superórdenes que contienen 14 órdenes: Syncarida a Bathynellacea y Anaspidacea; Peracarida a Spelaeogriphacea, Thermosbaenacea, Lophogastrida, Mysida, Mictacea, Amphipoda, Isopoda, Tanaidacea y Cumacea; y Eucarida a Euphausiacea, Amphionidacea y Decapoda. Cabe mencionar que este mismo arreglo ha sido adoptado recientemente por Ahyong et al. (2011). En particular los decápodos se caracterizan por tener de los 8 pares de apéndices torácicos 3 pares modificados como maxilípedos, que son apéndices asociados con la cavidad bucal que sirven para manipular el alimento y crear corrientes de agua que bañan las cámaras branquiales, y 5 pares de apéndices libres con funciones ambulatorias o de locomoción; de ahí deriva el nombre de “decápodos”. De estos 5 pares de apéndices, del primer al tercer pares pueden estar quelados o no (McLaughlin, 1980).
El grupo de los decápodos incluye a las formas más comunes y fáciles de identificar como crustáceos, que son los camarones, los langostinos, las langostas y los cangrejos (Fig. 1). Dentro de esta variedad morfológica se encuentran especies marinas, dulceacuícolas y semiterrestres. Una característica común a todos los decápodos es un caparazón que cubre las branquias, formando cámaras branquiales con diferentes grados de especialización. El cubrir a las branquias con el caparazón y modificar los 3 primeros apéndices torácicos como maxilípedos para regular la pérdida de agua por los canales branquiales eferentes que abren dentro de la cavidad bucal, ha permitido a los cangrejos braquiuros adaptarse a ambientes contrastantes, incluyendo el semiterrestre (Wolvekamp y Waterman, 1960).
Los 2 patrones morfológicos principales dentro de los decápodos son el de “camarón” y el de “cangrejo”. En el primero se tiene un caparazón que cubre la cabeza y el tórax, formando el cefalotórax dejando a menudo un surco cervical que evidencia la línea de fusión, y un abdomen libre extendido posteriormente con pleópodos bien desarrollados utilizados para la natación; el cuerpo está comprimido lateralmente. El segundo patrón morfológico principal es el de cangrejo, en donde el caparazón se ha ensanchado y el abdomen se ha reducido para plegarse por debajo del caparazón. Entre estos 2 patrones principales existen formas que podrían concebirse como “intermedias”, que corresponderían a los cangrejos “imperfectos” del infraorden Anomura; algunos ejemplos son los cangrejos porcelánidos y las langostillas de la superfamilia Galatheoidea o los cangrejos ermitaños de la superfamilia Paguroidea. El proceso de transformación entre el tipo “camarón” y el tipo “cangrejo” es quizá todavía demasiado complejo para poder ser dilucidado, puesto que hay que usar principalmente formas actuales para encontrar el camino evolutivo que se ha seguido. Sin embargo, para explicar la braquiurización (Stevcic, 1971) o carcinización (McLaughlin y Lemaitre, 1997) se han confeccionado hipótesis que parten de formas afines a los cangrejos paguroideos para llegar a los cangrejos verdaderos.
El tipo y arreglo de las branquias en los decápodos es importante para los esquemas de clasificación. Se tienen 3 tipos básicos: la dendrobranquia, que a partir de un tronco desarrolla 2 ramas que producen un arreglo radial de filamentos; la tricobranquia, que presenta ramas de filamentos en varias series a lo largo del tronco y la filobranquia que presenta pares de proyecciones aplanadas que salen del tronco central. Las branquias se clasifican también por su posición como: pleurobranquia, sujeta a la pared del cuerpo; artrobranquia, sujeta a la articulación entre la coxa y el cuerpo; y podobranquia si está sujeta a la coxa (Holthuis, 1993). La fórmula branquial es importante para la delimitación de grupos e identificación de taxa supraespecíficos.
Los tipos de reproducción en los decápodos son muy variados. La mayoría de las especies son gonocóricas, un número reducido de especies de camarones carideos son hermafroditas simultáneos (Bauer y Holt, 1998), y otros camarones carideos y pandálidos pueden ser hermafroditas secuenciales tanto protándricos como protogínicos, (Alonso et al., 2010). Recientemente se ha encontrado un par de especies de acociles de la familia Cambaridae que son partenogenéticas (Scholtz et al., 2003; Buric et al., 2011). Las gónadas tienen 2 lóbulos laterales y se dice que son pareadas. En ambos sexos y tanto en camarones como en cangrejos son dorsales al tubo digestivo y tienden a desarrollarse anterior y posteriormente cuando los organismos son reproductivos. En los machos los testículos conectan a través de un conducto deferente a la coxa del quinto par de pereiópodos en donde se encuentra el gonoporo. En las hembras, los lóbulos del ovario conectan a través de oviductos a las coxas del tercer par de pereiópodos en donde está el gonoporo. En especies evolucionadas los gonoporos migran al esternito del respectivo pereiópodo. En los camarones del suborden Dendrobranchiata, (e. g., peneidos) las hembras después del apareamiento ovipositan al medio acuático. En los camarones carideos y en los cangrejos, después del apareamiento, que puede ser un amplexo o una verdadera cópula, los huevos desovados se quedan adheridos a los pleópodos de las hembras que los llevan durante todo el desarrollo embriológico hasta la eclosión (Bliss, 1982; Brusca y Brusca, 2003; Bauer, 2004).
La clasificación de los decápodos que aquí se sigue es la propuesta por De Grave et al. (2009). Sin embargo, se consideraron algunos aspectos de las clasificaciones propuestas por Martin y Davis (2001), Ng et al. (2008), Ahyong (2009), Ahyong et al. (2010), Boyko y McLaughlin (2010), Chan (2010), McLaughlin et al. (2010a, 2010b), Osawa y McLaughlin (2010), Schnabel y Ahyong (2010) y Ahyong et al. (2011), y del arreglo que presentaron Felder et al. (2009). En general, se ha visto que en los últimos 10 años el número de familias ha aumentado de manera sensible básicamente por re-arreglos de grupos preexistentes, más que por descripción de taxa nuevos. Se está dando una tendencia en la cual las tribus y subfamilias son elevadas a familias y se crean “superfamilias” para agrupar familias similares, a veces con muy poco sustento (Ng et al., 2008). Dos de los casos más evidentes son los nuevos esquemas de los cangrejos majoideos y xantoideos que se clasificaban previamente en 2 familias pero ahora son agrupados en 6 y 3 familias, respectivamente. A diferencia de la clasificación de Ahyong et al. (2011), la de De Grave et al. (2009) para decápodos es particularmente útil pues muestra qué géneros quedan incluidos en cada familia y, quizá con un enfoque más conservador, presenta un mayor número de géneros en cada familia.
Se construyó un listado con todos los registros de crustáceos decápodos que se tienen en la literatura sobre México y se añadieron registros no publicados que se extrajeron de colecciones biológicas como: la Colección Nacional de Crustáceos, Instituto de Biología, Universidad Nacional Autónoma de México (UNAM); la Colección Regional de Invertebrados, Instituto de Ciencias del Mar y Limnología, UNAM; y la Colección de Artrópodos no Insectos de la Facultad de Biología, Universidad Autónoma de Nuevo León. Las principales publicaciones en las que se basa el listado de especies son: Hendrickx y Estrada-Navarrete (1989), Markham et al. (1990), Hendrickx (1993, 1995, 2005), Hendrickx y Harvey (1999), Wicksten y Hendrickx (2003), Briones-Fourzán et al. (2005), Rodríguez-Almaraz y Zavala-Flores (2005), Villalobos y Alvarez (2008, 2010), Felder et al. (2009), Ayón-Parente y Hendrickx (2010), Alvarez et al. (2011) y Hendrickx y Wicksten (2011).
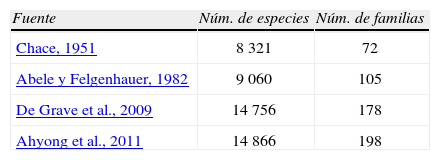
DiversidadRiqueza de especiesLa compilación hecha para este estudio arroja para México un total de 1 775 especies clasificadas en 537 géneros y 115 familias de crustáceos decápodos, lo que representa el 11.9% del total de especies en el mundo y el 57.5% de la familias, del total presentado por Ahyong et al. (2011) (Cuadro 1).
Estimaciones históricas del número de especies y familias dentro del orden Decapoda para el mundo
| Fuente | Núm. de especies | Núm. de familias |
| Chace, 1951 | 8 321 | 72 |
| Abele y Felgenhauer, 1982 | 9 060 | 105 |
| De Grave et al., 2009 | 14 756 | 178 |
| Ahyong et al., 2011 | 14 866 | 198 |
De Grave et al. (2009) estimaron que había 14 756 especies de decápodos contenidos en 2 725 géneros, de las cuales 6 835 especies (46%) son cangrejos braquiuros. En la lista recopilada para este estudio tenemos que de las 1 775 especies de decápodos, 714 (40.3%) son cangrejos braquiuros, un porcentaje menor de lo que se esperaría si en México se tuviera una representación proporcional de la diversidad mundial. Hay 2 posibles explicaciones para que México tenga esta representación de cangrejos braquiuros y de otros decápodos. Primero, puede ser que el muestreo no ha sido similar entre los grupos de decápodos que se han estudiado, lo que, combinado con que hay varias familias de camarones como Alpheidae o Palaemonidae que son muy diversas en México, arroja una proporción menor de especies de cangrejos. Segundo, como Ng et al. (2008) discuten, la fauna de cangrejos braquiuros marinos es más diversa en la región del Indo-Pacífico que en otras regiones del mundo, lo que se estaría reflejando en aguas mexicanas.
Distribución de la riqueza de especiesEl total de 1 775 especies de decápodos se distribuye de la siguiente manera: marinas 1 597 (89.9%) y 178 dulceacuícolas (10.1%); en aguas del Pacífico 866 (48.6%); en el Pacífico y golfo de México 21 (1.3%); en el Pacífico, golfo de México y Caribe 20 (1.2%); en el golfo de México 287 (16.2%); en el golfo de México y Caribe 277 (15.6%); y en el Caribe 124 (7%). Es interesante notar que el componente caribeño dentro del golfo de México es de 298 especies o 49% del total del golfo de México; esto sugiere que a pesar de que ambos mares están conectados se conserva una proporción alta de especies propias de cada región.
Composición de la riqueza de especiesLa familia con el mayor número de especies es Alpheidae con 132, o 7.4% del total, siendo una familia principalmente marina con una especie dulceacuícola, Potamalpheops stygicola, y una especie anquiahalina, Yagerocaris cozumel. Después está Palaemonidae con 98 especies, 62 marinas/estuarinas y 36 dulceacuícolas, Porcellanidae (80), Paguridae (80), Xanthidae (65), Diogenidae (64), Pseudothelphusidae (63), Pinnotheridae (62), Panopeidae (61), Epialtidae (58), Majidae (57), Cambaridae (56) e Hippolytidae (54). El resto de las familias tienen menos de 50 especies conocidas en México, y de éstas una cuarta parte (23 familias) están representadas por una sola especie: Procarididae, Agostocarididae, Alvinocarididae, Disciadidae, Rhynchocinetidae, Psalidopodidae, Bathypalaemonellidae, Anchistioididae, Parastacidae, Callianideidae, Ctenochelidae, Gourretiidae, Axianassidae, Strahlaxiidae, Homolodromiidae, Dynomenidae, Oregoniidae, Dairidae, Carpiliidae, Acidopsidae, Mathildellidae, Hexapodidae y Pilumnoididae.
Nivel de endemismoCon respecto a las especies marinas el nivel de endemismo que se encuentra en aguas mexicanas es bajo debido a los patrones de distribución de la mayoría de las especies que abarcan hacia el norte regiones templadas o subtropicales en ambas costas de los Estados Unidos, o bien, son de afinidad tropical y se extienden hacia el sur hasta las costas de Sudamérica. Sin embargo, en el golfo de California el nivel de endemismo de los crustáceos decápodos es relativamente alto (Villalobos et al., 1992; Villalobos y Alvarez, 2002). En el caso de todos los decápodos, hasta principios de la década de 1990 se estimó un endemismo del orden de 22% en el caso del golfo norte, de 17% en el golfo central y de 11% en el golfo sur (Hendrickx, 1992). Correa-Sandoval y Rodríguez-Cortés (1998) estimaron un 24.3% de endemismo en anomuros para todo el golfo. Sin embargo, desde entonces el nivel de endemismo en el golfo ha variado conforme se han registrado fuera del golfo varias especies consideradas endémicas (e.g., Plesionika carinirostris) (Montagne y Cadien, 2001), o especies de fuera dentro del golfo (e.g., Paeduma cylindraceum) (Hendrickx y Visauta-Girbau, 2012). Estas variaciones, junto con la descripción de especies nuevas conocidas por el momento solamente del golfo de California, indican que es necesario revisar frecuentemente cual es la componente endémica de esta fauna. En 2005, por ejemplo, Hendrickx (2005) reportó un total de 625 especies para el golfo de California, de las cuales 94 (15%) eran endémicas.
En el golfo de México se tiene también un nivel muy bajo de endemismo. Felder et al. (2009) consideraron que de las 1007 especies de decápodos registradas para el golfo de México un 7% (70 especies) serían endémicas de esta región, pero no exclusivamente de aguas mexicanas. Destacan algunas especies que se creían endémicas de la parte mexicana del golfo de México como la jaiba prieta, Callinectes rathbunae, con una distribución desde aguas al sur de la desembocadura del río Bravo hasta el extremo este de la costa de Campeche; sin embargo, ahora ha sido registrada en la isla del Padre, Texas, EUA. Un caso similar es el del cangrejo Platychirograpsus spectabilis que sería endémico de las costas de Veracruz, Tabasco y Campeche, pero fue introducido en la bahía de Tampa, Florida, EUA (Schubart et al., 2002).
El nivel de endemismo en los grupos dulceacuícolas, en contraste, es muy alto. En la familia Atyidae, por lo menos 4 de 12 especies son endémicas de México. Agostocaris bozanici, el único representante de la familia Agostocarididae en México es endémico de la isla de Cozumel, Quintana Roo. En la familia Palaemonidae 21 de 83 especies, todas de agua dulce, son endémicas de México. En los acociles de la familia Cambaridae, 55 de 56 especies son endémicas de México, aunque faltaría verificar la posible distribución de algunas especies en Guatemala y Belice. Con respecto a los cangrejos de agua dulce, todas las especies que se distribuyen en México de las familias Trichodactylidae y Pseudothelphusidae son endémicas de nuestro país.
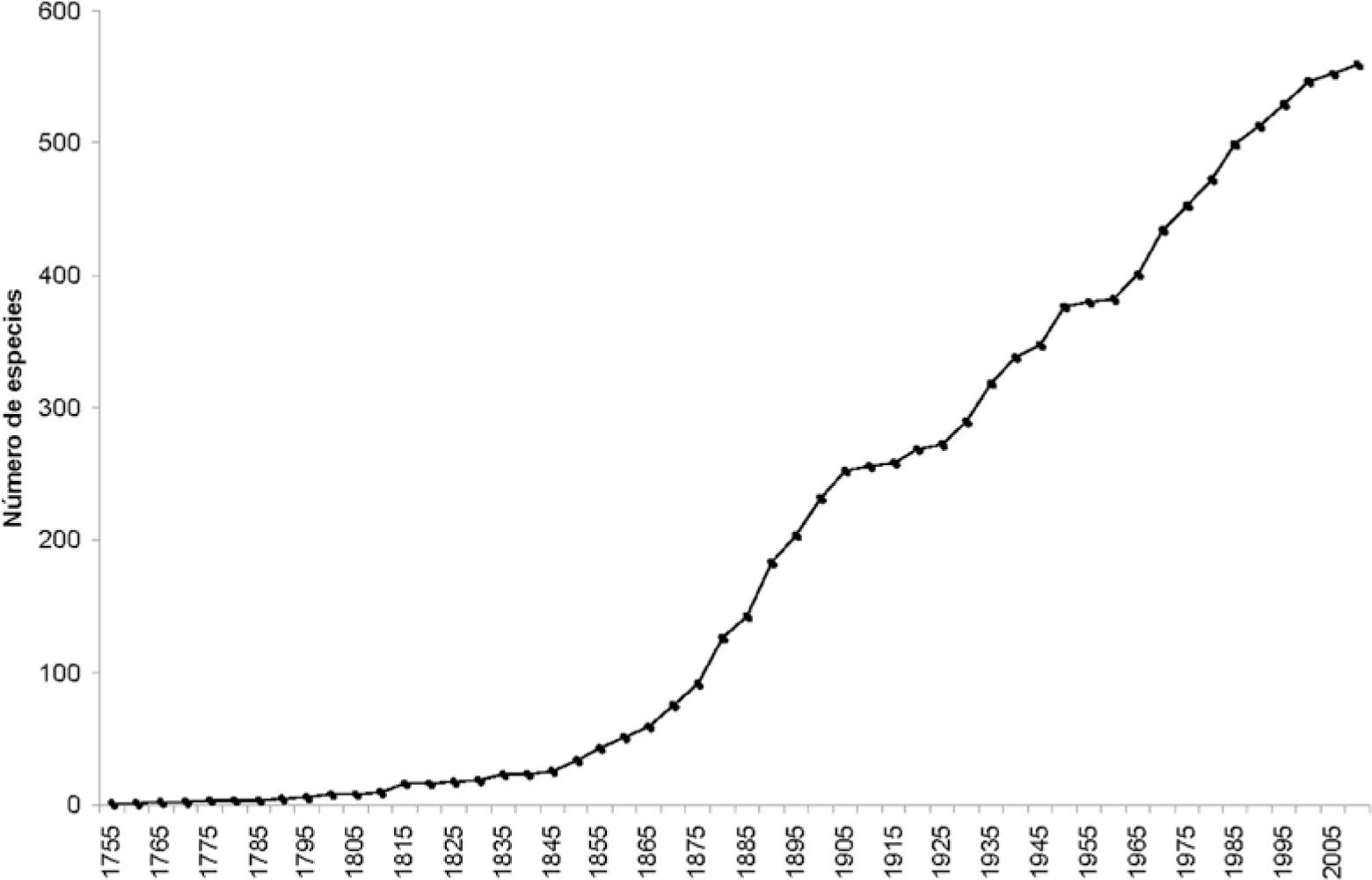
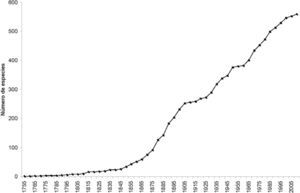
¿Cuántas especies faltan por describir?Para responder esta pregunta tenemos 2 fuentes de datos que muestran algunas tendencias. Primero, Martin y Davis (2006), al analizar la tendencia histórica en la descripción de crustáceos, muestran que para todo el subphylum en general y para el orden Decapoda en particular, se tiene un incremento sostenido en la descripción de especies nuevas. La curva que describe el aumento en las especies de decápodos sigue hasta ahora con una pendiente constante desde mediados del siglo 19, con una tasa de descripción de especies del doble de la tasa para copépodos y casi de la mitad que la tasa para peracáridos (Martin y Davis, 2006) (Fig. 2). De acuerdo con Appeltans et al. (2012), el número estimado de especies de decápodos fluctuaría entre 21 000 y 24 000 especies, o sea aproximadamente entre 1.5 y 1.7 veces el número conocido actualmente. Otras estimaciones con otros grupos de crustáceos establecen que se encontrarán entre 2 y 4 veces más especies de las conocidas hasta ahora (Wittmann, 1999; Adamowicz y Purvis, 2005).
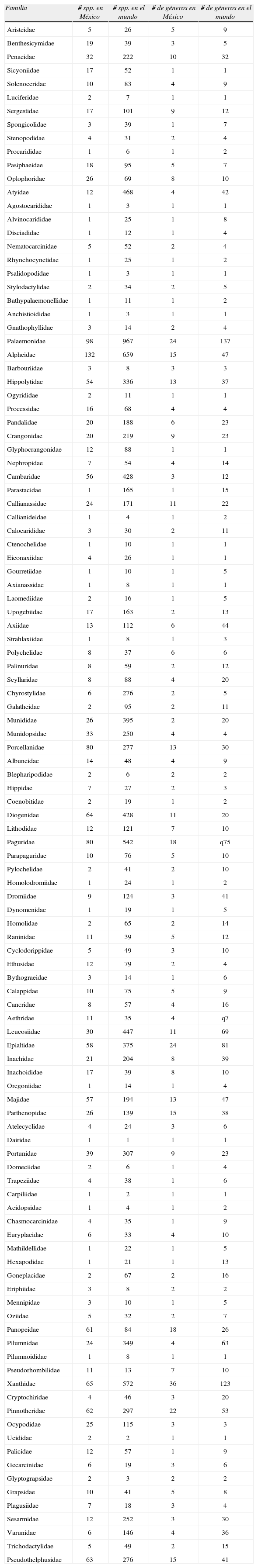
Una segunda aproximación es considerar que Álvarez et al. (1996) contabilizaron 1 410 especies de decápodos en 74 familias y estimaron que habría otras 470 especies comunes cuya presencia en México se podía inferir, para un total de 1 880 especies (Cuadro 2). A 17 años de distancia, en este estudio se registran 1 770 especies en 114 familias, representando un incremento total del 25% o de 21.1 especies más por año. Si asumimos, de manera conservadora pero totalmente especulativa, que el número total es 2 veces más (Wittmann, 1999; Appletans et al., 2012) que el conocido, entonces se encontrarían en México unas 3 540 especies de decápodos y describiendo 21 especies nuevas al año nos tomaría 84 años para alcanzar un conocimiento cercano al total de especies. Como referencia se presenta el Cuadro 3 en el que se enlistan todas las familias registradas en México con el número de especies y géneros conocidos en México y en el mundo. Estas cifras servirán en el futuro como referencia para evaluar los avances y corregir las proyecciones sobre cómo avanza el conocimiento de los crustáceos decápodos en México.
Estimaciones del número de especies y familias dentro del orden Decapoda para México
| Fuente | No. de especies | No. de familias |
| Álvarez et al., 1996 | 1 410 | 74 |
| Este estudio | 1 770 | 114 |
Número de especies y géneros por familia para México obtenidos en este estudio y para el mundo según Ahyong et al. (2011)
| Familia | # spp. en México | # spp. en el mundo | # de géneros en México | # de géneros en el mundo |
| Aristeidae | 5 | 26 | 5 | 9 |
| Benthesicymidae | 19 | 39 | 3 | 5 |
| Penaeidae | 32 | 222 | 10 | 32 |
| Sicyoniidae | 17 | 52 | 1 | 1 |
| Solenoceridae | 10 | 83 | 4 | 9 |
| Luciferidae | 2 | 7 | 1 | 1 |
| Sergestidae | 17 | 101 | 9 | 12 |
| Spongicolidae | 3 | 39 | 1 | 7 |
| Stenopodidae | 4 | 31 | 2 | 4 |
| Procarididae | 1 | 6 | 1 | 2 |
| Pasiphaeidae | 18 | 95 | 5 | 7 |
| Oplophoridae | 26 | 69 | 8 | 10 |
| Atyidae | 12 | 468 | 4 | 42 |
| Agostocarididae | 1 | 3 | 1 | 1 |
| Alvinocarididae | 1 | 25 | 1 | 8 |
| Disciadidae | 1 | 12 | 1 | 4 |
| Nematocarcinidae | 5 | 52 | 2 | 4 |
| Rhynchocynetidae | 1 | 25 | 1 | 2 |
| Psalidopodidae | 1 | 3 | 1 | 1 |
| Stylodactylidae | 2 | 34 | 2 | 5 |
| Bathypalaemonellidae | 1 | 11 | 1 | 2 |
| Anchistioididae | 1 | 3 | 1 | 1 |
| Gnathophyllidae | 3 | 14 | 2 | 4 |
| Palaemonidae | 98 | 967 | 24 | 137 |
| Alpheidae | 132 | 659 | 15 | 47 |
| Barbouriidae | 3 | 8 | 3 | 3 |
| Hippolytidae | 54 | 336 | 13 | 37 |
| Ogyrididae | 2 | 11 | 1 | 1 |
| Processidae | 16 | 68 | 4 | 4 |
| Pandalidae | 20 | 188 | 6 | 23 |
| Crangonidae | 20 | 219 | 9 | 23 |
| Glyphocrangonidae | 12 | 88 | 1 | 1 |
| Nephropidae | 7 | 54 | 4 | 14 |
| Cambaridae | 56 | 428 | 3 | 12 |
| Parastacidae | 1 | 165 | 1 | 15 |
| Callianassidae | 24 | 171 | 11 | 22 |
| Callianideidae | 1 | 4 | 1 | 2 |
| Calocarididae | 3 | 30 | 2 | 11 |
| Ctenochelidae | 1 | 10 | 1 | 1 |
| Eiconaxiidae | 4 | 26 | 1 | 1 |
| Gourretiidae | 1 | 10 | 1 | 5 |
| Axianassidae | 1 | 8 | 1 | 1 |
| Laomediidae | 2 | 16 | 1 | 5 |
| Upogebiidae | 17 | 163 | 2 | 13 |
| Axiidae | 13 | 112 | 6 | 44 |
| Strahlaxiidae | 1 | 8 | 1 | 3 |
| Polychelidae | 8 | 37 | 6 | 6 |
| Palinuridae | 8 | 59 | 2 | 12 |
| Scyllaridae | 8 | 88 | 4 | 20 |
| Chyrostylidae | 6 | 276 | 2 | 5 |
| Galatheidae | 2 | 95 | 2 | 11 |
| Munididae | 26 | 395 | 2 | 20 |
| Munidopsidae | 33 | 250 | 4 | 4 |
| Porcellanidae | 80 | 277 | 13 | 30 |
| Albuneidae | 14 | 48 | 4 | 9 |
| Blepharipodidae | 2 | 6 | 2 | 2 |
| Hippidae | 7 | 27 | 2 | 3 |
| Coenobitidae | 2 | 19 | 1 | 2 |
| Diogenidae | 64 | 428 | 11 | 20 |
| Lithodidae | 12 | 121 | 7 | 10 |
| Paguridae | 80 | 542 | 18 | q75 |
| Parapaguridae | 10 | 76 | 5 | 10 |
| Pylochelidae | 2 | 41 | 2 | 10 |
| Homolodromiidae | 1 | 24 | 1 | 2 |
| Dromiidae | 9 | 124 | 3 | 41 |
| Dynomenidae | 1 | 19 | 1 | 5 |
| Homolidae | 2 | 65 | 2 | 14 |
| Raninidae | 11 | 39 | 5 | 12 |
| Cyclodorippidae | 5 | 49 | 3 | 10 |
| Ethusidae | 12 | 79 | 2 | 4 |
| Bythograeidae | 3 | 14 | 1 | 6 |
| Calappidae | 10 | 75 | 5 | 9 |
| Cancridae | 8 | 57 | 4 | 16 |
| Aethridae | 11 | 35 | 4 | q7 |
| Leucosiidae | 30 | 447 | 11 | 69 |
| Epialtidae | 58 | 375 | 24 | 81 |
| Inachidae | 21 | 204 | 8 | 39 |
| Inachoididae | 17 | 39 | 8 | 10 |
| Oregoniidae | 1 | 14 | 1 | 4 |
| Majidae | 57 | 194 | 13 | 47 |
| Parthenopidae | 26 | 139 | 15 | 38 |
| Atelecyclidae | 4 | 24 | 3 | 6 |
| Dairidae | 1 | 1 | 1 | 1 |
| Portunidae | 39 | 307 | 9 | 23 |
| Domeciidae | 2 | 6 | 1 | 4 |
| Trapeziidae | 4 | 38 | 1 | 6 |
| Carpiliidae | 1 | 2 | 1 | 1 |
| Acidopsidae | 1 | 4 | 1 | 2 |
| Chasmocarcinidae | 4 | 35 | 1 | 9 |
| Euryplacidae | 6 | 33 | 4 | 10 |
| Mathildellidae | 1 | 22 | 1 | 5 |
| Hexapodidae | 1 | 21 | 1 | 13 |
| Goneplacidae | 2 | 67 | 2 | 16 |
| Eriphiidae | 3 | 8 | 2 | 2 |
| Mennipidae | 3 | 10 | 1 | 5 |
| Oziidae | 5 | 32 | 2 | 7 |
| Panopeidae | 61 | 84 | 18 | 26 |
| Pilumnidae | 24 | 349 | 4 | 63 |
| Pilumnoididae | 1 | 8 | 1 | 1 |
| Pseudorhombilidae | 11 | 13 | 7 | 10 |
| Xanthidae | 65 | 572 | 36 | 123 |
| Cryptochiridae | 4 | 46 | 3 | 20 |
| Pinnotheridae | 62 | 297 | 22 | 53 |
| Ocypodidae | 25 | 115 | 3 | 3 |
| Ucididae | 2 | 2 | 1 | 1 |
| Palicidae | 12 | 57 | 1 | 9 |
| Gecarcinidae | 6 | 19 | 3 | 6 |
| Glyptograpsidae | 2 | 3 | 2 | 2 |
| Grapsidae | 10 | 41 | 5 | 8 |
| Plagusiidae | 7 | 18 | 3 | 4 |
| Sesarmidae | 12 | 252 | 3 | 30 |
| Varunidae | 6 | 146 | 4 | 36 |
| Trichodactylidae | 5 | 49 | 2 | 15 |
| Pseudothelphusidae | 63 | 276 | 15 | 41 |
El primer autor agradece al programa PAPIIT de la DGAP-UNAM el apoyo recibido a través del proyecto IN214910-3 y a la Unidad de Información sobre la Biodiversidad (UNIBIO) del Instituto de Biología, UNAM. MEH agradece a Mercedes Cordero por compilar información complementaria acerca de los registros en el Pacífico mexicano.