La placenta humana cumple desde funciones de trasporte de nutrientes, respiración, y eliminación de desechos, hasta la función endocrina que alberga los efectos más importantes para la evolución y manutención de un embarazo normal, siendo una falla en dichas funciones, el desencadenante de patologías como la preeclampsia y el retraso en el crecimiento intrauterino (RCiu). se destacan por su importancia hormonas como la gonadotropina coriónica humana (hCG), el lactógeno placentario humano (hPl), las hormonas tiroideas y las esteroideas, destacándose en estas últimas los mecanismos que se conjugan para su producción. Cabe destacar que en cuanto a las funciones endocrinas, si bien la placenta produce algunas hormonas por sí sola, no es órgano completamente independiente e involucra varios ejes hipotalámicos maternos para poder funcionar de una manera correcta, producir lo que se necesita, y contribuir a que la gestación llegue a un feliz término.
Human placenta has several functions as nutrients transport, respiration, waste disposal, as well as endocrine functions that produce the most important effects on the evolution and maintenance of a normal pregnancy; being a failure in those functions, the trigger of pathologies like preeclampsia and intrauterine Growth Retardation (iuGR). The most important placental hormones are the human chorionic gonadotropin (hCG), human placental lactogen (hPl), thyroid steroid hormones, the last two known for the complex mechanisms that are mandatory for their formation.
Although the human placenta produces some hormones alone, is not a complete independent organ, requiring many maternal hypothalamic axes for a correct function, contributing in that way to a happy gestation ending.
La placenta es el órgano más especializado implicado en el embarazo, que gracias a su compleja estructura y con la ayuda del líquido amniótico ayuda al crecimiento y desarrollo del feto en formación, siendo los cambios presentados en ella factores de alto impacto en el desarrollo intrauterino fetal1. Teniendo en cuenta su relevancia en el embarazo, la placenta ha sido estudiada como parte de la etiología de condiciones gestacionales severas como la preeclampsia y el retraso en el crecimiento intrauterino (RCIU), en los cuales se ha encontrado la relación de los procesos placentarios con su desarrollo2. Además, este órgano se caracteriza por una invasión trofoblástica, la cual le confiere características especiales como sus capacidades endocrinas. En particular, el tejido endocrino de la placenta es el sincitiotrofoblasto, el cual se encarga de cubrir las vellosidades coriónicas3.
Formación de la estructura placentariaLa placenta se forma durante las 3 primeras semanas de gestación, abarcando los procesos de preimplantación, implantación y decidualización, que preparan al organismo para realizar la diferenciación de membrana embrionaria y comenzar con la formación de las membranas placentarias.
Lo primero que se necesita es un endometrio receptivo. El proceso se empieza a dar del día 20 a 24 del ciclo menstrual y se conoce como ventana de implantación4. Luego sigue la preimplantación, llamada así debido a que el óvulo empieza a viajar a través de la trompa de Falopio hasta el útero, y la estructura endometrial sigue libre5.
En la fecundación se da la unión óvuloespermatozoide y se compone de 3 etapas: 1) segmentación, 2) blastulación, donde se diferencia la mórula hasta formar una estructura cavitaria llamada blastocito, cuya cavidad se denomina blastocele, y está rodeado de un estrato celular (trofoblasto); y 3) gastrulación, donde hay anfimixis (unión de pronúcleo de óvulo y de espermatozoide), y comienzan los procesos para la formación de las 3 membranas embrionarias5.
En la implantación, el huevo se introduce en la mucosa uterina. Para ello el estroma endometrial (tejido conectivo compuesto por células y matriz extracelular), que se encuentra encargado de la remodelación constante del órgano a través del ciclo menstrual, empieza a sufrir los efectos de un proceso denominado decidualización, que es inducido por el efecto de la progesterona (comienza 6 a 7 días después de su aparición), y abarca cambios morfológicos, bioquímicos y génicos en las células estromales en respuesta a la acción hormonal6.
Además, hay un aumento de las células del sistema inmune, con un predominio en los leucocitos deciduales, cuya población está compuesta de Natural Killer uterinos (uNK) en un 70%, las cuales, en un ciclo menstrual normal ayudan a la diferenciación y renovación del endometrio. En la decidualización también regulan la invasión trofoblástica y la angiogénesis, desapareciendo gradualmente después de la semana 20 de gestación, y estando ausentes en totalidad de la decidua a término4.
También hay macrófagos, con una población que ocupa el 20%, y cuya presencia está regulada por estrógenos y
progesterona, ya que expresan receptores para estas hormonas; y linfocitos T que ocupan el 10% de la población leucocitaria total4.
En la reacción decidual hay edematización, que determina abundantes pliegues hacia la luz uterina gracias a la liberación de histamina por medio de señales hormonales que a su vez se acompañan de un enriquecimiento de material nutritivo y de una mayor facilidad para la dislaceración celular, facilitando la penetración del huevo5.
La diferenciación trofoblástica inicia cuando el trofoblasto (capa celular primaria), se diferencia rápidamente en 2 capas, el sincitiotrofoblasto y el citotrofoblasto. El sincitiotrofoblasto multinucleado desarrolla lagunas de las que proyectan algunas vellosidades del citotofoblasto, luego el sincitiotrofoblasto se comprime progresivamente hasta convertirse en una capa que cubre la vellosidad y se separa la capa del citotrofoblasto (que se vuelve discontinua) de las lagunas, que se fusionan para formar el espacio intervelloso. A la par, las enzimas trofoblásticas ayudan a que se empiecen a generar ramificaciones vasculares para que llegue sangre materna, y las células fetales mesenquimales invaden las vellosidades generando redes vasculares que conectan a las venas y arterias umbilicales. Por tanto, a pesar de estar estrechamente comunicadas, las circulaciones materna y fetal están separadas en áreas especializadas de transferencia. Las células del citotrofloblasto además invaden a las arterias espirales haciendo que la sangre que entra al espacio intervelloso, tenga una presión arterial menor que la normal7.
El sincitiotrofoblasto ayuda al intercambio de iones y nutrientes, además de la síntesis de hormonas esteroideas y otros péptidos necesarios para el crecimiento fetal. Entre las hormonas destacadas se encuentran la progesterona y la gonadotropina coriónica (hGC) fetal, las cuales son esenciales para mantener la gestación. El sincitiotrofoflasto nucleado se regenera por una rotación continua en la cual hay proliferación de citotrofoblasto mononuclear subyacente, seguido de una fusión de ambos. Esto se da durante todo el embarazo, permite un desarrollo fetal adecuado y previene un RCIU8. Cuando este proceso sufre alguna alteración, se presentan patologías como la preeclampsia.
El citotrofoblasto ya organizado como corión participa en la organización de la placenta emitiendo proliferaciones celulares que invaden los espacios y recubren la superficie lacunar5. De esta manera, culmina el proceso de formación placentaria y continúa el proceso de adaptación fisiológica para la normoevolución de la gestación.
Funciones de la placentaLa placenta cumple funciones de transporte y metabolismo, así como protectoras y endocrinas; siendo además la proveedora principal de oxígeno, agua, carbohidratos, aminoácidos, lípidos, vitaminas, minerales y nutrientes necesarios para que el feto se desarrolle de una manera adecuada1.
Obtención de nutrientes a través de la placentaLa placenta es el mayor proveedor de nutrientes para el feto. Para el paso de glucosa se han distinguido 6 trasportadores en el trofoblasto, GLUT-1, GLUT-2, GLUT-3, GLUT-4, GLUT-5, y GLUT-7. El principal es la isoforma del GLUT-1, que facilita el intercambio entre la membrana maternal del sincitiotrofoblasto y la fetal7. En cuanto a los aminoácidos, los mecanismos de transferencia son muy variados, pero todos incluyen transporte activo e involucran canales dependientes de Na y Ca+2, con glicoproteínas asociadas a transportadores específicos3.
Se conoce el transportador neutral de aminoácidos Na dependiente (SNAT, por sus siglas en inglés), y sus 3 isoformas, SNAT 1, 2 y 4. La deficiencia de este transportador ha sido identificada en situaciones patológicas como el RCIU, y se ha observado que el transporte de aminoácidos está alterado en embarazos de mujeres obesas, donde se ve disminuido, a la par que se ve relacionado con la resistencia a leptina9.
Para los ácidos grasos, sustancias fundamentales en la formación de membranas lipídicas, mielina entre otras, que ayudan a un correcto desarrollo fetal, se han identificado varias proteínas por parte de la madre para facilitar el traspaso: la proteína ligante de ácidos grasos de la membrana plasmática (FABPpm), la traslocasa de ácidos grasos (FAT), la proteína transportadora de ácidos grasos (FATP), y la familia de proteínas ligantes de ácidos grasos citoplasmáticos10.
Para los nucleósidos en la placenta de los mamíferos se han identificado 2 tipos de transportadores, equilibrados y concentrados, de los cuales en la humana se destacan 2 tipos por parte de los equilibrados: el hENT1 y el hENT210.
En cuanto a minerales importantes como el calcio y el hierro, se sabe que en cuanto al primero, el feto acumula aproximadamente de 25 a 30 g durante el embarazo para poder mineralizar el esqueleto, y la mayor demanda se sitúa en el tercer trimestre7. El calcio además ayuda al crecimiento celular y al desarrollo neurológico, y es transportado a través de la placenta por canales específicos para este fin; y el hierro es transportado con la ayuda del receptor transferrina-diférrica, el cual se encuentra en las microvellosidades del sincitiotrofoblasto7.
Función endocrina de la placentaLos cambios endocrinológicos son esenciales para el inicio y el mantenimiento de la gestación, además del correcto crecimiento y desarrollo fetal, hasta el momento del alumbramiento y comienzo del puerperio, culminando con la lactancia.
Los productos placentarios tienen blancos intrauterinos y extrauterinos y se ha demostrado que a pesar de no ser un órgano dependiente de los sistemas maternos, puede estar regulado por los ejes hipotálamo pituitario adrenal y el eje hipotalámico pituitario gonadal, teniendo cada célula placentaria una función endocrinológica diferente que varía no sólo de célula a célula sino en los estados de la gestación11.
Mientras el citotrofoblasto velloso se encarga de la producción de factores reguladores, el sincitiotrofoblasto produce péptidos comunes y hormonas tiroideas y se observa que en los inicios del embarazo, factores como el factor de crecimiento epidérmico (EGF), se incrementan, mientras que en estadios más avanzados aumentan sustancias como el lactógeno placentario humano (hPL)11.
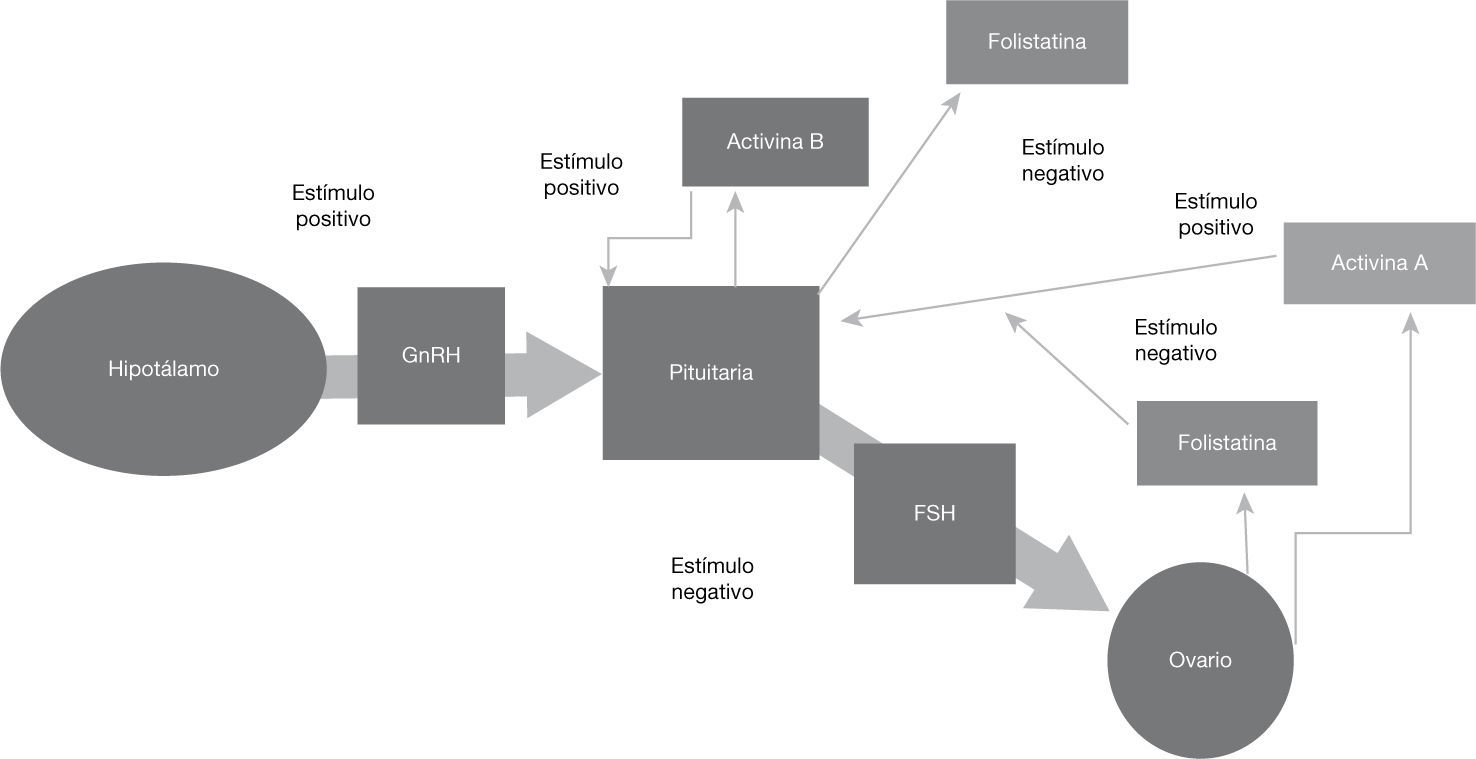
Los ejes superiores también producen sustancias que afectan el desarrollo placentario. El hipotálamo produce la hormona liberadora de gonadotropina (GnRH), la pituitaria, hCG, hPL, β-endorfina, oxitocina, y hormona del crecimiento (GH); y los ovarios producen progesterona, activinas e inhibinas; gracias a las señales de la placenta, quien participa además en vías importantes para la producción de hormonas esteroideas, ya que sus enzimas esteroidogénicas no son suficientes para producir por sí sola la cantidad necesaria de dichas hormonas11.
A continuación, se describe la acción de las hormonas más importantes para la función placentaria. Algunas son producidas por el sincitiotrofoblasto velloso, y otras de origen hipotalámico o producto de vías estimuladas por la placenta, también ayudan a la función placentaria (tabla 1).
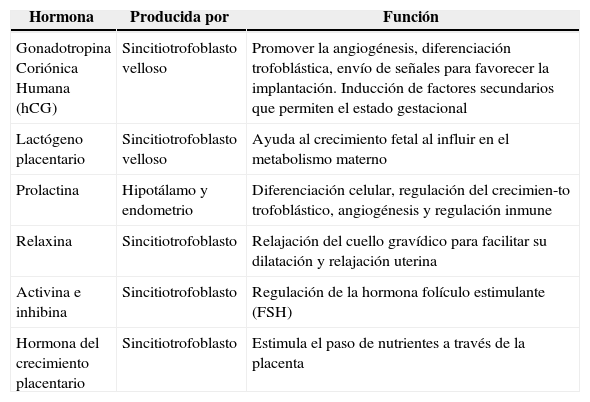
Hormonas que intervienen en la función placentaria
| Hormona | Producida por | Función |
|---|---|---|
| Gonadotropina Coriónica Humana (hCG) | Sincitiotrofoblasto velloso | Promover la angiogénesis, diferenciación trofoblástica, envío de señales para favorecer la implantación. Inducción de factores secundarios que permiten el estado gestacional |
| Lactógeno placentario | Sincitiotrofoblasto velloso | Ayuda al crecimiento fetal al influir en el metabolismo materno |
| Prolactina | Hipotálamo y endometrio | Diferenciación celular, regulación del crecimien-to trofoblástico, angiogénesis y regulación inmune |
| Relaxina | Sincitiotrofoblasto | Relajación del cuello gravídico para facilitar su dilatación y relajación uterina |
| Activina e inhibina | Sincitiotrofoblasto | Regulación de la hormona folículo estimulante (FSH) |
| Hormona del crecimiento placentario | Sincitiotrofoblasto | Estimula el paso de nutrientes a través de la placenta |
La hCG, es producida por el sincitiotrofoblasto velloso, es una hormona placentaria heterodimérica perteneciente a la familia glicoproteica entre las que se incluyen la hormona luteinizante (LH), la hormona folículo estimulante (FSH), y la hormona estimulante de la tiroides o tirotropina (TSH)12.
Compuesta por 2 cadenas unidas de forma no covalente, una subunidad alfa común para todas las proteínas de la familia, y una subunidad beta que difiere entre hormonas12; tiene 4 variedades, constituidas por moléculas independientes que son producidas por células distintas. La hCG se encuentra en su forma canónica, que es producida por las células de trofoblasto velloso, y cuyas funciones incluyen:
- 1.
Promover la producción de progesterona en el cuerpo lúteo previniendo la luteólisis. La hormona cuenta con una vida media de 37 horas y sólo promueve la producción de progesterona 3-4 semanas después de la implantación. Tiene un pico a la décima semana, y sigue produciéndose casi un mes después12,13.
- 2.
Promover la angiogénesis en la vasculatura uterina13.
- 3.
Permitir que las células del citotrofoblasto se fusionen, con la subsiguiente diferenciación del sincitiotrofoblasto. La hCG es una de las moléculas de producción más temprana, secretada por el embrión y el blastocito la produce antes de la implantación continuando el proceso el sincitiotrofoblasto13.
- 4.
Actuar sobre el sistema inmune materno. La hCG es un modulador inmune que regula la acción proinflamatoria. Induce al bloqueo de los macrófagos maternos impidiendo la invasión de las células placentarias y estimula a la producción de interleuquina 10 (IL-10), que funciona como regulador de los uNK, quienes se ven inducidos a la par por la producción de hCG, reduciendo la respuesta citotóxica que se pueda presentar en patologías como la preeclampsia13,14. Más aún, induce a la producción de otros reguladores inmunes como lo es la enzima indoleamina 2-3 dioxigenasa (IDO), que también disminuye la respuesta proinflamatoria14.
- 5.
Estimular el crecimiento uterino para que sea paralelo al crecimiento fetal promoviendo a su vez aparentemente el crecimiento de órganos fetales mediante el receptor hCG/LH expresado en el miometrio y en órganos fetales como el riñón, pulmón, intestino, bazo, e hígado13.
- 6.
Suprimir las contracciones miometriales durante el curso de la gestación induciendo a la proliferación miometrial y reduce su contractibilidad, regulando las uniones comunicantes que permiten el transporte de calcio12,13.
- 7.
Enviar señales al endometrio para permitir la implantación mediante una acción paracrina modula el medio ambiente uterino y lo prepara para la implantación12.
- 8.
Otras funciones: causa el crecimiento y la diferenciación del cordón umbilical; y actúa sobre receptores cerebrales causando hiperémesis gravídica13.
La hCG tiene acciones autocrinas y paracrinas. La autocrina envuelve el desarrollo del sincitiotrofoblaso, y la paracrina destaca acciones en la que el factor estimulante de colonias de macrófagos (M-CSF) disminuye, mientras que la citoquina especializada para la implantación del embrión (LIF), el factor de crecimiento proangiogénico (VEGF); y el regulador de la remodelación tisular (MMP-A), aumentan. Además de los efectos inmunes de la acción paracrina, ésta se extiende a tener un endometrio receptivo, y un blastocito funcional que permitan una implantación normal13.
Por otro lado, la hCG glicosilada que tiene una acción autocrina y es producida por las células del citotrofoblasto, promoviendo su crecimiento e invasión, pero estando implicada también en invasión de las células del coriocarcinoma. La sub-unidad beta libre, y la hCG pituitaria son las otras formas de la hCG14.
La sub-unidad beta libre es una variante monomérica glicosilada producida en malignidades tempranas no trofoblásticas, bloqueando la apoptosis en las células cancerosas promoviendo el desarrollo oncológico; mientras que la hCG pituitaria es producida siempre durante el ciclo menstrual, teniendo una acción similar a la de la HL14.
• Lactógeno placentarioEl hPL, es una hormona peptídica codificada por 5 genes estructurales relacionados ubicados en el brazo largo del cromosoma 17 (q22-q24)15. Con una homología del 85% con la hormona de crecimiento humana, es considerada la hormona de crecimiento fetal, al influir en el metabolismo materno haciendo que se genere un cambio con respecto al uso de carbohidratos como fuente principal, cambiándolos por los ácidos grasos; su pico se da al término de la gestación y la cantidad sintetizada igual a la masa placentaria16.
• ProlactinaLa prolactina es secretada por el endometrio decidualizado y persiste hasta el término de la gestación con un pico entre las 20 a 25 semanas, para que ahí en adelante los niveles sean bajos17. Se encuentran 2 tipos de prolactina, la pituitaria y la endometrial, las cuales tienen una secuencia de aminoácidos idéntica, pero cuyas funciones biológicas varían radicalmente.
La prolactina hipotalámica, producida por la glándula pituitaria, es inhibida por el hipotálamo, con un primer órgano blanco no endocrino, lo que hace que no tenga un feed back convencional, y actúa en la mayoría de las células del cuerpo con más de 85 funciones conocidas. Tiene efectos sobre el endometrio, cerebro, seno, piel, linfocito y adipocito. La prolactina se ve aumentada en la fase del proestro, el embarazo y el estrés18,19.
La prolactina es una de las hormonas más sintetizadas durante la decidualización. En un útero no gestante la síntesis de prolactina es detectada en la fase secretora, lo que coincide en la gestante con los primeros signos histológicos de decidualización18. La prolactina es controlada por la progesterona, la cual se ha evidenciado, si baja sus niveles reduce a la par los de prolactina a los 2 o 3 días, y cumple funciones en el embarazo de diferenciación celular, regulación del crecimiento trofoblástico, angiogénesis, y regulación inmune, relacionando su función endometrial con la activación de la vía kinasa Janus 2/ transductor de señal y activador de la transcripción tipo 3 (JAK2/STAT3), y teniendo como receptores hormonales miembros de la familia de las citoquinas clase I17.
• RelaxinaEs una hormona peptídica que se expresa en el cuerpo amarillo gravídico de la decidua y el trofoblasto20. La relaxina tiene efectos deciduales, de angiogénesis y de acción inmunológica; ya que aumenta la secreción de polimorfo nucleares, CD56+ (uNK), y CD68+ (macrófagos), en el endometrio, sin tener efectos sobre los linfocitos T CD321. Además se ha visto involucrada en el metabolismo de la glucosa, y se ha observado que es agonista del receptor glucocorticoide humano22.
El efecto más importante de esta hormona a nivel macro en el embarazo es la relajación del cuello gravídico para facilitar su dilatación, además de ser la responsable de la relajación uterina que incluye el miometrio, lo que contribuye a mantener en reposo al útero durante la gestación20. También tiene acciones antifibróticas, y regulación de la oxitocina pituitaria22.
En cuanto a sus niveles, la hormona se encuentra por debajo del nivel detectable durante los primero días del embarazo, empezando a subir desde el séptimo día, hasta el día 16 cuando alcanza la meseta; lo que podría coincidir con su colaboración en la decidualización. Además, las 48 horas previas al nacimiento han mostrado picos agudos de la hormona, que durante el parto disminuyen, a pesar de la relaxina decidual presente sobre la que tienen acción las prostaglandinas21,23.
• Activina e inhibinaSon proteínas diméricas pertenecientes a la familia del factor de crecimiento transformante beta (TGF-β), destacándose por su función biológica en el embarazo la inhibina A y la activina-A, siendo esta última producida por la placenta y membranas fetales, y cuyo receptor es un miembro de la familia serina-treonina quinasa24,25.
La importancia de esta última hormona radica en su asociación con la modulación de la secreción de FSH. En el ciclo menstrual, los niveles de activina aumentan en la fase lútea folicular (fig. 1). A la activina se le atribuyen acciones autocrinas y paracrinas26.
La secreción de inhibina y activina-A cambia en diferentes enfermedades gestacionales por lo que han cobrado relevancia clínica para el diagnóstico, prevención, pronóstico y seguimiento de diferentes patologías gestacionales, relacionándose como marcadores de la viabilidad trofoblástica, de tumores trofoblásticos, hipoxia fetal y la preeclampsia27.
• Hormona del crecimiento placentarioLa hormona del crecimiento placentario (PGH) es secretada por el sincitiotrofoblasto, y se encuentra en la circulación materna desde la semana sexta de gestación, e influencia al paso de nutrientes a través de la placenta. La hormona ejerce su efecto por mecanismos autocrinos y paracrinos regulados a través del factor de crecimiento de la insulina I (IGF-1), existiendo una correlación positiva entre el peso al nacer y el valor de PGH en embarazos de mujeres sanas, mientras que en embarazos de mujeres diabéticas suelen a disminuir dichos niveles; hay que recordar que es en el tercer trimestre donde se empiezan a presentar los problemas de resistencia a la insulina en el embarazo28.
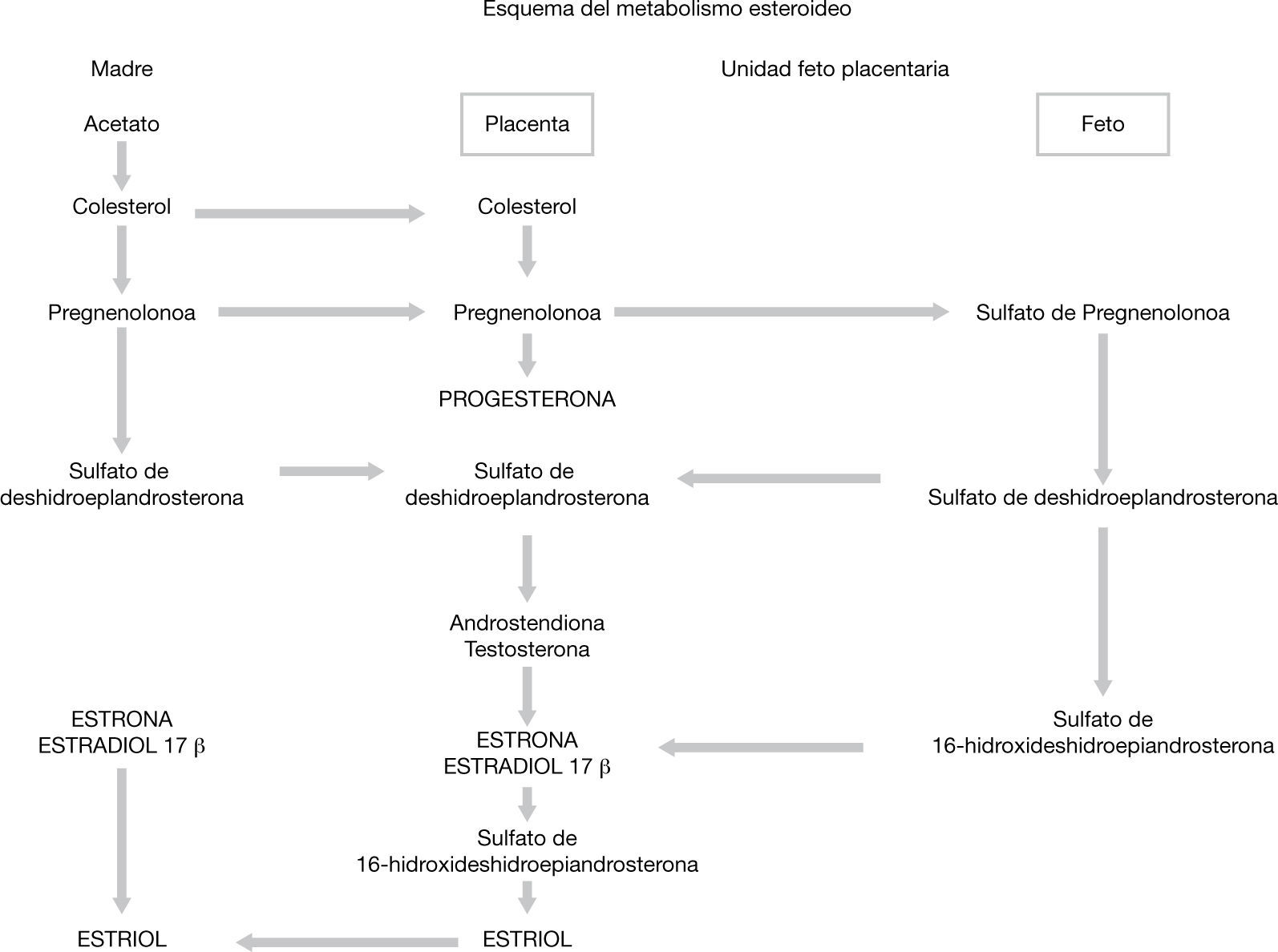
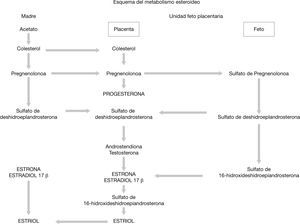
Regulación de la producción de las hormonas esteroideas por la placenta humanaLa placenta no puede sintetizar colesterol y toma este recurso de las lipoproteínas de baja densidad maternas29. Durante la gestación, los niveles de estrógenos aumentan, acelerando la síntesis de proteína, además, la producción de dehidroepiandrosterona (DHEA) en las glándulas adrenales aumenta drásticamente, y su sulfato (DHEAs), es el precursor principal de las hormonas esteroideas30.
La progesterona, el prostágeno más importante, induce cambios morfológicos y moleculares en el endometrio necesarios para la implantación embriogénica, ayudando también a la quietud miometrial y a la modulación del sistema inmune materno para que haya tolerancia de la madre hacia el feto; mientras que los estrógenos tienen efectos neovasculares, preparan al seno para la lactancia, y regulan de manera positiva los receptores LDL y las enzimas esteroidogénicas para la producción de progesterona29. La vía de síntesis de esteroides se resume en la figura 2.
• Hormonas tiroideasLa hormonas tiroideas juegan un papel importante en el embrazo, ya que pertenecen al grupo de hormonas que estimula el crecimiento fetal31. El feto recibe antes de la semana 16 la T4 materna, se ha comprobado que la placenta si de- ja pasar selectivamente hormonas tiroideas; desmintiendo la teoría de que no pasaban dichas hormonas. La transferencia maternofetal de hormonas tiroideas es regulada por transportadores presentes en la membrana celular del trofoblasto, y sus niveles intraplacentarios son regulados por deiodinasas D3 y D232,33.
Cabe anotar que la glándula tiroidea es la primera en desarrollarse (aproximadamente a la 5-6 semanas de gestación), pero su función comienza hasta la semana 14 o 16, con producción significativa a la semana 20. En cuanto a las hormonas tiroideas maternas, hay un aumento de T4 libres, en el primer trimestre el aumento de dicha hormona hace que disminuya FSH y que a su vez esa T4 eleve los niveles de hCG33.
DiscusiónLa placenta es un órgano endocrino bastante complejo, que a pesar catalogarse como “incompleto” debido a que no sintetiza colesterol para la síntesis de hormonas tiroideas, suple muchas funciones durante la gestación, y su papel es esencial para el desarrollo normal del embarazo. Algunos mecanismos endocrinologicos se ven relacionados con patologías placentarias y es allí donde empieza un efecto bola de nieve que termina en complicaciones gestacionales y perinatales.
Además, la placenta no trabaja sola, no se vale sólo de las hormonas que ella produce, sino que su acción también se ve influenciada por mecanismos endocrinológicos independientes, o vías inmunes34.
Citando un ejemplo de una hormona independiente, la adiponectina ha sido estudiada en el ámbito placentario por reducir la resistencia a la insulina en el embarazo, que muchas veces es asociada a procesos placentarios, observándose múltiples receptores de dicha hormona en los trofoblastos; como lo son dipoR1 y dipoR2, comprobándose además que la adiponectina no inhibe el desarrollo trofoblástico como se pensaba en un principio, razones que sugieren que si tiene un papel importante en el medio ambiente placentario35.
Patologías como el RCIU y la preeclampsia han sido relacionadas constantemente con los mecanismos endocrinológicos concernientes a la placenta, debido a que su etiología es el resultado de una interacción compleja de procesos, entre los que se podrían incluir los mencionados.
En cuanto al RCIU, cabe anotar que es el crecimiento fetal y la talla al nacer las que determinan la morbilidad y la mortalidad perinatal. El RCIU disminuye la supervivencia al nacer y genera un riesgo de que esos neonatos presenten enfermedades degenerativas cuando sean adultos36.
Mientras que en la preeclampsia, otra de las patologías gestacionales más complejas se ven implicados mecanismos como el de la renina-angiotensina-aldosterona, el cual si bien está claro su papel en una gestación normal, y en la preeclampsia no está definido su mecanismo totalmente, y varias hipótesis lo relacionan con la fisiopatología preeclámptica37.
Todos los mecanismos mencionados en la presente revisión y las funciones hormonales, son en conjunto los respon-sables para que haya un buen desarrollo fetal. Se debe ver a la placenta como un órgano trascendental a nivel metabólico fetal y materno que influye en todo aspecto en la evolución gestacional, siendo el punto blanco de estudio para investigar patologías gestacionales que sean de trascendencia poblacional.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.