Como otras formas de medicina, incluyendo la medicina complementaria y alternativa, la homeopatía provoca expectativas de los pacientes. La relación médicopaciente, el tratamiento personal y amplio, y la falta de efectos adversos, constituyen elementos para crear expectativas positivas. Otros elementos pueden asociarse a las expectativas negativas.
MétodosRealizamos una revisión sistemática de la bibliografía sobre los efectos placebo y nocebo en la acupuntura y la homeopatía, utilizando Medline.
ResultadosSe revisaron los hallazgos sobre los mecanismos psicofisiológicos y neuromediadores. Los estudios de dichos efectos revelan el modo en que pueden medirse las expectativas y el condicionamiento inconsciente mediante métodos de escáner y electroencefalografía. Ello deriva en efectos terapéuticos significativos y no específicos que pueden confundir la evaluación del tratamiento de los efectos terapéuticos específicos, dificultando la selección del simillimum.
ConclusionesSe abordan las orientaciones de la investigación futura sobre los efectos terapéuticos no específicos de la homeopatía, para mejorar la práctica y la investigación clínicas.
Like other forms of medicine, including complementary and alternative medicine, homeopathy elicits expectations in patients. The physician–patient relationship, personal and comprehensive treatment and lack of adverse effects are elements in creating positive expectations. Other elements may be associated with negative expectations.
MethodsWe conducted a systematic literature review on placebo and nocebo effects in acupuncture and homeopathy using Medline.
ResultsFindings on the psychophysiological and neuromediating mechanisms of the placebo-nocebo phenomenon are reviewed. Studies of these effects reveal how expectations and unconscious conditioning can be measured by imaging and electroencephalography methods. They result in signifi t, non-specifi therapeutic effects, which may confuse the evaluation of the specifi therapeutic effects treatment, hampering selection of the simillimum.
ConclusionsDirections for future research on non-specifi therapeutic effects of homeopathy to improve clinical practice and clinical research are discussed.
La homeopatía se basa en el principio de similitud, mediante la administración de sustancias tóxicas que causan síntomas similares en las personas sanas. A fin de minimizar el posible agravamiento de los síntomas de la enfermedad original que dicho tratamiento podría causar, Samuel Hahnemann propuso el método fármaco-técnico de la dinamización o potenciación (dilución en serie con sucusión) para reducir los efectos primarios de la medicación y desarrollar su poder “dinámico latente” (Organon, párrafo 269)1. Sin embargo, para que estas diluciones muy elevadas, con poder patogénico infinitesimal, despierten la reacción vital del organismo es necesario individualizar cada caso, y medicarlo con arreglo a la totalidad de los síntomas (Organon, párrafos 24-27, 162-165 y 211-213)1.
Para adquirir un conocimiento de las características idiosincrásicas del paciente, a fin de incrementar las probabilidades de éxito en la elección de una medicina individualizada, el médico homeopático toma una historia personalizada (Organon, párrafos 83-104)1 y solicita al paciente que le describa detalladamente las diversas clases de manifestaciones sintomáticas (locales, mentales, generales y físicas). Este proceso de individualización es gradual, pudiendo precisar un período prolongado de observación, con seguimiento y diferentes prescripciones, hasta lograr la medicación ideal (simillimum). En esta práctica médica humanística es probable que se incrementen los efectos terapéuticos no específicos de la relación médicopaciente, debido a las expectativas del paciente en cuanto al método terapéutico, que encajan con los efectos terapéuticos específicos de las medicinas, dificultando la evaluación del tratamiento en sí mismo, tanto en la práctica clínica rutinaria como en la investigación clínica.
La investigación científica moderna sobre el fenómeno placebo-nocebo subraya la necesidad de realizar una diferenciación entre estos efectos terapéuticos. El objetivo principal de un médico homeópata, quien busca la estimulación de la reacción vital del organismo, aplicando el principio de similitud de curación, es perfeccionar la selección de la medicina individualizada correcta (simillimum).
Esta revisión aborda los mecanismos psiconeurofisiológicos que modulan el fenómeno placebo-nocebo2,3, y su posible influencia sobre los índices de efectividad de la medicina complementaria y alternativa (homeopatía y acupuntura), realizando propuestas para el desarrollo de los ensayos clínicos homeopáticos para diferenciar los efectos específicos y los no específicos.
Material y métodosPara comprender más a fondo el fenómeno placebo-nocebo, y relacionarlo con los efectos no específicos del tratamiento homeopático, revisamos la bibliografía utilizando la base de datos Medline y las palabras clave “efecto placebo”, “efecto nocebo“, “efecto no específico”, “homeopatía”, “acupuntura” y “medicina complementaria y alternativa (CAM)”. Se seleccionaron las revisiones y documentos sobre los mecanismos psiconeurofisiológicos del fenómeno placebo-nocebo, y los efectos no específicos de la CAM, particularmente la homeopatía y acupuntura, y se extrajeron los principales aspectos de la evidencia descrita.
Evidencia científica del efecto placebo-noceboEn cualquier tratamiento farmacológico, los efectos terapéuticos tienen dos aspectos: los efectos específicos (dosificación, duración, medios de aplicación, farmacodinamia, farmacocinética, interacción entre medicaciones y otros) y efectos no específicos (historia y evolución natural de la enfermedad, regresión a la media, aspectos socioam-bientales, inter e intravariabilidad, deseo de curación y creencia en el tratamiento, relación médico-paciente, características no farmacológicas de la medicación y otros). El fenómeno placebo-nocebo forma parte del último grupo, donde la relación médico-paciente es un componente importante, de acuerdo con la investigación reciente4.
Se utilizan numerosos términos y definiciones para relacionar el espectro de los factores de tratamiento y los efectos asociados. Por ejemplo, Paterson y Dieppe5 prefieren los términos efectos característicos (es decir, efectos específicos) y efectos incidentales (es decir, placebo, efectos no específicos y contextuales), definiendo a los factores característicos como acciones o estrategias terapéuticas teóricamente derivados, y que se piensa que son causalmente responsables del resultado (es decir, un fármaco). Los factores incidentales son los muchos otros factores que también se ha visto que afectan al resultado, como la credibilidad de la intervención, las expectativas del paciente, el modo y estilo de consulta del profesional, y el ajuste terapéutico. En diseños aleatoriamente controlados, estos factores incidentales incluyen también una intervención simuladora o placebo.
Etimológicamente, la palabra placebo tiene su origen en el término latino placeo, placere, que signifi “agradar”, mientras que el término nocebo proviene del término latino nocere, que signifi “dañar”. En general, el efecto placebo se entiende como una mejoría de los síntomas y/o funciones fisiológicas del organismo, como reacción a factores no específicos y aparentemente inertes (es decir, sugerencia visual o verbal, píldoras inertes, cirugía fi y otros), atribuyéndose más comúnmente al simbolismo que ejerce el tratamiento sobre las expectativas positivas del paciente.
El efecto nocebo es el opuesto: la anticipación y expectativa de un resultado negativo puede originar el empeoramiento de un síntoma o enfermedad. Los ejemplos naturales del efecto nocebo son observables en el impacto de los diagnósticos negativos, desconfianza del paciente en el personal médico, o falta de confianza en un tratamiento. Los mecanismos neurofisiológicos se estudian de modo análogo al efecto placebo6.
Entre los factores medioambientales, sociales, psicológicos y metodológicos que interactúan en un ensayo clínico, deben tenerse en cuenta otros efectos no específicos como el efecto Hawthorne (mejora obtenida del mero hecho de que la persona esté sometida a observación clínica), los efectos beneficiosos del tratamiento adicional o el incremento de atención médica durante el estudio, la respuesta a la amabilidad o subordinación experimental (conociendo de antemano las respuestas que busca el investigador, el participante puede reportar beneficios cuando no se produce ninguno), los sesgos en la escala de medición hacia los resultados subjetivos (la escala de beneficios tiene mayor puntuación que la del empeoramiento de la situación), y otros. Estos mismos factores, a la contra, pueden inducir el efecto nocebo6.
De acuerdo a De Craen et al7, desde el primer ensayo clínico controlado por placebo en 1799, el efecto placebo aportó importantes lecciones a la ciencia médica, demostrando “la maravillosa y poderosa influencia de las pasiones de la mente en el estado y trastorno del cuerpo”. Con la introducción sistemática de los ensayos clínicos controlados por placebo, considerados los “tratamientos de referencia” para evaluar el efecto específico de los diferentes tratamientos, los frecuentes reportes de cambios clínicos significativos en el grupo placebo llevaron a la conclusión de que la intervención del placebo puede manifestarse mediante efectos no específicos importantes en las diversas situaciones clínicas.
Los metaanálisis han estudiado la respuesta placebo (porcentaje de mejoría), utilizando ensayos clínicos aleatorizados (ECA), en la enfermedad de Crohn (32 ECA; 19% efecto placebo)8, síndrome de fatiga crónica (29 ECA; 19,6%)9, síndrome de intestino irritable (45 ECA; 40%)10, colitis ulcerosa (38 ECA; 26,7%)11, trastorno depresivo mayor (75 ECA; 29.7%)12, manía (20 ECA; 31,2%)13, migraña (32 ECA; 21%)14, y otros.
En 2004, Hróbjartsson y Gøtzsche15 publicaron una revisión sistemática (156 ECA; 11.737 pacientes), comparando las respuestas de los pacientes que recibieron un placebo frente a aquellos que no lo recibieron, en 10 situaciones clínicas (es decir, dolor, obesidad, asma, hipertensión, insomnio, náuseas, depresión, ansiedad, fobia y adicción al tabaco), concluyendo que el efecto placebo es significativo solo en los tratamientos de dolor y fobia. En el reanálisis cualitativo de estas revisiones, Wampold et al16 demostraron que cuando los trastornos “son susceptibles a los placebos y el diseño es adecuado para detectar sus efectos, el efecto placebo es sólido y se aproxima al efecto del tratamiento”. Considerando las ambigüedades de los análisis previos, Hunsley y Westmacott17 confirmaron la existencia del efecto placebo en los mencionados estudios clínicos, y aseveraron que no puede descartarse simple y arbitrariamente como irrelevante o carente de importancia.
Reiterando estas conclusiones, una encuesta reciente aleatoria a nivel nacional18, en relación con la prescripción de placebo en la práctica clínica americana, con participación de 679 reumatólogos e internistas, demostró que casi la mitad de los médicos respondieron que prescribían regularmente diversos tratamientos placebo cuando se enfrentaban a situaciones clínicas y enfermedades no específicas.
En resumen, los muchos aspectos de la relación médicopaciente, desde la recepción hasta el contenido específico de los informes realizados por el médico, que influyen en las expectativas del paciente en cuanto a mejoría o empeoramiento de su situación clínica, pueden causar efectos no específicos.
Mecanismos psicofisiológicos del fenómeno placebo-noceboCondicionamiento inconsciente o clásicoEntre los mecanismos psicofisiológicos del efecto placebo, el condicionamiento inconsciente o clásico propone que la respuesta placebo aparece tras una exposición repetida de la persona a las asociaciones de las sugerencias neurosensoriales (p. ej., tipo de terapia, atmósfera de la consulta y otros) con los tratamientos eficaces (como morfina o tratamiento para el dolor). De acuerdo a un paradigma conductual o de Pavlov, las sugerencias neurosensoriales se desencadenan automáticamente y sin ayuda, tras una intervención placebo, como respuesta similar a la del tratamiento real. Ello estaría vinculado a la supervisión de las fluctuaciones del paciente en cuanto al estado de sus órganos internos vía feedback sensorial, mediante percepción visceral o somática, teniendo esta percepción una infl cia proporcional sobre la respuesta placebo. El efecto nocebo sería consecuencia de un condicionamiento inconsciente debido a las experiencias terapéuticas negativas19,20.
Estudiando el condicionamiento clásico en el sistema in-munológico, Olness y Ader21 condicionaron a los niños con lupus eritematoso sistémico tratados con ciclofosfamida aso- ciada a estímulos gustativos y olfativos, logrando una inmunosupresión con placebo durante 12 meses, administrándoles separadamente estímulos gustativos y olfativos. Goebel et al22, tras la inducción de inmunosupresión condicionada mediante una solución de sacarina con ciclosporina A, observaron una inmunosupresión por placebo (alteraciones en la interleucina-2 y el interferón gamma) tras la ingesta única de sacarina. En cuanto al sistema circulatorio, Benedetti el al23 demostraron que un condicionamiento previo, mediante dosis repetidas de buprenorfi que induce una hipoventilación moderada como efecto colateral, permitió que la analgesia placebo posterior imitara la misma depresión respiratoria. Esta respuesta respiratoria colateral al efecto placebo fue totalmente bloqueada mediante naloxona (antagonista opiáceo), lo que indica que estaba arbitrada por los mismos opiáceos endógenos de la principal respuesta analgésica al placebo. En el sistema endocrino, tras un condicionamiento previo con sumatriptán —un antagonista serotoninérgico que estimula la secreción de la hormona del crecimiento e inhibe la secreción de cortisol— la aplicación de un placebo estimuló los efectos del fármaco24.
Expectativa conscienteUn importante mecanismo psicológico inductor del placebo es la expectativa consciente de los pacientes en cuanto a la mejoría clínica. Esto puede reforzarse mediante sugerencias verbales durante el tratamiento.
Un modelo experimental ha evaluado el impacto clínico de las expectativas positivas y negativas, sin ayuda, en cuanto a revelar u ocultar al paciente la aplicación o suspensión del tratamiento (modelo abierto-oculto). Muchos estudios han reflejado que el mismo tratamiento es más eficaz cuando este se revela (abierto) que cuando no se revela (oculta) al paciente, lo que indica que la expectativa positiva (un efecto no específico) juega un papel esencial en el resultado del tratamiento. Considerando que el resultado clínico secundario de un tratamiento oculto representa el efecto específico sobre el propio tratamiento, despojado de cualquier contaminación psicológica, el resultado del tratamiento abierto representa la suma de los efectos terapéuticos específicos y no específicos. Se ha considerado la diferencia entre los efectos de los tratamientos abierto y oculto como la representación del efecto placebo, a pesar de no haberse administrado placebo alguno25,26. Del mismo modo, se evaluó la expectativa negativa al revelar u ocultar la interrupción del tratamiento27, lo que refleja que el grupo que conocía dicha interrupción experimentó un empeoramiento de los síntomas. La diferencia entre los efectos de la interrupción del tratamiento en los dos grupos refleja el efecto nocebo.
Condicionamiento inconsciente y expectativa conscienteEl condicionamiento inconsciente y la expectativa consciente son complementarios. Los estudios indican que son mecanismos sinérgicos en la inducción de la analgesia placebo, y el uno amplifica al otro.
Amanzio y Benedetti27 estudiaron la interacción entre estos dos mecanismos en sujetos, durante el período postoperatorio de la cirugía dental, con cuatro tipos de intervención: “expectativa” (aplicación de una solución salina con una sugerencia hablada de que era un potente analgésico”), “condicionamiento” (2 días de condicionamiento en los que la morfi se asoció a una solución salina, informándose a los pacientes que se trataba de un “antibiótico limpiador sanguíneo“), “expectativa + condicionamiento” y “no tratamiento” (grupo de control). Comparados con el grupo de control, los grupos de “expectativa” y “condicionamiento” manifestaron un incremento signifi de la tolerancia al dolor, mientras que el grupo que recibió “expectativa + condicionamiento” manifestó el doble de tolerancia al dolor que la manifestada por los grupos que recibieron intervenciones aisladas.
Al proponer un modelo que añada el deseo a la expectativa consciente (modelo deseo-expectativa)28, los estudios sugieren que la respuesta placebo podría estar dominada por objetivos, deseos, expectativas y emociones asociadas. Añadiendo el condicionamiento inconsciente a este modelo, los experimentos reflejan que la percepción somática de los cambios internos desencadena un feedback positivo de estos factores, seleccionando un sentimiento emocional más positivo (o menos negativo) para evitar experiencias aversivas, u obtener experiencias deseables19. De modo análogo, las dinámicas mentales negativas estimulan las respuestas nocebo.
Mecanismos neuromediadores de la respuesta placebo-noceboFenómenos dolorososLa respuesta analgésica al placebo está arbitrada por opiáceos péptidos endógenos (endorfinas), que actúan en los mismos espacios receptores que los opiáceos analgésicos exógenos (morfina), localizados en regiones específicas del cerebro (bulbo raquídeo, tálamo y médula espinal). Esta hipótesis fue confirmada por una secuencia de experimentos que probaron que la respuesta analgésica al placebo estaba bloqueada por una infusión de naloxona, un antagonista de los receptores opiáceos29.
Entre los mecanismos moduladores de la analgesia placebo, se postula que la expectativa de la disminución del dolor estimula la producción de opiáceos endógenos, mientras que el condicionamiento inconsciente activa subsistemas específicos insensibles a la naloxona. El efecto placebo analgésico puede estar modulado también por la estimulación de los circuitos dopaminérgicos y la inhibición de los circuitos dependientes de la prostaglandina y colecistoquinina.
En un modelo experimental sobre dolor inducido por calor, se analizaron los efectos neurofisiológicos de los analgésicos opiáceos y placebo en voluntarios sanos mediante tomografía por emisión de positrones (PET), comparándose las áreas activadas del cerebro30. Tanto el placebo como el antagonista opiáceo (remifentanilo) activaron las áreas específicas cerebrales, lo que sugiere una relación directa entre ambos tipos de analgesia: corteza medial prefrontal (corteza cingulada anterior), corteza orbitofrontal prefrontal (corteza somatosensorial) y el sistema opiáceo del bulbo raquídeo (materia gris periacueductal [PAG]). En los grupos de analgesia placebo, el incremento de la actividad de la corteza cingulada anterior se produjo solo en pacientes independientemente identificados como receptivos al placebo.
En dos experimentos con resonancia magnética funcional (RMf), Wager et al31 observaron una disminución del dolor con la aplicación de una crema placebo en los brazos de los pacientes sometidos a electrochoque, coincidente con un incremento de la actividad cerebral de la corteza orbitofrontal prefrontal, la corteza dorsolateral prefrontal, la corteza medial prefrontal y PAG (regiones vinculadas a la modulación emocional y la anticipación a los fenómenos dolorosos), y una disminución de la actividad cerebral en el tálamo, corteza anterior insular y corteza cingulada anterior (regiones ligadas al dolor).
De modo similar, Price et al32 mapearon la actividad cerebral (utilizando RMf) justo después de aplicar analgesia placebo a pacientes con síndrome intestinal irritable, observando el efecto de la sugerencia hablada (expectativa positiva) sobre la disminución de la actividad neuronal en las áreas cerebrales ligadas al dolor (es decir, tálamo, corteza insular anterior y corteza cingulada anterior), con un incremento simultáneo de la actividad cerebral en las áreas responsables de la modulación emocional del dolor (es decir, corteza cingulada anterior, amígdala lateral y PAG).
Ampliando la comprensión del circuito neuronal de la analgesia placebo, Fricchione y Stefano33 observaron que la corteza dorsolateral prefrontal juega un papel en el mantenimiento y refinamiento de las representaciones internas de las expectativas, activando las otras regiones cerebrales únicamente después. Las expectativas positivas hacia la analgesia estimularían después la corteza dorsolateral prefrontal, que luego activaría simultáneamente la corteza medial pre-frontal, la corteza orbitofrontal prefrontal (anticipación al dolor), y el sistema opiáceo del bulbo raquídeo (PAG), zonas responsables de la modulación emocional del dolor.
En cuanto al efecto nocebo hiperálgico, los estudios experimentales reflejan que la percepción de la intensidad de los estímulos dolorosos se magnifica tras una expectativa negativa (sugerencia hablada) del incremento de dolor, y que muchas regiones cerebrales (p. ej., corteza orbitofrontal prefrontal, corteza anterior cingulada y corteza anterior insular) manifiestan un incremento de actividad durante la anticipación al dolor. Estas alteraciones cerebrales son opuestas a las halladas durante la inducción de una expectativa positiva de disminución del dolor34.
Keltner et al35 hallaron que el nivel de intensidad de la expectativa dolorosa mediante un estímulo de calor (efecto nocebo hiperálgico) cambia la intensidad del dolor percibido, a la vez que activa las regiones cerebrales visualizadas mediante RMf; la expectativa negativa secundaria de un estímulo visual doloroso de alta intensidad activó diversas regiones cerebrales (tálamo, corteza insular anterior, corteza cingulada anterior, corteza somatosen-sorial, amígdala, estriación ventral y núcleos cuneiformes del bulbo raquídeo) en mayor medida que los estímulos visuales dolorosos de baja intensidad. Una investigación reciente similar atribuye un importante papel al hipocampo izquierdo en la hiperalgesia nocebo36.
Enfermedad de ParkinsonEn 2002, Pollo et al37 estudiaron la influencia de las expectativas positivas y negativas en la función motora de los pacientes con enfermedad de Parkinson, a quienes se les habían implantado electrodos con núcleos subtalámicos (STN) para estimular el cerebro profundo, un tratamiento paliativo de los síntomas motores de la enfermedad (temblor, rigidez muscular y lentitud de movimientos). Utilizando un analizador de movimiento, evaluaron el efecto de la estimulación subtalámica sobre la velocidad de movimiento de la mano derecha, observando movimientos más rápidos cuando la estimulación se asociaba a las expectativas positivas de mejora (efecto placebo), y más lentos con expectativas negativas (efecto nocebo). Estos efectos opuestos se producían en minutos, lo que indica que la expectativa induce rápidamente los cambios neuronales. Confirmando estos resultados, otros estudios indican que, entre los síntomas motores, la bradiquinesia es más sensible a las sugerencias habladas que el temblor y la rigidez, desconociéndose aún los mecanismos neurofisiológicos6,24.
Utilizando PET con marcación de raclopride (un antagonista de los receptores dopaminérgicos), De la Fuente-Fernández et al38 estudiaron el efecto placebo en pacientes con enfermedad de Parkinson. Como respuesta a las inyecciones subcutáneas de solución salina, se liberaron cantidades importantes de dopamina endógena (DA), presumiblemente desde las sinapsis del núcleo caudado y el putamen, expeliendo raclopride desde los receptores dopaminérgicos de la zona.
Esta liberación de DA fue superior en los pacientes que percibieron una mejoría con el placebo (receptivos al placebo), que en aquellos que no la percibieron. El incremento de DA endógena liberada sugiere que el efecto placebo en la enfermedad de Parkinson está arbitrado por la activación de DA nigroestriatal, incluso cuando este sistema está deteriorado en esta enfermedad. El placebo indujo un cambio en la concentración del antagonista de raclopride, comparable al producido por las dosis terapéuticas de levodopa. Los autores piensan que la expectativa relativa a la anticipación de mejoría terapéutica, junto con la liberación de DA endógena, puede ser un fenómeno común del efecto placebo en cualquier alteración clínica receptiva al placebo.
DepresiónSe evaluó la magnitud de la respuesta placebo en el tratamiento del trastorno depresivo mayor en una revisión sistémica de 75 estudios controlados por placebo12, que demostró que el grupo de placebo manifiesta un efecto terapéutico medio del 29,7%, mientras que el grupo activo manifiesta el 50,1%. Sysko y Walsh13 evaluaron el efecto placebo en el tratamiento del trastorno bipolar (litio, risperidona), encontrando una respuesta terapéutica similar del 31,2% en el grupo placebo, en comparación al 55,9% en el grupo activo.
Los recientes metaanálisis39,40 que han evaluado la eficacia clínica de las medicaciones antidepresivas en el tratamiento de los trastornos depresivos mayores concluyeron que no existe una diferencia significativa en comparación al placebo en los pacientes con depresión moderada, y solo “una diferencia relativamente pequeña en los pacientes con depresión muy grave”, probablemente porque manifestaron una disminución de la respuesta al placebo. Esta evidencia cuestiona los estudios que utilizan antidepresivos (grupo de control) como medida de eficacia en otros tratamientos.
A fin de distinguir los cambios en la actividad cerebral causados por el tratamiento placebo en pacientes depresivos, Leuchter et al41 realizaron un ensayo clínico en pacientes con trastorno depresivo mayor, tratados con antidepresivos o placebo durante 9 semanas, que luego clasifi como “receptivos a antidepresivos”, “receptivos a placebos”, “no receptivos a antidepresivos” y “no receptivos a placebos”. Utilizando la electroencefalografía cuantitativa (qEEG) para evaluar la actividad cerebral antes y después del tratamiento, observaron que mientras el grupo de pretratamiento no presentaba diferencia en la qEEG, el grupo “receptivo al placebo” manifestó un incremento considerable de cordancia prefrontal (una medición de la actividad electroencefalográfica que muestra una fuerte correlación con la perfusión cerebral cuantifi por PET). Esta alteración se observó antes del tratamiento, no detectándose en el grupo no receptivo o el grupo “receptivo a antidepresivos”, que reflejaron una disminución de la cordancia en la corteza prefrontal.
Utilizando PET para estudiar la respuesta placebo en el metabolismo regional de la glucosa cerebral en varones con trastorno depresivo mayor, Mayberg et al42 realizaron un ensayo clínico controlado por placebo a doble ciego, en el que se compararon los efectos de la fluoxetina con los del placebo.
Se observó la remisión de los síntomas en aproximadamente la mitad de de cada grupo que completó el estudio. Se observó que la respuesta placebo estaba asociada a un incremento del metabolismo de la glucosa en la corteza prefrontal, corteza cingulada anterior, corteza parietal, corteza insular posterior y corteza cingulada posterior, y a una disminución del metabolismo en la corteza cingulada subgenual, tálamo y parahipocampo. Los sujetos que respondieron a la fluoxetina mostraron un patrón metabólico similar, que sugiere una posible involucración de la serotonina en los efectos antidepresivos de la inducción de placebo. Petrovic et al30, en un estudio mencionado anteriormente, observaron cambios similares en el metabolismo de la glucosa cerebral.
Integración de los mecanismos psiconeurofisiológicos en el fenómeno placebo-noceboDe acuerdo a Benedetti et al6 hay suficiente evidencia para afi que la expectativa positiva activa los opiáceos endógenos y las interconexiones moduladoras del dolor, disminuyendo la transmisión y las rutas del dolor, induciendo la liberación de dopamina al striatum, y afectando a la actividad de las neuronas individuales del STN. En la depresión existe cierta evidencia experimental en cuanto a que diferentes regiones del cerebro vinculadas a la serotonina están implicadas en la respuesta placebo.
Por contra, la evidencia experimental indica que las sugerencias negativas habladas inducen ansiedad anticipatoria acerca del incremento del dolor, activando los sistemas colecistoquinérgicos que facilitan la transmisión del dolor y disminuyen la actividad de los opiáceos endógenos, promoviendo una hiperalgesia nocebo. También se ha demostrado que el efecto nocebo afecta a otras situaciones clínicas, como la enfermedad de Parkinson.
Basándose en el hecho de que la expectativa puede estar vinculada a la activación tónica de las neuronas dopaminérgicas, proyectada al striatum dorsal, el striatum ventral y la corteza prefrontal, De la Fuente-Fernández et al20 propusieron que cuando cualquier intervención placebo crea una expectativa positiva de recompensa, las neuronas de la corteza prefrontal se activan por la probabilidad de su ocurrencia; dichas células envían a las neuronas dopaminérgicas de todo el cuerpo impulsos directos que excitan al glutamato e inhiben los impulsos indirectos de GABA (ácido gammaaminobutírico), siendo la combinación de estas señales la que determina su activación tónica. Las neuronas de la corteza prefrontal, striatum dorsal y striatum ventral muestran también una activación tónica durante la expectativa de recompensa. También existe la activación dopaminérgica fásica, que se produce tras la recompensa efectiva, que es fuertemente inesperada, en particular.
Combinando ambos mecanismos, Fricchione y Stefano33 propusieron que la convicción de una expectativa positiva puede inducir un cambio en la actividad de la corteza prefronal, cuyo feedback estimula el flujo de DA desde el fascículo medial hasta el tegumento ventral. Los receptores en el striatum dorsal (núcleos caudados y putamen), en el striatum ventral (núcleos basales) y en las cortezas prefrontal medial, orbitofrontal y dorsolateral registrarían este cambio tónico en la DA.
Al mismo tiempo, la activación de la corteza prefrontal por la expectativa positiva puede estimular también el sistema opiáceo del bulbo raquídeo (PAG).
Añadiendo una reacción al estrés y óxido nitroso (NO) al mecanismo de respuesta placebo, estos autores33 proponen que, inducido por la expectativa de mejoría generada en la corteza prefrontal por el estímulo sensorial talámico, el mensaje es transmitido por los tractos corticolímbicos estriatales a los núcleos basales, donde muchos mediadores pueden trabajar a través del NO para liberar el flujo de dopamina a los circuitos de movimiento, recompensa y motivación. Por ello, el poder de convicción y expectativa consciente positiva, a los que está vinculado el efecto placebo, alteran el patrón neuroquímico en áreas cerebrales clave, responsables del movimiento (striatum), placer (núcleos basales) y dolor físico o psicológico (corteza cingulada anterior), desatando una respuesta placebo evidente en la enfermedad de Parkinson, como trastornos depresivos y dolorosos, respectivamente. Sin embargo, el sistema dopaminérgico mesolímbico-mesocortical se sitúa también bajo el control superior del eje de estrés (hipotálamo-pituitaria-locus coeruleus adrenal y amígdala), lo que sugiere que la expectativa positiva puede modificar la respuesta al estrés y transmitir el efecto placebo a muchas alteraciones como la hipertensión, enfermedad cardiaca coronaria y enfermedad intestinal inflamatoria, entre otras.
Sensibilidad individual al efecto placeboSe han realizado algunos estudios experimentales controlados (incluyendo un grupo de control “sin tratamiento”) en el campo de la analgesia placebo, con la intención de medir la sensibilidad de las personas a la respuesta placebo. En un ensayo clínico sobre el dolor secundario en intervenciones dentales, el 39% de los sujetos manifestó una respuesta analgésica al placebo43. En un estudio que utiliza un modelo de dolor isquémico en voluntarios sanos, el 26,9% de los sujetos tratados respondieron a la analgesia placebo, en comparación a un gran grupo de control de sujetos no tratados y no receptivos44.
Los estudios experimentales han demostrado que un pequeño subgrupo de personas muestra una respuesta placebo de alta intensidad, mientras que otro subgrupo no muestra ninguna respuesta a la intervención con placebo43,44. En la búsqueda de rasgos de personalidad que predigan la receptividad o no receptividad de una persona al efecto placebo, se han investigado ciertas características psicológicas como la sugestionabilidad, aquiescencia, ansiedad y susceptibilidad a la hipnosis, sin resultados consistentes. Pero un estudio controlado encontró una relación positiva entre la sugestio-nabilidad y la magnitud de la analgesia placebo45.
Magnitud del efecto placeboAlgunos estudios han demostrado que la magnitud de la respuesta está ligada al tipo de intervención placebo, porque acciona la expectativa del paciente. Debido a la magnitud de sus efectos adversos, los placebos activos (fármacos sin ninguna acción sobre el sistema fisiológico en estudio) son más efectivos que los inertes, mientras que la respuesta placebo es proporcional a la efectividad del fármaco con el que se compara46.
Los pacientes sometidos a una cirugía placebo, creyendo que se les estaba realizando una intervención real, manifestaron mejorías similares a los pacientes que fueron operados realmente47. De acuerdo a estos estudios, se podría conjeturar que la polifarmacia estimularía un efecto placebo más sólido que la monoterapia. Igualmente, un tratamiento no convencional, que popularmente se considera débil y solo eficaz a largo plazo (p. ej., la homeopatía), podría estimular un efecto placebo menos intenso que un tratamiento convencional fuerte y de acción rápida.
Utilizando grupos de control, muchos estudios hallaron que la magnitud media del efecto analgésico placebo para las personas se sitúa alrededor de 2/10 unidades en una escala analógica visual, o de alrededor del 20%25,48,49.
Buscando una relación entre las variables de la sensibilidad individual y la magnitud, Benedetti44 concentró su investigación en el subgrupo sensible, receptivo a la analgesia placebo, hallando un efecto placebo medio de 5/10 unidades en la escala numérica, o de alrededor del 50% de mejoría.
Duración de la intervención frente a magnitud del efecto placeboNo existen prácticamente estudios que investiguen la relación entre la duración de la intervención placebo y la magnitud de la respuesta placebo. Se precisaría de ellos para diseñar ensayos clínicos controlados por placebo más amplios, necesarios para la evaluación de la eficacia y efectividad de los tratamientos en las enfermedades crónicas.
Dado este vacío experimental, quedan todavía muchas cuestiones por responder, si se permite distinguir entre los efectos específicos y los no específicos: ¿cuál es la duración del efecto placebo tras una intervención simple? ¿Es la magnitud del efecto placebo directamente proporcional a la duración de la intervención respectiva, o puede convertirse en un efecto nocebo cuando existen expectativas frustradas? ¿Cómo interfiere el efecto placebo en la evolución a medio plazo de las enfermedades crónicas?
Medición del efecto placebo en la investigación clínicaPara distinguir y medir los muchos efectos no específicos, multifactoriales y altamente heterogéneos involucrados en cualquier terapia, los ensayos clínicos deberían incorporar las evaluaciones realizadas desde diferentes perspectivas, para realizar las interpretaciones del fenómeno más seguras y menos susceptibles de confusión y sesgo del análisis50.
En un esfuerzo por evaluar la influencia de un posible condicionamiento inconsciente de los resultados, es importante vigilar la experiencia previa de los pacientes con tratamientos similares. Debería incorporarse a los protocolos de investigación la revaluación periódica de las expectativas de los pacientes, en relación con los resultados clínicos de cualquier tratamiento. Las sugerencias a las que se expone el paciente (familiares, amigos, médicos, etc.) pueden alterar también las expectativas relativas al tratamiento y deben investigarse.
En ausencia de un grupo de control (evolución natural, sin tratamiento), deberán investigarse también otros factores no específicos que podrían influir en el efecto terapéutico, como cambios estacionales, regresión al medio, efecto Hawthorne, efectos beneficiosos del tratamiento adicional o atención médica, deferencia, amabilidad o consideración hacia el médico, sesgo en la escala de medición de los resultados subjetivos, etc.
Efectos terapéuticos no específicos de la medicina complementaria y alternativa (homeopatía y acupuntura)Casi la mitad de la población mundial ha utilizado la CAM51–54, incluyendo acupuntura, homeopatía y fitoterapia entre otras prácticas terapéuticas, en particular los pacientes que tienen cáncer55–59.
El principal motivo de acudir a la CAM es el descontento con la medicina convencional (mala relación médico-paciente, acercamiento fragmentario al proceso salud-enfermedad y efectos adversos a los fármacos) y la consecuente búsqueda de un modelo terapéutico que priorice la relación médico-paciente, aprecie a la persona en su totalidad y tenga menos efectos secundarios52–62. Además de estos aspectos, los pacientes con cáncer acuden a la CAM para estimular las defensas del organismo, reportando grandes niveles de satisfacción. Se ha observado que el uso previo de la CAM es predictivo del uso actual55–59.
La homeopatía, con su relación médico-paciente diferenciada y humanizada, (que es necesaria para comprender la totalidad sintomática característica y la individualización de la medicina)63, se asocia a la curación de “la persona completa”, y está libre de efectos adversos, pudiendo influir positivamente en las expectativas de los pacientes64–67. Esto puede estimular la actividad de las áreas cerebrales específicas y la liberación de neurotransmisores específicos, originando efectos terapéuticos no específicos independientemente de la correcta individualización de la medicina homeopática (efectos terapéuticos específicos).
Junto a estas expectativas podría existir una experiencia positiva del uso de la homeopatía, que origine un condicionamiento inconsciente que impulse el efecto placebo del enfoque homeopático, incluyendo las alteraciones en los parámetros bioquímicos.
Se han reportado algunos estudios sobre acupuntura y homeopatía con el objetivo de distinguir los efectos específicos de los no específicos en la CAM. Utilizando un diseño cruzado aleatorio y a doble ciego con 14 pacientes con osteoartritis dolorosa, y escáner PET, Pariente et al68 exploraron los efectos cerebrales de las punciones y la expectativa de alivio del dolor (efecto terapéutico no específico) con acupuntura real, acupuntura placebo (acupuntura simulada) y pinchazos cutáneos. La ínsula ipsilateral en el lugar de punción se activó durante la acupuntura real en mayor medida que durante la intervención placebo. La acupuntura real y el placebo (con la misma expectativa de efecto que la acupuntura real) causa una mayor activación que los pinchazos cutáneos (sin expectativa de efecto terapéutico) en la corteza dorsolateral prefrontal derecha, corteza cingulada anterior y mesencéfalo.
Para investigar los efectos terapéuticos específicos de la acupuntura, Lewith et al69 realizaron una revisión sistemática de la bibliografía, en busca del efecto de la acupuntura sobre la activación cerebral, con mediciones de RMf y PET. Se producen áreas de activación y desactivación cerebral ampliamente predecibles al considerar las funciones tradicionales chinas atribuibles a ciertos puntos específicos de acupuntura (p. ej., los puntos asociados a la audición y visión estimulan las áreas cerebrales auditiva y visual, respectivamente). De modo análogo, los estudios que utilizan qEEG identificaron alteraciones de la actividad cerebral (en la corteza prefrontal) en los pacientes receptivos al tratamiento homeopático individualizado70,71.
En algunos ECA, se compararon los efectos analgésicos de la acupuntura verdadera y el placebo en diferentes situaciones dolorosas (p. ej., migraña, dolor crónico lumbar y osteoartritis), y las expectativas de los pacientes sobre los resultados terapéuticos. El grupo de pacientes que creían que habían recibido acupuntura verdadera reflejaron una mejoría clínica superior a aquellos que pensaban que estaban en el grupo placebo72. Los pacientes con grandes expectativas sobre los efectos de la acupuntura reflejaron más respuesta que aquellos que no creían en el tratamiento, independientemente del grupo de tratamiento73.
Buscando la distinción y medición de los componentes del efecto placebo (efectos terapéuticos no específicos) en la acupuntura, Kaptchuk et al4 realizaron un ECA en 262 pacientes con síndrome de intestino irritable. El ensayo tenía tres ramas: lista de espera (evaluación y observación: efecto Hawthorne), únicamente acupuntura placebo (interacción “limitada” con un médico), o acupuntura placebo con relación médico-paciente “incrementada” con amabilidad, atención y confianza. Los pacientes continuaron con las medicaciones y el régimen terapéutico previos. Los tres grupos manifestaron mejorías significativas, progresivas y similares en los resultados analizados, siendo los resultados similares, a las 6 semanas de seguimiento: a) escala global de mejoría: 3,8 (desviación estándar [DE], 1,0) frente a 4,3 (DE, 1,4) frente a 5,0 (DE, 1,3), respectivamente; b) porcentaje de pacientes con alivio adecuado de los síntomas: 28 frente a 44 frente a 62, respectivamente; c) cambio en la puntuación de la gravedad de los síntomas: 30 (63) frente a 82 (89), respectivamente, y d) cambio en la calidad de vida: 3,6 (8,1) frente a 4,1 (9,4) frente a 9,3 (14,0), respectivamente.
Los autores concluyeron que “los factores que contribuyen al efecto placebo pueden combinarse progresivamente de manera similar a la clasificación de la intensidad de la dosis de las piezas componentes y efectos no específicos, que pueden producir resultados significativos a nivel estadístico y clínico, siendo la relación médico-paciente el componente más sólido”. El porcentaje de pacientes que reporta un alivio adecuado (el 62 y el 61% a las 3 y 6 semanas, respectivamente) es comparable al índice de respondedores en los ensayos clínicos sobre los fármacos actualmente utilizados en el tratamiento del síndrome de intestino irritable. Esto se debe probablemente a la gran expectativa que suscita la punción en los pacientes (un importante placebo ‘activo’). Se observó una respuesta placebo a diversas prácticas de la CAM para el síndrome de intestino irritable en cerca del 40% de los pacientes, en un metaanálisis74 de 19 ECA.
Esta hipótesis fue reforzada por una reciente ECA75 que evaluó el efecto de la acupuntura en el tratamiento del dolor de espalda en 638 pacientes. A las 8 semanas de tratamiento, el 60% de los pacientes sometidos a acupuntura placebo y acupuntura verdadera manifestaron mejorías considerables. En la tercera rama del estudio, solo el 39% de los pacientes que recibían tratamientos convencionales manifestaron mejorías significativas (un 60% frente al 39%; p < 0,001).
En homeopatía, Fisher et al76 desarrollaron un modelo de estudio para distinguir los efectos terapéuticos específicos de los no específicos. Se distribuyeron aleatoriamente 75 pacientes adultos con dermatitis en un ensayo de 4 ramas durante 12 semanas: control de lista de espera; homeopatía verdadera abierta; homeopatía verdadera de doble ciego; y homeopatía placebo de doble ciego. Con este diseño de estudio, los autores trataron de esclarecer la importancia relativa de los efectos específicos y no específicos de los tratamientos en la práctica homeopática rutinaria: el efecto específico de las medicinas homeopáticas (comparación entre homeopatía verdadera y placebo), el efecto del “paquete de cuidados” homeopáticos (comparación entre homeopatía verdadera abierta y control de lista de espera), y el efecto ciego (comparación entre los grupos ciego y no ciego). Ninguna medición de los resultados reflejó diferencias estadísticamente significativas entre los grupos, y los autores concluyeron que era improbable que este diseño discriminara las contribuciones relativas de los efectos no específicos y específicos del tratamiento homeopático, debido a que los resultados estaban fuertemente confundidos por el abandono diferencial entre los grupos (existía más probabilidad de abandono por parte de los pacientes de tipo ciego).
DiscusiónCon seguridad, los aspectos no específicos (p. ej, desilusión por otro tratamiento, efectos adversos, tratamiento holístico, relación médico-paciente diferenciada) pueden contribuir a las expectativas positivas (efecto placebo) en pacientes que buscan el tratamiento homeopático; otros aspectos (marginalización de la homeopatía, actitudes negativas de los medios y otros médicos, debilidad y durabilidad del tratamiento, necesidad de cambiar los hábitos establecidos) contribuyen a la formación de expectativas negativas (efecto nocebo), dificultando la evaluación sobre cuáles de estos efectos son dominantes.
Teniendo en consideración la evidencia mencionada, parece muy importante comprender los efectos no específicos del tratamiento homeopático a través de la investigación científica.
Siguiendo el modelo de los estudios previos68–71, deberán formularse las investigaciones con métodos modernos de evaluación de la actividad cerebral (RMf, PET, qEEG etc.) para mapear y distinguir las áreas cerebrales activadas por los distintos efectos terapéuticos. Deberán realizarse ensayos clínicos controlados, con diseños específicos77,78, para responder a las cuestiones relativas al efecto placebo en el tratamiento homeopático.
Como ya se ha realizado para la acupuntura4, las ramas de ensayo deberán dirigirse hacia los diversos efectos no específicos del tratamiento homeopático (expectativa, efecto Hawthorne, regresión al medio), los grupos de tratamiento deberían incluir la lista de espera, y únicamente homeopatía placebo, y la homeopatía placebo con un incremento de la relación médico-paciente, etc. Podría incorporarse a los pacientes que reciban tratamiento convencional para comparación, sin violar los principios éticos de la investigación clínica. Los estudios a largo plazo, con evaluaciones periódicas, tendrían una importancia fundamental para evaluar la relación entre la duración de la intervención placebo y la magnitud de su efecto, así como su influencia sobre la evolución de las enfermedades crónicas.
Deberán incluirse las cuestiones acerca de la expectativa de los pacientes sobre el resultado del tratamiento79 y el uso previo de la homeopatía (condicionamiento inconsciente). Debido a la relación directa entre la expectativa y el efecto placebo-nocebo, las evaluaciones periódicas de las expectativas positivas o negativas (p. ej., escala de patrón numérico de las expectativas) permitirían distinguir entre los efectos terapéuticos específicos y los no específicos, posibilitando la discriminación de: a) efecto terapéutico específico de la medicina homeopática, cuando hay una mejoría en los resultados de los pacientes que reportaron, previamente, una expectativa negativa del tratamiento, y b) efecto terapéutico no específico de la dinámica homeopática, cuando hay una mejoría evidente en los resultados de los pacientes que reportaron, previamente, una expectativa positiva del tratamiento.
En la evaluación del efecto placebo global en el tratamiento homeopático, los ECA para enfermedades crónicas deberían priorizar la individualización del tratamiento homeopático. De acuerdo con este enfoque, existen dos métodos para obtener la individualización de la medicina en estos diseños de estudio: la individualización antes de la aleatorización de los pacientes, mediante la selección de los pacientes que muestran síntomas característicos (ideas clave) de la medicina80, o conocimiento previo de su medicina simillimum81,82, o la individualización tras la aleatorización de los pacientes, con un largo seguimiento y ajuste del tratamiento.
El primer método permite disminuir el abandono de los pacientes debido al menor tiempo de seguimiento (validez interna). El segundo método responde a muchas cuestiones planteadas por la práctica homeopática rutinaria (validez externa), como: ¿Cuál es la efectividad del método semiótico utilizado (anamnesis, recopilación y jerarquización de los síntomas)? ¿Qué tiempo de seguimiento se precisa para lograr la debida medicina individualizada? ¿Cuál es la precisión de la selección de los simillimum?
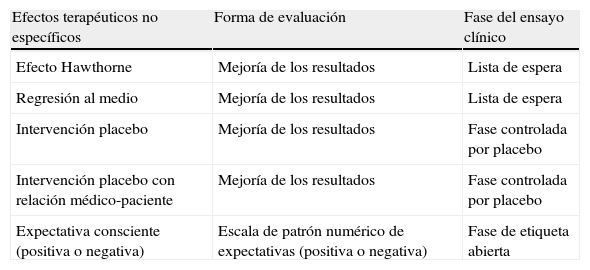
Para disminuir el número de abandonos en el seguimien-to a largo plazo, que confunde el análisis estadístico de los ECA, se sugiere la incorporación de una fase abierta (fase de etiqueta abierta) tras una fase inicial controlada por placebo, con evaluación cuantitativa y cualitativa periódica de los resultados y posibles efectos terapéuticos no específicos (tabla 1), que permita la distinción entre los diversos componentes de los efectos terapéuticos.
Evaluación de los efectos terapéuticos no específicos en ensayos clínicos homeopáticos
| Efectos terapéuticos no específicos | Forma de evaluación | Fase del ensayo clínico |
| Efecto Hawthorne | Mejoría de los resultados | Lista de espera |
| Regresión al medio | Mejoría de los resultados | Lista de espera |
| Intervención placebo | Mejoría de los resultados | Fase controlada por placebo |
| Intervención placebo con relación médico-paciente | Mejoría de los resultados | Fase controlada por placebo |
| Expectativa consciente (positiva o negativa) | Escala de patrón numérico de expectativas (positiva o negativa) | Fase de etiqueta abierta |
Durante la fase inicial controlada por placebo, siguiendo el modelo de Kaptchuk et al4 las evaluaciones periódicas permitirían la estimación del efecto Hawthorne y la regresión al medio (lista de espera), el efecto placebo de una única intervención, el efecto placebo de una intervención asociada a la relación médico-paciente y el efecto placebo de la relación médico-paciente únicamente.
Durante la fase de etiqueta abierta a largo plazo, utilizando un análisis individualizado y cualitativo del informe del caso o de los cuestionarios estructurados, podrían estimarse los posibles efectos placebo y nocebo, así como el efecto terapéutico específico de la medicina homeopática y la elección de simillimum (1), cuando exista una mejoría en los pacientes que tenían una expectativa negativa del tratamiento. Este enfoque cualitativo puede utilizarse para minimizar los problemas habituales de la evaluación cuantitativa a largo plazo.
Hemos aplicado elementos de este complejo diseño de estudio al tratamiento homeopático individualizado de la rinitis alérgica crónica2,83, observando a los pacientes durante un período de 3 años (fase de etiqueta abierta) tras una fase inicial de 6 meses controlada por placebo. Tras una mejoría del 25% en el grupo placebo al finalizar la fase inicial, sin diferencias significativas con el grupo de tratamiento, observamos una mejoría considerable y progresiva en los subgrupos de pacientes que permanecían en la fase de etiqueta abierta (50, 64 y 72% tras 12, 24 y 36 meses de tratamiento, respectivamente).
El análisis periódico de las expectativas de los pacientes en fase de etiqueta abierta permitió determinar el efecto específico de la medicina simillimum (mejoría considerable de algunos pacientes que tenían expectativas negativas), que se mantuvo a largo plazo durante años, incluso tras finalizar el tratamiento (efectos residuales, o a largo plazo). El hecho de que hubiera una mejoría considerable, tras únicamente 12 meses de tratamiento homeopático individualizado, en pacientes con enfermedades crónicas de larga duración (media de 15 años) confirmó la observación de otros homeópatas, que sugieren un mes de tratamiento por cada año de enfermedad (“regla del 12”)76.
Esperamos que esta revisión ayude a esclarecer y concienciar sobre los posibles efectos terapéuticos no específicos del enfoque homeopático, así como a estimular la realización de investigaciones dirigidas a la diferenciación y cuantificación de los efectos terapéuticos específicos de la medicación individualizada, para mejorar la prescripción homeopática.
Este artículo es una traducción autorizada por The Faculty of Homeopathy, propietario de la publicación Homeopathy, del artículo original en inglés publicado en la revista Homeopathy en 2010: The placebo effect and homeopathy. Homeopathy. 2010;99:119-29.Disponi- ble en: http://www.sciencedirect.com/science/article/pii/S1475491610000032