La diabetes (DM) en embarazo es pregestacional (DPG), incluye a la diagnosticada en primer trimestre y gestacional (DG). La prevalencia DM creciente de obesidad y DM2 y embarazos tardíos, han aumentado la DG y DPG tipo 2. Persiste controversia en diagnóstico de DG. Las metas glucídicas son más estrictas en la gestación.
Tratamiento en DPGProgramación del embarazo, buen control glicémico y complicaciones de su DM ausentes o tratadas. La DM1 intensifica la insulinoterapia y la DM2 la inicia.
DGCambios de estilo de vida; monitoreo de glucosa capilar e insulina si no se alcanzan metas. La terapia es beneficiosa para madre e hijo. El uso de antidiabéticos orales es controvertido. La glibenclamida estaría contraindicada: más macrosomía e hipoglicemia neonatal. La metformina presenta ciertas ventajas inmediatas, pero más parto pretérmino y sin estudios de seguridad a mayores plazos. El trabajo en equipo, educación y prevención de DM en DG son claves.
Diabetes (DM) in pregnancy presents as pregestational (PGD) which includes both known DM and DM diagnosed during first trimester and gestational DM (GD). Increasing prevalence of obesity and type 2 diabetes and late pregnancies have increased DG and DPG type 2 DM. Controversy persists on DG diagnosis.
TreatmentGlycemic goals are stricter in pregnancy. Programming, crucial for newborn congenital malformation prevention in PGD. Detection and management of microvascular complications is necessary. Glucose control attained by intensification of insulin therapy in type1 or insulinization in type 2 results in fetopathy prevention.
GD treatmentBeneficial for mother and child. Lifestyle changes are the first step measure; capillary glucose monitoring; insulin if goals are not met. The use of oral agents persists controversial. Glibenclamide seems contraindicated: more macrosomia and neonatal hypoglycemia. Metformin: certain immediate advantages, longer follow up safety studies are needed. Teamwork, education and prevention of diabetes in GD are key.
La asociación de diabetes y embarazo ha sido objeto de estudio y atención debido a las particulares interacciones entre la gestación y el metabolismo glucídico en las mujeres no diabéticas y por el impacto bidireccional sobre el producto de la concepción y las complicaciones crónicas en las diabéticas que se embarazan, que son un desafío para el equipo profesional que las atiende. Los cambios epidemiológicos han conducido a un incremento abrupto y sostenido de los factores de riesgo de diabetes tipo 2: sobrepeso y obesidad, sedentarismo, alimentación rica en grasas saturadas. El resultado ha sido alarmante en nuestro país con un aumento de la diabetes tipo 2 (DM2) cercano al 50% entre el 2003 y 2010. No se dispone de buenos estudios recientes sobre la prevalencia de diabetes gestacional, pero datos retrospectivos 1 muestran que su frecuencia va en ascenso, llegando a 24% en mujeres con IMC>25kg/m2. Por décadas, el embarazo en una mujer diabética era sinónimo de diabetes tipo1 (DM1) y por su baja prevalencia, constituían casos difíciles, más bien aislados y tratados sólo por especialistas. Además, la DM2 se presenta en edades tempranas, lo que unido al retraso en la edad del embarazo, ha determinado que el número absoluto y la proporción de DM2 en la gestación en muchos países, incluyendo el nuestro, haya superado ampliamente a la DM1 2–5.
La incorporación de nuevas tecnologías ha permitido conocer mejor la normalidad y la variabilidad de la glucosa en distintas condiciones, tales como la gestación. Los datos aportados por estos dispositivos han reafirmado que mientras más cercano a la normalidad metabólica, mejores son los resultados en la madre y el hijo.
La diabetes pre gestacional (DPG) comprende a la DM1, DM2 y otros tipos de diabetes presentes antes del embarazo y para fines prácticos, también los casos de diabetes diagnosticados con los criterios de la población general en el primer trimestre.
No existe consenso acerca de los criterios diagnósticos y definición de la diabetes gestacional (DG)6. Chile, NICE en el Reino Unido y la Asociación Latinoamericana de Diabetes 7–9 han coincidido, con algunos matices, en aceptar los niveles glicémicos de la población general OMS 10 en el embarazo. De este modo se califica como DG a la mujer que tiene glicemias de ayuno entre 100 y 125mg/dl en forma repetida en el primer trimestre y aquellas que siendo normales en el primer control, presentan entre la semana 24-28 una glicemia basal >100mg/dl y/o >140mg/dl a las 2hr de una carga de 75g de glucosa oral (PTGO); finalmente si entre la semana 30-33 se comprueban los valores señalados, al repetir la PTG por aparición de alteraciones sugerentes de DG, como macrosomía fetal, polihidroamnios o incremento excesivo de peso.
Tratamiento y control. El tratamiento de la DPG se inicia con la programación del embarazo. La confirmación de un embarazo no programado en una mujer diabética y el diagnóstico de diabetes mellitus en el primer control de una gestante, representan el fracaso del sistema de salud en esta área tan sensible.
El tratamiento de la DG debe considerar la detección oportuna del trastorno y una red de atención eficiente. Una premisa que se aplica a ambas situaciones, es que los tiempos son cruciales y que toda hiperglicemia durante el embarazo debe ser abordada como una urgencia.
Antes de describir las medidas terapéuticas, es necesario conocer las metas del control (Tabla 1) 11. Los estudios y sus resultados se basan en un monitoreo frecuente y diario, situación muchas veces distante de la realidad de los servicios, con controles de glicemia capilar periódicos, generalmente realizados durante la atención obstétrica de alto riesgo. Las metas pretenden acercarse a los valores normales del embarazo, que han variado de acuerdo con el avance del conocimiento, puesto que la gestación cursa con glicemias más bajas de lo que se creía, tanto que el promedio ±DS en 250 embarazadas sanas con autocontrol frecuente o monitoreo continuo fue 71±8;109±13; 99±10mg/dl en ayunas, 1 y 2 horas posprandial, respectivamente. La glucosa media en 24 horas fue de 88±10mg/dl. Estos resultados llevaron a los autores a proponer metas posprandiales inferiores 12. La hemoglobina glicosilada (HbA1c) sufre cambios no bien conocidos durante el embarazo, como para precisar su normalidad. La mayoría de los factores producen un descenso 13. Por lo anterior, la meta del tratamiento de la DPG es <6%. La magnitud menor del trastorno de la DG, hace que NO sea de utilidad en el seguimiento de estas mujeres. En casos individuales, frente a alteraciones mayores, dudas sobre su pre existencia del trastorno y en protocolos de investigación, puede ser medida.
METAS DE CONTROL DURANTE EL EMBARAZO
| GLICEMIA CAPILAR | VALORES |
|---|---|
| Antes del desayuno | 60-90mg/dl |
| Antes de otras comidas | 60-105mg/dl |
| 1 hora después de las comidas | <140mg/dl |
| 2 horas después de las comidas | <120mg/dl |
| 2:00 a 4:00 AM | >60mg/dl |
| Hemoglobina glicosilada A1c (DPG)* | <6% |
Las metas son relativamente fáciles de alcanzar y mantener en las DG y moderadamente dificultosas en DM2. En las pacientes con DM1 en cambio, resulta complejo, por lo que el médico y todo el equipo tratante, debe individualizar las metas: lo más cercanas a la normalidad, con riesgos mínimos de hipoglicemia y variabilidad glicémica, considerando los hábitos, costumbres y capacidad de comprensión de la paciente. La gestación es una condición fisiológica que involucra profundamente al grupo social donde se inserta: no es una enfermedad, la mujer mantiene su actividad habitual y su rol familiar, donde las creencias y mitos juegan un papel fundamental.
METAS NO GLICÉMICAS- 1.
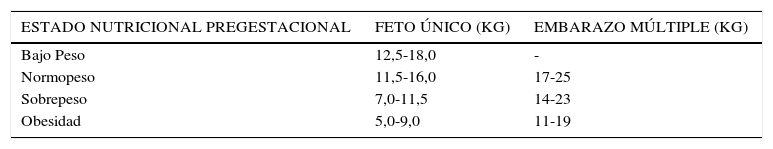
Ganancia de peso: Es la recomendada para todas las embarazadas y un punto crucial en el embarazo con diabetes. Es variable de acuerdo con el estado nutricional inicial, cuyo cálculo se basa en los estudios de Atalah (Tabla 2) 14. El incremento deseable se presenta en la Tabla 315,16.
TABLA 2.CLASIFICACIÓN DEL ESTADO NUTRICIONAL EN EL EMBARAZO
SEMANA DE EMBARAZO ESTADO NUTRICIONAL IMC KG/M2 SEMANA 10 Bajo Peso <20,2 Normopeso 20,2-25,2 Sobrepeso 25,3-30,2 Obesidad >30,2 SEMANA 40 Bajo Peso <25,0 Normopeso 25,0-28,9 Sobrepeso 29,0-33,0 Obesidad >33 Atalah E et al Rev. Med Chile 1997;125: 1429-1436 (ref 14).
TABLA 3.Incremento de peso recomendado según estado nutricional pregestacional*
ESTADO NUTRICIONAL PREGESTACIONAL FETO ÚNICO (KG) EMBARAZO MÚLTIPLE (KG) Bajo Peso 12,5-18,0 - Normopeso 11,5-16,0 17-25 Sobrepeso 7,0-11,5 14-23 Obesidad 5,0-9,0 11-19 - 2.
Prevención, detección y tratamiento oportuno de las complicaciones obstétricas asociadas: pre eclampsia y eclampsia, parto prematuro, infecciones urinarias, macrosomía fetal, restricción del crecimiento intrauterino. Se aplica tanto a DPG como DG.
- 3.
En DPG, seguimiento y control de las complicaciones crónicas de la diabetes. Tratamiento de ellas cuando es necesario.
- 4.
Manejo óptimo del parto, adecuado a las condiciones obstétricas y médicas de la paciente.
- 5.
Control y seguimiento a corto, mediano y largo plazo, individualizado.
Los pilares del tratamiento son: alimentación regulada, actividad física, monitoreo glicémico, insulinoterapia, ¿antidiabéticos orales?, control obstétrico de alto riesgo. Todo lo anterior sólo es exitoso si se cuenta con un equipo multidisciplinario constituido y un programa de educación garantizado.
1. Alimentación. El concepto más importante es que el aporte calórico y la distribución de los nutrientes no difieren del de las embarazadas no diabéticas. Sólo es necesario el incremento calórico diario de 420 calorías en embarazadas de peso normal y 510 en enflaquecidas, a partir del 2° trimestre 16. El embarazo no es el momento para bajar de peso en una mujer obesa. La información actual indica que el aporte calórico mínimo seguro en este estado es de 1.600 calorías. El porcentaje de carbohidratos (CH) y el aporte mínimo diario, ha sido objeto de controversia, las publicaciones apuntan a un rango entre 40 y 55% 17,18 y 160g CH/día. El elemento clave es el fraccionamiento, que debe considerar los hábitos; nuestro país ha experimentado cambios y tres comidas (desayuno, almuerzo y onces-comida o merienda) y tres colaciones (media mañana, media tarde y antes de dormir), se ha convertido en la alternativa más frecuente; esto es importante puesto que la distribución habitual durante las hospitalizaciones es de cuatro comidas y dos colaciones, lo que suele causar confusión al alta. El tipo de carbohidratos puede contribuir a mejorar el control. El consumo de alimentos de bajo índice glicémico ha demostrado reducir significativamente la necesidad de insulinoterapia 16. Otro punto, es que la disminución de los carbohidratos, conduce a un incremento de proteínas y/o lípidos, lo que representa un desafío de prescripción para el profesional, en las pacientes del sistema público. Una indicación adaptada a la realidad, puede lograr mejores resultados que una dieta perfecta. Para las DG, el inicio del plan de alimentación suele resultar dificultoso, dado lo inesperado del diagnóstico. En las mujeres DPG, el embarazo obliga a revisar y reforzar el cumplimiento de las medidas nutricionales. Es indispensable un fuerte apoyo de nutricionista. El aporte de vitaminas y minerales es similar a la recomendación durante el embarazo normal 16,17.
Algunos resultados del monitoreo pueden conducir a cambios en la distribución y tipo de carbohidratos, como la hiperglicemia pos desayuno, frecuente, que es posible corregir mediante la reducción de los carbohidratos del desayuno y así evitar el uso de insulina pre prandial.
2. Actividad física. Es importante como adyuvante al tratamiento por sus favorables efectos sobre la sensibilidad a la insulina. Su prescripción debe considerar la actividad y capacidad física previa de la mujer, el acceso a un plan de ejercicio adecuado a su condición, el esquema insulínico y su relación temporal con el ejercicio, el estado obstétrico de la paciente y por último, la presencia y severidad de complicaciones de la diabetes. El ejercicio de extremidades superiores es seguro durante la gestación; la caminata regular y sistemática, evitar el sedentarismo y el reposo innecesario, contribuyen a mejorar el control y mantener estado físico 18. El reposo es sólo de indicación obstétrica ya que la existencia de retinopatía proliferativa contraindica sólo ejercicios intensos.
3. Monitoreo glicémico. Indispensable para evaluar el logro de las metas y establecer los cambios en el tratamiento acordes con las modificaciones metabólicas de la gestación. Su frecuencia y relación con la alimentación son variables. Idealmente toda mujer embarazada con diabetes tanto DPG como DG, debiera tener controles antes y después de cada comida principal y si recibe insulina basal, una medición adicional en la madrugada. Esa es la indicación de muchos expertos, no obstante, razones prácticas y económicas, permiten recomendar que las mujeres con DG que inician régimen, tengan al menos 1 o 2 controles diarios, alternando los tiempos cada día con el fin de obtener una visión más amplia de la realidad metabólica. Inicialmente es conveniente conocer los controles preprandiales, una vez confirmada su normalidad, se privilegian los períodos postprandiales. El control 1 hora después de iniciada la comida, brinda utilidad similar al control de las 2 horas y en algunos estudios ha sido superior, con buena correlación con los resultados del recién nacido 19,20; por las razones señaladas y más facilidad de cumplimiento, es el más recomendado. Una vez bajo insulinoterapia, los controles aumentan en número y los tiempos se adaptan al esquema terapéutico y a los resultados obtenidos y puede llegar a ser tan frecuente como en la DPG.
En DM1, el monitoreo se intensifica para alcanzar las metas. La variabilidad metabólica propia de este tipo de diabetes, hace difícil mantenerlas de modo permanente, por lo que es importante que todo el equipo profesional tratante esté al tanto y flexibilice los objetivos, para evitar hipoglicemias y hospitalizaciones.
En DM2, la situación del monitoreo es intermedia entre DG y DM1. El número mínimo es de tres al día, pudiendo llegar en algunos casos hasta la complejidad del de las DM1.
La clave del éxito reside en la comprensión de la paciente, la destreza para realizar las mediciones, la precisión en los tiempos y la simplificación del calendario del registro que debe adecuarse a cada caso. Un requisito fundamental es la comunicación con el equipo tratante y las instrucciones claras sobre las medidas a tomar. La educación y el mensaje coherente de todos los profesionales involucrados, es posible aún en condiciones de carencia de recursos.
El Dispositivo de Monitoreo de Glucosa Continuo, que mide glucosa intersticial cada cinco minutos durante tres a siete días ha demostrado ser de utilidad cuando el monitoreo tradicional no logra optimizar el control 13.
4. Insulinoterapia. La insulina se ha indicado en el embarazo desde su descubrimiento y el impactante progreso en los resultados se atribuye en gran parte a ella. Tiene las ventajas de no tener dosis límite, no cruzar la barrera placentaria y haber mostrado seguridad materna y fetal. Afortunadamente, las insulinas disponibles en el mundo son las humanas obtenidas por bioingeniería y tienen baja inmunogenicidad. La NPH, de acción intermedia, cumple el papel de insulina basal y la rápida, regular, corriente o cristalina (denominación en el medio hospitalario), se usa para el control prandial. Los análogos de insulina de acción rápida tienen un peak de acción precoz con una curva parecida a la secreción normal estimulada por el alimento y una duración más corta que la humana. Esto permite que la inyección sea próxima a la comida (con la regular humana debe mediar ≥30min. entre la inyección y el alimento) y que no se asocien a episodios de hipoglicemia antes de la comida siguiente. Las aprobadas para el embarazo son la aspártica y la lispro. No presentan otra ventaja que la práctica y un mejor control de la glicemia postprandial no reflejada en la A1c. Entre los análogos de acción prolongada sólo la detemir está autorizada en el embarazo. Su mayor ventaja es su acción uniforme en el tiempo, lo que evita horarios rígidos de alimentación y menor variabilidad intra e inter individual comparada con la NPH. Estudios muestran que es segura y no inferior en DM1, DM2 y DG 21, igual efectividad, menor frecuencia de hipoglicemias, pero más alergias y mayor costo. Su mejor indicación es en DM1 y en otras embarazadas con horarios de alimentación impredecibles.
Insulinoterapia en diabetes gestacional. Está indicada cuando no se alcanzan las metas con las medidas no farmacológicas en un plazo variable entre 7 y 14 días. El criterio que define el fracaso del régimen puede ser: 2 controles consecutivos fuera de la meta o el 80% fuera de la meta. La primera aproximación resulta práctica y se asocia a buenos resultados. Situaciones especiales llevan a acortar los plazos o incluso a iniciar la insulina junto con el diagnóstico y la prescripción nutricional. Por ejemplo, si la mujer tiene controles iniciales alejados de la meta, sus hábitos alimentarios son cercanos a la recomendación, la tendencia de los controles no mejora con la alimentación prescrita, o se prevé mala adherencia.
La forma de iniciar la insulina en DG es variable. Las dosis y esquemas difieren notablemente. Las explicaciones de estas diferencias no están claras lo que causa confusión, particularmente en el medio obstétrico y en el control prenatal de atención primaria. Pioneros en el tema, como Jovanovic y Langer 22,23 proponen dosis y esquemas de inicio similares en DM2 y DG: Total 0,7-0,9UI/kg/día, distribuida en 60% matinal y 40% nocturna. La dosis matinal calculada se divide en 2/3 NPH y 1/3 rápida. Cuando se utiliza detemir 20 recomiendan subdividir el tercio de rápida en partes iguales antes de desayuno y almuerzo. A modo de ejemplo, una diabética gestacional que pesa 80kg, si necesita insulina recibiría como primera indicación, 64 U al día, distribuidas en 38 AM y 26 PM; Las 38 U AM se dividen en 24 o 26 NPH y 14 o 12 de rápida, 30min. antes del desayuno y las 26 PM se indican como NPH antes de dormir. Si se utiliza análogo rápido, solo cambia la inyección al momento de comer y una punción más, debido a que el análogo se administra con lápiz. Si elige un análogo lento, detemir, la recomendación es que el tercio de rápida AM, se inyecte en partes iguales antes de desayuno y almuerzo (7 y 7 o 6 y 6). Llama la atención las altas dosis de estas recomendaciones. Desde hace décadas se han utilizado cantidades mucho más bajas (0,27UI/kg/día en el tercer trimestre), basadas en la observación del perfil glicémico de cada paciente, con resultados similares en el recién nacido. En la Tabla 4 se propone una forma de inicio según las alteraciones más frecuentes. Cualquiera sea el esquema y dosis inicial, este debe ser modificado de acuerdo con los controles. Cada cambio que debe tomar en cuenta la magnitud de la alteración, la curva de acción de las insulinas en uso, la alimentación y su horario, además de la actividad física. Es preferible comenzar con dosis bajas, siempre que la comunicación de los controles y la factibilidad de los ajustes oportunos estén garantizados.
INICIACIÓN DE INSULINOTERAPIA EN DIABETES GESTACIONAL*
| PERFIL GLICÉMICO ALTERADO | INSULINA TIPO | DOSIS INICIAL |
| Solo ayunas (excursiones prandiales<50mg/dl) | NPH nocturna | 0,1UI/kg |
| Solo postprandial | Rápida pre prandial ** | 2-6UI *** |
| Post almuerzo, post onces y pre cena | NPH pre desayuno | 0,1UI/kg |
| Todos los tiempos | NPH pre desayuno (2/3) NPH al acostarse (1/3) | 0,2UI/kg |
En el embarazo se presentan con más frecuencia algunos perfiles glicémicos especiales; uno de ellos es la excursión pos desayuno que suele ser muy acentuada, tanto que para alcanzar la meta glicémica obliga a subir la dosis de insulina rápida, que puede sobrepasar la de NPH de la mañana. Otra alteración común es que los controles pre y pos almuerzo y pre onces están en niveles normales, pero con niveles fuera de meta antes de la cena; en esa circunstancia, el aumento de la NPH matinal provocaría una hipoglicemia y una buena medida es la adicionar una tercera dosis, pequeña de NPH antes de almuerzo.
Insulinoterapia en diabetes pre gestacional. En la mujer con DM1, el embarazo obliga a una mayor intensificación del tratamiento con ajustes de dosis frecuentes. La decisión sobre la insulina basal, debe ser individual. Si el buen control se ha logrado solo con glargina, la conversación con la paciente sobre su mantención o cambio a NPH o detemir, conduce en muchos casos a su mantención. Series clínicas han mostrado buenos resultados. En las primeras semanas habitualmente disminuyen los requerimientos, por lo que es importante evitar las hipoglicemias, que pueden verse facilitados por el estado nauseoso de esta etapa de la gestación. Luego ocurre un progresivo incremento de las necesidades de insulina, que alcanza a en promedio entre 30 y 80%; generalmente los requerimientos se estabilizan a partir de la semana 33 y pueden incluso descender levemente cerca del parto. Una baja brusca de las necesidades de insulina hace sospechar una disfunción placentaria y disminución de la vitalidad fetal. Los micro infusores subcutáneos continuos han demostrado ser de utilidad para lograr el control pre concepcional y durante el embarazo en DM1. Varios meta análisis no muestran superioridad 24, es probable que ensayos controlados, con dispositivos con visión en tiempo real de los valores y tendencia, muestren diferencias favorables.
En la DM2, la situación es distinta. La condición ideal es que el embarazo programado encuentre a la mujer DM2 bajo tratamiento insulínico y familiarizada con el monitoreo glicémico. La conducta en esos casos es el aumento de la frecuencia diaria de controles de glicemia capilar y los cambios de dosis y esquemas necesarios para la mantención de las metas. Desafortunadamente la gran mayoría no se ha preparado debidamente y en la primera consulta maternal aparece el antecedente de la diabetes previa o los exámenes de iniciales comprueban el diagnóstico. Ambas situaciones obligan a la iniciación de un complejo proceso terapéutico conducente a la compensación metabólica: educación en técnicas de inyección y monitoreo, alimentación, metas glicémicas, individualizado, como ya fue descrito en DG. Las claves del éxito residen en la priorización de los temas de capacitación, etapificación de la enseñanza, trabajo en equipo cohesionado y acceso y comunicación fluidas.
Las características generales de la insulinización en la DM2 embarazada son: requerimientos comparativamente más altos que en DG y DM1; incremento mayor de las dosis en el curso de la gestación, mayor estabilidad metabólica, menor tendencia a hipoglicemia; esquemas de distinta complejidad, según la magnitud de la alteración y su perfil glicémico. En principio, el enfoque es el de insulina basal- bolos prandiales, no obstante, la individualización lleva a indicaciones variadas, con adecuaciones similares a las descritas para DG. La diferencia mayor reside en los requerimientos más elevados, habitualmente entre 0,4 y 2UI/kg/día y esquemas complejos más frecuentes.
ANTIDIABÉTICOS ORALESExiste una controversia pendiente sobre su utilidad, indicación y seguridad en el embarazo. Históricamente fueron contraindicados. La baja frecuencia de embarazos en DM2 llevó a que se conocieran casos anecdóticos de hipoglicemia severa del recién nacido con sulfonilureas. Series clínicas retrospectivas mostraban más complicaciones del embarazo y del recién nacido. El riesgo de teratogénesis ha sido el mayor temor. No existen ensayos clínicos controlados en DM2 en el embarazo y es poco probable que los haya, no obstante varias Guías Clínicas recomiendan informar a la embarazada diabética sobre las ventajas y desventajas de los antidiabéticos orales y ayudarla a tomar una decisión informada 9,25. No obstante, las Guías Canadienses las proscriben 26. Existe una tendencia en el mundo médico actual a extrapolar con mucha facilidad resultados de estudios realizados en poblaciones distintas y con objetivos diferentes, lo que dificulta la toma de decisión.
Metformina. Los ensayos durante la organogénesis sólo se han realizado en mujeres portadoras de Sindrome de Ovario Poliquístico, con infertilidad y abortos frecuentes; en este grupo, el número de embarazos y recién nacidos aumentó significativamente y no se reportó anomalías congénitas. En DPG se dispone sólo de estudios descriptivos y series clínicas retrospectivas. En DG, el ensayo MiG 27 que incluó DG sobre la semana 24 de gestación, mostró ser similar a la insulina en los resultados de los recién nacidos; no logró la compensación en un 46%; los requerimientos fueron moderadamente inferiores cuando debió asociarse y la ganancia de peso materno del período fue menor. Un meta análisis reciente 28 incluye 6 estudios con 1362 DG, confirma la menor ganancia de peso (-1,14kg), menos hipertensión inducida por el embarazo con Riesgo Relativo (RR) 0,53, pero reporta más parto pretérmino, con RR 1,50 y una tendencia no significativa a menos hipoglicemia neonatal. Los efectos adversos digestivos varían entre 2,5 y 45,7% y el fracaso global al fármaco es 33,8%. Su pasaje transplacentario y la elevada concentración fetal son motivo de preocupación y no se dispone de información sobre los efectos a mediano y largo plazo en los hijos. El uso de metformina para la prevención de DG en mujeres con riesgo, no fue efectivo 29. Se puede concluir que la metformina en DG, constituye una herramienta terapéutica de resultados similares a la insulina en el RN en el corto plazo, con algunas ventajas maternas, aunque el parto pre término es más frecuente. No es suficiente como tratamiento en más de un tercio de los casos, se asocia a intolerancia digestiva variable, es preferida por las mujeres, no se conocen sus efectos a mediano y largo plazo y su uso no está explícitamente autorizado por las Agencias Internacionales de control de fármacos. Las últimas Guías Clínicas del MINSAL, Chile 7, recomiendan que por el momento sólo se prescriba en protocolos de investigación o de tratamiento, cuyos resultados deben ser comunicados.
Glibenclamida. Los ensayos se han efectuado sólo en DG. Tendría la ventaja de no atravesar la barrera placentaria y no causar hiperinsulinemia fetal, medida por el Péptido C del cordón. Langer et al 30 revolucionaron el tema con su reporte de resultados similares a la insulina en control metabólico y en los recién nacidos. Investigaciones posteriores demostraron que la glibenclamida cruza la placenta. El meta análisis señalado 28 incluye 7 estudios abiertos, sin datos de método de aleatorización con 798 DG. La glibenclamida se asoció a mayor peso del RN, más macrosomía, con RR 2,62 (95% IC 1.35-5,08), más hipoglicemia neonatal, RR 2,04 (95% IC1.30-3,20). Falla global al fármaco de 6,37%. La frecuencia de hipoglicemia materna es heterogénea, Langer la reporta mayor con insulina y el resto sin diferencias. Solo dos estudios comparan glibenclamida con metformina, con resultados favorables significativos para metformina, con menos macrosomía (RR 0,33), RN grandes para la edad gestacional (RR 0.44). La tasa de fracaso en estos estudios fue 26.8% para metformina y 23,5% para glibenclamida. Los datos analizados, permiten concluir que la glibenclamida no es un fármaco adecuado para el tratamiento de la DG.
Control y seguimiento obstétrico de alto riesgo. Escapa a este artículo el detalle de este aspecto fundamental del tratamiento. El objetivo es la detección precoz y tratamiento de las complicaciones del embarazo que son más frecuentes tanto en las DPG como las DG, en menor proporción. Existen distintos protocolos que consideran ecografías adicionales a las de un embarazo normal, detección de anomalías fetales en diabéticas, seguimiento del crecimiento fetal, del bienestar de la unidad feto placentaria, prevención de pre eclampsia con aspirina y determinación del momento y mejor resolución del parto.
Seguimiento de la DPG. Se reitera la importancia de la Programación del Embarazo que consiste en optimización de la insulinoterapia en DM1 y paso a insulina en DM2, y evaluación de daño en órganos blanco, antes de la suspensión del método anticonceptivo. Son deseables dos controles consecutivos lo más cercanos a la normalidad, sin aumento del riesgo de hipoglicemia. La ADA y las Guías Chilenas recomiendan A1c<7,0% y la EASD <6,5%. Se reitera la meta de A1c<6% durante la gestación y controles cada 6 semanas. Aun en ausencia de retinopatía previa debe realizarse fondo de ojo cada 3 meses. La presencia de complicaciones no es una contraindicación para el embarazo, no obstante la retinopatía diabética puede progresar, especialmente las avanzadas, lo que obliga a una vigilancia estricta para definir el momento oportuno de fotocoagulación. El seguimiento debe seguir hasta 6 meses posparto 31. La nefropatía puede deteriorarse durante la gestación, asociarse a hipertensión refractaria y compromiso vascular placentario, lo que dificulta el tratamiento y puede afectar al feto. La evolución posterior habitualmente es el retorno a la condición basal de la nefropatía. La existencia de neuropatía autonómica es un factor de mal pronóstico materno y la cardiopatía coronaria puede ser causa de muerte de la madre. Por lo anterior, el embarazo no es aconsejable frente a esas patologías. Una hipertensión refractaria es otra condición asociada a mal pronóstico fetal. Puesto que la decisión es un derecho de la pareja, a pesar de los riesgos, la programación, control y tratamiento de las patologías asociadas y un buen control metabólico y obstétrico, conducen con mucha frecuencia a un recién nacido sano y una madre que conserva su estado de salud previo a la gestación, en situaciones tan complejas como trasplantadas de riñón y/o páncreas.
Indicación del momento y vía del parto. Es de resorte obstétrico. La tendencia a la interrupción programada en DPG y en DG con insulina, ha sufrido cambios: si el control es adecuado, sea o no con insulina, el parto puede postergarse hasta cerca del término. Siempre con un balance entre riesgos y beneficios y considerando otras patologías asociadas. En la amenaza de parto prematuro, situación más frecuente en DM, la inducción de maduración pulmonar con corticoides, provoca descompensación que debe ser manejada estrictamente, muchas veces con bomba de infusión IV de insulina. El control glicémico durante el parto debe considerar si se trata de un parto espontáneo o programado, vaginal o cesárea, con insulinoterapia o sin ella. Existen variados protocolos, todos con buenos resultados. Los aspectos fundamentales a considerar son:
- a)
Es importante el control glicémico para el recién nacido, con metas entre 90-110mg/dl 11,32.
- b)
El control se realiza con infusión IV de insulina con velocidad según nivel>90->200mg/dl, 0,5 a 3U/hora, respectivamente.
- c)
DM1 requiere siempre insulina durante el trabajo de parto, aún en fase latente y si la espera se ve prolongada, el uso de 1/3 de la dosis de basal matinal, facilita el manejo.
- d)
Las DG requieren muy poca o nada.
- e)
Trabajo de parto activo necesita aporte calórico.
- f)
Cesárea electiva, DM1 aporte IV glucosa y si no es a primera hora: 1/3 dosis matinal, DM2 y DG, aporte glucosa e insulina según control.
- g)
Cesárea de urgencia con insulina colocada, glucosa IV, insulina sólo sobre 120mg/dl.
Producido el parto desaparecen las hormonas diabetogénicas y disminuyen drásticamente las necesidades de insulina, generalmente a cero en DG. En la mayoría de las DPG tipo1 en un 50%, llegando durante la lactancia a requerimientos menores a los previos al embarazo. En DM2 y DG es muy frecuente que no se requiera insulina para mantener glicemias entre 140 y 180mg/dL, por lo que al alta se debe insistir en las medidas no farmacológicas adecuadas a la lactancia. Clásicamente el único fármaco para control glicémico en este período era la insulina, con esquemas habitualmente simples. Información más reciente, muestra que la metformina prácticamente no cruza a la leche materna 33 y que puede ser indicada, particularmente en obesas. Tres desafíos se debe enfrentar después del parto: En DPG, insistir en el buen control para mantener la calidad de vida y permitir al hijo una relación duradera con una madre sana. En DG, la incorporación a un Programa Preventivo de Diabetes y Riesgo Cardiovascular y en ambos casos, la indicación oportuna de un método anticonceptivo seguro. Los preparados hormonales no están contraindicados, aunque puede observarse en DG un leve incremento del riesgo de DM. La medida más peligrosa es la falta de anticoncepción.
La autora declara no tener conflictos de interés, en relación a este artículo.