Los trastornos del ánimo en el adulto mayor, especialmente aquellos de inicio tardío son difíciles de diferenciar de la demencia en su etapa inicial, dado que existe un traslape sintomático. Esto puede llevar a errar o a retrasar el diagnóstico e impedir la entrega de un tratamiento adecuado.
Para el diagnóstico diferencial es fundamental obtener una historia rigurosa tanto del paciente como de la familia, un examen mental y neurológico. Se complementa con un estudio neuropsicológico y con biomarcadores de demencia. Hoy en día se dispone de nuevas técnicas de diagnóstico precoz en la demencia como la volumetría de hipocampos, el PET/CT F18-FDG y PET de amiloide, beta-amiloide y proteína Tau en el LCR, entre otras, que ayudan en casos complejos de diagnóstico diferencial.
Este artículo de revisión reúne elementos clínicos y estudios complementarios, con el objetivo de ayudar al psiquiatra en la tarea de diferenciar ambos cuadros.
Mood disorders in the elderly, especially those with late onset are difficult to differentiate from Dementia in its initial stage, given that there is a symptomatic overlap. This can lead to miss or delay the diagnosis and subsequently prevent an appropriate treatment.
For the differential diagnosis it is essential to obtain a rigorous history of both the patient and the family, a mental and neurological examination. It is complemented with a neuropsychological assessment and with biomarkers of Dementia. Nowadays, new early diagnosis techniques are available in Dementia such as hippocampal volumetry, PET/CT F18-FDG and PET of amyloid, beta-amyloid and Tau protein in the CSF, among others, which help in complex cases of differential diagnosis.
This article reviews clinical elements and complementary studies that help the psychiatrist in the task of differentiating both disorders.
En la medida que la población envejece y que existe una mayor conciencia de los problemas de salud mental, cada vez es más frecuente la presencia de pacientes de mayor edad en settings psiquiátricos. La depresión y la demencia son los síndromes neuropsiquiátricos más comunes y suelen presentarse al mismo tiempo1,2.
Los síntomas de la esfera anímica se pueden encontrar en una variedad de cuadros médicos y psiquiátricos. Cuando el compromiso central es el ánimo, se habla de trastornos del ánimo. Los dos grandes grupos corresponden al trastorno depresivo mayor y el trastorno bipolar, que adquieren características particulares en el adulto mayor y se asocian a una mayor morbilidad y mortalidad que en personas más jóvenes3.
Se describe en esta población una prevalencia de depresión del 2% en la comunidad, lo que aumenta significativamente en pacientes con patología crónica (9%), hospitalizados (36%) e institucionalizados (29-52%)4–6.
Para el trastorno bipolar en pacientes mayores de 65 años se menciona una prevalencia de 0,1–0,5% 7,8.
Los trastorno del ánimo en los adultos mayores a menudo cursan con alteraciones cognitivas. En la depresión, la prevalencia de deterioro cognitivo leve es hasta de un 50%9,10.
La demencia ahora, denominada por el DSM 5, trastorno neurocognitivo mayor, constituye uno de los principales problemas de salud a nivel mundial, debido a su elevada prevalencia y alto costo económico y social. En la actualidad existen aproximadamente 46 millones de personas con algún tipo de demencia, cifra que se duplicará cada 20 años, alcanzando a 131,5 millones de personas en el año 205011. Su prevalencia se duplica a partir de los 65 años. Afecta entre 5-8% de los individuos entre 65 - 70 años, entre 15-20% de los mayores de 75 años y entre 25-50% de los mayores de 85 años12.
La demencia se caracteriza primariamente por un deterioro cognitivo, sin embargo, frecuentemente va acompañada de manifestaciones psicológicas y conductuales. Los síntomas depresivos son frecuentes en la demencia vascular y en la enfermedad de Alzheimer (EA) especialmente en la etapa prodrómica. En la demencia frontotemporal variante conductual (DFT vc), es habitual la presencia de síntomas psiquiátricos que aparecen tempranamente en su evolución.
Este traslape sintomático puede ocurrir porque el correlato biológico, ya sea la atrofia en la demencia o la disfunción en los trastornos anímicos, se asocia a la distribución anatómica de la patología más que a la patología específica en sí13. Es decir, se afectan los mismos circuitos neuronales.
Ya que los síntomas psiquiátricos, en especial los anímicos son comunes en la demencia y que pueden aparecer incluso antes de que se manifieste el deterioro cognitivo y que los trastornos del ánimo en los adultos mayores se manifiestan con importante sintomatología cognitiva, los psiquiatras debemos estar alertas en diferenciar los cuadros psiquiátricos primarios de los secundarios. De esta forma podremos evitar evaluaciones clínicas innecesarias, entregar un tratamiento adecuado basado en la evidencia y hablar a tiempo con el paciente y cuidador sobre el pronóstico y manejo de la enfermedad14.
Este artículo se centra en el diagnóstico diferencial entre trastornos del ánimo: Depresión Mayor/Trastorno Bipolar y Demencia. Se revisan elementos de la clínica y de estudios complementarios que contribuyan a diferenciar ambas entidades.
Depresión tardíaDe acuerdo al DSM-5, la depresión mayor se define por un ánimo depresivo y/o anhedonia más 4 o más síntomas asociados (Tabla 1). Cuando se presenta después de los 60 o 65 años se denomina depresión tardía (Late life depression, LLD) esta difiere tanto en la clínica como en la etiología de la que se presenta en individuos más jóvenes. Existe mayor comorbilidad médica, alteraciones morfológicas cerebrales de tipo vascular, riesgo de demencia y riesgo de suicidio16.
Criterios para el Episodio Depresivo Mayor (DSM-5)15
| 5 o más de los siguientes síntomas durante 2 semanas y que representan un cambio respecto al estado anterior |
|---|
| □ Ánimo depresivo |
| □ Baja capacidad hedónica |
| □ Anorexia o hiperfagia |
| □ Disminución/aumento de peso o del apetito |
| □ Agitación o inhibición psicomotora |
| □ Fatigabilidad o pérdida de la energía |
| □ Sentimientos de inutilidad o culpa |
| □ Dificultad para pensar o concentrarse |
| □ Ideas de muerte o suicidio |
Los pacientes mayores no suelen verbalizar tristeza o sentimientos de culpa, presentan importantes fallas cognitivas y bajo insight. En relación a pacientes más jóvenes tienen más alteraciones neurovegetativas, síntomas psicóticos, inhibición psicomotora, quejas somáticas y dolor17,18.
Las alteraciones cognitivas en pacientes con LLD se asocian a mayores tasas de recaídas, discapacidad y menor respuesta a la farmacoterapia, por lo que su detección es relevante19.
La depresión tardía se puede clasificar según la edad de inicio de los síntomas: de inicio temprano (Early onset depression, EOD) cuando ésta ocurre bajo los 50-60 años y de inicio tardío, cuando el primer episodio aparece posterior a esta edad (Late onset depression, LOD). EOD se asocia a una historia personal y familiar de trastornos del ánimo y cuadros más severos. LOD se relaciona a patología médica (cardiovascular), mayor deterioro cognitivo, demencia, mayor recurrencia y baja respuesta al tratamiento farmacológico20.
La relación entre depresión y demencia es compleja y hasta ahora los mecanismos que las vinculan no se han dilucidado. La depresión es un factor de riesgo para todas las demencias. El riesgo se incrementa dos veces con el antecedente de historia de depresión en la juventud y éste aumenta en la medida que existe recurrencia21. Los pacientes con depresión de inicio tardío muestran un 8% más de riesgo de demencia que aquellos sin síntomas depresivos a corto y mediano plazo. Este hecho ha llevado a considerarla también como un pródromo de la demencia, es decir, que existe un continuum entre ambas entidades22. Por último, la depresión puede ser una consecuencia de la demencia.
Algunos de los mecanismos propuestos para explicar esta relación incluyen cambios vasculares23, incremento del cortisol24, procesos inflamatorios crónicos, desequilibrio entre la producción y el clearence de beta- amiloide y envejecimiento acelerado25.
Trastorno Bipolar TardíoEl trastorno bipolar se define por la presencia de episodios depresivos y maniacos. En las Tablas 1 y 2 se muestran los criterios DSM-5 para ambos episodios, respectivamente.
Criterios para el episodio Maniaco (DSM-5)15
| Un período de ánimo anormal y elevado, expansivo o irritable más un aumento de la energía persistente de al menos 1 semana, con 3 o más de los siguientes síntomas (4 si el ánimo es sólo irritable) |
|---|
| □ Autoestima elevada |
| □ Disminución de la necesidad de dormir |
| □ Verborrea |
| □ Taquipsiquia |
| □ Distraibilidad |
| □ Aumento en la actividad intencionada o agitación psicomotora |
| □ Implicación en actividades placenteras con consecuencias graves |
Cuando ocurre después de los 60 años se habla de trastorno bipolar tardío (Older age bipolar disorder, OABD).
Al igual que el trastorno depresivo mayor, se clasifica con respecto a la edad de inicio. Trastorno bipolar de inicio temprano (Early onset bipolar disorder, EOBD) y trastorno bipolar de inicio tardío (Late onset bipolar disorder, LOBD). La edad de corte es variable en los distintos estudios, fluctúa entre 40-50 años26.
EOBD se asocia con historia familiar de bipolaridad, mientras que LOBD con enfermedades neurológicas (cerebrovascular), pobre respuesta al tratamiento y alto riesgo de deterioro cognitivo27.
El perfil clínico no varía de forma importante entre la bipolaridad tardía frente a la que presentan los pacientes más jóvenes.
Hay que tener en consideración que un episodio maniaco en este grupo etario puede no ser solo la manifestación de un trastorno bipolar de inicio tardío si no también, el debut de una bipolaridad en un paciente con historia de depresiones recurrentes (“pseudounipolar”), un paciente bipolar de inicio temprano no diagnosticado previamente, ser secundario a uso de fármacos, a una enfermedad médica o neurológica como por ejemplo una demencia.
DemenciaEl término demencia se refiere a un síndrome clínico adquirido caracterizado por un déficit cognitivo múltiple que implica un deterioro significativo de la memoria y de otras funciones cognitivas en relación con el nivel de funcionamiento previo del individuo, afectando las actividades de la vida diaria del individuo.
En las fases iniciales destaca el deterioro de la memoria a corto y a largo plazo, asociado a la aparición progresiva de un deterioro del pensamiento abstracto, de la capacidad de razonamiento y posteriormente de otras funciones corticales superiores como afasia, apraxia y agnosia así como también a importantes cambios de la personalidad. Patrón que variará de acuerdo a la enfermedad que sustenta el síndrome, ya sea EA, demencia vascular, DFT, etc.
La EA es la demencia más frecuente en todos los grupos etarios, dando cuenta del 80% en mayores de 65 años, seguido de la demencia vascular, DFT y demencia por cuerpos de Lewy (LBD). Siendo importante mencionar que son frecuentes los casos mixtos.
En la EA el síntoma de inicio más frecuente es la alteración de la memoria. Los enfermos tienen dificultad para retener nueva información, manteniéndose la memoria remota. Es frecuente la aparición de problemas del lenguaje y posteriormente se afecta la capacidad de organización visuoespacial. Los pacientes se pierden fácilmente en lugares antes familiares para ellos. Se compromete la capacidad de juicio y se altera también la personalidad. En etapas más tardías aparecerá apraxia con limitación del vestir, del uso de instrumentos, etc., volviéndose el paciente cada vez más dependiente28.
La demencia vascular es la segunda causa más frecuente de demencia. Es importante buscar signos de focalización en el examen neurológico; antecedente de AVE o TIA; antecedente de hipertensión arterial, enfermedad cardíaca, arritmias, etc.
El curso clínico muestra un patrón escalonado, lo que se refiere a que el paciente se va deteriorando en la medida que va aumentando la carga lesional vascular cerebral.
En la DFT hay cambios importantes en la personalidad. Característicamente hay desinhibición en el comportamiento, apatía y anosognosia (falta de conciencia de enfermedad). La función ejecutiva (FE), es decir, la capacidad de planificar y realizar una acción está comprometida precozmente. Se altera también tempranamente el lenguaje. La memoria, capacidad de cálculo y habilidad visuoespacial están mejor conservadas que en la EA29.
En la LBD la alteración cognitiva se asocia a enlentecimiento psicomotor, déficit en función ejecutiva y signos extrapiramidales: parkinsonianos (caídas, hipomimia, rigidez, temblor, etc), también hay alucinaciones de aparición precoz, fluctuaciones en el nivel de vigilia y trastorno conductual del sueño REM30.
En los pacientes con demencia existen tanto síntomas cognitivos como conductuales que interactúan dando cuenta de la afección funcional del paciente:
- •
Sintomatología cognitiva: compromiso de la memoria, afasia, apraxia, agnosia, etc.
- •
Sintomatología no cognitiva o conductual: depresión, delirios, irritabilidad, cambios de personalidad, agitación, etc.
En EA se describe entre 30-50% de sintomatología depresiva,31 y un 10% de depresión mayor32. En la demencia vascular la prevalencia de depresión mayor es de más de 30%33.
En la DFT vc las manifestaciones conductuales son tan frecuentes que hasta el 50% de estos pacientes ha recibido un diagnóstico inicial primario psiquiátrico34.
Diagnóstico diferencialComo los trastornos del ánimo y la demencia comparten sintomatología pero difieren en su etiología, pronóstico y abordaje terapéutico es muy importante hacer un diagnóstico diferencial. Este se plantea especialmente con las etapas iniciales de la demencia. La mayoría de las veces este diagnóstico no reviste dificultades. Sin embargo, existen situaciones en que este es complejo. Como por ejemplo, cuando existe como primera manifestación la sintomatología anímica asociada al deterioro cognitivo, cuando no se puede obtener una historia clara y detallada, cuando el estado mental del paciente imposibilita un estudio neuropsicológico y cuando la demencia se manifiesta inicialmente con alteraciones conductuales y no cognitivas35.
Depresión Tardía y DemenciaHistoria y examen clínicoEs fundamental obtener una historia clínica detallada tanto del paciente como de la familia en especial cuando existe una baja conciencia de enfermedad.
La cronología en la aparición de los síntomas, es decir, el orden y la progresión de estos puede orientar a una demencia o una depresión. En la depresión el desánimo suele preceder la aparición de las alteraciones cognitivas y estas se instalan rápidamente. Por el contrario, en la demencia, el deterioro cognitivo es de comienzo insidioso y los síntomas anímicos aparecen posteriormente.
Se debe preguntar por antecedentes personales y familiares psiquiátricos y neurológicos. Antecedentes personales de depresiones recurrentes orientan a un trastorno del ánimo. Una historia familiar de demencia inclina a pensar en un trastorno neurocognitivo mayor, mientras que una historia familiar de depresión a un trastorno del ánimo.
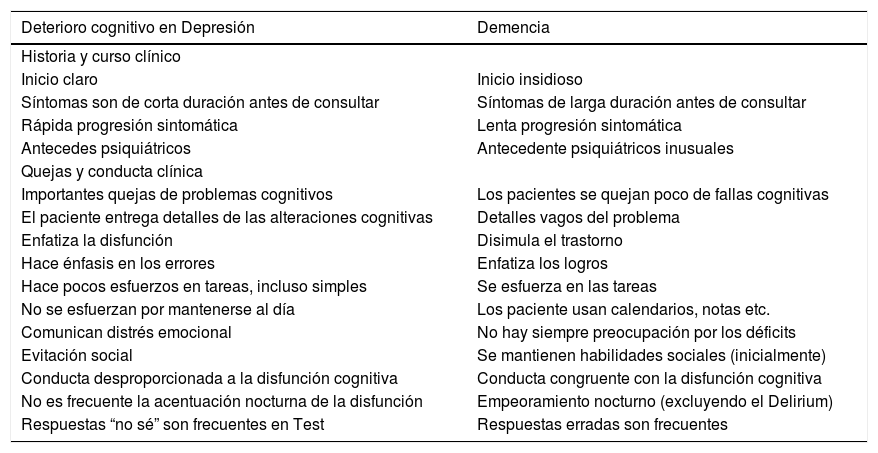
Leslie Kiloh en el año 1961 acuñó el término de “pseudodemencia” para referirse al deterioro cognitivo, como manifestación principal, encontrado en pacientes sin un cuadro neurodegenerativo de base. Frecuentemente reversible y relacionado a un cuadro psiquiátrico, generalmente a un episodio depresivo36. Es un concepto controversial por su falta de especificidad, porque induce a pensar que las fallas cognitivas de los pacientes depresivos no son genuinas y clínicamente relevantes y porque muchas veces después de un intervalo asintomático, una proporción mayor de lo esperable por azar puede presentar una demencia primaria franca. Sin embargo, las descripciones clínicas que se han hecho para diferenciar ambos cuadros siguen utilizándose hoy en día. Un resumen de las diferencias entre el deterioro cognitivo en depresión y demencia aparece en la Tabla 3.
Diferencias entre deterioro cognitivo en depresión y demencia37
| Deterioro cognitivo en Depresión | Demencia |
|---|---|
| Historia y curso clínico | |
| Inicio claro | Inicio insidioso |
| Síntomas son de corta duración antes de consultar | Síntomas de larga duración antes de consultar |
| Rápida progresión sintomática | Lenta progresión sintomática |
| Antecedes psiquiátricos | Antecedente psiquiátricos inusuales |
| Quejas y conducta clínica | |
| Importantes quejas de problemas cognitivos | Los pacientes se quejan poco de fallas cognitivas |
| El paciente entrega detalles de las alteraciones cognitivas | Detalles vagos del problema |
| Enfatiza la disfunción | Disimula el trastorno |
| Hace énfasis en los errores | Enfatiza los logros |
| Hace pocos esfuerzos en tareas, incluso simples | Se esfuerza en las tareas |
| No se esfuerzan por mantenerse al día | Los paciente usan calendarios, notas etc. |
| Comunican distrés emocional | No hay siempre preocupación por los déficits |
| Evitación social | Se mantienen habilidades sociales (inicialmente) |
| Conducta desproporcionada a la disfunción cognitiva | Conducta congruente con la disfunción cognitiva |
| No es frecuente la acentuación nocturna de la disfunción | Empeoramiento nocturno (excluyendo el Delirium) |
| Respuestas “no sé” son frecuentes en Test | Respuestas erradas son frecuentes |
Un diagnóstico diferencial particularmente complejo con depresión lo constituye la DFT vc. Esta aparece en individuos menores de 65 años, donde la sospecha de demencia es baja. Presenta al inicio más alteraciones conductuales que cognitivas y los pacientes suelen ser atendidos en atención primaria o en settings psiquiátricos, donde los médicos no tienen la experiencia de trabajar con este tipo de pacientes. Habitualmente no se diagnostica o se hace tardíamente.
Tanto la Depresión Mayor como la DFT vc, comparten la pérdida de interés, baja de energía y desconcentración. Sin embargo, el ánimo bajo permanente no está presente en DFT. Habitualmente no existe culpa, baja autoestima o pensamientos suicidas. El síntoma característico es la apatía que muchas veces es confundido con desánimo o anhedonia. La apatía es una pérdida de la motivación, que se expresa en una reducción de iniciativa y respuesta emocional al medio. No es egodistónica ni acompañada de disforia.
En este caso es importante ver cómo los síntomas conductuales se desvían del comportamiento habitual del paciente. Un cambio en la personalidad gradual, con apatía, pérdida de empatía, desinhibición, una disfunción ejecutiva y alteraciones amnésicas orientan a una DFT38.
Por último, la evaluación deberá incluir un examen neurológico que busque dirigidamente la presencia de síntomas que orienten a una demencia, por ejemplo: sintomatología focal, síntomas extrapiramidales o reflejos involutivos.
TAB y DemenciaHistoria y examen clínicoAl igual que en la depresión es importante una anamnesis rigurosa y una anamnesis externa poniendo énfasis en la aparición cronológica de los síntomas. También en la historia personal y familiar de trastornos del ánimo o demencia y en el examen neurológico.
Los episodios maniacos o depresivos, característicos del trastorno bipolar pueden ser una manifestación de cualquier demencia, aunque son más frecuentes en la DFT vc.
Las similitudes y diferencias en la depresión se detallaron previamente. Se puede agregar que en la depresión bipolar es habitual la presencia de sintomatología atípica, como por ejemplo hiperfagia e hipersomnia y que estos síntomas también se observan en la demencia.
Los episodios maniacos del TAB y la DFT comparten la irritabilidad, desinhibición y distractibilidad, como también el involucrarse en conductas de riesgo. Muchas veces presenta una alteración en el juicio.
En DFT el paciente puede mostrar una jocosidad inapropiada, que puede confundirse con el ánimo eufórico de una manía. Sin embargo, el sentido de invulnerabilidad y de grandiosidad suele estar ausente en la demencia.
La diferencia principal es que la demencia evoluciona a un deterioro cognitivo inexorablemente, mientras el TAB es de curso episódico. Incluso cuando las fallas cognitivas permanecen de forma crónica, no son de la magnitud ni progresan como en una demencia.
Hay un grupo de pacientes que cumplen criterios para una DFT pero que no tienen un deterioro claro ni alteraciones en las neuroimágenes. Son fenocopias de DFT vc. Se ha descrito una forma muy lentamente progresiva secundaria a una mutación genética en el gen C9ORF7239.
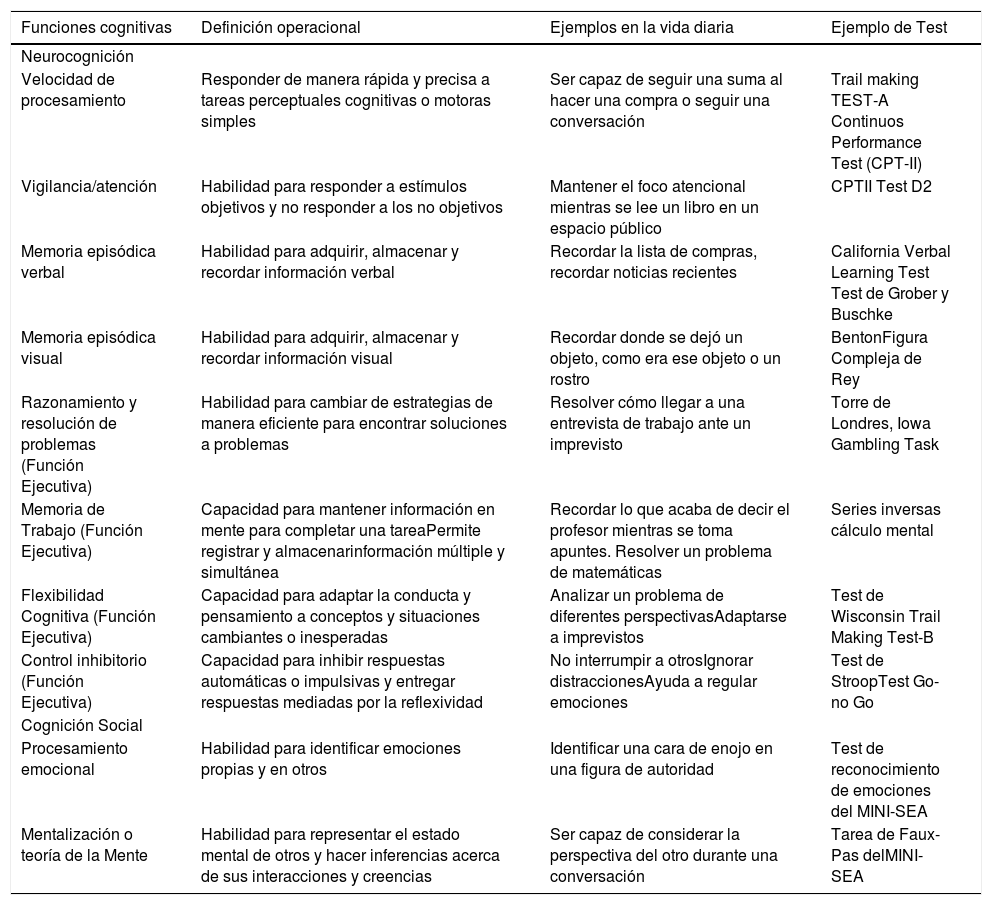
Perfil cognitivo y evaluación neuropsicológica como herramienta de apoyo en el diagnóstico diferencialLos neuropsicólogos se apoyan en la historia clínica, en la observación de la conducta, en tests neuropsicológicos y en cuestionarios o escalas neuropsiquiátricas. Exploran básicamente funciones cognitivas, incluyendo cognición social (Tabla 4), además de la esfera conductual, emocional y funcional.
Funciones cognitivas y de cognición social. Definición operacional y ejemplos de test de evaluación
| Funciones cognitivas | Definición operacional | Ejemplos en la vida diaria | Ejemplo de Test |
|---|---|---|---|
| Neurocognición | |||
| Velocidad de procesamiento | Responder de manera rápida y precisa a tareas perceptuales cognitivas o motoras simples | Ser capaz de seguir una suma al hacer una compra o seguir una conversación | Trail making TEST-A Continuos Performance Test (CPT-II) |
| Vigilancia/atención | Habilidad para responder a estímulos objetivos y no responder a los no objetivos | Mantener el foco atencional mientras se lee un libro en un espacio público | CPTII Test D2 |
| Memoria episódica verbal | Habilidad para adquirir, almacenar y recordar información verbal | Recordar la lista de compras, recordar noticias recientes | California Verbal Learning Test Test de Grober y Buschke |
| Memoria episódica visual | Habilidad para adquirir, almacenar y recordar información visual | Recordar donde se dejó un objeto, como era ese objeto o un rostro | BentonFigura Compleja de Rey |
| Razonamiento y resolución de problemas (Función Ejecutiva) | Habilidad para cambiar de estrategias de manera eficiente para encontrar soluciones a problemas | Resolver cómo llegar a una entrevista de trabajo ante un imprevisto | Torre de Londres, Iowa Gambling Task |
| Memoria de Trabajo (Función Ejecutiva) | Capacidad para mantener información en mente para completar una tareaPermite registrar y almacenarinformación múltiple y simultánea | Recordar lo que acaba de decir el profesor mientras se toma apuntes. Resolver un problema de matemáticas | Series inversas cálculo mental |
| Flexibilidad Cognitiva (Función Ejecutiva) | Capacidad para adaptar la conducta y pensamiento a conceptos y situaciones cambiantes o inesperadas | Analizar un problema de diferentes perspectivasAdaptarse a imprevistos | Test de Wisconsin Trail Making Test-B |
| Control inhibitorio (Función Ejecutiva) | Capacidad para inhibir respuestas automáticas o impulsivas y entregar respuestas mediadas por la reflexividad | No interrumpir a otrosIgnorar distraccionesAyuda a regular emociones | Test de StroopTest Go-no Go |
| Cognición Social | |||
| Procesamiento emocional | Habilidad para identificar emociones propias y en otros | Identificar una cara de enojo en una figura de autoridad | Test de reconocimiento de emociones del MINI-SEA |
| Mentalización o teoría de la Mente | Habilidad para representar el estado mental de otros y hacer inferencias acerca de sus interacciones y creencias | Ser capaz de considerar la perspectiva del otro durante una conversación | Tarea de Faux-Pas delMINI-SEA |
En base al conocimiento de los perfiles neuropsicológicos propios de cada condición clínica, aportan al diagnóstico diferencial de los pacientes.
Existen algunos trastornos neuropsiquiátricos que revisten particular dificultad a la hora del diagnóstico. Es el caso de la díada trastornos del ánimo-demencia.
El perfil en Late Life Depression (LLD) es heterogéneo, sin embargo, la alteración más común (50%) es la disfunción ejecutiva seguida por enlentecimiento en velocidad de procesamiento de la información (20%). Este enlentecimiento, junto con la afectación de la memoria de trabajo parecen ser los déficits distintivos en la LLD40,41.
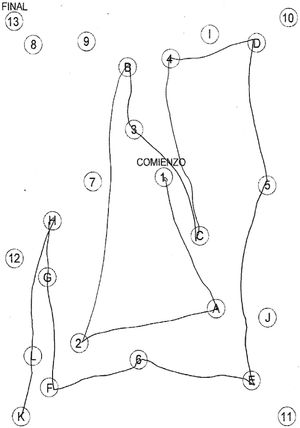
Desde el punto de vista psicométrico los perfiles de memoria parecen ser lo que más las diferencian: la curva de aprendizaje en la LLD es de mejor nivel, esto es, los pacientes se benefician de repeticiones del mismo material, a diferencia de quienes desarrollarán una demencia. El reconocimiento del material presentado previamente también es mejor en los pacientes con LLD: los pacientes con demencia tienden a olvidar lo aprendido42. Otras alteraciones, como el perfil en funciones ejecutivas también, son distintivas. Por ejemplo, en el estudio de Potter43 el desempeño en el TMT-B (Figura 1) fue altamente predictivo de aquellos sujetos con LLD que se convertirían a demencia.
Trail Making Test-B44
En esta clásica tarea de Función Ejecutiva se le pide al paciente unir los números y letras alternándolos en orden ascendente (1-A-2-B-3-C, etc), sin levantar su lápiz. Requiere de atención selectiva, memoria de trabajo y flexibilidad cognitiva. En este ejemplo el paciente no logra inhibir estímulos que aparecen en su ruta.
En el diagnóstico diferencial entre DFT vc y TAB, una entrevista en profundidad con los familiares y escalas específicas para evaluar posibles cambios atribuibles a circuitos frontales es lo indicado (Figura 2).
Escala de comportamiento de los sistemas frontales (FrSBe) (sección inicial)45
El FrSBe es un cuestionario de 46 ítems desarrollado para evaluar alteraciones conductuales vinculados a tres circuitos frontales: corteza cingulada anterior asociada a apatía, corteza orbitofrontal asociada a desinhibición y desregulación emocional, y corteza pre-frontal dorsolateral asociadas a disfunción ejecutiva.
Lo cierto es que los pacientes presentan un deterioro progresivo en su comportamiento social, conducta, procesamiento emocional y cognición.
La alteración de FE (ej. atención, organización, abstracción, juicio, resolución de problemas, flexibilidad cognitiva) es considerada un síntoma cardinal en la DFT vc, sin embargo, es común con otros condiciones neuropsiquiátricas, por lo que es menos específica.
Un área de creciente interés ha sido el estudio de las alteraciones de la cognición social. Actualmente hay consenso en considerarlas como una alteración temprana en la DFT vc. Los pacientes presentan dificultad para reconocer emociones (Figura 3), particularmente negativas: tienden a subestimar la intensidad de las emociones primarias (ej. miedo, enojo) y sobreestiman emociones secundarias (ej. vergüenza, rencor). El confundir una emoción y/o su intensidad puede generar malentendidos y conflictos. La dificultad para mentalizar, tomar la perspectiva de otro y detectar fallas en la interacción social (Figura 4) también discrimina entre pacientes con DFT vc, con controles y pacientes con Trastornos del ánimo46.
Ítem de ejemplo de la tarea de reconocimiento de emociones básicas de la Batería MINI-SEA46.
Historia de ejemplo de la tarea de Faux Pas46
Historia de ejemplo de la tarea de Faux Pas, que evalúa la capacidad de detectar “meteduras de pata”, su origen y las posibles consecuencias en los personajes.
En el TAB es posible observar déficits en atención sostenida, memoria verbal y FE que pueden estar presentes antes del inicio de los síntomas psiquiátricos y persistir hasta la vejez, incluso durante periodos de eutimia, exacerbándose durante episodios agudos. Varios estudios muestran que el patrón y magnitud de los déficits cognitivos permanece estable a lo largo de la vida. La evolución hacia demencia es poco frecuente (6-9%), aunque una historia larga de TAB podría incrementar el riesgo de desarrollar una DFT vc antes de los 60 años47.
Nuevas técnicas en el diagnóstico precoz de las demencias como ayuda en el diagnóstico diferencialLos avances en el estudio de la demencia nos permiten hoy en día contar con nuevas técnicas diagnósticas, que permiten realizar un diagnóstico en fases más tempranas, determinar la probabilidad de progresión y mejorar la especificidad en el diagnóstico diferencial.
Dentro de los estudios más avanzados actualmente se cuenta con:
- -
Estudio genético
- -
Biomarcadores moleculares en líquido cefalorraquídeo
- -
Estudios de neuroimagenes (volumetría de hipocampo, RNM funcional, técnicas de NeuroSpect, PET de fluorodeoxiglucosa (F18-FDG), PET de amiloide).
Estas técnicas, si bien se encuentran disponibles en centros avanzados, aun no se ha definido claramente su uso en el escenario clínico y se utilizan en casos seleccionados y a criterio de experto.
Los estudios genéticos se pueden realizar en un seleccionado grupo de pacientes, de presentación precoz o que tienen prominentes antecedentes familiares, es decir, historia familiar autosómica dominante de inicio precoz y debieran realizarse con el claro consentimiento del paciente y/o familiares y bajo asesoría genética.
Los biomarcadores en líquido cefalorraquídeo (LCR), miden la proporción de beta-amiloide y proteína Tau en el LCR. En el LCR de los pacientes con EA se ha observado una reducción de los niveles de beta-amiloide46 y una elevación de los niveles de proteína tau fosforilada. La determinación conjunta (en panel) de estas moléculas en LCR distingue EA frente a controles sanos con valores de sensibilidad y especificidad superiores al 90%, si bien frente a otros procesos neurodegenerativos estos parámetros son más débiles48,49.
Aún más, las concentraciones de proteína Tau total, proteína Tau fosforilada y beta-amiloide42 parecen estar ya alteradas en los pacientes con deterioro cognitivo leve (DCL) que posteriormente evolucionarán a EA, por lo que se trata de una herramienta diagnóstica para poder identificar los sujetos con DCL con mayor riesgo de evolución a EA50.
Respecto al rol de las neuroimágenes, estas ayudan a valorar el daño estructural que puede dar cuenta del deterioro cognitivo del paciente, es decir, la valoración de la atrofia, del daño vascular, etc., que orientan hacia causas degenerativas, vasculares o mixtas.
La volumetría de hipocampos ha demostrado tener un valor en la diferenciación de las distintas etiologías, así en un estudio realizado en un grupo de pacientes, se demostró una reducción del volumen hipocampal de un 42% en pacientes con EA, de un 21% en demencia vascular, del 15% en pacientes con deterioro cognitivo leve y comparable al grupo control en pacientes con pseudodemencia51,52.
Tomografía por emisión de positrones (PET)El PET/CT no es utilizado rutinariamente en el estudio de trastornos psiquiátricos puros. Particularmente, los estudios referentes a los hallazgos del PET en cuadros depresivos son poco concluyentes y muchas veces contradictorios53. La utilidad potencial del PET/CT radicaría en que una captación normal de F18-FDG en el cerebro podría ayudar a distinguir una pseudodemencia debido a un trastorno del ánimo, de un cuadro ocasionado por una enfermedad neurodegenerativa, patología que sí se asocia frecuentemente a alteraciones al PET54.
El PET y actualmente el PET/CT, sí tienen indicación en el estudio de trastornos neurodegenerativos, especialmente en el diagnóstico diferencial de demencias55. Los radiotrazadores más utilizados son la glucosa marcada con Flúor 18, o F18-fluorodeoxiglucosa (F18-FDG), y los marcadores de depósito de beta-amiloide en el caso de la EA. El primero es de amplia disposición en los centros que cuentan con PET/CT y el segundo, constituye un número de compuestos, de los cuales el único disponible a la fecha en Chile, es el F18-Florbetaben. También existen marcadores para Proteína Tau, que se están comenzando a utilizar en el estudio de EA, aunque no hay tanta evidencia como en el caso de los marcadores de beta-amiloide y su disponibilidad es bastante más limitada.
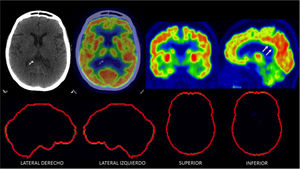
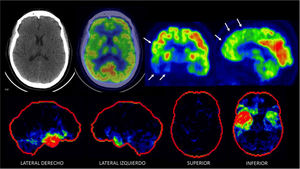
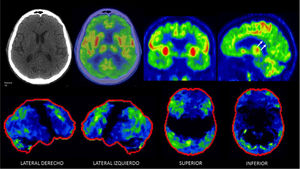
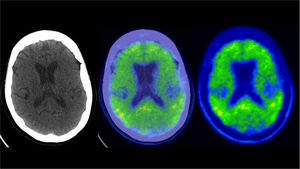
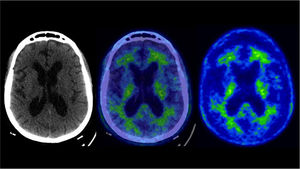
PET/CT cerebral con F18-FDGLa glucosa es el sustrato energético principal del cerebro y su distribución en el encéfalo da cuenta de la actividad neuronal y sináptica del paciente56. En un paciente normal existe alta captación homogénea de glucosa en la corteza cerebral y núcleos de la base (Figura 5). El consumo de glucosa suele estar alterado en pacientes con demencia, con patrones particulares según su etiología. Sin embargo, existen grados variables de sobreposición entre los hallazgos en la DFT (Figura 6), EA (Figura 7) y LBD54,57. Las áreas corticales dañadas muestran menor captación de F18-FDG, y corresponden a un marcador biológico de “injuria neuronal”56.
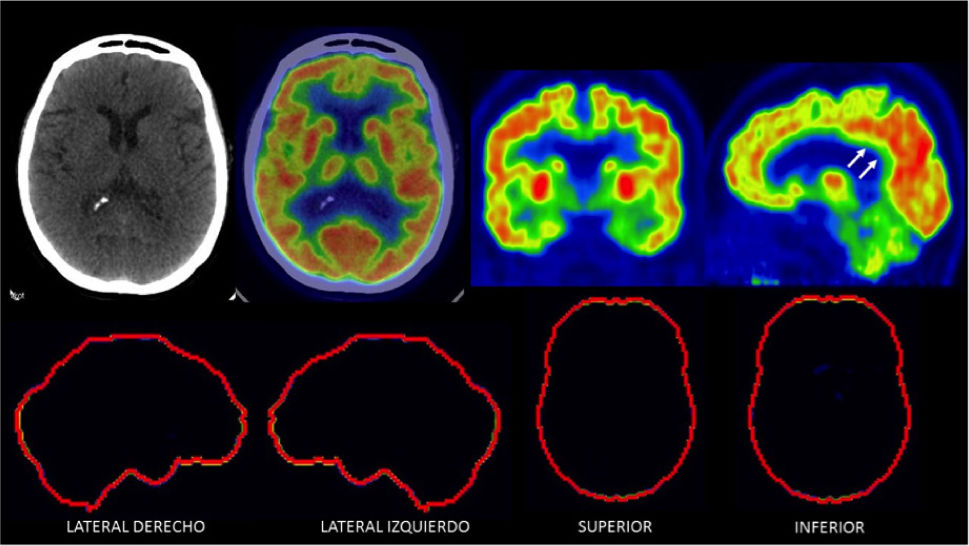
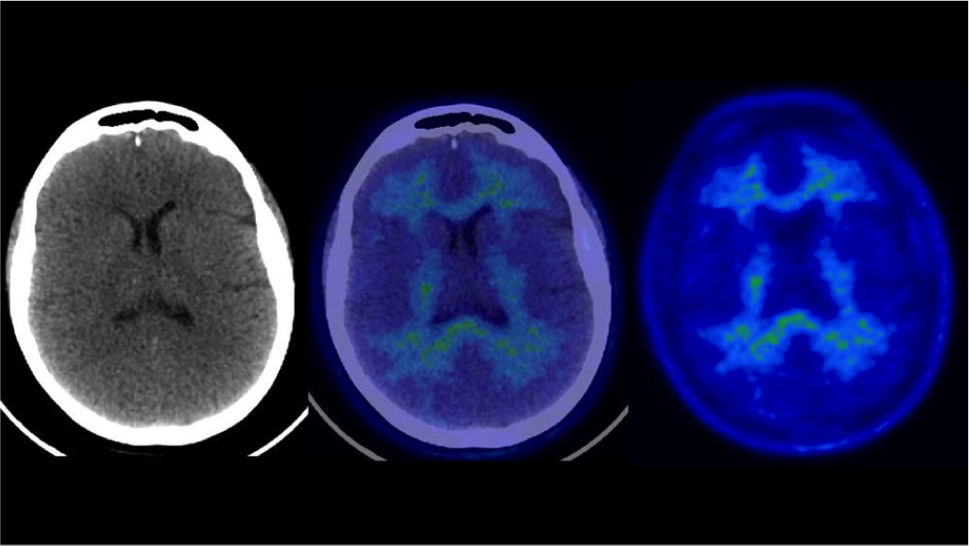
PET/CT F18-FDG normal en un paciente de 70 años con trastorno de memoria
Se observa captación alta homogénea en corteza cerebral, lo que indica actividad sináptica normal. Nótese captación simétrica entre ambos hemisferios cerebrales y la alta captación del cíngulo posterior (flechas). En las imágenes inferiores se muestra software de comparación con base de datos de cerebros normales de la misma edad y sexo (Cortex ID ®) sin alteraciones.
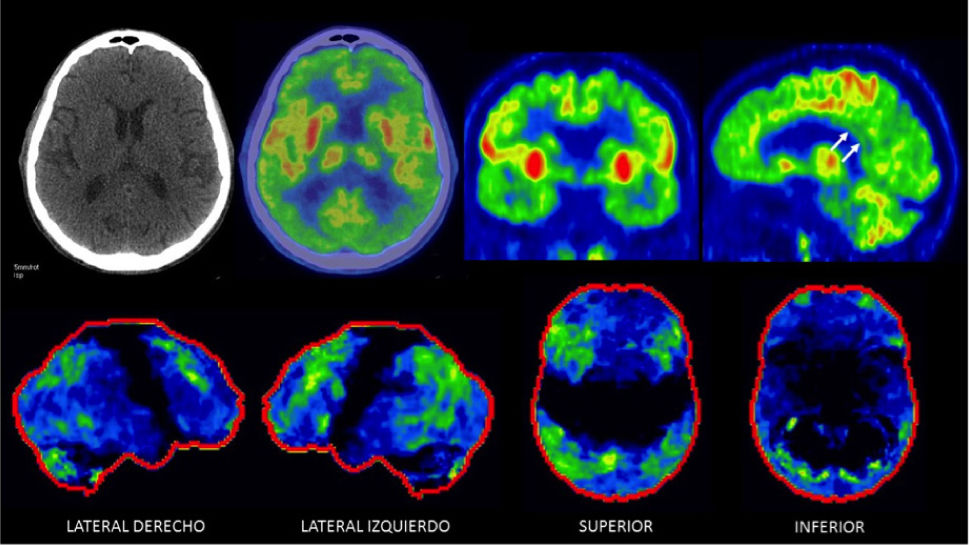
PET/CT F18-FDG en paciente de 68 años con demencia frontotemporal
Captación irregularmente disminuida en corteza temporal y frontal, especialmente a derecha (flechas). El cíngulo posterior se aprecia de metabolismo glucídico conservado. En las imágenes inferiores se muestra software Cortex ID ® con severa alteración temporal y frontal asimétrica (en rojo lo más alterado y en verde lo menos).
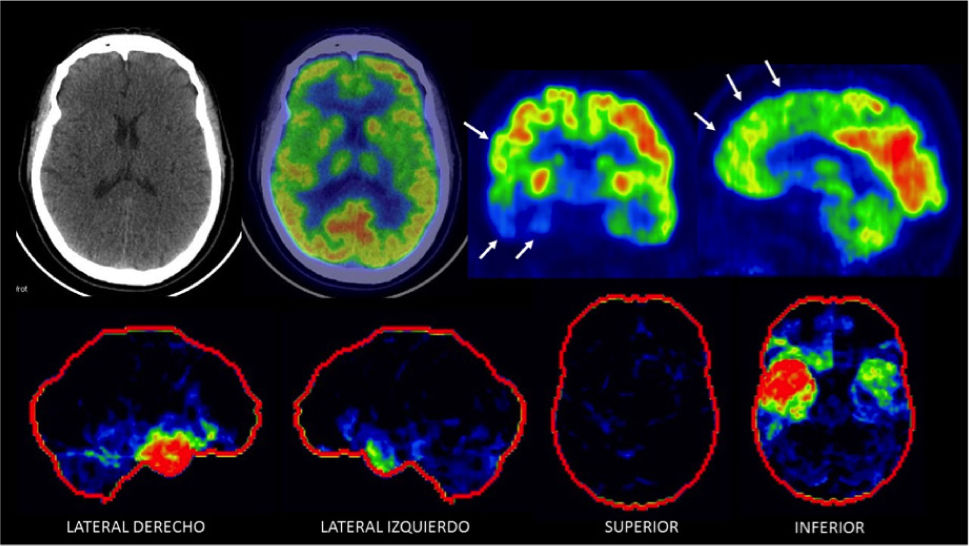
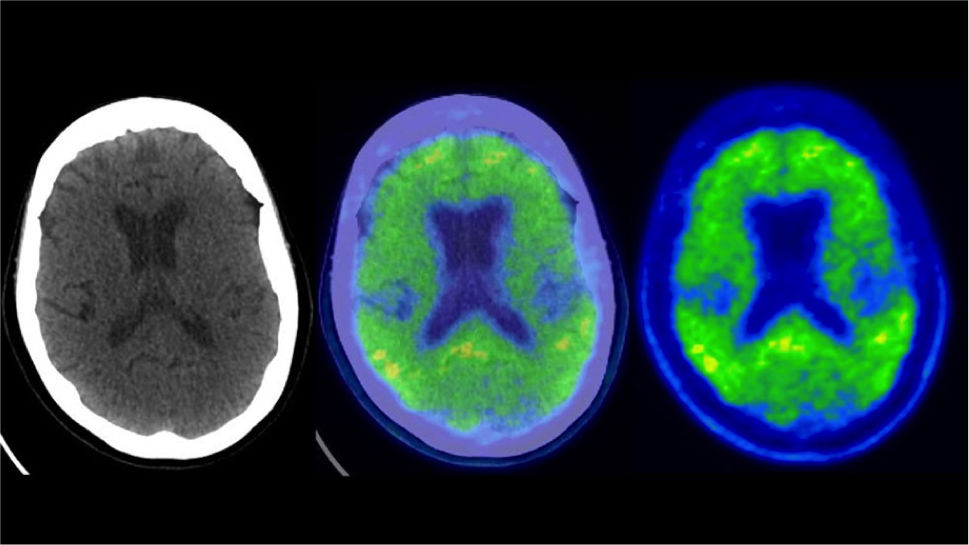
PET/CT F18-FDG en paciente de 71 años con enfermedad de Alzheimer
Típico patrón de hipocaptación de F18-FDG biparietotemporal, que puede ser asimétrica como en este paciente que es más acentuada a izquierda, con compromiso del cíngulo posterior (flechas). Hay respeto relativo de la banda motora a ambos lados. En algunos casos puede existir alteración de la corteza frontal, como en este paciente. En las imágenes inferiores las alteraciones descritas son significativas respecto a la comparación con base de datos (captación -2DS bajo lo esperado para la edad y sexo).
El PET/CT con F18-FDG es útil también en el diagnóstico precoz de demencia, ya que las alteraciones anteceden en varios años al inicio de los síntomas58. La interpretación de las imágenes debe ser llevada a cabo por un especialista con alta experiencia y con apoyo de software diagnósticos asistidos por computador54 que permitan optimizar la detección de alteraciones en el metabolismo glucídico cerebral global y/o regional.
Los cambios más precoces en EA son hipocaptación del cíngulo posterior, seguido por menor captación en precuña, y aspecto posterior de lóbulos temporales y parietales, simétrico o asimétrico56,58 (Figura 7). La afectación del lóbulo frontal suele ser tardío en esta enfermedad56. Puede observarse hipometabolismo temporal mesial en etapas intermedias, que puede no ser correlativa con la atrofia del hipocampo visible en la RM56,59.
La LBD presenta alteraciones de similar distribución, pero difiere en que con cierta frecuencia afecta los lóbulos occipitales60, los que están respetados en la EA. El patrón de alteraciones de la LBD es similar a la enfermedad de Parkinson con demencia y pueden ser indistinguibles con PET/CT utilizando F18-FDG.
En la DFT las áreas afectadas corresponden a la corteza frontal y temporal anterior, aunque también se pueden alterar la corteza temporal mesial, cuerpo estriado y tálamos (Figura 6).
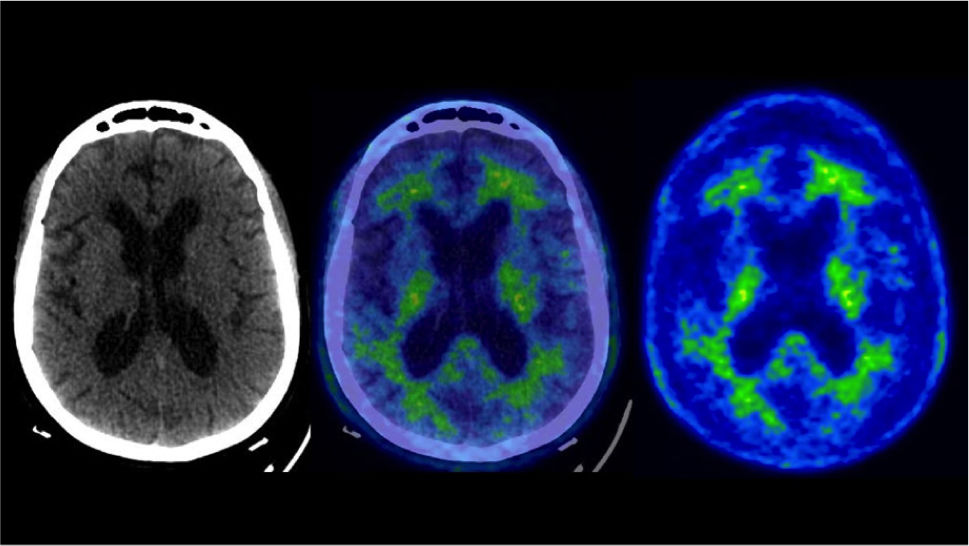
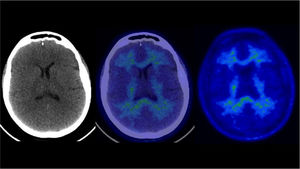
PET/CT cerebral para depósito de amiloideLa acumulación de β-amiloide extracelular es un sello distintivo de la EA en la anatomía patológica61. Esta es la base teórica para emplear PET/CT con trazadores de amiloide, y constituye una manera de explorar la carga de amiloide cerebral “in vivo”55. Al igual que el PET/CT con F18-FDG, el PET/CT con trazadores para amiloide puede predecir la ocurrencia de EA, ya que la acumulación anormal de β-amiloide antecede en décadas el inicio de los síntomas62. En la Figuras 8 y 9 se muestra un estudio normal y otro alterado, respectivamente.
Sin embargo, la acumulación de placas de β-amiloide no es exclusiva de EA, y puede observarse también en otras condiciones como el Sd. de Down, especialmente después de los 40 años, angiopatía amiloidea cerebral y aún en pacientes ancianos sanos63. Un PET/CT de paciente mayor con deterioro cognitivo leve, aunque sin criterios de EA, se muestra en la Figura 10. Por otro lado, los niveles de depósito de β-amiloide cerebral medido con PET/CT no muestran correlación con la gravedad de los síntomas de pacientes con EA63. Es por este motivo, que los hallazgos de este examen deben ser evaluados con cautela y en correspondencia los hallazgos clínicos y resto de marcadores disponibles.
Aun considerando esto, en un estudio reciente el PET/CT con amiloide mostró tener alto impacto en el manejo de pacientes con demencia, cambiando el diagnóstico etiológico desde EA a demencia no-EA en 25% de los pacientes y desde demencia no EA a EA en 10,5% de los casos64.
Actualmente el PET/CT con trazadores para amiloide está incluido en los criterios diagnósticos de EA, junto a los marcadores del líquido cefalorraquídeo55.
Existen radiotrazadores capaces de evaluar el sistema dopaminérgico, serotoninérgico y de otros receptores, así como de procesos de neuroinflamación, que han ayudado a comprender la fisiopatología de algunas enfermedades neurodegenerativas y psiquiátricas. Sin embargo, su uso actual se restringe más que nada al ámbito investigativo, y su utilidad en la práctica clínica no ha sido establecida aún65.
ConclusionesLa Demencia y los Trastorno del ánimo son problemas prevalentes en los adultos mayores y se espera que su frecuencia continúe incrementándose en la medida que la población envejezca. Ambas patologías implican un deterioro en la calidad de vida de los pacientes y cuidadores y se asocian a una mayor morbimortalidad.
La relación ánimo - cognición es compleja y los mecanismos que los vinculan aún no se han aclarado, considerándose la depresión un factor de riesgo, pródromo o expresión de una demencia.
La demencia, especialmente en sus etapas iniciales comparte sintomatología con los transtorno del ánimo. Esto se explica probablemente porque se afectan los mismos circuitos neuronales.
Al tener un pronóstico y abordaje médico diferente es importante hacer un diagnóstico diferencial precozmente. La clínica asociada a un estudio neuropsicológico y a las nuevas técnicas en el diagnóstico temprano de la demencia, facilitan esta tarea. Debido a la complejidad de este diagnóstico, es fundamental contar con un equipo médico multidisciplinario que incluya geriatras, neurólogos, neuropsicólogos, psiquiatras, radiólogos, entre otros.
Pese a un estudio exhaustivo hay ocasiones en que no es posible distinguir ambas patologías y solo la respuesta al tratamiento psiquiátrico y la evolución de la enfermedad permitirá hacer un diagnóstico certero.
Conflicto de interésDeclaración de conflicto de interés
Los autores declaran no tener conflictos de interés, en relación a este artículo.