A 50 años de experiencia, el trasplante cardíaco continúa siendo el tratamiento de elección en pacientes con insuficiencia cardíaca terminal. La creciente necesidad de trasplantes de corazón está incrementando las listas de espera. Lamentablemente, debido a la escasez de donantes, la demanda por órganos es mucho mayor que el número de trasplantes. En el presente manuscrito se revisa el estado actual del trasplante cardíaco, haciendo énfasis en la experiencia en el Reino Unido. Se comentan los criterios para la selección de receptores y la de donantes de órganos, examinando la donación en muerte encefálica (donation after brain death, DBD por sus siglas en inglés) y la donación por paro circulatorio (donation after circulatory death, DCD por sus siglas en inglés) y en como esta última ha contribuido a aumentar la oferta de órganos para trasplante. Se discuten las terapias alternativas al trasplante cardíaco en pacientes que exhiben deterioro mientras se encuentran en la lista de espera y que cumplen con las indicaciones actuales para el implante de un dispositivo de asistenca circulatoria (left ventricular assist device, LVAD por sus siglas en inglés). Los avances de supervivencia en el corto y mediano plazo se discuten, asi como tambien el manejo perioperatorio y el de mediano y largo plazo.
After just over 50 years of experience, heart transplantation continues tobethetreatmentofchoiceinpatients with end stage heart failure. The need for heart transplants is increasing the waiting lists. Regrettably, due to donor shortage and lack of suitable donors, the demand for donor organs is much higher than the rate at which patients are transplanted. In the following paper we review the current status of heart transplantation with some emphasis regarding the status of transplantation in the United Kingdom. We review selection criteria for recipients and organ donation looking into donation after brain death (DBD) and donation after circulatory death (DCD) and how the latter has contributed to the increase of available donor hearts. Alternatives to heart transplantation are discussed for patients who deteriorate while on the waiting list and that have an indication for implantation of a left ventricular assist device (LVAD). Improvements in short and medium term survival are discussed as well as perioperative, intermediate and long term management.
La insuficiencia cardíaca (IC) es una enfermedad con una preva- lencia estimada de unos 23.000.000 de enfermos en el mundo1. El patrón epidemiológico de la hipertensión arterial, la enfer- medad coronaria y el incremento de la obesidad hacen suponer que los casos de IC debieran incrementarse aún más. Si bien las recomendaciones vigentes para el manejo y tratamiento de la IC han contribuido al mejor manejo de la enfermedad, igualmente existe una proporción no despreciable de enfermos que progre- sarán hacia etapas avanzadas de IC. Para este grupo de enfermos las posibilidades y alternativas de tratamiento son limitadas pero el trasplante cardíaco junto al uso de dispositivos de asistencia ventricular implantables (LVAD, por sus siglas en inglés) son alter- nativas de tratamiento posible y con la capacidad de mejorar la supervivencia en pacientes en estado de IC terminal2. Ambas opciones presentan limitantes importantes. El trasplante cardíaco se encuentra limitado por la disponibilidad de donantes de órganos. Los dispositivos implantables de asistencia circulatoria se encuentran limitados por los malos resultados a largo plazo y por su elevado costo. El objetivo de este manuscrito es hacer un análisis del estado actual del trasplante cardíaco, analizar los resultados actuales, sus limitaciones y las alternativas de trata- miento existentes.
2Indicaciones y Contraindicaciones Del Trasplante De CorazónEl trasplante de corazón es el tratamiento de elección en pacientes con IC avanzada limitados por síntomas con respuesta insuficiente al tratamiento convencional y que tienen un precario pronóstico de supervivencia3. Las limitaciones actuales en el número de donantes efectivos hacen aún más importante que la selección de enfermos candidatos para trasplante sea adecuada y que proporcione el mayor beneficio a los pacientes seleccionados. Por lo tanto, la asig- nación de un escaso recurso, el corazón donado, debe ser vista desde dos ángulos. El primer aspecto a considerar es el de riesgo/beneficio del potencial receptor al ser trasplantado. El segundo aspecto a considerar es el beneficio individual relativo comparado con el potencial beneficio de otros tipos de receptores; por ejemplo el beneficio relativo de trasplantar un enfermo con una miocar- diopatía dilatada comparado con el beneficio de trasplantar un paciente con cardiopatía congénita y multiples operaciones previas. El trasplante de corazón debe ser considerado cuando hay una probabilidad clara de mejorar la supervivencia y la calidad de vida del receptor. Las enfermedades cardiovasculares que constituyen la principal indicación de trasplante en el Reino Unido de acuerdo con el último Annual Report de National Health Service Blood and Transplant/National Health Service England (NHSBT/NHSE por sus siglas en inglés) se enumeran en la Tabla 1.4 Esta distribución es similar a la citada en otros registros internacionales2,5,6. Si bien éstas proporciones se han mantenido relativamente estables, progresi- vamente hemos visto un incremento en casos más complejos que han evolucionado hacia la IC terminal y que requieren de un tras- plante. Dentro de éstos se encuentran los trasplantes combinados de corazón-riñon, corazón-hígado y trasplantes en pacientes con cardiopatías congénitas, en especial aquellas con fisiología univen- tricular y circulación de Fontan. Independiente de la patología de base los candidatos a trasplante cardíaco son hoy en día evaluados bajo dos posibles circunstancias:
- 1.
En forma electiva: pacientes estables, ambulatorios.
- 2.
Como candidatos urgentes: casos agudos con descompensa- ción reciente y que requieren de tratamiento como pacientes hospitalizados.
Enfermedades Cardiovasculares que llevan a insuficiencia cardíaca y trasplante de corazón
| Cardiomiopatía idiopática | 72% |
| Cardiomiopatía isquémica | 17% |
| Cardiopatías congénitas | 5% |
| Rechazo o falla del injerto | 1% |
| Otras causas | 5% |
NHSBT Annual Report on Cardiothoracic Organ Transplantation, Report for 2020/2021 (1 Abril 2011- 31 Marzo 2021) en colaboracion con NHS England4.
La Tabla 2 resume las condiciones para considerar a un enfermo como candidato a trasplante.
| Indicaciones para referir en forma ambulatoria pacientes con insuficiencia cardíaca para evaluación para trasplante de corazón |
|---|
| 1. Pacientes en tratamiento médico óptimo y con síntomas limitantes durante el ejercicio. |
| 2. Pacientes con descompensaciones frecuentes y que requieren hospitalización (dos o mas en 12 meses) a pesar de tratamiento médico bien llevado y adherente. |
| 3. Deterioro progresivo de la función renal o inhabilidad para tratar la congestión sin afectar adversamente la función renal. |
| 4. Necesidad de disminuir o suspender drogas que tienen un pronóstico positivo en el manejo de la IC debido a síntomas (hipotensión) o deterioro de la función renal. |
| 5. Deterioro de la función del ventrículo derecho o aumento de la presión en la arteria pulmonar. |
| 6. Aumento progresivo del péptido natriurético a pesar de tratamiento médico bien llevado. |
| 7. Episodios crecientes de arritmias ventriculares a pesar de tratamiento farmacológico y/o electrofisiológico óptimo. |
| 8. Presencia de anemia, pérdida de peso progresiva, hiponatremia, disfunción hepática, atribuible a la insuficiencia cardíaca. |
| Indicaciones para referir como urgente para evaluación de trasplante de corazón |
| 1. Imposibilidad de suspender terapia endovenosa con inótropos. |
| 2. Necesidadde tratamiento con cualquier modalidad de asistencia mecánica circulatoria. |
| 3. Necesidad de uso de ventilación mecánica en pacientes con edema pulmonar. |
| 4. Arritmias ventriculares refractarias. |
| (Todo lo anterior en ausencia de contraindicaciones para trasplante de corazón) |
Traducido de Bhagra SK et al., 20193.
Tanto pacientes ambulatorios como pacientes urgentes deben ser sometidos a una estricta evaluación para determinar la necesidad de trasplante, los riesgos versus beneficios y excluir contraindi- caciones. Es evidente que debido a las limitaciones de cada caso, pacientes referidos en estado agudo son más difíciles de evaluar que aquellos referidos para evaluación ambulatoria.
Las contraindicaciones para trasplante se resumen en la Tabla 3. La gran mayoría de éstas contraindicaciones son relativas, muchas de ellas reversibles y que deben ser evaluadas en el contexto de la necesidad de cada enfermo, la necesidad clinica, y la disponi- bilidad de órganos.
Contraindicaciones para trasplante cardíaco
| 1. Pacientes con infección activa (aquellos pacientes con infecciones virales crónicas tales como hepatitis B, hepatitis C, virus VIH, pueden ser considerados como candidatos siempre y cuando hayan completado tratamiento, tengan títulos virales negativos y no muestren evidencia de daños en otros órganos). |
| 2. Enfermedad vascular periférica y/o cerebral sintomática. |
| 3. Diabetes mellitus con daño orgánico: nefropatía, neuropatía, retinopatía proliferativa. Una diabetes mal controlada con Hb glicosilada >7,5% es una contraindicación relativa pero debe ser analizada en el contexto general del paciente. |
| 4. Neoplasias recientes, en especial<de 5 años: los riesgos de recidiva deben tener siempre la opinión de un oncólogo. |
| 5. Enfermedad pulmonar concomitante severa: Volumen espiratorio forzado en un Segundo (VEF1) y/o capacidad vital forzada (CVF) <50% del valor predictivo. |
| 6. Disfunción renal con filtración glomerular estimada <30ml/min/m2. |
| 7. Disfunción hepática irreversible: cirrosis hepática. |
| 8. Embolia pulmonar reciente <3 meses. |
| 9. Hipertension pulmonar con presión pulmonar sistólica >60mmHg, gradiente transpulmonar (TPG) >15mmHg y/o resistencia vascular pulmonar (PVR) >5 unidades Wood. Si estos son irreversibles con manipulación farmacológica entonces esto constituye una contraindicación absoluta a trasplante único de corazón. |
| 10. Elemento sociales y psicológicos: especialmente falta de apoyo familiar, no adherencia a tratamiento, fumador activo, abuso de alcohol, abuso de drogas recreacionales. |
| 11. Obesidad (IMC: >35kg/m2 o >140% del peso ideal. |
| 12. Enfermedades sistémicas con pobre supervivencia a largo plazo. |
Traducido de Bhagra SK et al., 20193.
Como ya se mencionaba más arriba, el proceso de evaluación tiene por objetivo confirmar la necesidad de trasplante a la vez de determinar la existencia de condiciones que lo contraindiquen. En la Tabla 4 se detallan los exámenes que se efectúan como parte de la evaluación y que se encuentran en nuestro protocolo. Esta lista no es exhaustiva y la necesidad de investigaciones o tests adicionales está determinada por las necesidades individuales de cada enfermo. Los pacientes que son evaluados en la categoría de urgencia, vale decir pacientes dependientes de drogas vasoactivas ó en soporte mecánico, deben someterse al mismo proto- colo con las adaptaciones necesarias de cada caso. Finalmente, todos los casos deben ser discutidos para su aceptación o rechazo en una reunión multidisciplinaria con participación amplia de los especialistas involucrados en el cuidado pre, intra y postopera- torio de éstos enfermos. Los exámenes que más gravitan en la decisión para trasplante son:
Exámenes solicitados por protocolo en Queen Elizabeth Hospital (Birmingham, Inglaterra) antes del trasplante
| 1. Sangre: hemograma, función renal, función hepática, función tiroídea, HbA1c, Fe plasmático, niveles de péptido natriurético, perfil lipídico. |
| 2. Orina: toxicología en caso necesario, razón albúmina/creatinina, microscopía y cultivo. |
| 3. Microbiologia: hepatitis B, hepatitis C, virus de la inmunodeficiencia humana (VIH), virus de Epstein-Barr, citomegalovirus, virus del herpes simple (VHS), toxoplasma. |
| 4. Grupo sanguíneo y tipificación tisular. |
| 5. Estatura, peso, índice de masa corporal (IMC). |
| 6. Imágenes: ecocardiograma, radiografía de tórax, tomografía computarizada de tórax, abdomen y pelvis, ecografía Doppler vascular, ultrasonografía de hígado/riñón, angiografía coronaria, resonancia magnética. |
| 7. Tests funcional: test cardiopulmonar de esfuerzo. |
| 8. Funcion pulmonar. |
| 9. Cateterismo derecho. |
1. Test de ejercicio cardiopulmonar:evalúa en forma objetiva la capacidad funcional. El test pretende evaluar en forma obje- tiva la limitación sintomática que el paciente refiere. El test de ejercicio cardiopulmonar mide el consumo de oxígeno del indi- viduo y el umbral al que el metabolism se transforma de aerobio a anaerobio (respiratory exchange ratio (RER) que corresponde al umbral de máximo ejercicio, normalmente >1,05). En aquellos pacientes que alcanzan un RER >1,05 y que tienen un consumo peak de oxígeno <10ml/kg/min, el test es un fuerte predictor de mal pronóstico7 de supervivencia en el mediano plazo. En pacientes intolerantes al uso de beta-bloqueadores se acepta un consumo peak de oxígeno <14ml/kg/min como valor de mal pronóstico8,9. En pacientes jóvenes <50 años la interpretación del consumo peak de O2 es menos predecible ya que por lo general estos enfermos se encuentran mejor condicionados. En éstos casos un consumo de oxígeno inferior a 50% del valor predicho puede, también, ser usado junto con el consumo peak de O2.
2. Cateterismo cardíaco derecho:con un cateter en la arteria pulmonar es posible medir directamente presiones de aurícula derecha, presión de capilar pulmonar, presiones en la arteria pulmonar, gradiente transpulmonar (presión arterial pulmonar media - presión de capilar pulmonar) como también hacer mediciones de gasto cardíaco. Presiones de llenado elevadas y aumento de la gradiente transpulmonar (TPG por sus siglas en inglés) >15 se encuentran asociada con un peor pronóstico11,12.
3. Marcadores:dentro del grupo de marcadores bioquímicos en la IC y uno de los más estudiados es el péptido atrial natriurético (NT-proBNP por sus siglas en inglés). Pacientes con tratamiento óptimo y que persisten con niveles de proBNP elevados requieren de un trasplante de corazón en los siguientes 12 meses. Por el contrario, pacientes con niveles <750pg/ml se encuentran en una categoría de menos riesgo en las que el trasplante puede ser diferido al menos por 2 años13,14.
Las contraindicaciones para trasplante han sido ya enumeradas en la Tabla 3. Si bien las contraindicaciones en su mayoría son relativas, vale la pena detenerse a analizar algunas de ellas en más detalle.
1. Edad: en la última década se ha visto un incremento en el número de candidatos a trasplante en pacientes mayores de 60 años2. La supervivencia a 5 años en pacientes mayores de 70 años es similar a la de aquellos de 60-69 años. Sin embargo la supervivencia a 5 años en pacientes>de 70 años es signifi- cativamente peor que la de enfermos trasplantados de 18-59 años15.
2. Hipertensión pulmonar: presión sistólica en la arteria pulmonar >60mmHg y/o gradiente transpulmonar >15mmHg se asocian con mayor disfunción ventricular derecha del corazón trasplantado9. Pacientes con hipertensión pulmonar y TPG >15mmHg se consideran una contraindicación para trasplante cardíaco ya que muestran una incidencia de disfunción primaria del injerto significativamente mayor que pacientes sin hiperten- sión pulmonar o con TPG <15mmHg. En pacientes jóvenes,<de 60 años o pacientes con hipertensión pulmonar y TPG>de 15; y en general sin morbilidad significativa es posible ofrecer como alternativa al trasplante, el implante de un dispositivo de asis- tencia ventricular mecánico (ventricular assist device VAD). Esta terapia ha demostrado ser efectiva en disminuir las presiones de la arteria pulmonar y de la TPG a valores aceptables para tras- plante cardíaco16. De esta forma el paciente se transforma en elegible para trasplante (bridge to candidacy BTC). Una vez que las presiones de la arteria pulmonar se normalicen y que la TPG haya disminuido, el paciente puede ser puesto en lista de espera para trasplante.
3. Disfunción renal: no es infrecuente encontrar distintos grados de disfunción renal en pacientes con IC avanzada. Esta falla renal es secundaria no solamente a hipoperfusión sino que además a congestión venosa secundaria a la falla cardíaca. Por lo general, un clearance de creatinina <40ml/min aumenta el riesgo de morbilidad y mortalidad perioperatoria en enfermos trasplantados.
4. Disfunción hepática: similarmente como en el caso de la disfunción renal, la congestión venosa y la hipoperfusión arte- rial conducen a la disfunción del hígado. Este desarrolla primero fibrosis hepática proceso que inicialmente es reversible. Sin embargo, en la medida que el proceso progresa, la fibrosis se organiza para conducir a un estado de fibrosis irreversible. La presencia de una función hepática anormal se asocia con peores resultados luego de trasplante cardíaco. Por lo tanto una adecuada evaluación de la función hepática es necesaria en pacientes que muestran grados de fibrosis y eventualmente constituye una contraindicación en pacientes con cirrosis demostrada17,18.
5. Cáncer y lesiones pre-malignas: con los avances actuales en el tratamiento de enfermedades malignas cada paciente debe ser evaluado individualmente. La identificación precoz de enfermedades malignas y su oportuno tratamiento hacen que las restricciones establecidas años atras no sean necesarias hoy en día para muchos casos. El trasplante puede ser considerado en pacientes con bajo riesgo de recidiva y que no presenten enfer- medad metastásica9.
6. Trasplante multiorgánico: El trasplante combinado de corazón con algún otro órgano, por lo general riñon, consti- tuyen aproximadamente el 4% de los trasplantes de corazón2. Candidatos seleccionados pueden ser considerados para trasplante combinado de corazón-riñon, corazón-hígado o corazón pulmón en casos de hipertensión pulmonar refrac- taria, por ejemplo. En los últimos 10 años ha habido un incre- mento progresivo de la actividad de trasplante combinado de corazón-hígado. El crecimiento de ésta actividad se ha visto determinado por el creciente número de pacientes con cardiopatías congénitas y circulación Fontan que ha comen- zado a fallar. En el Reino Unido el trasplante multiorgánico está limitado a sólo algunos de los centros financiados para trasplante3 de manera de poder concentrar la experiencia y de esta forma mejorar los resultados.
3Donantes y Donación De Órganos“Sin donantes no hay trasplantes”
Uno de los elementos principales que determinan la posibilidad de trasplantar es el acceso a donantes de órganos. Las autori- dades sanitarias y los gobiernos juegan un papel crucial en faci- litar el acceso a la donación a través de la promulgación de leyes que definan la muerte y a través de leyes que den libertad a los individuos en decidir entre ser o no donante de órgano. Es de conocimiento general que existe una crisis en la donación de órganos. Los donantes en general han disminuido pero tambien han cambiado de características: los donantes hoy en día son más viejos y con ello traen más morbilidad (hipertensión arterial, obesidad, diabetes mellitus, enfermedades malignas o pre-can- cerosas, etc.) esto ha hecho que sea más difícil accede a donantes y que la selección deba ser más cuidadosa y estricta.
En el Reino Unido ha habido una caída considerable en el número de donantes de órganos por causas que escapan al objetivo de esta revisión. Sin embargo, ésta caída en donantes efectivos, el constante incremento de las listas de espera para trasplante y la limitación en el número de enfermos que son finalmente tras- plantados llevó a Inglaterra tomar recientemente dos impor- tantes decisiones:
La primera contempla un cambio en la ley de donación de órganos. A partir del 2020 la ley inglesa adoptó la forma del donante presunto: todo individuo se presume donante de órganos a menos que declare que no lo es. Esta figura legal ya existía en Gales y fué también adoptada por Escocia.
El segundo desarrollo importante lo ha consituido el trabajo primero experimental y luego clínico que se tradujo en la intro- ducción del donante luego de muerte circulatoria (DCD, por sus siglas en inglés).
Desde un punto de vista médico los donantes provienen de dos fuentes posibles determinada por la forma en que se define el fallecimiento:
1. Donantes en muerte cerebral (donation after brain death, DBD): Son donantes en que el tronco encefálico ha sido irrever- siblemente dañado por el proceso que afecta al cerebro (trau- matismo, tumor, accidente vascular, hipoxia). La ley exige que se verifiquen cierto número de tests que determinan la muerte cerebral. Los donantes DBD han sido clásicamente la principal fuente de donación de órganos sólidos.
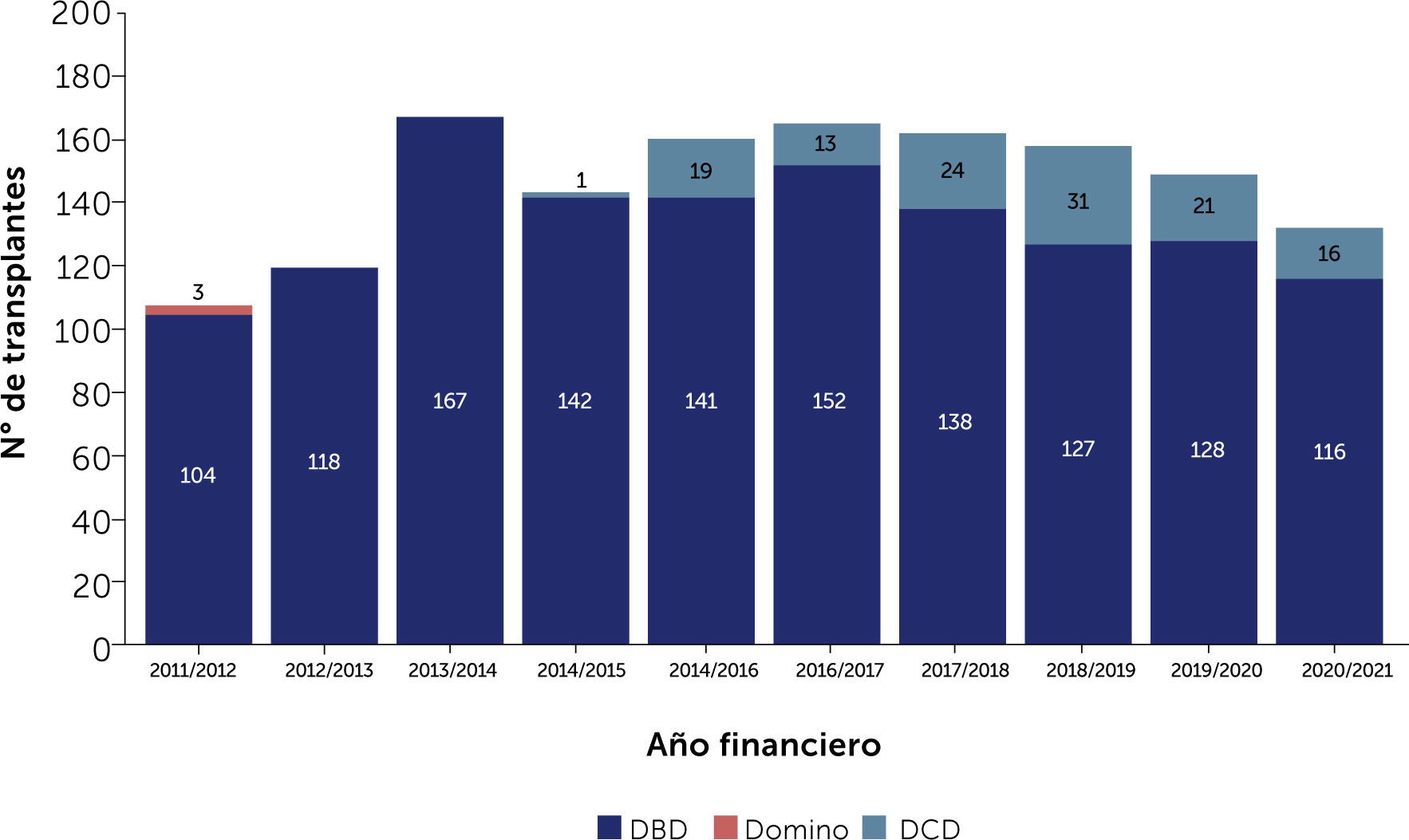
2. Donantes luego de muerte circulatoria (donation after circulatory death, DCD): Este tipo de donantes existía ya con anterioridad en trasplante hepático, renal y de pulmón. La nece- sidad de aumentar el pool de donantes de corazón impulsó el trabajo original del grupo de Papworth, Inglaterra en desarrollar la técnica para usar corazones luego de que se haya producido la muerte por paro cardíaco19. Este trabajo innovador ha sido revo- lucionario en el Reino Unido y el mundo en general. Los resul- tados han sido promisorios y el número de trasplantes de corazón con donantes DCD está mostrando un incremento progresivo como lo señala el Fig. 1. El desarrollo de tecnología capaz de perfundir órganos en forma extracorpórea ha sido fundamental para el desarrollo y éxito de esta novedosa técnica. Existe aún un tema de costo que es necesario superar para que la técnica pueda ser usada en forma mas amplia.
La selección del donante adecuado para un determinado receptor en general no ha variado con los años. La apropiada compatibi- lidad inmunológica continúa basándose en la compatibilidad de grupo sanguíneo y la compatibilidad de tamaño continua consi- derando la talla y el peso corporal de receptor y donante aceptán- dose diferencias de -10% a +20%. Existe, sin embargo, creciente evidencia de que la masa cardíaca es un mejor predictor de compatibilidad comparado con talla y/o peso corporal y es más precisa en predecir disfunción del injerto. La masa cardíaca esti- mada fue más precisa en predecir disfunción primaria del injerto cuando la diferencia era >30% comparado con igual diferencia cuando se uso el peso corporal20. En nuestro servicio hemos introducido desde hace ya un tiempo el uso de la masa cardíaca para la asignación de órganos a un determinado receptor,acep- tando diferencias de -10% y +20% entre donante y receptor.
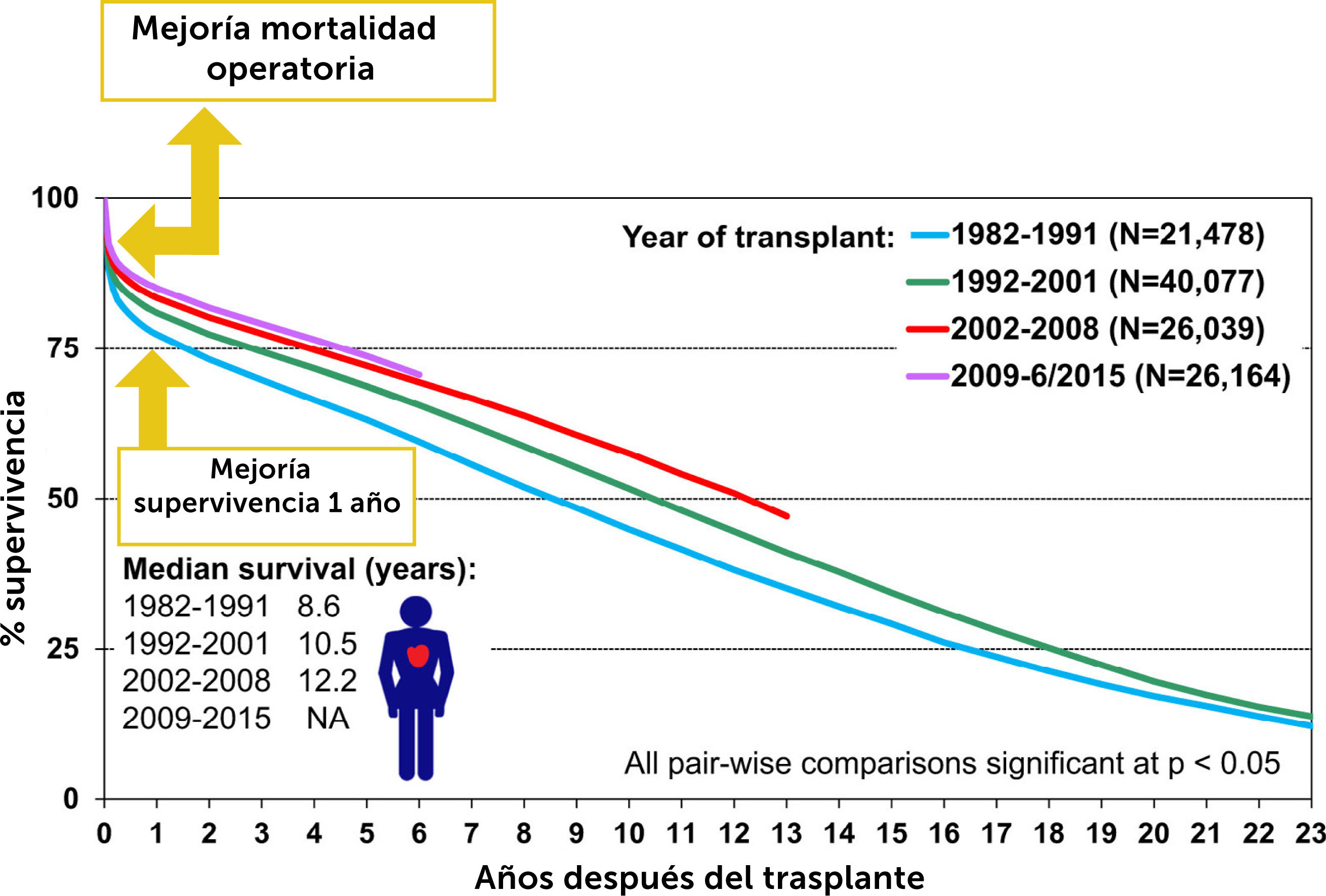
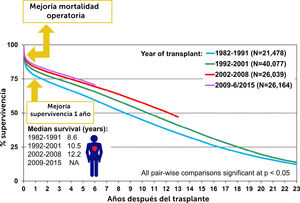
4Resultados Del Trasplante De CorazónEn las últimas tres décadas los resultados de corto y mediano plazo en trasplante cardíaco han mejorado considerablemente producto de la experiencia que la especialidad ha desarrollado. Como muestra el Fig. 2 las principales ganancias en supervi- vencia se han generado por mejorías en la supervivencia peri-ope- ratoria y supervivencia durante el primer año de trasplante con valores de supervivencia del orden de 85% y del 90% en centros de alto volumen21. La supervivencia a 30 días post trasplante en el Reino Unido (Tabla 5) y la supervivencia a 1 año (Tabla 6) son comparables con aquella en registros internacionales.
Trasplantes de corazón en adultos: supervivencia de Kaplan-Meier por periodo (trasplantes: enero de 1982 a junio de 2015). Lund LH, et al.21.
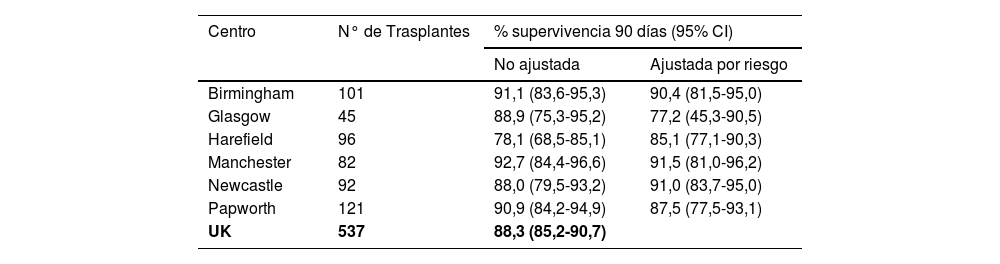
Supervivencia a 90 días post trasplante de corazón en adultos sin ajustar y ajustado por riesgo en el Reino Unido
| Centro | N° de Trasplantes | % supervivencia 90 días (95% CI) | |
|---|---|---|---|
| No ajustada | Ajustada por riesgo | ||
| Birmingham | 101 | 91,1 (83,6-95,3) | 90,4 (81,5-95,0) |
| Glasgow | 45 | 88,9 (75,3-95,2) | 77,2 (45,3-90,5) |
| Harefield | 96 | 78,1 (68,5-85,1) | 85,1 (77,1-90,3) |
| Manchester | 82 | 92,7 (84,4-96,6) | 91,5 (81,0-96,2) |
| Newcastle | 92 | 88,0 (79,5-93,2) | 91,0 (83,7-95,0) |
| Papworth | 121 | 90,9 (84,2-94,9) | 87,5 (77,5-93,1) |
| UK | 537 | 88,3 (85,2-90,7) | |
En la tabla se describen las tasas de supervivencia de los pacientes para cada centro y a nivel del Reino Unido para un total de 537 pacientes adultos trasplantados de corazón con donante DBD.
Trasplantes realizados en el periodo del 1 de abril de 2016 al 31 de marzo de 2020. Todos los resultados de los centros fueron estadísticamente consis- tente con la tasa de supervivencia de Reino Unido de que fue del 88,3%.
NHSBT/NHSE 2020 Annual report4.
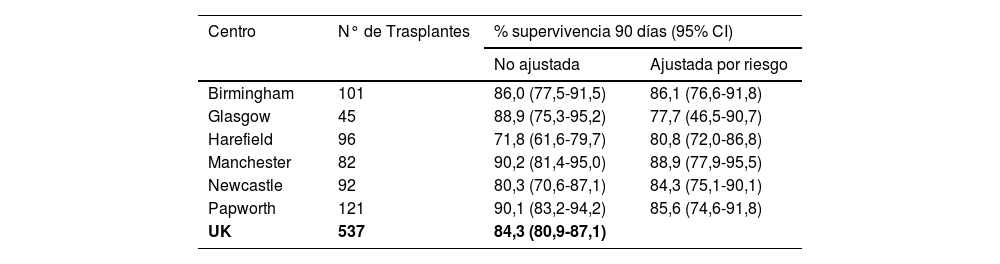
Supervivencia a 1 año post trasplante de corazón por centro en el Reino Unido
| Centro | N° de Trasplantes | % supervivencia 90 días (95% CI) | |
|---|---|---|---|
| No ajustada | Ajustada por riesgo | ||
| Birmingham | 101 | 86,0 (77,5-91,5) | 86,1 (76,6-91,8) |
| Glasgow | 45 | 88,9 (75,3-95,2) | 77,7 (46,5-90,7) |
| Harefield | 96 | 71,8 (61,6-79,7) | 80,8 (72,0-86,8) |
| Manchester | 82 | 90,2 (81,4-95,0) | 88,9 (77,9-95,5) |
| Newcastle | 92 | 80,3 (70,6-87,1) | 84,3 (75,1-90,1) |
| Papworth | 121 | 90,1 (83,2-94,2) | 85,6 (74,6-91,8) |
| UK | 537 | 84,3 (80,9-87,1) | |
En la tabla se describen las tasas de supervivencia de los pacientes para cada centro y a nivel del Reino Unido para un total de 537 pacientes adultos trasplantados de corazón con donante DBD.
Trasplantes realizados en el periodo del 1 de abril de 2016 al 31 de marzo de 2020. Todos los resultados de los centros fueron estadísticamente consis- tente con la tasa de supervivencia de Reino Unido de que fue del 84,3%.
NHSBT/NHSE 2020 Annual Report4.
Disfunción primaria del injerto (PGD): PGD ó primary graft dysfunction se define como la falla del corazón trasplantado en las primeras 24 horas postop eratorio en ausencia de rechazo agudo, hipertensión pulmonar ó complicaciones quirúrgicas como sangramiento o tamponamiento cardíaco22. La clasificación del grado de disfunción y su severidad queda determinada por los ventrículos afectados (falla uni ó bi ventricular),la evaluación de parámetros hemodinámicos y ecocardiográficos del enfermo ó la necesidad de uso de soporte circulatorio mecánico. La disfunción primaria del injerto es un problema serio en el postoperatorio del trasplante de corazón y determina importante morbilidad y mortalidad. Su incidencia es variable (3% a un 28% en distintas series). Desde que la definición de PGD fue acordada y ratificada en un documento de consenso de la International Society for Heart and Lung Transplantation (ISHLT), se han reportado incidencias de hasta 31%. PGD no sólo afecta la supervivencia a 90 días sino que también impacta la supervivencia a 1 año con reportes de super- vivencia de sólo 44% al final del primer año en pacientes que han sufrido de PGD severa23,24.
Rechazo agudo (RA): a pesar de los avances en el tratamiento inmunosupresor, el RA del injerto continúa siendo uno de los principales eventos adversos del trasplante de corazón y que determina sobevida a 1 año. Este RA es product de la interacción entre el sistema inmune del receptor y proteínas, antígenos en el injerto (órgano trasplantado). Esta respuesta immune es clasi- ficada en rechazo agudo celular, cuando el rechazo es mediado % supervivencia por linfocitos T ó humoral cuando el mecanismo principal de rechazo involucra linfocitos B y la producción de anticuerpos. Una forma distinta de clasificación se refiere a la severidad del rechazo y desde este aspecto éste puede ir leve a severo con disfunción severa del injerto en casos extremos. El advenimiento de nuevas drogas inmunosupresoras tales como el tacrolimus y micofenolato asociado al mejor entendimiento del proceso de RA han hecho que la necesidad de tratamiento con aumento de la inmunosuporesión hayan disminuido de 23% en 2004-2006 a un 13% en el período 2010-2014 desde el alta hospitalaria al primer año de supervivencia2. A pesar de los años, los avances científicos y la experiencia en el entendimiento del RA, la biopsia endomio- cárdica continúa siendo el gold standard en el diagnóstico del RA. Importantes avances se han producido en el entendimiento del RA que han conducido a una mejor nomenclatura y diagnós- tico que incluye el uso de marcadores inmuno-histoquímicos. La graduación del RA se encuentra detallada en la revisión del 2005 que propusiera ISHLT25.
Rechazo celular agudo: La incidencia de rechazo celular agudo ha disminuido con los años y es infrecuente después de los primeros 12 meses de trasplante en pacientes en los que el trata- miento inmunosupresor es estable26. Se estima que la incidencia de rechazo celular agudo que require aumento de la inmuno- supresión fluctúa entre 5% a 21%. El tratamiento agudo require de pulsos de esteroides endovenosos seguidos de control con biopsia endomiocárdica. Episodios repetidos de rechazo celular agudo se encuentran asociados con peor supervivencia a 5 y a 10 años27.
Rechazo agudo mediado por anticuerpos: este tipo de rechazo puede ocurrir en cualquier momento post trasplante ya sea precoz o tardíamente. No está aún claro como se genera o que es lo que desencadena este tipo de reacción. Sin embargo, actualmente se postula de que el rechazo se desencadena por interacción de componentes de la cadena del complemento que reaccionan con anticuerpos anti-HLA preexistentes en el injerto ó que se desarrollarían de novo post trasplante. La presentación de rechazo mediado por anticuerpos está asociada con disfunción del injerto y peor supervivencia en especial cuando se presenta después del primer año28. Su tratamiento se basa en limpiar el plasma de los complejos antígenos - anticuerpos circulantes con plasmaféresis complementando generalmente con el uso de esteroides o anticuerpos policlonales.
Infecciones post trasplante: El necesario uso de los medica- mentos inmunosupresores hacen que el paciente trasplantado sea más vulnerable y con un riesgo aumentado a infecciones en especial dentro del primer año en que la inmunosupresión es más intensa debido a la más alta probabilidad de rechazo agudo2. El uso de medidas profilácticas se encuentra recomen- dado para disminuir la probabilidad de infecciones por gérmenes oportunistas como citomegalovirus, Pneumocystis jirovecii (antes conocido como P. carinii), cándida y otros virus de la familia de
los herpes. La reciente pandemia COVID-19ha llevado a la comunidad médica a revisar estrategias a adoptar en pacientes trasplantados en general. Dentro de ellas se recomienda la vacu- nación de los pacientes trasplantados (recomendaciones de ISHLT sobre manejo de COVID-19 en pacientes trasplantados).
6Complicaciones a Largo PlazoEn el largo plazo los pacientes trasplantados del corazón enfrentan problemas derivados de la inmunosupresión ó efectos colate- rales de los medicamentos inmunosupresores como son el desa- rrollo de hipercolesterolemia, hipertensión arterial, disfunción renal, desarrollo de neoplasias como cancer de piel y síndromes linfoproliferativos dentro de los problemas más comunes. La supervivencia a largo plazo del injerto queda determinada por el desarrollo de una vasculopatía que afecta difusamente la circulación coronaria del corazón, proceso al que se le atribuye un componente de rechazo crónico. Estos efectos adversos de los medicamentos inmunosupresores resaltan la necesidad del manejo multidisciplinario de estos pacientes para evitar o tratar a tiempo deterioros mayores.
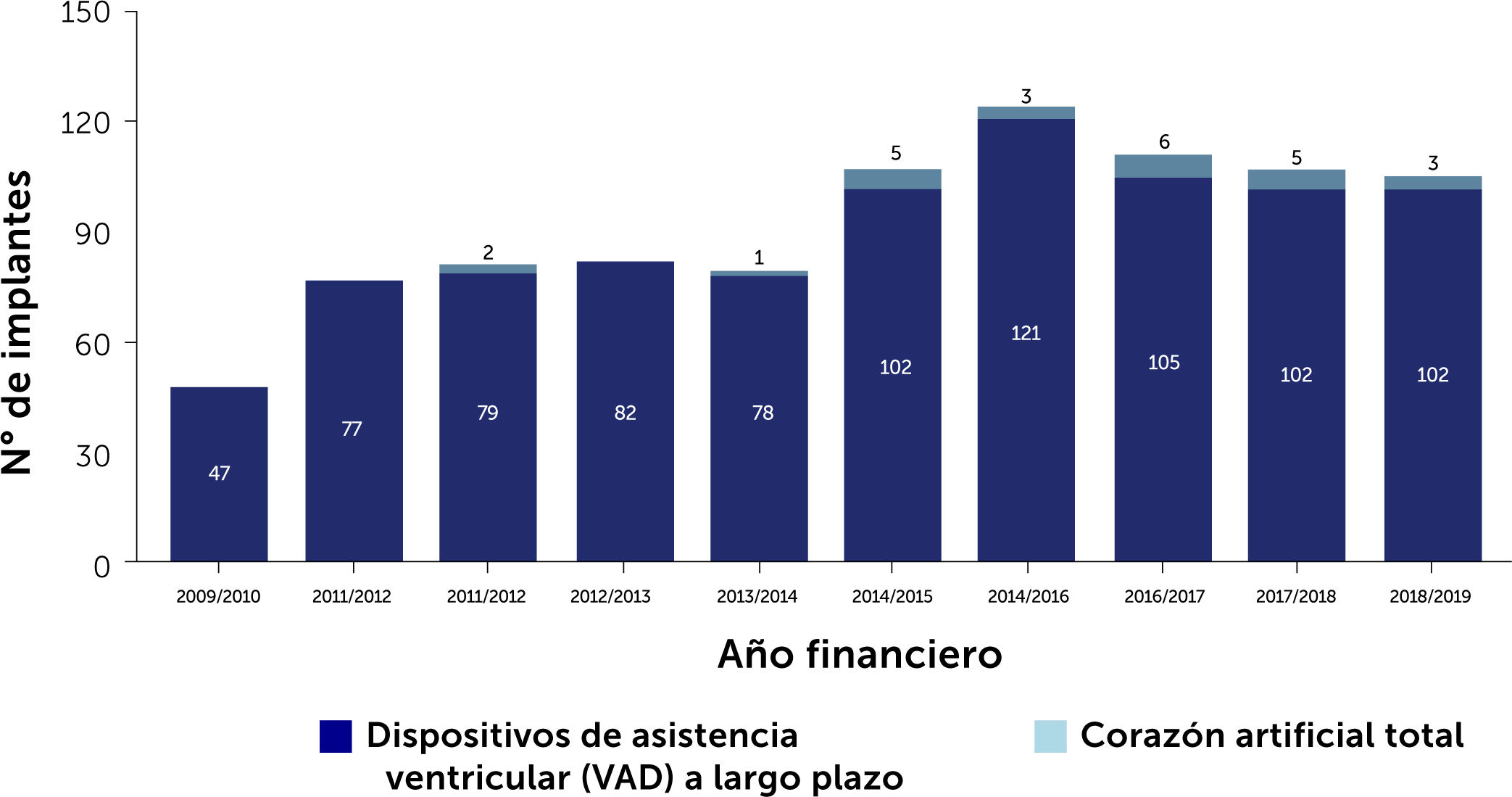
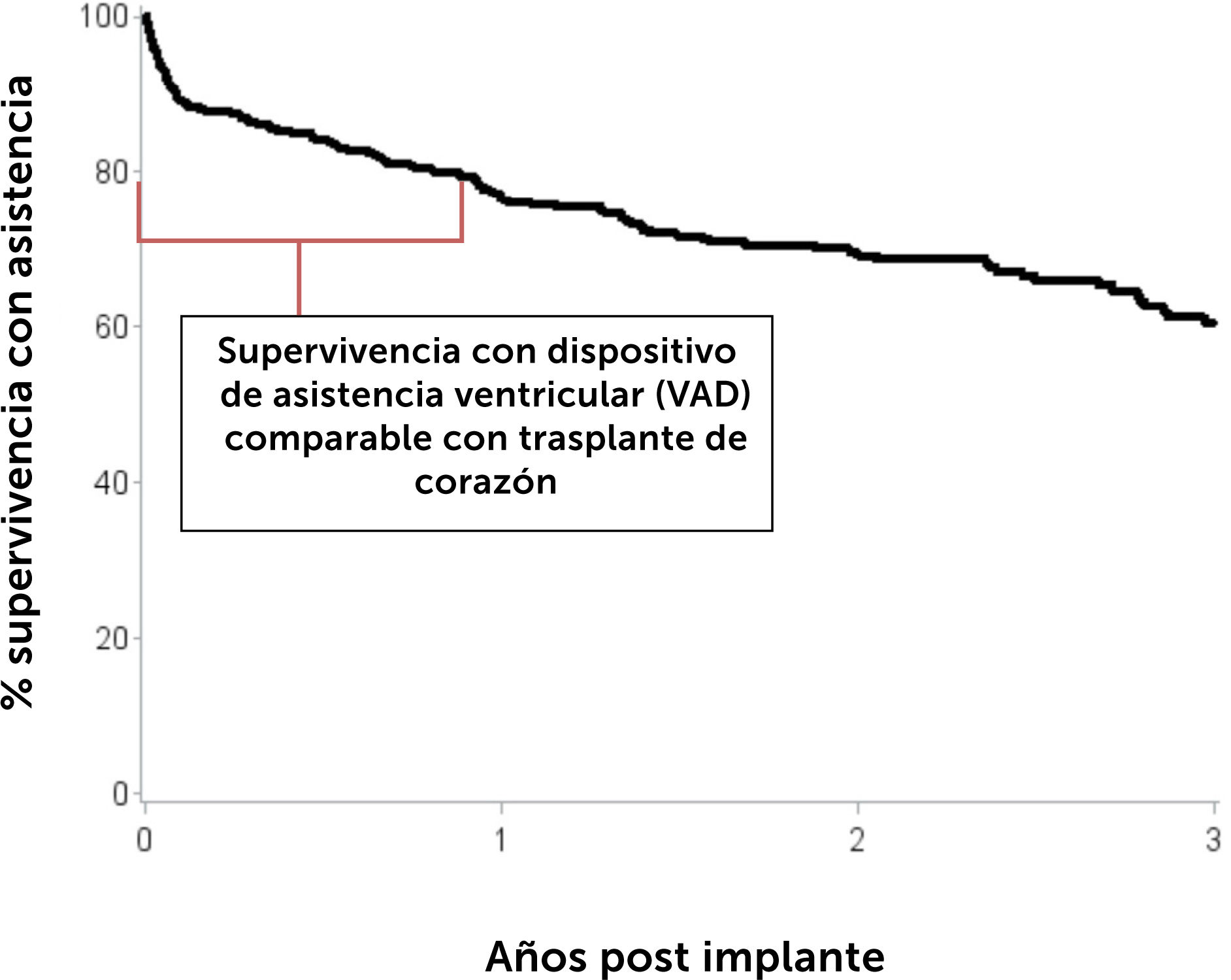
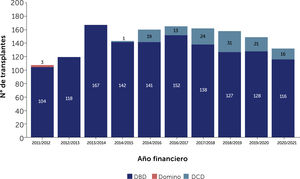
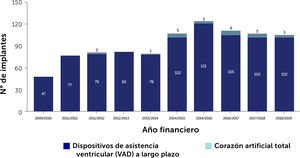
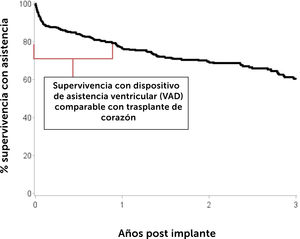
En pacientes con IC terminal el trasplante de corazón continúa siendo el tratamiento de elección3 para mejorar la supervivencia y calidad de vida de los pacientes que la padecen. Sin embargo la escasez de donantes adecuados, ya sea por la disminución del número de donantes o la calidad de ellos, ha llevado no sólo a un incremento en las listas de espera sino que también a un alar- gamiento en los tiempos de espera para trasplante. Esta espera prolongada tiene como consecuencia, un determinada morta- lidad en las listas de espera y que es de 25% a 30% por año. En segundo lugar los pacientes experimentan deterioro de sus funciones renal y hepática fundamentalmente; deterioro que se profundiza en la medida que los pacientes más esperan ó que desarrollan hipertensión pulmonar corriendo el riesgo desarro- llar contraindicaiones que los dejen fuera de las posibilidades de trasplante. El desarrollo de dispositivos de asistencia circulatoria mecánica ha ayudado a proporcionar estabilidad a pacientes que de otra forma habrían caído en un espiral de deterioro progre- sivo. El uso de estos dispositivos se ha popularizado en la medida que los resultados a corto y mediano plazo han mostrado buenos resultados con una supervivencia a un año de cerca de un 80% y de 75% a 2 años, comparables a la supervivencia del trasplante cardíaco. Estas cifras corresponden a estadísticas del Reino Unido y se encuentran reflejadas en el Annual Report on Mechanical Circulatory Support Related to Heart Transplantation de septiembre 2019 y que cubre el período 01 abril 2009 al 31 de marzo 201929. En el Reino Unido hasta Julio de 2021 se implantaban rutinariamente dos tipos de dispositivos: Heart Mate III HM3 (Abbott) y Heartware HVAD System (Medtronic). Sin embargo, en junio de 2021 la FDA recomendo la suspensión de implantes de HVAD debido a un aumento en la incidencia de eventos adversos: uno el aumento de complicaciones neurológicas y el segundo una potencial falla en la re-partida del controlador del dispositivo en caso de que éste se detuviera. Ambas situaciones constituyen una potencial amenaza vital para los pacientes. Desde julio 2021 sólo sistemas HM3 son implantados en el Reino Unido, situación que se ha extendido al resto del mundo en la medida que Heartware ha sido retirado del mercado. El Fig. 3 muestra el incremento progresivo anual de los dispositivos implantados en Inglaterra. El Fig. 4 y la Tabla 7 muestran la supervivencia en el largo plazo entre el 2014 al 2019 en el Reino Unido.
Número de dispositivos de asistencia mecánica implantados en adultos en el Reino Unido entre 01 Abril 2009 a 31 Marzo 2019. VAD: Long-term ventricular assist devices (dispositivos de asistencia ventricular a largo plazo). Annual Report on Mechanical Circulatory Support related to heart transplantation September 201928.
Supervivencia a largo plazo de pacientes adultos con dispositivo de asistencia ventricular (VAD) a largo plazo implantados del 1 de abril de 2014 al 31 de marzo de 2018 en Inglaterra. Annual Report on Mechanical Circulatory Support Related to Heart Transplantation, September 201928.
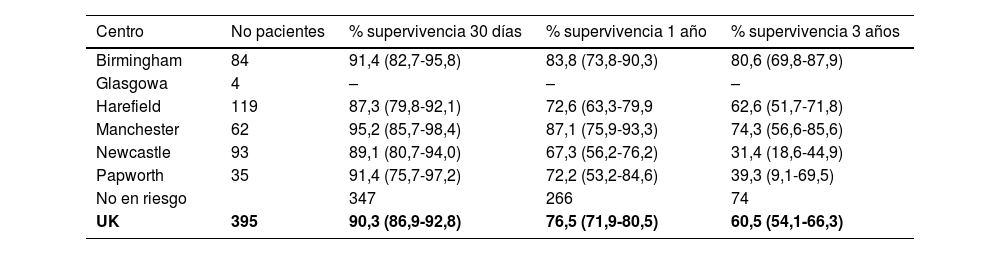
Supervivencia no ajustada a largo plazo en pacientes con dispositivo de asistencia para el ventrículo (VAD), por centro, del 1 de abril de 2014 al 31 de marzo de 2018 en el Reino Unido por centro
| Centro | No pacientes | % supervivencia 30 días | % supervivencia 1 año | % supervivencia 3 años |
|---|---|---|---|---|
| Birmingham | 84 | 91,4 (82,7-95,8) | 83,8 (73,8-90,3) | 80,6 (69,8-87,9) |
| Glasgowa | 4 | – | – | – |
| Harefield | 119 | 87,3 (79,8-92,1) | 72,6 (63,3-79,9 | 62,6 (51,7-71,8) |
| Manchester | 62 | 95,2 (85,7-98,4) | 87,1 (75,9-93,3) | 74,3 (56,6-85,6) |
| Newcastle | 93 | 89,1 (80,7-94,0) | 67,3 (56,2-76,2) | 31,4 (18,6-44,9) |
| Papworth | 35 | 91,4 (75,7-97,2) | 72,2 (53,2-84,6) | 39,3 (9,1-69,5) |
| No en riesgo | 347 | 266 | 74 | |
| UK | 395 | 90,3 (86,9-92,8) | 76,5 (71,9-80,5) | 60,5 (54,1-66,3) |
Las tasas de supervivencia para grupos con menos de 10 pacientes no se presentan debido al bajo número. Annual Report on Mechanical Circulatory Support Related to Heart Transplantation, September 201928.
A más de 50 años del primer trasplante de corazón éste continúa siendo el tratamiento de elección en pacientes con insuficiencia cardíaca terminal y que muestran deterioro progresivo o una pobre respuesta al tratamiento médico convencional. El éxito del trasplante es multifactorial debiendo considerar la adecuada selección de receptores así como también la adecuada selección de donantes. En años recientes se ha visto un cambio signifi- cativo en la población donante, viendose esta envejecida y por ende con una mayor incidencia de comorbilidades como hiper- tensión arterial, cardiopatía coronaria, hipertrofia cardíaca entre los problemas más comunes. La adecuada evaluación y selección del donante es, por lo tanto, tan importante como la evaluación y selección de receptores. Las patologías que requieren de tras- plante se han mantenido relativamente estables, sin embargo se ha visto un aumento progresivo en la necesidad de trasplante de enfermedades de mayor complejidad como las cardiopatias congénitas complejas, reintervenciones y trasplante multior- gánico. El adecuado manejo de receptores se fundamenta en la participación armónica y coordinada de un complejo equipo multidisciplinario. A pesar del aumento en la complejidad de los pacientes que son trasplantados y del uso de donantes cada vez más marginales, se han producido mejorías significativas en la mortalidad perioperatoria y en la supervivencia a 1 año post tras- plante. El rechazo celular y el rechazo mediado por anticuerpos continúan siendo un desafío. No obstante, las nuevas drogas inmunosupresoras han logrado disminuir la incidencia de rechazo durante el primer año. La supervivencia a largo plazo, el manejo de vasculopatía del injerto y el manejo de los efectos adversos de los medicamentos inmunosupresores son un reto para el equipo encargado del manejo de estos enfermos. Para aquellos pacientes para quienes la oportunidad de ser trasplantados se va viendo amenazada por progresivo deterioro, el uso de dispositivos implantables de asistencia circulatoria mecánica es una alterna- tiva viable con resultados comparables al trasplante cardíaco a 1 y 2 años de implante. Finalmente, el trasplante de órganos se basa en la donación generosa y desinteresada de donantes y sus fami- liares a quienes es necesario agradecer permanentemente. Es obligación del equipo completo orientar esfuerzos para el mejor aprovechamiento de un recurso que hoy en día es escaso.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.
Referencia no citada[10].