Las vacunas son altamente efectivas en prevenir enfermedades infecciosas a través del desarrollo en el individuo de una respuesta inmune protectora, sin desarrollar la enfermedad. Los distintos tipos de vacunas producen diferentes tipos de respuestas inmunes y variadas estrategias se han desarrollado para mejorar esta respuesta. El sistema inmune sufre cambios con la edad y esta inmunosenecencia altera la capacidad de responder frente a ellas. Por otro lado, si bien el sistema inmune puede reconocer elementos presentes en las vacunas y montar respuestas de hipersensibilidad ante ellos, las alergias a las vacunas son raras, teniendo que distinguirlas adecuadamente de otro tipo de reacciones. En caso que un paciente presente una reacción compatible con alergia, es importante conocer todos los componentes de la vacuna para realizar un estudio adecuado.
Vaccines are highly effective in preventing infectious diseases through the development in the individual a protective immune response, without developing the disease. Different types of vaccines produce different types of immune responses, and varied strategies have been developed to improve this response. The immune system undergoes changes with age, and this inmunosenescence alters the ability to respond to them. On the other hand, although the immune system can recognize elements present in vaccines and establish hypersensitivity responses to them, vaccine allergies are rare, having to properly distinguish them from other types of reactions. In the event that a patient has an allergy-compatible reaction, it is important to know all the components of the vaccine to conduct a proper study.
Las vacunas constituyen uno de los avances de la medicina más importantes del último siglo. Su uso como instrumento preventivo en salud pública ha logrado erradicar algunas enfermedades y disminuir la incidencia de otras afecciones altamente secuelantes e incluso mortales, como la poliomielitis.
El objetivo primario de la vacunación es lograr que los individuos que las reciben tengan una respuesta inmune protectora sin desarrollar la enfermedad. Incluso, a veces, esto también se puede lograr en los individuos alrededor del sujeto que recibe la inmunización.
El mecanismo subyacente consta de 3 fases principales:
Fase 1: En primer lugar, lograr una respuesta innata, que posteriormente estimule el desarrollo de una respuesta inmune adaptativa específica.
Fase 2: Este segundo nivel de respuesta, favorece la existencia de un amplio repertorio de linfocitos y anticuerpos capaces de reconocer y eliminar los patógenos incluidos en la vacuna1.
Fase 3: Finalmente, el sistema inmune logra establecer una memoria inmunológica, ya sea en base a anticuerpos persistentes o a células de memoria que se reactivan frente a un segundo encuentro con el patógeno, permitiendo así combatirlo.
Las vacunas no sólo protegen al individuo que las recibe, sino que también pueden proteger a los que lo rodean que no han sido vacunados. Habitualmente algunas pueden lograr esto disminuyendo la transmisión persona a persona de la enfermedad, disminuyendo el riesgo de exposición frente a la infección natural. Este fenómeno se conoce como inmunidad de rebaño. Para ello se requiere un alto porcentaje de individuos vacunados. Otro ejemplo de protección a un individuo distinto al vacunado, es la protección conferida por la madre al recién nacido en sus primeros meses de vida, al transferirles anticuerpos protectores a través de la placenta.
Los distintos tipos de vacunas, producen diferentes tipos de respuestas inmunes. Es importante conocer su conformación y comprender su mecanismo de acción, para poder elegir la más apropiada y a su vez, educar a la población respecto a su efectos beneficiosos y eventualmente adversos.
Uno de los hechos que más interesa en relación a una vacuna es identificar los potenciales factores que inciden en determinar su eficacia a largo plazo. En este sentido, las vacunas pueden clasificarse en 3 grandes grupos según sus antígenos:
- -
Antígenos multivalentes no proteicos
- -
Antígenos proteicos monovalentes
- -
Antígenos proteicos multivalentes
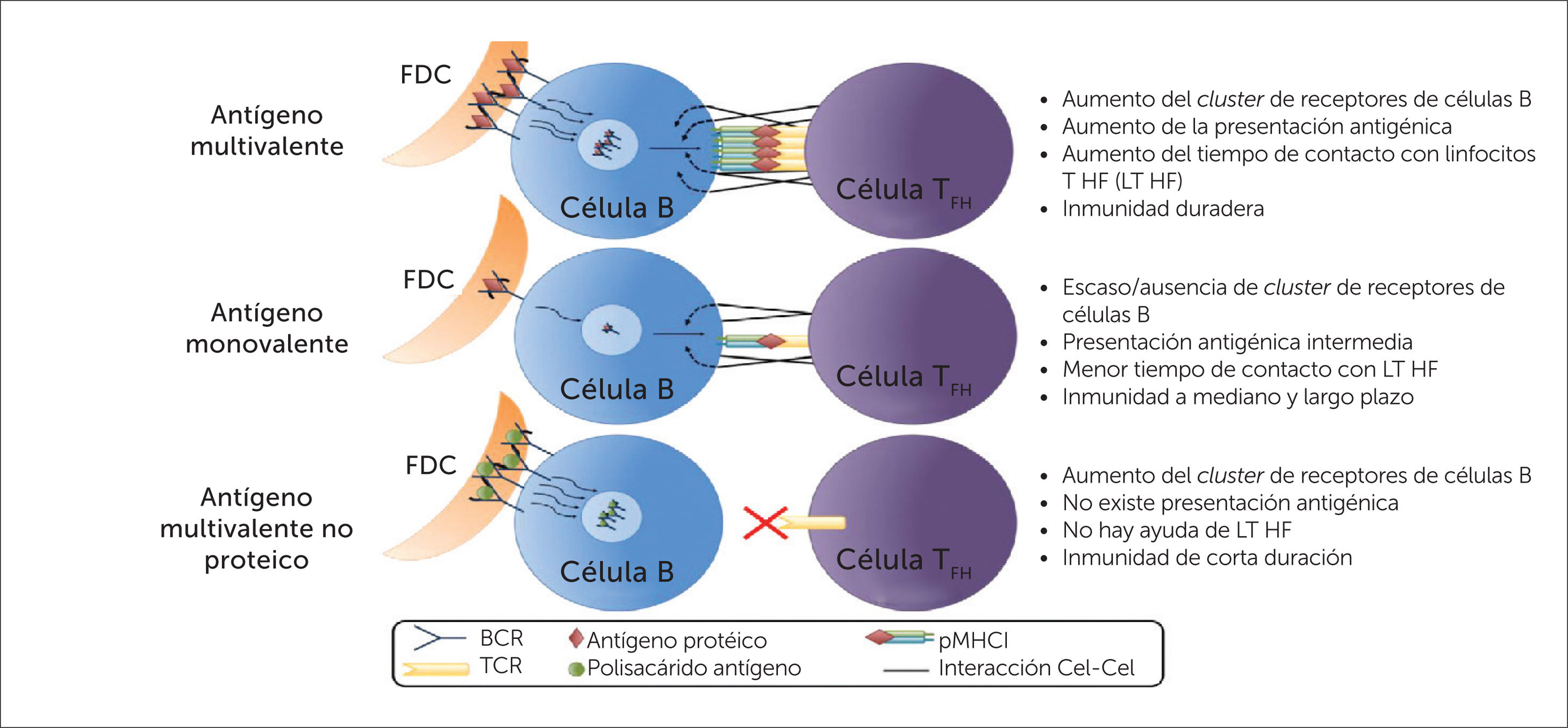
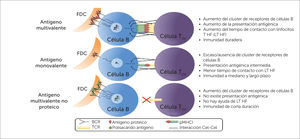
Los antígenos multivalentes no proteicos no logran ser presentados a la célula T y por tanto no hay ayuda de la célula T helper folicular y la inmunidad conferida es sólo de corta duración. Es la respuesta T independiente.
Cuando el antígeno es proteico, las células B los procesan y presentan a las células T helper foliculares. Si este antígeno es multivalente, aumenta el cluster de receptores de la célula B (BCR), su habilidad para captar el antígeno desde la célula presentadora y estabiliza el complejo antígeno-BCR, lo que lleva a un aumento en los complejos MHC II cargados con proteínas (pMHC II). Todo esto y otras interacciones entre la célula B y T (como CD 40 y CD 40L) llevan al desarrollo de un clon particular de células B, lo que permite una inmunidad a más largo plazo.
Los antígenos proteicos multivalentes pueden tener ventajas en presentar el antígeno y reclutar linfocitos T foliculares CD4 helper. Se plantea que un mayor tiempo de unión entre las células B antígeno específicas con los linfocitos T foliculares CD4 helper, asociado a un aumento en la coestimulación y secreción de citoquinas, sería el mecanismo para generar, entre otras cosas, células plasmáticas más duraderas.
Características del antígeno en la vacuna determinan la inmunidad subsecuente y su duración
Las características del antígeno de una vacuna determinan los niveles y duración subsecuentes de la inmunidad. Se muestra un posible antígeno proteico multivalente, comparándolo con un antígeno proteico monovalente y con uno no proteico. En el ejemplo, los clones de células B toman el antígeno de las células dendríticas foliculares (FDC), el que luego es procesado (sólo los antígenos proteicos) y presentado a la célula T helper folicular (THP). Existe evidencia que indica que las interacciones multivalentes aumentan el agrupamiento del receptor de la célula B (BCR) y mejoran la habilidad de estas células para tomar el antígeno desde las células presentadoras. Esta interacción multivalente también estabiliza el complejo antígeno-receptor B y aumenta los complejos MHC II cargados de péptidos2.
Figure 1 is taken/adapted from Vetter V et al., Annals of Medicine, 50(2): 110-120, 2018.
En relación a su conformación general, existen distintos tipos de vacunas:
- 1.
Vacunas vivas atenuadas
Contienen patógenos debilitados, alterados o seleccionados para ser menos virulentos
- 2.
Vacunas no vivas o inactivadas
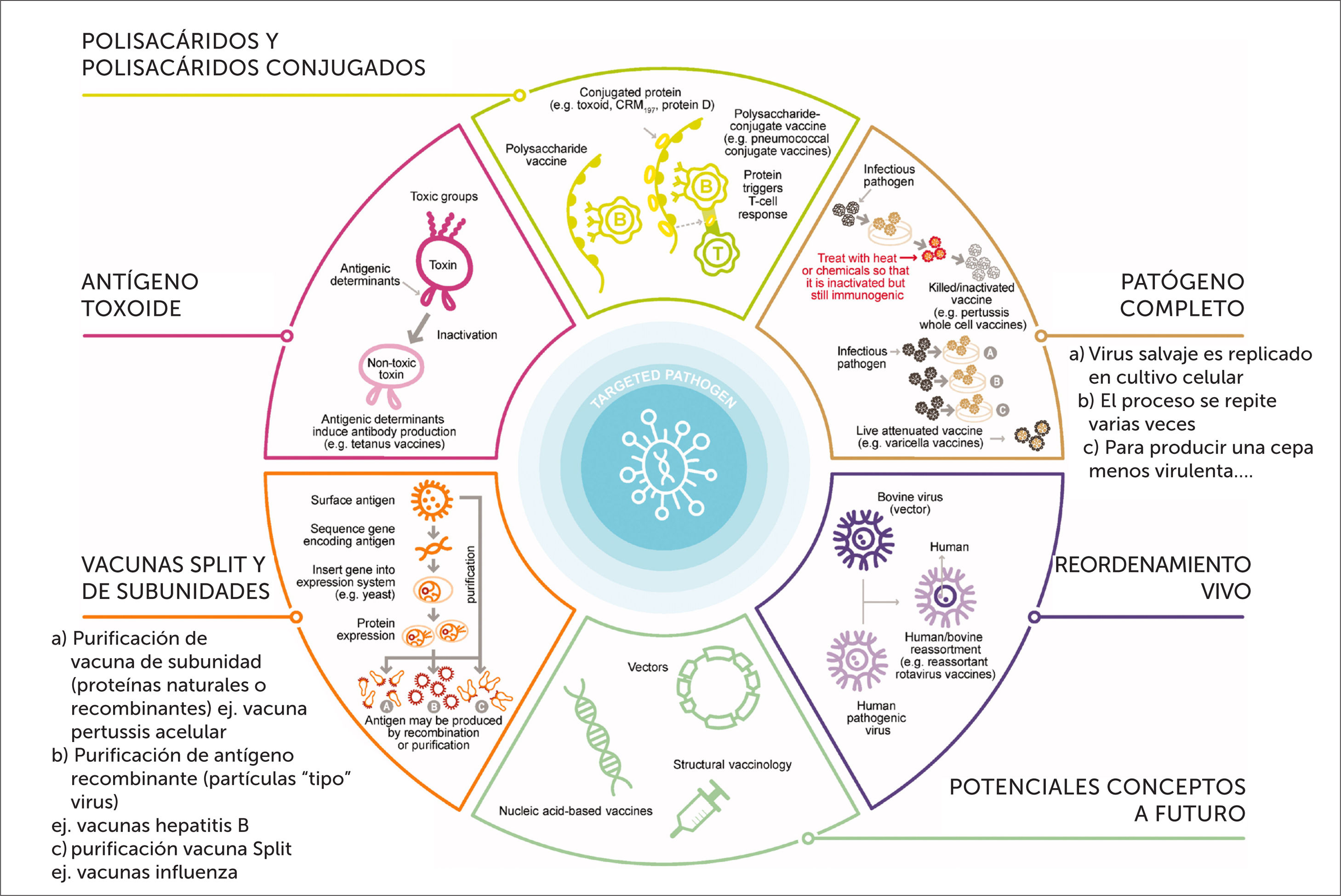
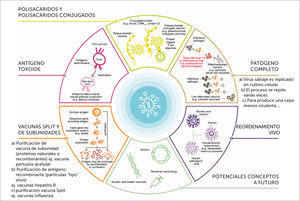
No contienen ninguna partícula viva o infecciosa. Pueden estar compuestas de patógenos enteros inactivados o sólo parte de ellos, como proteínas o polisacáridos: vacunas de subunidades. Estas subunidades pueden ser (Figura 2)30:
- -
Proteicas: proteínas antigénicas purificadas (algunas bacterias), ingeniería genética recombinante (virus), vaccinología reversa (identificación de genes que codifican para proteínas potencialmente antigénicas)
- -
Toxoides
- -
VLPs (proteínas similares a virus)
- -
Polisacáridas
- -
Polisacáridas conjugadas
Figura 2.Procesos de producción vacunas
Las vacunas pueden ser producidas por distintos procesos. Ellas pueden contener patógenos vivos atenuados (usualmente virus), patógenos enteros inactivados, toxoides (forma de toxina inactivada producida por la bacteria que causa la enfermedad), o partes de los patógenos (ej. proteínas naturales o recombinantes, polisacáridos, polisacáridos conjugados o partículas virus-like) (Adaptado de referencia 3).
- -
Son vacunas que contienen patógenos que han sido debilitados, alterados o seleccionados como menos virulentos que el patógeno “salvaje”. Esto permite que no sean capaces de causar la enfermedad frente a la que quieren inducir respuesta protectora o, en su defecto, producirla en una forma leve.
Generalmente son vacunas contra virus, puesto que ellos se componen de menos genes y así el proceso de “atenuación” es más confiable.
El proceso más frecuente es hacer “pasar” al patógeno (in vitro) por cultivos celulares sucesivos (ej. células embrionarias de pollo). Con esto se logra mejorar la capacidad de replicación en estos cultivos, pero se disminuye esta capacidad en el huésped humano. También se puede lograr atenuación al someter al patógeno a varios procesos a temperatura baja.
La gran ventaja de las vacunas vivas atenuadas es que al mantener los mismos antígenos que el patógeno “original”, los individuos sanos desarrollan una respuesta inmune similar a la de una infección natural. Se logra así respuesta inmune adaptativa muy potente y generalmente de larga duración, con 1 o 2 dosis solamente. Pueden también inducir respuesta de rebaño por un mecanismo distinto al de disminuir la exposición por menos enfermedad natural: al excretar partículas virales, los contactos son expuestos al patógeno e indirectamente son “vacunados”. Sin embargo, esto a su vez puede constituir un riesgo, si estos contactos están en alguna condición de inmunosupresión.
El efecto adverso más temido de las vacunas vivas atenuadas es que en forma muy infrecuente, aunque no imposible, puede ocurrir enfermedad con ellas, pero en general esta es mucho más leve que la infección natural. En este contexto, los pacientes inmunosuprimidos no pueden controlar bien la replicación del agente, por lo que generalmente, estas vacunas están contraindicadas en ellos. En el mismo sentido, están contraindicadas en embarazadas, por el riesgo teórico de trasmisión del agente infeccioso al feto y la consiguiente enfermedad congénita.
Vacunas vivas atenuadas: Sarampión, parotiditis, rubéola, varicela, rotavirus (Rotarix y Rotavac), herpes zoster (Zostavac), influenza (Flumist), polio oral y fiebre amarilla (Stamaril).
Un ejemplo de vacuna viva atenuada es la vacuna de polio oral. Tiene varias ventajas: se administra por gotas y no inyectable, es barata, es fácil de administrar en contextos extra hospitalarios, es efectiva para inducir inmunidad en mucosa intestinal y también logra altos niveles de inmunidad de rebaño. Sin embargo, en 1/1.000.000 de casos el virus puede revertir a la forma capaz de causar la enfermedad, induciendo polio paralítica asociada a la vacuna. Por ello, no debe usarse en la fase final de erradicación, cuando la transmisión por virus salvaje ya no existe. Así, actualmente en muchos países, incluido Chile, el calendario de inmunización contempla el uso de vacuna polio inactivada (inyectable).
La única vacuna viva bacteriana atenuada en uso actual es la BCG. Contiene Mycobacterium bovis que se ha atenuado por el pasaje en cultivos celulares y es la única autorizada para proteger a la población de la tuberculosis.
Vacunas no vivasPueden ser con el patógeno completo inactivado o estar hechas en base a subunidades del mismo: proteínas, toxoides, VLPs (virus like proteins), polisacáridos o polisacáridos conjugados. Todas ellas tienen la ventaja que no son capaces de causar la enfermedad y tampoco pueden reactivarse. Por tanto, son más seguras y son las que pueden usarse en individuos inmunosuprimidos. Sin embargo, su inmunogenicidad y la duración de la protección que confieren tiende a ser menor que la que otorgan las vacunas vivas. Esto ha intentado mejorarse con el uso de varias dosis sucesivas (boosters) o con el agregado de adyuvantes.
Vacunas inactivadas: Vacuna inactivada de polio (IPV), vacuna celular completa contra pertussis, vacuna anti rabia y hepatits A.
Vacunas de subunidades: Están compuestas por fragmentos seleccionados del patógeno involucrado. Estos pueden ser: proteínas, polisacáridos o partes de un virus (VLPs). Tienen la ventaja de causar menos reacciones adversas que las vivas o de organismo completo inactivado, pero son menos inmunogénicas: contienen menos antígenos y el proceso mismo de purificación puede eliminar los componentes que mejor estimulen la respuesta innnata. Ej: Toxoide tetánico, influenza estacional con subunidades, pertussis acelular, neumocócica polisacárida y neumocócica conjugada.
En relación a las vacunas glicoconjugadas, ha sido una práctica cada vez más habitual unir polisacáridos capsulares bacterianos con carriers proteicos T dependientes. Esto logra estimular tanto la respuesta celular de tipo T como la B4.
Se han mostrado distintos mecanismos involucrados en estas vacunas, siendo la estructura del polisacárido crítica para definir los mecanismos usados por las células presentadoras5.
En este sentido, la vacuna antineumocóccica polisacárida es capaz de activar la célula B, pero al no ir asociada a proteína, no logra estimular la cooperación del linfocito T CD4 folicular. Esta es la respuesta llamada T independiente, que logra una respuesta inmunológica de duración limitada y tampoco puede establecer respuesta de memoria. Dados estos problemas, el polisacárido se conjugó con una proteína, con lo que se obtuvo respuesta protectora más duradera en el tiempo y con memoria (Tabla 1).
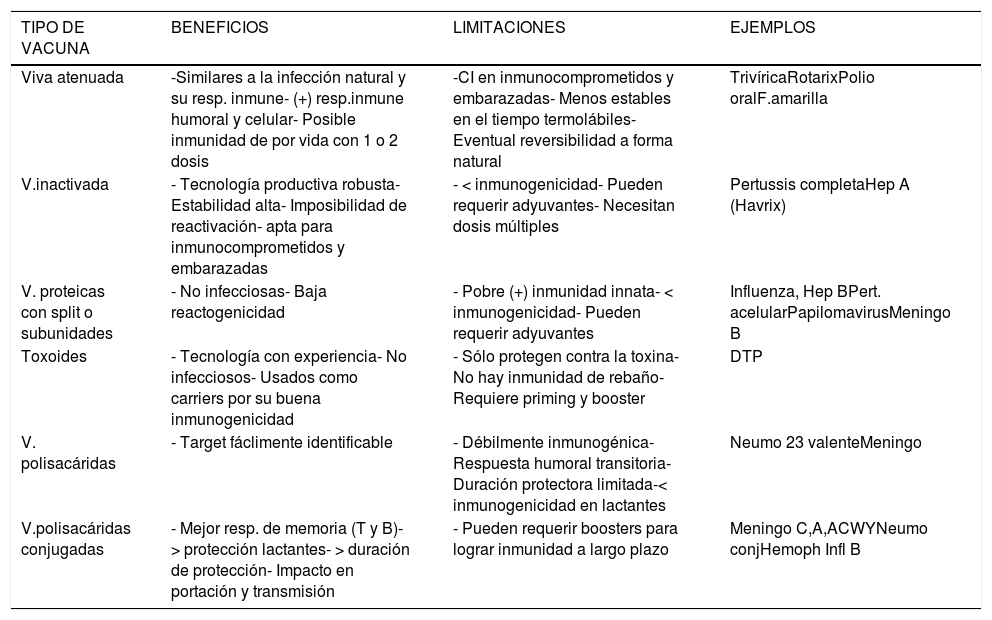
Beneficios y limitaciones de distintos tipos de vacunas3
| TIPO DE VACUNA | BENEFICIOS | LIMITACIONES | EJEMPLOS |
|---|---|---|---|
| Viva atenuada | -Similares a la infección natural y su resp. inmune- (+) resp.inmune humoral y celular- Posible inmunidad de por vida con 1 o 2 dosis | -CI en inmunocomprometidos y embarazadas- Menos estables en el tiempo termolábiles- Eventual reversibilidad a forma natural | TrivíricaRotarixPolio oralF.amarilla |
| V.inactivada | - Tecnología productiva robusta- Estabilidad alta- Imposibilidad de reactivación- apta para inmunocomprometidos y embarazadas | - < inmunogenicidad- Pueden requerir adyuvantes- Necesitan dosis múltiples | Pertussis completaHep A (Havrix) |
| V. proteicas con split o subunidades | - No infecciosas- Baja reactogenicidad | - Pobre (+) inmunidad innata- < inmunogenicidad- Pueden requerir adyuvantes | Influenza, Hep BPert. acelularPapilomavirusMeningo B |
| Toxoides | - Tecnología con experiencia- No infecciosos- Usados como carriers por su buena inmunogenicidad | - Sólo protegen contra la toxina- No hay inmunidad de rebaño- Requiere priming y booster | DTP |
| V. polisacáridas | - Target fáclimente identificable | - Débilmente inmunogénica- Respuesta humoral transitoria- Duración protectora limitada-< inmunogenicidad en lactantes | Neumo 23 valenteMeningo |
| V.polisacáridas conjugadas | - Mejor resp. de memoria (T y B)- > protección lactantes- > duración de protección- Impacto en portación y transmisión | - Pueden requerir boosters para lograr inmunidad a largo plazo | Meningo C,A,ACWYNeumo conjHemoph Infl B |
Resp: respuesta; CI: contraindicada; F. amarilla: fiebre amarilla; Hep A: hepatitis A; Pert.acelular: pertussis acelular; DTP: difteria, tétano, pertussis neumo23 valente: neumocóccica 23 valente; meningo: meningocóccica, neumo conj: neumocóccica conjugada, hemoph infl B: Hemophilus influenzaB.
Son sustancias que se agregan a la formulación de las vacunas para aumentar la inmunogenicidad de los antígenos. En general no son necesarios para las vacunas vivas atenuadas. Se usan frecuentemente en vacunas en base a subunidades, puesto que contienen menos antígenos, por un lado, y por otro, carecen de algunos de los componentes intrínsecos del patógeno que estimulan la respuesta inmune innata y, por ende, la respuesta adaptativa puede ser menor a la esperada.
Pueden actuar por diversos mecanismos: formación de depósitos, reclutamiento de células inmunológicas, activación del inflamosoma, estimulación de la presentación antigénica por las MHC e inmunomodulación6.
Al activar la respuesta inmune innata, contribuyen a aumentar o extender la respuesta inmunológica y mejoran la respuesta de memoria. Así, se puede reducir el número de dosis de las vacunas o la cantidad de antígeno en cada una de ellas. También contribuyen a mejorar la respuesta inmune en grupos de población con menor respuesta: lactantes, adultos mayores o inmunosuprimidos.
El adyuvante más antiguo y más comúnmente usado son las sales de aluminio (alum). Su mecanismo de acción aún es controversial, pero hay bastante información sobre su capacidad para aumentar la respuesta inmune humoral.
Se han licenciado algunos otros: MPL (lipopolisacárido bacteriano detoxificado, agonista del TLR4), emulsiones de aceite en agua (MF-59), virosomas (membranas lipídicas esféricas unidas in vitro con proteínas virales para simular membranas lipídicas) y combinaciones AS (AS 01-04). La combinación AS 04 (aluminio y MPL) por ejemplo, se ha usado en vacunas para el virus papiloma, aumentando el nivel de respuesta de anticuerpos, pero aún no está clara la duración de este aumento.
BoostersFinalmente, se requiere mantener el nivel de protección otorgado por la vacuna el mayor tiempo posible. En general, todas las vacunas requieren boosters. Una de las razones es que, por ej., las vacunas vivas atenuadas se seleccionan por su menor eficiencia en replicar, lo que lleva a menor patogenicidad y mejor perfil de seguridad. Pero la menor eficiencia de replicación va a llevar a una menor carga antigénica total, pudiendo impactar en la mantención de la protección lograda.
No es lo mismo inmunidad a largo plazo que protección a largo plazo. Una infección por agente natural o “salvaje”, estimula una respuesta inmunológica con un peak cercano a la infección, que va disminuyendo a lo largo del tiempo hasta alcanzar un plateau (fase de mantención). Una vacuna viva atenuada logra curvas de protección similares a las de la infección natural, pero en niveles menores. Puede ocurrir que en algún momento, estos niveles caigan bajo el nivel considerado como protector (a pesar que exista un nivel de respuesta medible). El booster permite llevar nuevamente los niveles de respuesta inmunológica a rangos de protección.
En general, el análisis de la eficacia de una vacuna y la duración de su inmunidad protectora han contribuído a la comprensión de los mecanismos subyacentes de su acción a corto, mediano y largo plazo. En ausencia de ayuda de los linfocitos T helper, las vacunas en base a polisacáridos logran sólo inmunidad de corto plazo y no proveen respuesta de memoria. Las vacunas con antígenos proteicos T dependientes logran producir respuesta inmune de largo plazo, pero la mayoría de las veces se rquiere de boosters para mantener niveles protectores en el tiempo. Los antígenos particulados han demostrado ser más inmunogénicos que los antígenos solubles. Los adyuvantes contribuyen a la inmunogenicidad de las vacunas por mecanismos diversos.
Generalmente, la mayoría de las veces se requieren boosters, para mantener los niveles de respuesta inmune dentro de los rangos de protección.
INMUNOSENESCENCIA Y VACUNASDado que las infecciones son una causa importante de morbimortalidad en la 3a edad, las vacunas parecen ser la herramienta óptima para promover un envejecimiento saludable7. Actualmente se recomiendan cuatro vacunas para mayores de 60 años: vacuna anti-influenza, neumococo, tétano/coqueluche, y una para prevenir la reactivación del herpes zoster.
Las cuatro están enfocadas en contra de antígenos para los cuales ya existe memoria inmune. Tres de ellas inducen respuestas de memoria, al menos en parte, mientras que la vacuna neumocócica actual es una vacuna polisacárida que induce principalmente una respuesta de linfocitos B (LB) independiente de los linfocitos T (LT). De estas cuatro vacunas, solo la vacuna contra tétano/coqueluche acelular proporciona una respuesta de anticuerpos protectores satisfactoria, pero, reducida en comparación con los adultos jóvenes8. Por el contrario, las vacunas contra la gripe o la enfermedad neumocócica no logran inducir inmunidad protectora en una gran proporción de esta población, pero al menos parecen ser capaces de mitigar la enfermedad en algún grado9,10. De manera similar, la vacunación con la vacuna viva del virus de la varicela zoster solamente previene parcialmente la reactivación del herpes zoster o atenúa la gravedad de la neuralgia posherpética11,12.
Una mejor comprensión de los cambios que ocurre durante el proceso de envejecimiento inmune es indispensable para enfrentar de manera óptima los defectos relacionados con la edad y restaurar las respuestas de las vacunas a un nivel en que la vacunación se convierta en una herramienta efectiva para promover el envejecimiento saludable.
El sistema inmune (SI) sufre profundas transformaciones con el paso de los años y, por lo tanto, los patrones de respuestas a los desafíos inmunológicos dependen en gran medida de la edad. Dado lo anterior, se ha observado que en los adultos mayores, los beneficios de la vacunación para prevenir enfermedades infecciosas son limitados, principalmente debido a la incapacidad del sistema inmune adaptativo para generar inmunidad protectora.
La declinación de la función del SI relacionada con la edad, denominada inmunosenescencia, sería secundario al deterioro progresivo tanto de la respuesta inmune innata y adaptativa13.
En este proceso están involucrados la médula ósea, el timo y su involución, los LT con deficiencias en su formación, maduración, homeostasis, migración y función, y acortamiento de sus telómeros. Por su parte, la interacción de la inmunidad innata con la respuesta adquirida se deteriora, la reparación del ADN disminuye, además se alteran los mecanismos antioxidantes, junto con la existencia de un estrés antigénico persistente. En paralelo, también se altera la presentación y procesamiento de los antígenos, la función de las citoquinas y de los LB14,15.
Cambios en la inmunidad innataSe observan alteraciones en las células presentadoras de antígenos (CPAs), específicamente se produce una sobreestimulación por activación no específica, disminuyendo además la capacidad de reconocimiento antigénico, así como la afinidad por los antígenos. Sin embargo, los cambios producidos en la inmunidad innata serían menores y poco relevantes16.
Las células NK, si bien tienen alteraciones en su función, con disminución de la lisis intracelular de células tumorales y partículas virales, de la capacidad de unión al antígeno y su respuesta a citoquinas, son capaces de compensar estos déficits con un aumento numérico, manteniendo su función15.
No se encontraron cambios importantes en los polimorfonucleares, salvo una disminución de su llegada a las abrasiones de la piel y un aumento de la sensibilidad a las citoquinas pro-apoptóticas. Estos procesos son aún más evidentes en pacientes con diabetes, bronquitis crónica, dislipemias o con enfermedad vascular16.
Los macrófagos sufren una baja en la producción de Interferón-γ, menor citotoxicidad tumoral y menor síntesis de óxido nítrico luego de su activación17.
Las citoquinas pro-inflamatorias en reglas generales aumentan en forma no específica en los pacientes ancianos, si bien algunas como la IL-1, están disminuidas17 (Tabla 2).
Cambios en la respuesta inmune innata durante la inmunosenescencia
| COMPONENTE | CAMBIOS DURANTE EL ENVEJECIMIENTO |
|---|---|
| Células presentadoras de antígenos | Alteración en el reconocimiento como en la presentación de los antígenos |
| Natural Killers | Aumento del número para compensar pérdida de función; disminución de la afinidad y unión a los antígenos |
| Polimorfos nucleares | Se observa menor penetración en los tejidos, asociado a un aumento de la sensibilidad a citoquinas apoptóticas y un aumento de los radicales libres intracelulares pero con menor actividad lítica |
| Macrófagos | Disminución de lisis tumoral asociada a una menor respuesta a INF-γ o LPS, con una reducción cercana al 50% en la producción de óxido nítrico |
| Citoquinas | Menor producción de IL-1, INF- γ, con aumento de PGE2 e IL-10 |
INF-γ: interferón gamma; LPS: lipopolisacárido; IL: interleuquina; PGE2: prostaglandina E2.
Como se mencionó, los principales protagonistas de la inmunidad adquirida son los LT y LB.
A medida que se envejece, se produce la involución del timo. Se estima que, a los 45 años, el timo ha involucionado en casi un 90% de su volumen original. La producción de LT naive disminuye a medida que aumenta la edad y la producción tímica es mínima a partir de los 55 años18.
Linfoctios T: Tanto la involución tímica, como los cambios en la médula ósea resultan en cambios fenotípicos en los LT circulantes, con una disminución en el número de LT naive y una acumulación relativa de LT de memoria, no todos los cuales son normo funcionantes.
Un repertorio diverso de células T naive es esencial para una respuesta vigorosa a infecciones y vacunas. Sin embargo, el envejecimiento interfiere de distintas maneras en los repertorios de LT19:
- -
Disminución del número, reserva y diversidad de LT naive, responsables de la respuesta a nuevos antígenos. Por lo tanto, son principalmente los LT de memoria quienes se encargan de la respuesta inmune en el adulto mayor.
- -
Reconocimiento de antígenos con reactividad cruzada por parte de los LT memoria.
- -
Aumento relativo de la proliferación de los LT memoria. Al disminuir el aporte de LT naive, la proliferación es mayor en los LT memoria, lo que ofrece menos LT capaces de responder a nuevos antígenos.
Linfocitos B: Los LB naive disminuyen en número y los LB efectores se acumulan, lo que determina una reducción en la diversidad de respuesta a los antígenos. Se observa también una disminución de la producción de LB a nivel medular, por consiguiente, la población B está formada por más células experimentadas (en cuanto a su reconocimiento de antígenos) que por células naive. Por otro lado, hay una alteración en la maduración de la afinidad de los antígenos, proceso que ocurre en el centro germinal del tejido linfoide secundario.
En los ancianos, además está afectada la calidad de los anticuerpos. Esta alteración de la calidad asociada al envejecimiento, con aumento de anticuerpos no específicos y baja de los específicos de alta afinidad, se asocian directamente a una alteración de la respuesta inmunológica a la vacunación20,21.
Otros cambios en la inmunidad adquiridaLa médula ósea envejecida no apoya la supervivencia de las células plasmáticas de larga vida media, esenciales en la respuesta a la vacunación22.
Todas estas modificaciones asociadas al envejecimiento, aumentan la susceptibilidad a las infecciones bacterianas, afectan la respuesta a la vacunación y probablemente se asocian fuertemente a la fragilidad inmunológica de los ancianos (Tabla 3).
Cambios en la respuesta inmune adquirida durante la inmunosenescencia
| COMPONENTE | CAMBIOS DURANTE EL ENVEJECIMIENTO |
|---|---|
| Linfocitos T | Disminución de las células tímicas.Reconocimiento de antígenos con reactividad cruzada por parte de los LT memoria, asociado a la disminución de la diversidad de los LT naive y aumento de la proliferación de los LT de memoria.Disminución de la diversidad de los LT naive.Mayor % de LT hipofuncionantes con la edad |
| Involución tímica y stem cells en médula ósea | Menor producción de stem cells y cambios fenotípico de los LT circulantes. Disminución del N° LT naive y aumento relativo de los de memoria. |
| Citoquinas. Respuesta Th1 | Disminución de IL-2, IFN- γ variable.Disminución de la expresión de citoquinas proinflamatorias con menor activación y fosforilación. |
| Citoquinas. Respuesta Th2 | Aumento PGE2 e IL-10, variable IL-4. Aumento de la función pro-apoptótica. |
| Linfocitos B | Cambios similares a LT con menor activación y proliferación. Menos células productoras de anticuerpos y menor producción de anticuerpos. Por cada LB, los que además son menos eficaces. Menor efecto booster. |
| Alteración de precursores B | Menos cél. Plasmáticas de larga vida media en médula ósea.Menos LB naive y, proporcionalmente, más LB antigénicamente experimentados.Aumento de auto-anticuerpos. |
INF-γ: interferón gamma; IL: interleuquina; PGE2: prostaglandina E2; LT: linfocito T; LB: linfocito B.
Dado el profundo cambio demográfico a nivel mundial, es perentorio mejorar las respuestas a las vacunas en los pacientes mayores. Durante la última década, el progreso en la optimización del éxito de la vacuna ha sido modesto, sin embargo, lograr desentrañar cómo envejece el SI en los humanos e identificar las vías moleculares que pueden ser dirigidas a mejorar específicamente la respuesta a la vacuna en los ancianos, resulta auspicioso.
Las características cardinales de la inmunosenescencia se pueden resumir en13:
- -
Incapacidad para responder a nuevos antígenos.
- -
Respuestas de memoria no sostenidas
- -
Mayor propensión a respuestas autoinmunes.
- -
Inflamación persistente de bajo grado, ciertamente contribuyen a respuestas defectuosas de la vacuna.
Las respuestas a las vacunas en el adulto mayor dependen inevitablemente de los recursos disponibles en términos de LT y B, sin embargo, el mantenimiento del repertorio en el adulto parece mantenerse relativamente robusto y no depende en gran medida de la generación de novo de LB y T. La restauración de la generación de células precursoras B y T en la médula ósea o la función tímica rejuvenecedora son objetivos desafiantes y ciertamente no son fácilmente aplicables, pero pueden no ser una necesidad primaria para un envejecimiento inmune saludable. Los cambios intrínsecos en las células que deterioran la activación y diferenciación de las células T y B son bastante sutiles y pueden superarse mediante intervenciones limitadas temporalmente en el momento de la vacunación. Los circuitos de retroalimentación negativa en la señalización y el metabolismo celular emergen como vías importantes para comprender y potencialmente modular el comportamiento del envejecimiento de las células T.
ALERGIA A VACUNASGeneralidadesCualquier vacuna, como cualquier antígeno que toma contacto con nuestro sistema inmune, puede teóricamente causar una eventual reacción alérgica. Si bien las reacciones adversas asociadas a vacunas no son raras, las reacciones alérgicas sí son muy infrecuentes. La mayoría de las reacciones adversas son leves y no mediadas inmunológicamente, e incluso no reproducibles con una nueva vacunación. Existen varios tipos de reacciones a vacunas, y debemos distinguir las alérgicas de otro tipo de manifestaciones, como respuestas vaso-vagales, reacciones ansiosas, reacciones locales en el sitio de punción inmediatas o retardadas.
Las reacciones de hipersensibilidad, (alérgicas), se han estimado entre 1 en 50.000 y 1 en 1.000.000 de dosis. Entre ellas las anafilaxias, las más graves, se han cifrado entre 1 en 100.000 y 1 en 1.000.000 de dosis para las vacunas administradas más frecuentemente23. Aunque su frecuencia sea muy baja, estas reacciones son súbitas, impredecibles y no prevenibles, además de eventualmente con riesgo vital, por lo que es de crucial importancia que todos los lugares que aplican inmunizaciones estén debidamente preparados para enfrentarlas, en todo momento. Esto implica contar con el equipamiento y medicamentos necesarios para tratarlas, además de personal entrenado para su manejo.
Reacciones adversas y reacciones alérgicas a vacunasLa mayoría de las reacciones adversas a vacunas, corresponden a reacciones no mediadas por un mecanismo de hipersensibilidad, es decir no alérgicas. Las más comunes son reacciones locales, que incluyen dolor, eritema, tumefacción en el sitio de inyección, atribuidas a la inflamación por la inyección misma, y por la introducción de elementos externos. También pueden existir reacciones adversas no alérgicas sistémicas, como fiebre, decaimiento, irritabilidad, cefalea, diarrea, rash inespecíficos, mialgias y síncope se encuentran entre los más comunes, (Tabla 4)24.
Diferenciación entre anafilaxia y reacción vaso-vagal24
| SÍNTOMAS | ANAFILAXIA | REACCIÓN VASO-VAGAL |
|---|---|---|
| Tiempo de inicio desde la inmunización | Pocos minutos, habitualmente 30 min | Durante la inyección o segundos después |
| Respiratorio | Sibilancias, estridor | Normal o hiperventilación |
| Cardiovascular | Taquicardia, hipotensión | Bradicardia, hipotensión |
| Piel | Eritema, urticaria, angioedema | Palidez, sudoración, frialdad distal |
| Gastrointestinal | Dolor abdominal cólico | Náuseas, vómitos |
| Neurológico | Alteración o pérdida de conciencia, poca respuesta al poner en prono | Pérdida de conciencia autolimitada, buena respuesta al poner en prono |
Las reacciones alérgicas podemos clasificarlas en inmediatas (Hipersensibilidad tipo I, IgE mediada), y retardadas (Hipersensibilidad tipo IV), basándonos en el tiempo transcurrido entre la vacunación y la reacción.
Generalmente denominamos una reacción alérgica inmediata aquella producida hasta 2 horas posteriores al contacto con el alérgeno, (aunque se han descrito infrecuentemente latencias mayores, de hasta 4 horas). En las vacunas generalmente las reacciones de tipo inmediato se dan en minutos, antes de la primera hora23. Éstas se caracterizan por síntomas que pueden comprender eritema, prurito, rino-conjuntivitis, síntomas gastrointestinales, urticaria, angioedema, hasta anafilaxia, que puede incluir dificultad respiratoria alta por cierre laríngeo, dificultad respiratoria baja con bronco-constricción, taquicardia e hipotensión. Las anafilaxias en general comprometen a más de un sistema y presentan en un 80-90% asociación a síntomas cutáneos. La importancia de distinguir reacciones IgE mediadas es que se pueden manifestar como reacciones severas con compromiso vital, por lo que el paciente requerirá de una evaluación más detallada (Tabla 5)25.
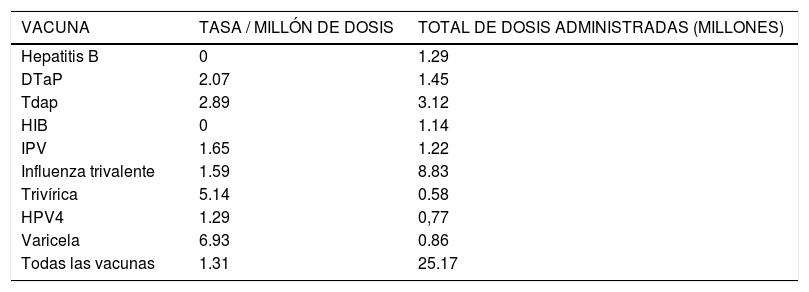
Incidencia de reacciones anafilácticas gatilladas por vacunas25
| VACUNA | TASA / MILLÓN DE DOSIS | TOTAL DE DOSIS ADMINISTRADAS (MILLONES) |
|---|---|---|
| Hepatitis B | 0 | 1.29 |
| DTaP | 2.07 | 1.45 |
| Tdap | 2.89 | 3.12 |
| HIB | 0 | 1.14 |
| IPV | 1.65 | 1.22 |
| Influenza trivalente | 1.59 | 8.83 |
| Trivírica | 5.14 | 0.58 |
| HPV4 | 1.29 | 0,77 |
| Varicela | 6.93 | 0.86 |
| Todas las vacunas | 1.31 | 25.17 |
Las reacciones alérgicas retardadas ocurren varias horas o días posterior a la exposición. Las manifestaciones más habituales son rash maculopapulares, dermatitis de contacto o desarrollo de nódulos subcutáneos pruriginosos. Generalmente son fenómenos autolimitados, que no contraindican una dosis posterior.
Las reacciones locales raramente pueden estar producidas también por una reacción de Arthus, por un mecanismo de hipersensibilidad tipo III, (mediada por la formación de complejos inmunes) que induce una vasculitis local transitoria. Se presenta 4-12 horas post vacunación y se caracteriza por dolor local, induración, edema y eritema, ocasionalmente con hemorragia y necrosis25.
Para disminuir reacciones locales la técnica de vacunación es muy importante, ya que inyecciones más profundas se asocian a una menor incidencia de ellas, especialmente en menores de 3 años. Así mismo, la aplicación en los brazos se asocia a mayor reacción que en los muslos.
Componentes de vacunas que pueden provocar reacciones alérgicasLas reacciones alérgicas a las vacunas están dirigidas en su gran mayoría a compuestos adicionados en el proceso de manufactura. El conocimiento de los ingredientes de la vacuna es importante al momento de valorar una reacción alérgica.
Además de los antígenos microbianos, las vacunas pueden incluir estabilizadores, antibióticos, adyuvantes, preservantes y contaminantes residuales del proceso de producción. Muchos de estos componentes están presentes en cantidades muy pequeñas, generalmente insuficientes para gatillar reacciones alérgicas en la mayoría de los individuos con una posible hipersensibilidad al componente. Sin embargo, en aquellos inusualmente sensibles, se podría llegar a gatillar una reacción26. A continuación, se describen los principales componentes que han sido asociados a respuestas alérgicas.
Huevo: La alergia al huevo es una de las alergias alimentarias más frecuentes en la infancia, y la sensibilización ocurre principalmente antes de los 5 años. Algunas vacunas contienen cantidades muy pequeñas, residuales, de ovoalbúmina, dado que su cultivo se produce en fibroblastos de embriones de pollo (trivírica) o en huevos embrionados de pollo (influenza, fiebre amarilla). Si bien las concentraciones de ovoalbúmina generalmente no son reportadas, y varían entre marcas y lotes de vacuna27, en ambos casos son extremadamente bajas (nanogramos - picogramos), por lo que varios estudios han ido comprobando la seguridad del uso de estas vacunas en pacientes alérgicos al huevo, como veremos a continuación en cada vacuna.
Leche: La alergia a las proteínas de la leche de vaca es la alergia alimentaria más común de la infancia. Se han publicado algunas series de casos de pacientes con alergia severa a la leche que han presentado reacciones a vacunas DTaP y Tdap28. En algunas marcas de estas vacunas se usan proteínas de la leche como estabilizadores de los medios de cultivo, habiéndose descrito nanogramos de caseína. También hay reportes de casos con vacuna trivírica30 y polio oral que contiene alfalactoalbúmina29. En el caso de la vacuna trivírica, se han reportado en Chile y Brasil. Este hallazgo varía entre marcas y lotes de una misma vacuna. Dado que la anafilaxia es muy rara, y la abismante mayoría de los niños alérgicos a la leche reciben estas vacunas sin eventos adversos, se recomienda continuar con las precauciones estándar en su administración. En caso de pacientes muy alérgicos a la leche que reaccionen a estas vacunas, se debe considerar como etiología posible y referir a especialista inmunólogo, además ser reportado y derivado a evaluación por especialista en inmunología y alergias23.
Gelatina: Esta proteína animal se usa ampliamente en alimentos y medicamentos, pudiendo ser de origen bovino o porcino. En las vacunas se usa como agente estabilizador, principalmente de vacunas de virus vivos. El primer caso confirmado de reacción por alergia a la gelatina fue un reporte de anafilaxia a vacuna trivírica, en un paciente que tenía síntomas alérgicos frente al consumo alimentario de gelatina, y en el cual se demostró presencia de IgE específica a esta proteína con reactividad cruzada entre la proteína de origen farmacéutico y la alimentaria31. Subsecuentes estudios demostraron también gelatina como etiología de reacciones anafilácticas en vacunas trivírica, varicela y encefalitis japonesa23,26. Muchos pacientes que han presentado anafilaxia a una vacuna que contiene gelatina toleran su ingesta, por lo que este antecedente no descarta la alergia a la gelatina al momento de evaluar un paciente con una reacción. Presumiblemente esto se debe a que la ingesta permite la digestión de la proteína en péptidos más pequeños, menos alergénicos. En un paciente con antecedente de alergia a una vacuna con gelatina, que requiere nuevas dosis, debe estudiarse con test cutáneos a gelatina y la vacuna. La solución para prick test se puede preparar disolviendo 1 cucharada de té de gelatina en 5ml de solución salina, siendo importante testear proteína de origen bovino y porcino23. Si estos son positivos, realizar una vacunación graduada, en dosis crecientes, como se verá más adelante.
Adyuvantes: Los adyuvantes son elementos incorporados en las vacunas para potenciar la respuesta inmune del receptor, específicamente la respuesta específica de linfocitos T CD4. Los más comunes han sido hidróxido y fosfato de aluminio. No se han documentado reacciones anafilácticas ni otras alergias inmediatas contra estos componentes, pero sí se ha reportado como causa de reacciones locales, tipo hipersensibilidad retardada, como dermatitis de contacto, rash maculopapular o de tipo nodular granulomatosa26. En general, los pacientes con antecedente previo de alergia al aluminio pueden recibir vacunas que lo contengan sin inducir reacciones severas, aunque sí se puede gatillar una reacción cutánea retardada. Actualmente este adyuvante se ha ido retirando de la formulación de las vacunas.
Preservantes: Las vacunas en viales multidosis contienen preservantes para evitar el crecimiento bacteriano. Dentro de ellos están el tiomersal o timerosal, el 2-fenoxietanol y fenol. El timerosal ha sido asociado a reacciones alérgicas de contacto, pero no sistémicas inmediatas. Una reacción local por timerosal no contraindica una nueva dosis de la vacuna26. El 2-fenoxietanol y fenol se usan ampliamente en cosméticos, colirios y antisépticos. El primero ha sido reportado como etiología de algunos casos de dermatitis de contacto, y para el segundo no hay reportes de hipersensibilidad.
Antimicrobianos: Algunos antibióticos se usan durante el proceso de producción de las vacunas, para prevenir la contaminación con microrganismos. Entre ellos están la neomicina, gentamicina, tetraciclina, estreptomicina y polimixina B. Dado que son removidos durante el proceso de purificación, lo que puede estar presente en una vacuna son trazas. Si bien estos antobióticos son capaces de producir reacciones alérgicas en su uso como tratamientos, no se ha documentado adecuadamente que estas trazas puedan ser etiología de una reacción de hipersensibilidad a vacunas. Dicho esto, dado que no hay estudios al respecto, sigue siendo una posibilidad teórica y una historia de anafilaxia a la neomicina contraindica la inmunización con vacunas que la contengan en sus ingredientes declarados32.
Látex: El látex natural puede estar presente en los tapones de los viales o jeringas pre llenadas, con el riesgo teórico de producir una reacción en pacientes alérgicos severos al látex. Hay comunicaciones de casos de anafilaxias atribuidas al látex, pero ninguna con los estudios causales que comprobaran éste como etiología. Una revisión de reportes de eventos adversos a vacunas, determinó que el riego de una reacción alérgica causada por el látex del envasado de las vacunas sería extremadamente raro33. Por lo tanto, no se recomiendan mayores medidas preventivas aparte de usar guantes sin látex. En muchas vacunas el látex natural ha sido remplazado por látex sintético, no alergénico, por lo que a los pacientes con antecedentes de alergias severas al látex (anafilaxias), se podría recomendar, si es posible, evitar vacunas que lo contengan26.
Otros: En las vacunas se pueden encontrar cantidades residuales de los medios usados para cultivar microrganismos. La purificación posterior remueve la mayoría de los restos celulares, pero pueden quedar trazas. Uno de estos medios son células de levaduras (Saccharomyces cerevisiae), donde se expresan las proteínas recombinantes. Las vacunas HPV cuadrivalente y nonavalente, hepatitis B y una meningocócica conjugada usan este medio, y podrían contener proteínas residuales de esta levadura. Se han reportado algunos casos de posibles anafilaxias luego de vacunación en pacientes con historia de alergia severa a levaduras, aunque sin estudio de confirmación etiológica26. La recomendación en pacientes con antecedente de alergia severa a levadura, es testear IgE específica a S. cereviciae, y en aquellos con sensibilización, derivar a evaluación a especialista inmunólogo para realizar test cutáneos previos a las vacunas. Si estos son positivos, en caso de no existir vacuna alternativa, el especialista puede evaluar realizar una vacunación graduada, en dosis crecientes23.
Algunas vacunas específicas y alergiaDifteria- Tétano-Pertusis acelular (DTaP): La hipersensibilidad a DTaP es muy rara. La mayoría de los reportes consignan reacciones en el sitio de inyección, y entre ellas está hipersensibilidad retardada a aluminio que contiene como adyuvante. Las reacciones de hipersensibilidad se estiman en 2 por millón de dosis25. Hasta 1997 DTaP contenía gelatina. En Japón se reportó entre 1994 y 2000 una incidencia de anafilaxia de 0,95 por millón, pero no se pudo establecer causalidad con ningún componente en particular34. Como ya se mencionó, algunas marcas de DTaP puede contener trazas de una proteína de la leche de vaca, caseína, dado que se preparan en un medio que la contiene. Ha sido implicada como causa de anafilaxia en niños con alergia severa a la leche y niveles muy altos de IgE específica, pero dado que es tolerada por la gran mayoría de los niños alérgicos, incluso severos, a partir de estos reportes no se han recomendado cambios en las precauciones estándar en su aplicación, sí vigilancia.
Sarampión-Paperas-Rubéola (Trivírica): La mayoría de los casos de hipersensibilidad a vacuna trivírica reportados han sido asociados a la gelatina, pero la tasa más alta reportada es previa a 1998, dado que hasta ese momento contenía una concentración mayor de gelatina que la actual. Desde la disminución de la concentración y el uso de una forma de gelatina hipo alergénica, los reportes de anafilaxia han disminuido dramáticamente34,35. Por otra parte, históricamente en esta vacuna ha habido una preocupación respecto del riesgo en pacientes alérgicos al huevo, dado que se cultiva en fibroblastos de embriones de pollo. Se han determinado cantidades ínfimas que llegan a picogramos de proteína de huevo, insuficiente para causar una reacción alérgica. Además, múltiples estudios clínicos en pacientes con alergia al huevo, incluso con antecedente de anafilaxia, han demostrado una tasa de reacciones similar al grupo control, por lo que actualmente no es una contraindicación, ni tampoco se recomienda ninguna precaución especial al momento de vacunar a estos pacientes, más que las precauciones estándar23,36,37.
Influenza: La vacuna influenza es preparada en huevos embrionados, conteniendo escasa cantidad residual de ovoalbúmina, por lo que la alergia al huevo ha sido una preocupación de larga data. Los estudios a la fecha indican que las reacciones alérgicas severas con las vacunas anti influenza actuales son raras, con una incidencia de anafilaxia de 1,5 en 1 millón de dosis25. El contenido de ovoalbúmina es menor de 0,12 microgramos/ml, variando entre distintas marcas y lotes. Se han llevado a cabo más de 25 estudios específicamente diseñados para evaluar la seguridad de la vacuna influenza en alérgicos al huevo, reclutando más de 4.300 pacientes, incluyendo más de 650 con antecedente de anafilaxia. Se demostró que la incidencia de anafilaxia en pacientes con alergia al huevo no es mayor a aquéllos sin alergia, ni a la de otras vacunas que no lo contienen38,39. Actualmente la recomendación es que todos los pacientes alérgicos al huevo pueden recibir la vacuna sin contraindicación. Si bien algunas sociedades científicas recomiendan en pacientes con antecedente de alergia severa al huevo (anafilaxia) un período de observación posterior de 30-60 minutos, otras han declarado que la vacuna puede ser administrada con las precauciones estándar en todos los niños alérgicos al huevo, independiente de su severidad38,23,24. También se debe considerar que algunas marcas de esta vacuna contienen gelatina.
Varicela: Algunas marcas de vacuna varicela y de vacuna zoster contienen gelatina, y ésta ha sido asociada los escasos reportes de anafilaxia a esta vacuna23.
Polio: La anafilaxia es extremadamente rara, reportándose una tasa, indicándose una tasa 0,65-3 casos por millón de dosis. Existe un riesgo teórico de reacciones de hipersensibilidad a trazas de neomicina, estreptomicina y polimixina B tanto en la forma inyectable como la oral. Como se mencionó previamente, en polio oral también se han descrito la presencia de proteínas de leche (alfalactoalbúmina)24.
Pneumococo y meningococo: No hay contraindicaciones de estas vacunas en pacientes alérgicos, excepto a aquellos que tengan una hipersensibilidad conocida a sus componentes o a una dosis previa24.
Hepatitis B: Los reportes de anafilaxia son muy raros y han estado asociados a hipersensibilidad a levadura o a látex24.
Fiebre amarilla: La vacuna de la fiebre amarilla, producida en huevos embrionados de pollo, tiene un contenido de ovoalbúmina que se ha estimado en menos de 16 microgramos /dosis. Algunas marcas contienen cantidades similares a la vacuna influenza. Dado lo anterior, se podría suponer segura, sin embargo, no existen estudios grandes de seguridad en pacientes alérgicos al huevo. La recomendación en pacientes alérgicos al huevo que la necesiten, es realizar test cutáneos con la vacuna, y una administración graduada en dosis crecientes24. Una marca de vacuna fiebre amarilla contiene gelatina.
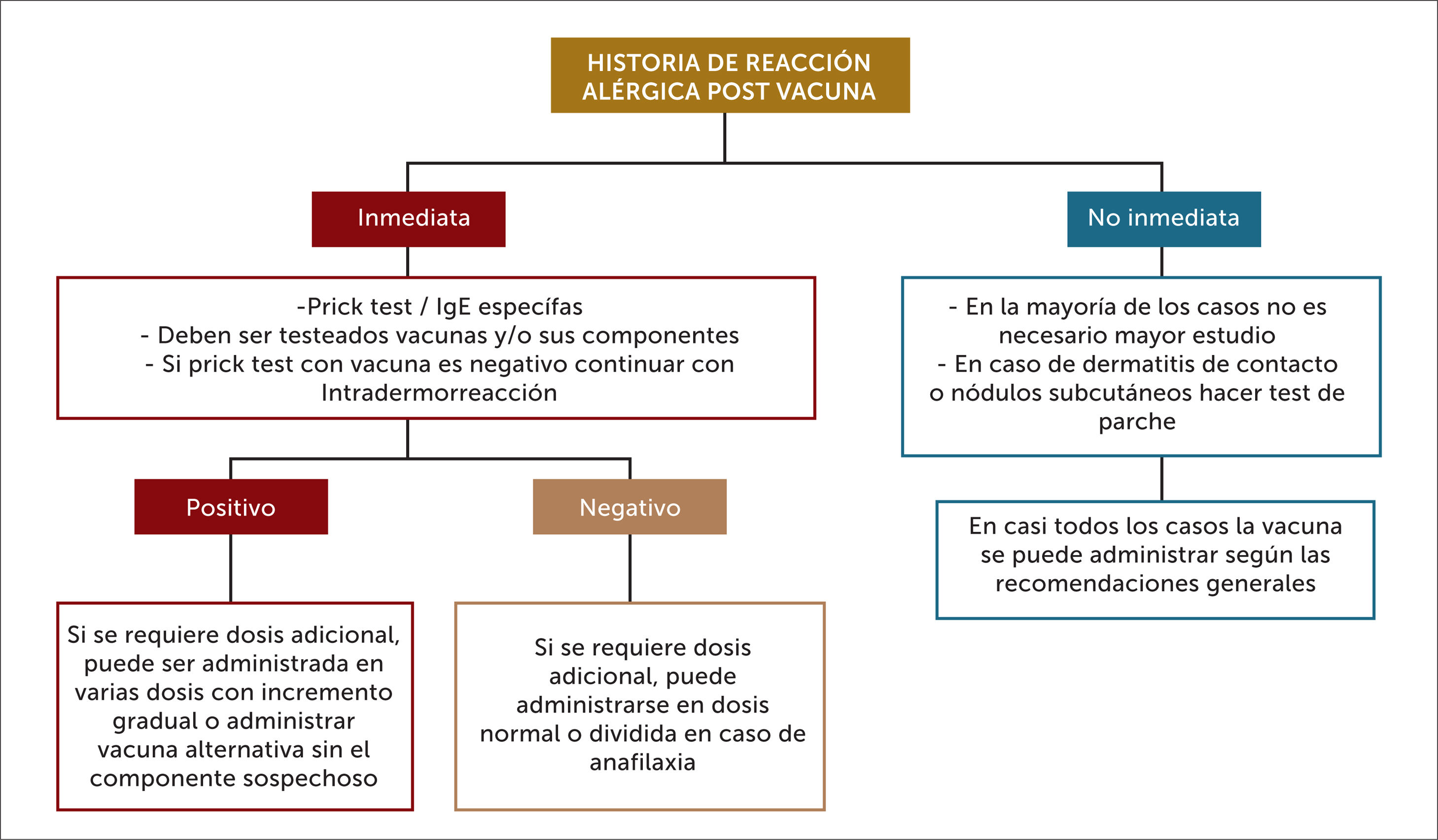
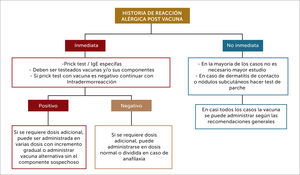
Enfrentamiento diagnóstico en reacciones alérgicas a vacunasPara establecer el diagnóstico de alergia a una vacuna, lo primero es una historia clínica detallada, que sea sugerente de una posible reacción alérgica. No es infrecuente que los pacientes frente a reacciones inespecíficas queden falsamente catalogados de alérgicos, en los cuales la administración de una siguiente dosis es bien tolerada. El antecedente de enfermedades alérgicas o una historia familiar de alergia no son contraindicación alguna para ser inmunizados, así como también una historia de sensibilización a algún componente, pero sin síntomas clínicos asociados (Figura 3).
Flujograma estudio alergia a vacunas23
Debe ser llevado a cabo por especialista en inmunología y alergias. Ref 23.
Por otro lado, los pacientes que tengan una historia compatible con una reacción alérgica severa posterior a una inmunización, son considerados de alto riesgo, y no deben ser re inmunizados con la misma vacuna hasta que se haga el estudio alergológico correspondiente. Si se sospecha en un paciente una reacción alérgica a una vacuna, la confirmación y eventual identificación del alérgeno causal es importante para indicaciones posteriores de inmunización.
Luego de una reacción de tipo inmediata, se debe estudiar la sensibilización para componentes de la vacuna con IgE específicas (huevo, proteínas de la leche, gelatina, látex, levaduras) y realizar test cutáneos. Sin embargo, es importante tener en cuenta que no existen publicados datos de especificidad y sensibilidad de los test cutáneos en diferentes concentraciones, por lo que no hay valores predictivos de anafilaxia23.
La aproximación general en la literatura es iniciar con prick test con la vacuna sin diluir. Si éste es negativo, continuar con intradermorreacción (IDR), primero en dilución 1:100, y si esta es negativa, pasar a dilución 1:10. No se recomiendan IDR sin diluir, por la alta tasa de reacciones irritativas. En vacunas como influenza, trivírica y varicela se han descrito reacciones irritativas en concentración 1/1024.
En los pacientes con antecedente de anafilaxia, en que se demuestra sensibilización a una vacuna o uno de sus componentes, deben evitar ser re vacunados, y si es posible, elegir una vacuna que no contenga el alérgeno identificado. Cuando existe un escenario de necesidad absoluta de recibir inmunización y no es posible una vacuna alternativa hay dos aproximaciones posibles24:
- -
Con antecedente de anafilaxia con test cutáneos negativos, vacunar con dosis divididas: primero 10% de la dosis, luego de 30 minutos de observación, si no hay reacción, proceder a aplicar el 90% restante.
- -
Con antecedente de anafilaxia y test cutáneos positivos, hacer una desensibilización rápida, administrando dosis gradualmente con un incremento progresivo: cada 15-30 minutos según tolerancia (0,05ml de una dilución 1:10, luego 0,05ml, luego 0,1ml, 0,15ml, 0,2ml, de una vacuna completa de 0,5ml). Es importante conocer que este protocolo solo lleva a la desensibilización transitoria, y el paciente debe seguir siendo considerado alérgico a la vacuna.
En caso de que el paciente haya presentado una reacción de tipo retardada, esto no es considerado necesariamente contraindicación para una siguiente vacunación, dado que el riesgo de no estar inmunizado supera el de una eventual reacción local. Se puede investigar sensibilización de tipo retardada con test epicutáneos (test de parche) a aluminio, antibióticos u otros componentes. Si bien no es esencial para las decisiones terapéuticas, podría ayudar a afinar el diagnóstico y elegir vacunas alternativas si hay disponibles. En estudios en niños con reacciones nodulares posterior a vacunas, se demostró con test de parche significativa mayor sensibilización al aluminio versus sus hermanos asintomáticos (77% v/s 8%). El aluminio se testea en el parche al 2% y 10%, y su lectura debe hacerse al 3° o 4° día y luego a la semana24.
No se recomiendan hacer estudios pre inmunización, dado que no son predictivos ni excluyen eventuales reacciones futuras.
Por último, es necesario subrayar que todos éstos procedimientos y protocolos deben ser llevados a cabo por especialistas en inmunología y alergias.
CONCLUSIONESLa interacción de los antígenos de una vacuna con el sistema inmune es compleja y avances en la tecnología de las vacunas han permitido mejorar la inmunogenicidad de ellas. Dado el progresivo envejecimiento y mayor expectativa de vida de la población, se hace más necesario el desarrollo de estrategias que permitan optimizar la respuesta a las inmunizaciones de los adultos mayores. Las reacciones alérgicas a las vacunas son eventos raros, pero potencialmente severos y fatales. La identificación del posible alérgeno causal y estudio con la vacuna implicada es muy importante para poder dar recomendaciones futuras al paciente.
Declaración de conflicto de interésLos autores no tenemos conflictos de interés relacionados con esta publicación que declarar.