La resistencia antibiótica ha limitado progresivamente nuestras posibilidades terapeúticas y ha aumentado los costos. En este artículo se entrega una visión de los mecanismos más frecuentes en bacterias comunes, tanto comunitarias como nosocomiales y las implicancias terapéuticas que generan en el día a día.
Antibiotic resistance has increasingly limited our therapeutic alternatives and has amplified medical charges. In this review article, prevalent mechanisms present in common community or nosocomial bacteria are analyzed together with their therapeutic implications.
El presente artículo ha sido preparado como una revisión sobre el problema de la resistencia antimicrobiana en bacterias comunes, adaptando la información a las implicancias terapéuticas de esta resistencia. Se debe recordar que los esquemas presentados en este artículo tienen un propósito docente y han sacrificado numerosos detalles y excepciones para dar mayor claridad.
La resistencia antimicrobiana en bacterias patógenas u oportunistas es un fenómeno progresivo que aparece luego de la introducción de los diferentes antimicrobianos, se desarrolla y se comporta en forma acumulativa en diferentes especies, tiende a la multiresistencia y es detectable tanto en los hospitales como en la comunidad (tabla 1).
Algunos Ejemplos de Emergencia de Resistencia Antimicrobiana en la Comunidad
| EN LA COMUNIDAD | |
| • Gonococo | Resistencia a penicilina (presente en Chile) |
| • Salmonella serotipo Typhi | Multiresistencia (no observado en Chile) |
| • Mycobacterium tuberculosis | Multiresistencia (de baja frecuencia en Chile) |
| • Shigella sp | Multiresistencia (relevante en Chile) |
| • Escherichia coli (como agente de ITU) | Resistencia a ampicilina y cotrimoxazol (presente en Chile) |
| • Neumococo | Resistencia a penicilina y en una fracción de los casos a cefalosporinas (presente en Chile) |
| • Haemophilus influenzae | Resistencia a ampicilina (presente en Chile) |
| • Moraxella catharralis | Resistencia a ampicilina (presente en Chile) |
| • Staphylococcus aureus | Resistencia a penicilina (presente en Chile) |
| • Plasmodium sp | Resistencia a diferentes antimaláricos |
| EN HOSPITALES | |
| • Staphylococci | Resistencia a cloxacilina y multiresistencia (presente en Chile) Resistencia a vancomicina (no descrito en Chile) |
| • Enterococo | Resistencia a beta-lactámicos, aminoglucósidos y vancomicina (presente en Chile) |
| • Bacilos Gram negativos entéricos y no fermentadores | Resistencia a beta-lactámicos/carbapenémicos, aminoglucósidos, quinolonas, cotrimoxazol (presente en Chile). |
La capacidad de resistir el efecto de algún antimicrobiano está presente en forma infrecuente en una población bacteriana antes de la exposición al compuesto. La frecuencia de este fenómeno es muy baja y oscila entre 10−6 a 10−7 (una bacteria dotada con la capacidad de resistir un compuesto determinado cada un millón o 10 millones de individuos en una población). Ante una exposición al producto, estas bacterias resistentes son seleccionadas, manteniendo su capacidad replicativa y reemplazando a la población original con una nueva población resistente. Los individuos resistentes no son más virulentos que los originales y en algunos casos, su capacidad replicativa es más lenta. Por ello, si se suspende la presión selectiva, la población nativa puede en teoría recolonizar al paciente y reemplaza luego de algún tiempo a la población resistente. Esto explica por qué la resistencia antimicrobiana es más infrecuente en la comunidad, pero común en los hospitales, lugar donde la presión selectiva nunca cesa. Una serie de factores de la atención hospitalaria facilita además la diseminación horizontal de esta resistencia, como por ejemplo un bajo nivel de adherencia en la higiene de manos y la contaminación de equipos, instrumental y mobiliario.
La transformación de la resistencia antibiótica desde un fenómeno bacteriano infrecuente a uno común obedece mayoritariamente a las prácticas de uso irracional de antibióticos, tanto a nivel comunitario como nosocomial. La bacteria posee la capacidad de resistir, pero su expansión obedece básicamente a conductas de la especie humana (tabla 2). La presión selectiva sobre las especies bacterianas en la comunidad puntualmente involucra a algunos pocos pacientes sin embargo, es recurrente y continúa a través de los años, lo que permite la sobrevida de las bacterias resistentes en la comunidad. Una causa complementaria de resistencia bacteriana en la comunidad, está constituida por la transferencia de bacterias resistentes seleccionadas mediante la utilización de antimicrobianos en la industria pecuaria, con el objetivo de mejorar la ganancia económica de la producción. Este factor no está prohibido en Chile, a diferencia de las regulaciones que rigen a algunos países desarrollados.
Actitudes Médicas y Culturales Que Favorecen el uso Irracional de Antimicrobianos
| Uso de la prescripción médica como sedante para el propio médico y la familia. |
| Uso de antibióticos para evitar llamadas telefónicas y facilitar viajes de fin de semana. |
| Uso de antibióticos en cuadros respiratorios virales. |
| Uso indiscriminado de antibióticos en cuadros de diarrea aguda. |
| Uso indiscriminado de penicilina en consultas de urgencia por odinofagia y fiebre. |
| Profilaxis quirúrgica indiscriminada. |
| Presión maternal por lograr algún tratamiento antibiótico para los hijos. |
| Falta de capacitación y/o desconocimiento del tema en el cuerpo médico. |
| Promoción y presión farmacéutica. |
| Ausencia histórica de regulaciones en la venta libre de antimicrobianos*. |
| Utilización de antimicrobianos para mejorar el crecimiento del ganado o de la producción avícola. |
| Comisiones que estimulan la venta de antimicrobianos en farmacias. |
La resistencia antimicrobiana puede ser explicada por numerosos mecanismos (tabla 3). Los mecanismos de resistencia más caracterizados y además prevalentes en bacterias Gram positivas y negativas, corresponden a sistemas enzimáticos de degradación o a modificaciones estructurales de la pared celular o de los sitios blanco en el citoplasma o DNA. Para los antibióticos más utilizados (beta-lactámicos), la resistencia en bacilos Gram negativos es predominantemente enzimática y en cocáceas Gram positivas, predominantemente de tipo estructural.
Mecanismos Generales de Resistencia Antibiótica en Bacterias
| MODIFICACIÓN ENZIMÁTICA DEL ANTIBIÓTICO |
|
| CAMBIOS EN LA PERMEABILIDAD A ANTIBIÓTICOS POR MUTACIONES EN PORINAS |
|
| MODIFICACIONES EN EL SITIO DE ATAQUE DEL ANTIBIÓTICO |
|
| MECANISMOS DE EFLUJO |
|
| TRANSPORTE INEFECTIVO |
|
Característicamente la resistencia a los compuestos beta-lactámicos y aminoglicósidos es explicada fundamentalmente por mecanismos enzimáticos que facilitan la degradación de estos antibióticos, denominados beta-lactamasas y enzimas modificantes, respectivamente.
Beta-lactamasasLas beta-lactamasas constituyen un amplio grupo de enzimas que tienen la capacidad de hidrolizar uno o más compuestos beta-lactámicos.
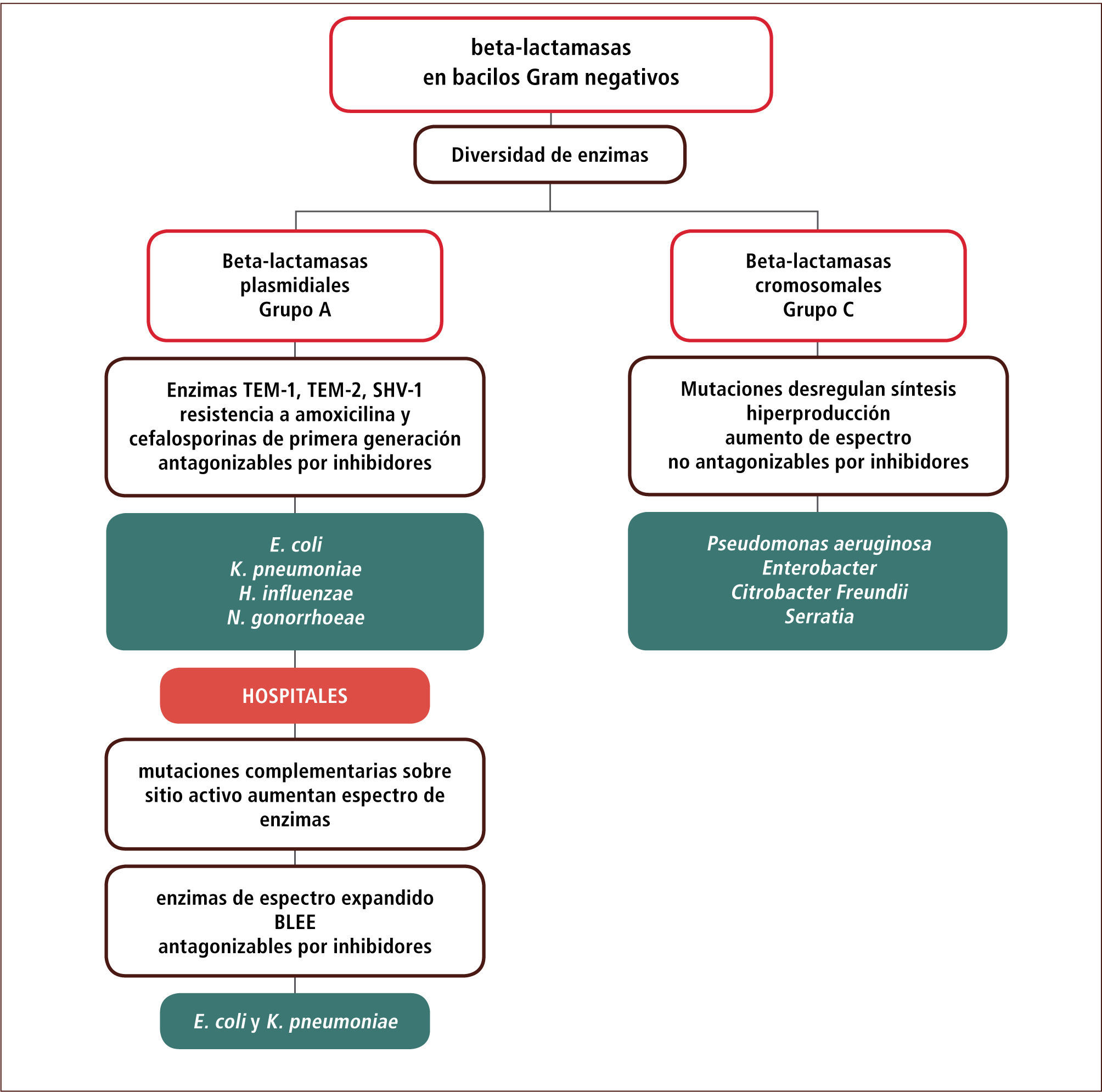
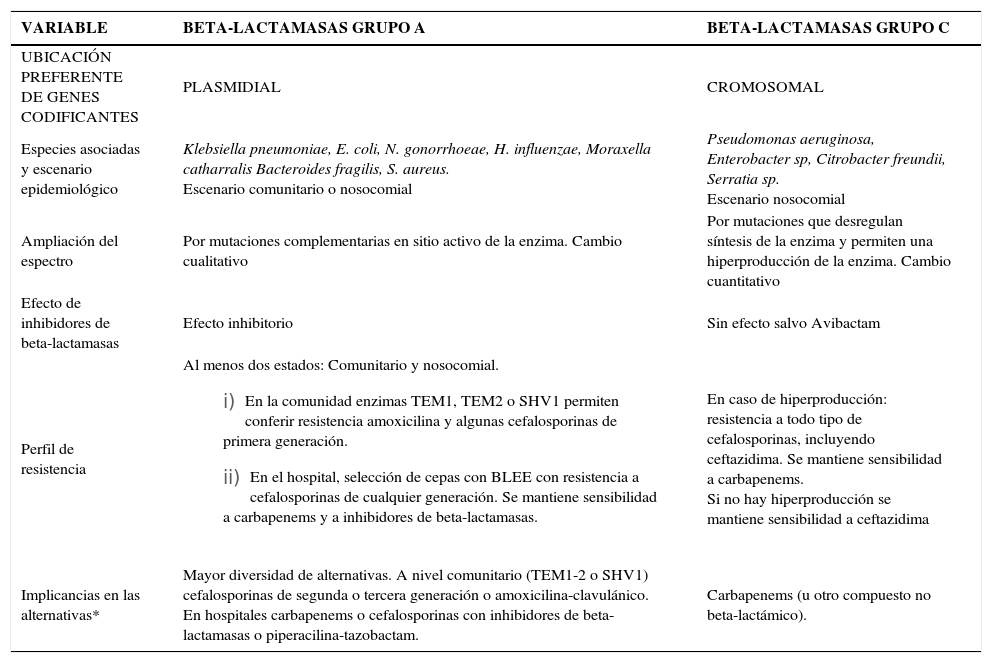
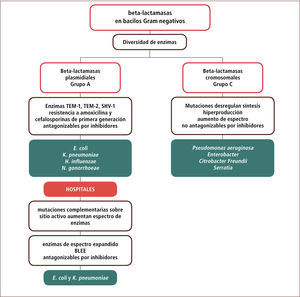
Numerosos estudios han permitido agrupar las beta-lactamasas en cuatro grupos moleculares (A-D). Dos de estos grupos (C y A) son prevalentes e importantes en bacilos Gram negativos comunitarios o nosocomiales y serán revisados con mayor detalle en este artículo. En general estos grupos difieren en la ubicación de sus genes (cromosomal versus plasmidial), en la forma en que se logra un mayor espectro antimicrobiano (por mutaciones que llevan a una mayor síntesis versus mutaciones en el sitio activo); en la posibilidad de inhibir su actividad por inhibidores de beta-lactamasas; y en las especies asociadas (tabla 4).
Algunas Diferencias Relevantes Entre Beta-Lactamasas de los Grupos A y C
| VARIABLE | BETA-LACTAMASAS GRUPO A | BETA-LACTAMASAS GRUPO C |
|---|---|---|
| UBICACIÓN PREFERENTE DE GENES CODIFICANTES | PLASMIDIAL | CROMOSOMAL |
| Especies asociadas y escenario epidemiológico | Klebsiella pneumoniae, E. coli, N. gonorrhoeae, H. influenzae, Moraxella catharralis Bacteroides fragilis, S. aureus. Escenario comunitario o nosocomial | Pseudomonas aeruginosa, Enterobacter sp, Citrobacter freundii, Serratia sp. Escenario nosocomial |
| Ampliación del espectro | Por mutaciones complementarias en sitio activo de la enzima. Cambio cualitativo | Por mutaciones que desregulan síntesis de la enzima y permiten una hiperproducción de la enzima. Cambio cuantitativo |
| Efecto de inhibidores de beta-lactamasas | Efecto inhibitorio | Sin efecto salvo Avibactam |
| Perfil de resistencia | Al menos dos estados: Comunitario y nosocomial.
| En caso de hiperproducción: resistencia a todo tipo de cefalosporinas, incluyendo ceftazidima. Se mantiene sensibilidad a carbapenems. Si no hay hiperproducción se mantiene sensibilidad a ceftazidima |
| Implicancias en las alternativas* | Mayor diversidad de alternativas. A nivel comunitario (TEM1-2 o SHV1) cefalosporinas de segunda o tercera generación o amoxicilina-clavulánico. En hospitales carbapenems o cefalosporinas con inhibidores de beta-lactamasas o piperacilina-tazobactam. | Carbapenems (u otro compuesto no beta-lactámico). |
Las beta-lactamasas del grupo A se asocian típicamente a E. coli, Klebsiella pneumoniae, Haemophilys influenzae, Moraxella catharralis y Neisseria gonorrhoeae y generalmente sus genes residen en plasmidios (excepto en K.pneumoniae) (tabla 4). El incremento en el espectro sobre los compuestos beta-lactámicos no ocurre en este caso por razones estequiométricas (mayor cantidad de enzima), sino que por mutaciones adicionales sobre el sitio activo de la enzima, que mejoran la actividad de la enzima y y no su cantidad. Al menos dos grandes líneas evolutivas o filogenéticas de estas enzimas se han descrito y ellas corresponden a las enzimas de los grupos TEM y SHV.
Las cepas comunitarias de estas especies que poseen estas enzimas presentan resistencia a ampicilina-amoxicilina y algunas cefalosporinas de primera generación. Portan en general las enzimas denominadas TEM1, TEM2 o SHV1. Las cefalosporinas de segunda o tercera generación son estables a estas enzimas y estos compuestos pueden por lo tanto, ser utilizados como alternativa de tratamiento. Las combinaciones de amoxicilina con inhibidores de beta-lactamasas permiten recuperar el espectro de actividad por el efecto de estos compuestos sobre la enzima (tabla 4). La capacidad de revertir la resistencia con inhibidores es una característica distintiva con las enzimas del grupo C (tabla 4).
Para bacilos Gram negativos entéricos, la resistencia a beta-lactámicos en la comunidad está asociada a beta-lactamasas del grupo A y su espectro es limitado. Su actividad permite resistencia ante ampicilina-amoxicilina y cefalosporinas de primera generación. La capacidad de estas enzimas de ser inhibidas por moléculas específicas permite que se incluyan dentro de las alternativas terapéuticas compuestos con estos inhibidores. Son opciones útiles también, las cefalosporinas de segunda o tercera generación y compuestos de otras familias de antimicrobianos. A pesar del espectro limitado de estas enzimas, éstas tienen un claro impacto económico sobre el tratamiento debido al mayor costo de las alternativas.
La presión selectiva en los hospitales ha permitido la generación de líneas evolutivas de estas enzimas hacia variantes de mayor espectro con mutaciones adicionales en el sitio activo. Conocidas en general como beta-lactamasas de espectro extendido (BLEE), permiten la aparición de resistencia a cefalosporinas de segunda y tercera generación. En términos prácticos, esta condición se reconoce por la resistencia a ceftazidima o ceftriaxona en el antibiograma. En general estas variantes siguen siendo sensibles al efecto inhibitorio de sulbactam, tazobactam o del ácido clavulánico, aunque en ocasiones, ya sea por razones de menor permeabilidad a través de la membrana externa, por una mayor cantidad relativa de enzima producida o por el tipo de enzima (SHV más difíciles de inhibir), puede que ello no ocurra. Desde el punto de vista terapéutico, la presencia de estas enzimas implica un aumento del costo de tratamiento en ciertas infecciones debido al salto obligado hacia combinaciones de cefalosporinas con inhibidores de beta-lactamasas, piperacilina-tazobactam o hacia carbapenems (en ausencia de otras alternativas) (tabla 4 y figura 1).
Enzimas grupo CLas beta-lactamasas del grupo C son normalmente inducibles por diferentes beta-lactámicos (ampicilina, amoxicilina y algunas cefalosporinas) lo que permite la aparición de resistencia hacia estos compuestos. La exposición de la cepa con el antimicrobiano en el medio permite sintetizar la enzima y expresar resistencia a pesar de que la cepa aparece inicialmente susceptible a estos compuestos, favoreciendo el fracaso de la terapia. Mutaciones en genes regulatorios de esta enzima permiten una desrepresión y la síntesis en ausencia de inducción (típicamente en hospitales) con la aparición de cepas hiperproductoras en las especies portadoras de estas enzimas (tabla 4). Las cantidades sintetizadas permiten una resistencia ante cefalosporinas de cualquier generación y estas cepas sólo permanecen susceptibles a carbapenems. Las especies característicamente asociadas a este patrón corresponden a P. aeruginosa, Enterobacter sp, Citrobacter freundii y Serratia sp.
El fenómeno de hiperproducción se puede reconocer fácilmente porque el aislado aparece resistente a cefalosporinas de tercera generación en el antibiograma. Según la cantidad de enzima presente, el aislado puede ser susceptible o resistente a cefepime, un compuesto con cierta estabilidad a las enzimas del grupo AmpC. Las combinaciones con inhibidores no son efectivas, salvo para el nuevo inhibidor avibactam (NXL 104, ver más adelante). Desde el punto de vista terapéutico, la presencia de cepas hiperproductoras de beta-lactamasas condena rápidamente a los hospitales al uso de carbapenems, compuestos de alto valor intrínseco, sin la posibilidad de alternativas intermedias, exceptuando el uso de otras familias de antimicrobianos si es que el antibiograma lo permite.
Importancia de la resistencia a ceftazidima/cefotaxima en la identificación de los mecanismos de resistencia ante Beta-lactámicosTanto la hiperproducción de beta-lactamasas de tipo AmpC (cromosomales) como la presencia de BLEE en especies portadoras de enzimas del grupo A, determinarán la presencia fenotípica de resistencia a ceftriaxona o ceftazidima. Por lo tanto, el análisis de la susceptibilidad o resistencia a estas cefalosporinas es pivotal en la lectura del antibiograma y en la identificación de los mecanismos de resistencia. En otras palabras, la susceptibilidad a estos compuestos implica que aún no existe hiperproducción de beta-lactamasas cromosomales o que las beta-lactamasas plasmidiales no son de espectro expandido.
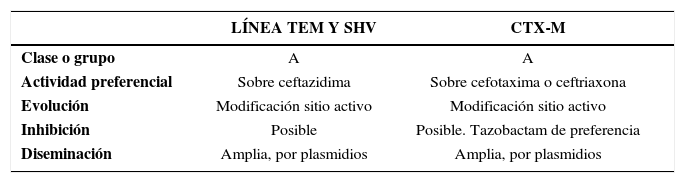
Otras Beta-lactamasas de espectro extendidoEn el ambiente bacteriano existen otras BLEE que no vienen de una línea evolutiva TEM o SHV sino que han emergido en forma natural en algunos géneros bacterianos como Kluvyera y han sido traspasadas a otras especies y también han tenido una evolución posterior. Todas ellas pertenecen a la clase A, al igual que las otras BLEE ya comentadas, pero tienen una terminología diferente. Entre ellas se encuentran las CTX-M, PER, VEB, GER, BES, TLA, SFO y BEL. Las más diversas son las del grupo CTX y GES con numerosos representantes. El grupo CTX-M se divide en cinco subfamilias y dentro de ellas se ha registrado una enorme diversificación por microevolución con optimización del sitio activo. Estas subfamilias corresponden a CTX-M1, CTX-M2, CTX-M8, CTX-M9 y CTX-M25, algunas de ellas identificadas en Chile. La extensa diseminación en varias partes del mundo es una propiedad de estas enzimas, la que ocurre tanto a nivel nosocomial como comunitario. Una característica central de las enzimas de la línea CTX-M es su actividad sobre cefotaxima o ceftriaxona con mínima actividad sobre ceftazidima, estableciendo un contrapunto con las BLEE asociadas a TEM y SHV que se caracterizan por el perfil opuesto (tabla 5).
Características de Diferentes Tipos de Beta-Lactamasas de Espectro Extendido (BLEE)
| LÍNEA TEM Y SHV | CTX-M | |
|---|---|---|
| Clase o grupo | A | A |
| Actividad preferencial | Sobre ceftazidima | Sobre cefotaxima o ceftriaxona |
| Evolución | Modificación sitio activo | Modificación sitio activo |
| Inhibición | Posible | Posible. Tazobactam de preferencia |
| Diseminación | Amplia, por plasmidios | Amplia, por plasmidios |
In vitro. Las enzimas del grupo A pueden ser inhibidas especialmente por ácido clavulánico. Aunque esta inhibición puede ser traspasada a la arena clínica en el caso de enzimas sencillas que no son del tipo BLEE, las combinaciones con este compuesto tienen una capacidad clínica ocasional para poder eficientemente tener un efecto terapéutico sobre las enzimas BLEE. Las razones de esta paradoja residen en que las BLEE hidrolizan óptimamente a la amoxicilina y el efecto del ácido clavulánico se pierde en este contexto. Este fenómeno es especialmente importante en las enzimas tipo SHV que se asocian a K. pneumoniae más que a E. coli y por ello, los inhibidores tienen menor actividad en esta especie. La combinación de amoxicilina con ácido clavulánico tiene actividad sobre la mayor parte de las cepas productoras de BLEE en orina (>90%) debido a las mayores concentraciones locales de estos compuestos que superan los valores CIM requeridos (<32+16μg/mL para amoxicilina y clavulánico, respectivamente). En contraste, la capacidad de inhibición sobre aislados de infecciones sistémicas no supera el 20% ya que las concentraciones en plasma no permiten llegar a los niveles de CIM que requieren estas cepas (>16+8μg/mL). Por razones de mercado (patentes que involucran diferentes compañías) no se dispone de combinaciones ideales tales como ceftazidima o cefotaxima con clavulánico o incluso de cefepime con clavulánico. Teóricamente, estos tres compuestos en combinación con ácido clavulánico podrían administrarse tres veces al día.
Nuevos problemasRecientemente se han descrito enzimas tipo AmpC en K. pneumoniae, lo que rompe las asociaciones tradicionales vigentes por muchos años. Debe sospecharse cuando una cepa resistente a ceftazidima no es inhibida en el laboratorio por clavulánico.
CarbapenemasasEstas enzimas son infrecuentes en las cepas hospitalarias y tienen la habilidad de permitir la degradación de todos los compuestos beta-lactámicos, incluyendo los carbapenémicos, que se comportan en forma estable ante las beta-lactamasas comunes. Las carbapenemasas pertenecen al grupo molecular B (metalo βeta-lactamasas) y también hay algunas pertenecientes al grupo A.
– Carbapenemasas grupo B (métalo βeta-lactamasas). Estas enzimas no pueden ser antagonizadas por sulbactam, tazobactam o ácido clavulánico. Aztreonam es el único compuesto relacionado que mantiene actividad contra cepas portadoras de esta enzima. Las enzimas del grupo B pueden ser encontradas habitualmente en la especie Stenotrophomona maltophilia donde es codificada a nivel cromosomal y en forma constitutiva (tabla 6). Este tipo de enzimas se han detectado ocasionalmente en plasmidios de cepas de P. aeruginosa, S. marcescens y K. pneumoniae y puede ser detectado fenotípicamente mediante la adición de EDTA al medio de cultivo, compuesto que permite la quelación de zinc, un cofactor importante en su funcionamiento. Algunas denominaciones conocidas son VIM, IMP y GIM.
Resistencia a Carbapenémicos
| MECANISMO | CARBAPENEMASA | CARBAPENEMASA | MUTACIÓN PORINA+HIPERPRODUCCIÓN AMPC |
|---|---|---|---|
| Grupo o Clase | Grupo o clase B | Grupo o clase A | |
| Denominación | Metalo beta-lactamasas | KPC | |
| Especies asociadas | S. maltophilia (100%), P. aeruginosa (VIM, <20%) otras especies | K. pneumoniae | P. aeruginosa |
| Espectro | Todos los beta-lactámicos | Todos los beta-lactámicos | Todos los beta-lactámicos |
– Carbapenemasas grupo A. Suceden ocasionalmente, han sido descritas en K. pneumoniae y denominadas por ello KPC. Aparecieron en Chile el año 2012. Otros exponentes conocidos son las enzimas IMI, NMC y SME (tabla 6). Pueden ser inhibidas por avibactam.
Resistencia a compuestos carbapenémicos en P. aeruginosaA pesar de que las carbapenemasas pueden explicar la resistencia a este tipo de compuestos, la resistencia observada a ellos (meropenem o imipenem), es generalmente ocasionada por otro mecanismo y no por una enzima del grupo B.
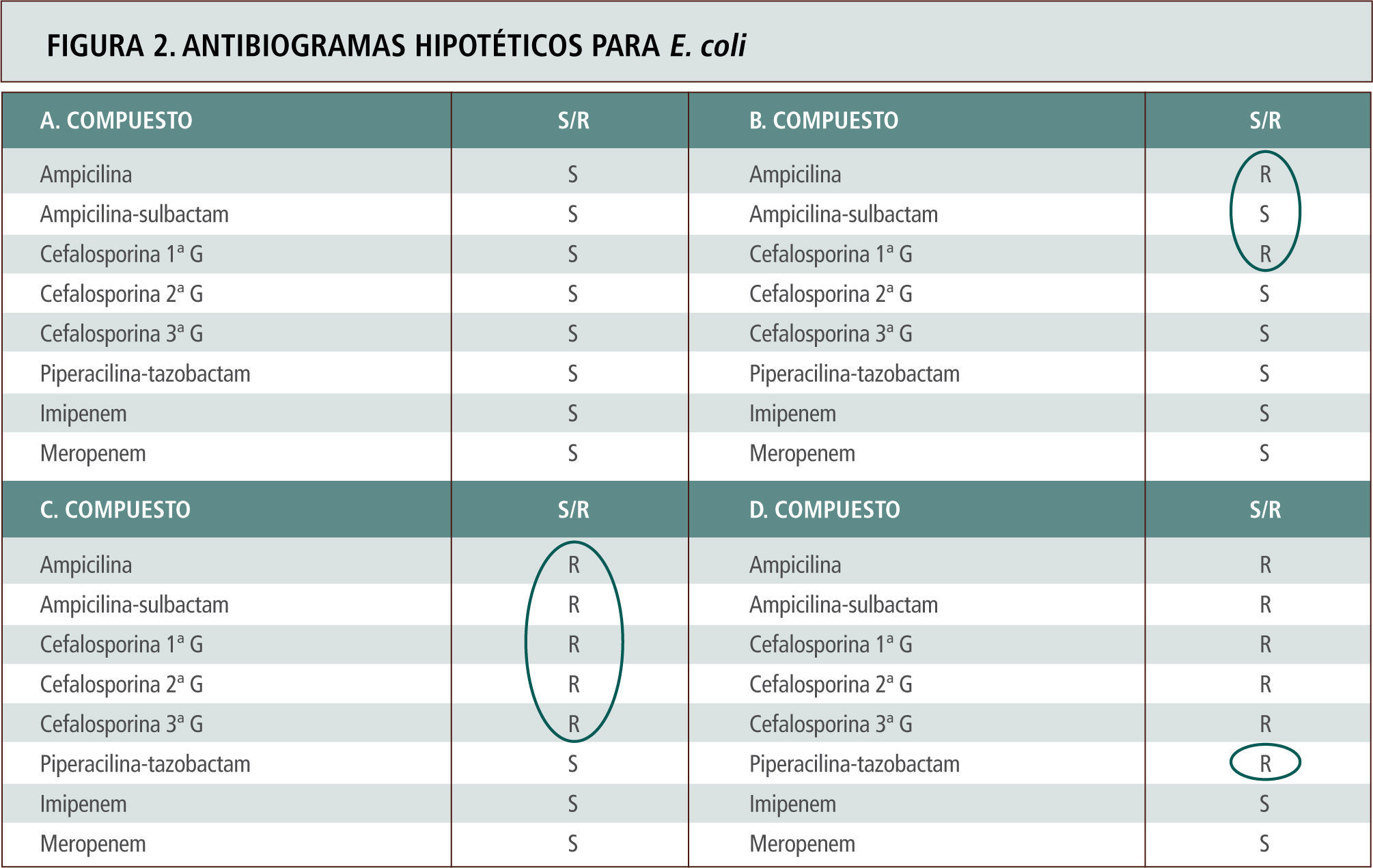
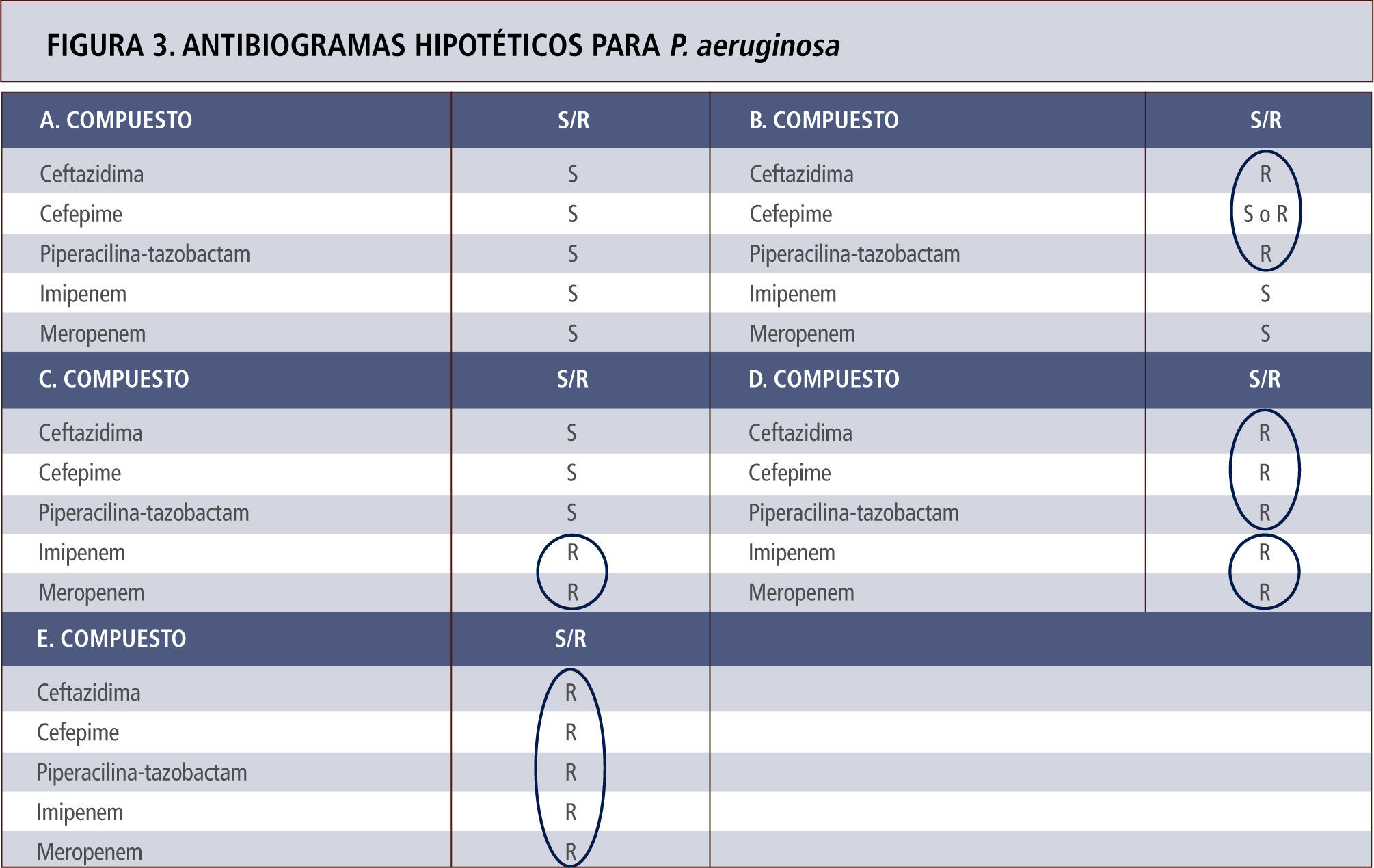
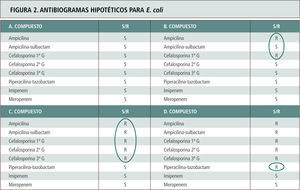
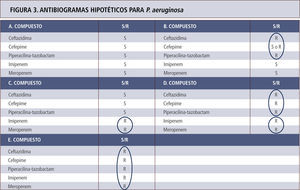
El mecanismo más frecuente tras la resistencia a carbapenémicos nosocomiales es la mutación de una porina específica en la pared celular de P. aeruginosa. En estos casos, la resistencia queda sólo restringida a los carbapenémicos, pero no incluye otros beta-lactámicos. Estos mismos aislamientos suelen ser también resistentes a cefalosporinas mediante hiperproducción de la enzima AmpC lo que genera resistencia a cefalosporinas (hiperproducción) junto a resistencia a carbapenémicos (mutación porina). Aproximadamente en no más de un 20%, la resistencia a todos los beta-lactámicos y carbapenémicos es explicada por la existencia de carbapenemasas tipo VIM (<20%) (tabla 6). En las figuras 2 y 3 se representan ejemplos de antibiogramas asociados a diferentes mecanismos de resistencia para beta-lactámicos.
Antibiogramas hipotéticos para E. coli con diferentes mecanismos de resistencia para beta-lactámicos, cuyo espectro se explica por el circulo respectivo. A. Cepa de E. coli no portadora de beta-lactamasas. B. Cepa portadora de beta-lactamasas tipo TEM 1 o SHV 1 de espectro limitado. C. Cepa portadora de BLEE. Tómese nota que la susceptibilidad ante inhibidores de beta-lactamasas como en el caso de piperacilina-tazobactam no siempre ocurre debido a que las enzimas BLEE derivadas de la línea SHV son más difíciles de inhibir, o hay una mayor copia de plasmidios con mayor cantidad relativa de enzima o existen alteraciones de permeabilidad asociadas (Caso D).
Antibiogramas hipotéticos para P. aeruginosa con diferentes mecanismos de resistencia para beta-lactámicos, cuyo espectro se explica por el circulo respectivo. A. Cepa portadora enzima AmpC en estado basal sin hiperproducción. B. Cepa hiperproductora de la enzima AmpC. Según el nivel de enzima puede haber susceptibilidad o resistencia a cefepime. C. Cepa con mutación de porina sin hiperproducción de enzima AmpC. D. Cepa con mutación de porina e hiperproducción de AmpC. E. Cepa portadora de carbapenemasa. Los antibiogramas de los casos D y E son indistinguibles. Tómese nota que tazobactam no actúa sobre AmpC y que el efecto sobre P. aeruginosa depende exclusivamente de piperacilina.
Recientemente se ha descrito el inhibidor NXL104 conocido también como avibactam, que inhibe enzimas del tipo A, AmpC e incluso carbapenemesas del grupo A. No es activo contra metalocarbapenemesas (grupo B). Ofrece grandes ventajas terapéuticas y se ofrece en conjunto con una cefalosporina de 5a G.
El problema en Acinetobacter baumanniiTodas las clases moleculares han sido descritas en esta especie aunque no con la misma prevalencia. La mayor parte de las cepas de A. baumannii tiene la enzima AMPc y la sintetiza en forma inducible o desreprimida y se han descrito cepas con BLEE y enzimas del grupo B. En la resistencia a compuestos beta-lactámicos participan también alteraciones en la permeabilidad. El análisis fenotípico del antibiograma no es fácil en esta especie para predecir los mecanismos más importantes. Sulbactam tienen un efecto inhibitorio intrínseco y por ello, compuestos combinados muestran actividad (cefoperazona-sulbactam o ampicilina-sulbactam).
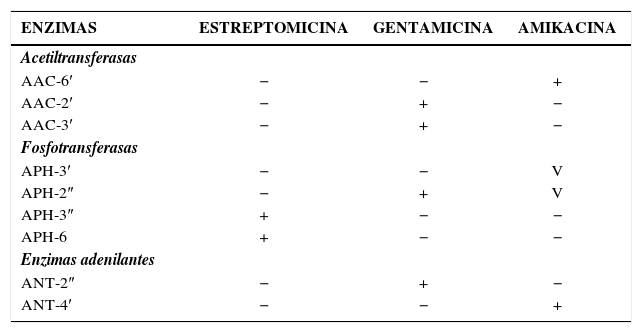
AminoglucósidosAl igual que la resistencia ante beta-lactámicos, la resistencia a aminoglucósidos es mediada en bacilos Gram negativos generalmente por mecanismos enzimáticos. Diversas enzimas de este tipo han sido descritas, las que difieren en la modificación química realizada sobre el aminoglucósido (adenilación, fosforilación o acetilación) (tabla 7).
Variantes de Enzimas Modificantes de Aminoglucósidos y Su Espectro de Acción
| ENZIMAS | ESTREPTOMICINA | GENTAMICINA | AMIKACINA |
|---|---|---|---|
| Acetiltransferasas | |||
| AAC-6′ | − | − | + |
| AAC-2′ | − | + | − |
| AAC-3′ | − | + | − |
| Fosfotransferasas | |||
| APH-3′ | − | − | V |
| APH-2″ | − | + | V |
| APH-3″ | + | − | − |
| APH-6 | + | − | − |
| Enzimas adenilantes | |||
| ANT-2″ | − | + | − |
| ANT-4′ | − | − | + |
V: variable, no presente en todas las isoformas
El espectro de acción de estas enzimas es más bien limitado y específico. Varias de estas enzimas pueden inactivar gentamicina pero sólo unas pocas son activas contra amikacina. La especificidad de su espectro de acción explica por qué la resistencia a estos compuestos no se da en forma cruzada. De la misma manera, la multiresistencia ante aminoglucósidos obedece habitualmente a la presencia de enzimas con diferentes mecanismos de acción en forma simultánea (tabla 7).
En la tabla 7 se puede observar que la resistencia simultánea a estreptomicina, gentamicina y amikacina sólo puede ser explicada por el concurso simultáneo de diferentes tipos de enzimas. La suma de diferentes genes permite la expansión del espectro de resistencia ante los aminoglucósidos, lo que contrasta con el modelo de las beta-lactamasas, donde el aumento de espectro se da por cantidad o por cambios evolutivos en el sitio activo de la enzima.
La resistencia ante amikacina es infrecuente en comparación a los otros compuestos de esta familia debido a que existen pocas enzimas activas contra ella (tabla 7). La resistencia mediada por mutaciones ribosomales es infrecuente en aislamientos clínicos, excepto en la resistencia a estreptomicina observada en M. Tuberculosis.
QuinolonasLa resistencia a quinolonas es ocasionada por mutaciones en las subunidades de la DNA girasa (subunidades A o B). La resistencia a ciprofloxacino genera resistencia cruzada a otras fluoroquinolonas. La resistencia por mutaciones de la DNA girasa es cromosomal y no transferible. Sin embargo, recientemente se han descrito 3 mecanismos de resistencia residente en plasmidios: proteínas de resistencia a quinolonas (Qnr) que protegen a la DNA girasa; la enzima modificante de aminoglucósidos Aac(6′)-lb-cr que confiere también resistencia cruzada a quinolonas (bifuncional); y finalmente un sistema de eflujo (QepA efflux). Por ahora la frecuencia de estos mecanismos es muy baja.
Sulfonamidas y cloranfenicolEstos compuestos inhiben competitivamente la incorporación del ácido para-aminobenzoico en el ácido tetrahidropteroico, un precursor del ácido fólico, mediante la interferencia de la enzima involucrada (dihidropteroato sintetasa). La resistencia a sulfonamidas es producida ya sea por a) un aumento de la síntesis del ácido para-aminobenzoico; b) mutaciones en la dihidropteroato sintetasa o; c) la existencia de enzimas alternativas codificadas en plasmidios que hacen inefectiva la acción de las sulfonamidas. La resistencia a las sulfonamidas es de tipo cruzada. El compuesto trimetoprim actúa en la etapa metabólica posterior al lugar de acción de las sulfonamidas inhibiendo la dihidrofolatoreductasa bacteriana. La resistencia a este compuesto puede ser cromosomal o plasmidial. En el primer caso por mutaciones en la enzima que hacen inefectiva la acción de trimetoprim o por hiperproducción de la misma enzima sin mutaciones. En el segundo caso por la expresión de enzimas alternativas codificadas en plasmidios, las que no son inhibidas por este compuesto.
La resistencia ante cloranfenicol es mediada generalmente por un mecanismo enzimático (acetilación). Se han descrito variantes de esta enzima y los genes respectivos pueden residir a nivel cromosomal o plasmidial.
Resistencia en bacterias anaerobiasCon excepción de Bacteroides fragilis que posee una beta-lactamasa cromosomal del grupo A expresada constitutivamente, las diferentes especies de anaerobios son en general sensibles a penicilina o amoxicilina. Las enzimas de esta especie actúan sobre penicilina, amoxicilina y cefalosporinas y son antagonizable por inhibidores de beta-lactamasas. La presencia de B. fragilis es habitual y característica en la microbiota de vísceras huecas debajo del diafragma y muy ocasional sobre él. Esta distribución determina que las infecciones por anaerobios sobre el diafragma sean sensibles a penicilina o amoxicilina y las que ocurren bajo esta membrana, sean potencialmente resistentes a estos compuestos por la presencia de B. fragilis. Los aislamientos son sensibles a combinaciones con inhibidores debido a que esta enzima pertenece al grupo A (tabla 8). Se debe recordar que numerosas especies de anaerobios bajo el diafragma son sensibles a penicilina (por ej. Clostridium perfringens) o a otros compuestos alternativos (clindamicina, metronidazol, cloranfenicol).
Resistencia en Anaerobios e Implicancias Terapéuticas en Infecciones Potenciales o Establecidas
| ASPECTO | SOBRE EL DIAFRAGMA | BAJO EL DIAFRAGMA |
|---|---|---|
| Presencia de B. fragilis | Muy infrecuente | Habitual |
| Resistencia a penicilinas | Infrecuente | Presente |
| Alternativas terapéuticas para su manejo (penicilina, cloranfenicol, metronidazol, clindamicina, cefalosporinas con inhibidores de beta-lactamasas, algunas quinolonas tigeciclina) | Todas aplicables* | Combinaciones de amoxicilina, ampicilina o piperacilina con inhibidores de beta-lactamasas u otras alternativas antianaeróbicas tradicionales |
No se dispone en Chile de cefalosporinas estables a las beta-lactamasas de microorganismos anaerobios tales como cefoxitina o cefotetan. En nuestro medio, la única forma de utilizar cefalosporinas sobre bacterias anaerobias es mediante la combinación con inhibidores de beta-lactamasas (por ej. Cefoperazona-sulbactam) alternativamente por otros beta-lactámicos con inhibidores (por ej. Piperacilina-tazobactam).
Resistencia en cocáceas Gram positivasA diferencia de los bacilos Gram negativos, la resistencia en este grupo está predominantemente asociada a cambios estructurales en la pared celular o en componentes citosólicos como los ribosomas y no a mecanismos enzimáticos. Los ejemplos más emblemáticos se señalan en la tabla 9 y ellos incluyen al neumococo, estaflococo y enterococo. Las estructuras involucradas en la resistencia de estos tres grupos no son las mismas. La acumulación de resistencia se ha dado para algunos de estos casos en etapas históricas bien definidas.
Especies Bacterianas de Cocáceas Gram Positivas y Mecanismos de Resistencia de Mayor Importancia Terapéutica
| GÉNERO/ESPECIE | MECANISMO |
|---|---|
| Streptococcus pneumoniae | Modificaciones en PBP mediante mosaicismo genético (adquisición de fragmentos desde otras especies en los genes respectivos). Modificaciones en 4 PBP (1a, 2x, 2a y 2b) para lograr resistencia de alto nivel a penicilina. Modificaciones en sólo 3 PBP para resistencia intermedia a penicilina. Cambios simultáneos en 2 PBP específicas (1a y 2x) para lograr resistencia a cefalosporinas, la que aparece en un sunconjunto de aislados ya resistentes a PNC. |
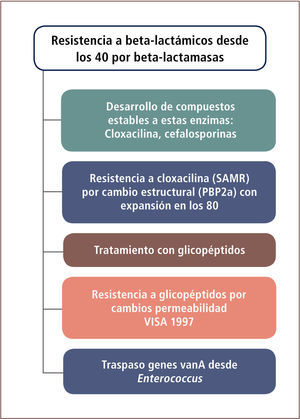
| Staphylococci Primera etapa: resistencia a Penicilina por mecanismo Enzimático (40′) | Pocos años después de la incorporación terapéutica de la penicilina se describe resistencia a este compuesto en esta especie mediada por beta-lactamasas. La cloxacilina permite obviar este problema por su estabilidad ante esta enzima. |
| Segunda etapa: resistencia a Cloxacilina (meticilina) en Hospitales (80′) por mecanismo Estructural | La resistencia a cloxacilina o meticilina (SAMR) es explicada por la expresión de una PBP alternativa denominada PBP2a, que impide el efecto de cloxacilina. Esta PBP es codificada en el cromosoma por un bacteriofago integrado al genoma de esta especie. La alternativa terapéutica es vancomicina que no actúa sobre ninguna PBP sino que sobre la cadena pentapeptídica del peptidoglicano. |
| Tercera etapa: aparición de Resistencia intermedia a glicopéptidos (estafilococo VISA), 1997 | Resistencia explicada probablemente por alteraciones en la permeabilidad que dificultan entrada de vancomicina |
| Cuarta etapa: aparición de resistencia a glicopéptidos | Resistencia explicada por adquisición de mecanismo Van A desde enterococo |
| Enterococcus Primera etapa: resistencia a beta-Lactámicos y/o aminoglucósidos en aislamientos nosocomiales | Especie normalmente tolerante a beta-lactámicos y aminoglucósidos (efecto bacteriostático pero no bactericida). Requiere combinación de ambos tipos de compuestos para lograr efecto bactericida (sinergia). La resistencia a beta-lactámicos por mecanismos enzimáticos (beta-lactamasas) y/o aminoglucósidos limita esta posibilidad. |
| Segunda etapa: aparición de Resistencia a vancomicina en aislamientos nosocomiales | Reemplazo de D-alanina-D-alanina en la cadena pentapeptídica del péptidoglicano por D-ala-D-lactato genera resistencia a vancomicina. |
La emergencia de la resistencia a penicilina (PNC) en esta especie, obedece principalmente al uso irracional de antibióticos en cuadros respiratorios virales. Es un fenómeno ahora frecuente en aislamientos obtenidos de pacientes pediátricos y menos relevante pero progresivo en aislamientos de pacientes adultos. La resistencia a la penicilina limita la eficacia terapéutica de este compuesto en casos de meningitis y en forma más discutible en otras infecciones fuera del sistema nervioso central.
La penicilina está contraindicada en caso de infecciones del SNC por neumococo con susceptibilidad intermedia o resistente a este compuesto. Sin embargo, ello es discutible en infecciones extrameníngeas en que la CIM para PNC se mantiene ≤ 4∼g/mL. Además la resistencia a PNC no determina una resistencia cruzada a amoxicilina.
La aparición de resistencia a PNC en aislados de neumococo se ha dado en forma escalonada, con aislamientos con resistencia intermedia y otros con alto nivel de resistencia, siendo predominantes los primeros. Esta resistencia no es explicada por mecanismos enzimáticos, sino por modificaciones en las proteínas ligantes de penicilina en la propia pared celular (denominadas PBP en la literatura anglosajona). Estas proteínas se han modificado en forma secundaria a fenómenos de transformación genética, lo que ha permitido la recombinación con genes foráneos y el reemplazo de fragmentos de los genes codificantes. Este reemplazo fragmentario y parcial (mosaicismo genético) altera las propiedades de la PBP y modifica la afinidad de la penicilina por ella. La resistencia en neumococos a PNC en adultos es infrecuente en Chile actualmente (<1%).
El resultado es la menor actividad de penicilina sobre la función de estas PBP y la aparición de resistencia. Sin embargo, varias PBP deben sufrir este cambio antes de que se exprese la resistencia intermedia o de alto nivel a penicilina (tabla 9). Se requieren 3 PBP alteradas para la aparición de resistencia intermedia a penicilina y cuatro para una resistencia de alto nivel. En Chile coexisten aislamientos resistentes que se han seleccionado en nuestra propia comunidad con aquellos que se han diseminado desde otras partes del globo.
Cuando estas modificaciones involucran a 2 PBP específicas, aparece resistencia a cefalosporinas (tabla 9), la que en la práctica es infrecuente y aparece sólo en un subconjunto de aislados que ya expresan resistencia a PNC. Por ello, para la mayor parte de los casos de neumococos resistentes a PNC en nuestro país, aún se mantiene la actividad antimicrobiana y aplicabilidad clínica de las cefalosporinas. La resistencia a penicilinas o cefalosporinas no confiere resistencia cruzada a vancomicina o teicoplanina (glicopéptidos), pues estos compuestos actúan por otro mecanismo en la pared celular de las cocáceas Gram positivas (ver más adelante).
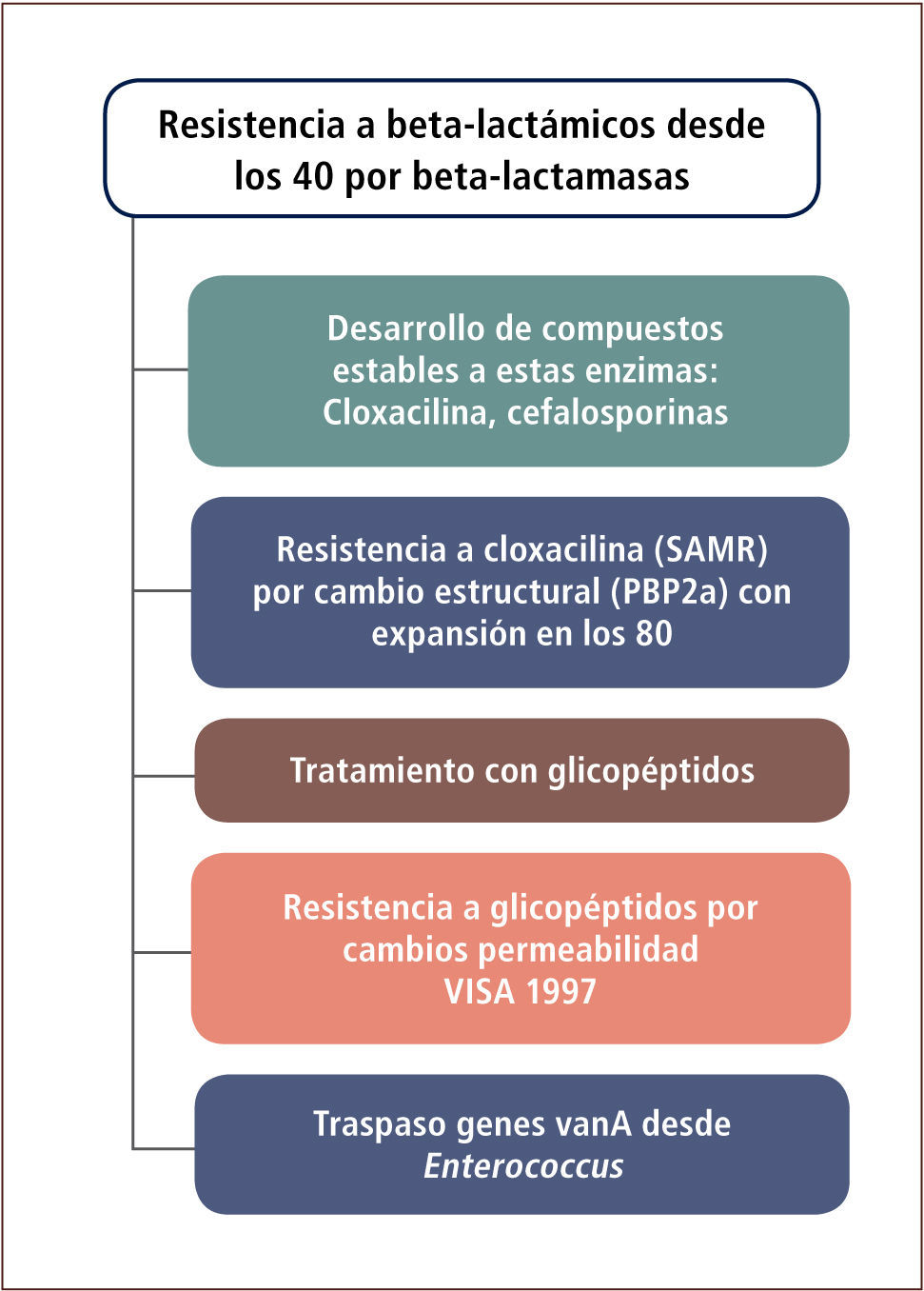
Resistencia a beta-lactámicos en Staphylococcus aureusLa resistencia a beta-lactámicos en esta especie se ha dado en forma escalonada. Inicialmente mediante un mecanismo enzimático y posteriormente por alteraciones estructurales (tabla 9 y figura 4).
La mayor parte de los aislamientos de S. aureus de la comunidad poseen beta-lactamasas que permiten su resistencia ante penicilina. Este mecanismo de resistencia fue detectado poco después de la masificación en el uso de este antibiótico en los años 40. Este fenómeno de resistencia fue contrarrestado médicamente mediante la utilización de compuestos estables a las enzimas de S. aureus, siendo la cloxacilina el más conocido de ellos. Algunas cefalosporinas de primera generación así como las de segunda o tercera generación son también estables a este tipo de enzimas. Estas enzimas son codificadas a nivel plasmidial y son antagonizables con combinaciones con inhibidores (por ejemplo amoxicilina-clavulánico) (tabla 10).
Algunos Aspectos Relevantes de las Beta-Lactamasas de S. aureus
|
Alternativas terapéuticas:
|
En una segunda etapa y asociado básicamente a aislamientos hospitalarios, aparecen cepas resistentes a cloxacilina (químicamente cercana a meticilina), denominadas también como S. aureus resistentes a meticilina (SAMR).
Este fenómeno se extiende desde los años 80 a nivel mundial. En esta oportunidad la resistencia es mediada por una nueva PBP con menor afinidad por la cloxacilina, lo que impide su efecto antimicrobiano. Esta PBP, denominada PBP2a o PBP2’ es codificada por un gen adquirido por transferencia genética horizontal desde otra especie. Los aislamientos SAMR poseen ambos mecanismos de resistencia, uno enzimático (beta-lactamasa) y otro estructural (PBP2a). Terapéuticamente, estos aislamientos pueden ser tratados con glicopéptidos (vancomicina o teicoplanina), los que actúan en un lugar diferente al sitio de acción de la cloxacilina, inhibiendo también la síntesis de péptidoglicano. Cerca de la mitad de los aislamientos nosocomiales de esta especie en Chile son resistentes a cloxacilina.
Aproximadamente un 10% de los aislados de SAMR son resistentes a cloxacilina por hiperproducción de beta-lactamasas del grupo A (activa contra PNC) y no por cambio de PBP. Estos aislados son susceptibles a amoxicilina-clavulánico pero no son detectados en los laboratorios en forma rutinaria.
Los glicopéptidos actúan impidiendo la formación de enlaces cruzados entre aminoácidos del péptidoglicano. Específicamente impiden la formación de enlaces covalentes cruzados entre dos moléculas de D-alanina ubicadas en cadenas paralelas de aminoácidos. Ello ocurre por la unión directa de vancomicina o teicoplanina en estos aminoácidos terminales impidiendo directamente la formación de los enlaces.
En una tercera y más reciente etapa (tabla 9 y figura 4), también bajo condiciones de presión selectiva, se han identificado aislamientos SAMR resistentes en grado moderado a los glicopéptidos. Este fenómeno fue descrito en 1997, especialmente en pacientes con insuficiencia renal crónica sometidos a terapias con vancomicina. Los aislamientos de S. aureus con resistencia intermedia a vancomicina o glicopéptidos (VISA o GISA), han sido descritos en diferentes países del mundo aunque todavía en forma muy ocasional. La resistencia parece ser explicada por una disminución de la permeabilidad a la vancomicina y no es de carácter plasmidial. La etapa más reciente está definida por la adquisición del mecanismo de resistencia Van A desde enterococo, tornando totalmente resistentes a los aislados de S. aureus. Estas cepas no han sido identificadas en Chile aún, pero sí en Brasil.
Resistencia en enterococoLos aislamientos comunitarios de enterococo son normalmente tolerantes a beta-lactámicos y aminoglucósidos, es decir, estos compuestos pueden lograr un efecto bacteriostático por separado pero no bactericida a las concentraciones farmacológicas habituales. La combinación de ambos compuestos permite un efecto bactericida. Este efecto sinérgico es fundamental en infecciones sistémicas graves.
Las presiones selectivas propias de los ambientes hospitalarios han permitido la selección de cepas resistentes a beta-lactámicos y/o aminoglucósidos, lo que impide un efecto sinérgico y bactericida. Los mecanismos de resistencia a beta-lactámicos difieren entre las dos especies clínicamente importantes de este género: E. faecalis o E. faecium. En el primer caso, la resistencia está mediada por beta-lactamasas y en el segundo por hiperexpresión de una PBP constitutiva (PBP5), los que limitan el efecto de este tipo de compuestos. La resistencia a aminoglucósidos está asociada a enzimas modificantes.
La resistencia a beta-lactámicos puede ser manejada alternativamente con glicopéptidos y de esta manera recuperar el efecto bactericida siempre y cuando no exista resistencia simultánea a aminoglucósidos. En una etapa posterior y también en el escenario selectivo de los hospitales, aparecen cepas resistentes a vancomicina y/o teicoplanina. Estos aislamientos se denominan enterococos resistentes a vancomicina (ERV). La resistencia a estos antimicrobianos reside en el reemplazo de D-alanina por D-lactato en las cadenas pentapeptídicas del péptidoglicano. Este reemplazo impide la unión de vancomicina (o teicoplanina) a este lugar, genera resistencia a este compuesto y es codificado por genes adquiridos. Las alternativas terapéuticas son escasas debido a la multiresistencia de estos enterococos. En Chile se han descrito infecciones por este tipo de agente y existe un programa nacional para contener su diseminación.
Conclusiones- •
La resistencia antimicrobiana es un fenómeno progresivo presente en muchas especies bacterianas.
- •
El uso irracional de antimicrobianos ha promovido la selección de bacterias resistentes y su presencia ubicua.
- •
La resistencia antimicrobiana ha complicado las alternativas terapéuticas y ha encarecido los costos de tratamiento tanto a nivel comunitario como nosocomial.
- •
Los mecanismos que participan en la resistencia a beta-lactámicos son predominantemente enzimáticos o estructurales, predominando los primeros en bacilos Gram negativos y los segundos en cocáceas Gram positivas.
- •
Los mecanismos enzimáticos habitualmente involucran beta-lactamasas y enzimas modificantes de aminoglucósidos. Los mecanismos estructurales generalmente incluyen modificaciones o aparición de nuevas proteínas ligantes de penicilina, reemplazos de algunos aminoácidos en la cadena del peptidoglicano o mutaciones en porinas.
- •
Una diversidad de beta-lactamasas ha sido seleccionada y ellas se agrupan en cuatro grandes grupos moleculares. Dos de ellos tienen importancia cotidiana y difieren en una serie de características funcionales de importancia terapéutica.
- •
En general las beta-lactamasas de agentes bacterianos presentes en la comunidad son de espectro reducido. En contraste, repetidos procesos de selección genética sobre beta-lactamasas nosocomiales han permitido ampliar su espectro de resistencia. Este mayor espectro obedece a una plasticidad funcional o cuantitativa de estas enzimas.
- •
La resistencia mediada por enzimas modificantes de aminoglucósidos es originada por genes de espectro reducido. La ampliación del espectro de resistencia se debe habitualmente a la suma de diferentes genes.
- •
La resistencia en cocáceas Gram positivas se ha manifestado en forma escalonada a lo largo de varias décadas, con la aparición de nuevos mecanismos de resistencia para cada una de las estrategias terapéuticas aplicadas.
- •
Hasta ahora las bacterias comunes han presentado una reserva inagotable de estrategias defensivas ante numerosos antimicrobianos.
Conflicto de interés. El autor ha efectuado conferencias sobre antimicrobianos con pago de honorarios para Laboratorios Saval.