La enfermedad renal crónica (ERC) es un grave problema de salud pública. Se espera que el número de personas con insuficiencia renal que reciben tratamiento con diálisis y trasplante aumente dramáticamente en los próximos años. Los malos resultados de la ERC no se limitan a la insuficiencia renal terminal, sino que también incluyen a las complicaciones derivadas de una menor función renal, como hipertensión arterial, anemia, desnutrición, trastornos óseos y minerales, neuropatía, así como un mayor riesgo de enfermedad cardiovascular. El diagnóstico precoz basado en la presencia de proteinuria o una velocidad de filtración glomerular estimada reducida, puede permitir la intervención temprana para reducir: el riesgo de insuficiencia renal progresiva, los eventos cardiovasculares y la mortalidad que se asocian con la ERC. Las estrategias eficaces para frenar la progresión de la ERC y reducir el riesgo cardiovascular están disponibles en la actualidad. Los modelos clínicos de atención que faciliten la entrega de los aspectos diversos y complejos del tratamiento en forma simultánea, podrían mejorar la gestión y probablemente los resultados clínicos.
Chronic kidney disease (CKD) is a serious public health problem. The number of persons with kidney failure who are treated with dialysis and transplantation is expected to rise dramatically in the coming years. The poor outcomes of CKD are not restricted to kidney failure but also include the complications of decreased kidney function, such as hypertension, anemia, malnutrition, bone and mineral disorders and neuropathy, as well as increased risk of cardiovascular disease. Early diagnosis on the basis of presence of proteinuria or reduced estimated glomerular filtration rate could permit early intervention to reduce the risk of: kidney failure, cardiovascular events and death that are associated with CKD. Effective strategies are available to slow the progression of CKD and reduce cardiovascular risk. Clinical models of care that facilitate delivery of the many complex aspects of treatment simultaneously could enhance management and probably the clinical outcomes.
La ERC es una condición clínica cada vez más frecuente, que está asociada a riesgo de falla renal, enfermedad cardiovascular y otras complicaciones serias. Actualmente representa un problema de salud pública global por su carácter epidémico, alto costo y elevada morbi-mortalidad. Se requieren estrategias de detección precoz para poder prevenir su desarrollo y complicaciones futuras. La nueva definición de ERC y su clasificación en estadios según velocidad de filtración glomerular (VFG) facilita su pesquisa y manejo. Las estrategias de pesquisa se basan en la medición de la presión arterial, detección de albuminuria y estimación de la VFG mediante fórmulas basadas en la creatinina plasmática. Los grupos de mayor riesgo son los pacientes con diabetes mellitus, hipertensión arterial o historia familiar de nefropatía. El manejo terapéutico apunta al control de la presión arterial, especialmente mediante el bloqueo del sistema renina-angiotensina-aldosterona. En diabéticos es vital lograr un control glicémico óptimo. No debe olvidarse el control de los factores de riesgo cardiovascular, principal causa de morbi-mortalidad de esta población. A continuación revisaremos aspectos generales de ERC, estrategias de detección precoz y conductas terapéuticas preventivas.
Definición y clasificaciónDefiniciónEn la nomenclatura nefrológica actual el término insuficiencia renal crónica ha sido reemplazado por el de enfermedad renal crónica (ERC). Esta se define por una reducción mantenida, más de 3 meses, de la VFG por debajo de 60ml/min/1.73m2 o por evidencias de daño renal estructural o funcional (1). Este daño renal puede evidenciarse en exámenes de orina (ej. albuminuria), radiológicos (ej. enfermedad poliquística) o histológicos (ej. fibrosis intersticial en la biopsia renal). Es así que podemos hacer el diagnóstico de ERC con una VFG considerada normal (> 60ml/min), si el individuo tiene daño renal estructural (imágenes) y/o funcional (albuminuria). Este componente dual de la definición nos permite detectar a los pacientes antes de que se deteriore su VFG. Basándose en esta definición, la “National Kidney Foundation” (NKF), en EE.UU., estableció una clasificación de ERC en 5 estadios o etapas (Tabla 1 y ref. 1), que ha sido aceptada a nivel internacional (guías KDIGO en ref. 2). Los estadios se definen según la VFG, variable derivada de fórmulas basadas en la medición de la creatinina sérica, y la presencia o no de daño renal estructural o funcional.
Clasificación de la enfermedad renal crónica y prevalencia estimada en chile según la ens del 2003
| Etapas ERC | VFG (ml/min/1.73m2) | Descripción | Prevalencia (ENS 2003) |
|---|---|---|---|
| 1 | ≥ 90ml/min | Daño renal con VFG normal o aumentada | |
| 2 | 60–89ml/min | Daño renal con leve reducción de VFG | |
| 3 | 30–59ml/min | Reducción moderada de VFG | 5.7% |
| 4 | 15–29ml/min | Reducción severa de la VFG | 0.2% |
| 5 | < 15ml/min o diálisis | Falla renal terminal (ESRD en inglés) | 0.1% |
La creatinina plasmática aislada es un mal marcador de función renal, porque no es sensible para detectar la presencia de ERC en etapas iniciales. Su nivel en la sangre varía según la producción diaria por el músculo, la hipertrofia compensadora renal, la excreción extra renal, la secreción tubular variable y los métodos utilizados. La medición del clearence de creatinina se ha abandonado por sus limitaciones, que son principalmente la inseguridad en la recolección de orina de 24 horas y la secreción tubular de creatinina cuando cae la VFG. La valoración de la función renal mediante el cálculo de la VFG estimada (llamada VFGe) ha sido un avance, que ha facilitado el manejo de los pacientes y el desarrollo de los estudios clínicos. La VFG se estima mediante fórmulas que consideran la creatinina plasmática y variables demográficas como edad, sexo y raza. Las fórmulas utilizadas derivan de estudios poblacionales y las más conocidas son la de Cockroft-Gault y la del estudio MDRD (“Modification of Diet in Renal Disease”). La fórmula MDRD es más precisa que la de Cockroft-Gault cuando la VFG es menor de 60ml/min. Sin embargo la fórmula MDRD puede subestimar la VFG cuando esta es mayor de 60ml/min y por esto tiene la desventaja de sobrestimar la prevalencia de ERC en poblaciones de bajo riesgo. Nuevas ecuaciones más precisas se han desarrollado considerando la creatinina (CKD-EPI en ref. 3) o la cistatina C. La fórmula CKD-EPI tiene la ventaja de ser precisa cuando la VFG es cercana a lo normal (∼ 60ml/min), sin embargo no ha sido validada en poblaciones heterogéneas. La cistatina C es una proteína de bajo peso molecular, que es filtrada por el glomérulo y no reabsorbida, pero si metabolizada por el túbulo. En comparación con la creatinina, es menos afectada por la edad, sexo y masa muscular, pero si por otros factores como diabetes, hipotiroidismo e inflamación. Se propone su uso en pacientes con baja producción de creatinina, como ancianos, niños, cirróticos y trasplantados renales. Sin embargo, su utilidad clínica no está aún determinada con claridad. Las distintas fórmulas disponibles se detallan en la Tabla 2.
Ecuaciones para estimar la VFG (VFGe)
|
Entre los marcadores de daño renal destaca la mayor excreción de proteínas en la orina y específicamente albúmina. Las personas normales excretan habitualmente en su orina entre 50–100mg de proteínas por día, aunque existe una gran desviación estándar, por lo que se estableció un límite superior de proteinuria de 300mg/día. Los pacientes con ERC, excretan preferentemente en su orina albumina, que se relaciona al daño glomerular. La albuminuria además de ser un signo específico de daño renal es un marcador precoz cuando este daño ha sido causado por diabetes, hipertensión o glomerulopatías.
Los valores normales de proteinuria y albuminuria se detallan en la Tabla 3 (1). Como allí se señala, para estimar la excreción en 24 horas de proteinuria total o albuminuria, se puede realizarse la relación en muestra aislada de su concentración dividida por la concentración de la creatinina (mg/gr). Este ajuste permite corregir las variaciones en la concentración de la proteinuria dependientes del estado de hidratación del paciente y nos evitan la recolección de 24 horas. Cuando la albuminuria se encuentra en el rango de 30–300mg/día (17–250mg/gr en ♂ o 25–355mg/gr en ♀), no es detectada por los exámenes de proteinuria y se le llama rango de microalbuminuria. Valores de albuminuria sobre los 300mg/día (> 250mg/gr ♂ o > 355mg/gr ♀) son ya detectados en la proteinuria total y se habla de macroalbuminuria o proteinuria franca. De igual forma, al medir la proteinuria total se define como anormal valores > 300mg/día o una relación > 200mg/gr. Cuando los valores de proteinuria sobrepasan los 500–1000mg/gr, es sugerente de una enfermedad glomerular y cuando es > 3000mg/gr es indicativo de un síndrome nefrótico. A estos niveles de proteinuria total no es ya indispensable medir albuminuria y se puede monitorizar la proteinuria de 24 horas o la relación proteína/creatinina en orina aislada. No debe olvidarse que la proteinuria y albuminuria pueden aparecer transitoriamente en personas sin ERC, por ejemplo en relación a infecciones, ejercicio vigoroso o fiebre.
Definiciones de proteinuria y albuminuria (1)
| MÉTODO DE RECOLECCIÓN | VALOR NORMAL | MICRO ALBUMINURIA | MACRO ALBUMINURIA O PROTEINURIA |
|---|---|---|---|
| Proteinuria Total | |||
| Excreción en orina de 24 horas | < 300mg/día | no detectada | > 300mg/día |
| Relación proteína vs creatinina en orina de muestra aislada | < 200mg/gr | no detectada | > 200mg/gr |
| Albuminuria | |||
| Excreción en orina de 24 horas | < 30mg/día | 30–300 /día | > 300mg/día |
| Relación albúmina vs creatinina en | < 17mg/gr (♂) | 17–250mg/gr (♂) | > 250mg/gr (♂) |
| orina de muestra aislada | < 25mg/día (♀) | 25–355mg/gr (♀) | > 355mg/gr (♀) |
En pacientes con riesgo de ERC se debe medir la albuminuria de 24 horas o la relación en orina aislada. En pacientes de riesgo de ERC, además de la medición de proteinuria o albuminuria, es importante contar con un sedimento de orina y un estudio de imágenes (ej. ecografía).
EpidemiologiaPrevalencia e incidenciaLa prevalencia de ERC es conocida en los países desarrollados, pero desconocida en las naciones en desarrollo. El uso de las nuevas definiciones y fórmulas ha permitido comparar las cifras a nivel internacional. Si se considera solo una VFG < 60ml/min para definir ERC, encontramos prevalencias entre 2.5–11% en adultos. Esta población es alrededor de 200 veces superior a la cantidad de pacientes en terapia de sustitución renal (4). Si definimos ERC por la presencia de albuminuria, la prevalencia aumenta a 10.5–13% (5). En mayores de 65 años se han estimado prevalencias de ERC entre 25 a 35%, aunque es discutido si esto representa parte del envejecimiento normal (6). Lo que es claro es que la prevalencia de ERC está aumentando en la población general en relación al envejecimiento y aumento de la prevalencia de la diabetes, hipertensión arterial y obesidad. En Chile se conocen los datos de la encuesta nacional de salud (ENS del 2003), que se muestran en la Tabla 1.
La incidencia de ERC ha sido estimada en pocos trabajos prospectivos: en el estudio de descendencia de Framingham, de 2500 personas sanas seguidas por 18.5 años, un 9.4% presentó al fin del seguimiento una ERC definida por una VFG < 60ml/min (7).
Impacto de la ERC en la morbi-mortalidadAún las etapas iniciales de ERC están asociadas a mayor morbilidad y mayor uso de recursos económicos. Esto se explica porque la población con ERC inicial muestra prevalencias de co-morbilidades comparables a los pacientes en diálisis: enfermedad cardiovascular (40 vs 60% en dializados), enfermedad cerebro-vascular (12 vs 8%) y enfermedad vascular periférica (14% para ambos) (8). Las tasas de hospitalización son 3 veces mayores en enfermos con ERC inicial que en la población general. Esta tasa representa aproximadamente un 50% de la cifra de los pacientes en diálisis. Los factores de riesgo de hospitalización son similares (edad, albúmina sérica, hematocrito, etc.) entre los pacientes en etapas iniciales de ERC y la población en diálisis. Estos hechos apuntan a que las co-morbilidades y complicaciones observadas en la insuficiencia renal crónica terminal comienzan a manifestarse ya en etapas precoces de la falla renal.
La mortalidad de esta población se encuentra aumentada, especialmente por causas cardiovasculares. El riesgo de mortalidad cardiovascular de los individuos con ERC es mucho mayor que el riesgo de requerir diálisis o trasplante. Por ejemplo en un estudio de 1 millón de pacientes del Medicare en EE.UU., se reportaron los pronósticos a 2 años de los pacientes con ERC diabética y no diabética. En cuanto a la necesidad de diálisis al cabo de ese seguimiento se estimó una tasa de 1.6 para la ERC no diabética y 3.4 por 100 pacientes/año para la ERC diabética. En comparación la tasa estimada de muerte fue de 17.7 para la ERC no diabética y 19.9 por 100 pacientes/año para la ERC diabética (9). Los autores además destacan la alta prevalencia en estos pacientes de enfermedad vascular ateroesclerótica e insuficiencia cardiaca congestiva.
El aumento del riesgo cardiovascular no depende solo de las co-morbilidades asociadas, sino que la ERC es en sí misma una condición de riesgo cardiovascular elevado. Además tanto la VFG reducida (< 60ml/min) como la proteinuria son factores independientes de riesgo de enfermedad coronaria y su efecto es aditivo. La evidencia de que la ERC aún en etapas iniciales está asociada a un peor pronóstico cardiovascular, ha llevado a que se le considere como un equivalente de riesgo de enfermedad coronaria (10).
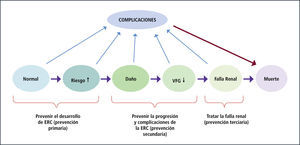
Estrategias de detección precozHistoria natural y prevención de ERCEn la Figura 1 se puede apreciar el curso natural y estadios de la ERC y las oportunidades de prevención. Este modelo recalca que la ERC, independiente del origen, tiende a ser progresiva en el tiempo a través de etapas definidas. Puede variar la velocidad de progresión y la duración de cada etapa. Las flechas que separan cada lapso indican la acción de los factores de riesgo de ERC. Estos pueden dividirse en factores de susceptibilidad, iniciación, progresión y de etapa terminal. En la Tabla 4 se definen estos factores y se dan ejemplos clínicos. Los factores de susceptibilidad ponen al individuo en riesgo de daño renal. Los factores de iniciación son capaces de causar daño renal en forma directa. Los individuos que presentan factores de susceptibilidad o de iniciación son los que están en riesgo de desarrollar ERC. Representan la población a estudiar y vigilar en forma regular, si se quiere realizar prevención primaria de ERC. Cuando ya existe daño renal, los factores de progresión son los que determinan el riesgo y la velocidad del deterioro de la función renal. Debe recalcarse que la enfermedad renal puede progresar porque la patología causal no está controlada (ej. diabetes mal tratada) o por vías independientes del insulto inicial (ej. hipertensión arterial no controlada). El manejo y control de estos factores es lo que se considera prevención secundaria de ERC. Los factores llamados de etapa terminal influencian los malos pronósticos clínicos observados en pacientes en estadio 5.
Clasificación de los factores de riesgo en ERC
| FACTORES DE RIESGO | DEFICIÓN | EJEMPLOS |
|---|---|---|
| De susceptibilidad | Aumenta la susceptibilidad al daño renal | Historia familiar, bajo nivel socioeconómico, bajo peso al nacer, reducción masa renal, ancianos |
| De iniciación | Causan en forma directa el daño renal | Diabetes, HTA, enfermedades autoinmunes, litiasis renal, tóxicos, obstrucción vía urinaria |
| De progresión | Causan que el daño renal progrese o avance más rápido | Proteinuria de alto grado, presión arterial no controlada, mal control glicémico, cigarrillo |
| De etapa terminal | Incrementan la morbi-mortalidad en falla renal avanzada | Baja dosis de diálisis, anemia, hipoalbuminemia, hiperfosfemia, referencia tardía al nefrólogo |
Todo paciente sometido a un chequeo médico de rutina debe ser evaluado para determinar si tiene factores de susceptibilidad o de iniciación de ERC. Cabe destacar que el examen físico de un paciente debe incluir siempre la medición de su presión arterial. Aquellos con algún tipo de riesgo deben tener al menos una medición de creatinina plasmática para estimar la VFG y una medición de proteinuria. Actualmente se recomienda evaluar la presencia de proteinuria mediante la medición de la relación albúmina/creatinina en orina de muestra aislada. Según el criterio clínico se pueden realizar otros exámenes complementarios, desde radiológicos a una biopsia renal, para determinar si existe daño renal estructural. No debe olvidarse que los pacientes de mayor riesgo de ERC incluyen a: diabéticos tipo 1 y 2, hipertensos, mayores de 60 años, portadores de enfermedad cardiovascular y con historia familiar de ERC. En cada uno de estos grupos existen recomendaciones de pesquisa específicas en cuanto a cuando empezar y con qué frecuencia seguir (11).
Beneficios del screeningLa pesquisa precoz de ERC tiene como beneficios la implementación de intervenciones potenciales que reducen la progresión del daño renal y disminuyen la tasa de eventos cardiovasculares. La búsqueda activa de estas enfermedades se basa en: su carácter asintomático por muchos años, su alta prevalencia, el acceso actual a exámenes de laboratorio diagnósticos y pronósticos, y la disponibilidad de tratamientos eficaces para evitar sus complicaciones. El análisis de costo-efectividad de las medidas de pesquisa, como son la estimación de la VFG y la medición de proteinuria, ha determinado que son más útiles cuando se aplican en poblaciones de alto riesgo (adultos mayores, diabéticos, hipertensos) y no en población general (12). Datos poblacionales de Estados Unidos muestran que la albuminuria es el marcador típico de ERC en población joven y que por otro lado la VFG reducida se observa en sujetos de mayor edad (13). El uso combinado de las 2 variables permite la identificación de los sujetos con mayor riesgo de desarrollar una falla renal avanzada. Una consideración de gran importancia es que el sistema de salud debe ser capaz de entregar un cuidado adecuado cuando se diagnostica una ERC mediante estas pesquisas.
Un avance en este tema ha sido el reporte automático, por parte de los laboratorios, de la VFG estimada al informar la creatinina plasmática. Un ejemplo es que el reporte de la VFGe y la educación del personal médico han permitido mejorar la pesquisa de casos de ERC por médicos de atención primaria de un 27 a un 85% (14). Si bien esta medida incrementa la cantidad de pacientes referidos al nefrólogo, especialmente en los subgrupos de mujeres, ancianos y pacientes en etapa 3, aún está en estudio su rol en modificar el pronóstico clínico a largo plazo de esta condición (15).
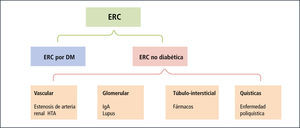
Evaluación clínicaLa meta de la evaluación clínica es iniciar precozmente las medidas preventivas para evitar de esta forma el mal pronóstico actual de la ERC. Los objetivos de la evaluación se detallan en la Tabla 5. El diagnóstico del tipo de ERC se basa tradicionalmente en factores etiológicos y patológicos. Una clasificación simple se grafica en la Figura 2 y separa a las causas en diabéticas y no diabéticas. La nefropatía diabética es la primera causa de daño renal crónico en EE.UU. y Chile (16). Las causas no diabéticas pueden separarse en glomerulares, intersticiales, vasculares y quísticas.
La evaluación se inicia con una historia clínica y examen físico, dónde es importante detectar las posibles causas del daño renal y los elementos reversibles o tratables de progresión de ERC y riesgo CV. Ejemplos clínicos habituales son la hipertensión arterial no controlada, uso de nefrotóxicos (ej. AINES) y mal control metabólico de la diabetes. Los exámenes de laboratorio deben explorar, además de la VFG y proteinuria, alteraciones en otras funciones renales como la producción de eritropoyetina y la excreción del fósforo. En etapas 3–5 de ERC, es recomendable medir la hemoglobina, calcemia, fosfemia, albuminemia, PTHi y bicarbonatemia. Como ya se ha señalado, el alto riesgo CV de estos pacientes hace imperioso la medición del perfil lipídico y la de otros factores de riesgo CV tradicionales y no tradicionales, como la resistencia a la insulina y la proteína C reactiva.
Todos los pacientes deben tener un estudio de imágenes, siendo la eco-grafía renal el examen más utilizado. Este estudio es de bajo costo y nulo riesgo y es útil en detectar anormalidades anatómicas como el menor tamaño renal o la presencia de obstrucción. La realización de otros estudios de imágenes, como scanner o resonancia, dependerán del contexto clínico del paciente.
ERC en el ancianoLa presencia de una VFGe reducida (< 60ml/min/1.73m2) es muy común en los adultos mayores y se asocia a los cambios estructurales y funcionales que ocurren con el envejecimiento renal. Con este nivel de función renal podemos catalogar a los sujetos como portadores de una ERC. La prevalencia de ERC en ancianos varía según los estudios y los métodos utilizados para estimar la VFG. En población anciana, se citan valores de prevalencia de ERC entre 23 a 35% versus 7% de la población más joven (17). Alrededor de 2/3 de los pacientes ancianos diagnosticados con ERC por VFGe reducida, están en etapa 3. Los estudios han determinado que en estos pacientes la progresión del deterioro renal es lenta, a menos que exista proteinuria agregada. En efecto es mucho mayor su probabilidad de morir antes de llegar a requerir diálisis. Los adultos mayores con mayor riesgo de progresión son aquellos con proteinuria, diabéticos o con una VFGe menor de 30ml/min. Son estos pacientes en especial los que se benefician de un manejo nefrológico preventivo. En todos los ancianos con ERC se deberá llevar a cabo una terapia intensiva para reducir el riesgo cardiovascular. La aplicación de las guías clínicas debe ser cautelosa en esta población, dado la mayor probabilidad de efectos adversos de los fármacos utilizados (ej. inhibidores de la enzima de conversión).
Intervenciones preventivas y terapéuticasEl manejo de la ERC consiste en 7 puntos principales: tratar las causas específicas de la enfermedad renal, identificar y resolver las causas reversibles de daño renal, tratar los factores de progresión, manejar y controla los factores de riesgo cardiovascular, evitar los nefrotóxicos, tratar las complicaciones urémicas y preparar al paciente para alguna técnica de sustitución renal (diálisis o trasplante) si corresponde.
Independiente de la causa de base y los otros factores fisiopatológicos involucrados, el manejo preventivo de la ERC ya instalada está enfocado en retardar o detener su tasa de progresión y prevenir los eventos cardiovasculares.
Tratamiento en la ERC no diabéticaEl tratamiento de la hipertensión arterial (HTA) es lo muy importante para lograr reducir la progresión de la ERC y reducir los eventos CV (18). Estudios observacionales han mostrado un mayor riesgo de progresión si la presión arterial (PA) es mayor de 130/80mm Hg (19). Los objetivos de presión arterial en ERC son menores a la población general, del orden de 125–135/75–85mm Hg. Algunos estudios han sugerido que niveles menores serían aún más beneficiosos en retardar la progresión del daño renal: una PA media de 92mm Hg (∼ PA < 125/75mm Hg). Este objetivo ha sido demostrado especialmente en algunos subgrupos, como los pacientes con proteinuria >1gramo/día o con seguimiento prolongado (20). Otros estudios en cambio no han demostrado beneficio con objetivos de PA más estrictos (PA < 130/80mm Hg) (21).
Los fármacos mejor estudiados en retardar la progresión de la ERC son los inhibidores de la enzima de conversión (IECA). Su efectividad ha sido probada en el subgrupo de pacientes con ERC y proteinuria y son la primera línea de tratamiento en estos casos. En pacientes con proteinuria mayor de 500mg/día, el riesgo de falla renal avanzada o de doblar la creatinina plasmática se ve reducido en un 40% al utilizar IECA comparado a otros antihipertensivos (22). Los riesgos clínicos de esta terapia son la falla renal aguda sobre agregada y la hiperkalemia (23). En pacientes con ERC en etapas iniciales e HTA y sin proteinuria, no hay evidencia que favorezca a los IECA sobre otros antihipertensivos en reducir la progresión del daño renal (24). Sin embargo hay estudios que apuntan a una reducción de los eventos CV con el uso de IECA en pacientes con falla renal leve, aunque no está claro si este efecto es independiente del control de la presión arterial (25).
Los efectos de los bloqueadores del receptor de angiotensina 2 (ARB) sobre la progresión de ERC han sido menos estudiados que los de los IECA. Un meta análisis sugiere que los ARB son fármacos igual de eficaces que los IECA en controlar la presión arterial y proteinuria en pacientes con ERC (26). Son una alternativa en aquellos pacientes que no toleran los IECA por tos o angioedema. No existen estudios que sugieran un rol de los IECA o ARB en la prevención primaria de ERC en pacientes no diabéticos. En un estudio reciente, el uso del ARB Telmisartán no previno la aparición de ERC en pacientes cardiovasculares, no diabéticos, con función renal normal y sin proteinuria (27).
La combinación de IECA y ARB ofrece efectos sinérgicos en reducir la proteinuria, lo que teóricamente sugiere una mejor renoprotección (26). Sin embargo en el estudio ONTARGET la terapia combinada (IECA + ARB) se asoció a: mayor riesgo de requerir diálisis (por falla renal aguda y crónica) y doblar la creatinina sérica o muerte en pacientes con función renal conservada y baja tasa de proteinuria (28). En pacientes de bajo riesgo de progresión, la terapia combinada ofrecería riesgos potenciales mayores que los beneficios esperados (29). Estas conclusiones no se aplican necesariamente a pacientes con una enfermedad progresiva.
Estudios recientes apuntan al efecto antiproteinurico sinérgico de la espironolactona al combinarla con IECA o ARB. Se ha observado una mayor reducción en la proteinuria al adicionar espironolactona (25mg al día) a un IECA que al adicionar un ARB. Es importante señalar el riesgo de hiperkalemia que acompaña a la combinación de estos fármacos.
Los pacientes con ERC requieren en general varios tipos de antihiper-tensivos distintos para lograr un buen control de su HTA, especialmente con los objetivos ya señalados de PA. Los diuréticos de asa o tiazidicos logran mejorar el componente de expansión de volumen de la HTA y además evitan el desarrollo de hiperkalemia al caer la VFG. A su vez los bloqueadores de los canales de calcio no dihidropiridínicos, adicionan un efecto potente sobre la HTA sistólica y pueden reducir la proteinuria aún más (30).
Tratamiento en la ERC diabéticaEl tratamiento de la HTA en diabetes se asocia a una reducción en el riesgo de: muerte, accidente vascular encefálico y complicaciones micro-vasculares como la retinopatía (31). Los objetivos de PA serían similares a los pacientes con ERC no diabética.
Desde hace años se sabe que los IECA tienen un efecto favorable en pacientes con diabetes tipo 1 y nefropatía establecida, al reducir el riesgo de muerte, diálisis o trasplante (32). De igual forma los ARB han demostrado los mismos efectos favorables en pacientes con diabetes tipo 2 y nefropatía establecida. Los estudios sugieren que los IECA y los ARB logran retardar el paso a macroalbuminuria en pacientes con microalbuminuria. En pacientes con diabetes tipo 2 e hipertensión arterial, con función renal y albuminuria normales, los IECA logran retardar la aparición de la microalbuminuria (33). No hay datos suficientes para recomendar esta terapia preventiva a sujetos normotensos (34), si requieren de una monitorización estrecha. La terapia combinada (IECA + ARB) logra reducir la proteinuria significativamente en pacientes con nefropatía diabética. Sin embargo aún se desconocen las consecuencias clínicas a largo plazo sobre el pronóstico renal. Un nuevo factor a considerar puede ser el efecto potenciador sobre la reducción de la proteinuria del aliskiren, un inhibidor directo de la renina, sobre el cual hay estudios en curso (35).
El mal control glicémico se ha asociado a mayor riesgo de nefropatía diabética y progresión rápida de la ERC. Los estudios dónde se han buscado metas de hemoglobina glicosilada menor de 6%, han demostrado menor incidencia de nuevos casos de micro o macroalbuminuria en diabéticos tipo 1 y 2 (36). Los beneficios de un control estricto de la glicemia deben balancearse contra los riesgos de hipoglicemia, evento que es más frecuente en pacientes con una VFG reducida. Intervenciones que reducen el riesgo cardiovascular:
Los estudios clínicos en pacientes con ERC son escasos, por esto debemos extrapolar los datos de trabajos en población general o de subgrupos con ERC. Las estatinas no han demostrado beneficios claros en los pacientes sometidos a hemodiálisis. El subgrupo de dializados que pudiera beneficiarse es aquel con el mayor nivel basal de LDL. Sí se observa una reducción de la mortalidad global y tasa de eventos cardiovasculares con estatinas, en pacientes con una VFGe entre 30–60ml/min (37). La aspirina (ASA) es prescrita con frecuencia en pacientes con riesgo de ERC (HTA o DM), por su rol en la prevención cardiovascular secundaria. No existen estudios que sugieran que ASA pueda retardar la progresión de la enfermedad renal. Los antecedentes no apuntan a un mayor riesgo de hemorragia en pacientes con ERC tratados con dosis bajas de ASA (38). El uso de ASA u otro antiagregante plaquetario, debe individualizarse según el riesgo cardiovascular versus el riesgo de hemorragia del paciente.
Otros aspectos del cuidado médico preventivoNo debe olvidarse impedir la exposición del paciente a nefrotóxicos, ajustar la dosis de los distintos fármacos según la VFGe o según niveles plasmáticos si están disponibles.
Las medidas dietéticas recomendadas incluyen una reducción de la ingesta de sal a menos de 100mmol/día, lo que facilita el control de la HTA. La restricción severa de proteínas no es recomendable por el riesgo de desnutrición (39). La suplementación oral con bicarbonato de sodio reduce la tasa de progresión de la falla renal crónica y mejora el estado nutricional de pacientes con VFG reducida (< 30ml/min) y acidosis crónica (40).
Es importante destacar el cese del tabaco, debido al riesgo demostrado de progresión de ERC y mayor mortalidad en esta población (41).
La obesidad se asocia al desarrollo de ERC, progresión del daño renal y mortalidad relacionada a ERC (42). Es recomendable realizar ejercicio físico dinámico, de tipo moderado, por 30 a 60 minutos, 5 veces por semana.
En la Tabla 6 se resumen las distintas medidas preventivas aplicables a esta población.
Recomendaciones preventivas en pacientes con erc inicial
| RECOMENDACIONES | |
|---|---|
| Cambio del estilo de vida | Cese del tabaco |
| Dieta baja en sodio (2–3gr/día) | |
| Restricción proteica de 0.8gr/kg/día | |
| Bicarbonato sodio oral, en caso de acidosis | |
| IMC < 25, circunferencia abdominal < 102 ♂ y < 88cm en ♀ | |
| Ejercicio físico regular, de intensidad moderada (caminata, bicicleta, trote) | |
| Hipertensión arterial | Objetivo: PA < 130/80mm Hg |
| En caso de albuminuria, utilizar de preferencia un IECA o ARB | |
| Diabetes mellitus | Objetivo: HbA1C < 7% y glicemia 70–126mg/dl |
| Metformina no recomendada en estadios 3–5 de ERC | |
| Dislipidemia | Objetivo: LDL cercano a 70mg/dl |
| Estatinas de preferencia, ajustar dosis si se usan Fibratos | |
| Antiagregantes plaquetarios | Aspirina 81mg al día, en caso de riesgo CV elevado y ausencia de contraindicaciones |
En la práctica clínica, aún en países desarrollados, la implementación de estas medidas preventivas en población de riesgo es muy baja. Por ejemplo en el Reino Unido, sólo un quinto de los pacientes con DM y ERC tiene una PA < 130/80mm Hg y sólo la mitad de ellos recibe un IECA o ARB (43). Además sólo el 50% de esta población, que incluía pacientes con ERC estadios 3–5, recibe ASA o algún hipolipemiante.
El manejo de estos pacientes por médicos no especialistas puede realizarse con pautas claras y con derivación oportuna al nefrólogo. Las indicaciones recomendadas de referencia al nefrólogo se señalan en la (Tabla 7. La referencia tardía al nefrólogo no es inocua, acarrea un claro peor pronóstico para estos pacientes 44).
Indicaciones de referencia al nefrólogo
| VFG estimada < 60ml/minuto |
| Microalbuminuria > 30mg/día |
| Declinación de la VFG > 30% en 4 meses |
| Hipertensión arterial resistente |
| Hiperkalemia a pesar de terapia |
| Elevado riesgo de progresión de la ERC |
| Efectos adversos significativos con la terapia |
| Complicaciones de la ERC (anemia, hiperparatiroidismo, acidosis,…) |
Se ha planteado que el manejo preventivo de estos pacientes debería ser enfocado en forma multidisciplinaria y multimodal. Por ejemplo en Italia se utilizan unidades clínicas dónde se manejan con metas estrictas todos los factores clínicos asociados a la ERC (45). Los resultados reportados han sido espectaculares, con remisión o regresión de la ERC en 50% de los casos; cabe señalar que antiguamente todos esos pacientes progresaban rápidamente a la falla renal terminal (45)
Desafios futurosSe necesitan de mejores métodos clínicos para detectar en forma costo-efectiva aquellos pacientes con riesgo de mal pronóstico renal y cardiovascular. Una alternativa posible son los modelos predictivos basados en la VFG estimada y la proteinuria. Otra alternativa es el desarrollo de nuevos marcadores, como la cistatina C y otros, que nos permitan refinar la detección de individuos en riesgo de desarrollar ERC. A pesar de que disponemos de intervenciones terapéuticas efectivas en ERC, un porcentaje elevado de pacientes continúa progresando a la falla renal avanzada. La implementación de las medidas preventivas debe poder llegar a todos los individuos en riesgo, esto depende de una mejor educación del personal sanitario y la población. A futuro nuevos agentes terapéuticos, enfocados en otros procesos fisiopatológicos, pueden marcar la diferencia en la estrategia preventiva. En lo inmediato se necesitan de estudios clínicos que evalúen las terapias clásicas de prevención cardiovascular, así como otras específicas a la falla renal, en pacientes con ERC. En beneficio de los sistemas de salud pública, se requieren de programas de prevención y clínicas de intervención múltiple, para optimizar el manejo y el uso de recursos por parte de estos pacientes.
En Chile necesitamos de estudios que nos muestren la real prevalencia e incidencia de la ERC en nuestra población. Luego debemos enseñar a nuestros médicos de atención primaria y secundaria la pesquisa y manejo de los pacientes en riesgo. El sistema de salud debe contar con la capacidad física y humana para hacer frente a los pacientes detectados y poder implementar las estrategias preventivas. La población debe ser educada acerca de las enfermedades renales y las conductas preventivas adecuadas. Sólo de esta forma podremos reducir la carga humana, familiar y económica que estas enfermedades traen consigo.
El autor declara no tener conflictos de interés, en relación a este artículo.