Antraciclínicos, trastuzumab e inhibidores de tirosin kinasa moléculas pequeñas son agentes antitumorales muy eficaces, pero que producen toxicidad miocárdica, con diferentes intensidades y frecuencias; los mecanismos implicados en la cardiotoxicidad se conocen parcialmente, y ha habido avances en el reconocimiento temprano de los síndromes cardiovasculares que diferentes agentes antineoplásicos que pueden producir. Los factores de riesgo de cardiotoxicidad son ahora mejor conocidos. Proponemos algoritmos para el seguimiento y manejo de los efectos cardiovasculares adversos de estos fármacos, con el fin de prevenir morbilidad y la mortalidad.
Anthraciclines, trastuzumab and small molecules tyrosine kinase inhibitors are very effective antitumor agents, but they produce myocardial toxicity, with varying intensities and frequencies; the mechanisms involved in cardiotoxicity are partially known, and there has been advances in early recognition of the different cardiovascular syndromes that antineoplasic agents can produce. Risk factors for cardiotoxicity are also better known now. We propose algorithms for monitoring and management of cardiovascular untoward effects of these drugs, in order to prevent morbidity and mortality.
El perfil epidemiológico de nuestro país ha cambiado en las últimas décadas hacia uno con cohortes de poblacionales de progresiva mayor edad: este hecho ha ocasionado un aumento de la incidencia y prevalencia de casos de cáncer, siendo ahora la segunda causa de muerte en Chile. Por otra parte, tratamientos más eficaces para este grupo de enfermedades hacen que la prevalencia aumente. De aquí la relevancia de elaborar nuevas estrategias terapéuticas contra el cáncer, que incluyan la reducción de la toxicidad de las actuales terapias, incluyendo las formas clásicas de quimioterapia, así como las terapias biológicas. El pronóstico a largo plazo de los sobrevivientes de cáncery su calidad de vida dependen no sólo de la eficacia de sus tratamientos, sino también de la minimización de los efectos adversos que ellos pueden producir (1).
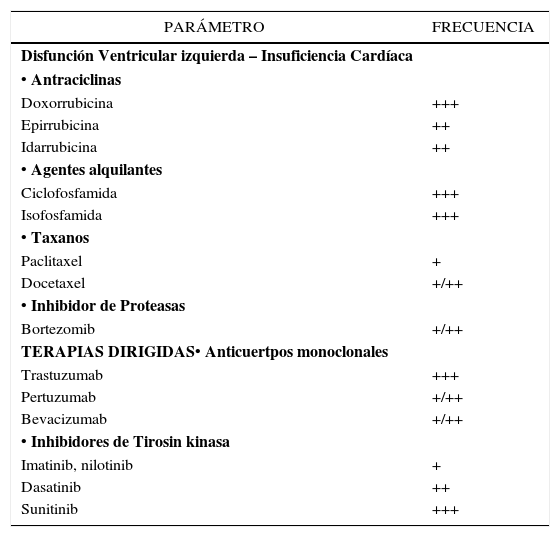
Existe una variedad de posibles síndromes clínicos que afectan al sistema cardiovascular como expresión de toxicidad por antineoplásicos. En las Tablas 1y 2 se esquematizan estos síndromes, con sus frecuencias relativas.
Síndromes clínicos de cardiotoxicidad
| PARÁMETRO | FRECUENCIA |
|---|---|
| Disfunción Ventricular izquierda – Insuficiencia Cardíaca | |
| • Antraciclinas | |
| Doxorrubicina | +++ |
| Epirrubicina | ++ |
| Idarrubicina | ++ |
| • Agentes alquilantes | |
| Ciclofosfamida | +++ |
| Isofosfamida | +++ |
| • Taxanos | |
| Paclitaxel | + |
| Docetaxel | +/++ |
| • Inhibidor de Proteasas | |
| Bortezomib | +/++ |
| TERAPIAS DIRIGIDAS• Anticuertpos monoclonales | |
| Trastuzumab | +++ |
| Pertuzumab | +/++ |
| Bevacizumab | +/++ |
| • Inhibidores de Tirosin kinasa | |
| Imatinib, nilotinib | + |
| Dasatinib | ++ |
| Sunitinib | +++ |
Síndromes clínicos de cardiotoxicidad
| PARÁMETRO | FRECUENCIA |
|---|---|
| • Síndromes isquémicos | |
| Fluorouracil, capecitabina | ++ |
| Cisplatino, carboplatino | + |
| lnterferón-α | + |
| Paclitaxel | + |
| Docetaxel | + |
| Bevacizumab | ++ |
| Vinca alcaloides | + |
| Sorafenib | +-++ |
| Erlotinib | +-++ |
| • Hipertensión | |
| Cisplatino | ++++ |
| Bevacizumab | ++++ |
| Sunitinib | ++++ |
| Sorafenib | ++++ |
| • Trombosis venosa | |
| Cisplatino | +++ |
| Talidomida | ++++ |
| Lenalidomida | +++ |
| Erlotinib | ++ |
Los antraciclínicos son una clase de agentes antineoplásicos más ampliamente usados por su eficacia contra el cáncer: su exponente principal es la doxorrubicina, que se usa contra diferentes tipos de neoplasias, tanto sólidas como hematológicas. Sin embargo, el uso clínico de doxorrubicina está limitado por su cardiotoxicidad asociada (2). Los nuevos esquemas de tratamiento no han reducido la cardiotoxicidad, sino que más bien la han aumentado, con el uso de nuevas terapias biológicas adyuvantes. Por ejemplo, el uso de Trastuzumab en el cáncer de mama ha aumentado la incidencia de toxicidad miocárdica (3).
La cardiotoxicidad inducida por antraciclínicos puede ocurrir en forma aguda (días a semanas), subaguda (meses), o crónica (años). La presentación crónica es la que se ha descrito y estudiado principalmente en humanos, y en su máximo grado en severidad se presenta clínicamente como insuficiencia cardíaca (IC). El daño miocárdico inducido por antraciclínicos es dosis dependiente: la cardiotoxicidad clínicamente aparente ocurre en menos de 5% de los sujetos que acumulan hasta 300mg/m2; la miocardiopatía ocurre en 5 a 10% de los sujetos que llegan a dosis entre 300 and 450mg/m2, mientras que el riesgo aumenta dramáticamente (sobre 20%) en quienes sobrepasan esas dosis. La cardiotoxicidad puede potenciarse con otros factores, como la radiación torácica, edad temprana o tardía, uso concomitante o secuencial de trastuzumab, enfermedad cardiaca pre existente, y acumulación de factores de riesgo cardiovascular (4-9). Se ha recomendado no superar las siguientes dosis de las antraciclinas (dosis máximas): doxorrubicina (adriamicina) no superar de 450mg/m2, daunorrubicina no más de 400mg/m2, epirrubicina no más de 650gm/m2, y mitoxantrona hasta 120gm/m2.
Está bien establecido que un dosis acumulativa de doxorubicina de sólo 250mg/m2 a menudo causa cambios patológicos que se pueden reconocer a través de biopsias endomiocárdicas, pudiéndose observar con microscopía electrónica: reducción del número de fibrillas, cambios mitocondriales y degeneración celular, incluyendo necrossi y apoptosis (10), lo que constituye una prueba de cardiotoxicidad precoz. Esto enfa-tiza la necesidad de encontrar biomarcadores precoces con el propósito de identificar los grupos más vulnerables, y de realizar intervenciones preventivas.
Los mecanismos subyacentes al efecto antineoplásico de las antraci-cilinas en las células tumorales son diferentes de los mecanismos que causan cardiotoxicidad. Los mecanismos antineoplásicos incluyen interferencia con las señales moleculares que gobiernan desde el DNA la síntesis de macromoléculas. También producen daño a nivel de DNA inhibiendo la topoisomerasa II, e inducción de apoptosis (11-13). Si bien estudios iniciales sugirieron que la formación de especies reactivas de oxígeno (ROS) y la inducción de peroxidación de lípidos podrían contribuir a los efectos antitumorales de las antraciclinas (14), comunicaciones más recientes demuestran lo contrario: el estrés oxidativo no es un mediador del efecto anitumoral de estos fármacos (11-12, 15-16). Estos resultados implican que las estrategias para disminuir la formación de ROS para prevenir la cardiotoxicidad no comprometen la eficacia del tratamiento del cáncer. Por otra parte, la cardiotoxicidad por antraciclíncos parece ser mediada por producción exagerada de ROS en el corazón, con muchos efectos miocárdicos directos e indirectos: apoptosis de miocitos (17), inhibición de síntesis de miofilamentos (18), alteración de metabolismo energético (19) cambios ultraestructurales de los miocitos (20).
Varias estrategias dirigidas a contrarrestar el daño del estrés oxidativo se han ensayado en modelos experimentales, siendo el desrazoxano el único agente aprobado clíncamente. Este es un agente quelante del fierro que bloquea la generación de radicales libres, y es efectivo como agente cardioprotector en regímenes que contienen antraciclínicos. Desrazoxano tiene su propia toxicidad general, es caro, requiere uso parenteral, recomendándose para situaciones con altas dosis acumuladas, sin tratamientos alernativos (21,22). Cuatro estudios randomizados pequeños han sugerido que fármacos cardioprotectores comúnmente usados pueden ser eficaces en prevenir la cardiotoxicidad por antraciclínicos: valsartán, Carvedilol, enalapril, and atorvastatina (23-26). El primero de estos ensayos observó que valsartán podía casi completamente abolir un ascenso de BNP observado en los controles (23). Nosotros hemos observado un aumento similar de Pro BNP luego de los dos primeros ciclos de antraciclínicos (27). Oíros estudios han demostrado aumentos transitorios de Troponinas, luego de semanas de ciclos de antraiclínicos (28, 29). Es posible postular entonces que luego de cada ciclo de antra-ciclínico hay frecuentes episodios subclínicos de disfunción ventricular. Probablemente se gatillan mecanismos de reparación miocárdica, con rápida normalización de los índices de disfunción. Esta secuencia puede ser efectiva por muchos ciclos, hasta que se alcanza un límite de capacidad de reparación -variable para cada individuo-, momento en que la insuficiencia cardíaca clínicamente manifiesta sobreviene. Esta hipótesis es consistente con la observación que la población de células progeni-toras CD133+/CD34+y CD34+aumentan transitoriamente en forma precoz luego de quimioterapia (30).
Tirosin kinasa y transducción de señales en la salud y en el cáncerLas cascadas de transducción de señales permiten que un pequeño estímulo sea amplificado a una respuesta mayor, como por ejemplo, reprogramación de la expresión génica. Las tirosin kinasas son familias de enzimas que catalizan la transferencia de residuos fosfato desde el ATP a residuos tirosina en otras proteínas (sustratos). Juegan un rol crítico en la transducción de señales que activan vías metabólicas que regulan procesos celulares de diferenciación, metabolismo, crecimiento, migración, y apoptosis. Se reconocen dos tipos principales de tirosin kinasas: de receptor e intracelulares. Las primeras están localizadas en la membrana celular con un dominio extracelular (que se une a sus ligandos) y un dominio intracelular, responsable de las señales al interior de la célula. Hay un balance fino en la actividad las tirosin kinasas y las tirosin fosfatasas, que median la defosforilación de la tirosina y actúan por lo tanto en oposición a las kinasas, controlando la duración y temporalidad de las señales celulares. Normalmente, la actividad de la tirosin kuinasa está regulada en forma muy estrecha en su rol crítico de la comunicación celular y mantención de la homeostasis (31).
Las señales mediadas por tirosin kinasa son fundamentales para la transformación maligna de las células y para la angiogénesis tumoral. La transformación maligna a menudo resulta de alteración de las señales mediadas por tirosin kinasa. La activación constitutiva de tirosin kinasa se ha implicado en una gran cantidad de cánceres. En leucemias y en muchos tumores sólidos los genes que codifican kinasas causales (o contributorias) esíán amplificados o mutados; lo primero causa un aumento de las expresión de la kinasa y lo último lleva a un estado perma-nentemente activado. Ambos mecanismos incentivan la proliferación de clones celulares cancerigénicos e impiden su curso hacia apoptosis (32). Las señales celulares mediadas por tirosin kinasa juegan también un rol importante en la angiogénesis tumoral. Los cánceres de cierto tamaño son dependientes del desarrollo de nuevos vasos para su crecimiento continuo y su capacidad para producir metástasis (33). La inhibición de la actividad anormal de la actividad de tirosin kinasa anormal se ha transformado en un foco central y muy activo de la terapia del cáncer. Se han desarrollado dos clases de fármacos cuyo objetivo específico es tirosin kinasa: Anticuerpos monoclonales humanizados e inhibidores de tirosin kinasa de molécula pequeña. Un importante ejemplo del primer tipo es trastuzumab.
Características y mecanismos de cardiotoxicidad por trastuzumabEl cáncer de mama es una enfermedad maligna altamente prevalente y una causa importante de muerte. Alrededor de un 25% de las pacientes con esta neoplasia sobre expresan el receptor HER2, lo que se asocia un peor pronóstico.Trasíuzumab es un anticuerpo monoclonal humanizado dirigido a HER2, que aumenta la sobrevida en 20% en mujeres HER2+con enfermedad metastásica (34-37). Recientemente, cuatro ensayos clínicos de cáncer de mama HER2+temprano demostraron que trastuzumab reduce la recurrencia y el riesgo de muerte en 50% (38). A pesar de sus beneficios oncológicos muy favorables, trastuzumab presenta cardiotoxicidad. En los estudios Fase III, la insuficiencia cardíaca o la disfunción ventricular izquierda se encontró en 4 a 18% de los pacientes, respectivamente (39-41). La cardiotoxicidad por trastuzumab es diferente de aquella producida por antraciclíncos: los cambios patológicos son menos intensos, y no hay una relación dosis respuesta en relación con la acumulación de los ciclos. Inicialmente, la cardiotoxicidad por trastuzumab se consideró como esencialmente reversible (42), pero más recientemente ha surgido evidencia de que el pronóstico es variable: en un estudio se encontró que este fármaco se discontinuó en 22% de pacientes debido a disfunción ventricular izquierda: de ellas, un 40% no mostró mejoría en la función ventricular a pesar de tratamiento médico completo (43). En el mismo sentido, en un estudio “del mundo real”, un 21,6% de las mujeres en tratamiento tuvieron un evento cardíaco que requirió discontinuación de trastuzumab, ya sea transitorio o permanente (44). Los ensayos clínicos iniciales que llevaron a la aprobación del fármaco probablemente reflejan la influencia de criterios de exclusión más exigentes, que en la práctica clínica habitual.
En términos de mecanismos, la cardiotoxicidad por trastuzumab no es un fenómeno sorprendente: HER2 y su ligando, neuregulina-1 juegan roles críticos en el desarrollo del corazón. Ratas con deleción de HER2 desarrollan insuficiencia cardíaca severa con acortamiento de su período de vida. Algunas de las vías metabólicas cardíacas afectadas por trastuzumab son comunes a aquellas afectadas por antracicilínicos, como ERK y PI3K/Akt (para una revisión reciente, ver referencia 45). Los biomarcadores pueden ser una alternativa útil para un diagnóstico precoz, con algunos estudios hechos en la situación clínica sub-aguda (45,47). No existen aún estudios randomizados que examinen intervenciones precoces como antioxidantes. Hay sólo un estudio observacional que sugiere que las usuarias de beta bloqueo desarrollan menos cardiotoxicidad por trastuzumab (48).
Características y mecanismos de cardiotoxicidad por inhibidores de tirosin kinasa no mabInhibidores de tirosin kinasa de molécula pequeña (smTKI) como ima-tinib, dasatinib and nilotinib son agentes nuevos agentes usados en pacientes con leucemia con alta eficacia antineoplásica. Producen disfunción ventricular con una frecuencia que ha variado en diferentes comunicaciones. Tienen como objetivo varias tirosin kinasas, y se presume que su cardiotoxicidad se relaciona principalmente con pérdida de masa miocárdica, consistente con muerte celular (49). La vía metabólica que media apoptosis celular parece ser una inducción de respuesta de estrés del retículo sarcoplásmico, en el cual una activación de proteínas con defecto de plegamiento induce muerte celular (50). La familia de proteínas JNK, activada por kinasas, opera como un factor crítico en la vía metabólica que estimula la respuesta de estrés del retículo sarcoplásmico, que media finalmente la apoptosis (49). Notablemente, esta misma vía metabólica (JNK) se activa frente a la intensa actividad de ROS en la cardiotoxicidad por antracicilínicos (51). Aun aceptando que smTKI produce con menor frecuencia insuficiencia cardíaca que antraciclinas o tratuzumab, se debe tomar en cuenta que estos son agentes son extraordinariamente efectivos en leucemia mieloide crónica, que prolongan la sobrevida en forma efectiva, que los pacientes deben continuar su uso durante el resto de sus vidas, dando la oportunidad para la aparición de una segundas forma de enfermedad cardíaca (52).
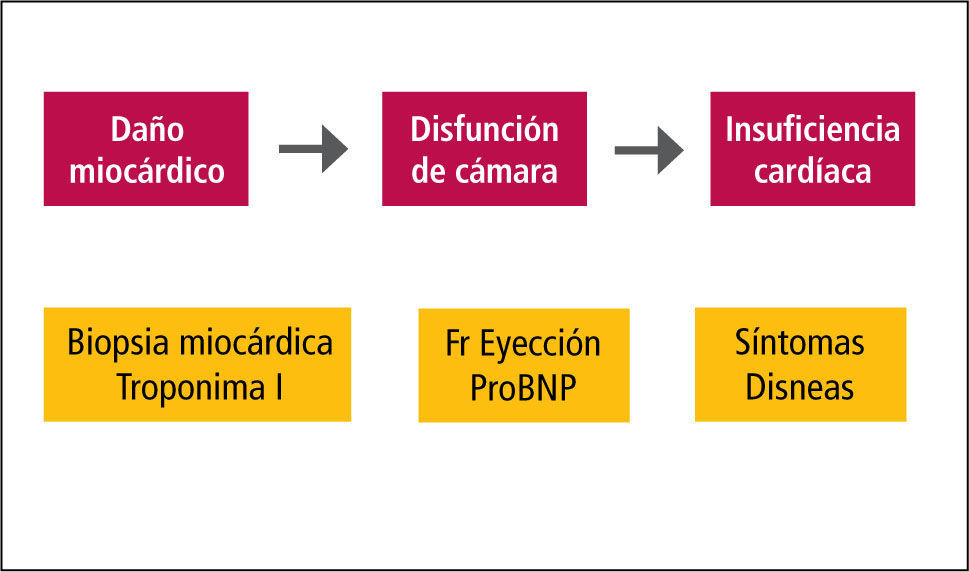
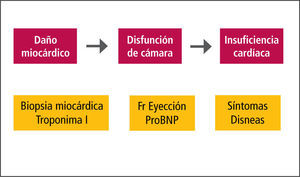
Detección precoz de cardiotoxicidadLa identificación de pacientes en riesgo de presentar cardiotoxicidad por quimioterapia es uno de los objetivos principales de la cardio-oncología. La identificación de cardiotoxicidad en la práctica clínica se realiza mediante la evaluación de la función ventricular izquierda, aunque confiar sólo en las mediciones de fracción de eyección podría ser poco sensible, al pesquisar el daño cuando ya se ha producido, de manera que la búsqueda de marcadores que detecten precozmente el daño miocárdico sería muy útil para evitar un daño definitivo en estos pacientes. La figura 1nos muestra las etapas de la cardiotoxicidad: se inicia con el daño miocárdico que puede ser pesquisado por una biopsia miocárdica o por la liberación de troponinas al torrente sanguíneo. La siguiente etapa, aún asintomática, es la disfunción de cámara que se detecta por el deterioro de la fracción de eyección, por cambios de función diastólica y por los péptidos natriuréticos cardíacos. Por último, la expresión clínica de la cardiotoxicidad, la insuficiencia cardíaca, es un estado muy avanzado que se asocia a eventos cardíacos mayores. El uso de la biopsia en-domiocárdica a pesar de ser muy específica es poco práctica por su invasividad y falta de homogeneidad.
Marcadores de cardiotoxicidad
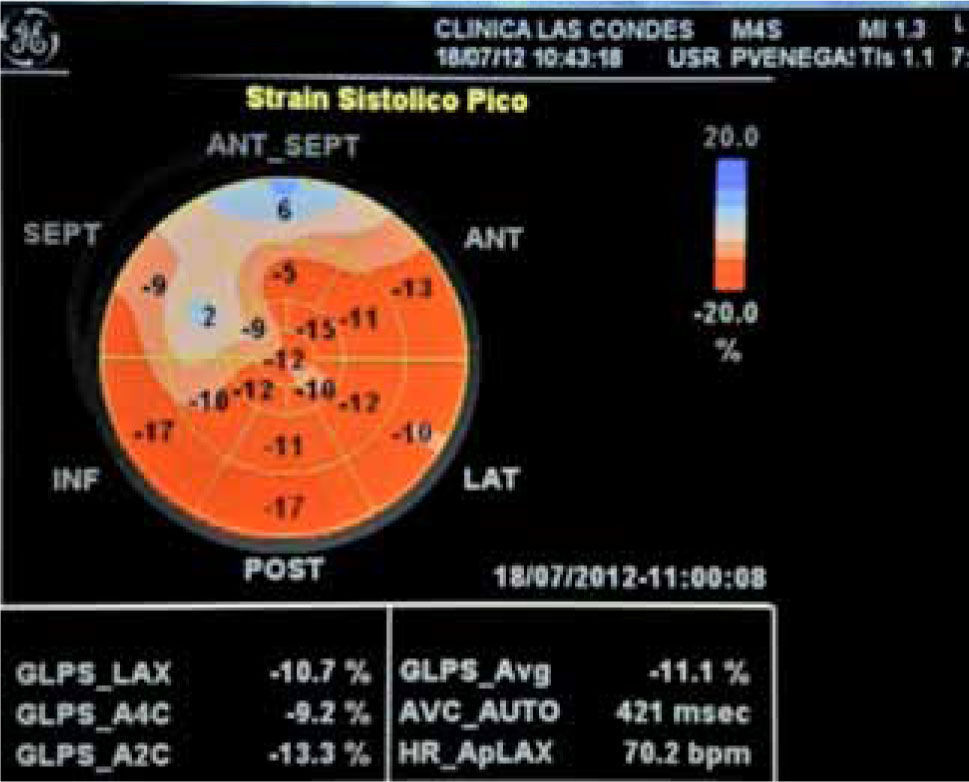
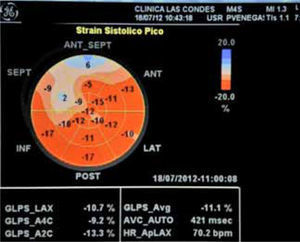
La Fracción de Eyección ventricular izquierda es la variable más utilizada para diagnosticar la presencia de cardiotoxicidad, ya sea estudiada con la ventriculografía radioisotópica, el patrón de diferencia por años, o por la ecocardiografía, técnica de más fácil acceso, pero con menor reproducibilidad. La ecocardiografía tiene la ventaja que además permite evaluar otras variables de función ventricular tanto sistólica como diastólica y aporta información de la morfología cardíaca, el tamaño de las cámaras, el grosor de las paredes y la función valvular. La resonancia magnética cardíaca tiene alta reproducibilidad en la evaluación de la fracción de eyección VI, pero su menor disponibilidad y alto costo la hacen poco práctica. La evaluación de la Fracción de Eyección con la ecocardiografía ha mostrado ser útil en el seguimiento de pacientes con quimioterapia con antraciclinas, una caída>5% llegando a un valor<55% en pacientes sintomáticos o una reducción asintomática>10% hasta llegar a un valor de<55% constituirían cardiotoxicidad. Para mejorar la reproducibilidad de la fracción de eyección ecocardiográfica se han utilizado algunas técnicas más avanzadas: la ecocardiografía tridimensional en tiempo real ha demostrado una alta correlación con la resonancia magnética cardíaca (53). Algunos estudios han mostrado un deterioro más precoz de la función diastólica que de la función sistólica en pacientes tratados con quimioterapia, de manera que el análisis del llenado transmitral o del doppler titular del anillo mitral permitirían un diagnóstico más precoz de cardiotoxicidad (54, 55). Nuevas técnicas, como el strain longitudinal global, sería más precoz en detectar deterioro de la función ventricular (47, 56-59). El strain longitudinal global es una técnica cuantitativa automática para la medición de la función del eje longitudinal global a partir de imágenes de escala de grises, evaluando el desplazamiento con la técnica de speckle tracking a lo largo de todo el ciclo cardíaco y calculándolo a partir de la media de 17 segmentos (Figura 2). En un estudio realizado en 35 mujeres con cáncer de mama tratadas con trastuzumab la deformación miocárdica evaluada con el strain global longitudinal y radial identifica una disfunción miocárdica preclínica más precoz que la fracción de eyección en 2D y 3D (57). En otro estudio realizado en 43 mujeres con cáncer de mama tratados con antraciclinas y trastuzumab, una caída en el strain longitudinal global predice el desarrollo de cardiotoxicidad antes que la fracción de eyección, permitiendo seleccionar a aquel grupo de pacientes que se beneficiaría de tratamientos alternativos (47). En resumen, la disminución de la fracción de eyección después de quimioterapia es un marcador tardío de daño miocárdico, como también es un marcador imperfecto que depende de las condiciones de carga. El uso de diferentes variables ecocardiográficas permite hacer una evaluación más integral y diagnosticar más precozmente la presencia de cardiotoxicidad. La ecocardiografía sería el método más práctico para evaluar y hacer seguimiento de la función ventricular en pacientes tratados con quimioterapia potencialmente cardiotóxica.
Biomarcadores y cardiotoxicidadUna disminución de la fracción de eyección es un marcador tardío de daño miocárdico, por lo que se ha explorado a marcadores que permitan detectar más precozmente el daño miocárdico. Para esto se han evaluado marcadores bioquímicos como las troponinas cardíacas que detectarían específicamente daño miocárdico y los péptidos natriuréticos que podrían predecir disfunción ventricular.
Troponinas séricas. La medición de troponinas séricas ha demostrado ser útil en confirmar la presencia de daño miocárdico. En un modelo animal, la troponina T fue liberada por los miocitos dañados por doxo-rrubicina, y las concentraciones de troponina T se correlacionaron con las dosis de doxorrubicina recibida, como con el grado de daño miocárdico (60). Algunos estudios clínicos han sugerido que la troponina T e I son marcadores precoces de daño miocárdico por antraciclinas y antraciclinas más trastuzumab (28, 29, 45, 61). Aproximadamente un tercio de los pacientes con quimioterapia potencialmente cardiotóxi-cas presentan elevación de troponinas séricas, este aumento se asocia a una reducción de la fracción de eyección durante el año siguiente (28). En otro estudio, en 703 pacientes con diversos cánceres que recibieron quimioterapia a altas dosis que incluían antraciclinas, la elevación de Troponina I precedió en al menos 3 meses la presencia de disfunción ventricular izquierda, y también predijo el grado y severidad de esta futura disfunción ventricular (29). Más aún, los pacientes con troponina I persistentemente elevadas se asociaron a una mayor probabilidad (85%) de presentar eventos cardíacos mayores en el plazo de un año. En cambio, los pacientes con resultados de troponina I persistentemente negativos, tienen muy bajo riesgo de cardiotoxicidad y no presentaban eventos cardíacos mayores en el primer año después de terminada la quimioterapia (29). De manera que las determinaciones de troponina I permiten separar a aquellos pacientes con mayor riesgo de presentar cardiotoxicidad de un grupo de más bajo riesgo. Otro estudio del mismo grupo, realizado en 251 mujeres con cáncer de mama tratadas con trastuzumab (92% precedido por antraciclinas), demostró que la elevación de troponina I identificó a los pacientes con mayor riesgo de presentar cardiotoxicidad, a aquellos que presentaron una disfunción ventricular irreversible y quienes presentaron eventos cardíacos mayores (45). En este grupo de pacientes, la irreversibilidad se asoció al uso previo de antraciclinas. En resumen, la presencia o ausencia de troponinas en sangre detecta a los sujetos de alto y bajo riesgo de presentar cardiotoxicidad, y permitiría seleccionar a aquellos pacientes que requieren un seguimiento ecocardiográfico cercano de aquellos que no lo necesitan.
Péptidos natríuréticos cardíacosTanto el péptido auricular natriuréti-co (ANP) como el péptido natriurético cerebral (BNP) son sintetizados, depositados y secretados desde el corazón en respuesta a sobrecarga auricular o ventricular. Se ha utilizado el péptido natriurético tipo B como el amino terminal de su precursor (NT-proBNP) como marcador de disfunción ventricular y se han asociado en generar estos marcadores con el comienzo de la cardiotoxicidad. Los resultados de diversos estudios son dispares. La elevación de péptidos natriuréticos cardíacos se ha asociado a disfunción ventricular tanto sistólica como diastólica. En un estudio realizado en 26 pacientes con diversos cánceres tratados con antraciclinas se observó aumento de proBNP cercana a 3 veces a las 24 horas de cada ciclo, retornando a valores normales antes de la siguiente cura (62). Pero en este estudio no se evaluó la correlación con disfunción ventricular. En otro estudio, en 28 pacientes con linfoma no Hodgkin que recibieron doxorubicina en altas dosis, se demostró que la aparición de disfunción ventricular izquierda se asoció a elevación plasmática de ANP, NT-proANPy BNP (63). Esta asociación fue más marcada con un deterioro de la función diastólica más que con disfunción sistólica. En un estudio con mayor número de pacientes el BNP no permitió anticiparse a la aparición de disfunción ventricular izquierda (64). En 79 pacientes con cáncer de mama tratadas con antraciclinas, el BNP predijo el desarrollo de insuficiencia cardíaca con una sensibilidad de 83% y una especificidad de 90% (65). En resumen, los péptidos natriuréticos cardíacos se asocian a la disfunción ventricular izquierda sistólica y diastólica y a la insuficiencia cardíaca clínica, pero falta más evidencia para asegurar su rol como marcador precoz que permita predecir el grupo de pacientes que van a presentar cardiotoxicidad.
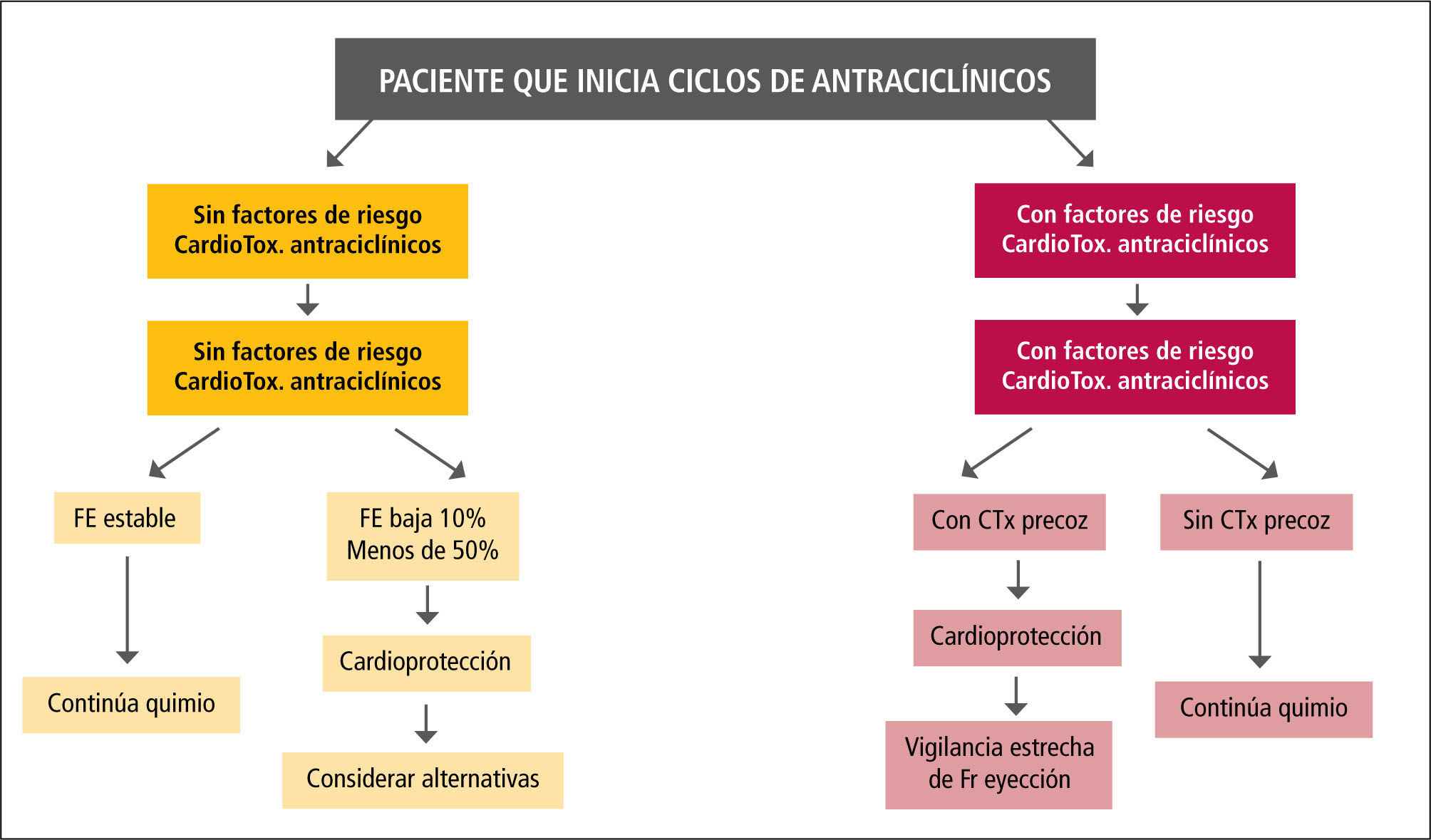
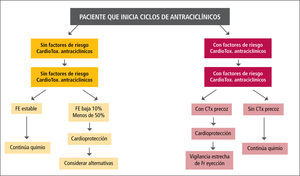
Monitorización y manejo de pacientes que reciben quimioterapia potencialmente cardiotóxica (45,52,66-69)Monitorización y manejo de pacientes que reciben antraci-clínicosSe debe efectuar examen cardiovascular, efectuar ECG, ECO y Troponinas basales. Investigar factores de riesgo de cardiotoxicidad (FRC) frente a estos fármacos: Edad bajo 35 años y sobre 65 años; historia personal de enfermedad coronaria; fracción de eyección bajo 55%; sugerencia de alteración estructural en ECG (HVI; BCRI); radioterapia tórax; dosis acumulada sobre 300mg/m2; administración de otros fármacos cardiotóxicos, como ciclofosfamida. La frecuencia de controles ecocardiográficos y biomarcadores dependerá de la existencia de FRC (ver Figura 3). En pacientes sin FRC, se harán controles cada tres meses si los ciclos se mantienen por periodos mayores de tiempo. En pacientes que tienen baja de la FE, se inician medidas de cardioprotección (beta-bloqueo con Carvedilol y ARAII o IECA). Si la caída de la FE es franca, y si el paciente tiene síntomas, se debe interrumpir los antraciclíncos, se deben considerar alternativas terapéuticas. En pacientes con FRC, se harán controles de ECO y biomarcadores antes de ciclos alternos: por ejemplo, ECO antes de ciclos impares, Troponina antes de ciclos pares. Si se detecta cardiotoxicidad precoz (paciente asintomático, con FE estable, pero con alteración de strain o disfunción diastólica o alza de troponinas), se iniciará cardioprotección, con vigilancia estrecha de FE. Seguimiento alejado de pacientes que no requieren más ciclos por el momento: evaluación clínica y Eco cada 6 meses por dos años y luego control anual, en pacientes que alcanzaron o superaron 300mg/m2 o dosis menores acumuladas con FRC y con cardiotoxicidad precoz.
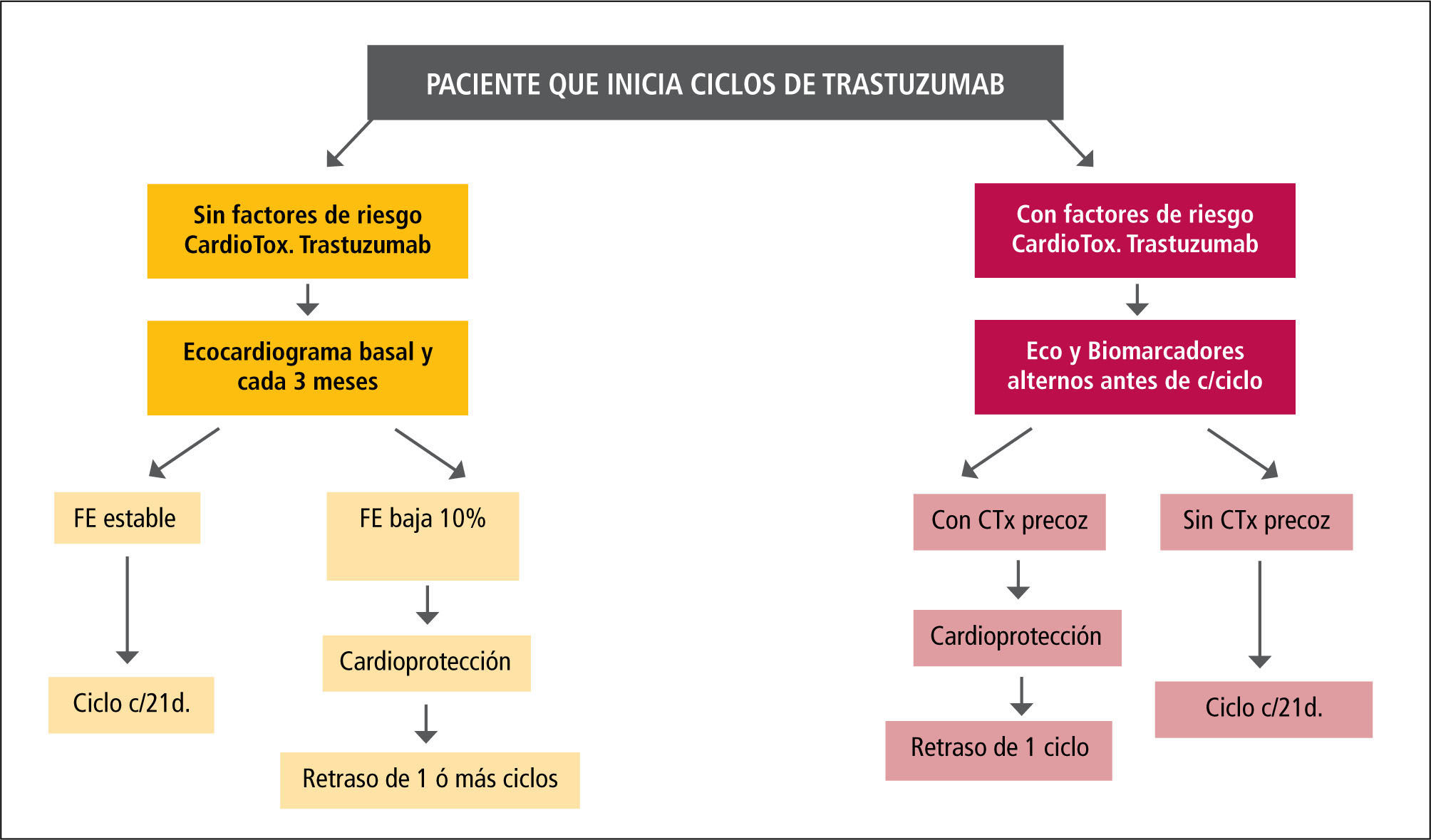
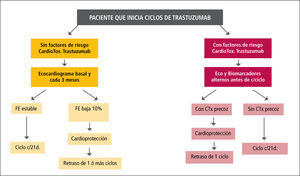
Monitorización y manejo de pacientes que reciben trastuzumabSe debe efectuar examen cardiovascular, efectuar ECG, ECO y Troponinas basales. Investigar factores de riesgo de cardiotoxicidad (FRC) frente a trastuzumab: uso previo (sobre todo, reciente) de an-traciclínicos; insuficiencia renal crónica; fumador; hipertensión arterial; historia personal de enfermedad coronaria; fracción de eyección bajo 55%; sugerencia de alteración estructural en ECG. Contraindicaciones cardiovasculares para recibir Trastuzumab: arritmias malignas recurrentes no controladas; fracción de eyección bajo 30%; hipertensión arterial severa retractaría. La frecuencia de controles ecocardiográficos y biomarcadores dependerá de la existencia de FRC (ver Figura 4). En pacientes sin FRC, se harán controles cada 3 meses mientras duren los ciclos (habitualmente, cada 21 días por un año). En pacientes que tienen baja de la FE, se inician medidas de cardioprotección (betabloqueo con Carvedilol y ARAII o IECA), y se retrasan los ciclos necesarios para permitir recuperación de la función sistólica. Si no se recupera la función sistóli-ca, se deberá considerar la suspensión o baja de la dosis. En pacientes con FRC, se harán controles de ECO y biomarcadores antes de ciclos alternos: por ejemplo, ECO antes de ciclos impares, Troponina antes de ciclos pares. Si se detecta cardiotoxicidad precoz (paciente asintomático, con FE estable, pero con alteración de strain o disfunción diastólica o alza de troponinas), se iniciará cardioprotección, con vigilancia estrecha de FE, retrasando un ciclo por lo menos.
Pacientes que usarán fármacos que pueden provocar isquemia miocárdicaConsiderar uso profiláctico de Aspirina a dosis bajas, o de doble antiagregación plaquetaria, según presencia de riesgo asociado. En caso de presentar síntomas o signos isquémicos, manejar según las normas de síndrome coronario agudo. Considerar uso de esquemas oncológicos alternativos.
Pacientes que usarán fármacos que se asocian a una mayor incidencia de tromboembolismo venosoConsiderar uso profiláctico con HBPM (enoxaparina), seguido de tratamiento anticoagulante oral. En caso de presentar TVP/TEP, manejar según las normas correspondientes. Considerar uso de esquemas oncológicos alternativos.
Pacientes que usarán fármacos que se asocian a una prolongación del Intervalo QTEn caso de existir antecedentes personales o familiares de arritmias po-tencialmente malignas, considerar esquemas oncológicos alternativos, monitorizar con frecuencia el Intervalo QTc. Suspender quimioterapia si el intervalo QTc supera los 500ms, o si hay aumento de 60ms respecto del Intervalo QTc basal.
Los autores declaran no tener conflictos de interés, con relación a este artículo.