Uno de los grandes obstáculos que presenta el trasplante de órganos es el tiempo en que se puede preservar el órgano en isquemia en un estado viable antes de ser implantado. Con la utilización de la técnica estándar de conservación estática en frío (4°C) los tiempos de conservación se limitan a 6-8 horas, tiempo conocido como tiempo de isquemia fría. Este comienza desde que se realiza el “cross clamp” o cese completo de la circulación en el donante hasta la irrigación del órgano implantado en el receptor.
Recientemente se han publicado estudios preclínicos y clínicos que demuestran beneficios de conservación del injerto a 10°C en comparación con el almacenamiento estándar, además de permitir una prolongación de los tiempos de isquemia con iguales estándares de seguridad para el receptor. Estas nuevas líneas de desarrollo apuntan a facilitar la logística del trasplante pulmonar transformándolo de una cirugía de urgencia a un proceso quirúrgico semi electivo. Dicho cambio ha demostrado beneficios en seguridad quirúrgica y resultados de sobrevida del implante aumentando los tiempos de preservación y abriendo incluso la posibilidad de abrir nuestras fronteras para programas internacionales.
One of the great obstacles for organ transplantation is the time in which the ischemic organ can be preserved in a viable state before being implanted. With the use of the standard static cold preservation technique (4°C) preservation times are limited to 6-8hours, a time known as cold ischemia time. This begins from the moment the “cross-clamp” or complete cessation of circulation in the donor is performed until the organ is irrigated in the recipient.
Preclinical and clinical studies have recently been published demonstrating benefits of graft conservation at 10°C compared to standard storage, in addition to allowing ischemia times to be prolonged with the same safety standards for the recipient. These new lines of development aim to facilitate the logistics of lung transplantation, transforming it from an emergency surgery to a semi-elective surgical procedure, a change that has demonstrated benefits in surgical safety and even in implant survival results.
El trasplante de pulmón es actualmente la única intervención que proporciona mayor sobrevida a los pacientes con enfermedad pulmonar en etapa terminal. Sigue estando limitado por la escasez de órganos de donantes utilizables. Aunque el número de pacientes que esperan recibir un trasplante de pulmón sigue aumentando, solo el 20% de los pulmones de donantes cumplen los criterios funcionales para el trasplante1. Esta subutilización de órganos de donantes, combinada con el creciente número de pacientes que los necesitan, representa un factor importante que contribuye a la mortalidad en las listas de espera2.
Muchas de las condiciones que hacen que los pulmones del donante sean rechazados para el trasplante son potencialmente reversibles, pero los métodos convencionales de preservación del pulmón del donante se basan en la isquemia estática fría no fisiológica y la correcta evaluación del pulmón donado como también en la reparación y recuperación endógenas del injerto posterior a su implantación3. El proceso de isquemia seguido de reperfusión puede tener consecuencias devastadoras, dada por una condición conocida como síndrome de isquemia-reperfusión pulmonar (SIRP), siendo esta la principal causa de disfunción primaria del injerto (PGD, por sus siglas en inglés) y por consiguiente de morbilidad y mortalidad en el período postoperatorio4. Por lo tanto, una mayor comprensión del mecanismo de SIRP y de las estrategias para reducir su incidencia puede mejorar la función del órgano trasplantado y el resultado a corto y largo plazo del trasplante de pulmón.
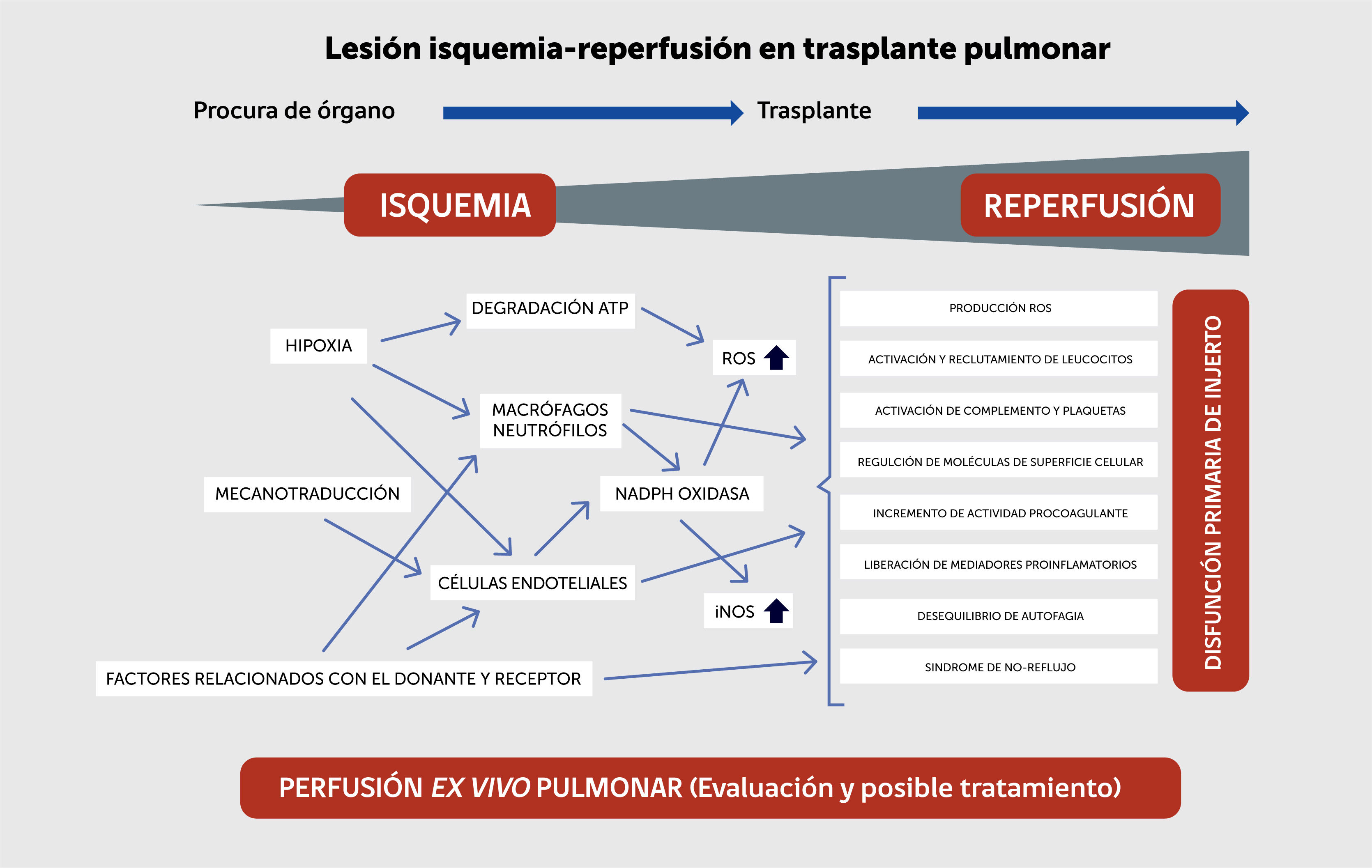
Síndrome de isquemia-reperfusión pulmonar (SIRP) y disfunción primaria de injerto (PGD)Durante la isquemia prolongada sin ventilación, la hipoxia hace que se detenga el metabolismo aerobio y la síntesis de la adenosina trifosfato (ATP) mitocondrial, activándose el anaerobio, lo cual produce acidosis y depleción de ATP, que se degrada hasta productos finales como la xantina y la hipoxantina. La depleción de ATP produce una disfunción de las bombas ATP-dependientes, lo que genera edema celular y una salida de calcio al citosol, activando enzimas calcio-dependientes como las fosfolipasas, y proteasas y endonucleasas, que conducen a la lisis celular5. Esta pérdida de mecanotransducción en arteriolas y capilares por ausencia de flujo sanguíneo, induce a macrófagos y células endoteliales a generar especies reactivas de oxígeno (ROS, por sus siglas en inglés) y a producir citoquinas proinflamatorias, y moléculas de adhesión6,7. Con la reperfusión, se restaura el flujo sanguíneo y la consecuente oxigenación, este exceso de O2 da lugar a la formación masiva de ROS, lo que produce un importante estrés oxidativo, que junto con los productos tóxicos generados durante la isquemia, alteran la función metabólica de las células pulmonares8,9 y como consecuencia producen PGD como se puede apreciar en la figura 1.
Alteraciones pulmonares durante el síndrome de isquemia y reperfusión.
Modificado de den Hengst et al.5.
Existen múltiples estrategias para prevenir el SIRP y se basan en la eliminación o reducción de los factores de riesgo potencialmente modificables tanto de los donantes como de los receptores. Asimismo hay sistemas que se centran en los métodos de reperfusión y ventilación de los injertos pulmonares y de la preservación pulmonar6,10–12.
El concepto de enfriamiento de órganos para reducir los efectos nocivos de la actividad metabólica en condiciones isquémicas es la base de la preservación de órganos. La conservación estática en frío a 4°C se ha utilizado durante décadas para permitir la supervivencia de los pulmones durante el transporte al receptor. El objetivo de mantención en frío es mantener la viabilidad celular reduciendo el metabolismo celular, sin embargo, la conservación estática en frío acaba provocando daños celulares por diversas razones, entre ellos la disfunción mitocondrial13–15. Para reducir estos daños causados por desequilibrio iónico, los órganos sometidos a preservación estática en frío se irrigan con soluciones de preservación con bajo contenido en potasio y se ventilan los pulmones con O2 para reducir las lesiones isquémicas. Esta es la razón de que mientras se realiza la extracción o procuramiento del pulmón donado, este debe estar siempre ventilado con adecuadas presiones y concentraciones de O216. A pesar de mejorar la calidad pulmonar, la conservación estática en frío sólo permite el almacenamiento a corto plazo, en la práctica actual los pulmones sólo se utilizan si la conservación estática en frío es inferior a 8 horas17. Lograr un aumento seguro de estos tiempos de isquemia, permitiría una logística en el trasplante que llevaría a aumentar nuestras áreas de captación de pulmones con el consecuente aumento de órganos ofrecidos y utilizados.
Facilitando logística: aumentando tiempos de isquemia y número de trasplantesLa actual logística del trasplante pulmonar presenta múltiples barreras, en relación a la distancia y organización de equipos, que dificultan su realización y aumentan el rechazo de órganos con el consecuente aumento de mortalidad en nuestras listas de espera.
La prolongación de los tiempos de isquemia puede llevar a múltiples ventajas; dentro de estas podemos mencionar la posibilidad de extender los límites geográficos de donación pensando incluso en programas internacionales, tener mas tiempo para optimizar el matching inmunológico entre donante y receptor, y acercarse a la posibilidad de hacer del trasplante una cirugía semi-electiva en vez de la cirugía de urgencia que es hoy18.
Tener la capacidad de hacer trasplantes pulmonares en forma más organizada lleva a la optimización de los recursos humanos y físicos de las instituciones y mejoramiento de resultados. Publicaciones han demostrado que los trasplantes realizados durante la noche están asociados con mayores riesgos de eventos adversos postoperatorios y a 5 años disminución de sobrevida y aumento de rechazo crónico o bronquiolitis obliterante comparado con los trasplantes realizados durante el día19.
Con miras a buscar soluciones a la logística y tiempos de isquemia es que recientemente se ha retomado el estudio en cuanto a las ventajas de utilizar almacenamiento estático en frío a 10°C en pulmones de donantes. Esto se postuló hace más de 30 años20 en ensayos experimentales en animales demostrando que el almacenamiento estático de los pulmones a 10°C permite una excelente función del injerto después de un periodo de almacenamiento prolongado de más de 24 horas17,20.
Preservación pulmonar a 10°CLos estudios iniciales que demostraron mejores resultados con preservación a 10°C versus a 4°C no prosperaron en el paso a la clínica aparentemente por falta de información sobre los mecanismos celulares subyacentes que explican el beneficio de preservación a 10°C. Estos mecanismos han podido ser estudiados de mejor manera gracias a modelos animales con perfusión pulmonar ex vivo (EVLP, por sus siglas en inglés)18, en los que se ha evidenciado que con preservación pulmonar a 10°C se logran mejores parámetros funcionales como menor presión de vía aerea, mayor compliance pulmonar, mejores índices de oxigenación y mejor fisiología pulmonar, comparando con preservación convencional a 4°C. Además, se evidencia que en preservación a 10°C los metabolitos protectores (N-acetylglutamina, itaconato, glutamina) mitocondriales se encuentran en mayor nivel y que disminuyen los marcadores de injuria mitocondrial. Las líneas de estudio han demostrado que la preservación utilizando la técnica de preservación estática en frío (CSP, por sus siglas en inglés) a 10°C por sí sola no logra mantener la función de un injerto por un periodo de 72 horas. Sin embargo, CSP a 10°C con protocolo de EVLP intermitente ha logrado adecuados resultados en modelos animales después de 72 horas.
Teniendo en cuenta lo anteriormente expuesto, el Grupo de Toronto evaluó la conservación del injerto a 10°C intercalado con ventanas de EVLP (Figura 2).
Protocolo de almacenamiento a 10°C con EVLP intermitente.
Modificado de Ali et al.18.
El protocolo diseñado, emula los tiempos de isquemia fría actualmente utilizados (6 horas a 4°C) seguidos de 18 horas de CSP a 10°C, que emula la preservación estática que se realizaría en caso de utilización de trasplante semi-electivo o arreglos logísticos. Después de cada ciclo de EVLP, los pulmones se desconectaron del circuito mediante un sistema de conexión rápida y el circuito de perfusión se almacena en una cámara frigorífica a 4°C durante la noche para su uso al día siguiente. También se agregó un dispositivo de irradiación ultravioleta C al circuito de perfusión estándar para evitar la contaminación de éste durante el uso de varios días. Durante los 2 ciclos de EVLP, los parámetros de la función pulmonar ex vivo permanecieron estables. El aumento medio de peso pulmonar fue de sólo 96 gramos±23 gramos después del primer ciclo de EVLP y de 160±56 gramos después del segundo ciclo, en donde el aumento de peso se correlacionó con presencia de edema pulmonar. Las imágenes revelaron patrones de perfusión estables durante ambos períodos sin evidencia de formación de edema pulmonar masivo18.
Finalmente, se evaluó la función pulmonar realizando un trasplante de pulmón único izquierdo en un animal receptor, seguido de 4 horas de reperfusión del injerto. Se monitorizó la función pulmonar a cada hora posterior al trasplante y se pinzó la arteria pulmonar derecha al final de la reperfusión para medir la oxigenación del injerto trasplantado independiente. Las estructuras histológicas pulmonares se mantuvieron durante todo el período de preservación y al final del período de perfusión. Los pulmones conservados durante 3 días utilizando la CSP a 10°C con el EVLP diario intermitente de 4 horas tuvieron una excelente función del injerto después del trasplante y no se observó edema pulmonar en la evaluación broncoscópica después del trasplante. Según las propiedades de EVLP, se plantea la hipótesis de que el uso intermitente de EVLP puede proporcionar un mejor mantenimiento de los metabolitos clave del tejido en comparación con el almacenamiento estático en frío sólo.
Aunque EVLP se recomienda a través de datos de observación, se sabe poco sobre el mecanismo por el cual EVLP puede permitir períodos prolongados de conservación. Un concepto central de EVLP es que la preservación del órgano del donante durante el período de EVLP ocurre en normotermia, por lo tanto, con actividad metabólica completa para mitigar potencialmente los daños celulares.
Se debe precisar que el estudio presenta limitaciones en cuanto a los pulmones utilizados en el estudio, puesto que no presentaban ninguna lesión basal. Además, el estudio solo se prolongó hasta finalizado el tiempo de reperfusión del órgano, por lo que no se estima potenciales morbilidades posteriores. Sin duda este estudio evidencia el potencial de preservación de órganos por un tiempo mas prolongado, lo que permitiría mejorar la logística de trasplantes, derrumbar barreras geográficas y da oportunidad para explorar el concepto de banco de órganos. A su vez, permitiría acceder a otros beneficios inherentes como lo es mejorar la coincidencia inmunológica entre donante y receptor.
Con mayor conocimiento sobre la fisiología de protección mitocondrial, las líneas de investigación apuntaron a ensayos clínicos con una primera cohorte de 5 pacientes en quienes se realizó el implante luego de una media de preservación de 10,4 horas (9,92 - 14,8) para el primer pulmón y 12,1 horas (10,9 - 16,5) para el segundo pulmón. No hubo mortalidad en los primeros 30 días ni PGD grado 3 en las primeras 72 horas post trasplante, con un promedio de ventilación mecánica invasiva de 1,73 días (0,24 a 6,71), sin requerimientos de oxigenación por membrana extracorpórea (ECMO, por sus siglas en inglés) ni óxido nítrico en el post trasplante. El promedio de tiempo de hospitalización post trasplante fue de 17 días (rango 14 a 26)14.
Recientemente, se publicó un ensayo prospectivo no aleatorizado multicéntrico con 70 pacientes en donde se trasplanta de forma diferida; el criterio principal de valoración fue la incidencia de PGD grado 3 a las 72 horas post trasplante, en pacientes sometidos a trasplante pulmonar luego de un periodo de prolongación intencional (mediana de 7 horas). El protocolo trataba de un tiempo máximo de conservación permitido de 12 horas (definido como desde el lavado en frío del donante hasta el inicio de la anestesia del receptor). Una vez adquirido el órgano del donante, se pasaba a CSP a 4°C, luego de esto era inmediatamente transferido a CPS a 10°C y posteriormente se implantaba el injerto. Ningún injerto se sometió a EVLP21.
De los resultados del estudio destaca que la mediana de edad en el grupo de estudio versus el control fue la misma, 52 años, la relación PaO2/FiO2 fue de 430mmHg en ambos grupos. La edad y el índice de masa corporal de los receptores fueron las mismas en ambos grupos. De los puntos finales del estudio se evidenció que la incidencia de PGD grado 3 a las 72 horas en el grupo estudio fue de 5,7% y en los controles emparejados fue de 9,7%, la incidencia de ECMO fue relativamente mayor en el grupo control y la mediana de estadía en la Unidad de Cuidados Intensivos (UCI) fue similar en ambos grupos. En un seguimiento de 385 pacientes, la tasa de supervivencia al año fue de 94% en el grupo estudio y de 87% en el grupo control.
Si bien el estudio evidencia la factibilidad de realizar un trasplante diferido, con un organo en CSP a 10°C, no evidencia que si se hubiese mantenido de forma convencional hubiese tenido resultados distintos. Dado esto, se plantea la necesidad de estudios aleatorizados que permitiesen demostrar la superioridad del enfoque de CSP a 10°C, transformado al trasplante pulmonar, con las mejoras ya expuestas, en un procedimiento semi-electivo.
ConclusionesLos avances que se han desarrollado en el tema de perfusión pulmonar han demostrado una mayor tasa de utilización de pulmones donados. La experiencia inicial de nuestro equipo con perfusión de pulmones rechazados por todos los equipos y recuperados en EVLP22, con adecuadas sobrevidas al año, ha dado algunas luces de la utilidad de este procedimiento. Se agrega a esto la preservación pulmonar a 10°C que esboza la posibilidad de mayores tiempos de isquemia y un trasplante pulmonar semi-electivo.
En nuestra realidad latinoamericana, con bajas tasas de donación y programas de bajo volumen, este tipo de avances nos permiten pensar en mejoramiento de las logísticas del trasplante, pudiendo incluso pensar en programas internacionales y bancos de perfusión que lograrían reducir costos y aumentar nuestra utilización de los escasos pulmones donados.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.