Este artículo analiza el rol de las imágenes en diferentes síndromes neoplásicos hereditarios, incluyendo mama, colon y neoplasias endocrinas múltiples.
Las mujeres con mutaciones genéticas asociadas a mayor susceptibilidad de desarrollar cáncer de mama pueden optar a la vigilancia con imágenes desde edades tempranas, detectando así precozmente la enfermedad. En este grupo de mujeres, la mamografía ha mostrado un bajo rendimiento, mientras que la resonancia mamaria se ha establecido como el principal método de screening.
El cáncer colorrectal es una patología muy frecuente en nuestra población. Un 2-5% constituyen síndromes hereditarios, de los cuales el más frecuente es el Síndrome de Lynch o cáncer colorrectal hereditario no polipósico, seguido de la Poliposis Adenomatosa Familiar y otras poliposis. La importancia de detectar estos síndromes está en identificar los individuos en riesgo, y realizar métodos de tamizaje apropiados para una detección precoz del cáncer.
Las Neoplasias Endocrinas Múltiples incluyen entre sus manifestaciones los tumores paratiroideos, los feocromocitomas, los tumores gastroenteropancreáticos y el cáncer medular de tiroides. Estas lesiones presentan características fisiológicas como expresión de receptores o hiperfunción celular que permiten obtener imágenes con técnicas de Medicina Nuclear que actualmente se denominan Imágenes Moleculares.
This article discusses the role of images in different Neoplastic Syndromes, Hereditary including breast, colon, and Multiple Endocrine Neoplasia. Women with genetic mutations associated with greater susceptibility of developing breast cancer are eligible for surveillance with images from an early age, thus detecting early disease. In this group of women, mammography has shown poor performance, while the breast resonance has been established as the primary method of screening.
Colorectal cancer is very frequent in our population. 2-5% of them constitute hereditary syndroms, the most frequent of them being Lynch Syndrome or hereditary non polyposic colorectal cancer. It is very important to detect these syndroms in order to identify individuals at risk, as well as to do apropiate screening and early detection of cancer.
Multiple Endocrine Neoplasia include among their clinical manifestations parathyroid tumours, pheochromocytoma, gastroenteropancreatic tumours and medullary thyroid carcinoma. All these entities may be imaged with Nuclear Medicine techniques currently called Molecular Images, which target specific receptors or hyper functioning cells, in a physiological approach to diagnostic images.
La evaluación genética en pacientes con cáncer o con un riesgo aumentado de cáncer se ha ido incorporando con mayor frecuencia en su manejo. En este artículo se analiza el rol de las imágenes como estrategia de detección temprana de la enfermedad o como examen de diagnóstico en algunos de los síndromes neoplásicos hereditarios más estudiados, incluyendo cáncer de mama, cáncer colorectal y neoplasias endocrinas múltiples.
CÁNCER DE MAMA HEREDITARIOUna historia familiar de cáncer de mama es uno de los principales factores de riesgo para desarrollar esta enfermedad; se estima que los factores hereditarios pueden jugar un rol en más del 25% de las pacientes con cáncer de mama. Se han identificado múltiples alteraciones genéticas asociadas con alto, moderado y leve incremento del riesgo de desarrollar cáncer de mama. Mutaciones genéticas asociadas a mayor susceptibilidad de desarrollar cáncer de mama, como BRCA1, BRCA2, TP53 y PTEN, se asocian a un riesgo acumulativo durante la vida de 50 a 85% y se caracterizan por una presentación de la enfermedad en edades jóvenes. Sin embargo, estas alteraciones genéticas ocurren sólo en un 5% de las pacientes con cáncer de mama.
Las mujeres con alto riesgo de contraer cáncer de mama tienen la opción de reducir el riesgo de morir por esta enfermedad con el seguimiento a través de imágenes desde edades tempranas para detectar precozmente la enfermedad, como una estrategia alternativa a la mastectomía profiláctica.
Estratificar a las mujeres según su riesgo, presenta desafíos y oportunidades para el screening diferentes a los de la población de riesgo normal. En este grupo de mujeres de alto riesgo de desarrollar cáncer de mama, la sensibilidad del test de screening se verá afectada por el hecho de ser mujeres jóvenes y, por ende, con un mayor porcentaje de mamas densas y, también, por la ocurrencia de cánceres de mama con subtipos histológicos diferentes.
SÍNDROME DE CÁNCER DE OVARIO Y MAMA HEREDITARIO
La mayoría de los cánceres de mama hereditarios y en particular el síndrome de cáncer de ovario y mama hereditario son atribuidos a mutaciones en BRCA1 y BRCA2 y se relacionan a un desorden autosómico dominante. La prevalencia de la enfermedad asociada a mutación en BRCA1 y BRCA2 se ha estimado en 1 en 300 y 1 en 800 respectivamente en la población general y presenta una frecuencia mayor en la población judío askenazi. El riesgo de desarrollar un cáncer de mama durante la vida es similar para las portadoras de mutación BRCA1 y BRCA2, siendo de un 50 a 80% aproximadamente.
En las portadoras de mutaciones BRCA2 los cánceres de mama son receptores de estrógenos positivos en un 65 a 79% de las veces y los cánceres lobulillares infiltrantes se presentan con mayor frecuencia, siendo este tipo histológico de mayor dificultad para el diagnóstico en mamografía. En las portadoras de mutación BRCA1, los cánceres son generalmente de tipo ductal, infrecuentemente son receptores de estrógenos positivo y la mayoría son triple negativo, con una tasa de crecimiento más rápida y con mayor porcentaje de cánceres de intervalo que los de la población general, presentan un alto porcentaje de tumores de márgenes bien circunscritos e infrecuente presentación de masa con calcificaciones (Figura 1a,b,c)1–3. El periodo preclínico detectable al screening de los cánceres mamarios es de 1-4 años en las portadoras de mutación BRCA1, a diferencia del periodo de 2-7 años en las portadoras de mutación BRCA2 4.
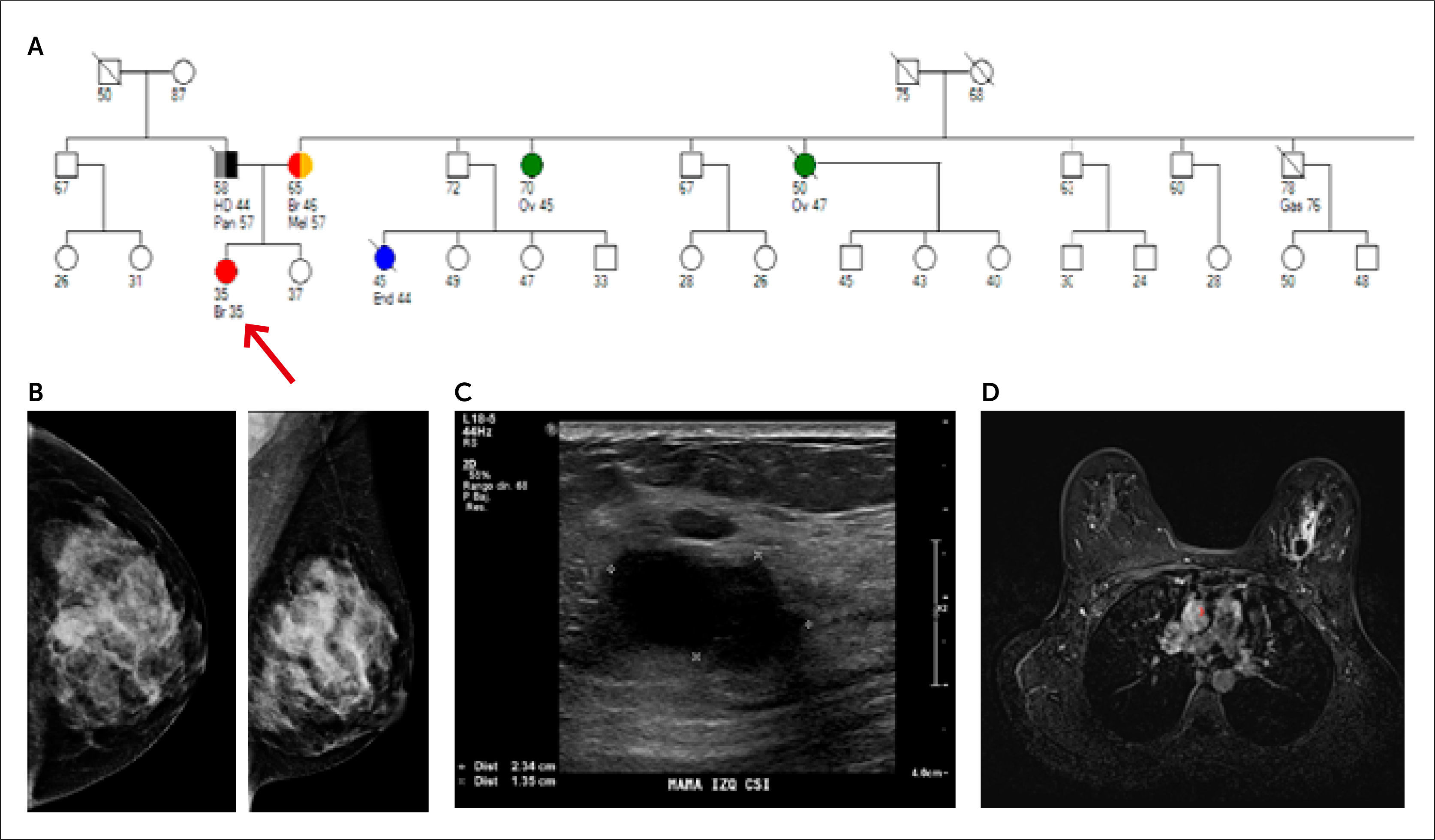
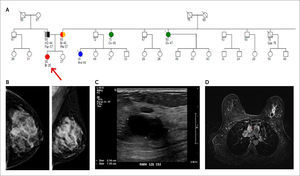
PACIENTE DE 35 AÑOS CON ANTECEDENTES FAMILIARES DE CÁNCER DE MAMA Y DE OVARIO
Consulta por nódulo palpable en UCS de la mama izquierda. El estudio histológico muestra un carcinoma ductal infiltrante indiferenciado, grado nuclear 3, triple negativo. Estudio genético demostró que es portadora de mutación BRCA1.
(A) Pedigree. caso índice (flecha)
(B) Mamografía digital izquierda proyecciones cráneo caudal y oblicua. Nódulo isodenso, parcialmente delimitado, de 25mm, ubicado en UCS de la mama izquierda.
(C) Ultrasonido: Nódulo ovalado, hipoecogénico, parcialmente bien delimitado y con refuerzo acústico posterior.
(D) Resonancia mamaria: Nódulo ovalado con impregnación precoz en anillo y prolongación hacia anterior.
El riesgo de desarrollar cáncer de ovario varía entre un 11 a 62% en las portadoras de mutación BRCA1 y de 10 a 20% en las portadoras de mutación BRCA2. También tienen mayor riesgo de desarrollar otras neoplasias malignas, especialmente en las portadoras de mutación BRCA2 como cáncer pancreático, melanoma, cáncer peritoneal y trompas de falopio, cáncer de mama en hombre, cáncer de próstata y cáncer uterino, este último más frecuente en las portadoras de mutación BRCA1.
MÉTODOS DE SCREENING EN CÁNCER DE MAMAHEREDITARIO Y GRUPO DE ALTO RIESGO:
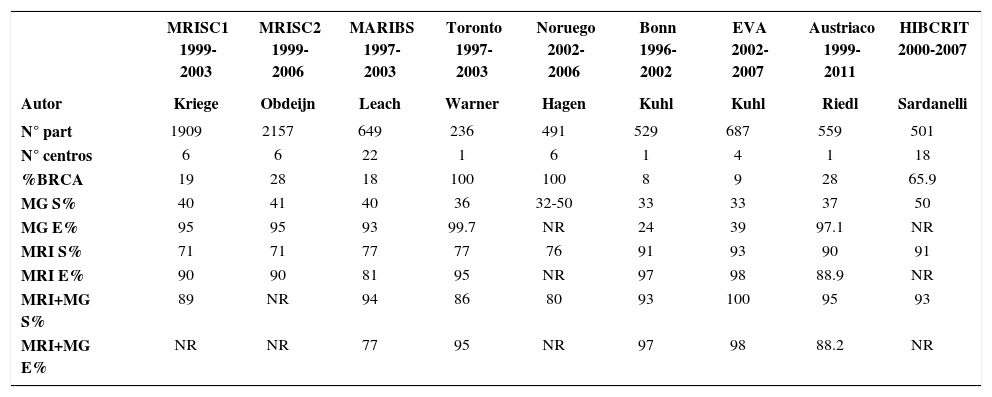
Varios estudios retrospectivos y prospectivos demostraron que la sensibilidad de la mamografía (MG) como método de screening en las mujeres de alto riesgo, sola o en combinación con examen clínico o ultrasonido, fue baja en comparación con los resultados del screening mamográfico en la población general entre los 50 y 75 años. Especialmente, en las portadoras de mutaciones BRCA1 y BRCA2, los cánceres de intervalo ocurrieron con mayor frecuencia que en la población de riesgo normal, con una tasa de 40 a 60% aproximadamente 5–7. Desde entonces comenzaron los estudios con métodos de imágenes complementarios y se introdujo la resonancia mamaria (RM) como un método adicional a la MG de screening. Resultados de diferentes ensayos clínicos prospectivos han sido publicados en los últimos 15 años y en todos la sensibilidad de la RM es superior, aproximadamente el doble, a la sensibilidad de la MG en el grupo de mujeres de alto riesgo 6–13. Tabla 1.
ENSAYOS CLÍNICOS PROSPECTIVOS QUE COMPARAN LA SENSIBILIDAD Y ESPECIFICIDAD DE LA RESONANCIA MAMARIA Y DE LA MAMOGRAFÍA EN EL SCREENING DE MUJERES DE ALTO RIESGO
| MRISC1 1999-2003 | MRISC2 1999-2006 | MARIBS 1997-2003 | Toronto 1997-2003 | Noruego 2002-2006 | Bonn 1996-2002 | EVA 2002-2007 | Austriaco 1999-2011 | HIBCRIT 2000-2007 | |
|---|---|---|---|---|---|---|---|---|---|
| Autor | Kriege | Obdeijn | Leach | Warner | Hagen | Kuhl | Kuhl | Riedl | Sardanelli |
| N° part | 1909 | 2157 | 649 | 236 | 491 | 529 | 687 | 559 | 501 |
| N° centros | 6 | 6 | 22 | 1 | 6 | 1 | 4 | 1 | 18 |
| %BRCA | 19 | 28 | 18 | 100 | 100 | 8 | 9 | 28 | 65.9 |
| MG S% | 40 | 41 | 40 | 36 | 32-50 | 33 | 33 | 37 | 50 |
| MG E% | 95 | 95 | 93 | 99.7 | NR | 24 | 39 | 97.1 | NR |
| MRI S% | 71 | 71 | 77 | 77 | 76 | 91 | 93 | 90 | 91 |
| MRI E% | 90 | 90 | 81 | 95 | NR | 97 | 98 | 88.9 | NR |
| MRI+MG S% | 89 | NR | 94 | 86 | 80 | 93 | 100 | 95 | 93 |
| MRI+MG E% | NR | NR | 77 | 95 | NR | 97 | 98 | 88.2 | NR |
En el estudio de Riedl del grupo austriaco, la sensibilidad de la RM en el grupo de pacientes mutadas (BRCA1 y 2) fue de 81% versus 43% de la MG y 37% del ultrasonido mamario, valores bastantes similares al resto de los estudios. En el grupo de alto riesgo hubo 18/40 cánceres detectados solo por RM, 2/40 solo por MG y ninguno detectado solo por ultrasonido mamario 12. Todos los carcinomas ductales in situ (CDIS) fueron diagnosticados por RM, a diferencia de lo reportado en los primeros estudios hechos con RM en esta población de alto riesgo 6, lo que probablemente se explique por la mejoría en los protocolos de resonancia y la curva de aprendizaje del diagnóstico de los CDIS por parte de los radiólogos. La RM fue menos específica que los otros exámenes, con la mayor tasa de falsos positivos.
Además de valores superiores de sensibilidad, el uso de la RM se ha asociado a beneficios en cuanto a tamaño tumoral y compromiso de linfonodos al momento del diagnóstico, cánceres de intervalo y sobrevida. En el estudio prospectivo de Warner en pacientes mutadas BRCA1 y 2, con una cohorte de 1275 mujeres, de las cuales 445 tuvieron screening con RM y 830 en el grupo control tuvieron screening con MG, se observó una menor tasa de cánceres de intervalo (cánceres que se presentan clínicamente entre dos rondas de screening) en la cohorte con RM, de 1/31 versus 38/77 en el grupo comparativo 11.
En el estudio del grupo MRISC con controles pareados por categoría de riesgo, año y edad de diagnóstico, en que el grupo control tuvo sólo screening con MG desde los 50 años, se observó que las pacientes que desarrollaron cáncer de mama y que estaban en seguimiento con RM tuvieron un diagnóstico más precoz, con un 87% de estadios menores a T2 versus 52% en el grupo control, más linfonodos negativos (69% versus 44%), menor uso de quimioterapia (39% versus 77%) y menor porcentaje de metástasis a distancia (9% versus 23%)14.
Si se compara la sobrevida entre las portadoras de mutación BRCA1 y BRCA2 que desarrollaron cáncer infiltrante de mama, la sobrevida total a 6 años fue alta en ambos grupos, pero algo menor en las portadoras de mutación BRCA1 (83.9% en BRCA1 versus 92.7% en BRCA2). En el grupo BRCA1 hubo un tamaño tumoral mayor, menos CDIS y más cánceres de intervalo y la edad de diagnóstico fue menor que en el grupo BRCA2 15.
La efectividad de un programa screening organizado fue reportada en el Ontario Breast Screening Program (OBSP) que comenzó en el año 2011 y cuyos resultados fueron presentados hasta marzo del año 2013, incluyó a mujeres de alto riesgo con mutación BRCA u otro gen predisponente a un riesgo aumentado de cáncer de mama, sus familiares no testeados y otros factores que aumenten el riesgo en >25%. En mujeres de entre 30 a 69 años con screening con RM y MG, la prevalencia de cáncer de mama en la primera ronda de screening fue de 30.8/1000 en las portadoras BRCA1/2 a diferencia de 6.9/1000 en las mujeres con historia familiar de ≥25%. Se encontró 74% de cánceres infiltrantes con RM, no hubo cánceres detectados por MG sola y un 65.7% fueron detectados solo por RM. Las rellamadas ocurrieron con mayor frecuencia por los hallazgos de la RM en la primera ronda, los que deberían disminuir en las siguientes rondas. Hubo un 5.1% (113/2207) de biopsias innecesarias como resultado de un falso positivo secundario al hallazgo de la RM 16.
Con el uso de la RM en el seguimiento de las portadoras de mutación BRCA1 y 2 se ha cuestionado la ganancia adicional de agregar la MG, especialmente en las portadoras de mutación BRCA1. En este grupo de mujeres, el screening con MG tiene un muy bajo rendimiento y, por otro lado, hay preocupación acerca del riesgo de la exposición a bajas dosis de radiación y riesgo de cáncer de mama 4,17,18. Considerando esto, surge la pregunta de si es necesario hacer MG si ya se cuenta con una RM, incluso si esta MG es digital, la que ha demostrado ser superior en sensibilidad a la MG convencional en mujeres jóvenes y con mamas densas 19. En un estudio multicéntrico publicado el año 2014, se evalúan portadoras de mutación BRCA1 que desarrollaron cáncer de mama desde enero 2003 a marzo 2013, comparando la sensibilidad de la RM y de la mamografía digital (MGD), obteniendo la RM una sensibilidad de 93.6% versus 51.1% de la MGD (p<0.001). Un 45% de los cánceres fueron detectados por RM sola, versus 2.1% por MGD sola (2 CDIS) y no hubo ningún beneficio al agregar la MGD en las mujeres de menos de 40 años, lo que también se había encontrado en el estudio combinado con los resultados de los grupos MARIBS y canadiense 4,20. Con la evidencia actual, hay grupos que proponen que el grupo de mujeres de menos de 40 años con mutación BRCA1 tengan un protocolo de seguimiento diferente al de las portadoras de mutación BRCA2, con RM desde los 25 años y empezar con MG no antes de los 40 años, a diferencia de lo que recomiendan las guías médicas, como la de la NCCN que establece su uso desde los 30 años para las mujeres mutadas BRCA1 y 2 20,26.
En tanto, hay estudios de análisis de costo efectividad que, considerando el riesgo de radiación, sugieren que lo más costo efectivo sería RM desde los 25 años y alternar MGD y RM cada 6 meses desde los 30 años, principalmente en las portadoras BRCA1. La alternancia de MG y RM cada 6 meses podría tener beneficios psicológicos, pero no hay estudios que muestren superioridad al efectuar la RM y MG juntas anualmente 21,22.
Después de los 50 años se debería continuar estudiando con RM a las mujeres portadoras de mutación, según los resultados de un meta análisis de 6 ensayos de screening en mujeres portadoras de mutación BRCA1/2, en el que se observó que la sensibilidad del screening combinando RM y MG en las mayores de 50 años es significativamente mejor que con MG sola (94% versus 38% p<0,001) y además la especificidad mejora en comparación con las menores de 50 años 23.
La ecografía mamaria no ha demostrado tener un beneficio al agregarla en el grupo de portadoras de mutación BRCA1/2, a menos que la RM no esté disponible o exista alguna contraindicación para realizarla 7,10,24.
En la Tabla 2 se resume las recomendaciones de guías clínicas para el seguimiento con imágenes en las portadoras de mutaciones de alta y moderada penetrancia. Para las mujeres con mutación BRCA que han sido tratadas de un cáncer de mama, el screening del tejido mamario remanente debería continuar con RM y MG 25,26.
RECOMENDACIONES DE GUÍAS CLÍNICAS PARA EL SEGUIMIENTO CON IMÁGENES EN LAS PORTADORAS DE MUTACIONES DE ALTA Y MODERADA PENETRANCIA
| MUTACIÓN | RECOMENDACIÓN |
|---|---|
| BRCA 1 y 2 | RM anual entre los 25 y 29 años MG y RM intercaladas cada 6 meses entre los 30 y 75 años |
| TP53 (Síndrome de Li-Fraumeni) | RM anual entre los 25 y 29 años MG anual a partir de los 30 años (controversial por riesgo de radiación acumulativa) |
| PTEN (Síndrome de Cowden) | MG y RM anual (puede ser intercaladas cada 6 meses) a partir de los 30-35 años o 5 a 10 años antes de le edad del familiar más joven diagnosticado |
| STK11 (Síndrome de Peutz-Jeghers) | RM anual a partir de los 25 años MG anual después de los 50 años |
| CDH1 (Síndrome de Cáncer Gástrico Difuso Hereditario) | MG anual desde los 30 años Considerar RM anual desde los 30 años |
| MSH2(Síndrome de Lynch) | Screening basado en la historia familiar dada la poca evidencia sobre el riesgo |
| PALB2 | MG y RM anual a partir de los 30 años |
| CHEK2 | MG y RM anual a partir de los 40 años |
| ATM | MG anual a partir de los 40 años Considerar RM a partir de los 40 años |
| NF1 | MG anual desde los 30 años Considerar RM desde los 30 a 50 años |
El cáncer colorrectal es una patología de alta incidencia en nuestra población. Un 30% de estos cánceres son heredables y un 2-5% constituyen síndromes hereditarios, con mutaciones de alta penetrancia, como el Síndrome de Lynch (HNPCC), la Poliposis Adenomatosa Familiar, que incluye el Síndrome de Gardner, poliposis asociada a MUTYH, poliposis hamartomatosas como el Síndrome de Peutz Jeghers, entre otros 27.
La importancia de la detección de estos síndromes radica en identificar los individuos en riesgo, realizar un tamizaje o screening apropiado, lo que llevará una detección precoz, prevención y un adecuado tratamiento. En este artículo nos referiremos a tres síndromes: Lynch, Poliposis Adenomatosa Familiar y Peutz Jeghers.
Síndrome de LynchEs el más frecuente de los síndromes hereditarios, constituyendo el 2-4% de los cánceres colorrectales 28. También se le denomina cáncer colorrectal hereditario no polipósico. Se hereda en forma autosómica dominante, producido por mutación en los genes reparadores del desapareamiento del DNA (MMR).
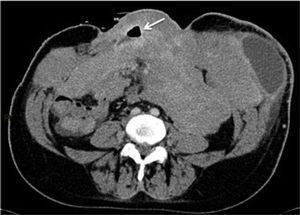
El riesgo de presentar cáncer colorrectal durante la vida es de aproximadamente un 80%. Se manifiesta a edades más tempranas, usualmente en el colon derecho, con mayor frecuencia de la variedad mucinosa (Figura 2).
Además, hay mayor riesgo de presentar otros cánceres como endometrio, ovario, tracto urinario, intestino delgado (en especial duodeno) y estómago.
Para su diagnóstico están los criterios de Amsterdam y los de Bethesda. En relación a los criterios de Amsterdam: tres o más miembros de la familia deben haber presentado cáncer de colon o alguno de los cánceres asociados, uno de los tres debe ser pariente en primer grado de otros dos, debe afectar como mínimo a dos generaciones, al menos una de las personas debe haber tenido menos de 50 años para el diagnóstico de la neoplasia, el tumor maligno debe ser confirmado con biopsia y debe descartarse poliposis adenomatosa familiar.
Si bien en este síndrome no hay evidencias de una poliposis, los tumores malignos en general se originan de adenomas en colon derecho.
Desde el punto de vista de las imágenes, exceptuando la colonoscopía, la modalidad de elección para el diagnóstico de cáncer de colon o bien de la presencia de pólipos clínicamente significativos es la Tomografía Computada, que puede ser realizada con técnica de colonoscopía virtual, en la cual se insufla vía endorrectal aproximadamente 1.5-2 litros de gas (CO2 o aire), o bien la Coloclisis, en que se administran 1.5-2 litros de agua vía endorrectal. Esta última es mejor tolerada, aunque la Colonoscopía virtual tiene una mayor sensibilidad en la detección de pólipos clínicamente significativos (mayores a 6mm). El cáncer se identifica como un engrosamiento focal o concéntrico de la pared colónica, con un mayor refuerzo que el resto de la mucosa tras la administración de contraste. El inicio del engrosamiento es abrupto, a diferencia de las lesiones inflamatorias, en que generalmente es gradual. También, se pueden detectar adenopatías mesentéricas y retroperitoneales, ascitis e implantes peritoneales, y metástasis hepáticas.
Para la detección de cáncer endometrial el examen de elección es la Resonancia Magnética, que además de diagnosticarlo lo etapifica, logrando identificar la profundidad de la infiltración tumoral en el útero, así como la presencia de adenopatías en cadenas ilíacas externas, internas u obturatrices.
Para los tumores de urotelio, la modalidad de elección es el Urotac, que corresponde a una Tomografía Computada trifásica, con fases sin contraste, nefrográfica y de excreción, que tiene una alta sensibilidad en la detección de lesiones tanto de vejiga, ureteres y sistemas excretores renales.
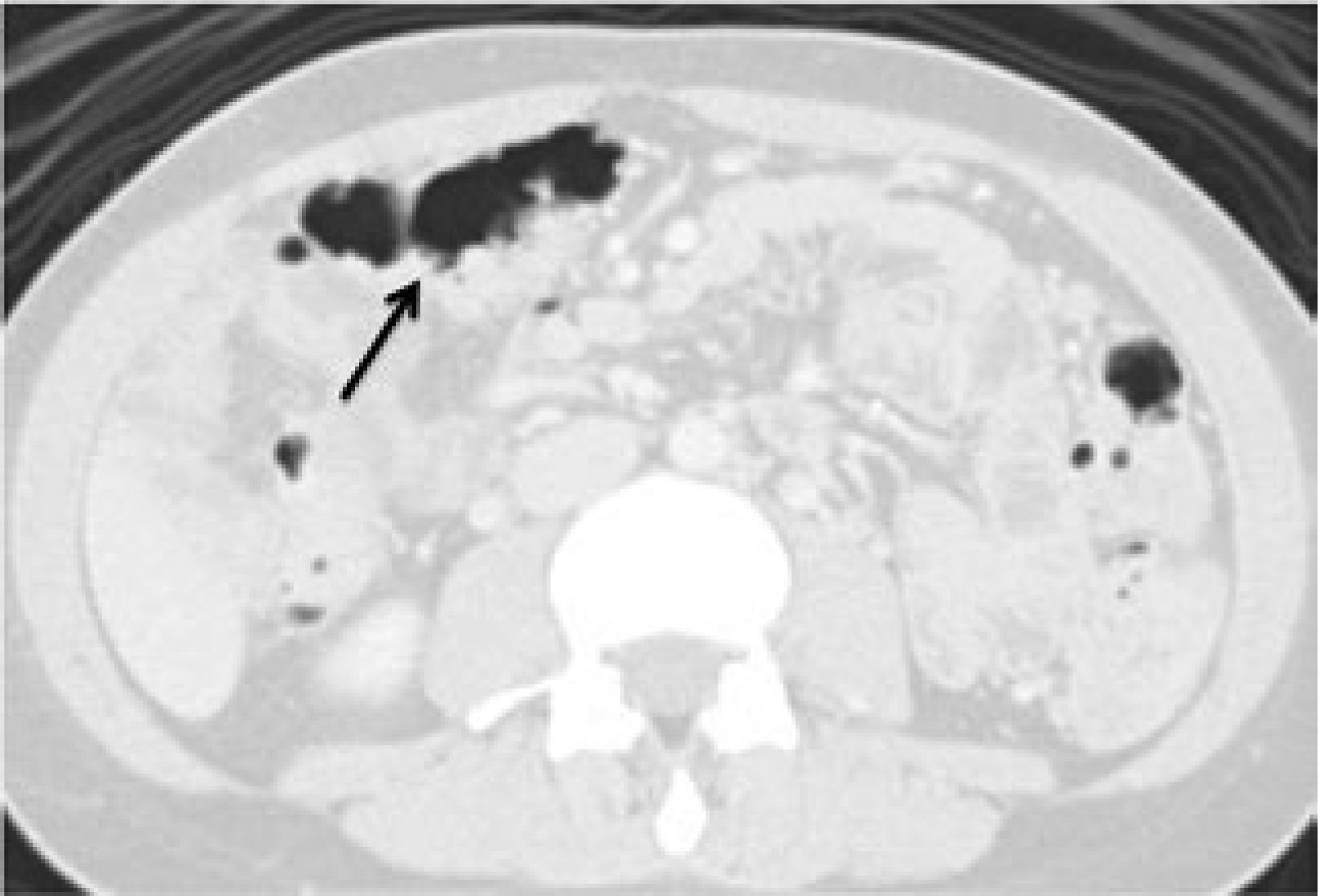
Poliposis Adenomatosa Familiar (PAF)Es el segundo síndrome más común de cáncer de colon heredable, con una prevalencia de 1:10000. Se caracteriza por la presencia de cientos de pólipos adenomatosos distribuídos en colon y recto. En promedio, los pacientes desarrollarán cáncer de colon a los 39 años y en un 95% a los 50 años.
La forma atenuada de este síndrome es menos severa, con presencia en promedio de 30 pólipos y aparición más tardía de la enfermedad 29.
A la PAF asociado a quistes epidermoides, tumores desmoides y osteomas se le denomina Síndrome de Gardner.
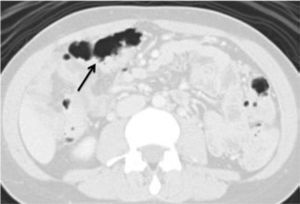
El método radiológico de elección para la detección de estos pólipos es la TC con técnica de colonoscopía virtual, donde se identifican los múltiples pólipos distribuidos a lo largo del colon y recto (Figura 3).
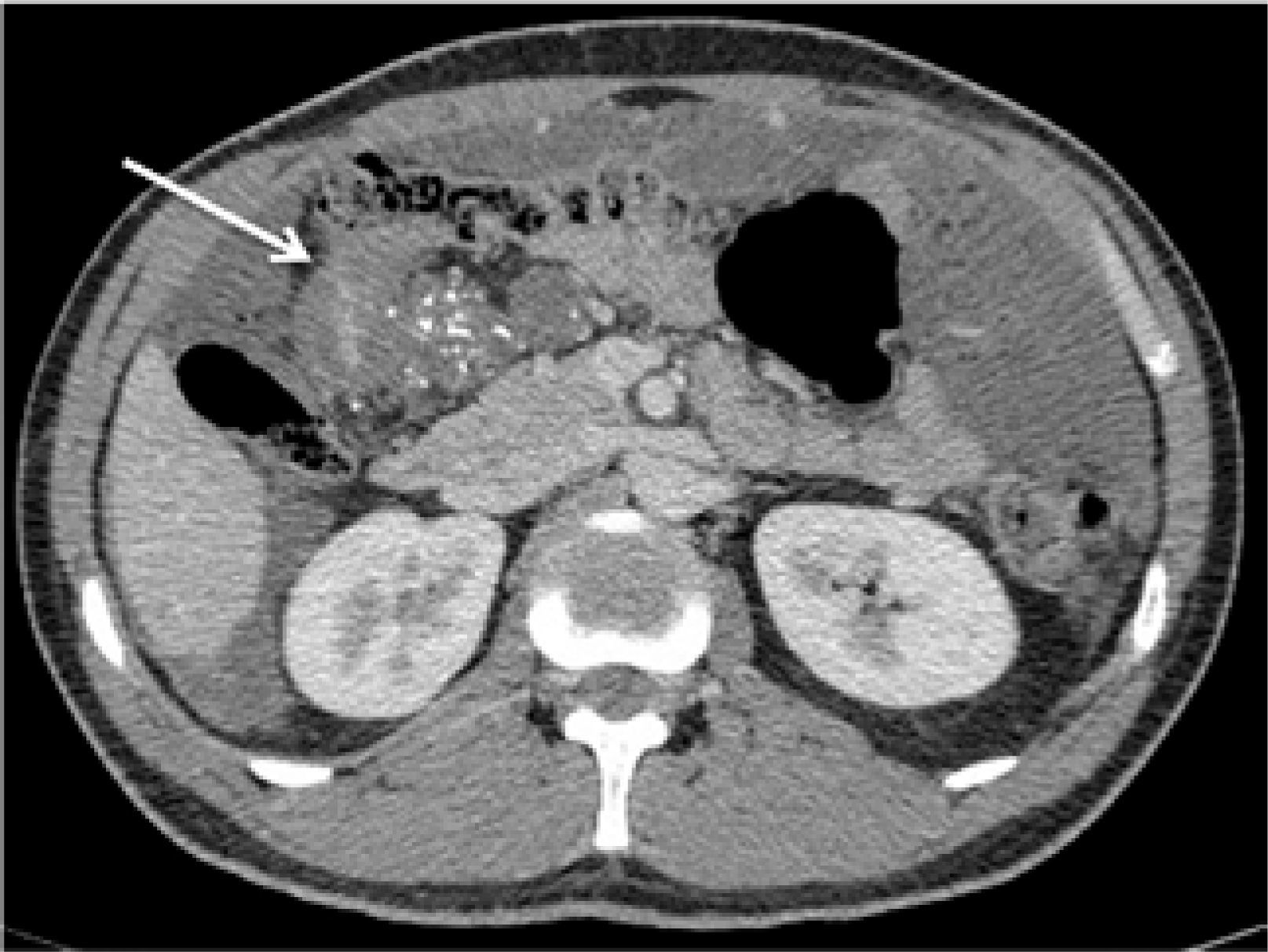
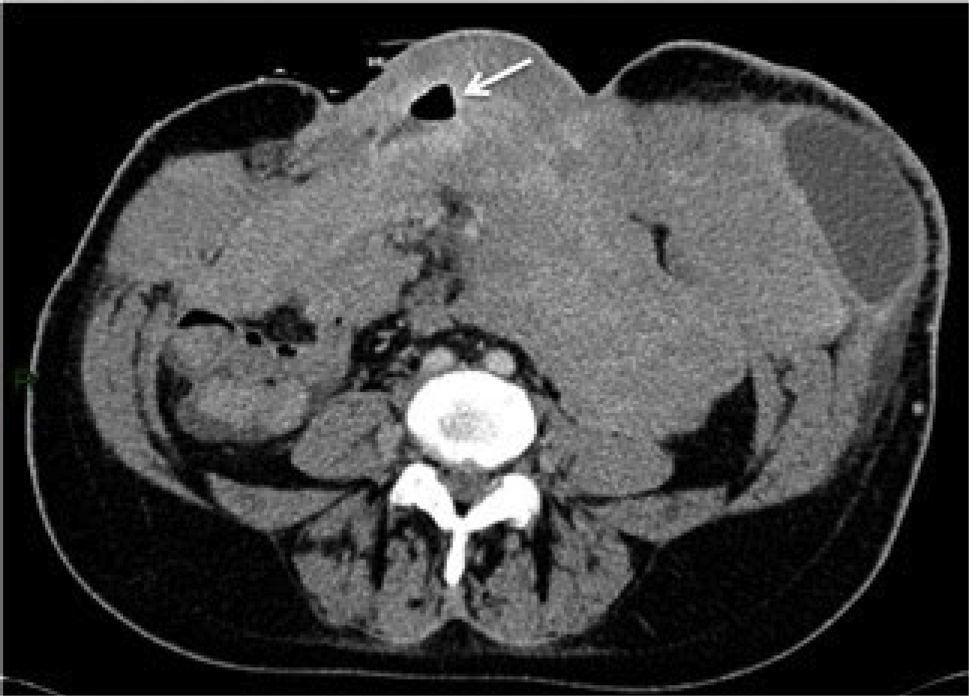
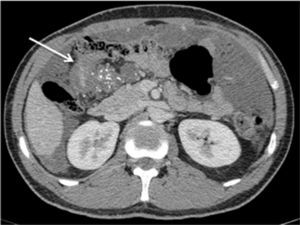
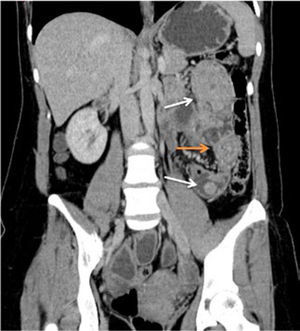
Una vez realizada la colectomía total, en pacientes con síndrome de Gardner existe un riesgo de 4-29% de desarrollar tumores desmoides, de estirpe fibromatosa, tanto en la pared abdominal como en el mesenterio 30. Estos son tumores mesenquimáticos benignos, pero de comportamiento infiltrativo local, que pueden determinar compromiso de asas intestinales, con presencia de fístulas a nivel mesentérico, abscesos, e incluso degeneración sarcomatosa, que determina la mortalidad de esta patología. Estos tumores pueden medir desde algunos centímetros hasta más de 40cm. A la TC son masas homogéneas relativamente isodensas con el músculo adyacente, que pueden tener contornos irregulares. Pueden ser múltiples, formando conglomerados de masas que se extienden desde el mesenterio hasta la pared abdominal, con infiltración de asas de intestino delgado y presencia de trayectos fistulosos que drenan hacia la pared abdominal, así como colecciones adyacentes (Figura 4).
MUJER DE 43 AÑOS CON ANTECEDENTE DE SÍNDROME DE GARDNER (POLIPOSIS ADENOMATOSA FAMILIAR ASOCIADO A TUMORES DE PARTES BLANDAS)
Corte axial de TC que muestra conglomerados de masas mesentéricas y de la pared abdominal compatibles con tumores desmoides, con pre-sencia de una fístula (flecha) y una colección en flanco izquierdo.
Es un trastorno hereditario autosómico dominante caracterizado por pólipos hamartomatosos intestinales, de predominio en intestino delgado, asociado a pigmentación mucocutánea en región oral y en los dedos de las manos. Hay un riesgo 15 veces mayor de presentar un cáncer intestinal en comparación con la población general 31.
El estudio radiológico de elección para su evaluación es la enterografía por tomografía computada, en que se administra manitol o agua vía oral, obteniendo una adecuada distensión de las asas de intestino delgado, donde se identifican innumerables pólipos de distinto tamaño, algunos de los cuales pueden determinar la presencia de invaginaciones y obstrucción parcial (Figura 5). También se pueden identificar pólipos en colon y estómago.
IMÁGENES MOLECULARES EN EL ESTUDIO DE LOS SÍNDROMES HEREDITARIOS NEUROENDOCRINOSExisten entidades genéticas heredadas en forma autosómica dominante denominadas Neoplasias Endocrinas Múltiples (NEM) que se subdividen en tipo 1 y 2 según las manifestaciones clínicas. En NEM1 se incluyen los tumores paratiroideos, hipofisiarios y gastroenteropancreáticos, mientras que NEM2 agrupa cáncer medular de tiroides, feocromocitoma, tumores paratiroideos y neuromas mucosos 32. La gran mayoría de estas expresiones clínicas se pueden evaluar funcionalmente con las llamadas imágenes moleculares.
Las imágenes moleculares han estado tradicionalmente ligadas a la práctica de la Medicina Nuclear, donde se obtienen estudios “funcionales” de distintos órganos mediante la administración de radiotrazadores, moléculas que tienen un blanco biológico definido a las que se les une un emisor de radiaciones que permite la obtención de imágenes. Los tumores neuroendocrinos se caracterizan por presentar una serie de características que incluyen sobre-expresión de receptores, secreción aumentada y/o aumento de la función celular, que permiten su identificación por las denominadas imágenes moleculares. A continuación se discuten las técnicas de imágenes para los tumores neuroendocrinos más frecuentes.
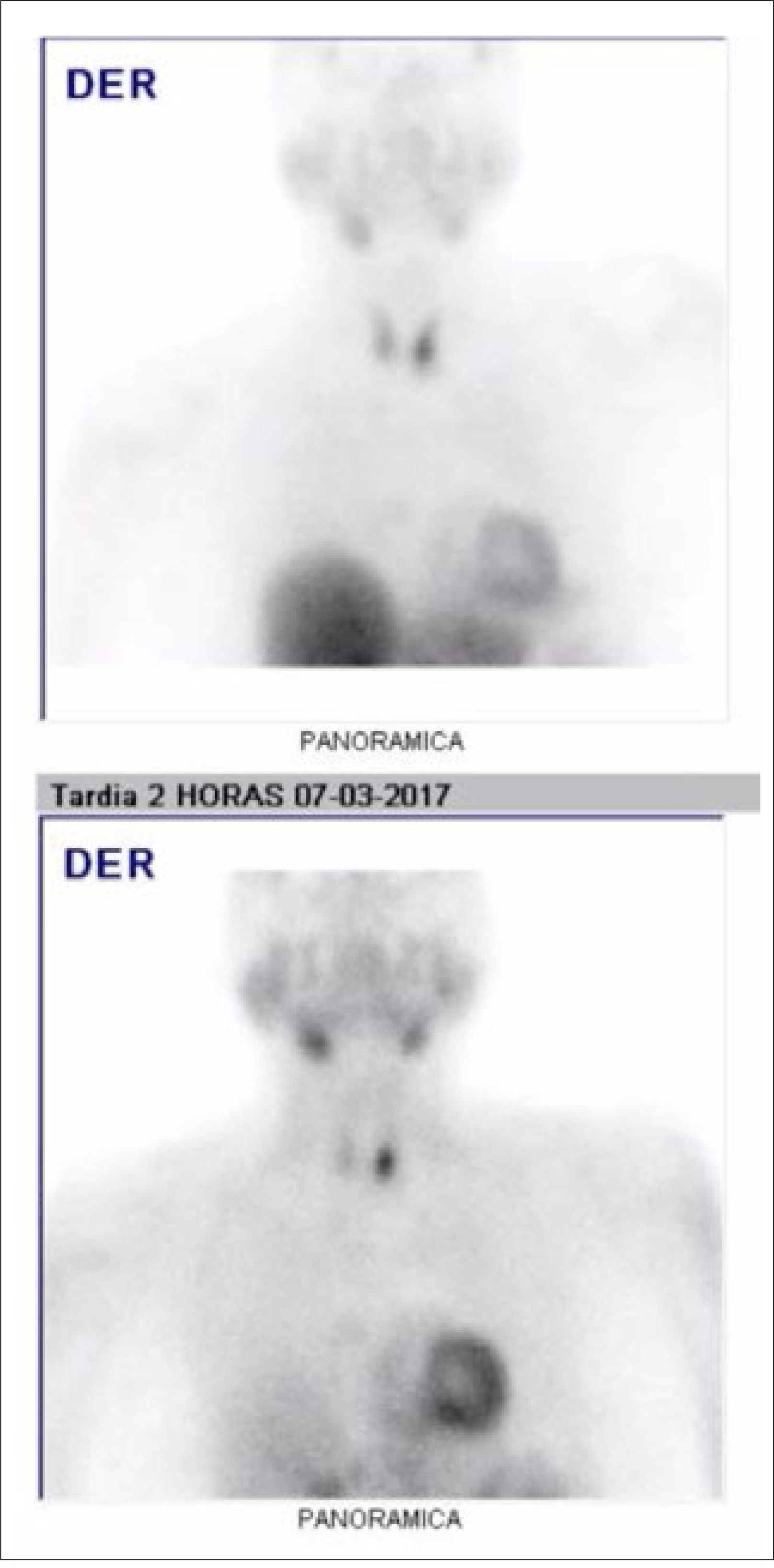
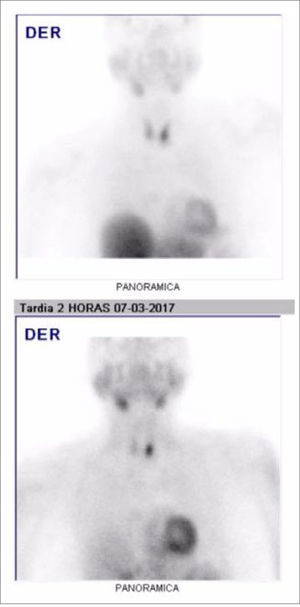
Paratiroides: Los adenomas paratiroideos se caracterizan por una hiperfunción glandular, provocando hipercalcemia y aumento de la PTH. Hace varias décadas se describió la avidez de los adenomas paratiroideos por el 201Talio, pudiendo de esta forma obtener una imagen funcional 33. Posteriormente se reemplazó el compuesto por Sestamibi marcado con 99mTecnecio dada su calidad de imagen superior y mejor dosimetría 34. El principio fisiológico involucrado en la obtención de estas imágenes es que el Sestamibi presenta una captación inicial dependiente del flujo en el parénquima tiroideo y paratiroideo. Con el tiempo el trazador es depurado por el tejido tiroideo, permaneciendo con mayor intensidad en el tejido paratiroideo hiperfuncionante. Taillefer describió en 1992 la técnica de doble fase que persiste hasta la actualidad, donde se obtienen imágenes precoces luego de la administración del trazador y controles tardíos para ver su retención en las paratiroides hiperfuncionantes (Figura 6) 35. Al agregar la adquisición tomográfica (SPECT) a las imágenes planares se logró aumentar la sensibilidad de la técnica desde un 57% a un 65%, con una especificidad cercana al 99% en ambos casos. Con la llegada de los equipos híbridos en esta década se ha logrado aumentar la sensibilidad hasta un 73%, manteniendo la excelente especificidad 36. La principal limitante sigue siendo el tamaño de la paratiroides, aunque se ha reducido progresivamente el límite de detección. Fuera de la confirmación diagnóstica, las imágenes cumplen un rol fundamental en la planificación pre-operatoria en estos casos, ya que el abordaje quirúrgico unilateral acorta los tiempos quirúrgicos y la morbilidad post-operatoria. Se ha demostrado que la combinación de la técnica con Sestamibi y una Ecotomografía realizada por un operador entrenado es la mejor alternativa para una planificación pre-operatoria exitosa 37.
Feocromocitoma: Desde su desarrollo a fines de la década del 70, el metayodobencilguanidina (MIBG) ha sido utilizado para el estudio de los feocromocitomas. Al ser un análogo de la norepinefrina, el MIBG es captado selectivamente y almacenado en los gránulos de secreción noradrenérgicos, por lo que se acumula en forma muy específica en los feocromocitomas funcionantes 38. El MIBG se marca con radioisótopos del yodo como el 123I (cintigrafía tradicional) o el 124I (PET), que permiten una mejor calidad de imagen y menor dosimetría, aún no disponibles en Chile y el 131I que permite obtener imágenes cintigráficas pero dada la presencia de radiación β y el riesgo de radiotoxicidad se debe limitar su dosis con el consiguiente deterioro de la calidad de imagen. La principal ventaja de esta técnica es su alta sensibilidad en tumores funcionales cercana al 90% y el valor predictivo positivo de 100% 39.
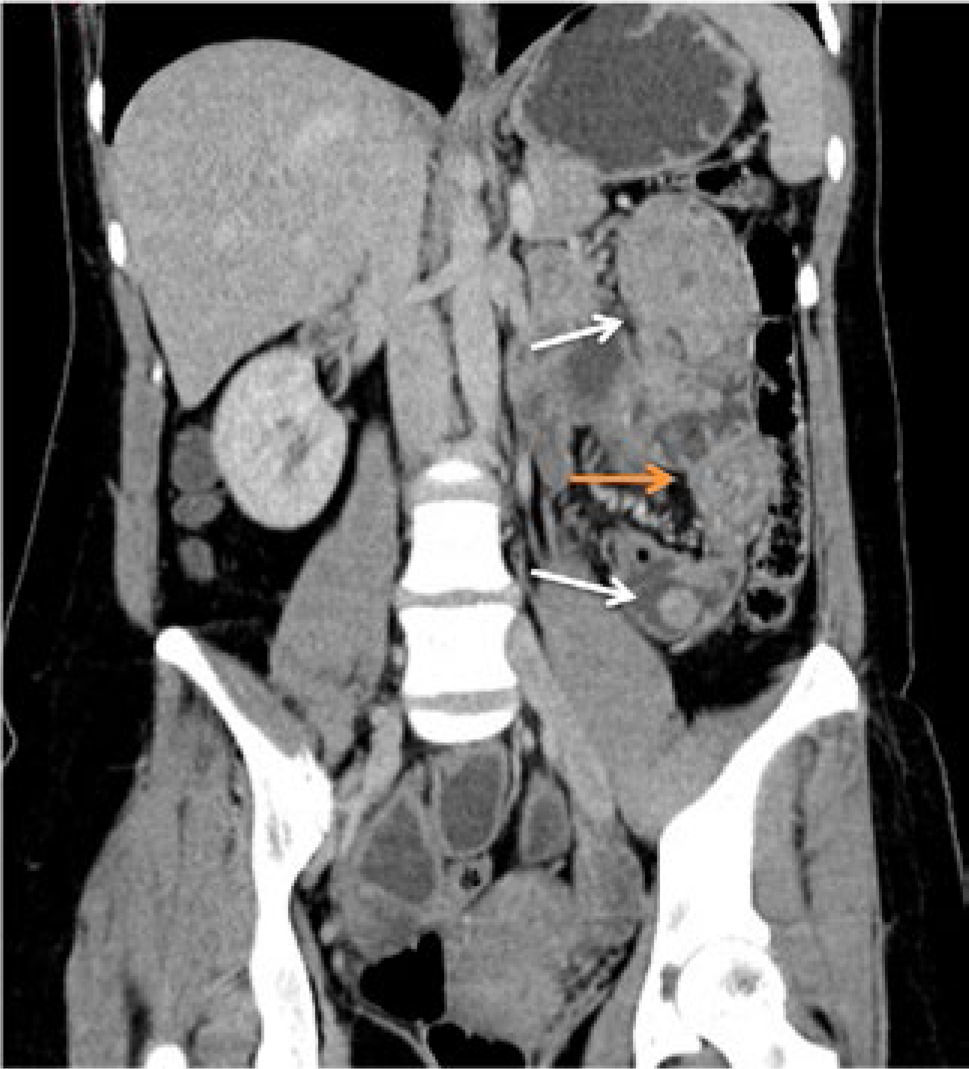
Tumores Gastroenteropancreáticos (GEP): Existe una sobre-expresión de receptores de somatostatina en los distintos tumores GEP como el gastrinoma, insulinoma o carcinoide, entre otros 40. Estos receptores han demostrado afinidad variable por algunos análogos de somatostatina que a su vez se han logrado marcar con emisores radioactivos que permiten una imagen diagnóstica. Desde principios de los 90 se cuenta comercialmente con el Octreotide marcado con 111Indio (Octreoscan) y posteriormente con 99mTecnecio, lo que permite obtener cintigrafías de la distribución de estos tumores. Desde fines de la pasada década se dispone en Chile de un emisor de positrones, el 68Galio, que puede unirse a los análogos de somatostatina como el DOTATATE y obtener imágenes con técnica PET/CT de significativa mejor calidad y resolución. Los distintos tumores sobre-expresan distintos subtipos de receptores, denominados sst1 al sst5, los que a su vez presentan distinta afinidad por los diferentes análogos de somatostatina disponibles. Esto ha motivado que exista una amplia variedad de combinaciones entre tumores y posibles radiotrazadores que apuntan a la futura capacidad de poder elegir la mejor modalidad dependiendo de las características específicas de cada paciente 41. Cabe destacar además que otros tumores neuroendocrinos como el feocromocitoma y el cáncer medular de tiroides también sobre-expresan estos receptores, por lo que se puede emplear esta técnica para evaluarlos conjuntamente (Figura 7). Algunos tumores GEP pueden desdiferenciarse con el tiempo, perdiendo la capacidad de sobre-expresar receptores de Somatostatina. En estos casos se sugiere utilizar el PET con flúordeoxiglucosa (FDG) ya que se vuelven metabólicamente activos y acumulan la glucosa con mayor intensidad 42.
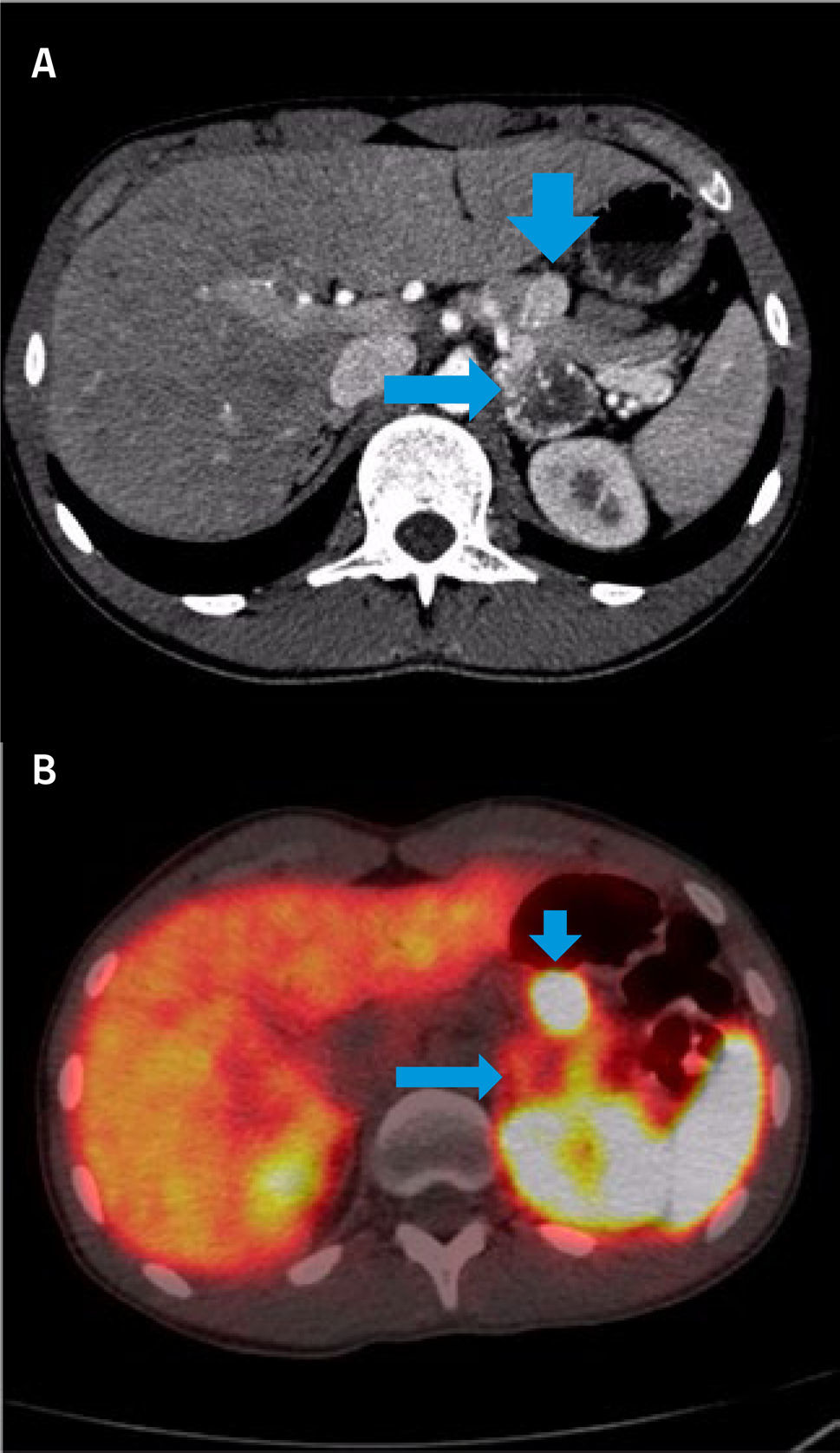
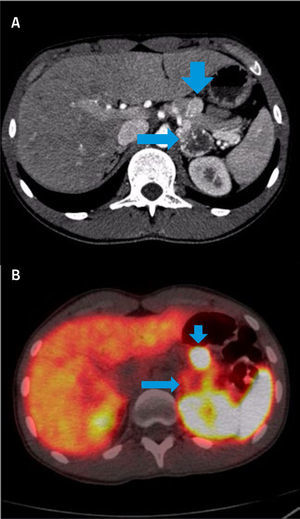
PET/CT CON GA68-DOTATATE (ANÁLOGO DE SOMATOSTATINA) EN PACIENTE JOVEN CON SOSPECHA DE FEOCROMOCITOMA
(A) CT con fase arterial muestra gran lesión necrótica en suprarrenal derecha (flecha larga) y nódulo hipervascular en cuerpo pancreático (flecha corta).
(B) El estudio fusionado demuestra intensa sobre-expresión de receptores de Somatostatina en lesión pancreática (flecha corta) y captación en la periferia de la lesión suprarrenal (flecha larga) atribuible a necrosis central.
Cáncer Medular de Tiroides (CMT): Si bien el CMT se ve frecuentemente en pacientes de 40 a 65 años, en los casos de NEM2 esto se puede adelantar una década y tienden a ser más agresivos, con una mayor incidencia de metástasis al momento del diagnóstico. El PET con FDG ha demostrado sensibilidades en un amplio rango para la detección de estas metástasis (60-95%), que dependen del tamaño de las lesiones y del grado de diferenciación, siendo más sensible a mayor nivel de calcitonina sérica 43. Las células C sobre- expresan receptores de somatostatina, por lo que en nuestro medio se ha utilizado con éxito el PET con análogos de somatostatina marcados con 68Ga, siendo más específico y capaz de detectar lesiones pequeñas, además de poder evaluar eventuales candidatos a terapia radioisotópica.
“Theranostics”, la posibilidad terapéutica implícita: El uso de un agente para obtener imágenes diagnósticas y luego utilizar el mismo agente para efectuar una terapia es la base del concepto “Theranostic” acuñado hace algunos años. El ejemplo más clásico es el del 131I en el cáncer diferenciado de Tiroides, utilizado a bajas dosis da imágenes de distribución del tejido tiroideo funcionante (Exploración Sistémica) y a dosis altas logra un efecto terapéutico ablativo dada la concentración de energía beta. En feocromocitoma metastásico se emplea este principio utilizando el MIBG con bastante éxito desde hace varias décadas. Desde la década del 2000 se empezó a aplicar el mismo concepto a los tumores neuroendocrinos que sobre-expresaban receptores de Somatostatina, confirmando la captación tumoral con imágenes diagnósticas previamente descritas (cintigrafía tradicional o PET con 68Ga) y luego administrando dosis terapéuticas de 90Itrio o 177Lutecio marcados con los análogos de Somatostatina 44. Esta técnica permite entregar altas dosis de radiación a células específicas, en cualquier parte del cuerpo, con escasa radiotoxicidad a tejido sano circundante. La ventaja adicional de las imágenes con técnica PET es que permiten obtener un valor estandarizado de captación (SUV) en lesiones, herramienta de gran utilidad en el seguimiento a largo plazo de tumores de crecimiento lento como son las neoplasias neuroendocrinas antes vistas; o al momento de comparar estudios pre y post terapia, permitiendo evaluar respuesta precoz a tratamiento para definir eventuales cambios de conducta clínica.
Los autores declaran no tener conflictos de interés en relación a este artículo.