La clasificación etiológica de la American Diabetes Association (ADA) de la diabetes incluye el grupo de “Otros tipos específicos de diabetes”, constituido por 8 subgrupos, que en su totalidad son de baja frecuencia. Del largo listado, los Maturity Onset Diabetes in the Young (MODY) y las inducidas por fármacos, las que vemos en la práctica clínica; la diabetes lipoatrófica, las asociadas a hemocromatosis y a síndrome de Down, entre otras, se presentan ocasionalmente; y de las “formas infrecuentes de diabetes mediadas por inmunidad” solo tenemos conocimiento por la literatura.
En las “Diabetes Atípicas” (no incluidas en la clasificación ADA), se mencionan la DM tipo 2 en niños y adolescentes, favorecida por el aumento de la obesidad y del sedentarismo; la diabetes propensa a la cetosis, que debutan en cetoacidosis, con etiopatogenia y evolución de DM2; los Latent Autoinmune Diabetes of Adults (LADA), DM tipo 1 de lenta aparición y la diabetes postrasplante.
The American Diabetes Association (ADA) etiological classification of diabetes includes the group of “Other specific types of diabetes”, constituted by 8 subgroups, all of them have low frequency. From the long listing, Maturity Onset Diabetes of the Young (MODY) and drug induced diabetes are seen in the clinical practice; lipoatrophic diabetes and those associated to hemochromatosis and to Down's syndrome, among others, present occasionally; and of the “Infrequent forms of immunity-mediated diabetes”, we only know from the literature.
Among the “Atypical Diabetes” (not included in the ADA classification), mention is made of type 2 DM in children and adolescents, favoured by the increase in obesity and sedentarism; ketosis prone diabetes, which presents with ketoacidosis and has the etiopathogenesis and evolution of DM2; Latent Autoimmune Diabetes of Adults (LADA), slow-onset type 1 DM and post transplant diabetes.
La diabetes mellitus (DM) es un desorden metabólico caracterizado por niveles elevados de glucosa en sangre, resultado de defectos en la secreción y/o acción de la insulina. Tiene múltiples etiologías e incluye un grupo de enfermedades que presentan variados procesos patogénicos como trastornos genéticos, ambientales y autoinmunes que conducen a alteraciones en la función de las células beta, provocando deficiencia en la secreción de insulina y distintos grados de resistencia a la insulina (RI); los mecanismos pueden asociarse.
La clasificación de la DM actual más ampliamente usada es de la American Diabetes Association (ADA) 1, que se basa fundamentalmente en su etiología y características fisiopatológicas. Comprende 4 categorías:
- I.
Diabetes mellitus tipo 1
- II.
Diabetes mellitus tipo 2
- III.
Diabetes mellitus gestacional
- IV.
Otros tipos específicos de diabetes (Tabla 1), siendo éstas las que se revisarán en este artículo.
TABLA 1.OTROS TIPOS ESPECÍFICOS DE DIABETES MELLITUS
A. DEFECTOS GENÉTICOS EN LA FUNCIÓN DE LA CÉLULA β 1. Cromosoma 12, HNF-1α (MODY3) 5. Diabetes neonatal transitoria 2. Cromosoma 20, HNF-4α (MODY1)) 6. Diabetes neonatal permanente 3. Cromosoma 7, glucoquinasa (MODY2) 7. ADn mitocondrial 4. Otras formas muy raras de MODY 8. Otros B. DEFECTOS GENÉTICOS EN LA ACCIÓN DE LA INSULINA 1. Resistencia a la insulina tipo A 4. Diabetes lipoatrófica 2. Leprechaunismo 5. Otros 3. Síndrome de Rabson-Mendenhall C. ENFERMEDADES DEL PÁNCREAS EXOCRINO 1. Pancreatitis 5. Hemocromatosis 2. Trauma/pancreatectomía 6. Pancreatopatía fibrocalculosa 3. Neoplasia 7. Otros 4. Fibrosis quística D. ENDOCRINOPATÍAS 1. Acromegalia 5. Hipertiroidismo 2. Síndrome de Cushing 6. Somatostatinoma 3. Glucagonoma 7. Aldosteronoma 4. Feocromocitoma 8. Otros. E. INDUCIDA POR FÁRMACOS O SUSTANCIAS 1. Vacor 7. Agonistas ß-adrenérgicos 2. Pentamidina 8. Tiazidas 3. Ácido nicotínico 9. Dilantin 4. Glucocorticoides 10. Interferón-γ 5. Hormona tiroidea 11. Otros 6. Diazóxido F. INFECCIONES 1. Rubéola congénita 3. Otros 2. Citomegalovirus G. FORMAS INFRECUENTES DE DIABETES MEDIADA POR INMUNIDAD 1. Síndrome de “Stiff-man” 3. Otros 2. Anticuerpos anti receptores de insulina H. OTROS SíNDROMES GENÉTICOS OCASIONALMENTE ASOCIADOS A DIABETES 1. Síndrome de Down 7. Síndrome de Laurence-Moon-Biedl 2. Síndrome de Klinefelter 8. Distrofia Miotónica 3. Síndrome de Turner 9. Porfiria 4. Síndrome de Wolfram 10. Síndrome de Prader-Willi 5. Ataxia de Friedreich 11. Otros 6. Corea de Huntington
Producidas por mutaciones en genes que regulan la función de las células beta (cel ß); se caracterizan por deterioro en la síntesis o secreción de insulina con un defecto mínimo o nulo en su acción.
En este subgrupo de DM se incluyen los MODY (Maturity Onset Diabetes of the Young) que representa el 1% de la diabetes no insulino dependiente en Europa; la diabetes neonatal y la diabetes mitocondrial, estas últimas de muy escasa frecuencia.
MODY se denomina al grupo de diabetes no insulino dependientes que se diagnostican usualmente antes de los 25 años y son hereditarias por patrón autosómico dominante con penetrancia incompleta; se ha identificado que la causan al menos 10 mutaciones. Estos pacientes suelen tener estado nutricional normal, ausencia de estigmas de RI al examen físico y se consideraba como requisito historia familiar de DM en tres generaciones; sin embargo, puede haber casos índices sin antecedentes de DM.
La diabetes tipo MODY se puede clasificar de acuerdo a dos presentaciones clínicas diferentes: MODY glucoquinasa y MODY por factores de transcripción.
MODY glucoquinasa (MODY GK) se caracteriza por presentar hiperglicemia de ayunas desde el nacimiento, no es progresiva, no requiere tratamiento farmacológico (excepto en embarazo) y no se asocia a complicaciones 2. Es la denominada MODY 2.
MODY por factores de transcripción (MODY FT) se presenta en la adolescencia o en la juventud, es progresiva con requerimiento de tratamientos más complejos en su evolución y se asocia a complicaciones microvasculares; se han denominado MODY 1 y MODY 3 3.
La forma más frecuente es la MODY 3, que se origina por una mutación en el cromosoma (Cr) 12 del gen que codifica el factor nuclear de transcripción hepática 1α (HNF-1α). Se caracteriza por alteración de la síntesis de insulina e hiperglicemia progresiva, necesidad de terapia farmacológica y alto riesgo de desarrollar complicaciones crónicas de la DM. La segunda en frecuencia es la MODY GK, causada por una mutación heterocigota que inactiva al gen de la glucoquinasa. Se diagnostica en estudio de glicemias elevadas en un niño o joven, y en el 1-2% de mujeres con diabetes gestacional. Los pacientes presentan un defecto al sensar la glucosa en sangre, determinando que la homeostasis glicémica sea mantenida en un rango levemente más elevado, con glicemias de ayunas entre 98 y 150mg/dl y hemoglobinas glicosiladas A1c (HbA1c) entre 5,8-7,6%. Experimentan un leve deterioro con los años. Pueden no presentar complicaciones microvasculares y la prevalencia de macrovasculares es probablemente similar a la población general. No se recomienda tratarlos, salvo en el caso de mujeres embarazadas con un feto que no ha heredado la mutación, que evoluciona con macrosomía; con monitorización ecográfica estrecha, evaluando la circunferencia abdominal fetal. Si está sobre los percentiles esperables, se debe implementar tratamiento con insulina por este periodo.
La diabetes MODY 1 tiene una presentación clínica similar a la 3, y se debe a mutaciones del factor de transcripción HNF-4α en el Cr2. Se caracteriza por un umbral bajo para presentar glucosuria, pudiendo constatarse glucosuria precediendo el diagnóstico de DM. Los pacientes tienen niveles elevados de HDL, pero tienen mayor riesgo de enfermedad cardiovascular que los sujetos con DM1 y una frecuencia comparable de complicaciones microvasculares.
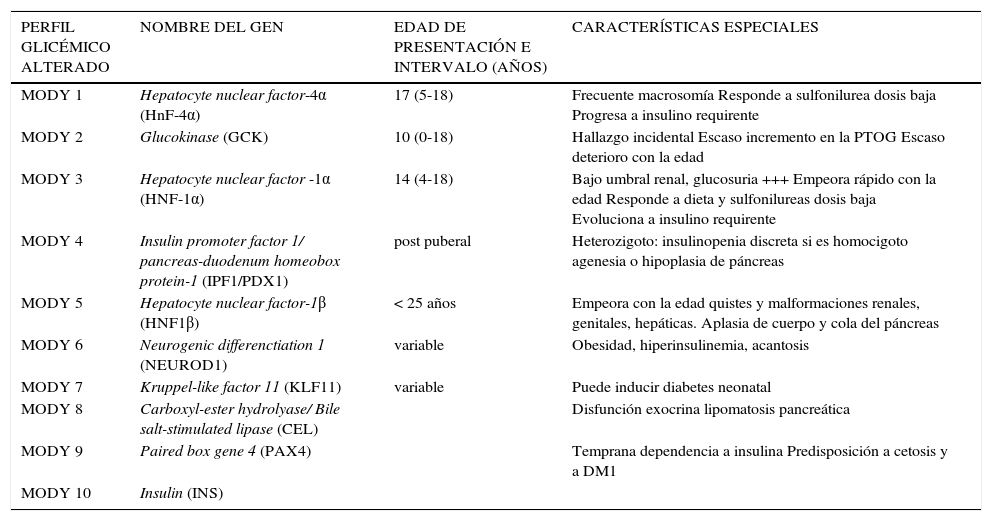
Las otras formas menos comunes están asociadas a diferentes mutaciones: MODY 4, en el factor 1 promotor de insulina (IPF-1), MODY5, en el factor de transcripción hepático nuclear 1 beta (HNF-1β) y MODY 6, en un factor de transcripción de la cel ß, regulador de la síntesis de insulina (NEUROD1/BETA2). Los distintos MODY aparecen en la Tabla 2.
SUBTIPOS DE DIABETES “MATURITY ONSET DIABETES IN THE YOUNG” (MODY)
| PERFIL GLICÉMICO ALTERADO | NOMBRE DEL GEN | EDAD DE PRESENTACIÓN E INTERVALO (AÑOS) | CARACTERĺSTICAS ESPECIALES |
|---|---|---|---|
| MODY 1 | Hepatocyte nuclear factor-4α (HnF-4α) | 17 (5-18) | Frecuente macrosomía Responde a sulfonilurea dosis baja Progresa a insulino requirente |
| MODY 2 | Glucokinase (GCK) | 10 (0-18) | Hallazgo incidental Escaso incremento en la PTOG Escaso deterioro con la edad |
| MODY 3 | Hepatocyte nuclear factor -1α (HNF-1α) | 14 (4-18) | Bajo umbral renal, glucosuria +++ Empeora rápido con la edad Responde a dieta y sulfonilureas dosis baja Evoluciona a insulino requirente |
| MODY 4 | Insulin promoter factor 1/ pancreas-duodenum homeobox protein-1 (IPF1/PDX1) | post puberal | Heterozigoto: insulinopenia discreta si es homocigoto agenesia o hipoplasia de páncreas |
| MODY 5 | Hepatocyte nuclear factor-1β (HNF1β) | < 25 años | Empeora con la edad quistes y malformaciones renales, genitales, hepáticas. Aplasia de cuerpo y cola del páncreas |
| MODY 6 | Neurogenic differenctiation 1 (NEUROD1) | variable | Obesidad, hiperinsulinemia, acantosis |
| MODY 7 | Kruppel-like factor 11 (KLF11) | variable | Puede inducir diabetes neonatal |
| MODY 8 | Carboxyl-ester hydrolyase/ Bile salt-stimulated lipase (CEL) | Disfunción exocrina lipomatosis pancreática | |
| MODY 9 | Paired box gene 4 (PAX4) | Temprana dependencia a insulina Predisposición a cetosis y a DM1 | |
| MODY 10 | Insulin (INS) |
Las MODY FT se tratan inicialmente con dieta. Al agregar fármacos, las sulfonilureas son las drogas de elección, pero se debe titular su dosis ya que estos pacientes presentan una gran sensibilidad y tendencia a presentar hipoglicemias. También pueden emplearse las glinidas. En etapas avanzadas pueden requerir insulinoterapia.
Más del 80% de los individuos con MODY son erróneamente clasificados como diabéticos tipo 1 o tipo 2. Recientemente se han desarrollado modelos de predicción clínica “on line”4 y aplicaciones para dispositivos móviles5 que calculan la probabilidad de tener un MODY considerando la edad de diagnóstico, tratamientos recibidos e historia familiar. Estos ayudarían a decidir cuáles pacientes se benefician de estudios genéticos más específicos.
En la Tabla 3 se describen las diferentes características de los pacientes jóvenes con diabetes monogénicas, DM1 y DM2.
DIFERENCIAS ENTRE PACIENTES CON DIABETES MONOGÉNICAS, DM1 Y DM2 EN jÓVENES
| CARACTERÍSTICAS | DM1 | DM2 | MODY GK | MODY FT |
|---|---|---|---|---|
| Insulino dependencia | Si, posterior a luna de miel | No | No | No |
| Antecedente en padres | 2-4% | Sí, 60% | 80% | 80% |
| Edad de diagnóstico | Desde los 2 años a adulto joven | Adolescentes y jovenes | Desde el nacimiento | Adolescentes y jovenes |
| Obesidad | Poco frecuente | >90% | Poco frecuente | Poco frecuente |
| Acantosis Nigricans | No | >75% | No | No |
| Auto anticuerpos Célula β | + en 80% al diagnóstico | No | No | No |
| Glicemia | Alta | Variable progresiva | Leve sobre rango normal | Variable progresiva |
Diabetes neonatal. Se define por hiperglicemia que se manifiesta antes de los 6 meses de edad. Es muy infrecuente, afectando a uno en 200.000 nacidos vivos. El punto de corte de los 6 meses de edad se determinó por la alta posibilidad de que sea monogénica versus poligénica DM1 en base a estudios poblacionales. Existe una forma de diabetes neonatal transitoria (DMNT) que es la más frecuente, de curso autolimitado; la otra es permanente (DMNP) y requiere terapia desde el diagnóstico 6.
En la DMNP, las causas más frecuentes son mutaciones en los genes codificantes para los canales de potasio sensibles a ATP (KATP), genes KCNJ11 y ABCC8. Las mutaciones de estos genes impiden que el ATP produzca el cierre de los canales y, como consecuencia, no se produce la depolarización de la membrana, no aumenta el calcio intracelular y con ello hay menor liberación de insulina. En la DMNT, el defecto genético más frecuente es en el imprinting ZAC/HYAMI, llevando a la sobre expresión de genes heredados del padre. Esta diabetes se presenta dentro de las primeras semanas de vida y se resuelve a los pocos meses de edad, para luego reaparecer en la adolescencia o edad adulta en aproximadamente el 50% de los casos 7.
El estudio genético de los pacientes con diabetes neonatal tiene importancia pronóstica y terapéutica; se puede sustituir el tratamiento de insulina por sulfonilureas. Estos fármacos mejoran la glicemia con bajo riesgo de hipoglicemias, y también los trastornos neurológicos asociados.
Diabetes mellitus mitocondrial. Es una forma muy infrecuente de diabetes asociada a sordera neurosensorial. Se debe a defectos del ADN mitocondrial, siendo más frecuente la mutación 3243 A/G. Se transmite por herencia materna. La misma mutación que determina esta diabetes también causa un síndrome de enfermedad neuromuscular severa llamada MELAS (miopatía mitocondrial, encefalopatía, acidosis láctica y accidente cerebrovascular). Se presenta habitualmente en la tercera a cuarta década de la vida en individuos no obesos, con antecedentes familiares de DM materna y con sordera bilateral. El diagnóstico se confirma con estudio genético.
Actualmente en Chile se puede solicitar la determinación de la mutación mitocondrial 3243 A/G y del MODY GK.
B. DIABETES POR DEFECTOS GENÉTICOS DE LA ACCIÓN DE LA INSULINASon enfermedades de muy baja frecuencia caracterizadas por presentar severa insulino resistencia:
Síndrome de Donohue o Leprechaunismo se presenta en el período neonatal, con severa resistencia a la insulina asociada a retardo del crecimiento intrauterino, ausencia de grasa subcutánea, rasgos dismórficos y alta letalidad.
Síndrome de Rabson-Mendenhall es de presentación más tardía, con retardo severo del crecimiento, hiperplasia gingival con displasia dental. La mayoría de los pacientes fallecen en la infancia.
Resistencia insulínica tipo A es la forma clínica más leve y habitualmente se diagnostica en mujeres adolescentes sin sobrepeso que presentan acantosis nigricans, hirsutismo, virilización y ovarios poliquísticos.
Diabetes lipoatróficas o lipodistrofias pueden ser congénitas o adquiridas.
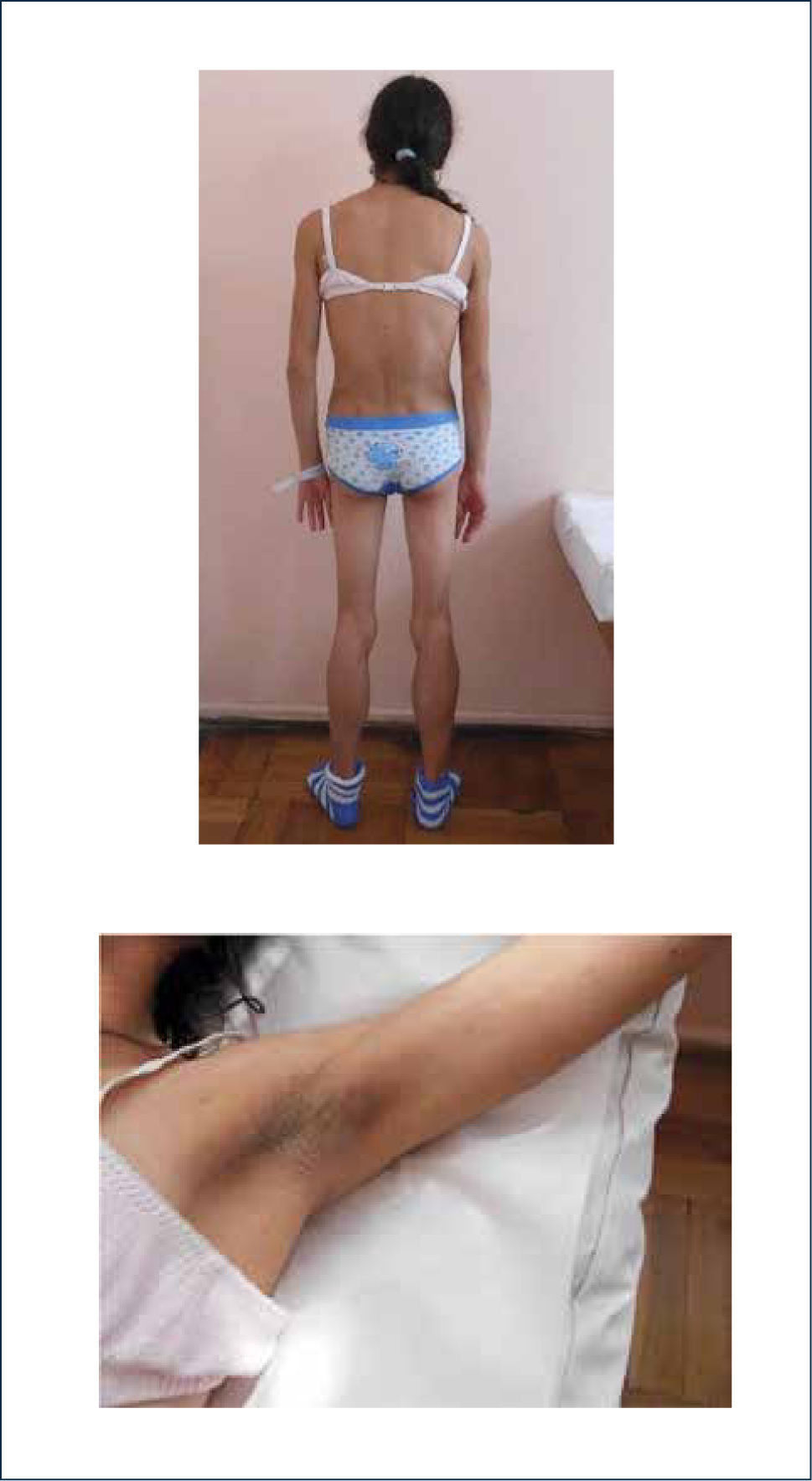
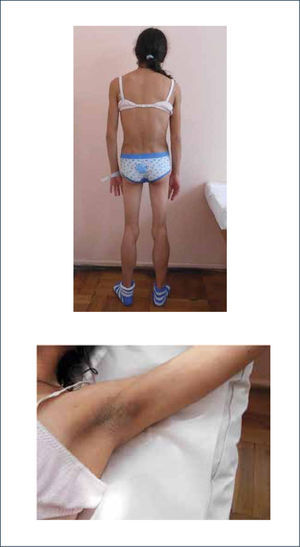
Las genéticas son producidas por mutaciones en los genes de factores diferenciadores de adipocitos. Pueden ser parciales en que las mutaciones más frecuentes están en los genes que codifican para las proteínas (láminas) que mantienen la envoltura nuclear y los genes del receptor activado por proliferadores de peroxisomas gamma. Además hay otra forma total generalizada (síndrome de Berardinelli-Seip) que se debe a mutación del gen de la enzima 1-acilglicerol-3-fosfato-O-aciltransferasa 2 (AGPAT2) que juega un rol fundamental en la adipogénesis. Se produce depleción de triglicéridos en el tejido adiposo, acumulándose en hígado y músculos. Los pacientes presentan ausencia parcial o casi total de tejido adiposo, aspecto de marcada musculatura por acumulación grasa en músculos, severa resistencia insulínica, hiperglicemia, hipertrigliceridemia, esteatosis hepática, miocardiopatía y trastornos en la fertilidad. Presentan niveles disminuidos de leptina y adiponectina. En las fotografías se puede observar una paciente en control en la Unidad de Diabetes del Hospital San Juan de Dios, con lipoatrofia de etiología no conocida que presenta diabetes con severa RI y dislipidemia (Figura 1).
Las adquiridas se caracterizan por desaparición generalizada del tejido adiposo, diabetes mellitus no cetósica, hipertrigliceridemia, descenso del colesterol HDL, resistencia a la insulina, hiperinsulinemia, hipoleptinemia, xantomas eruptivos y hepatomegalia. Se manifiestan en la adolescencia. Afectan más frecuentemente a mujeres que a varones. La hipertrigliceridemia severa en ocasiones es responsable de episodios de pancreatitis. Se presentan en individuos con enfermedades autoinmunes como tiroiditis de Hashimoto, artritis reumatoide, vitíligo, anemia hemolítica y hepatitis crónica activa. Se han identificado anticuerpos contra la membrana del adipocito, planteándose que la lipodistrofia generalizada adquirida tiene una etiología autoinmune.
Estos pacientes presentan altos requerimientos de insulina, por lo que drogas insulino sensibilizadoras como glitazonas y metformina están indicadas. El manejo de la dislipidemia suele ser difícil.
Recientemente en Estados Unidos fue aprobada por la Food and Drug Administration (FDA) la metreleptina (leptina recombinante) para tratar a pacientes con lipodistrofia generalizada. Existe expectación con respecto a la aparición de anticuerpos contra esta, lo que disminuiría su efectividad, y mayor aparición de linfomas, que serían más frecuentes en pacientes en tratamiento con metreleptina 9.
C. DIABETES SECUNDARIAS A ENFERMEDADES PANCREÁTICASIncluyen múltiples patologías como pancreatitis, cáncer pancreático y enfermedades sistémicas como la fibrosis quística y la hemocromatosis.
El cáncer de páncreas corresponde a adenocarcinoma ductal en aproximadamente el 90% de los casos. El diagnóstico suele ser tardío porque es clínicamente asintomático hasta que el tumor ha alcanzado una etapa avanzada, y se presenta con pérdida de peso, dolor abdominal y/o ictericia. Esta condición es dos veces más frecuente en personas obesas con DM2. Presentan DM hasta el 50% de aquellos con carcinoma del páncreas, y el diagnóstico de la DM a menudo precede al diagnóstico de cáncer. Factores humorales asociados al tumor, que confieren resistencia a la insulina, pueden ser responsables. Se ha demostrado que la progresión a cáncer de páncreas implica una cascada de mutaciones de genes, de los cuales KRAS es el más importante. En adultos mayores sin historia familiar de DM, con hiperglicemia severa de reciente diagnóstico, sin obesidad o con baja de peso, se debe sospechar y descartar una neoplasia. El tratamiento de elección es la insulinoterapia con metas flexibles de control 10.
Fibrosis quística del páncreas. Con el aumento de la sobrevida de los pacientes portadores de esta patología, nos vemos enfrentados con mayor frecuencia al manejo de esta complicación metabólica que se asocia a peor estado nutricional y mayor mortalidad. Se presenta más frecuentemente en pacientes de mayor edad y evolución más prolongada. Estudios informan una alta asociación con DM, llegando a un 20% de los adolescentes y 50% de la población adulta con fibrosis quística. Estos pacientes presentan sensibilidad a la insulina normal, excepto mientras cursan una infección aguda o están en tratamiento con glucocorticoides, cuando la resistencia a la insulina puede ser severa.
Su etiología no es aún bien conocida; estudios histopatológicos post mortem han constatado que los pacientes con fibrosis quística con DM no necesariamente tienen más fibrosis pancreática que los pacientes con fibrosis quística sin DM. Estudios más recientes sugieren estar relacionada al defecto en los canales de cloro presente en esta enfermedad 11. El tratamiento recomendado es con insulina, en algunos pacientes asociada a metformina 12.
Hemocromatosis. Enfermedad hereditaria causada por mutaciones en el gen llamado HFE, ubicado en el Cr6. Esta enfermedad es autosómica recesiva, se necesita una mutación de ambos alelos para que se exprese clínicamente. Se produce una absorción exagerada de hierro en el intestino, que lleva a la acumulación progresiva de este metal en el organismo. El hierro en exceso produce daño celular por diversos mecanismos, siendo probablemente el más importante el estrés oxidativo por generación de radicales libres. Se le describe como la tríada de diabetes, cirrosis e hiperpigmentación de la piel (piel bronceada).
El 30-60% de los pacientes con hemocromatosis presentan diabetes. Los mecanismos fisiopatológicos no son del todo conocidos, existiría un déficit de secreción e insulino resistencia 13.
D. DIABETES ASOCIADAS A ENDOCRINOPATÍASEl exceso de cualquiera de las hormonas que antagonizan la acción de la insulina como cortisol, hormona de crecimiento, glucagón y epinefrina pueden producir hiperglicemia. El síndrome de Cushing, la acromegalia, el feocromocitoma y el glucagonoma cursan con distintos grados de trastornos del metabolismo de la glucosa hasta DM.
El síndrome de Cushing con DM se asocia en 20-50%. Probablemente su frecuencia está subestimada ya que no siempre se realiza test de tolerancia a la glucosa a individuos con glicemias de ayunas normal.
El glucagonoma es muy infrecuente, es una neoplasia por proliferación de células alfa, que se presenta con diabetes en la quinta década de la vida, con lesiones cutáneas, diarreas anemia y enfermedad tromboembólica.
El somatostatinoma y el aldosteronoma inducen hipokalemia, lo que en parte causa DM por inhibición de la secreción de insulina. Habitualmente la glicemia se normaliza después de la extirpación del tumor 14.
E. DIABETES INDUCIDA POR FÁRMACOS O SUSTANCIAS QUÍMICASVarios fármacos pueden inducir trastornos en el metabolismo de los hidratos de carbono, por diferentes mecanismos. Pueden precipitar una diabetes en individuos predispuestos que ya tienen alguna alteración en la secreción o acción de la insulina. Ciertas toxinas como el vacor, la estreptozotocina y la pentamidina endovenosa pueden dañar en forma permanente las cel β.
Los glucocorticoides por su amplia indicación y potencia diabetogénica son los fármacos que más frecuentemente inducen hiperglicemia. Se utilizan en el tratamiento de muchas condiciones médicas. Producen aumento de peso a menudo con depósitos anormales de grasa, en abdomen, zona interescapular y dorsocervical. Favorecen el paso de pre adipocitos a adipocitos maduros. El efecto hiperglicemiante de los glucocorticoides en el metabolismo de la glucosa es consecuencia de aumento de la resistencia periférica de la insulina y a nivel hepático disminución de la sensibilidad a la insulina y mayor producción de glucosa. Las dosis altas de corticoides inducen disfunción de la cel β (menor secreción de insulina). El efecto de los glucocorticoides es principalmente sobre la glucosa postprandial vespertina, y no en los niveles de glucosa en ayunas. Esto podría también reflejar una relación con la hora matutina de administración 15.
Los antipsicóticos atípicos (clozapina, olanzapina, risperidona, quetiapina, ziprasidona y ripiprazol) parecen inducir diabetes por promover aumento de peso y también inducir RI no relacionada con obesidad. La RI puede ser explicada por el bloqueo de los antipsicóticos atípicos a receptores muscarínicos centrales y periféricos M3, que tienen gran relevancia en la regulación del metabolismo de los hidratos de carbono. Clozapina y olanzapina son los fármacos con mayor riesgo de inducir diabetes y estos poseen la mayor afinidad por estos receptores. La presentación de diabetes con cetoacidosis se describe con mayor frecuencia con clozapina y olanzapina, pero también con quetiapina, risperidona, aripiprazol y ziprasidona 16.
Los medicamentos antirretrovirales inhibidores de la proteasa y análogos de nucleósidos, utilizados en la infección por VIH, producen un sindrome caracterizado por una lipodistrofia característica con redistribución del tejido adiposo de la cara y extremidades al torso con acumulación de grasa en abdomen y zona interescapular, RI y alta frecuencia de DM, se asocia a una dislipidemia con niveles elevados de colesterol LDL (Low Density Lipoprotein), reducido HDL (High Density Lipoprotein) y tendencia a la acidosis láctica.
Las bases fisiopatológicas de este sindrome no están claras, si se ha constatado en estudios in vitro e in vivo que fármacos inhibidores de proteasas provocan alteraciones en las señales del post receptor de insulina y la expresión del transportador de glucosa 4 (GLUT4) al igual que disfunción mitocondrial 17.
Los inmunosupresores (tacrolimus, ciclosporina) producen RI y daño tóxico directo sobre la cél β. Es conocida la alta incidencia de DM por la terapia inmunosupresora post trasplante, independiente del uso de corticoides. Asimismo, los pacientes tratados con interferón α desarrollan DM secundaria a anticuerpos contra las células de los islotes. Se menciona la diabetes post trasplante dentro de las atípicas.
El ácido nicotínico aumenta la RI y las tiazidas alteran la secreción insulínica por hipokalemia.
Inhibidores de la hidroximetilglutaril-CoA reductasa. Se ha descrito un aumento de nuevos casos de diabetes en pacientes en tratamiento con estatinas, en meta análisis de individuos recibiendo estatinas versus placebo en un 10-12%, siendo el riesgo mayor con un tratamiento más intensivo y con atorvastatina y rosuvastatina que pravastatina 18,19. Los mecanismos por los que estas favorecen la aparición de diabetes no están claros. Se ha planteado la disminución de la insulino sensibilidad y la captación de glucosa por el adipocito, tejidos muscular y hepático y menor secreción de insulina por las cel β. A pesar del aumento del riesgo de diabetes asociado al uso de estatinas, análisis riesgo-beneficio han demostrado que el beneficio de las estatinas en relación a la enfermedad cardiovascular (ECV) supera el riesgo de diabetes 20.
F. DIABETES INDUCIDA POR INFECCIONESAlgunos virus causan daño directo en la cel β. Se han descrito DM no asociadas a autoinmunidad en rubéola congénita y otros virus, entre ellos Coxsackie B, citomegalovirus y adenovirus.
G. FORMAS INFRECUENTES DE DIABETES MEDIADA POR INMUNIDADLa diabetes se puede asociar a múltiples enfermedades autoinmunes con diferente etiología pero que llevan a un proceso de insulinitis similar al de la DM1.
Los pacientes con el síndrome deStiff-man (hombre rígido), una enfermedad autoinmune del sistema nervioso central caracterizada por rigidez y espasmos musculares dolorosos, suelen tener títulos elevados del autoanticuerpo anti decarboxilasa del ácido glutámico (anti GAD). Un 30-50% de estos pacientes desarrollan DM1.
Los anticuerpos anti-receptor de insulina pueden causar diabetes, ya que se unen al receptor, bloqueando su unión con la insulina y reduciendo su acción en tejidos blanco. Sin embargo, estos anticuerpos también pueden actuar como agonistas induciendo hipoglicemias.
Su frecuencia es muy escasa y no la hemos visto nunca en nuestra práctica clínica.
H. OTROS SÍNDROMES GENÉTICOS ASOCIADOS A DIABETESMuchos trastornos genéticos tales como los síndromes de Down, Klinefelter, Turner y otros se acompañan de una mayor incidencia de DM.
DIABETES ATÍPICASEn este subtipo de DM incluimos la DM2 en niños y adolescentes, la diabetes propensa a la cetosis (ketosis prone type 2 diabetes) y la diabetes autoinmune latente del adulto (Latent Autoinmune Diabetes in Adults, LADA), las catalogamos como atípicas debido a su comportamiento clínico no habitual; además, se agrega la diabetes post trasplante. Las DM analizadas en este acápite, no aparecen en la clasificación original de la ADA.
DM2 en niños y adolescentes. El aumento de la obesidad y sedentarismo se ha visto aparejado con un aumento de DM2 que se presenta en niños y jóvenes. La relación entre sensibilidad a la insulina y capacidad secretora de esta es fundamental para mantener la homeostasis glucídica. Para una tolerancia normal a los hidratos de carbono, la menor sensibilidad es compensada con mayor secreción. La RI (hepática y muscular) y el déficit de secreción son fundamentales en su patogénesis. La obesidad, particularmente la abdominal y su asociación a insulino resistencia, es un factor de riesgo relevante. La mayoría de los pacientes con DM2 tienen antecedentes familiares. Los adultos que tienen un padre enfermo tienen un riesgo de 30-40% de presentar DM2, si son ambos padres, un 70% 21. En jóvenes con antecedente de madres con diabetes gestacional o previa al embarazo se presentan a menor edad, con mayor disglicemia y reducción de la función celular β 22. La herencia es determinante, en estudios en adultos se han identificado m¿ltiples variantes asociadas a DM2. No existen publicaciones de estudios genéticos en niños y adolescentes.
La clínica de estos pacientes puede adquirir múltiples presentaciones, asintomática, con un síndrome diabético agudo y alrededor de 13% con cetoacidosis diabética, y en forma excepcional, con un síndrome hiperglicémico hiperosmolar 23.
Los niños y adolescentes con DM2 tienen mayor riesgo de presentar comorbilidades como hipertensión arterial, dislipidemia, nefropatía, enfermedad cardiovascular subclínica e hígado graso no alcohólico. Estudios han mostrado que estos pacientes tienen mayor riesgo de presentar complicaciones microvasculares. En el estudio SEARCH, se estimó una prevalencia de 42% de retinopatía en niños con una DM2 de 7,2 años desde su diagnóstico 24. En el estudio TODAY, se informó una prevalencia de 13,7% en jóvenes con una DM2 de 4,9 años. Los niños o jóvenes con DM2 deben ser evaluados con fondo de ojo al diagnóstico. En relación al aumento de la excreción urinaria de albúmina persistente entre 30 y 300mg/24 horas, que es la primera manifestación de nefropatía, en el SEARCH 22% de los jóvenes la presentaban, en el TODAY al inicio del estudio era un 6,3%, aumentando a 16,6% a 6 años 25. Además, mayores niveles de hemoglobina glicosilada A1c estaban significativamente relacionados a mayor riesgo de presentar albuminuria elevada. Un estudio canadiense encontró que los niños con DM2 tienen 4 veces mayor riesgo de desarrollar insuficiencia renal terminal versus jóvenes con DM1 26. Existen muy pocas publicaciones que informen de neuropatía en esta población. Los adolescentes con DM2 tienen también mayor riesgo de presentar complicaciones macrovasculares, debido a la asociación con obesidad, sedentarismo, dislipidemia, hipertensión e hiperglicemia.
El tratamiento de la DM2 en jóvenes debería ser abordado por un equipo multidisciplinario y dirigido al paciente y su familia, enfocado en lograr cambios de estilo de vida, implementando una alimentación saludable y actividad física regular, sumado a tratamiento farmacológico para normalizar la glicemia, reducir el peso y tratar las comorbilidades como dislipidemia, hipertensión arterial y esteatohepatitis.
Diabetes con tendencia a la cetosis (DTC). Corresponde a una variante de DM2 previamente denominada diabetes atípica, DM intermedia y “Flatbush diabetes”. Fue descrita inicialmente en afroamericanos y posteriormente, aunque en menor proporción, se ha reconocido en todas las etnias. Es más frecuente en hombres (2-3:1) con edad promedio de 40 años (33-53 años). Se caracteriza por debutar con cetoacidosis (CD) sin factor desencadenante, y una vez resuelto el cuadro agudo, puede mantenerse un buen control metabólico con dieta y fármacos antidiabéticos orales 27.
En la etapa aguda existe una severa alteración en la secreción y en la acción de la insulina y posteriormente, con el control glicémico, ambos trastornos se recuperan lo que permite discontinuar la terapia insulínica. Puede presentarse recurrencia de la CD. Su patogenia no es clara. Los pacientes con DTC carecen de marcadores autoinmunes y de asociación genética HLA. El principal determinante de la severa descompensación metabólica sería una falla transitoria de la cel β por glucotoxicidad, en sujetos predispuestos 28.
Los pacientes que se presentan con DTC y plantean dificultades diagnósticas, deben ser egresados con terapia insulínica y estudiarlos con marcadores inmunológicos y péptido C para su mejor clasificación y manejo.
Diabetes autoinmune latente del adulto (Diabetes Autoimmune of Adults, LADA). Se ha denominado diabetes 1.5. Es una forma lentamente progresiva de DM tipo 1 o autoinmune que no requiere terapia con insulina por un tiempo variable.
Se plantea el diagnóstico en pacientes que cumplan 3 criterios clínicos: se presente en la edad adulta, usualmente en mayores de 35 años aunque puede presentarse más tempranamente, presencia de autoanticuerpos para DM1 circulantes, que los distinguen de pacientes con DM2, no requerir insulina al diagnóstico, lo que los distingue de la forma clásica de la diabetes mellitus tipo 1 29.
En el estudio UKPDS (United Kingdom Prospective Diabetes Study) realizado en pacientes con DM2, aproximadamente el 10% al momento del diagnóstico tenían autoinmunidad evidenciada con anticuerpos ICA (anti islote) o anti GAD (ácido glutámico descarboxilasa). Estos adultos progresaron a dependencia de la insulina más rápidamente que los con anticuerpos negativos. La historia natural de la enfermedad no ha sido bien definida. Se plantea exista una larga historia de autoinmunidad con una lenta progresión a través del tiempo del daño β cel, o tal vez aparición de autoinmunidad tardía con una fase preclínica breve 30.
Los pacientes con LADA comparten susceptibilidad genética HLA (Human Leukocyte Antigen) y marcadores de autoinmunidad con los pacientes con DM1, pero se diferencian en el tipo y número de anticuerpos. Los LADA habitualmente presentan un solo auto anticuerpo, el anti GAD positivo.
Sin embargo, hay evidencia que en este grupo de pacientes hay heterogeneidad inmunogenética relacionada con los títulos de anti GAD, lo que establece diferencias fenotípicas que dificultan su identificación. Los pacientes con títulos altos de anti GAD se parecen más genética y fenotípicamente a los DM1. En cambio, los LADA con bajos títulos de anticuerpos son muy similares a los DM2, presentando incluso síndrome metabólico, y solo se diferencian de éstos por la presencia de susceptibilidad HLA. Los sub tipos LADA con bajos títulos tienen genes protectores de la célula β y se plantea que la RI adelantaría su presentación clínica 31.
Su manejo inicial es con dieta y ejercicio, más drogas antidiabéticas orales, a la fecha no se ha demostrado beneficio de algún agente hipoglicemiante en particular en estos pacientes. La terapia con insulina es de elección.
Diabetes post trasplante. Es la complicación metabólica más frecuente en pacientes trasplantados. Se denominaba nueva diabetes post trasplante (NODAT por su sigla en inglés), haciendo énfasis en las relevantes consecuencias fisiopatológicas del trasplante en el metabolismo glicémico. Sin embargo, el International Consensus Panel acordó llamarlas diabetes post trasplante (DPT), ya que muchas correspondían a diabetes no diagnosticadas previo a la cirugía 32. El término NODAT involucraba haber hecho una pesquisa previa, lo que con gran frecuencia no ocurre. El término DPT debe ser utilizado para pacientes clínicamente estables que han presentado persistente hiperglicemia post trasplante. La hiperglicemia inmediatamente post trasplante es muy frecuente, pudiendo afectar al 90% de los trasplantados de riñón en las primeras semanas.
El diagnóstico debe ser hecho cuando el paciente se encuentre estable, recibiendo su terapia inmunosupresora planificada y sin complicaciones infecciosas. Los criterios diagnósticos son los mismos, adquiriendo mayor sensibilidad en esta población la prueba de tolerancia a la glucosa. La HbA1c utilizada por la ADA (dos valores iguales o mayores a 6,5%) en estos pacientes puede estar subestimada, ya que frecuentemente tienen anemia y glóbulos rojos con reducida sobrevida secundario a enfermedad renal o hepática. Si la HbA1c está elevada, se deben solicitar glicemias para descartar diabetes. Los factores de riesgo son los mismos que para DM2, edad mayor de 45 años, historia familiar de DM2, grupos étnicos hispanos y afroamericanos, alteración de la glucosa previa, sobrepeso u obesidad, infección por virus de la hepatitis C o citomegalovirus e hipertrigliceridemia. Algunos fármacos inmunosupresores contribuyen al riesgo como los corticoesteroides y el inhibidor de la calcineurina, el tacrolimus. La ciclosporina y los inhibidores de mTOR como el sirolimus también aumentan el riesgo 33. La DPT aumenta la frecuencia de infecciones y eventos cardiovasculares, disminuyendo la sobrevida del paciente y de los injertos. El tratamiento de elección es la insulinoterapia. Al alta, en pacientes que requieren bajas dosis de insulina y sin contraindicaciones, se puede implementar terapia antidiabética oral.
Queremos señalar que aunque los subtipos de diabetes analizados en este artículo son de baja frecuencia, es importante tenerlos presentes, hacer la pesquisa y el diagnóstico específico de ellos. La clasificación del tipo de DM, la mayoría de las veces se realiza en base a las características clínicas del paciente; en un grupo pequeño apoyado por exámenes más específicos, tales como: marcadores inmunológicos, función β celular (péptido C) o estudios genéticos. El diagnóstico preciso es el camino que nos lleva a la mejor terapia de nuestros pacientes.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Las imágenes de este artículo han sido autorizadas por los pacientes para su publicación.