La definición clásica de nódulo pulmonar solitario corresponde a una imagen radiológica de menos de 3cms que puede corresponder a múltiples condiciones tanto benignas como malignas. Sin embargo con la masificación del uso del TAC de tórax se detectan actualmente diferentes tipos de NP pequeños, incluso subcentrimétricos: sólidos, en vidrio esmerilado (VE) y mixtos. Cada uno con diferente ritmo de crecimiento y diferente potencial de malignidad. Los recientes avances en oncología torácica, tanto en procedimientos diagnósticos como terapéuticos, han hecho que la definición clásica sea insuficiente para incorporar todas las variaciones en el comportamiento de los diferentes nódulos pulmonares que se pesquisan actualmente. Aparte del enfrentamiento habitual de nódulos sólidos de mayor tamaño, se ha definido el manejo de nódulos pequeños sólidos y subsólidos. Se ha establecido claramente que las lesiones en VE tienen un mayor riesgo de malignidad, existiendo una buena correlación entre el aspecto radiológico y el grado histológico. Las lesiones mixtas que persisten en el tiempo y las lesiones en VE en que se desarrolla un componente sólido son las de más alto riesgo de representar un Adenocarcinoma invasor.
Por tanto, todos los nódulos, incluso más pequeños subcentrimétricos, deben ser evaluados por equipos multidisciplinarios, con experiencia en los diferentes algoritmos de manejo y seguimiento. Determinando qué nódulos biopsiar de manera de poder resecar tumores iniciales potencialmente curables. Los tumores pequeños pueden ser operados con técnicas quirúrgicas mínimamente invasivas, incluso resecciones sublobares, con similares resultados oncológicos, pero con menor riesgo y menor deterioro de la capacidad funcional.
The definition of a solitary pulmonary nodule corresponds to a radiological image of less than 3cms that may correspond to multiple conditions both benign and malignant. However with the extended use of Chest CT a great number of small sub-centrimetric Pulmonary Nodules are detected: solids, ground-glass opacities (GGO) and mixed lesions. Each with different growth rates and malignant potential.
Diagnostic and treatment advances in thoracic oncology, made the classic definition insufficient to incorporate all the difference in growth rate and behavior of the different lung nodules currently detected.
In addition to the management larger solid nodules, new diagnostic and treatment algorithms for small GGO and mixed nodules have been defined. It has clearly established that GGO lesions have an increases risk of malignancy, with correlation between radiologic imaging and pathology. Mixed lesions that persist or enlarge during follow-up, or GGO lesions that develop a solid component have the higher risk of representing an invasive adenocarcinoma.
Therefore, all nodules, even small sub-centrimetric, should be evaluated by multidisciplinary teams, with experience in management and treatment algorithms determining when to resect potentially curable tumors. Small tumors can be resected by minimally invasive surgery, including sub lobar resections, with equivalent oncologic outcomes, lower risks and better preservation of pulmonary function.
La definición clásica de nódulo pulmonar solitario corresponde a una imagen radiológica de menos de 3cms rodeada de parénquima pulmonar que puede corresponder a múltiples condiciones tanto benignas como malignas1.
Sin embargo en los últimos años se han producido grandes avances en la oncología torácica, tanto en métodos diagnósticos, estudios anátomo-patológicos y moleculares y en el tratamiento, tanto médico como quirúrgico, que han hecho que el concepto de nódulo pulmonar solitario sea insuficiente para el manejo de los diferentes tipos de nódulos pulmonares (NP) que enfrentamos hoy en la práctica clínica.Figura 1
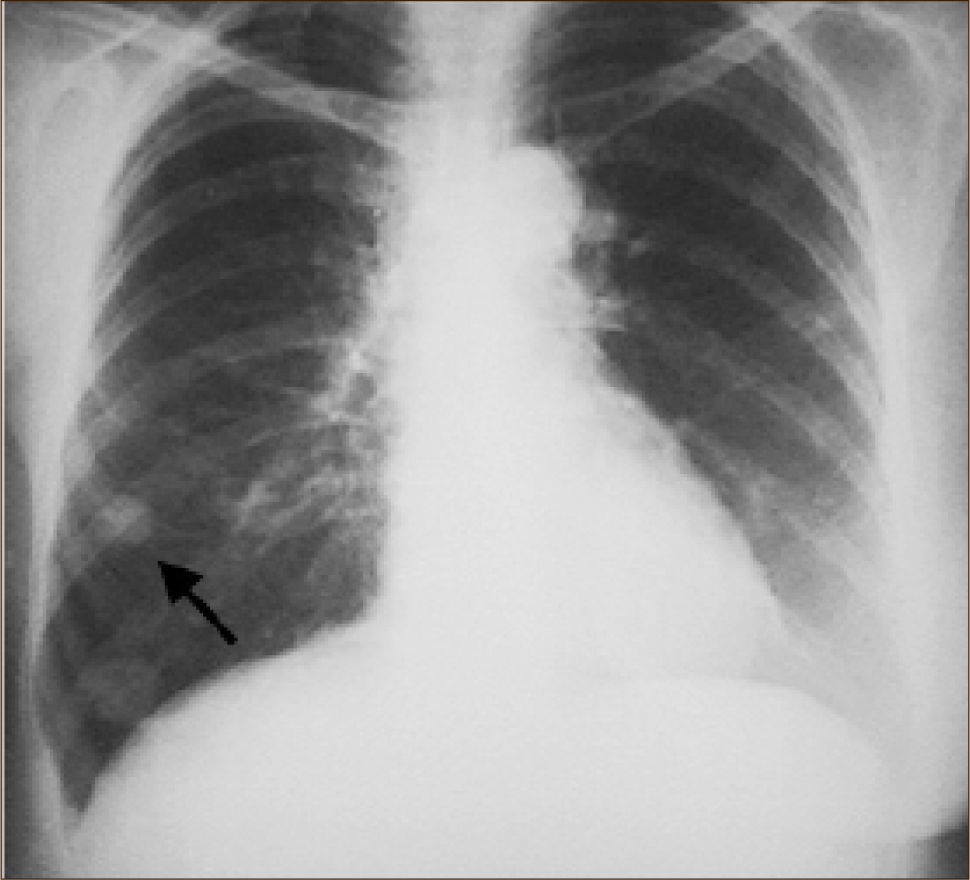
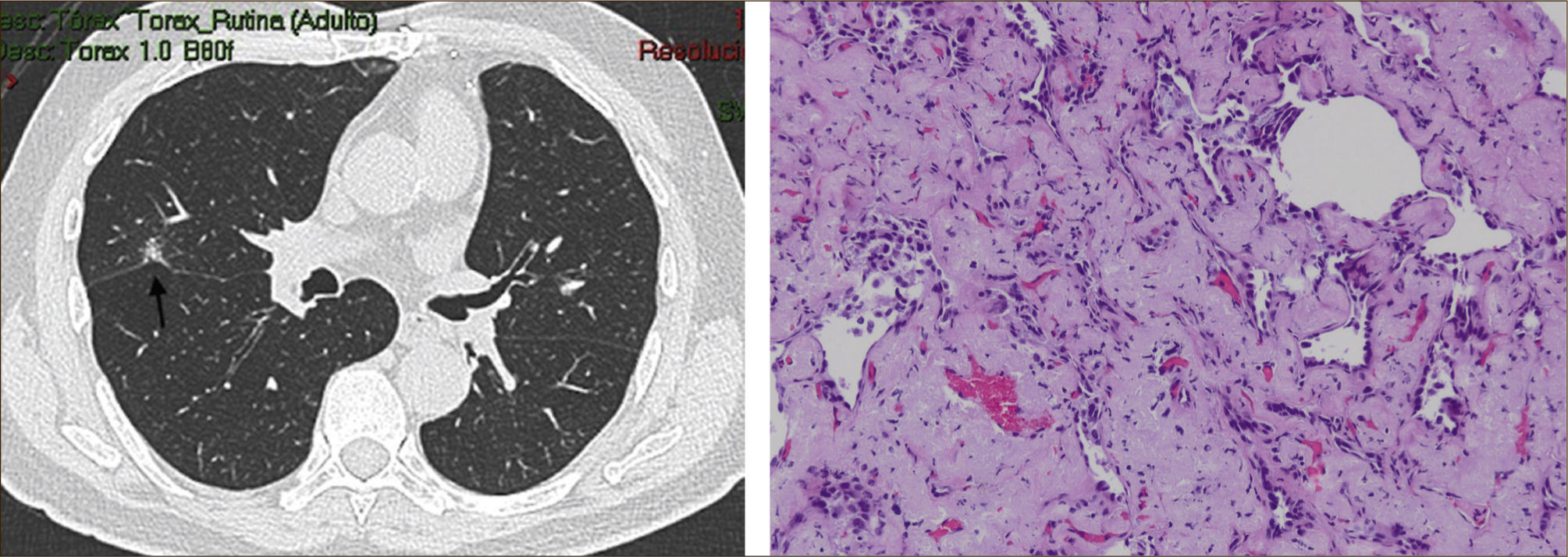
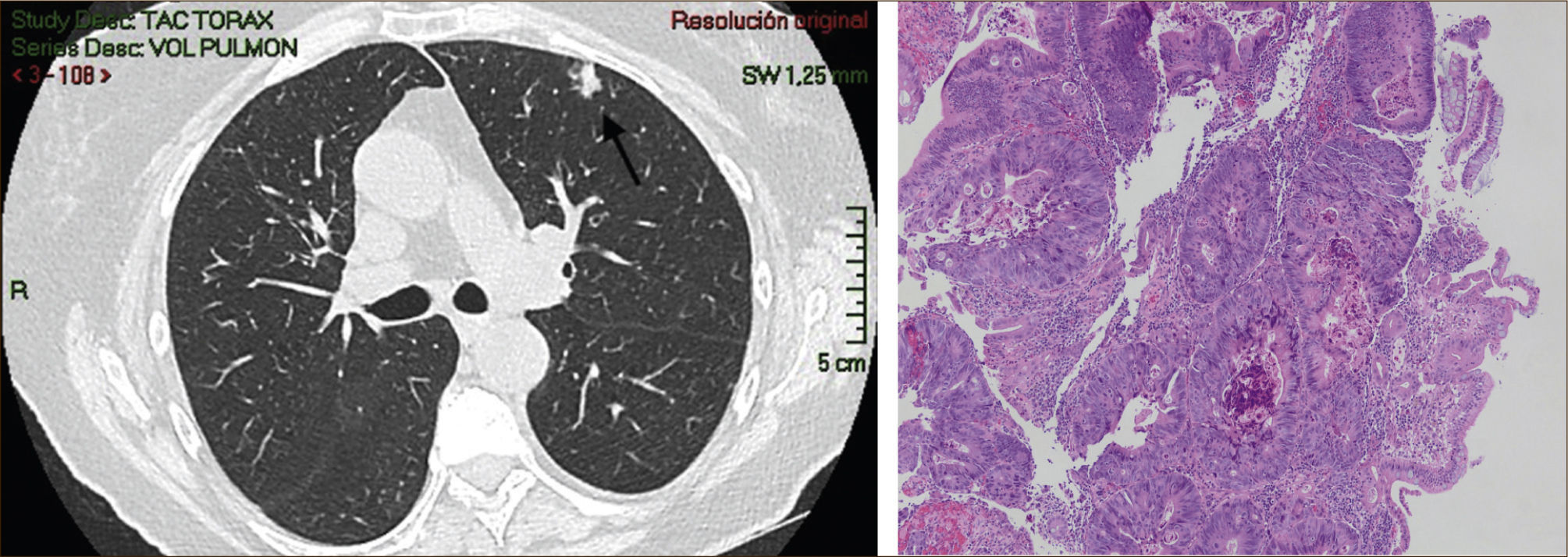
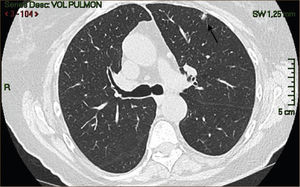
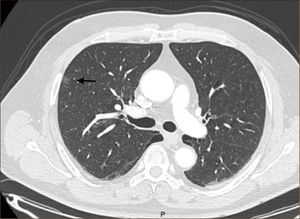
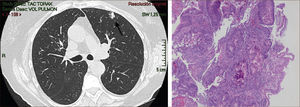
La masificación de los métodos de diagnóstico por imágenes, especialmente del TAC de Tórax, ha significado un importante aumento en la detección de NP pequeños, menores de 2cm, no visibles en la radiografía de tórax. Estos nódulos pueden ser tanto sólidos como sub-sólidos, cada uno tiene diferente comportamiento, velocidad de crecimiento y probabilidad de malignidad2,3 (Figuras 2 y 3).
El diagnóstico diferencial de los nódulos pulmonares es amplio e incluye además del cáncer pulmonar, metástasis de otros primarios y lesiones benignas: infecciosas (tuberculoma, granulomas no tuberculosos, quiste hidatídico), inflamatorias, vasculares (secuestro intrapulmonar), traumáticas y congénitas (hamartomas, quistes bronquiales)1.
Diferentes características radiológicas y su comportamiento en el tiempo permiten sospechar su etiología: nódulos calcificados, bien delimitados y que no crecen sugieren lesiones benignas; mientras que nódulos espiculados o irregulares que crecen en controles sucesivos, sugieren etiología maligna2,4–7.
Se han desarrollado diferentes algoritmos de decisión para el estudio racional de los nódulos, incluyendo exámenes como TAC seriados, PET/CT y biopsias por fibrobroncoscopía, EBUS, percutánea o quirúrgica4–7.
Es por tanto muy importante conocer los diferentes tipos de nódulos pulmonares, y cómo diferenciar los que corresponden a lesiones benignas y los sospechosos de corresponder a un cáncer pulmonar así como los diferentes algoritmos de manejo y seguimiento actualmente aceptados.
El cáncer pulmonar es un tumor altamente agresivo, correspondiendo a la primera causa de muerte por cáncer a nivel mundial8. Su incidencia ha seguido aumentando en el mundo asociado al consumo de tabaco, especialmente en países en vías de desarrollo y en mujeres8,9.
En nuestro país el cáncer pulmonar es ya el segundo cáncer más frecuente, luego del cáncer gástrico10. El aumento de las esperanza de vida asociado a uno de los índices de tabaquismo más altos de América Latina (41%), significará que en los próximos años el cáncer pulmonar se convertirá en un serio problema de salud pública en Chile10–12.
Revisaremos brevemente algunos avances en el diagnóstico y tratamiento del cáncer pulmonar y su relación con el manejo actual de los nódulos pulmonares. Una presentación más detallada se encuentra en un número anterior de la Revista13.
El cáncer pulmonar se divide en células pequeñas (CPCP) que representa entre el 10 y el 15% del total de tratamiento preferentemente médico y el cáncer pulmonar de células no pequeñas (CPCNP) que representa el 85 a 90% restante y al que nos referiremos con mayor detalle14.
La sobrevida global del CPNCP es aproximadamente 16% a 5 años variando según la etapa desde un 60 y 80% a cinco años en etapa I, a un 0 a 5% en etapa IV15. Solo un 25% de los CPNCP se presenta en etapas iniciales potencialmente curables, lo que explica en parte la altísima letalidad de este tumor15.
Los principales tipos histológicos del CPNCP son el adenocarcinoma (40-50%), el carcinoma escamoso (25%) y el de células grandes (10%). En los últimos años se ha observado un aumento progresivo en la frecuencia de adenocarcinomas, donde además se identificaron inicialmente diversas mutaciones que dieron paso a la terapia personalizada en cáncer pulmonar16–18.
La International Association for the Study of Lung Cancer (IASLC), la American Thoracic Society (ATS) y la European Respiratory Society (ERS) establecieron recientemente una nueva clasificación para los adenocarcinomas, diferenciando entre adenocarcinomas invasores versus adenocarcinoma in situ y mínimamente invasor, debido a las diferencias moleculares, aspecto radiológico, pronóstico y alternativas de tratamiento19.
Se abandonó el término de carcinoma bronquiolo-alveolar que se prestaba a confusión y no se correspondía con la diferenciación entre lesiones pre-invasoras, mínimamente invasoras o invasoras (Tabla 1). Y se definió como componente estándar del estudio anátomo-patológico de este tipo histológico el estudio molecular para determinación de las mutaciones de EGFR y translocación de ALK-ML4 dado su rol predictivo de respuesta a terapia19,20.
Clasificación de Adenocarcinomas Pulmonares de la IASLC/ATS/ERS
| Lesiones pre-invasoras | • Hiperplasia Adenomatosa Atípica • Adenocarcinoma in situ < 3cm (previamente Carcinoma Bronquioloalveolar –BAC) |
| Adenocarcinomas Mínimamente Invasores | • Lesión de < 3 cms con componente invasor < 5 mm • Tipos no-mucinoso, mucinoso y mixto |
| Adenocarcinomas Invasores | • De predominio lepídico con > 5mm invasión (previamente BAC no mucinoso) • Otros tipos: Acinar, papilar, micropapilar, sólido |
| Otras variantes de Adenocarcinomas invasores | • Adenocarcinoma invasor mucinoso (previamente BAC mucinoso) • Otros tipos: coloideo, fetal, entérico |
Adaptado de Travis WD, et al. Journal of Thoracic Oncology 2011, 6(2): 244-285.
En 2009 se adoptó la 7ª Edición de la Clasificación TNM de cáncer pulmonar desarrollada por la (IASLC)32. En ella se estableció como factor pronóstico independiente el tamaño del tumor (T), debido a las diferencias en sobrevida encontradas entre tumores menores de 2cms (T1a), los de 2 a 3cms (T1b), entre 3 y 5cms (T2a), entre 5 y 7 (T2b), y T3 los mayores de 7cms15.
El año 2011 el National Lung Screening Trial, estudio multicéntrico con más de 50.000 sujetos, demostró claramente que la detección precoz mediante TAC de Tórax de baja dosis disminuye la mortalidad por cáncer pulmonar en un 20%. En concordancia con estudios previos de tamizaje mediante TAC de Tórax la gran mayoría de los tumores pesquisados fueron en etapas iniciales21–23.
El tratamiento de elección en las etapas iniciales del cáncer pulmonar es quirúrgico24,25. La cirugía oncológica estándar es la Lobectomía más una Linfadenectomía mediastínica, lo que fue establecido en 1995 por el único estudio randomizado hasta la fecha26. Esta cirugía se realiza actualmente por Videotoracoscopía, con los consiguientes beneficios de las cirugías mínimamente invasivas27–32.
Sin embargo en los últimos años múltiples estudios han ido demostrando que las resecciones sublobares serían cirugías oncológicamente equivalentes a las lobectomías en tumores menores de 2cms (T1a) y especialmente en adenocarcinomas mínimamente invasor o in situ33–37.
Por lo tanto, se detectan más nódulos pulmonares debido al mayor uso del TAC de Tórax. Su uso como herramienta de tamizaje ha demostrado ser efectivo en prevenir la mortalidad por cáncer pulmonar y pesquisar un mayor número de cánceres en etapas iniciales. Se pesquisan además nuevos tipos de nódulos (VE y mixto) que se correlacionan con lesiones pre invasores o tumores mínimamente invasores, para los cuales se discuten nuevas alternativas de tratamiento. Esto ha significado al mismo tiempo una mayor complejidad en el manejo de estos pacientes y en los protocolos de diagnóstico y seguimiento de los diferentes tipos de nódulos pulmonares. Revisaremos algunos de estos aspectos de mayor relevancia para la práctica clínica.
CARACTERIZACIÓN DE LOS NÓDULOS PULMONARESComo se mencionó la definición clásica de nódulo pulmonar consiste en una imagen radiológica de lesiones pulmonares o pleurales que se superponen a las estructuras normales con un desarrollo más o menos similar en las tres dimensiones del espacio. Se denomina nódulos a las opacidades de hasta 30mm de diámetro y masas a las mayores, siempre que estén al menos parcialmente delimitadas2.
Un nódulo pulmonar corresponde por tanto a tumores Etapa I (T1a o T1b). Estas lesiones especialmente las menores de 2cms no son visibles a la Radiografía de Tórax siendo sólo pesquisables mediante TAC, especialmente cuando son subsólidas.
El diagnóstico por imágenes mediante TAC de Tórax, cumple por tanto un rol fundamental en la identificación y caracterización de los nódulos pulmonares. Los cánceres pulmonares iniciales pueden presentarse como nódulos de diferente densidad: sólidos, cavitados, en vidrio esmerilado (VE: definidas como una intensidad discretamente mayor a la del parénquima pulmonar a través de la cual la vasculatura pulmonar es visible) o lesiones mixtas con componente sólido y VE. Figuras 2 y 33. En etapas más avanzadas los CPNCP se presentan como nódulos de mayor tamaño o masas (>3cms), sin embargo también pueden presentarse como lesiones consolidadas mal definidas, especialmente algunos adenocarcinomas productores de mucina. Estas lesiones pueden ser indistinguibles de una neumonía, pero a diferencia de estas persisten en el tiempo pese al tratamiento antibiótico 27,28.
Sólo un bajo número de los NP corresponden a cánceres pulmonares 3,38. En el estudio ELCAP 2,7% y en NLST a 3.8% de los nódulos pesquisados correspondieron finalmente a un CPNCP 21,23,38. Las principales características radiológicas que ayudan a diferenciar un nódulo maligno de uno benigno son: tamaño, densidad y refuerzo con el medio de contraste, además son útiles el contorno del borde, forma, calcificaciones, contenido graso y cavitaciones 3,39.
Los NP con bordes irregulares, espiculados, lobulados o mal definidos tienen una mayor probabilidad de malignidad 40–42. Los CPNCP tienen una mayor vasculatura que los nódulos benignos40. Al evaluar un nódulo en un TAC sin contraste inicial y compararlo luego de la administración de medio de contraste endovenoso se puede evaluar el cambio de densidad, medido en Unidades Hounsfield (UH). Un incremento de menos de 15UH es muy sugerente de benignidad, con una sensibilidad de 98%43,44. Por el contrario un aumento de más de 15UH es sugerente de malignidad. Usando como punto de corte 30UH el valor predictivo positivo de que el nódulo sea maligno alcanza un 71%40,43.
En relación al tamaño mientras mayor sea el tamaño del nódulo mayor es su riesgo de malignidad. Los nódulos menores de 5mm tienen un riesgo de malignidad de 1%, entre 6 a 10mm 24% y entre 11 y 20mm aumenta a 33%. Los nódulos sólidos mayores de 20mm tienen un riesgo de malignidad de 80% y los mayores de 30mm de 90%45–47.
La variación del tamaño del nódulo en el tiempo es muy importante en determinar la probabilidad de malignidad. Nódulos que crecen muy rápido (semanas) o que disminuyen de tamaño sugieren un origen inflamatorio infeccioso. En cambio el crecimiento de un nódulo durante su seguimiento sugiere malignidad. El tiempo de duplicación de los nódulos, es decir el tiempo que un nódulo demora en duplicar su volumen (que corresponde aproximadamente a un aumento del diámetro en un 25%) varía entre 20 y 600 días, siendo más prolongado en las lesiones en VE48,49. Por su lento crecimiento estas lesiones deben seguirse al menos por 3 años para determinar su potencial maligno50.
Actualmente la densidad del nódulo es uno de los aspectos más importantes a considerar en el estudio de los NP. Los nódulos sólidos tienen un riesgo de malignidad general de 7%, y como se mencionó previamente, mientras mayor sea el tamaño del nódulo mayor es el riesgo51.
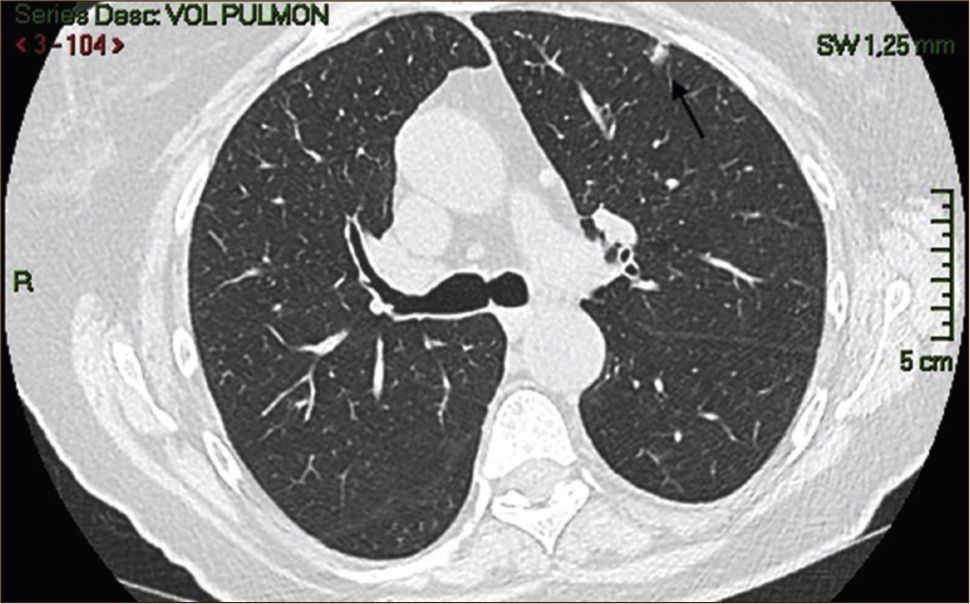
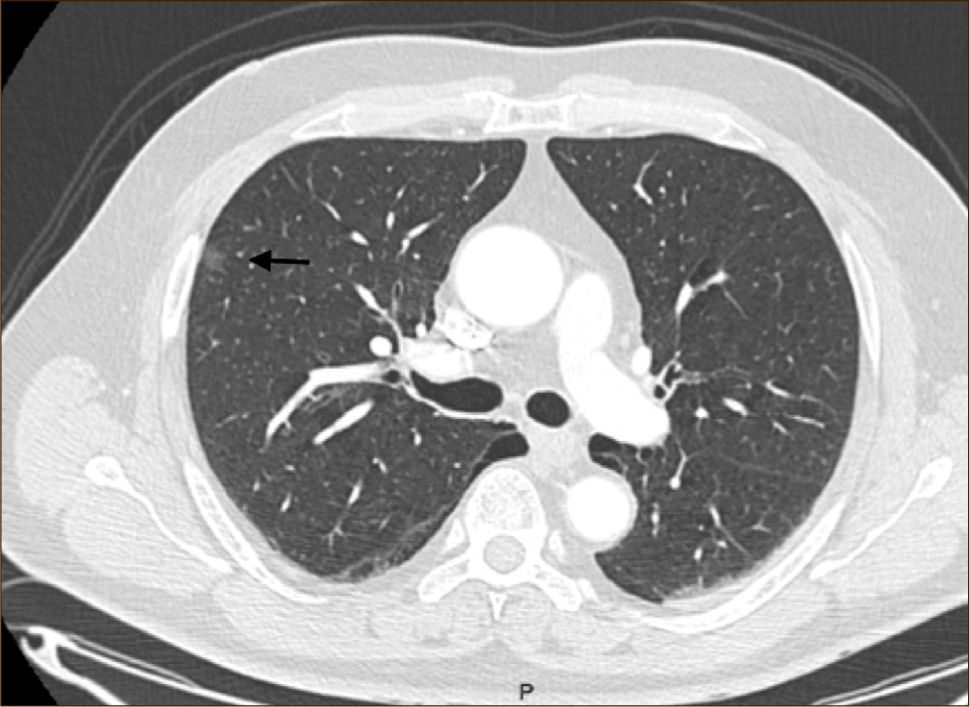
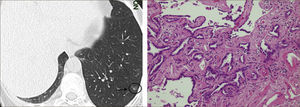
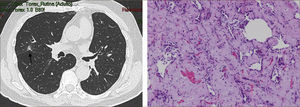
Las lesiones Subsólidas tienen un mayor riesgo de malignidad que puede alcanzar un 18%51. Las lesiones subsólidas pueden corresponder a lesiones en Vidrio Esmerilado Puro (VE o GGO: Ground Glass Opacity) o a lesiones mixtas con un componente en VE y una zona sólida (Figuras 4, 5 y 6).
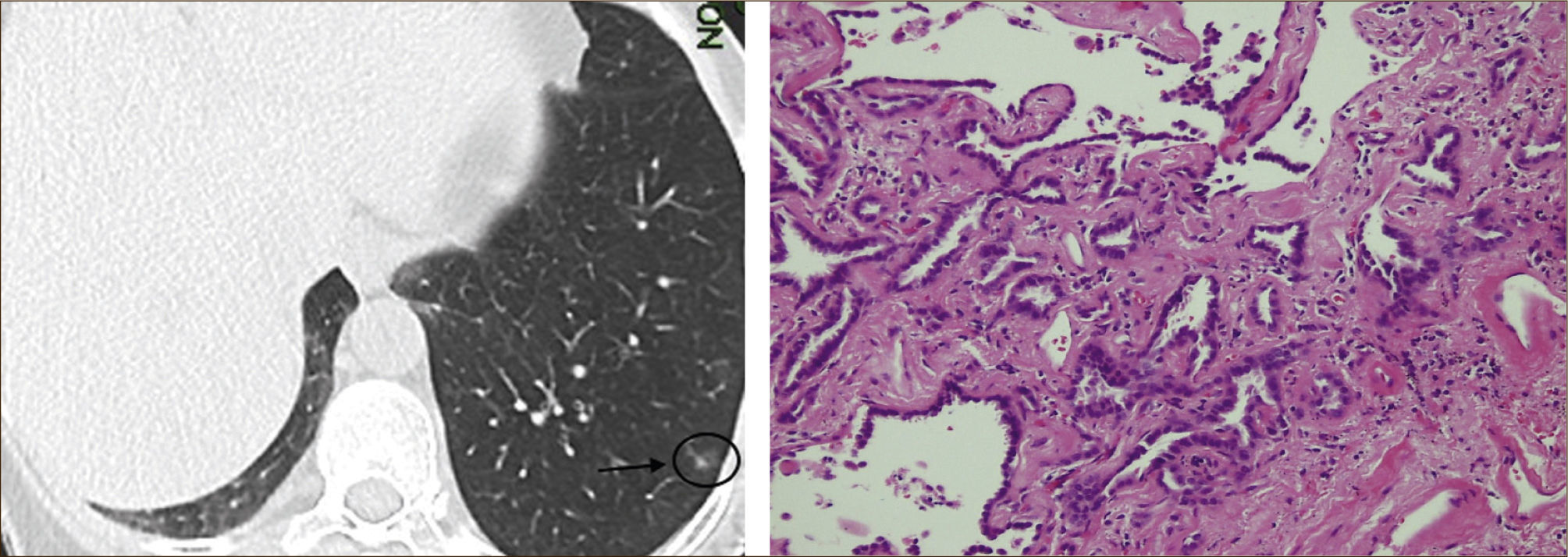
Las lesiones subsólidas fueron caracterizadas inicialmente en Japón. Noguchi en su clasificación definía ya diferentes tipos de Adenocarcinoma (A, B, C, D, y F) los que se correlacionaban con las imágenes radiológicas y tenían diferente pronóstico52.
Asamura recientemente correlacionó también los hallazgos radiológicos con los histológicos en diferentes nódulos pulmonares pequeños. Las lesiones en VE puro corresponderían generalmente a Hiperplasia Adenomatosa Atípica (HAA), las lesiones mixtas (con componente en VE y sólido) a adenocarcinoma in situ y las lesiones mixtas en que el componente sólido sea mayor al 50% de la lesión corresponderían a adenocarcinomas invasores53.
Los nódulos en VE menores a 5mm generalmente corresponden a Hiperplasia Adenomatosa Atípica (HAA). Los nódulos en VE mayores pueden corresponder a HAA o Adenocarcinomas. Los CPNCP que se presentan como lesiones en VE puro (pure GGO) corresponden generalmente a adenocarcinomas in situ, adenocarcinomas tipo A en la clasificación de Noguchi54Figura 4.
Las lesiones mixtas (con componente en VE y sólido), son las que tienen la mayor probabilidad de malignidad, la que alcanza hasta un 63%51. Mientras mayor sea la proporción del componente sólido, mayor es la probabilidad de malignidad y peor el pronóstico. Estas lesiones corresponden a Adenocarcinomas micro invasores o invasores (Noguchi By C), Figura 4. Finalmente el desarrollo de un componente sólido en una lesión en VE o el aumento de la proporción del componente sólido en una lesión mixta en seguimiento indica su transformación en una lesión más agresiva50,51,53–57.
DETECCIÓN PRECOZLa gran mayoría de los CPNCP tiene una etapa pre-clínica prolongada, por lo que desde hace años se ha estudiado la posibilidad de utilizar estudios de imágenes para tamizaje. Estudios realizados en los años 60 mediante radiografía de tórax no demostró ser útil en disminuir la mortalidad por cáncer pulmonar58.
A partir de los años 90 se comenzó a realizar diferentes estudios utilizando el TAC de Tórax para le detección precoz de cáncer pulmonar. El Anti-Lung Cancer Association Project en Japón, permitió pesquisar 11.5% cánceres versus 3.4% con radiografía, el 71% de los tumores correspondían a etapas tempranas22. En Estados Unidos el Early Lung Cancer Action Project, pesquisó 2.7% de cánceres pulmonares, de los cuales 85% correspondía a etapa I23. Estudios iniciales en nuestro país con detección han demostrado cifras similares, se pesquisa entre un 39 a 71% de NP de los cuáles entre 1.5 a 2.7% corresponden a CP59–61.
Recientemente el National Lung Screening Trial permitió demostrar claramente que el tamizaje con TAC de Tórax de baja dosis es útil para la detección precoz de cáncer pulmonar. Este estudio multicéntrico incluyó a 53.454 individuos mayores de 55 años con gran carga tabáquica (más de 30 paquetes/año); obteniendo una reducción en la mortalidad por cáncer pulmonar de 20% en los individuos seguidos con TAC de Tórax en relación a los seguidos con Radiografía de Tórax15.
En base al NLST y resultados pre-eliminares del estudio NELSON, se ha empezado a recomendar el uso del TAC de Tórax para la detección precoz de cáncer pulmonar en poblaciones de alto riesgo38,50,62–64. Sin embargo han aparecido varios problemas además del aspecto económico de un tamizaje con TAC.
Se detecta un número muy importante de nódulos15,21–23,59–64, de los cuales sólo un baja proporción corresponden a cánceres pulmonares, es decir un importante número de falsos positivos (94.5% en el NLST y 59.4% en los resultados iniciales del estudio NELSON) y existen riesgos potenciales asociados al estudio de estos: radiación acumulada y los falsos positivos que necesitarán biopsias y/o cirugías potencialmente evitables38,50,64,65.
Además se pesquisan nódulos de diferentes tipos (sólidos, VE y mixtos) con diferentes tamaño, tiempo de duplicación y riesgo de malignidad. Lo que requiere de diferentes y complejos protocolos de estudio diagnóstico y seguimiento aún en desarrollo. Ejemplo de estos protocolos de estudio de NP son las guías desarrolladas por la American Cancer Society (ACS), la National Comprehensive Cancer Network (NCCN), el American College of Chest Physicians (ACCP), y la American Society of Clinical Oncology (ASCO) 4–7.
En general el tamaño, tipo de nódulos y comportamiento en el tiempo son las variables más importante a considerar. Además es importante el riesgo de desarrollar cáncer pulmonar de cada sujeto (carga tabáquica, edad, antecedentes de cáncer familiares, exposición a carcinógenos, etc.).
Nódulos sólidos menores a 4mm sólo requieren un seguimiento en 12 meses, en cambio nódulos mayores de 8mm requieren un nuevo TAC en 3 meses o un TAC con contraste (para ver el refuerzo en UH), PET/CT o biopsia. Los nódulos de tamaño intermedio requieren seguimiento a diferentes intervalos. Si un nódulo sólido permanece estable por un período de 2 años se considera benigno4–7,39,49,50,54,63.
Las lesiones en VE corresponden en mucho casos a lesiones inflamatorias por lo que se recomienda un TAC inicial a los 3 meses, en este primer control ceca del 75% de estas lesiones desaparece. Las lesiones en VE que persisten corresponden como se mencionó generalmente a HAA o Adenocarcinoma in situ, los que tienen tiempos de duplicación prolongados. Se requiere por tanto seguimiento anual al menos por 3 años para determinar que no progresan. Las lesiones de mayor tamaño (>10mm) o que crecen o desarrollan un componente sólido durante el seguimiento deben ser biopsiadas3–7,48–50,53–57.
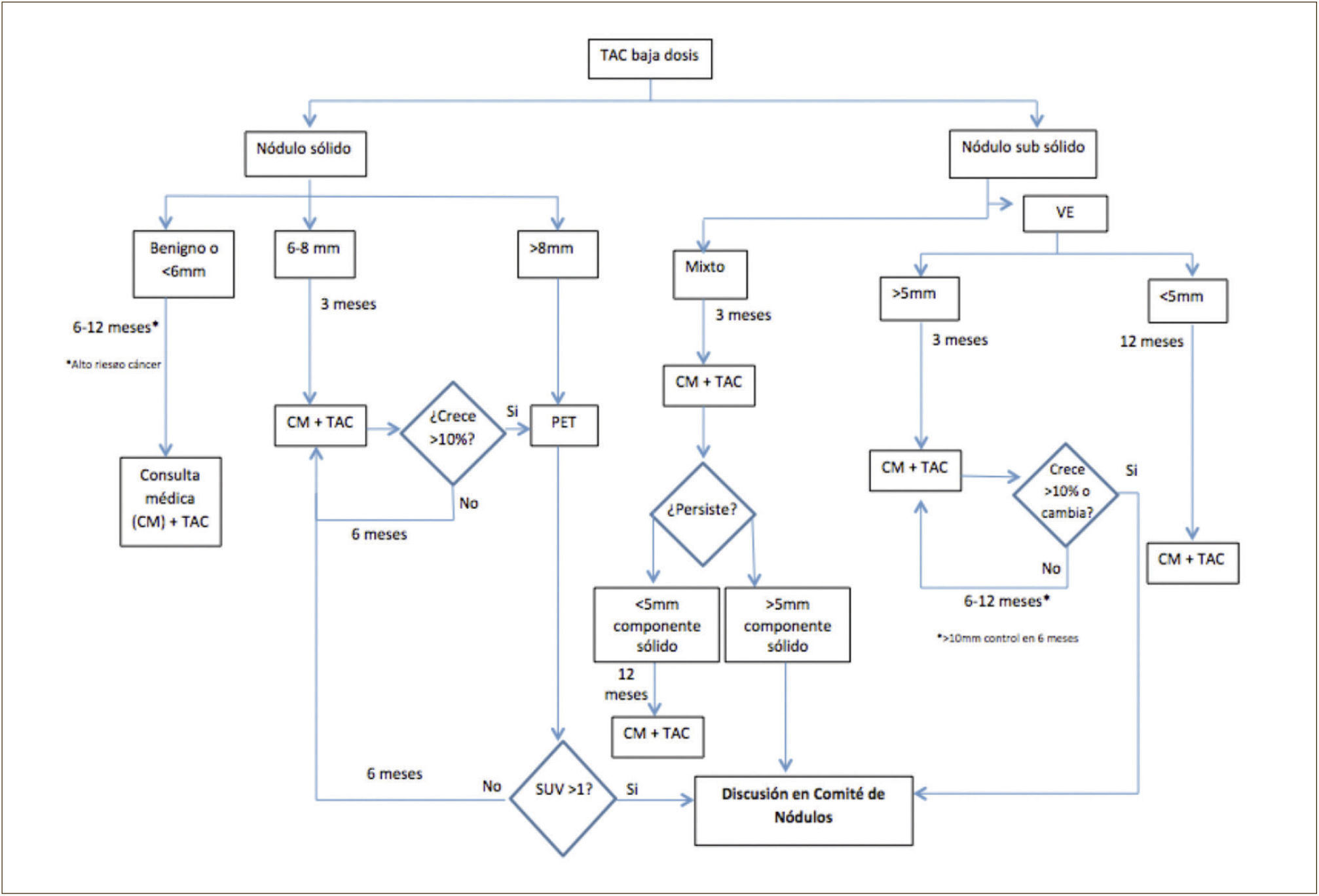
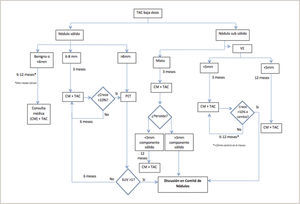
Es recomendable que estas lesiones, una vez pesquisadas, sean evaluadas en un grupo multidisciplinario (radiólogos, broncopulmonares, oncólogos y cirujanos de tórax) con experiencia en los protocolo de manejo de los NP; “Clínica de Nódulos”4. Estableciendo el riesgo de malignidad de un NP en cada caso particular y determinado que estudio realizar: seguimiento con TAC, PET/CT o biopsia ya sea por punción bajo TAC, broncoscópica o quirúrgica, considerando la experiencia y resultados con cada técnica en cada centro en particular3–7,48–51. En la Figura 7 se presenta parte del algoritmo de seguimiento de los NP en Clínica Las Condes.
TRATAMIENTOComo se mencionó previamente, el tratamiento de elección en las etapas iniciales del cáncer pulmonar es quirúrgico24,25. Siendo la cirugía oncológica estándar la Lobectomía más Linfadenectomía mediastínica26,66–68. Esta cirugía se realiza en forma mínimamente invasiva en la mayoría de los centros con experiencia en Cirugía Torácica, con resultados equivalentes a la cirugía abierta, pero con los beneficios de este tipo de cirugía: menor estadía hospitalaria, reincorporación laboral precoz, menos complicaciones y mejores resultados en pacientes de edad avanzada27–32.
Sin embargo, en los últimos años se ha comenzado a cuestionar si es necesario realizar una resección pulmonar tan extensa en tumores pequeños menores de 2cms (T1aN0M0), especialmente en los de bajo grado, como Adenocarcinoma in situ o mínimamente invasor33–37,53,54,69,70. Especialmente considerando que un 8-11% de los pacientes con CPNCP etapa I resecados desarrollarán un segundo primario metacrónico antes de 5 años71,72.
Siguiendo la experiencia inicial de autores japoneses, múltiples estudios han ido demostrando que las resecciones sublobares serían cirugías oncológicamente equivalentes a las lobectomías en tumores menores de 2cms (T1a) y especialmente en adenocarcinomas mínimamente invasor o in situ33,34,38,69,70. Se ha estudiado extensamente el tipo de resección (resección no anatómica o segmentectomía anatómica) y los márgenes necesarios para poder realizar este tipo de resecciones, incluyendo citología del margen y compromiso del linfonodo segmentario35–37.
Las segmentectomías regladas, técnicamente más complejas que las lobectomías, también pueden ser realizadas por Videotoracoscopía con resultados equivalentes a la cirugía abierta37. Existiendo actualmente dos trabajos randomizados multicéntrico en curso en Japón y Estados Unidos comparando los resultados de lobectomía versus segmentectomías anatómicas en tumores de <2cms que permitirán esclarecer este punto70,73,74.
CONCLUSIONESImportantes cambios se han producido en los últimos años respecto al diagnóstico y manejo de los nódulos pulmonares. La masificación del uso del TAC de tórax y su uso inicial en programas detección precoz, permiten detectar un número creciente de NP pequeños, tanto sólidos, como en VE y mixtos. Cada uno con diferente potencial de malignidad y diferentes algoritmos de manejo y seguimiento.
Los últimos avances en oncología torácica, especialmente en el manejo de tumores pequeños, ha significado que la definición clásica de NP sea actualmente insuficiente para incorporar todo el espectro, tanto diagnóstico como terapéutico, de los diferentes NP que se pesquisan hoy.
Las lesiones en VE previamente no bien caracterizadas tienen un claro riesgo de malignidad, existiendo una buena correlación entre el aspecto radiológico y el grado histológica (HAA, Adenocarcinoma in situ, Adenocarcinoma mínimamente invasor o invasor). Las lesiones mixtas que persisten en el tiempo y las lesiones en VE en que se desarrolla un componente sólido son las de mayor riesgo de representar un Adenocarcinoma invasor y deberían ser biopsiadas.
Todos los NP, incluyendo los pequeños subcentrimétricos, que sean pesquisados tanto en forma incidental como en programas de detección, deberían ser evaluados por equipos multidisciplinarios con experiencia en el manejo y tratamiento de los NP (Clínica de Nódulos). Estos equipos pueden identificar mejor los NP con alta probabilidad de malignidad que deben ser resecados. En cánceres pulmonares pequeños diagnosticados de esta manera es posible realizar resecciones sublobares videotoracoscópicas, mejorando la sobrevida por cáncer pulmonar y con mayor preservación de la función pulmonar. El autor declara no tener conflictos de interés, en relación a este artículo.