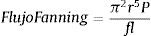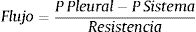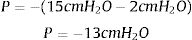Dentro de la cirugía de tórax, las pleurostomías desempeñan un papel fundamental, tanto en el tratamiento como en la rehabilitación y pesquisa de complicaciones. La mayoría de los cirujanos maneja las pleurostomías basados en los dogmas de sus mentores o del lugar donde se entrenaron. Existen varios tipos de drenajes pleurales, sin embargo la elección de cada uno depende exclusivamente de la patología en cuestión. Los equipos de drenaje han sufrido modificaciones a lo largo de los años, siendo hoy en día más cómodos y seguros. La evaluación del equipo de drenaje, debe responder ciertas preguntas esenciales, que guiarán la conducta a seguir. Para el retiro del drenaje deben cumplirse al premisas que evitan complicaciones a futuro. En este artículo se realiza una revisión de los aspectos más importantes que se deben considerar para llevar a cabo un manejo adecuado de las pleurostomías.
Chest tubes play a crucial role in thoracic surgery, especially in terms of rehabilitation and early detection of complications. Most surgeons decide how to manage chest tubes based on their previous training. There are different kinds of thoracostomy devices, choice depends on the pathology aimed. Drainage equipment has changed over the years, becoming safer and more confortable.
Equipment assessment must respond crucial questions, to guide the conduct. To avoid future complications, drainage removal should meet some specific criteria. This article reviews the most relevant aspects related to chest tubes, in order to achieve an adequate management.
Dentro de la cirugía de tórax, las pleurostomías desempeñan un papel fundamental, tanto en el tratamiento como en la rehabilitación y pesquisa de complicaciones.
Un mal manejo de las pleurostomías puede desencadenar serias complicaciones, que en algunos casos requieren de una cirugía a cielo abierto para ser solucionadas, agregando inherentemente una morbimortalidad considerable.
La mayoría de los cirujanos maneja las pleurostomías basados en los dogmas de sus mentores o del lugar donde se entrenaron, más que en revisiones actualizadas de literatura científica, dada la escasa información respecto al tema (1).
A pesar de esto, no hay discusión en que el uso de las pleurostomías es un medio que acompaña, salvo excepciones muy precisas, a todos los procedimientos en que se abre la cavidad pleural.
En este artículo se realiza una revisión de los aspectos más importantes que se debieran considerar para llevar a cabo un manejo adecuado de las pleurostomías.
FISIOLOGíA DEL ESPACIO PLEURALLa ventilación resulta de los cambios activos de volumen del tórax que se transmiten al pulmón gracias a un sistema de acoplamiento por vacío que asegura un estrecho contacto, sin adherencia, entre pulmón y caja torácica. Esto se logra por la presencia de las pleuras que, como todas las serosas, están formadas por una hoja parietal y otra visceral. La formación de líquido pleural por ultrafiltración depende del balance entre las presiones que mueven el líquido desde los capilares parietales hacia el espacio pleural (presión intracapilar, presión negativa intratorácica, presión oncótica del líquido pleural) y aquellas que tienden a impedir su salida (presión oncótica intracapilar) (2). Habitualmente el líquido ultrafiltrado suele provenir de las regiones apicales y bordea los 350cc diarios (3). El drenaje se produce en los estomas linfáticos de la pleura parietal mediastínica, diafragmática y costal basal. La diferencia neta entre las presiones de la pleura parietal y el espacio pleural suele ser de 7cm H2O. Esto genera un pequeño balance positivo (a favor de la ultrafiltración) que permite mantener un promedio de 0.25ml/kg de líquido en la cavidad pleural (4). Con la acumulación de agua, aire, sangre u otros líquidos en el espacio pleural, se pierde la presión negativa y el pulmón tiende a colapsarse, lo que lleva a hipoventilación alveolar e hipoxia; eventualmente, esta presión intrapleural puede incrementarse y provocar un desplazamiento del mediastino hacia el lado contrario, lo cual compromete aún más la ventilación y llega, inclusive, a disminuir el retorno venoso (5). De esta manera, los objetivos que se persiguen con las pleurostomías son el vaciamiento de la cavidad pleural, el restablecimiento de la presión negativa y la expansión pulmonar.
INDICACIONESSe requiere de un drenaje pleural en los casos de neumotórax sintomático (6), neumotórax asintomático con una distancia >2cm entre la pleura visceral y la pared torácica (6), neumotórax a tensión, hemotórax (7), derrame paraneumónico complicado (8), empiema pleural no tabicado (8), quilotórax (4), derrame pleural neoplásico (9) (en aquellas ocasiones en que no es suficiente la toracocentesis) y en el postoperatorio de la cirugía torácica y cardíaca.
CONTRAINDICACIONESLa única contraindicación absoluta corresponde a las adherencias extensas entre la pleura parietal y visceral del hemitórax afectado (10). Dentro de las contraindicaciones relativas está la coagulopatía (<50.000 plaquetas, TTPA >2 veces sobre VN, TP >2 veces sobre VN, INR >2 veces sobre VN) y la infección en el sitio de inserción (4). Estas pueden ser revertidas con hemoderivados y cambiando el sitio de inserción, respectivamente.
TUBOS DE DRENAJELos tubos de drenaje pleural son estériles, flexibles, multifenestrados y confeccionados de un material no trombogénico (habitualmente silicona o polivinilo). Suelen incorporar una línea de contraste radiológico, que está interrumpida por la fenestra más proximal. Existen drenajes finos de 10 o 12French (Fr) (Pleurocath®), que se instalan con técnica de Seldinger y drenajes de mayor diámetro (20 a 32Fr) con o sin trocar conductor, que requieren de un procedimiento quirúrgico para su inserción.
La decisión sobre qué drenaje utilizar depende de varios factores, siendo los principales, el contenido a drenar y el tamaño del paciente. De esta forma, el drenaje de aire requiere de tubos más delgados que el drenaje de líquidos viscosos como la sangre, el pus y el quilo. A pesar de que los drenajes finos son mucho mejor tolerados por los pacientes, estos corren el riesgo de obstruirse.
Para los casos de neumotórax y derrames neoplásicos, tubos con diámetros entre 14 y 24Fr son suficientes, mientras que para los casos de empiema, hemotórax o quilotórax, se recomienda el uso de tubos gruesos (28 a 32Fr) (11).
Por otra parte, los conectores deben ser herméticos y lo suficientemente amplios para evitar la obstrucción por líquidos viscosos.
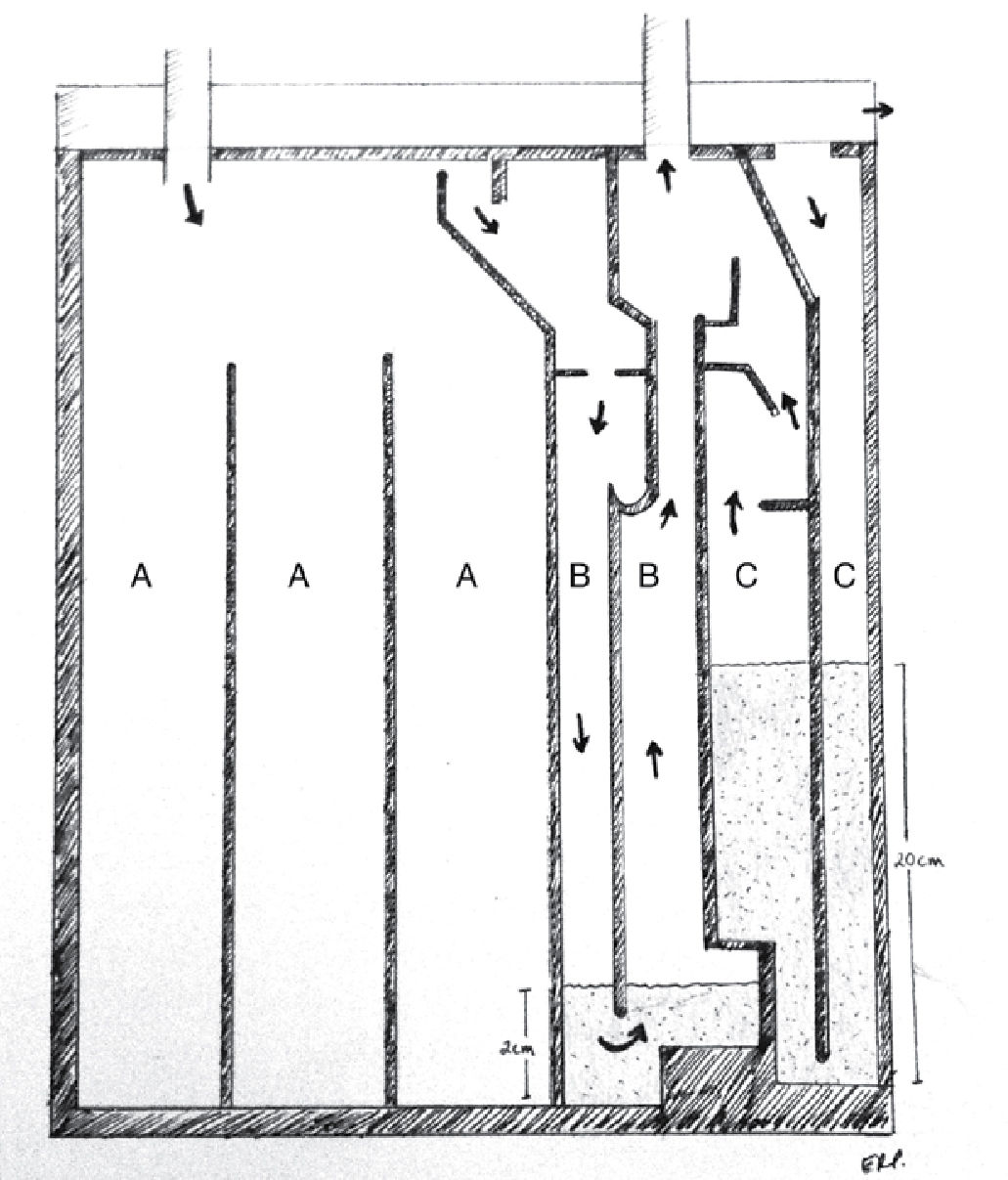
SISTEMAS DE DRENAJEActualmente existen diversos sistemas de drenaje pleural, siendo los principales el sistema clásico de botellas de Bülau, los sistemas comerciales integrados como Pleur-Evac® o Aqua-Seal® y los sistemas digitales como Thopaz®. Independiente del sistema a utilizar, es fundamental mantener la hermeticidad del sistema, para evitar la entrada de aire y la falta de expansión pulmonar. Todos los sistemas se basan en los mismos principios de funcionamiento, utilizando un sello de agua, un recolector y un sistema de aspiración continua.
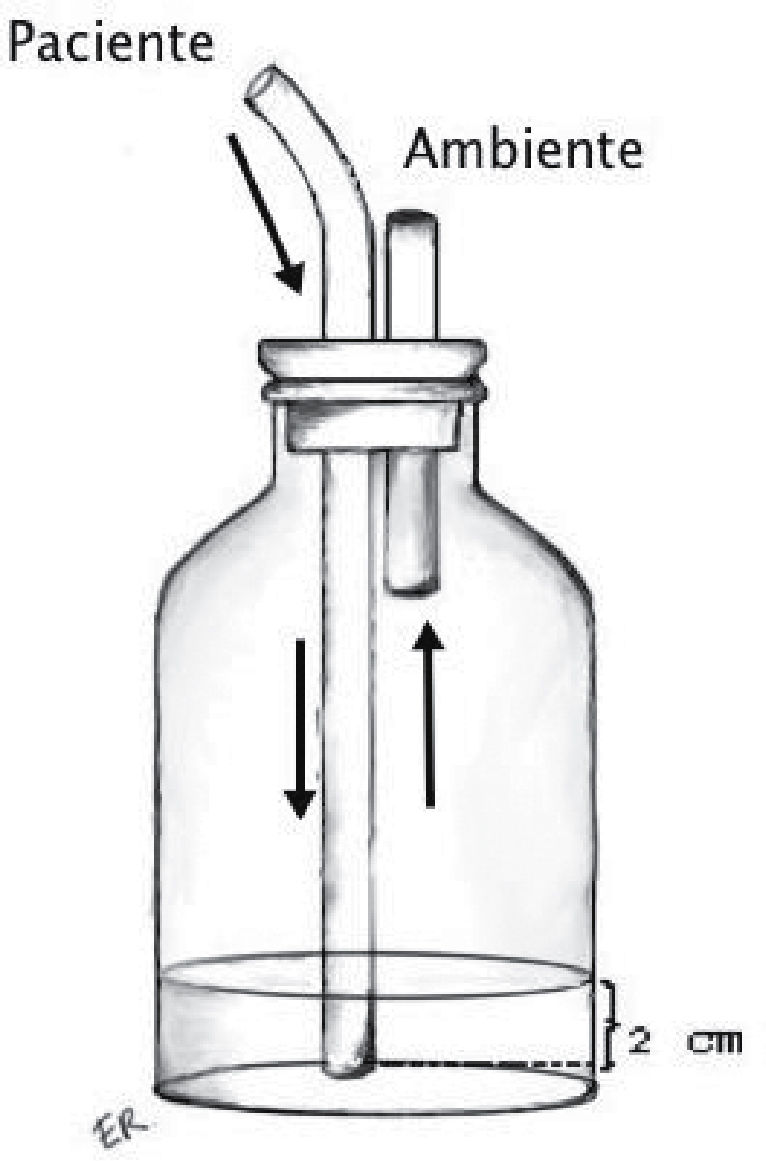
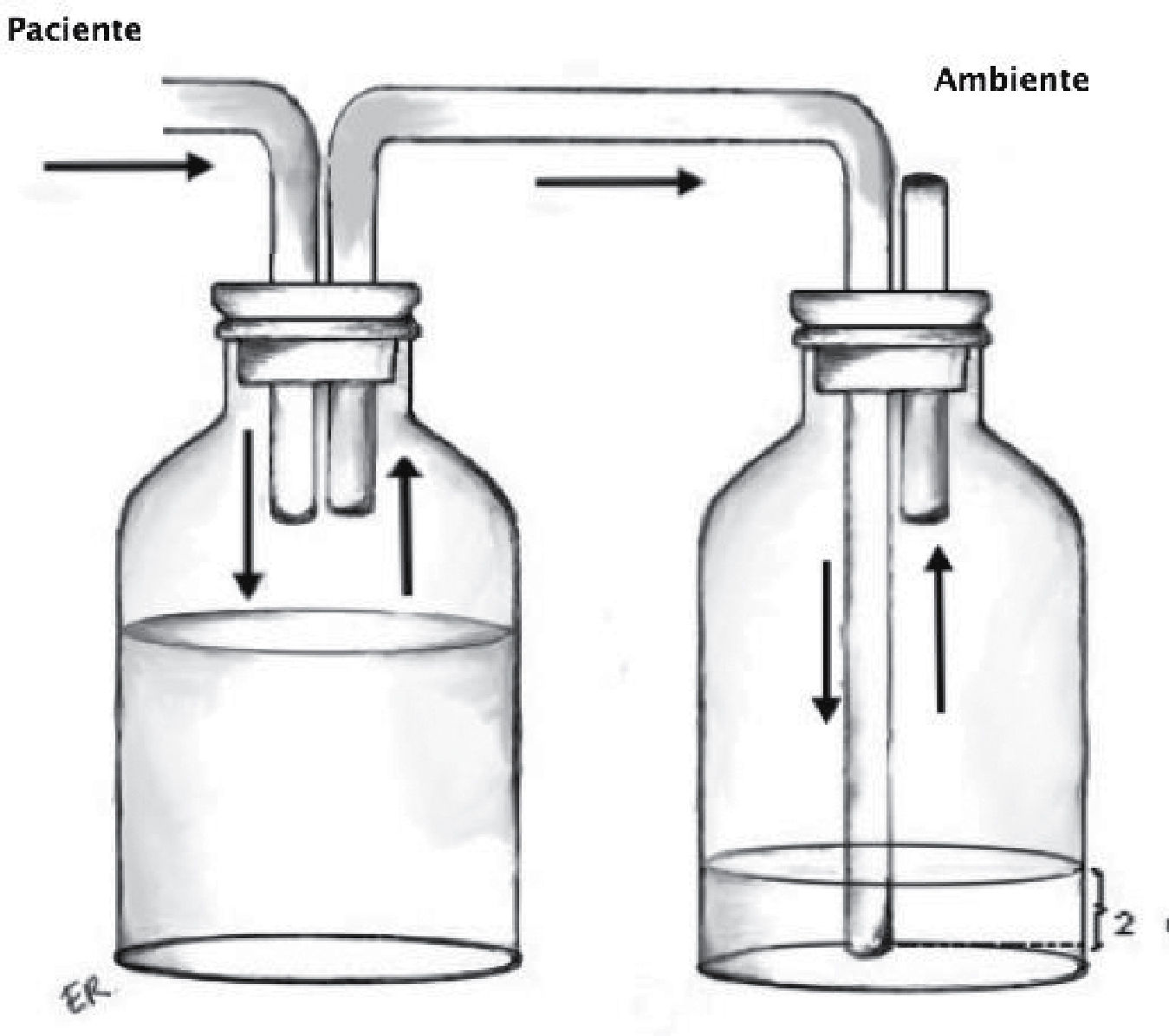
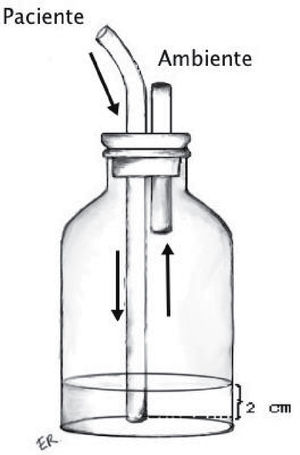
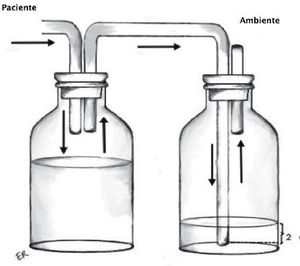
Sello o trampa de agua: Elemento básico del sistema, consiste en la conexión desde la cavidad pleural a un sistema valvular hidráulico unidireccional, que corresponde a una varilla sumergida en una cantidad estandarizada de agua (2cm) y una salida a la atmósfera desde el frasco receptor (Figura 1). Utiliza el movimiento respiratorio y los cambios de presión de la cavidad pleural sumado a la gravedad como motor para favorecer el drenaje de la cavidad pleural. En condiciones de alto débito de líquidos, que modifiquen la resistencia de la trampa de agua, puede ser necesario interponer un segundo frasco receptor actuando solo como reservorio de líquido.
Recolector: Permite mantener intacto el sello de agua y evitar reflujo del líquido dentro de la cavidad pleural (Figura 2).
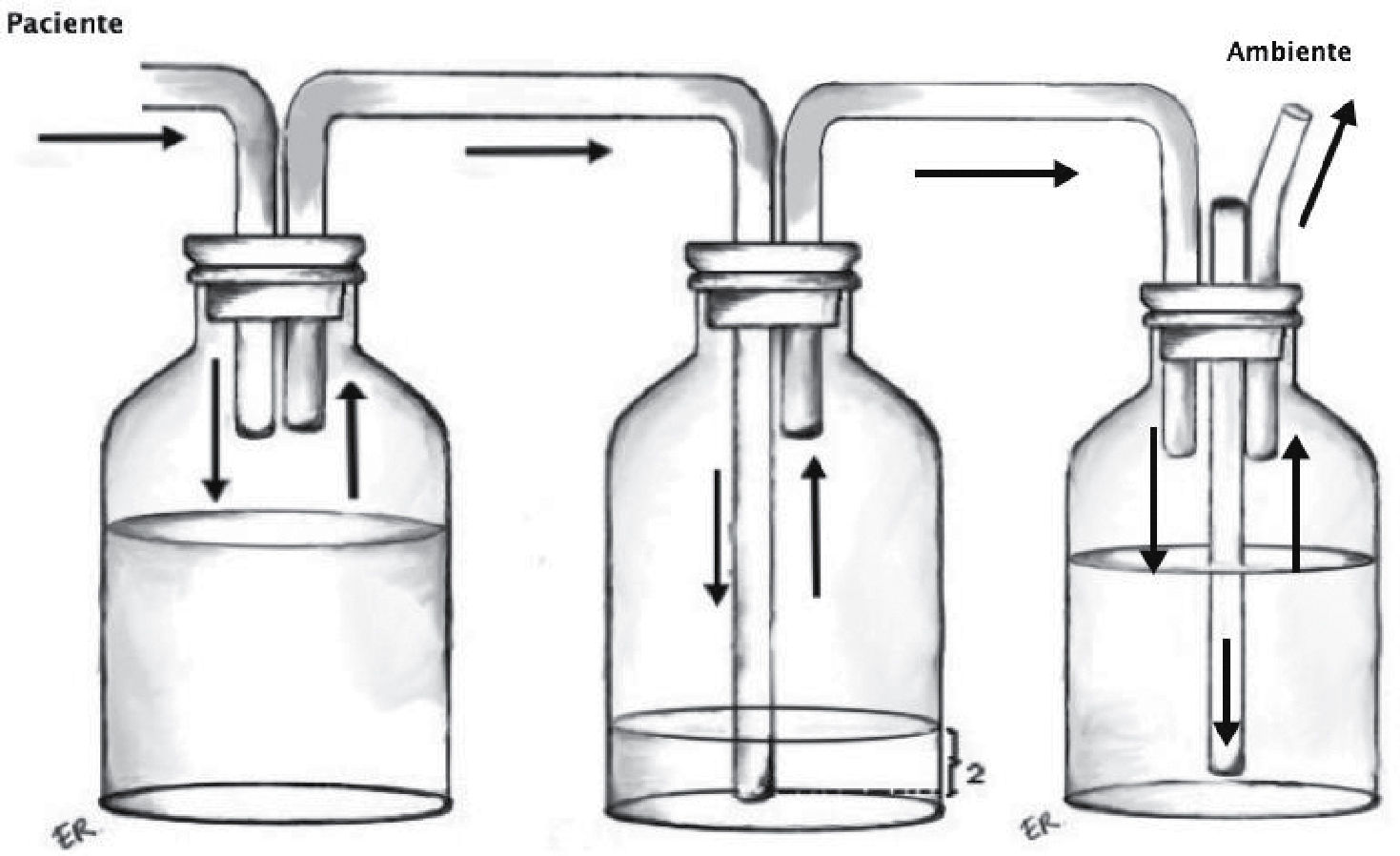
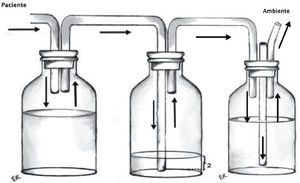
Sistema de aspiración continua: Busca aumentar el gradiente de presión entre el sistema y la cavidad pleural. No existe evidencia sobre la necesidad de utilizar rutinariamente aspiración en los sistemas de drenaje pleural, aunque la mayoría de los cirujanos recomienda utilizarla. Se conecta por un lado a la trampa de agua y por otro a la red de aspiración (Figura 3).
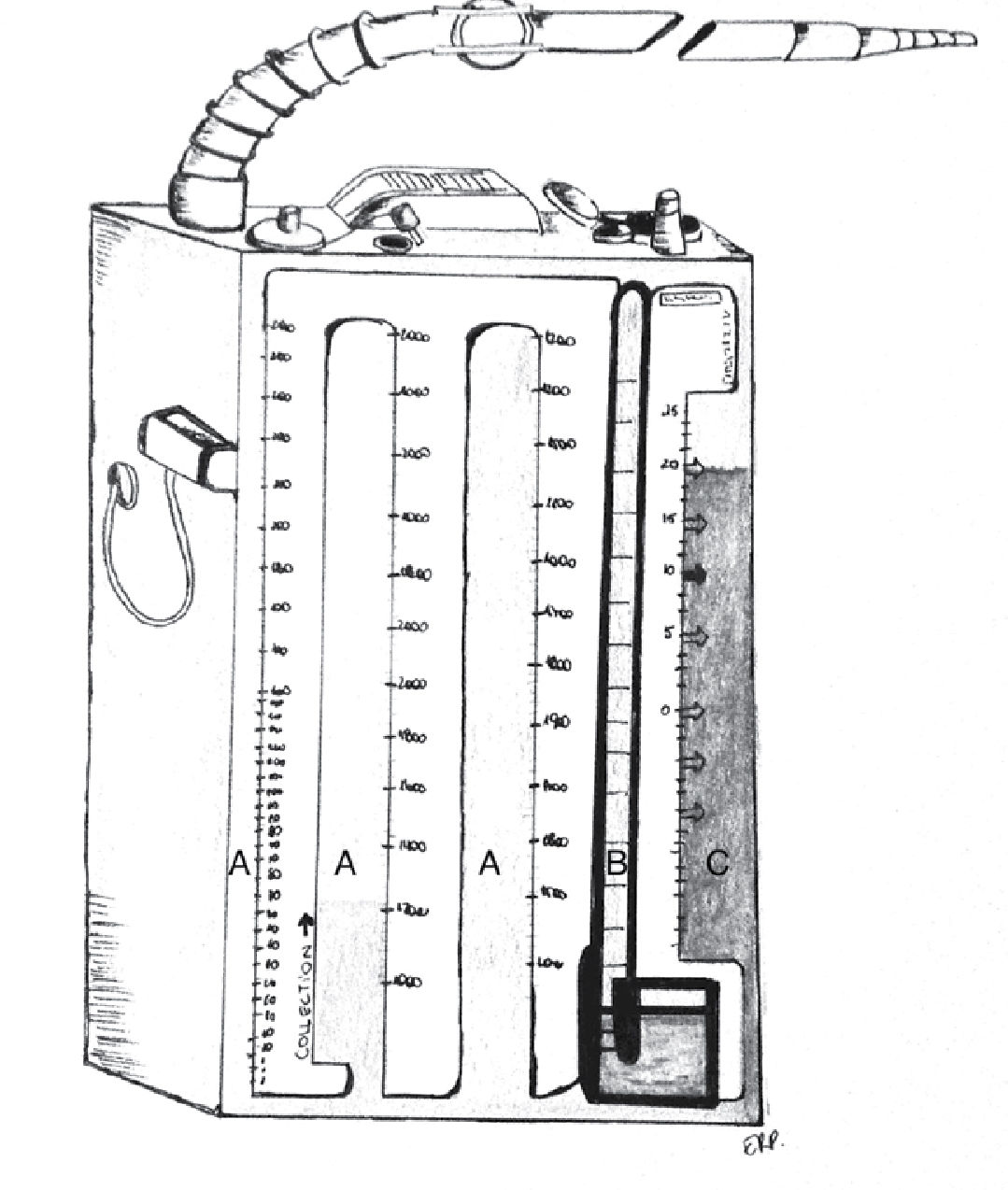
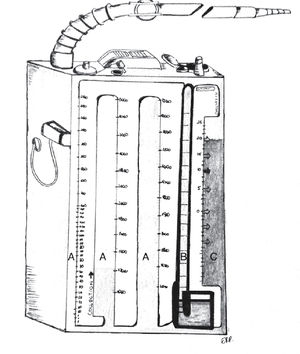
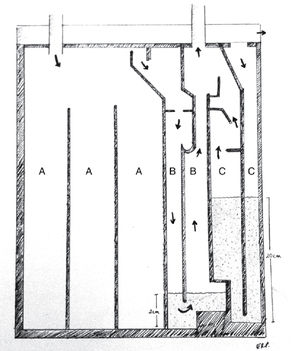
Los sistemas comerciales integrados son equipos fabricados en una sola estructura que contiene las mismas 3 cámaras, todas incorporadas dentro de un único compartimento, más funcional y cómodo para el paciente, pero con las mismas características que un sistema de frascos convencional (Figuras 4 y 5).
También existen algunos sistemas de uso ambulatorio, sin un reservorio importante y que permiten el manejo en domicilio de algunos pacientes, estos sistemas utilizan un tipo de válvula unidireccional denominada “Válvula de Heimlich”.
Los sistemas digitales como Thopaz® permiten la medición computacional de las fugas aéreas, medición de flujos y mayor confort para el paciente.
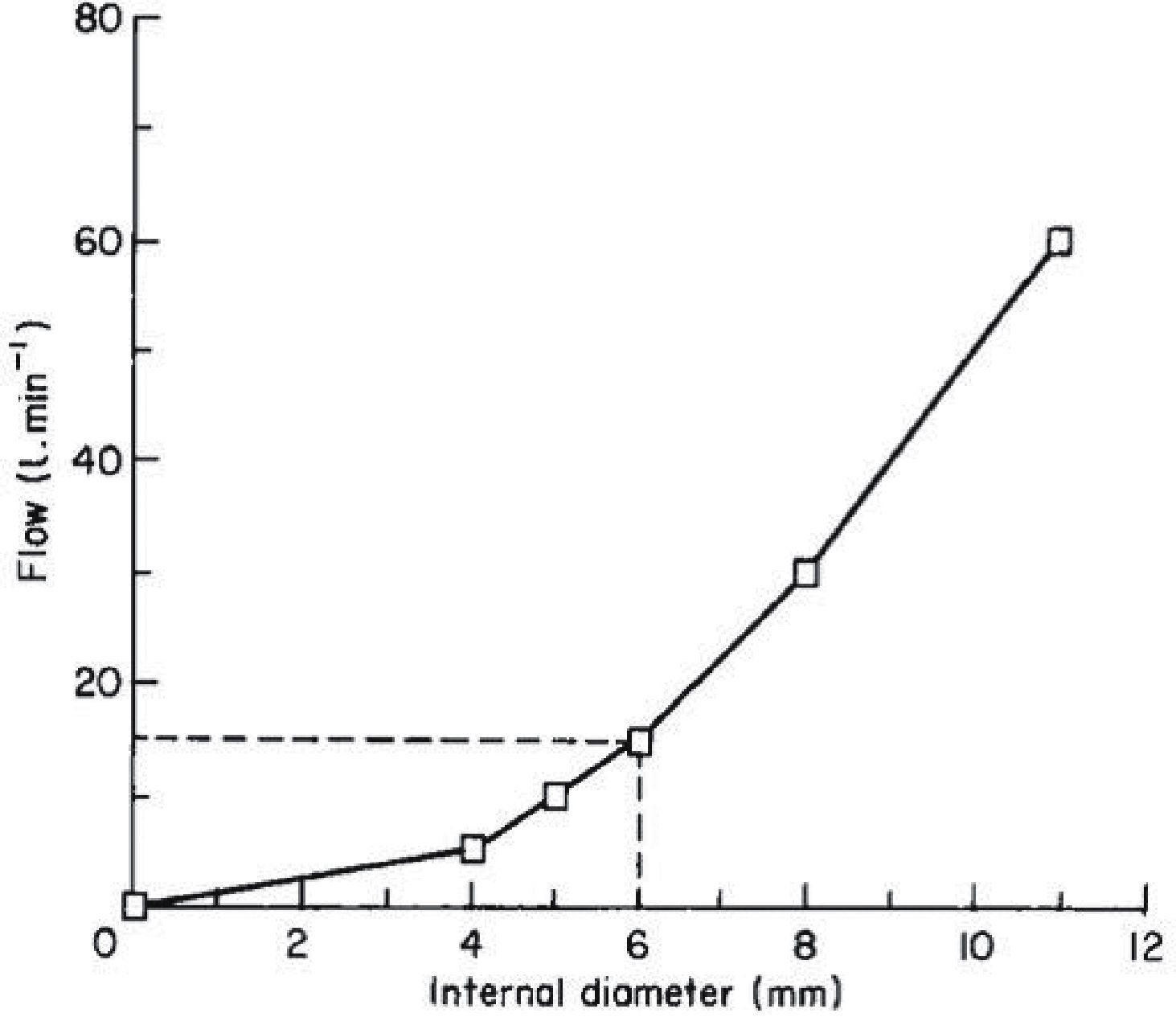
MECANISMO DE FUNCIONAMIENTOEl movimiento diafragmático causa la entrada de aire al tórax, normalmente a través de la vía aérea. Si una pleurostomía estuviese conectada a la atmósfera, el aire entraría a través de ésta, es por ello que se utiliza un sistema valvular denominado sello de agua, que sumado a la permanencia del drenaje bajo el nivel del tórax, permite que solo se produzca un movimiento desde la pleura al exterior. Al espirar el aire, este es empujado contra la columna de agua, exteriorizándose en forma de burbujas, lo que gradualmente permite la re-expansión pulmonar. El sistema debe generar la menor resistencia posible. En el tubo el flujo tiende a hacerse turbulento y se comporta de acuerdo a la ecuación de Fanning.
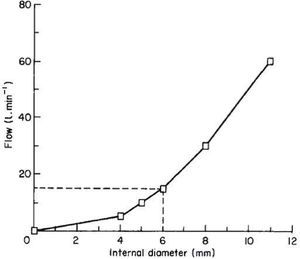
El diámetro interno del tubo es el principal determinante de la resistencia. Según esta ecuación, el diámetro interno mínimo sugerido es de 6mm, lo que genera un flujo de 15.1l/min con una presión de -10cmH2O, mientras que un tubo de 12mm de diámetro interno puede alcanzar un flujo de 50–60 l/min. En la Figura 6 se relaciona el flujo y su variación en relación al diámetro interno del tubo.
El flujo efectivo en el sistema está dado por la siguiente ecuación:
Para disminuir el efecto de la cámara de recolección y las conexiones, es importante aumentar el efecto de la gravedad, bajando el nivel del sistema, respecto del paciente, lo que genera un mayor gradiente de presión entre la pleura y el sistema. Si éste se ubica 1m bajo el paciente, el delta de presión alcanza los 100cmH2O. La presencia de bucles altera esta relación, disminuyendo la gradiente y aumentando la resistencia al flujo. Finalmente la presión del sistema estará dada por la diferencia en la distancia en que se encuentre sumergida la varilla de control de aspiración y la del sello de agua en forma inversa. Por ejemplo si la varilla de control de aspiración se encuentra sumergida a 15cm y la del sello de agua a 2cm, la presión del sistema será de -13cmH2O.
INSTALACIÓNPara realizar la instalación del drenaje debe seleccionarse el lugar más adecuado donde se cumplan condiciones adecuadas de esterilidad, monitorización y capacidad para resolver una complicación inmediata, lo que significa en casi todos los casos el pabellón. En ocasiones de emergencia esto puede realizarse en la unidad de emergencia o intensivo.
El uso de fármacos ansiolíticos y opiáceos está recomendado en todo paciente en que no exista contraindicación. No existen trabajos que evalúen la necesidad real de utilizar Atropina en el procedimiento, por lo que se recomienda usarla en caso de necesidad y en aquellos pacientes conocidos como vagotónicos.
El sitio anatómico de instalación por defecto es el quinto espacio intercostal, utilizando el denominado triángulo de seguridad, delimitado por el borde anterior del músculo dorsal ancho, el borde lateral del pectoral mayor y una línea horizontal a nivel de la mamila.
El procedimiento se realiza con el paciente en posición semisentado, con lo que el diafragma desciende y con abducción del brazo ipsilateral para lograr mayor apertura de los espacios intercostales.
Previa aseptización de la zona, se instalan los campos estériles y se ubica el quinto espacio intercostal, tomando como referencia el ángulo de Louis. Una vez localizado, se ubica la línea axilar media (11). Se procede a la infiltración de Lidocaína al 1 o al 2% sobre la zona a ser intervenida (12). Además de la piel, el tejido celular subcutáneo y el tejido muscular, se debe aneste siar adecuadamente la pleura parietal y el periostio de la cuarta y quinta costilla, considerando que son las zonas que gatillan mayor dolor.
Se realiza una incisión transversa sobre la piel del borde superior de la sexta costilla. Con una pinza Kelly se diseca cuidadosamente el tejido celular subcutáneo y la musculatura intercostal hasta llegar a la pleura parietal (siempre paralelo al borde superior de la sexta costilla, para evitar dañar del paquete vasculonervioso) (12). Con un movimiento controlado, se perfora delicadamente la pleura parietal y se abre el extremo de la pinza, para generar un espacio que permita el paso del drenaje. Se toma el extremo distal en la misma dirección de la pinza Kelly y se introduce, insinuándose, a la cavidad pleural. Una vez dentro de ésta, se retira la pinza Kelly y la pleurostomía se posiciona desde el exterior, asegurándose de que todas las fenestras queden dentro de la cavidad pleural. Se fija con una sutura de Seda 2/0 a la piel, se coloca un punto colchonero horizontal alrededor de la pleurostomía (que realizará el cierre de la solución de continuidad al momento del retiro del drenaje) y se conecta al tubo de conexión, que viene incorporado en el equipo de drenaje.
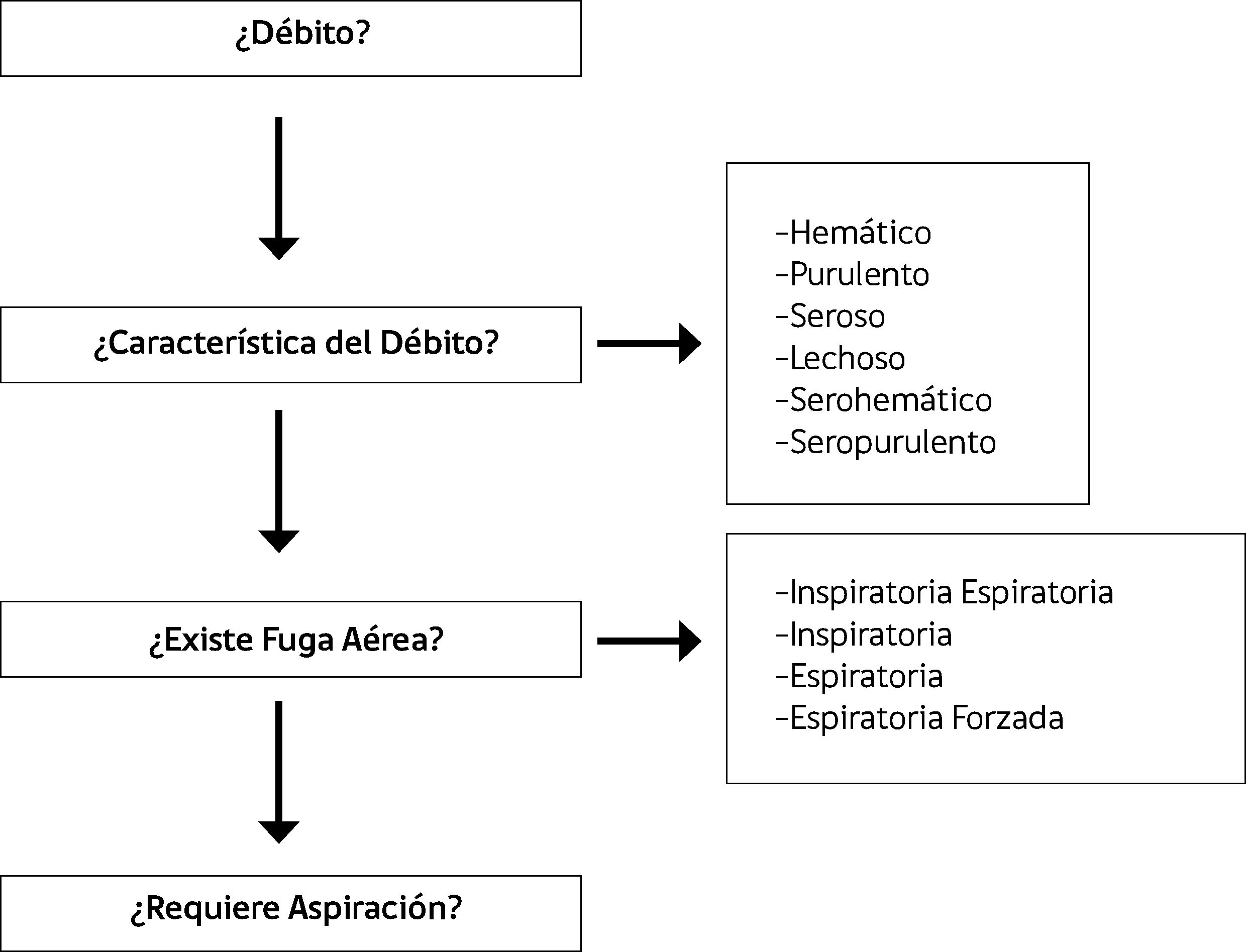
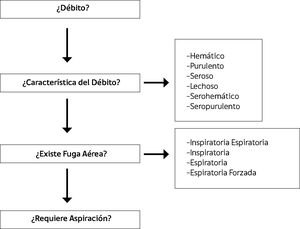
EVALUACIóNEl médico debe ser capaz de responder las siguientes preguntas (Figura 7):
¿Cuánto es el débito? Se debe cuantificar diariamente la cantidad de líquido drenado (a excepción del hemotórax de presentación aguda, que en las primeras 4 horas debe medirse cada 1 hora) (13).
¿Cuáles son las características del débito? Se debe precisar si el líquido es hemático, purulento, seroso, lechoso, serohemático o seropurulento.
¿Existe fuga aérea? Si en algún momento del ciclo respiratorio se visualizan burbujas dentro de la cámara del sello de agua, significa que el paciente tiene una conexión entre el alvéolo o el bronquio con la pleura. Cerfolio (1) clasificó las fugas aéreas en cuatro tipos, dependiendo de la fase del ciclo respiratorio en que se presentaban. La primera es la fuga aérea continua (C), corresponde a aquella se presenta en todo el ciclo respiratorio, es infrecuente y suele verse en aquellos pacientes que presentan una gran fístula bronco pleural. La segunda es la inspiratoria (I), se manifiesta netamente en la inspiración y se debe a una pequeña fistula broncopleural o una gran fístula alveolo pleural. La tercera es la espiratoria (E), se distingue exclusivamente en la espiración y es causada por una pequeña fístula alveolo pleural.
La cuarta, corresponde a aquella que se hace evidente a la espiración forzada (FE), razón por la cual se le solicita al paciente que tosa. Anatómicamente equivale a una fístula alvéolo pleural de menor tamaño que aquella que se manifiesta exclusivamente en la espiración.
El 99% de los pacientes que son sometidos cirugías pulmonares electivas y no requieren de ventilación mecánica, presentan fugas aéreas E y FE (14,15).
¿Es necesario mantener la aspiración? El aumentar la presión negativa dentro de la cavidad pleural favorece el drenaje, la re-expansión pulmonar y disminuye las atelectasias junto con la formación de cavidades residuales.
En relación a los casos de neumotórax, no existe evidencia suficiente que permita recomendar o proscribir el uso de aspiración, no obstante en los casos no resueltos, lo habitual es mantener el drenaje con aspiración (16), a -15cm H2O, hasta la re-expansión pulmonar.
En los casos de hemotórax y en el postoperatorio de cirugía torácica y cardíaca, se recomienda mantener la aspiración a -15cmH2O, hasta la obtención de un débito con características serohemáticas, pese a que no se han demostrado ventajas en relación a los drenajes no aspirativos (17).
Para los casos de empiema pleural y derrames paraneumónicos no complicados, lo recomendable es mantener la aspiración a -15cmH2O hasta la resolución del cuadro, sin embargo en la actualidad no existe un consenso clínico al respecto (18).
Con respecto al derrame pleural neoplásico, lo más frecuente es no utilizar la aspiración, salvo en los casos en que haya falta de re-expansión pulmonar y fuga aérea persistente, en que se recomienda un aumento gradual, hasta alcanzar una presión de -15cmH2O (19). Esta aspiración se debe discontinuar cuando se logra la re-expansión pulmonar y cesa la fuga aérea.
Para los pacientes cursando con quilotórax se recomienda mantener la aspiración a -15cmH2O, hasta la obtención de un débito con características serohemáticas.
RETIRO DEL DRENAJE PLEURALLa decisión de retiro de un drenaje pleural debe responder a varias preguntas sencillas, clínicas, propias del drenaje y de imágenes:
¿La causa por la cual se instaló el drenaje está resuelta? Si aún no está resuelta, se recomienda mantener el drenaje.
¿Existe fuga aérea? Su presencia indica la presencia de una fístula alvéolo o broncopleural, por lo tanto si se retira el drenaje se generará un neumotórax.
¿El pulmón se ha expandido correctamente en la radiografía de tórax? No siempre se debe esperar una expansión pulmonar completa, esto dependerá exclusivamente de la patología en cuestión.
¿Cuánto es el débito? A pesar de que algunas escuelas preconizan el retiro de los drenajes pleurales con débitos de hasta 450cc por día (20), lo habitual es retirarlos con débitos menores a 200cc (16).
¿Existe derrame pleural residual? Si existe un derrame pleural residual y se retira el drenaje, existe el riesgo de que este aumente o se infecte el líquido generando un empiema pleural.
Técnica de retiroEs importante recalcar que es importante mantener siempre una técnica aséptica para toda manipulación del drenaje.
No existe evidencia que demuestre que una técnica es superior a otra, sin embargo, lo más habitual es el retiro entre dos operadores, con el paciente en decúbito lateral.
Se le solicita al paciente que realice una espiración larga y forzada. En ese momento uno de los operadores retira rápidamente el drenaje, mientras el otro anuda el punto colchonero horizontal. Esto último debe ser realizado antes de que el paciente reanude la inspiración (4).
CONCLUSIÓNUn entendimiento adecuado de la anatomía torácica y la fisiología pleural permite a un médico no especialista instalar un drenaje pleural y manejarlo de manera adecuada, teniendo en consideración las indicaciones y contraindicaciones consensuadas en la actualidad. Para la evaluación diaria del equipo de drenaje y el retiro de éste, se debe responder ciertas preguntas, que guiarán la conducta a seguir. Solo de esta manera se puede sacar el máximo de provecho a esta herramienta, que juega un rol esencial en la cirugía torácica.
Los autores declaran no tener conflictos de interés, en relación a este artículo.