El injerto de grasa autóloga es actualmente un procedimiento común, tanto en cirugía estética como reconstructiva. Muchos avances en cirugía plástica se han generado con esta técnica y ha sido tema central de muchos congresos.
La técnica moderna de lipoinyección se ha popularizado por Coleman hace más de 20 años, quien ha sistematizado la técnica de cosecha, purificación e injerto. Con anterioridad esta técnica tenía una mala reputación por ser impredecible.
En el año 2001 Zuk y colaboradores demuestran que el tejido adiposo es una fuente de células madres mesenquimales, capaces de diferenciarse en otros tejidos. Si bien muchos estudios preclínicos soportan su beneficio, más estudios clínicos son necesarios para dilucidar su verdadero rol.
En el detalle de este artículo se discuten tópicos relevantes acerca del comportamiento del tejido adiposo como injerto, diferencias en las técnicas de procesamiento y rol de la criopreservación. En relación a la utilización actual de la lipoinyección se menciona su uso en rejuvenecimiento facial, cirugía corporal, mamaria y cirugía reconstructiva.
Autologous fat grafting is now a popular procedure, both aesthetic as reconstructive surgery. Many advances in plastic surgery were generated with this technique and has been “hot topic” of many plastic surgery meetings.
Modern fat grafting technique has been popularized by Coleman over 20 years, who has systematized the technique of harvesting, purification and graft. Previously this technique had a bad reputation for being unpredictable.
In 2001 Zuk and colleagues demonstrated that adipose tissue have mesenchymal stem cells able to differentiate into other tissue source. While many preclinical studies support its benefit, more clinical studies are needed to elucidate its true role.
In this article detailing relevant topics about the behavior of adipose tissue as a graft, differences in processing techniques and the role of cryopreservation are discussed. In relation to the current use fat grafting, facial rejuvenation, body contouring, breast surgery and reconstructive surgery uses are mentioned.
En 1893 el cirujano alemán Gustav Neuber reporta el primer injerto de tejido adiposo desde el brazo a la región periorbitaria para corregir una secuela de osteomielitis1. En 1895 otro alemán, Viktor Czerny, transfiere un lipoma a la mama para reestablecer simetría, posterior a una mastectomía parcial2.
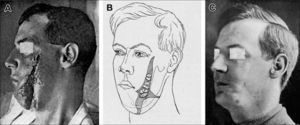
Antes del injerto en jeringas como lo conocemos ahora, el injerto graso se realizaba en bloque, a veces con dermis. El beneficio de este injerto fue descrito ampliamente por Erich Lexer (1867-1937) quien dedica más de 300 páginas de su libro a describir un amplio rango de aplicaciones clínicas desde la corrección de deformidades de contorno facial, a microsomía hemifacial, microgenia, asimetría mamaria, rigidez postraumática de mano y enfermedad de Dupuytren3. Harold Gillies (1882-1960) en su libro “Plastic Surgery of the face” publica numerosos casos de la Primera Guerra Mundial tratados con injerto graso4 (Figura 1). Los resultados posteriores del injerto graso no fueron muy buenos debido a la reabsorción impredecible y a la tendencia a formar quistes oleosos.
En 1926 Charles C. Miller de Chicago publica en su libro “Cannula Implants”, el injerto graso con jeringas5. Sin embargo, nunca fue popular hasta el advenimiento de la liposucción.
En la década de los 50 Lyndon Peer investiga el comportamiento del injerto graso al año, demostrando que cerca del 50% de las células adiposas se rompe y muere después del injerto, siendo reemplazado por tejido fibroso. Demostró además que la nueva circulación sanguínea se establece al día 4, de no ocurrir, el injerto muere6.
En los 80 Pierre Founier7 e Yves-Gerard Illouz8, ambos de París, en forma independiente introducen la liposucción, un nuevo procedimiento para remover grasa del abdomen y muslos. Esta técnica tiene un gran éxito, se expande rápidamente y la reintroducción de la grasa aspirada se vuelve a explorar.
En los 90 Sydney Coleman sistematiza el procedimiento de lipoinyección. Sus recomendaciones fueron cosechar la grasa con una cánula roma de 3mm conectada a una jeringa de 10ml a baja presión negativa para disminuir el trauma, purificación de la grasa por medio de la centrifugación separando la capa oleosa y acuosa de los componentes adiposos, finalmente introducir la grasa en múltiples túneles con un contacto estrecho de un tejido receptor bien vascularizado, utilizando un cánula 18G9,10.
En el año 2001 un grupo de cirujanos plásticos e investigadores de Pittsburgh coordinados por Bill Futrell, demuestran que el tejido adiposo es una gran fuente de células madres mesenquimales adultas denominadas “células madres derivadas del tejido adiposo” (ASCs), capaces de diferenciarse en varios tejidos. Se identifica la fracción vascular estromal (SVF) como fuente de estas células11,12.
El año 2007 Gino Rigotti y colaboradores publican una serie de casos de tejidos irradiados tratados con injerto graso, atribuyendo esta propiedad regenerativa a las ASCs13.
Es así como el injerto graso se ha constituido en una herramienta de relleno con expectativas regenerativas, objeto de estudio continuo en la actualidad.
CÉLULAS MADRES DERIVADAS DEL TEJIDO ADIPOSOEl tejido adiposo ha emergido en los últimos 15 años como una excelente fuente de células aptas para ingeniería tisular y terapias regenerativas. El tejido adiposo más que un mero soporte de órganos, es un tejido complejo y dinámico que envuelve diversos procesos fisiológicos y patológicos. En los años 60, Rodbell14 describe la separación del tejido adiposo en sus componentes celulares, lo que ha permitido comprender la existencia de células precursoras de adipositos y sus programas de diferenciación15,16. En el año 2001 Zuk y cols. muestran al tejido adiposo como una nueva fuente células madres mesenquimales con potencial de diferenciación multilinaje11.
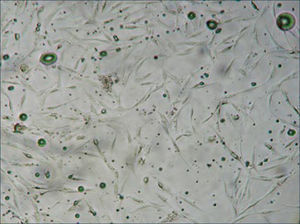
Las células madre derivadas del tejido adiposo (ASCs) se encuentran rodeando los vasos sanguíneos y en el tejido conectivo del tejido adiposo humano. Estas células estromales no lipídicas, se obtienen de la digestión enzimática del tejido adiposo y luego centrifugación (Figura 2), el pellet celular obtenido se compone de tipos celulares heterogéneos y se denomina fracción vascular estromal (SVF). Si las células del SVF son cultivadas a 37°C con 5% de CO2 por más de 8 horas, las células adheridas a la placa de cultivo corresponderán a las ASCs, las células no adherentes son eliminadas con solución buffer fosfato (Figura 3). Para expandir el número de ASCs se puede mantener las células en cultivo con un medio estándar consistente en DMEM (Dulbecco's Modified Eagle Medium) con 10% de suero y 1% de antibióticos. Una vez en cultivo, se pueden agregar diferentes factores de crecimiento u otros aditivos para apreciar la diferenciación a un linaje celular específico como tejido adiposo, cartílago, hueso o músculo17.
A las ASCs se las categoriza dentro del grupo de las células estromales mesenquimáticas multipotentes (mesenchymal stem cells o MSCs) que corresponden a células madres obtenidas de tejido adultos. La Sociedad Internacional de Terapia Celular (ISCT) ha establecido criterios para poder denominar a una célula como MSC. Primero las MSC deben ser adherentes al plástico en condiciones de cultivo estándar. Segundo, 95% de las MSC medido por citometría de flujo debe expresar CD105, CD73 y CD90 y perder la expresión (2% positivo) para CD45, CD34, CD14 o CD11b, CD79a o CD19 y HLA clase II. Tercero estas células deben ser capaces de diferenciarse en osteoblastos, adipocitos y condroblastos en condiciones de cultivo estándar18 (Tabla 1).
CRITERIOS PARA IDENTIFICAR MSC
| 1. Adherencia al plástico en condiciones de cultivo estándar | ||
|---|---|---|
| 2. Fenotipo | Positivo (≥ 95%) | Negativo (≤ 2%) |
| CD105 | CD45 | |
| CD73 | CD34 | |
| CD90 | CD14 o CD11b | |
| CD79α o CD19 | ||
| 3. Diferenciación in Vitro: osteoblastos, adipositos, condroblastos (demostrado por tinción del cultivo celular) | ||
(Dominici el al.) ref 18.
Existen múltiples estudios preclínicos que evidencian el potencial regenerativo de las ASCs17, ya sea por diferenciación directa en múltiples tejidos con el uso de factores de crecimiento o por un efecto estimulador paracrino de angiogénesis y proliferación celular19,20.
El principal problema actual es la falta de evidencia clínica para el amplio uso de este tipo de terapia, a la fecha hay más de 120 ensayos clínicos registrados en el sitio web del Instituto Nacional de Salud Norteamericano (clinicaltrials.gov) y muchas instituciones académicas, privadas y hospitales se encuentran realizando estudios con ASCs21. Es cierto que ya existen protocolos de procesamiento de acuerdo a las guías de buenas prácticas de manufactura (GMP)22, pero aún faltan estudios aleatorizados con resultados contundentes y además no hay un pronunciamiento favorable de las diferentes sociedades científicas en nivel mundial respecto al tema clínico.
Las regulaciones respecto el uso clínico de ASCs varían dependiendo del país. En Estados Unidos pueden ser consideradas como “producto tisular” o como “producto celular”. Los productos tisulares deben cumplir normas estrictas de preparación, almacenamiento y transporte para ser utilizados, mientras que los productos celulares caen dentro de la categoría “droga biológica” y debe ser testeada su eficacia en estudios de fase 1, 2 y 3. Por lo tanto, el debate actual se centra en si la digestión enzimática y uso clínico de la SVF constituye mínima manipulación del tejido o se pasa a la categoría de droga biológica. En la última actualización de la FDA al respecto consideran la digestión enzimática y disrupción mecánica más que mínima manipulación de tejido, ya que se eliminan componentes estructurales de soporte, alterando las características originales del tejido (http://www.fda.gov/BiologicsBloodVaccinesGuidanceComplianceRegulatoryInformation/Guidances/Tissue/ucm427795.htm).
SOBREVIDA DEL TEJIDO ADIPOSO INJERTADOLa teoría clásica de “sobrevida celular” sostiene que el tejido adiposo trasplantado se mantiene vivo en tejido receptor si recibe una adecuada nutrición23. Por otro lado, existe la teoría de “reemplazo celular” que sostiene que gran parte de los adipocitos mueren y son subsecuentemente reemplazados por una nueva generación durante los primeros tres meses. Esta novedosa teoría propuesta por Kotaro Yoshimura evidencia como las ASCs trabajan en respuesta a los cambios microambientales, tales como la isquemia y las fuerzas mecánicas24,25.
El tejido adiposo no es sólo un órgano almacenador de energía, también es un órgano endocrino, que libera múltiples hormonas como leptina y adiponectina, regulando homeostasis. Se compone de adipocitos, ASCs, células vasculares, pericitos, fibroblastos, macrófagos, linfocitos y tejido conectivo. El tamaño de un adipocito es entre 50 y 150μm y vive aproximadamente 10 años en humanos. Las ASCs se localizan alrededor de los capilares, responden ante la isquemia liberando factor de crecimiento vascular y se diferencian en adipocitos y células endoteliales26. Los adipocitos muy grandes de individuos obesos mueren de isquemia relativa y son rodeados por los macrófagos inflamatorios M1.
La remodelación del tejido adiposo es un balance entre la apotosis/necrosis y la adipogénesis mediada por las ASCs. En los tejido deficientes de células, como irradiados o crónicamente inflamados, cualquier tipo de remodelación del tejido adiposo o cicatrización se ven limitada; por lo que el injerto graso permitiría fertilizar este territorio y sería teóricamente la solución correcta27. La atrofia adiposa de la edad sería un desbalance de este reemplazo celular.
Dentro de los componentes del tejido adiposo, los adipocitos son más susceptibles de morir en condiciones isquémicas. En contraste, las ASCs pueden permanecer vivas hasta tres días y se pueden activar por señales de las células moribundas, contribuyendo a la adipogénesis y angiogénesis24,25.
Luego del injerto graso, el tejido es sometido a isquemia y se nutre por difusión plasmática proveniente del tejido receptor por unos pocos días hasta la revascularización. Esto resulta en muerte de muchos adipocitos en las primeras 24 horas y liberación de múltiples factores procedentes tanto del tejido moribundo como del tejido receptor. El tejido se infiltra de células inflamatorias y luego de 72 horas las ASCs son activadas y tratan de reparar el daño en conjunto con otras células24,28.
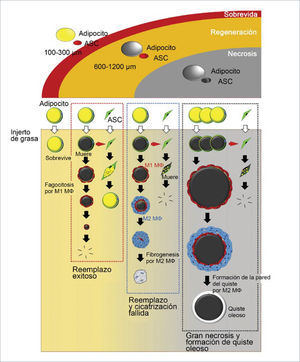
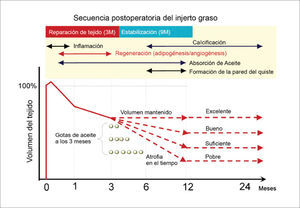
En los primeros tres meses luego del injerto existe un período de remodelación sin adipogénesis. El injerto es categorizado en tres zonas de la periferia al centro1. Sobrevida (superficial), regeneración (intermedia), y necrosis (central) (figura 4). La demarcación de la zona de sobrevida (100-300μm de grosor) de la zona de regeneración se define a la semana, mientras que la demarcación entre la zona de regeneración y la de necrosis ocurre entre la 2 y la 4 semana. La muerte de los adipocitos ocurre desde las 24 horas de injerto y los adipocitos muertos son rodeado por macrófagos M1 para fagocitosis, sin embargo, el proceso de reabsorción toma meses. Por lo tanto, el injerto puede mantener su volumen en las primeras 4 semanas aún existiendo necrosis. Los nuevos y pequeños preadipocitos aparecen alrededor de los adipocitos muertos, separados por una capa de macrófagos entre la 1° y 2° semana, en la zona de regeneración y reemplazan a los muertos totalmente a los tres meses. Mientras tanto, no se observa regeneración en la zona de necrosis. El radio de las 3 zonas puede variar, dependiendo de la vacularidad del tejido receptor y de los cuidados postoperatorios24.
ESQUEMA REPRESENTATIVO DEL COMPORTAMIENTO DE LOS ADIPOCITOS EN EL INJERTO
Pueden haber 4 opciones: sobrevida, regeneración, cicatrización o formación de quistes oleosos. La zona más superficial de 300μm es la zona de sobrevida. La segunda zona de regeneración varía de 600 a 1200μm de grosor dependiendo de las condiciones locales. La zona más central es la de necrosis donde en donde no hay regeneración, y es espacio muerto puede llevar a fibrosis o convertirse con un quiste oleoso. (Modificado de: Kato H, Mineda K, Eto H, et al. Degeneration, regeneration, and cicatrization after fat grafting: dynamic total tissue remodeling during the first 3 months. Plast Reconstr Surg 2014;133:312e).
Aunque el peak del proceso de regeneración ocurre a 4 semanas, se completa a los 3 meses. La estabilización persiste por varios meses y la reducción del volumen se puede apreciar hasta el año. Los remanentes oleosos pequeños son absorbidos por los macrófagos, mientras que las gotas de más de 8mm forman quistes oleosos, quedando en forma permanente y se pueden acompañar de inflamación y calcificación29. Los adipocitos muertos actúan como espaciadores, para guardar el espacio de los nuevos adipocitos durante el proceso de regeneración. Por lo tanto, el volumen final después de un injerto es un balance entre degeneración y regeneración (Figura 5).
SECUENCIA POSTOPERATORIA DEL INJERTO GRASO
La adipogénesis finaliza al 3° mes y los adipocitos muertos son reabsorbidos durante los siguientes 9 meses. Las gotas lipídicas son absorbidas por macrófagos en forma lenta, si las gotas son de más de 8mm se formarán quistes. El volumen final del injerto depende del éxito de reemplazo de los adipocitos muertos. En presencia de grandes gotas oleosas residuales en tejido se atrofiará entre los 3 y 12 meses, evidenciando un resultado pobre. (Modificado de: Yoshimura K, Eto H, Kato H, et al. In vivo manipulation of stem cells for adipose tissue repair/reconstruction. Regen Med 2011;6 (6 Suppl):38).
La comprensión de este mecanismo de sobrevida permite considerar una serie de implicancias clínicas. La mejor vascularidad del sitio receptor incrementa la zona de sobrevida. La presión interna excesiva disminuye la zona de sobrevida. La inmovilización ayuda a la re-vascularización. El tamaño del injerto en relación a la superficie receptora es crítico para minimizar la zona de necrosis, el diámetro del injerto debiera ser menor de 2mm.
TÉCNICAS DE OBTENCIÓN, PROCESAMIENTO E INJERTO GRASOLos refinamientos en las técnicas de lipoinyección han sido ampliamente investigados para mantener la viabilidad del tejido adiposo y mantener el mejor ambiente en el tejido receptor para la sobrevida. La discusión se centra en cómo cosechar el tejido, cómo procesar, cómo preparar el sitio receptor y cómo inyectar la grasa. Uno de los principales problemas encontrados al momento de evaluar estos pasos, es analizar la información que nos entregan los estudios en relación a la medición de la viabilidad. Los estudios presentan variaciones importantes en la técnicas de medición, las cuales no son siempre válidas y no siempre permiten comparar de un estudio a otro30. Dentro de las técnicas para evaluar viabilidad podemos mencionar: La evaluación histológica, la cual depende mucho del evaluador y de la manipulación del tejido. La medición de viabilidad en forma indirecta por colorimetría de actividad de mitocondrial, es buena técnica, pero depende de la manipulación que se le de al tejido. La densidad de ASCs es un buen parámetro, pero no se sabe si el número de células es proporcional al éxito de un injerto. Por último, la evaluación de sobrevida de un injerto en una rata inmunosuprimida aparentemente es una de las mejores técnicas, pero requiere infraestructura de laboratorio y tiempo prolongado de medición.
La lipoinyección se puede dividir en tres categorías arbitrarias en base al volumen utilizado: Lipoinyección de pequeño volumen (<100ml), utilizada habitualmente para cirugía plástica facial; lipoinyección de gran volumen (100-200ml), utilizada de preferencia para mamas y contorno corporal; y lipoinyección de mega volumen (>300ml) para aumento primario de glúteos, mamas o cirugía reconstructiva31.
Elección del sitio dador: Como regla general, el sitio dador debe ser seleccionado en base al mejoramiento del contorno corporal dador y la accesibilidad dependiendo de la posición del paciente. Aunque no hay evidencia a favor un sitio dador, porque la viabilidad del tejido adiposo es igual, una mayor concentración de ASCs es encontrada en el abdomen inferior y en la cara interna de los muslos en un estudio32. Estas últimas zonas son ideales si el paciente se encuentra en supino, pero si el paciente está en prono, la cara medial del muslo el trocánter y el flanco son áreas elegibles como sitio dador. La palma de la mano y el pinch test pueden predecir la cantidad de tejido a extraer33. La palma de la mano mide 200cm2 aprox, multiplicado por un pinch test de un cm da un volumen de 200ml.
Cosecha de la grasa: La aspiración con jeringa y la aspiración con baja presión son avaladas por estudios recientes34,35. Khouri y cols, promueven la presión a menos de 300mmHg con un dispositivo especial denominado KVAC-Syringe que decanta al mismo tiempo a baja fuerza33. Muchas otras marcas promueven equipos que cosechan, procesan y transfieren, pero pocos dispositivos han sido estudiados adecuadamente.
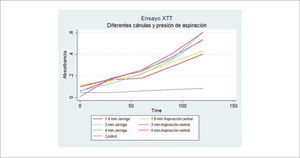
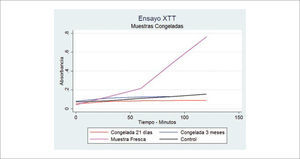
En nuestra experiencia hemos evaluado la viabilidad de grasa obtenida con jeringa y con aspiración central, con el método de medición de actividad mitocondrial y no hemos encontrado diferencias estadísticamente significativas. La ventaja de esta técnica de medición de viabilidad, es que permite obtener valores relativamente inmediatos, sin mayor procesamiento30. Si hemos encontrado diferencias en relación el grosor de la cánula con que se obtiene el injerto, a favor de las cánulas de mayor calibre (Figura 6).
Procesamiento del tejido adiposo: Varios procedimientos se han propuesto para preparar un injerto más puro. Los métodos clásicos de procesamiento incluyen la decantación por gravedad, la centrifugación y filtración. Todas estas técnicas promueven eliminar la mayor cantidad de componente acuoso y no vital, pero la mayor discusión se centra no producir daño al tejido adiposo con cualquier técnica.
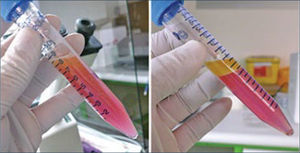
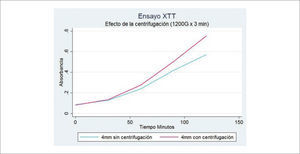
La centrifugación propuesta por Coleman36, a 1200 G x 3 minutos. Es una muy buena técnica para separar el componente graso útil, el cual queda al centro del tubo, de los adipocitos destruidos que quedan formando una capa oleosa superior y del componente acuoso que queda al fondo del tubo (Figura 7). 1200 G son equivalentes a 3000rpm, una fuerza mayor que esta no es recomendada. Algunos autores han propuesto disminuir la fuerza de centrifugación a 50 G con mejores resultados. En nuestra experiencia, hemos evaluado que viabilidad del tejido efectivamente aumenta con la centrifugación (Figura 8).
La centrifugación es muy práctica para pequeños volúmenes de grasa, pero el proceso se torna más demandante para grandes volúmenes.
Filtración: Un estudio reciente demuestra que la filtración con gasa sería equivalente a la centrifugación, lo cual es un método sencillo. Algunos dispositivos nuevos como Revolve sytem (LifeCell Corporation) o Puregraft (Cytori Therapeutics) promueven concentraciones equivalentes o superiores a la técnica de Coleman37,38. Sin embargo, estos estudios tienen problemas de diseño experimental y no cuentan con una revisión independiente.
Injerto del tejido adiposo: Uno de los puntos más importantes, es cómo posicionar los injertos. La idea es proporcionar el máximo contacto entre la grasa y el sitio receptor. El injerto debe ser posicionado con múltiples pasadas en múltiples planos y en múltiples direcciones36,39. La inyección debe ser lenta y en pequeña cantidad40. El tamaño de cánula elegido debe ser en relación al sitio anatómico, idealmente una cánula roma con una apertura en un lado.
Si al momento de inyectar, estando en el plano adecuado, el volumen no aumenta lo esperado, se debe considerar factores restrictivos locales como adherencias fibróticas, ligamentos o envoltorio cutáneo muy estrecho. La fibrosis y la adhesión pueden ser resueltos con una aguja 18-G o con una cánula con punta tipo Toledo. El envoltorio cutáneo estrecho requiere pre-expansión.
Aún no está clara la utilidad de la sobrecorrección, ya que pone en riesgo la sobrevida del injerto, genera más necrosis, calcificación e incluso infección41.
Segundo tiempo: Debido al porcentaje de reabsorción variable entre un 10% y un 50%36,39, frecuentemente se requieren procedimientos adicionales. No hay un estudio que indique el tiempo exacto para la reinyección, pero la opinión de expertos es mencionada en la literatura, sugiriendo diferir al menos en 6 meses las sesiones de lipoinyección adicionales, para disminuir la respuesta inflamatoria en el área42. En general, la experiencia indica que al 3er mes hay una estabilización, aunque incompleta, por lo tanto, menos que este tiempo para un segundo tiempo no es aceptable.
Injertos grasos enriquecidos: Un mayor contenido de ASCs se correlacionaría positivamente con mayor retención del injerto en estudios experimentales43, sin embargo, la eficacia y seguridad no han sido determinadas aún. Yoshimura promueve un procedimiento denominado “cell assisted lipotransfer” adicionando SVF al lipoinjerto44. La hipótesis es una mejora en el prendimiento del injerto y regeneración de los adipocitos muertos. Sin embargo, más estudios aleatorizados deben ser llevados a cabo para probar estos beneficios.
Pre-expansión externa del tejido: Una novedosa técnica es propuesta por Khouri y cols45, denominada pre-expansión (EVE, external volume expansion). Se basa en la preparación del sitio receptor para un mejor ambiente de sobrevivencia y retención del injerto. El dispositivo aplica presión negativa continua a la piel en forma similar al VAC y fue utilizado primariamente para aumento mamario. Este dispositivo ha logrado demostrar resultados exitosos en largo tiempo. La hipótesis es que EVE puede incrementar el grosor del tejido receptor y mejorar la angiogénesis. Lancerotto y cols46, encontraron que EVE genera edema, estimulación mecánica, isquemia e inflamación del sitio receptor, manteniendo un ambiente conductivo a la proliferación celular y angiogénesis. Los inconvenientes del dispositivo son el uso interrumpido, rash cutáneos, dermatitis, e hiperpigmentación posinflamatoria.
Criopreservación de tejido adiposo: La criopreservación de tejidos multicelulares es un tema complejo, en el que se debe velar por la sobrevida celular y la integridad estructural y funcional del tejido. Los principales problemas, son la crio-injuria celular, la formación de hielo extracelular, el daño vascular por hielo y el estrés térmico durante el proceso de descongelado47. Los procesos críticos de la criopreservación incluyen la adición de agentes crio protectores (CPA, cryoprotective agent) y un proceso de congelado y descongelado uniforme y monitorizado. El problema de los CPA es su citotoxicidad y el problema de su eliminación posterior al descongelamiento es la lesión osmótica.
En relación a la viabilidad del tejido adiposo criopreservado, algunos estudios muestran datos contradictorios. Sin embargo, se mantienen los principios básicos de la conservación de tejidos. Se ha reportado que se puede congelar grasa en forma simple a -20°C, incluso sin CPA48,49. Sin embargo, esta opinión ha sido cuestionada y se estima que el congelamiento y descongelamiento simple de la grasa a -20°C sólo genera células muertas y su inyección no es más que un filler inerte50,51. En nuestra experiencia hemos verificado la ausencia de viabilidad tisular luego de la congelación a -20°C sin CPA (Figura 9). La discusión actual se centra en la búsqueda del mejor protocolo de congelamiento y descongelamiento, en estandarizar el método para evaluar la viabilidad tisular posdescongelamiento, en reducir el uso de DSMO (Dimetil Sulfoxido) como agente criopreservante y en eliminar el uso de sueros de origen animal52.
REJUVENECIMIENTO FACIAL CON LIPOINYECCIÓNLa lipoinyección el en rejuvenecimiento facial, puede ser un procedimiento primario o complementario para tratar la atrofia de los tejidos. El injerto de grasa entrega un rejuvenecimiento volumétrico con un material que se integra al tejido facial y entrega una apariencia natural mantenida en el tiempo. Adicionalmente la lipoinyección mejora la calidad del tejido facial, por un mecanismo aún no muy claro y que podría implicar la participación de ASCs.
Las áreas más frecuentemente tratadas son la frente, ceja, glabela, radix, reborde orbitario, mejillas, “tear trough”, tercio medio de la cara, labios, área perioral, surco nasogeniano, líneas de marioneta, contorno mandibular y mentón, entre otras zonas.
La cantidad de grasa a inyectar depende de la intuición y la observación del cirujano y se puede estimar en forma preoperatoria. La grasa debe ser inyectada en múltiples trayectos y en general menos de 0,5ml deben ser aplicados en cada pasada. El manejo de la jeringa es esencial para evitar la sobreinyección. En caso de existir obstrucción de la cánula, se debe evitar el exceso de presión, revisar y limpiar.
En las zonas de la cara donde la piel es gruesa se puede realizar inyección en múltiples planos desde el periostio (ej: tercio medio y mentón), mientras que en el resto de la cara se debe colocar con mayor detalle y en forma más limitada para evitar irregularidades. La inyección en el área temporal es subcutánea, mientras en que el área periorbitaria la inyección es habitualmente suborbicular. En contorno de la mandíbula habitualmente se utiliza un plano preperióstico o submasetero.
El surco nasogeniano es una buena zona para ser lipoinyectada y la profundidad depende de la existencia o no de recesión maxilar. Los labios responden con un aspecto natural y parejo, sin embargo, el principal inconveniente es el excesivo edema que demora en resolver.
LIPOINYECCIÓN MAMARIAEn 1987 la Sociedad Americana de Cirugía Plástica (ASPS) condena la lipoinyección mamaria, porque el injerto podría confundir la imágenes de un cáncer de mama. Con posterioridad se ha logrado demostrar que el seguimiento radiológico que el injerto mamario no es tan problemático53,54. En el año 2009, la ASPS establece que el injerto graso si puede ser considerado en el aumento mamario y para la corrección de defectos asociados a cirugías mamaria previas; sin embargo los resultados son dependientes de la técnica y del cirujano55.
La lipoinyección mamaria actualmente se desarrolla en cuatro escenarios:
1) Aumento mamario primario: Útil para pacientes que desean un incremento moderado de no más de una copa, aunque se puede requerir un segundo tiempo para mayor volumen. También es una alternativa para el relleno de polo inferior en una mama tuberosa o simulación del volumen pectoral en un síndrome de Poland.
2) Reconstrucción mamaria: En tejidos irradiados la lipoinyección mejora la calidad de la piel13 y genera un mejor terreno para una reconstrucción. En la reconstrucción con colgajos o implantes, se puede mejorar defectos residuales específicos. Por último en mastectomías parciales se puede utilizar como único tratamiento de relleno, aunque aún existen dudas del comportamiento oncológico de este “lipo-filling”56.
3) En combinación con implantes: El concepto consiste en incrementar el grosor cutáneo o “pinch test” mamario con el objeto de evitar la visibilidad del implante y como reemplazo de la técnica de dual-plane57. A esta técnica se la conoce también con el nombre de “Aumento mamario compuesto”58.
4) En combinación con brava®: La expansión adecuada crea un sitio receptor más apropiado para el injerto graso. Si bien esta técnica se utilizó inicialmente para aumento mamario primario, posteriormente se expandió su uso a reconstrucción mamaria, tanto inmediata como diferida59.
CONTORNO CORPORALLa lipoinyección glútea es una técnica ampliamente difundida, con resultados variables, pero que en la práctica actual se asocia a gran parte de la cirugía de contorno corporal. Toledo reporta una amplia serie de lipoinjertos glúteos con más de 500ml en cada lado, puestos en plano muscular y subcutáneo con una reabsorción de un 20-50%60. Mendieta por otro lado estima su tasa de reabsorción entre un 10-15%61.
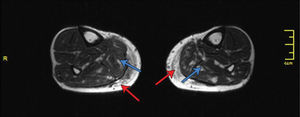
Otro sitio corporal frecuente de ser remodelado con lipoinyección son las pantorrillas. Toledo inyecta un volumen de entre 50 y 150 cc en cada pantorrilla60. Hoppmann inyecta un volumen promedio de 125cc en el plano muscular y subcutáneo (Figura 10) con una reabsorción estimada de 30% a los 6 meses62.
LIPOINYECCIÓN EN CIRUGÍA RECONSTRUCTIVALos beneficios de la lipoinyección se han incorporado al área reconstructiva de trauma y quemaduras. Adicional a su uso como relleno de partes blandas, se está utilizando para el tratamiento de heridas crónicas y para mejorar cicatrices retráctiles e hipertróficas. Este beneficio ha sido correlacionado positivamente con hallazgos histológicos63,64.
Khouri y cols. describen un procedimiento de aponeurotomía y lipoinyección para el tratamiento de la contractura palmar de Dupuytren (PALF, Percutaneous aponeurotomy and lipofilling). Realizan múltiples cortes con una aguja 19G y cuando la cuerda está completamente liberada inyectan la grasa. Reportan satisfacción de paciente de un 95% de los casos, encontrando un resultado igual de bueno que la aponeurectomía tradicional65.
El autor declara no tener conflictos de interés, en relación a este artículo.