Se estima que aproximadamente un 15% de las parejas son incapaces de concebir luego de un año de relaciones sexuales no protegidas; 30% son debidas a factor femenino y 30% a factor masculino. El 40% restante es de causa mixta.
La evaluación inicial de rutina en el varón (que incluye una detallada historia clínica, examen físico y test básicos como perfil hormonal y análisis seminal) es por lo tanto esencial para la mejoría de su fertilidad.
El varicocele, criptorquidia no tratada y las infecciones del tracto urogenital son las causas identificables más frecuentes de infertilidad masculina. Causas menos frecuentes son las disfunciones sexuales, trastornos endocrinos y efectos adversos de medicamentos.
Los tratamientos para estas patologías han sido efectivos en la mayoría de los casos, permitiendo a un importante número de parejas concebir en forma espontánea. Si esto no es posible, las parejas pueden recurrir a técnicas de reproducción asistida de baja complejidad, tales como la Inseminación Intrauterina. Y sólo en aquellos casos con problemas más severos recurriremos a técnicas de reproducción de alta complejidad como por ejemplo el ICSI (Inyección Intracitoplasmática de Espermatozoides). Importantes progresos en el área de la Microcirugía permiten no sólo reparar la vía seminal en muchos casos, sino también recuperar espermatozoides de pacientes con atrofia testicular. En los últimos años, junto con el ICSI, han sido una importante contribución.
It is estimated that approximately 15% of couples are unable to conceive after one year of contraceptive-free intercourse; 30% of which are due to female factors and 30% to male factors. The remaining 40% are due to both partners.
A routine initial evaluation of the male partner (including detailed medical history, physical exam and basic tests such as hormonal profile and semen analysis) is therefore essential, for improvement of their fertility.
Varicocele, untreated Cryptorquidism, infections (eg. epididymitis, orquitis, prostatitis and vesiculitis, most of which are related with sexually transmitted diseases) are the most frequent causes of male infertility. Other minor causes include sexual dysfunctions, drug adverse effects, exposure to radiation or contaminants, endocrine and genetic factors.
Treatment for this condition has been effective in most cases, allowing a significant proportion of couples to conceive spontaneously. Whenever this is not possible, patients may resort to low complexity techniques such as artificial insemination, and only in more severe cases, to advanced assisted reproduction techniques such as In Vitro Fertilization (IVF) and in particular Intracytoplasmic Sperm injection (ICSI). Microsurgery has also progressed. Not only used to repair the seminal path when obstructed, but also to recover sperm from patients with testicular atrophy. In recent years, these techniques, together with ICSI, have made an important therapeutic contribution.
Se estima que un en un 30% de las parejas infértiles la causa está en el hombre y en un 40% en ambos. Por esta razón, la evaluación del varón debería ser esencial y al inicio en el estudio de la pareja infértil. Esto, considerando además que en un porcentaje importante de los pacientes se puede obtener una mejoría parcial o total de su problema, incrementando así su potencial de fertilidad.
Esta evaluación comprenderá una detallada historia clínica y examen físico, así como el análisis de estudios de laboratorio, como perfiles hormonales y análisis del semen.
Dentro de las causas más frecuentes de la infertilidad masculina se encuentra el Varicocele, el mal descenso testicular o Criptorquídea no tratada y enfermedades infecciosas del tracto reproductor, como la epididimitis, orquitis, prostatitis y vesiculitis. La mayoría de estas últimas están relacionadas con infecciones de transmisión sexual. Causas menos frecuentes incluyen disfunciones sexuales, efectos adversos a medicamentos, exposición a radiaciones o contaminantes, causas endocrinas y genéticas.
Todas estas patologías se traducen en una disminución en la fertilidad del varón, que se evidencia a través de una disminución en la cantidad de espermatozoides, de su motilidad y de alteraciones en su morfología. Elementos básicos del análisis seminal, que en la actualidad puede complementarse con la evaluación de la presencia de autoanticuerpos, evaluar la fragmentación del ADN de los espermatozoides, detectar la presencia de especies oxígeno reactivas en el semen y medir la capacidad de unión del espermatozoide a la zona pellucida. Todos estos son exámenes complementarios al espermiograma tradicional, que son de gran utilidad en la evaluación y planificación del tratamiento de la infertilidad masculina.
Un mejor conocimiento de la patología asociada a los problemas andrológicos y nuevas terapias permiten que ocurra una mayor concepción natural en estas parejas. Si esto no ocurre, es posible recurrir a técnicas de baja complejidad, como la inseminación artificial para lograr el embarazo. Sólo en algunos casos, en general aquellos más severos, en que las opciones anteriores no han tenido éxito, es posible recurrir a técnicas de alta complejidad, como es la fecundación asistida, particularmente la inyección intracitoplasmática de espermatozoides (ICSI).
Importantes avances se han logrado en el uso de la microcirugía, no sólo para reparar la vía seminal en aquellos pacientes con obstrucción de esta, sino que también para la búsqueda de espermatozoides en el testículo en aquellos pacientes con ausencia de estos por una atrofia u obstrucción de los conductos seminales. Estas técnicas, acompañadas con el ICSI han significado un importante aporte terapéutico en los últimos años.
Cabe señalar, que la mayoría de los problemas de infertilidad en el hombre se podrían prevenir: la corrección precoz del varicocele, el descenso oportuno de los testículos, la prevención de las enfermedades de transmisión sexual, así como también el evitar la exposición a drogas y tóxicos.
IncidenciaAproximadamente un 10 a 15% de las parejas después de un año de relaciones sexuales no protegidas, no podrá lograr un embarazo. De estas, un 30% se debe a causa femenina, otro 30% a causa masculina y un 40% a problemas en ambos.
Se estima que uno de cada 20 hombres tiene algún tipo de problema de fertilidad, con bajo número de espermatozoides en el eyaculado. Sin embargo, sólo uno de cada 100 hombres no tienen espermatozoides en su eyaculado.
En el 60% de los hombres infértiles, no se encuentra una causa para el recuento bajo o de la mala calidad de los espermatozoides (1).
La fertilidad del hombre, en general, se basa en la cantidad y la calidad de sus espermatozoides. Si el número de espermatozoides que un hombre eyacula es muy bajo o si son de muy mala calidad será difícil, a veces imposible, que una pareja logre el embarazo.
Factores pronósticoLos principales factores que influencian el pronóstico de la infertilidad se muestran en la Tabla 1. (3)
Cuando la duración de la infertilidad excede los 4 años, la probabilidad de concepción es 1,5% por mes.
Causas de infertilidad masculinaLa infertilidad masculina puede ser causada por los problemas que afectan a la producción de espermatozoides o el proceso de transporte de los mismos.
Las causas conocidas de infertilidad masculina se puede describir como:
- •
Anormalidades urogenitales congénitas (incluye obstrucción y disgenesias)
- •
Infecciones del tracto urogenital
- •
- •
Trastornos endocrinos
- •
Anormalidades genéticas
- •
Factores inmunológicos
Aún así, aproximadamente en un 30% de los pacientes no es posible encontrar una causa definida de su infertilidad.
En la tabla 2 se muestran las causas de infertilidad masculina encontradas en un estudio realizado por la Organización Mundial de la Salud sobre más de 7000 hombres infértiles (1).
Causas de infertilidad masculina
| CAUSA | % |
|---|---|
| • Factores Sexuales | 1.7 |
| • Infección urogenital | 6.6 |
| • Anormalidades congénitas | 2.1 |
| • Factores adquiridos | 2.6 |
| • Varicocele | 12.3 |
| • Trastornos endocrinos | 0.6 |
| • Factores inmunológicos | 3.1 |
| • otras anormalidades | 3.0 |
| • Semen anormal idiopático o causa no demostrable | 75.1 |
| * WHO (2001) (1). |
El diagnóstico de infertilidad debe incluir una historia clínica detallada del varón para detectar algún problema de salud evidente que podría afectar la fertilidad. Aquí son importantes la historia de enfermedades en la infancia y pubertad como por ejemplo el mal descenso testicular, alteraciones cromosómicas, cirugías, si ha tenido infecciones del tracto urogenital, uso de medicamentos, exposición a sustancias nocivas que induzcan daño al epitelio germinal.
El examen físicoLa historia clínica será seguida por un examen físico completo.
El examen físico para evaluar factores relacionados con la fertilidad de un varón debe buscar en:
- •
Características sexuales secundarias.
- •
La presencia de ginecomastia.
- •
Cualquier evidencia de anteriores cicatrices quirúrgicas en la región inguinal o escrotal.
- •
El crecimiento y desarrollo del pene.
- •
Posición de los testículos en el escroto.
- •
Medición del tamaño y la consistencia de los testículos.
- •
Características del epidídimo.
- •
Presencia de los vasos deferentes junto a los testículos.
- •
Desarrollo de varicocele.
- •
Si hay alguna sospecha de inflamación de la glándula prostática, un examen rectal de la próstata debe realizarse.
Se utiliza para obtener una evaluación más precisa del tamaño testicular, para comprobar que no hay pequeños quistes de epidídimo y para descartar la presencia de imágenes sugerentes de cáncer en desarrollo. Estos hallazgos son más comunes en los hombres con problemas severos en la producción de espermatozoides o en los hombres que han tenido una historia de criptorquídea. La asociación con doppler permite confirmar el diagnóstico de varicocele.
Estudio de la infertilidad masculinaAnálisis SeminalEste análisis constituye la base de importantes decisiones en relación a un tratamiento apropiado y requiere, por lo tanto, de una adecuada estandarización en laboratorios especializados. Se recomiendan al menos 2 análisis de semen con entre 3 a 5 días de reposo sexual. El análisis del eyaculado ha sido estandarizado por la Organización Mundial de la Salud (OMS) a través de la publicación continua de su manual, que se recomienda seguir sin excepción (2, 3).
Los valores normales recomendados según este manual son:
| Volumen | > 2.0ml. |
| ph | 7.0–8.0 |
| Concentración | ≥ 20 millones/ml |
| Número total de espermatozoides | ≥ 40 millones/ml |
| Motilidad rápida | ≥ 50% movilidad progresiva |
| o 25% movilidad A | |
| Morfología | ≥ 14% formas normales (Kruger) |
| Viabilidad | > 50% de los espermatozoides |
| Leucocitos | <1 millón/ml |
| MAR test | < 10% espermatozoides con partículas adheridas |
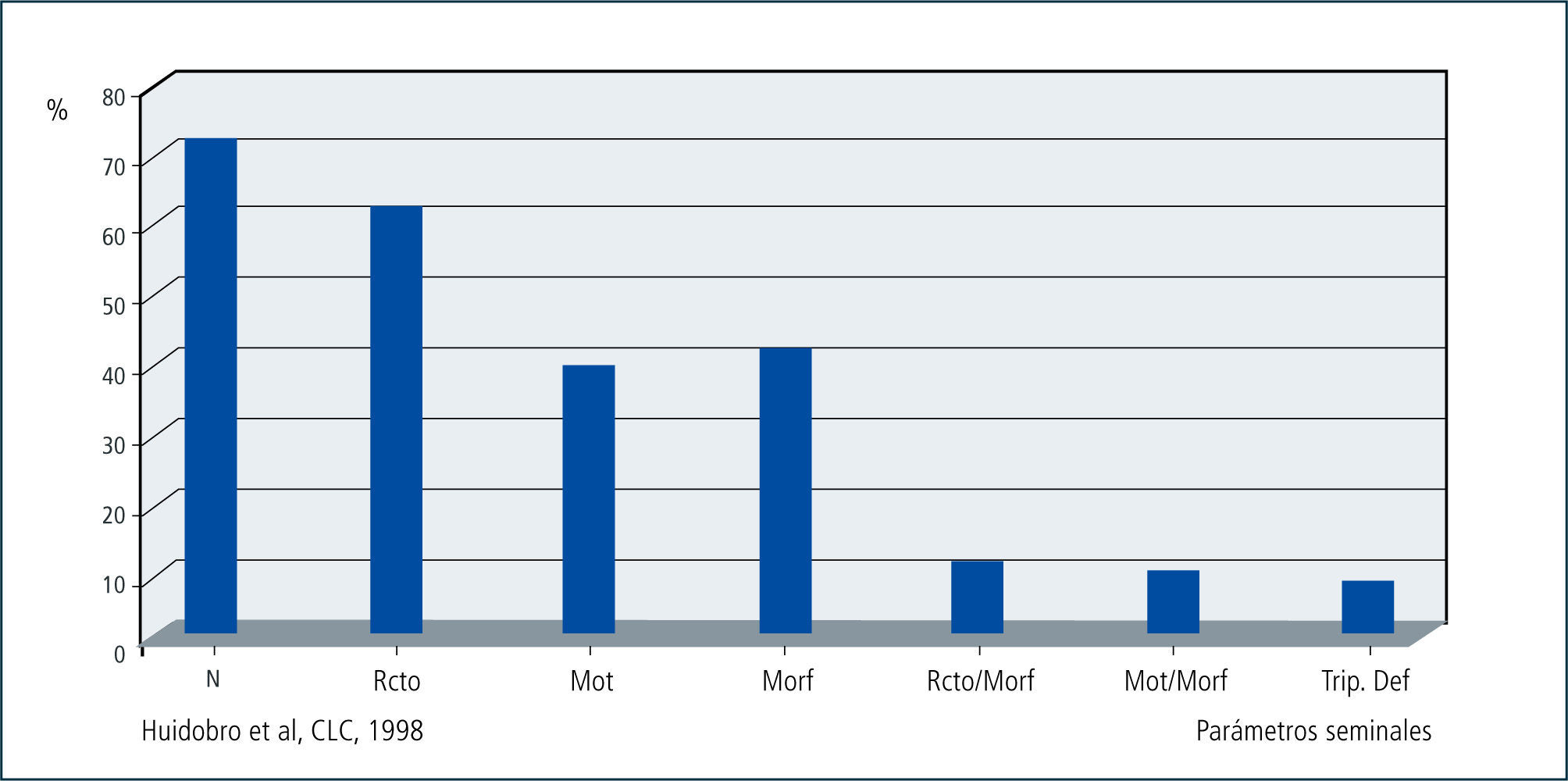
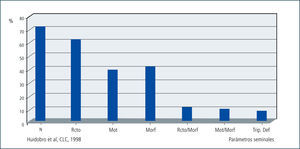
En la mayoría de los pacientes infértiles coexisten una o más de estas alteraciones, lo que motivará análisis adicionales. La combinación de estas alteraciones puede ser un elemento predictivo del resultado de técnicas de fertilización in Vitro. En la gráfico 1 se observa una disminución significativa en las tasas de fertilización in Vitro en pacientes con dos o más parámetros alterados del espermiograma.
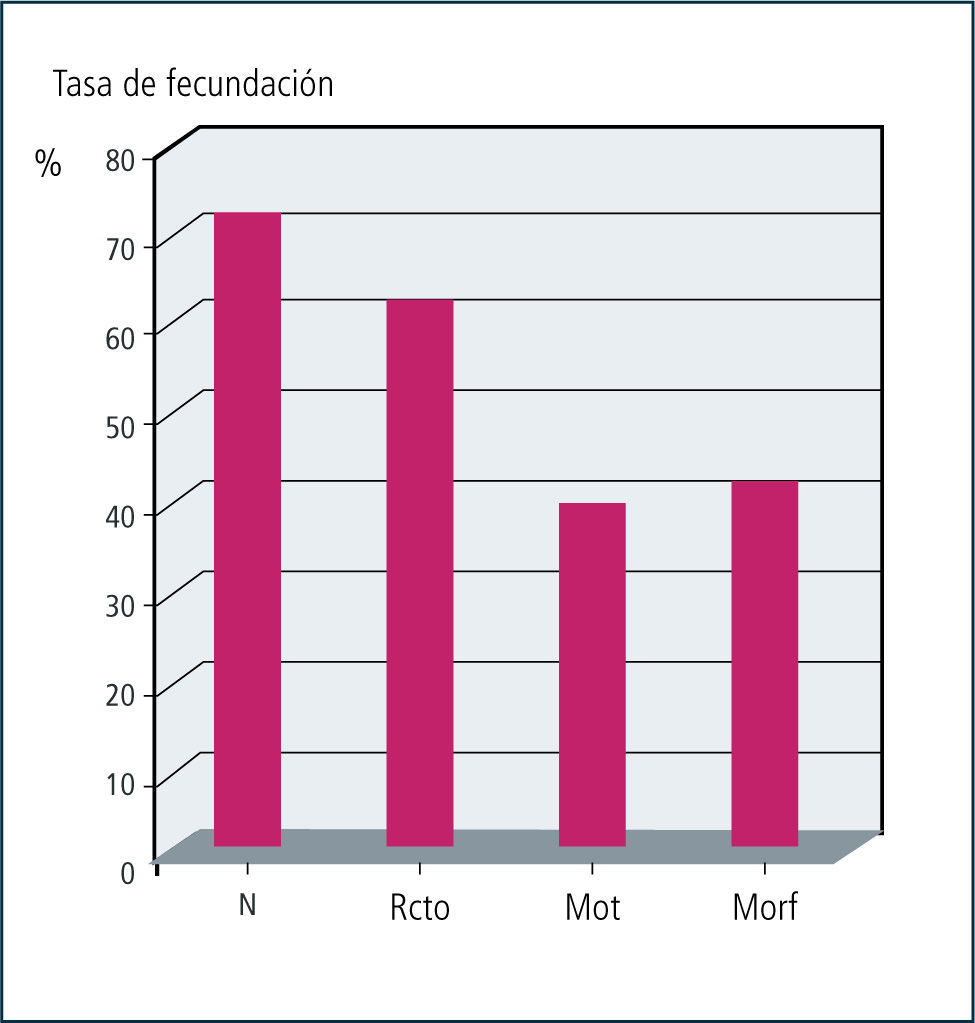
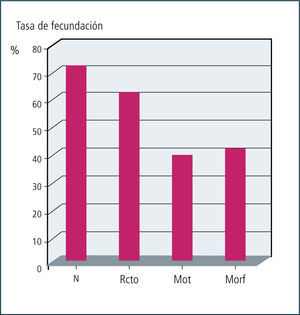
Otro factor pronóstico en cuanto a la tasa de fertilización in Vitro es el número de espermatozoides separados, tal como se observa en el gráfico 2. Mientras menor es el número de espermatozoides separados, menor es la tasa de fertilización observada.
Otros estudiosMedición de anticuerpos antiespermáticosSe realiza de rutina con el fin de detectar la presencia de anticuerpos antiespermáticos. Estos aparecen como resultado de la ruptura de la barrera remato-testicular, en general debido a cuadros obstructivos de la vía seminal e infecciones del tracto urogenital.
Estudio de fragmentación del ADN espermáticoEs un marcador de función espermática que afecta a toda la muestra espermática. Está asociado a varicocele y a cuadros inflamatorios. También en pacientes con azoospermia se ha observado una mayor fragmentación del ADN (espermatozoides testiculares y epididimarios), lo que podría tener un impacto en el resultado de tratamientos de fecundación asistida.
Cuantificación de especies oxígeno reactivas (EOR)Las EOR son radicales libres, es decir cualquier átomo o molécula que posee uno o más electrones no pareados.
Estas moléculas están involucradas en diversos procesos tales como: apoptosis, inducción de trascripción de genes involucrados en la inmunidad, cicatrización, y procesos inflamatorios en general (4).
Habitualmente éstas se encuentran elevadas en procesos infecciosos y/o inflamatorios crónicos de la vía seminal.
La excesiva generación de EOR por espermatozoides y leucocitos ha sido identificado como una de las etiologías claramente asociadas a infertilidad.
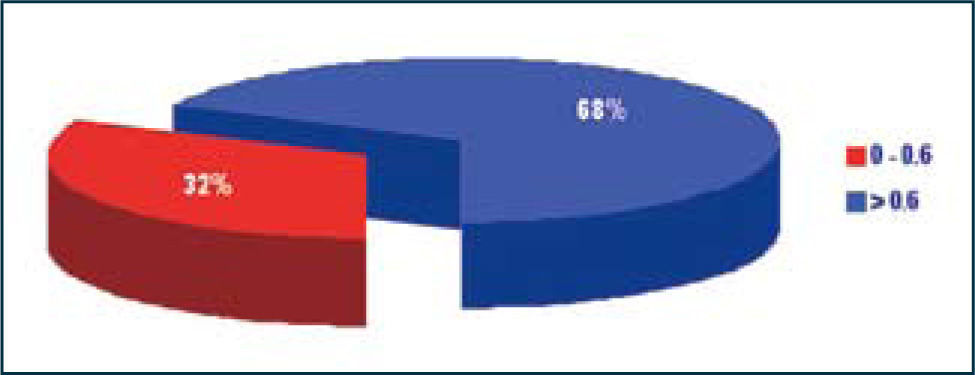
Niveles altos de EOR se han detectado hasta en el 40% de hombres infértiles.
El uso de altas dosis y por tiempo prolongado de antioxidantes produce la disminución de éstas con la consecuente mejoría en la función de los espermatozoides.
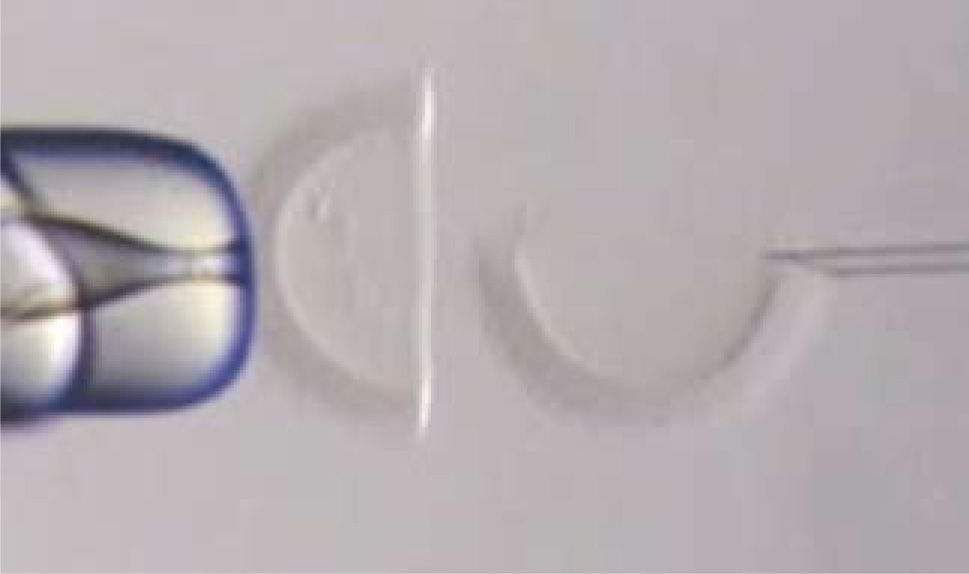
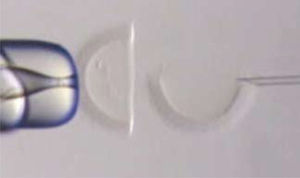
Test de HemizonaEs un test homólogo en el que se utilizan zonas pelúcidas de ovocitos que no adecuados para su utilización en procedimientos de reproducción asistida o cadavéricos. Una hemizona es utilizada para evaluar la capacidad de unión de los espermatozoides del paciente y se compara con la otra hemizona donde se utiliza un donante fértil. La diferencia entre el número de espermatozoides adheridos a cada hemizona da un índice de la capacidad de unión a la zona pelúcida (Figura 1).
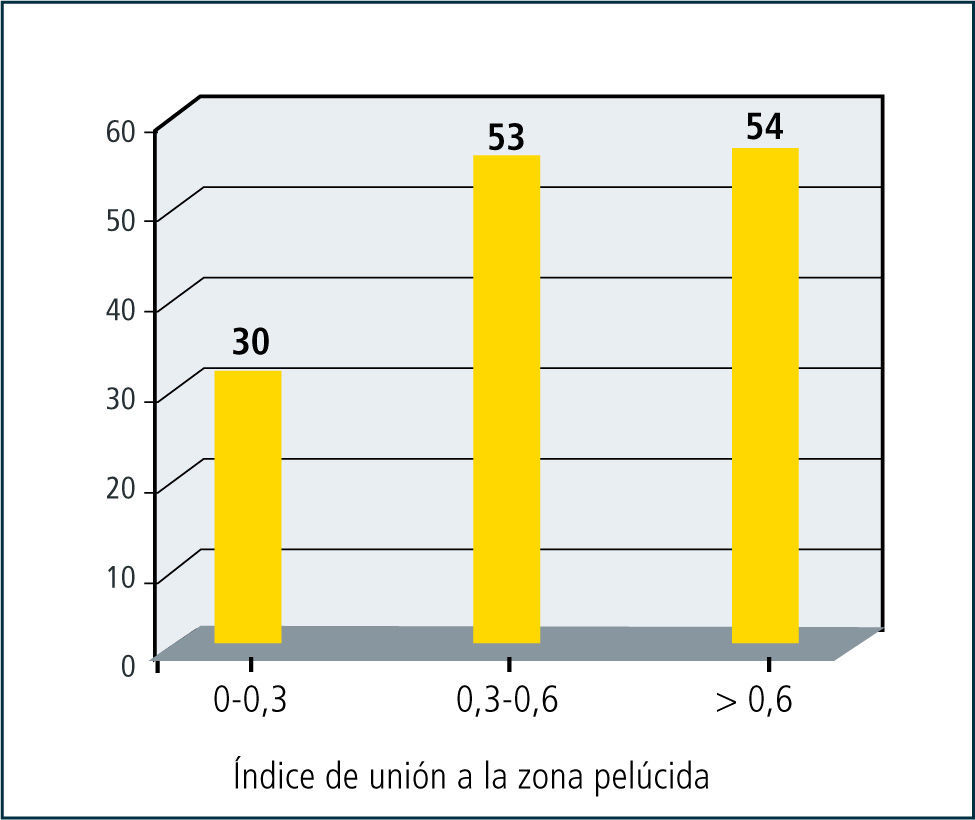
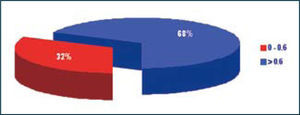
Existe una adecuada correlación con las tasas de Fecundación in Vitro. (Gráfico 3).
Estudios genéticosCariotipoSólo está indicado si clínicamente hay sospechas de cuadros clínicos relacionados con trastornos cromosómicos.
Microdeleción cromosoma Y
Su estudio está indicado en pacientes con azoospermia no obstructiva, especialmente para determinar si es necesario realizar biopsia testicular, ya que deleciones en AZFc presentan una alta probabilidad de espermatogenesis completa a nivel del epitelio germinal y obtención de espermatozoides, lo contrario ocurre en deleciones presentes en AZFa y AZFb. (5).
Análisis sistemático de las causas de infertilidad masculinaFalla Espermatogénica PrimariaEsta es una alteración en la función testicular causada por condiciones propias del testículo, más allá de las fallas en el eje hipotálamo-hipófifis. Las fallas severas tienen diferentes etiologías y en la mayoría de los casos se presentan como oligozoospermias severas (<1 millón espermatozoides por ml.) y azoospermia no obstructiva (ausencia de espermatozoides). Su incidencia en población de hombres infértiles puede ser entre 10 a 20% (3).
EtiologíaAnorquia- •
Factores congénitos (disgenesia testicular).
- •
Factores adquiridos (trauma, torsión testicular, tumores, cirugías).
- •
Mal descenso testicular.
- •
Síndrome de Klinefelter.
- •
Otras alteraciones cromosómicas.
- •
Aplasia de células germinales.
- •
Aplasia germinal completa o focal (síndrome de Sertoli solo), congénito o adquirido: mal descenso testicular, radiación, drogas citostáticas).
- •
Detención de la espermatogénesis.
- •
Post inflamatorio (orquitis).
- •
Factores exógenos (medicamentos, toxinas, radiaciones, calor).
- •
Enfermedades sistémicas (cirrosis hepática, falla renal).
- •
Tumor testicular.
- •
Varicocele.
- •
Cirugías que pueden dañar la irrigación del testículo.
- •
Idiopáticos.
La mayor parte de estos pacientes tienen cantidades muy bajas de espermatozoides (menos de 1millón /ml), o bien, no tienen (azoospermia no obstructiva). Se recomienda centrifugar la muestra a lo menos a 1000g para ver si hay espermatozoides en el pellet.
Determinaciones hormonalesLos valores de FSH están generalmente elevados, indicando una cantidad disminuida de espermatogonias, aunque se puede encontrar normal en pacientes con espermatogonias normales, pero con bloqueo a nivel espermatocítico o espermátida. En general, en el análisis de un paciente individual, el nivel de FSH no predice el estado de su espermatogénesis.
Biopsia testicularEn general la biopsia testicular está indicada con el objeto de diferenciar entre azoospermia obstructiva y no obstructiva en pacientes sin factor evidente, hormonas normales y tamaño testicular normal.
Además de tener información sobre el estado de la espermatogénesis, se recomienda la realización de ésta idealmente en el contexto de enviar simultáneamente muestras testiculares al laboratorio de reproducción asistida con el fin de aprovechar el procedimiento con fines terapéuticos y criopreservar espermatozoides en caso de ser encontrados. Estos se usarán posteriormente en ciclos de ICSI. Aproximadamente 50 a 60% de los pacientes con NOA tendrán espermatozoides en el túbulo seminífero.
TratamientoLa extracción de espermatozoides del testículo (TESE), asociado a ICSI comenzó como terapia efectiva en estos pacientes en 1993, siendo implementado en Clínica Las Condes (CLC) en 1995. Se recomienda en estos pacientes ser evaluados con estudios genéticos como cariotipo y estudio de microdeleciones del cromosoma Y. En caso de estar alteradas, la pareja debe ser apropiadamente aconsejada. Si la microdeleción es AZFa y AZFb, lo habitual es que no se encuentren espermatozoides en el túbulo seminífero.
Si la extracción se realiza bajo microscopio, sobre los túbulos más dilatados se logra optimizar el hallazgo de ellos, sin resecar una cantidad exagerada de parénquima, lo que podría determinar posteriormente un déficit androgénico en estos pacientes.
Los resultados de ICSI en pacientes con NOA son más bajos que en pacientes con OA, 28 contra 42% de embarazo por transferencia embrionaria (CLC). En pacientes con azoospermia no obstructiva, los resultados de ICSI con espermatozoides testiculares criopreservados son ligeramente inferiores que cuando se usan espermatozoides frescos (25 vs 28% respectivamente).
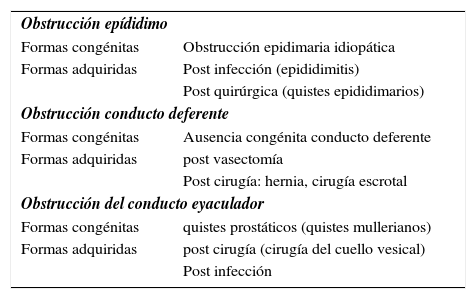
Azoospermia ObstructivaSe define a la situación en la que hay ausencia de espermatozoides en el semen debido a obstrucción bilateral de los conductos seminales, desde el epididimo hasta los conductos eyaculadores.
Clasificación de la azoospermia obstructiva
| Obstrucción epídidimo | |
| Formas congénitas | Obstrucción epidimaria idiopática |
| Formas adquiridas | Post infección (epididimitis) |
| Post quirúrgica (quistes epididimarios) | |
| Obstrucción conducto deferente | |
| Formas congénitas | Ausencia congénita conducto deferente |
| Formas adquiridas | post vasectomía |
| Post cirugía: hernia, cirugía escrotal | |
| Obstrucción del conducto eyaculador | |
| Formas congénitas | quistes prostáticos (quistes mullerianos) |
| Formas adquiridas | post cirugía (cirugía del cuello vesical) |
| Post infección | |
Los hombres con azoospermia obstructiva tienen tamaño testicular normal y niveles de FSH normales. Al examen físico se aprecia un engrasamiento del epidídimo y/o presencia de nódulos, siendo importante también las características del conducto deferente.
En aquellos pacientes con ausencia congénita de los conductos deferentes se encuentran bajos volúmenes de semen en el eyaculado, esto por la ausencia de las vesículas seminales. Esta patología se asocia a por lo menos una mutación del gen de la fibrosis quística, razón por la cual es necesario el estudio de la mujer en estos casos. Siendo ella portadora para la mutación, y se encuentra que el hombre es portador heterocigoto, la probabilidad de tener un hijo con Fibrosis Quística es del 25%. Si es homocigoto, la probabilidad asciende al 50% (14).
En los casos cuyo origen es un factor infeccioso, la reparación con restitución de la vía seminal es de muy bajo rendimiento. Lo que hace recomendable la aspiración microquirúrgica de los espermatozoides (MESA) desde el conducto epididimario, los que son usados en ICSI (8).
Cuando la obstrucción es en el conducto deferente, por ejemplo como resultado de una vasectomía, los resultados de la reparación microquirúrgica son muy buenos en términos de tasas de permeabilidad por sobre el 85% (8) (9).
En casos excepcionales se puede recurrir a ICSI.
VaricoceleEl varicocele es una patología frecuente. Se caracteriza por una dilatación del plexo pampiniforme testicular debido a un reflujo venoso. Se presenta en aproximadamente el 20% de la población llegando hasta el 40% en algunas series en población de hombres infértiles. Puede tener las siguientes implicaciones andrológicas: falla en el crecimiento y desarrollo testicular ipsilateral, dolor e infertilidad.
En la fisiopatología han sido involucrados los siguientes mecanismos: reflujo reno-adrenal de catecolamina, prostaglandinas y cortisol con vasoconstricción asociada; disfunción hormonal: disminución de testosterona, FSH – LH; hipertermia e hipoxia.
El diagnóstico se hace basado en el examen clínico y se confirma con ecotomografía y estudio doppler.
Las indicaciones para corregir in varicocele son: el varicocele es palpable, existen uno o más parámetros seminales o test funcionales alterados, la pareja tiene infertilidad documentada, la mujer tiene fertilidad normal o infertilidad potencialmente corregible (10).
Existen varias formas de tratamiento del varicocele, todas ellas tienen en común la ligadura o esclerosis de los vasos venosos comprometidos. La técnica quirúrgica se realiza por distintas vías, como inguinal, escrotal, ligadura alta laparoscópica, embolización y, en los últimos años, se ha preconizado la ligadura microquirúrgica.
CriptorquideaEs la anormalidad congénita más frecuente de los genitales masculinos y consiste en la ausencia de los testículos en la cavidad escrotal. Se encuentra en aproximadamente el 2 a 5% de los recién nacidos, siendo ésta más elevada en niños prematuros (21%). La etiología es multifactorial, donde están involucrados, tanto factores genéticos, como ambientales y endocrinos, constituyendo una disgenesia gonadal. Esta implicará problemas en el desarrollo del genital con su consecuente impacto en el potencial de fertilidad, que se reduce en forma progresiva en la medida que el hombre crece e incluso con mayor riesgo de desarrollar cáncer (11).
La prevención de la infertilidad futura de estos pacientes se basa principalmente en un tratamiento precoz, es decir antes de los 2 años de edad, realizando el descenso quirúrgico y/o con apoyo de gonadotrofinas. En el adolescente no tratado se recomienda la criopreservación espermática, dado el carácter progresivo del daño testicular.
La mayoría de estos pacientes ya en la edad fértil se presentan con oligozoospermias muy severas o azoospermia no obstructiva (NOA). Dada la pérdida cuantitativa de línea germinal, no existe tratamiento específico para aumentar el número de espermatozoides por lo que deben recurrir a técnicas de fertilización asistida, principalmente ICSI, con resultados muy satisfactorios.
Infeccion de las glándulas accesoriasEsta patología presenta una alta prevalencia en hombres infértiles (20%) y es una causa potencialmente curable. Su impacto sobre la fertilidad radica en un efecto directo del agente patógeno sobre el espermatozoide así como también sobre la función de estas glándulas, constituyendo en muchos casos una disfunción de estas de carácter crónico y de difícil solución. En casos más severos puede llegar a generar distintos grados de obstrucción de la vía seminal. Las diferentes formas de infección son: uretritis, prostatitis, vesiculitis, orquitis y epididimitis.
Especial relevancia la constituyen las prostato-vesiculitis (12). En este grupo de pacientes, generalmente asintomáticos, se detecta la infección principalmente por la aparición de leucocitos en el semen y/o el aislamiento de diversas bacterias. En la mayoría de los casos los pacientes tendrán distintos grados de oligo, asteno y teratozoospermia, la presencia de anticuerpos antiespermáticos, fragmentación elevada del ADN espermático y elevación de especies oxígeno reactivas en el semen. Los gérmenes más frecuentemente aislados son: E. Coli, ureaplasma urealiticum, mycoplasma, clamideas, enterococo, klebsiella, entre otros (13).
En general, el tratamiento, en base a antibióticos, antiinflamatorios y antioxidantes, en forma prolongada y en algunos casos también a la pareja. Dado que esta patología tiene una alta tendencia a la recidiva, es importante el monitoreo continuo de estos pacientes, especialmente si están en programas de fertilidad de baja complejidad (inseminaciones intrauterinas) o alta complejidad, como fertilización in vitro (IVF) o ICSI.
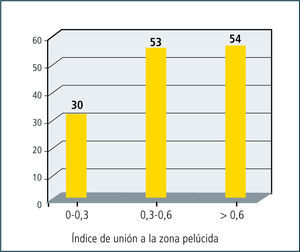
Infertilidad masculina de causa desconocidaAun existe un 40% de hombres infértiles en que no es posible encontrar una causa aparente. Algunos estudios funcionales, como el test de hemizona han sido evaluados en esta población de pacientes, demostrando que sus espermatozoides en aproximadamente el 30% de ellos tienen bajas tasas de unión a la zona pelúcida (Figura 2). Esto tiene gran utilidad en la decisión terapeutica y la orientación en estos casos hacia la resolución a través de técnicas de reproducción asistida de alta complejidad (ICSI).
Numerosos tratamientos han sido probados, la mayoría de ellos en forma empírica y sin una base científica sólida, siendo en general inefectivos y en general no son recomendados.
Entre ellos, se han utilizado gonadotrofinas, antioxidantes, y andrógenos, sin embargo sólo se justifica en el marco de estudios randomizados.
La mayoría de estos pacientes, dependiendo de la severidad de sus alteraciones espermáticas serán tratados como pareja con técnicas de reproducción de baja complejidad, como IIU o de alta complejidad, como ICSI.
ConclusiónLa Infertilidad Masculina constituye un elemento muy importante en el impacto reproductivo de las parejas, llegando a ser tan frecuente como el 50% de ellas.
Los centros de Medicina Reproductiva en la actualidad debieran considerar sistemáticamente la evaluación del varón en toda pareja que consulta por infertilidad.
Dada la patología involucrada en el problema masculino, nos damos cuenta primero que hay muchas de ellas que son factibles de corregir o mejorar.
Esto nos permitirá, en casos que no logran mejoría y embarazo en forma espontánea, llegar en una mejor condición a las distintas técnicas de reproducción asistida, sea esta la Inseminación Intrauterina o la Fertilización in Vitro, dependiendo de la severidad del problema.
El autor declara no tener conflictos de interés, en relación a este artículo.