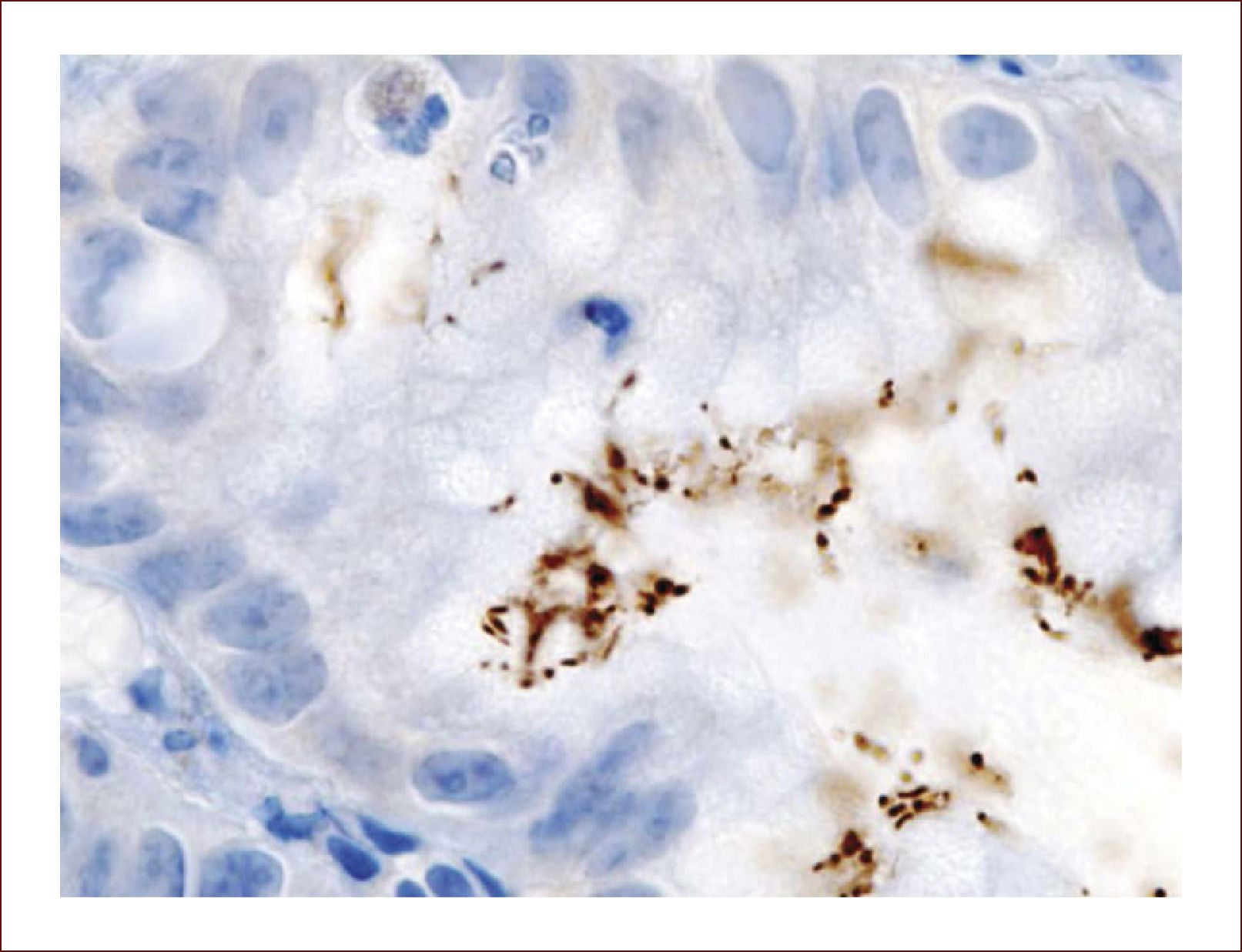
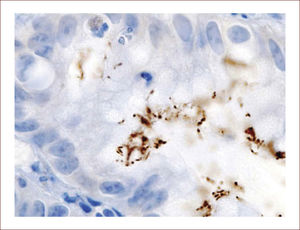
En 1983, hace 30 años, Warren JR y Marshall BJ publican el artículo en Lancet1, que revolucionó el entendimiento de varias patologías gástricas, al encontrar un bacilo curvo no identificado en el epitelio gástrico, en gastritis crónica activa, de forma casi fortuita, al bacilo llamado subsecuentemente, Campylobacter pylori y con la nomenclatura de hoy, Helicobacter pylori. Fue considerado por la OMS carcinogenético gástrico el año 2001 (Figura 1).
En el 2005, fueron galardonados con el Premio Nobel de Medicina, por su contribución (Figura 2).
Es el tópico que más publicaciones científicas ha generado en la literatura.
En la presente revisión, nos ocuparemos de un enfoque eminentemente práctico, sobre hechos de relevancia clínica de su presencia, de su diagnóstico, de la terapéutica y sus variables actuales y de los diferentes escenarios, en los cuales nos desenvolvemos.
Se hace mención de un excelente documento generado en un Consenso actualizado en Latinoamérica2.
In 1983, 30 years ago, Warren JR & Marshall BJ, published in Lancet, their leading revolutionary article1, modifying the understanding of several gastric pathologies, thanks to the discovery of an unidentified curved bacilli in the gastric epithelium, in chronic active gastritis, almost unvoluntariously, nominated sequentially Campylobacter pylori and according to the today's nomenclature Helicobacter pylori. It has been considered gastric carcinogen by WHO in 2001 (Figure 1).
In 2005, they were awarded with the Nobel Prize of Medicine for their contribution (Figure 2).
It is the topic generating the highest number of scientific publications, in the literature.
In this publication, we deal with a practical focus on clinical relevant aspects, related with its presence, its diagnosis, the therapeutic approach and its variables, and tackling the different clinical scenarios.
A recently published practical Latin American consensus, has been preferently considered2.
La frecuencia de infección por Helicobacter pylori es variable en el mundo, hay zonas geográficas donde el contagio es precoz en la vida, áreas donde la prevalencia es casi universal, y áreas donde es escaso o van descendiendo progresivamente sus niveles de infección. En Chile, la prevalencia es alta, aproximadamente el 65-70% y en todo el país, con diferentes ambientes climáticos.
Se le ha relacionado con la enfermedad ulcerosa, la gastritis aguda y crónica y en especial la gastritis crónica atrófica, el cáncer gástrico, la hiperplasia nodular gástrica, los adenomas gástricos, el linfoma MALT y el linfoma gástrico.
El tratamiento estándar para esta infección ha sido diseñado por sociedades científicas europeas y de los EE.UU. Se ha elaborado un Consenso de América Latina (2000), con la WGO/AIGE de Coelho H y col.9, y uno publicado en 2014, liderado por Rollan A.2, que aportan visiones más cercanas al escenario Latino americano.
También se le ha relacionado con otras afecciones no digestivas, como el Púrpura Trombopénico Idiopático (PTI), que mejoraría en algunos casos con su erradicación, evitando esplenectomías. Anemia ferropriva y déficit de vitamina B12.
REFLUJO Y HELICOBACTER PYLORIEs aún tema en discusión, su relación con la dispepsia y la repercusión sobre el reflujo gastroesofágico, al erradicarlo.
Parecería que el status de Helicobacter pylori, no tendría efecto sobre la severidad de los síntomas, la recurrencia de los síntomas y la eficacia del tratamiento de enfermedad por reflujo gastroesofágico (RGE). No exacerba la sintomatología de RGE pre-existente o interfiere en la eficacia del tratamiento. Sin embargo, hay estudios que muestran asociación negativa entre prevalencia de Helicobacter pylori y la severidad del RGE e incidencia de adenocarcinoma esofágico.
DIAGNÓSTICOLa tecnología actual permite diferentes opciones diagnósticas, tales como la identificación en biopsias con tinción adecuada, el estudio de anticuerpos séricos, el estudio de aire expirado con carbono marcado (Figura 3), la búsqueda en directo en deposición, el cultivo de muestras obtenidas de la mucosa gástrica y además en estudios de endoscopia moderna con magnificación, al ver ocupadas las criptas gástricas (Yao)3, serología para Helicobacter pylori. Anticuerpos. Es interesante considerar también, las formas de evaluar erradicación.
Diagnóstico de presencia de Helicobacter pylori- •
Histología
- •
Test de Ureasa Rápida
- •
Cultivo de biopsias de antro o cuerpo obtenidas por EDA
- •
Serología para Helicobacter pylori Anticuerpos.
- •
Test de Carbono marcado en aire expirado
- •
Detección de Helicobacter pylori en deposición
Es interesante determinar la edad de comienzo de la infección en una población y de los cambios en la mucosa gástrica, atribuibles a la infección por Helicobacter pylori. Establecer quizás “un punto de no retorno”, en el cual ya no es suficiente la erradicación del Helicobacter pylori, para evitar el cáncer gástrico.
EL ABORDAJE DE LA TERAPÉUTICA ES CONTROVERSIALExisten, numerosos esquemas terapéuticos, con tres o cuatro drogas, por 7 a 14 días de duración, las terapias secuenciales, concomitantes, los tratamientos abreviados, esquemas alternativos para gérmenes resistentes. Un análisis de estas opciones y una recomendación en diferentes escenarios, sería deseable en esta revisión.
EL MANEJO DEL HELICOBACTER PYLORI PREVALENCIA DE INFECCIÓN POR HELICOBACTER PYLORIEn Chile, aunque hay variaciones según la geografía, la prevalencia se encuentra entre el 65-70%.
Se ha descrito4 las tendencias de la exposición a su mayor riesgo en lugares de diferentes patrones de cáncer gástrico. La prevalencia es mayor en América del Sur, Centro América y Asia. Al menos 2 veces mayor que el promedio, en países con incidencia mayor de Cáncer Gástrico. El estudio incluye evaluaciones de diferentes períodos y los más recientes, revelan una disminución de su prevalencia. En países con prevalencia baja, no ha habido cambios. En países de alta prevalencia hay trabajo por hacer5.
TERAPIAUna terapia ideal debe tener una alta tasa de erradicación, duración corta, con pocos efectos colaterales y mantener bajo costo. La extensión del tratamiento a 14 días, parece ser importante, al mejorar las tasas de erradicación. Se han diseñado numerosos esquemas de terapia, pero éstos debieran ser diseñados de acuerdo a la epidemiología y resistencia antibiótica del área de trabajo.
Hay terapias, triples, cuádruples, secuenciales, concomitantes, de duración variable (7-10-14 días), además de esquemas de segunda línea, en casos de fracaso de erradicación que incluyen nuevos antibióticos como levofloxacino6.
Erradican en promedio con terapia secuencial 84,3% (IC 95% 82.1-86.4%). Es superior a triple terapia 7 días con RR 1,21 y un NNT de 6. Superior a triple terapia 10 días con RR 1,11 y un NNT de 10.
No es superior a triple terapia 14 días con RR 1.00 o terapias con o sin bismuto.
La terapia secuencial erradica 72,8% de cepas resistentes a claritromicina.
La duración ideal del tratamiento es controversial (Grupo Cochrane). El aumentar a 14 días la triple terapia, aumenta la tasa de erradicación, aumentando escasamente los eventos adversos7.
Estudios recientes han mostrado además, resultados con la llamada terapia concomitante, que alcanza niveles muy satisfactorios de erradicación, de hasta 94%. Esta terapia incluye a un BBP (rabeprazol), amoxicilina, claritromicina y metronidazol8.
Hay tasas de resistencia variables según el área y se debe en estos lugares, hacer estudios de resistencia. Hay países con consumo importante y no discriminado de antibióticos, en los cuales hay una tasa de resistencia mayor.
En esta terapia antibiótica, debiera considerarse el riesgo de presentar CDI (Infección por Clostridium difficile).
En general, las terapias están basadas en claritromicina y metronidazol, además de amoxicilina y uso de inhibidores del ácido gástrico.
En los últimos años ha habido un aumento de la resistencia a claritromicina y metronidazol con la creciente disminución de las tasas de erradicación.
Se debe optar a tasas de erradicación superiores al 90%.
Parece ser de ayuda el monitorizar resistencia antibiótica en la población a cargo.
TERAPIA SECUENCIALRégimen en el cual se administran los antimicrobianos en una secuencia determinada, que se compara con su uso simultáneo.
Una opción sugerida sería iniciar con terapia dual con Bloqueadores de Bomba de protones (BBP) y amoxicilina (AMX) 1 gramo dos veces al día, por 5 días, seguido por terapia triple, al agregar nitroimidazolicos (metronidazol) los siguientes 5 días.
Como hemos dicho, no existe una terapia útil universal y es necesario considerar un enfoque epidemiológico y bacteriológico local, de acuerdo a cepas más frecuentes y su sensibilidad antibiótica. Se requiere de estudios locales.
La triple terapia, tiene una eficacia aproximada cercana al 80%. La terapia secuencial tendría éxito en más del 90%, o cifras de 84,3%, seguido de la triple terapia 14 días con dos antimicrobianos y luego 10 y 7 días.
La resistencia antibiótica y el fracaso del tratamiento, es un problema frecuente actualmente y significa uso de más de un esquema terapéutico y la existencia de terapias de segunda línea y tercera línea, al retratar y debiera en estos casos, basarse en estudios bacteriológicos10.
La triple terapia habitual con BBP, amoxicilina y claritromicina, tiene hoy niveles de éxito bajos. No hay cifras globales y se requiere de datos locales, que justifican a veces ignorar consensos o recomendaciones que aplican en otras latitudes. Se debe optar a cifras de erradicación superiores a 90%.
Se ha evaluado la efectividad relativa de regímenes de tratamiento de erradicación de 7, 10 y 14 días. Se investigó persistencia de Helicobacter pylori y efectos adversos de la terapia.
A mayor duración más erradicación. 14>10>7 (PCA=PPI+Cl+AMX) (PCN= PPI+cl+ Nitroimidazol).
Recomendar 14 días.
Los efectos adversos aumentan escasamente18.
DISPEPSIA11Los pacientes con dispepsia y sin signos de alarma, podrían mejorar con terapia antisecretora empírica, de erradicación de Helicobacter pylory, con la modalidad de “test and treat”, (T&T). También se tiene éxito en estos casos, con antidepresivos y probióticos. Esta estrategia sería conveniente, en poblaciones de alta incidencia de infección por Helicobacter pylori, lo que debe evaluarse en su costo eficacia y no sería recomendable en pacientes con síntomas de alarma o edad avanzada.
Pacientes con más de un mes de evolución, deben evaluarse buscando signos de alarma. Quienes los tengan deberán someterse a endoscopia digestiva alta (EDA), para descartar enfermedad ulcerosa o neoplasia.
En quienes no los tengan, es válido usar la estrategia de T&T, costo-efectiva en países de alta prevalencia.
Esta estrategia produce alivio permanente de los síntomas en 1/12 pacientes, lo que aún es mejor que otras terapias (Maastrich IV/Florence)14.
Los pacientes con dispepsia, pueden presentar dolor abdominal, meteorismo, sensación de plenitud, reflujo ácido y sensibilidad epigástrica al examen. Son necesarios una historia y examen clínico acuciosos12.
Puede utilizarse tests no invasivos, como los serológicos en pacientes nunca tratados, determinación en deposición o tests de aire expirado.
La dispepsia requiere de manejo basado en una buena relación médico-paciente, cambios en la dieta y estilo de vida, además de terapias médicas o psicoterapia y uso de psicotrópicos.
RELACIÓN CON USO DE ASPIRINA (AAS) O ANTI-INFLAMATORIOS NO ESTEROIDALES (AINEs)En usuarios de dosis bajas de AAS o AINEs la presencia de Helicobacter pylori, se asocia con riesgo aumentado de úlceras gastroduodenales, complicadas y no complicadas. Es conveniente erradicar Helicobacer pylori en estos pacientes y más aún en pacientes con antecedentes de enfermedad ulcerosa. Estos pacientes se beneficiarían del uso concomitante de BBP, en tratamiento crónico de AAS y AINEs.
CÁNCER GÁSTRICO13Se ha estudiado la influencia de la terapia de erradicación de Helicobacter pylori, en la reducción de incidencia de cáncer gástrico en individuos “sanos”, asintomáticos infectados, lo cual tiene gran interés, en la futura incidencia de cáncer gástrico.
Hay cierta evidencia de esta reducción en China, pero no aún en otras poblaciones.
Podría aumentar la clínica de reflujo, al mejorar la calidad de la mucosa productora de ácido, y lesiones en epitelio cardioesofágico y el riesgo de neoplasia asociada al Barrett.
El Consenso de Maastricht IV, menciona que el status de Helicobacter pylori, no tendría efecto en la severidad de los síntomas, recurrencia de síntomas o la eficacia del tratamiento. La erradicación de Helicobacter pylori no aumenta la enfermedad por RGE o influencia la eficacia del tratamiento.14.
Se necesitan estudios de seguimiento de poblaciones y erradicación de Helicobacter pylori versus controles en áreas de incidencia alta de cáncer gástrico y así diseñar las mejores estrategias.15,16.
Se requiere además seguimiento más prolongado, lo que haría quizás más evidente el beneficio. (Más de dos años).
Estudios en Japón y China y uno en Colombia (4-14 años de seguimiento), muestran un RR en conjunto de 0.66 (95 IC 0.46-0.90).
El uso crónico de BBP sin erradicar Hp, se asocia con gastritis corporal, lo que acelera el proceso de pérdida de glándulas especializadas, aumentando frecuencia de gastritis atrófica. La erradicación ayuda a revertir este proceso, sin asegurar que desaparezca el riesgo de cáncer gástrico. (“Punto de no retorno” involucrado).
No se ha demostrado sin embargo que la erradicación revierta la metaplasia intestinal17.
El cáncer gástrico sigue siendo la tercera causa de muerte en el mundo y debiera ser motivo de preocupación y esfuerzos por disminuir su incidencia, por erradicación de Helicobacter pylori, además de mejorar el diagnóstico precoz con la tecnología endoscópica actual, la cual permite además su resección endoscópica en estas etapas, no invasivas con excelentes resultados, donde existe gran experiencia, como en el Japón. Estos conceptos se expanden progresivamente en occidente.
La infección por Helicobacter pylori, se relaciona además, con gastritis crónica, gastritis crónica atrófica y metaplasia intestinal, principales precursores reconocidos del cáncer gástrico estableciendo una relación causal.
Designado carcinógeno Tipo I por la OMS
Además se relaciona con el linfoma MALT gástrico y el linfoma difuso. Erradicar Helicobacter pylori es el tratamiento de primera línea, en MALT gástrico de bajo grado.
Los infectados tuvieron entre 3 y 6 veces más riesgo de desarrollar cáncer gástrico que los no infectados.
LOS CONCEPTOS EN LATINO AMÉRICASe realizó un simposio sobre infección por Helicobacter pylori en Viña del Mar, en noviembre de 2012, con la participación de aproximadamente 400 gastroenterólogos. Se realizó previamente, un consenso con 10 expertos utilizando la técnica de Delphi con tres rondas, alcanzando en la tercera 100% de acuerdo2.
Se destacan entre las principales conclusiones- •
Detectar y erradicar Helicobacter pylori, en todos los pacientes sometidos a gastroscopia, para disminuir riesgo de enfermedad ulcerosa péptica, prevenir o retardar la progresión a cáncer gástrico o prevenir la recurrencia en tratados por cáncer gástrico.
- •
Se requiere más investigación para evaluar resultados de la erradicación de Helicobacter pylori para prevención primaria de cáncer gástrico, en poblaciones de alto riesgo.
- •
Se recomienda triple terapia estándar de 14 días (PAC), o terapia secuencial, como de primera línea.
- •
Evaluar la erradicación post tratamiento. Usando métodos no invasivos, como Test de urea en aire expirado o detección de antígeno en deposición (HpSA).
- •
Formular terapias de segunda o tercera línea, de acuerdo a tests de susceptibilidad antibiótica.
Los tests no invasivos, tienen niveles altos de sensibilidad y especificidad y pueden ser usados tanto en instancias de diagnóstico, como en evaluación de respuesta en erradicación. Útil en quienes se sospeche la infección, niños, dispépticos para implementar la estrategia de “test & treat”, ulcerosos pépticos con test de ureasa rápido o histología negativos, en sangrantes, etc.
En áreas de alta incidencia de cáncer gástrico, es preferible el estudio endoscópico y obtención de muestras para test de ureasa rápido e histología.
En sangrantes en el área Latinoamericana con recursos limitados, dada la incidencia, es más “costo efectivo” tratar en forma empírica. Debe tratarse al paciente una vez que inicia su realimentación oral.
Los test serológicos pueden servir en diagnóstico en niños y en detección de portadores asintomáticos, como por ejemplo en áreas de alto riesgo de cáncer gástrico. No debe usarse para evaluar erradicación
Debe evaluarse y tratarse la infección por Helicobacter pylori, en todos los sintomáticos sometidos a endoscopía.
Detectar y tratar la infección, disminuye el riesgo de enfermedad ulcerosa, sus complicaciones, mejora los síntomas de dispepsia funcional, y no pareciera modificar el curso clínico de la enfermedad por reflujo gastroesofágico, como se ha sugerido en el pasado. La terapia con IBP, necesaria para el manejo de ERGE, compensa cualquier aumento de secreción ácida al erradicar Helicobacter pylori en estos pacientes.
La erradicación de Helicobacter pylori sería una estrategia en prevención primaria del cáncer gástrico, especialmente en áreas de alta incidencia. Es difícil recomendar esta acción en toda la población. Hay además elementos clínicos a considerar en la efectividad de los antibióticos, resistencias, y aparición de patologías relacionadas, como la Infección por Clostridium difficile (ICD).
La estrategia “Test & treat”, podría ser efectiva en prevención de cáncer gástrico. La erradicación parece ser costo-efectiva y se diría que es más beneficioso en edades más precoces, evitando la aparición de condiciones histológicas pre-neoplásicas. (Gastritis atrófica y metaplasia intestinal).
La progresión a cáncer de estos estados histológicos pre-malignos tendería a detenerse, aunque los estudios disponibles arrojan resultados controversiales.
Es recomendable la erradicación antes que se produzcan cambios atróficos o metaplasia intestinal en la mucosa gástrica, evitando el “punto de no retorno”.19.
Se recomienda en prevención secundaria, tratar y erradicar a aquellos tratados de cáncer gástrico, ya sea endoscópica o quirúrgicamente. Familiares directos de estos pacientes debieran ser también erradicados.
Se han establecido, estrategias de seguimiento con estudios endoscópicos, en la prevención del cáncer gástrico de las lesiones histológicas pre-malignas, como la gastritis crónica atrófica, la metaplasia intestinal y la displasia.
Control, cada 2-3 años, para aquellos con Gastritis crónica atrófica moderada a severa o metaplasia intestinal, anual para aquellos con displasia de bajo grado y cada 3-6 meses, para aquellos con displasia de alto grado, sin una lesión focal a la endoscopía. (Protocolo de Sydney, con uso de datos para OLGA u OLGIM).
¿Cómo tratar y erradicar Helicobacter pylori en Latino América?Se recomienda triple terapia estándar (BBP+Cl+ Amx) por 14 días con dosis altas de BBP, obteniendo la máxima tasa de erradicación.
Debe considerarse datos de resistencia antibiótica del germen en diferentes escenarios, para recomendar alternativas, (uso de metronidazol, furoxona, tetraciclinas o quinolonas p.ej).
La triple terapia estándar 14 días, ha sido similar a terapia secuencial empírica en Latino América, siendo esta última mejor en áreas de alta prevalencia de cepas resistentes a claritromicina.
Se recomienda el uso de quinolonas, como una buena alternativa de segunda línea, especialmente si no se dispone de formulaciones de bismuto fácilmente, o hay buena sensibilidad a quinolonas y/o resistencia a claritromicina (BBP, quinolona, amoxicilina).
Debe estudiarse en Latino América, la alternativa sugerida de cuádruple terapia concomitante, sin bismuto, conteniendo BBP, claritromicina, amoxicilina, metronidazol.
El estudiar sensibilidad antibiótica en determinada área es recomendable, puede mejorar los resultados, especialmente en lugares con altos niveles de resistencia. Esta estrategia, debiera seguirse antes de usar una terapia de segunda línea en caso de fracaso de erradicación.
Los niveles de resistencia en América Latina han sido descritos como de, 12% a claritromicina, 53% a metronidazol, 4% a amoxicilina, 15% para fluorquinolonas y 8% para la combinación claritromicina/metronidazol.
La obtención de cultivos estándar con resultados satisfactorios, no es fácil de lograr en el área Latino Americana. Estudios basados en PCR bacteriana, podrían facilitar los tests de susceptibilidad antibiótica, una vez que éstos, se encuentren disponibles, fácilmente.
Esta estrategia podría ser obligatoria, después de dos fallas de terapia.
Se considera conveniente el confirmar la erradicación, en todos los pacientes, especialmente en ulcerosos pépticos, (menos riesgo de complicaciones, incluyendo a los sangrantes), cáncer gástrico, o linfoma MALT.
En América Latina es mayor la recurrencia por reinfección, que en países desarrollados. Hay cifras variables hasta 17-18% al año, de acuerdo a la región. En Chile se estima en alrededor del 1,5 a 3%.
Estos datos obtenidos del Consenso Latinoamericano de Rollan et al, entrega datos más próximos a nuestra realidad Latino Americana, con énfasis en factores locales más aplicables a nuestra realidad, que aquellos ensayos realizados en poblaciones ya del primer mundo o de realidades muy diferentes como por ejemplo, Asia o África. Diferentes en cierto modo del Consenso Maastricht IV/Florencia. (2012).14
EL FUTUROExiste además una esperanza de contar con una vacuna que elimine la infección por Helicobacter pylori.
Con lo que seguramente, la historia que hemos contado, será completamente diferente.
Como anécdota, el autor recibió hace dos años a un paciente australiano, que viviría temporalmente en Chile, (casado con chilena), quien era controlado por el Prof. Marshall y que había recibido tres curas para su Helicobacter pylori, sin éxito, con la idea de usar nuestro esquema en estos casos. Hice terapia cuádruple con bismuto por 14 días y el paciente erradicó la bacteria.
El autor declara no tener conflictos de interés, en relación a este artículo.
Las imágenes han sido autorizadas para su publicación.