Los cambios fisiológicos con la edad, son consecuencia de cambios sistémicos generales producidos por el envejecimiento, entre los que se destacan cambios a nivel de los mecanismos de defensa relacionados con las especies reactivas del oxígeno (ROS) y alteraciones de la microcirculación. Los cambios evolutivos ováricos con la edad, se deben esencialmente a una depleción de la población folicular, la cual al disminuir por debajo de 1000 folículos, hace perder la capacidad del ovario de ciclar en forma normal, con la consiguiente disminución en los niveles de esteroides circulantes y sus efectos secundarios en los órganos efectores. Asociado a la disminución de la población folicular, se producen cambios en la calidad ovocitaria, los cuales determinan la disminución progresiva de la fertilidad en mujeres mayores de 35 años. Entre los cambios más frecuentes se observan aumento de aneuploidias, disfunciones mitocondriales, cambios de la microcirculación y disminución de la capacidad defensiva sobre las ROS, entre otros.
The physiological changes with age are the consequence of systemic general changes produced by aging, where changes of the defense mechanisms related to ROS and microcirculation alterations are highlighted. The evolutive changes produced by age in the ovary are related to the follicular depletion. When the ovarian follicle population decrease below 1000 follicles, the ovary loses its capacity to cycle normally. As a consequence, the levels of circulating steroids diminished, producing negatives effects on secondary steroidal organs. In association with the follicular depletion, there are changes in oocyte quality, which determine the progressive diminution of fertility in women older than 35 years. The most frequent changes observed are an increase of the aneuploidies, mitochondrial dysfunction, microcirculation changes and a diminution of the defense capacity to ROS among others.
En la especie humana, así como en la mayoría de las hembras de mamíferos, la formación del gameto femenino comienza en la etapa embrio-fetal, quedando determinado en esta etapa el número definitivo de células germinales de la mujer. En la pubertad, al hacerse el ovario sensible a las gonadotrofinas hipofisarias, se establece un proceso cíclico de producción de gametos, el cual perdura hasta el final de la etapa reproductiva de la mujer, es decir, la menopausia, donde se observa una depleción de folículos primordiales (células germinales) en ambos ovarios.
Durante la etapa fértil de la mujer, el ovario en respuesta a la secreción cíclica de gonadotropinas (LH y FSH), genera y libera de manera periódica ovocitos (gametos) aptos para ser fecundados (función citogénica) y secreta hormonas esteroidales, peptídicas y factores de crecimiento (función endocrina).
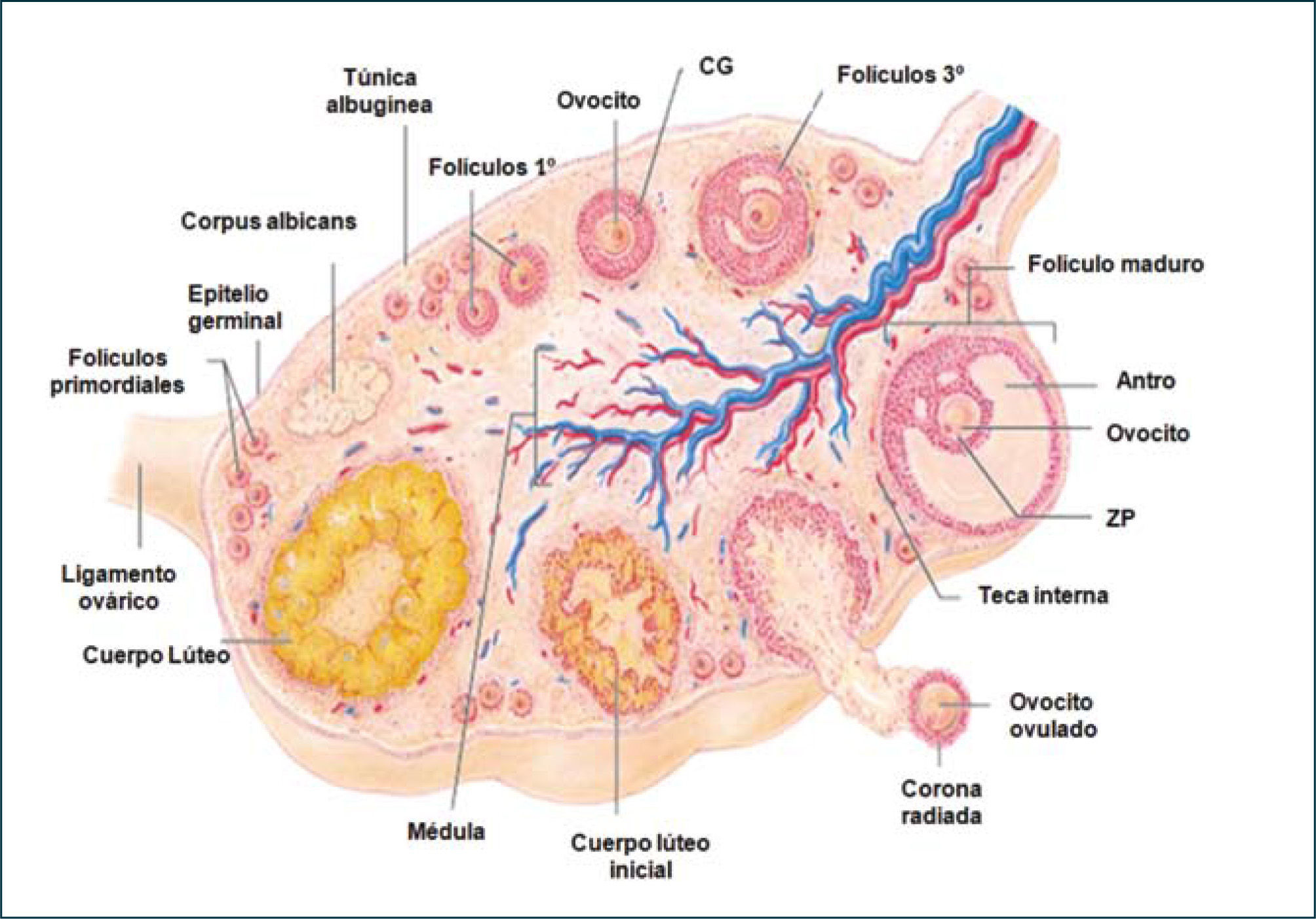
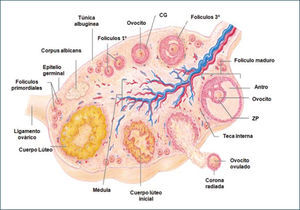
Los folículos que contienen los ovocitos están distribuidos en todo el ovario, de preferencia en la región subcortical. En la etapa postpuberal sólo unos pocos de estos folículos logran ovular o liberar al ovocito, mientras la mayoría restante degenera y se transforma en folículos atrésicos. La estructura folicular que permanece en el ovario después de la ovulación es el cuerpo lúteo, el cual involuciona en los ciclos no concepcionales (1) (Figura 1).
La obtención normal del gameto femenino depende del desarrollo normal del folículo al cual pertenece. En efecto, se ha reportado que las interacciones entre las células somáticas (foliculares) y las germinales (ovocito), comienzan en las primeras etapas del desarrollo embrionario. Los ovocitos que no se asocian con células somáticas para formar folículos primordiales, degeneran y mueren por apoptosis (muerte celular programada). De modo tal que en el ovario la interacción entre los distintos tipos celulares es fundamental para la generación de gametos en la mujer, todo lo cual ocurre de manera coordinada desde la etapa embrio-fetal hasta la menopausia. Después del nacimiento, durante el período reproductivo, esta interacción se hace particularmente activa obteniéndose un desarrollo folicular cíclico, lo que da origen a las funciones gametogénica y endocrina del ovario. La función ovárica es regulada por el hipotálamo y la hipósifis a través de la liberación de gonadotrofinas como también por fenómenos ováricos autocrinos y paracrinos.
Esta revisión tiene como objetivo describir los eventos que ocurren en el eje hipotálamo-hipófisis-gónada, como también los cambios que sufre el ovario y particularmente el ovocito durante el envejecimiento femenino.
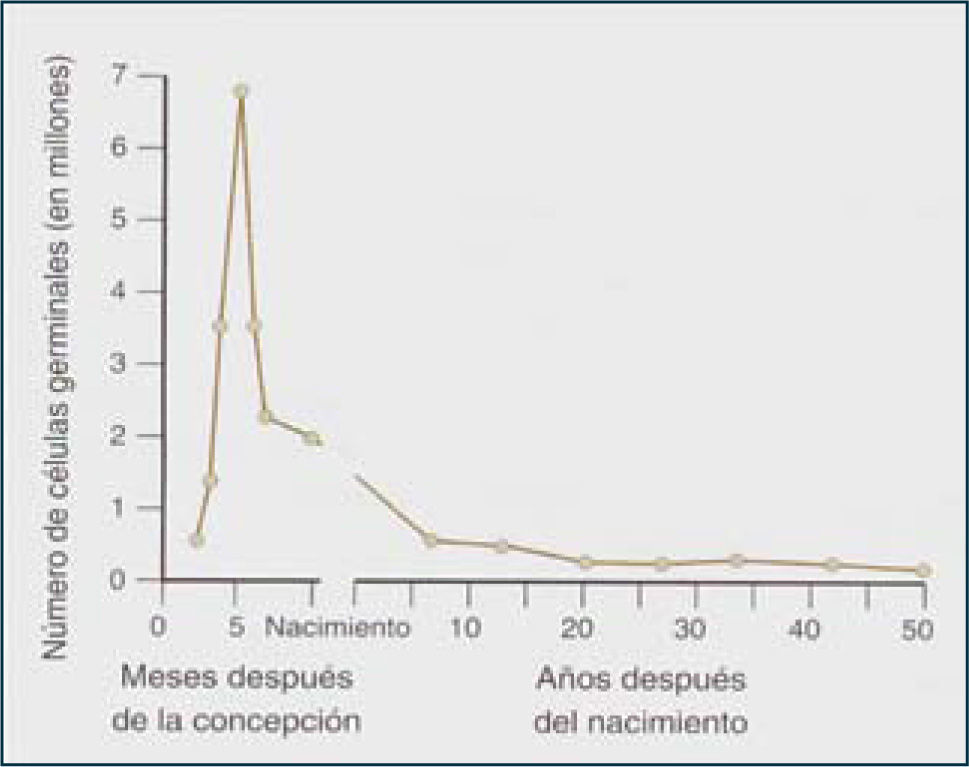
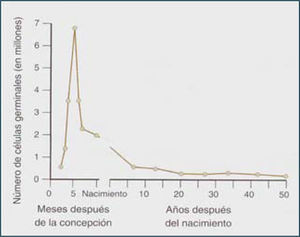
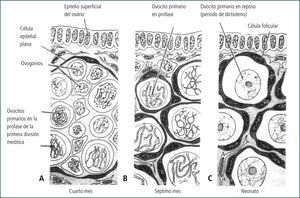
Etapa embrionaria del desarrollo ováricoDurante la etapa embrionaria, las células germinales comienzan su desarrollo a la 5a a 6a semana de gestación. Cien a doscientas células germinales primordiales (CGP) colonizan la gónada embrionaria. Luego, a través de mitosis el número de CGP aumenta y se diferencian a ovogonias, proceso que ocurre gradualmente en el ovario fetal. Las ovogonias (células diploides 2n, 2c) corresponden a las células germinales que darán origen a los gametos femeninos durante la etapa reproductiva de la mujer, las cuales se multiplican por mitosis alcanzando un número de alrededor de 7 millones en el ovario fetal a las 20 semanas de gestación (Figura 2).
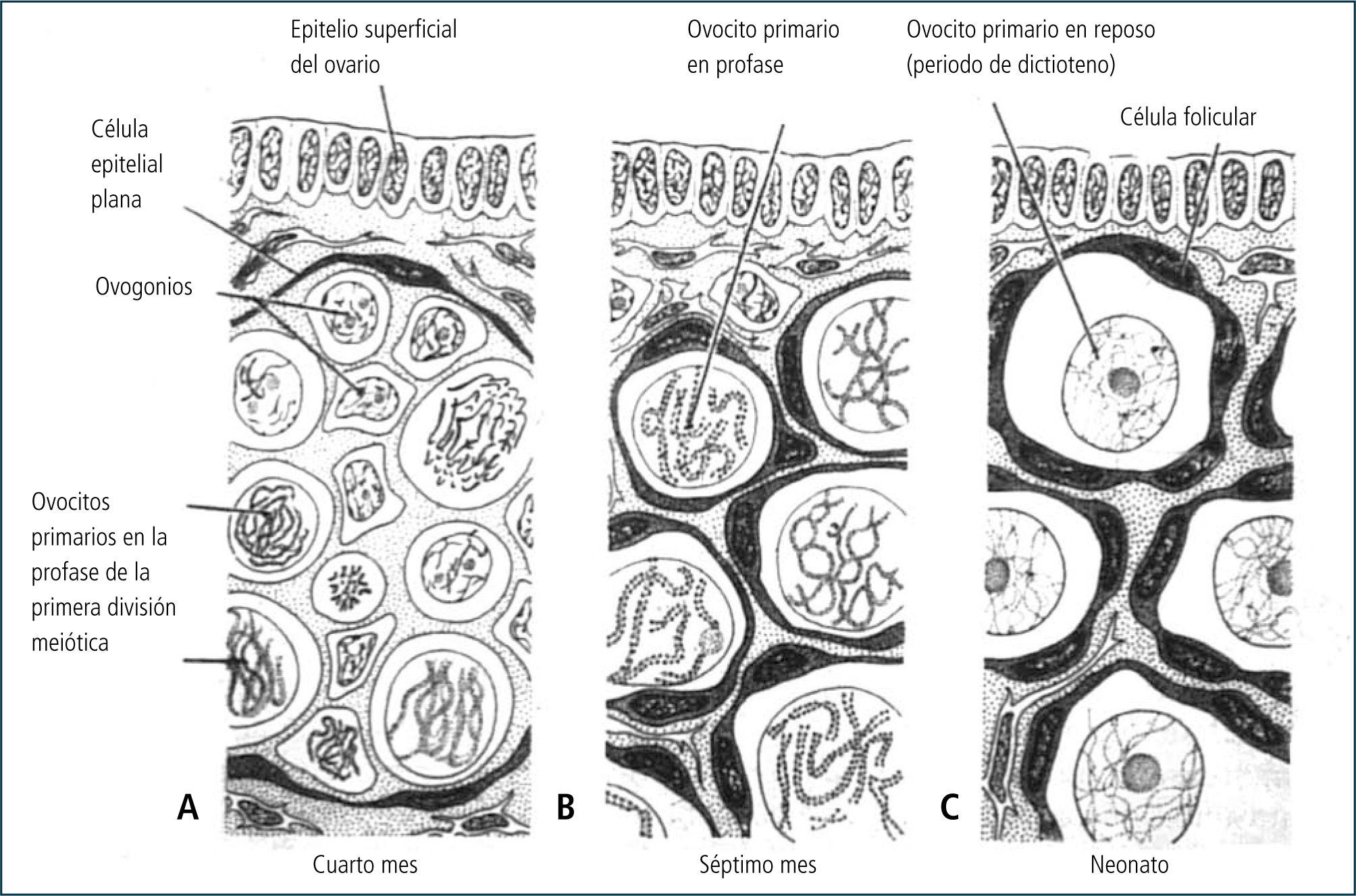
En su calidad de célula germinal, las ovogonias tienen la capacidad de experimentar meiosis, y es así que alrededor de la octava a la décimo tercera semana de gestación, las ovogonias de manera paulatina ingresan a meiosis, específicamente a la primera profase meiótica, y se transforman en ovocitos I. La primera meiosis se detiene al estado de dictioteno hacia finales de la profase I, no progresando hacia la metafase I. El núcleo del ovocito en este estado se denomina vesícula germinativa debido a sus características morfológicas.
Éste primer reposo meiótico en la especie humana puede llegar a tener una duración mayor de 45 años. Si bien es cierto durante este período está detenida la actividad meiótica del ovocito I, la actividad transcripcional y en menor grado, la traduccional, se encuentran activas, lo que le permite la sobrevivencia a la célula germinal (2, 3).
Durante este período y de manera coincidente con la generación de ovocitos I en profase I, células somáticas del estroma ovárico rodean a cada célula germinal (ovocito I) y se comienzan a formar los folículos primordiales.
Las células somáticas corresponden a las células pre-granulosas, las cuales secretan una matriz extracelular que constituye la lámina basal que rodea al folículo primordial. La formación de los folículos primordiales, es decir, la interacción entre las células somáticas y el ovocito, es posible dado que las células de pre-granulosa expresan en su superficie una proteína que es el Stem Cell Factor (SCF) y que constituye el ligando para una proteína receptora específica localizada en la membrana plasmática del ovocito (3). Este reconocimiento molecular específico permite que la formación de los folículos primordiales sea adecuada, si esta interacción no ocurre, no se forman folículos primordiales y el ovocito muere por apoptosis, así como, lo hacen las células somáticas (Figura 3).
Hacia finales de la gestación, todos los ovocitos I presentes en el ovario fetal, están detenidos en profase I de la meiosis (primer reposo meiótico) y formando parte del folículo primordial. Al momento del nacimiento, la población de folículos primordiales presentes en ambos ovarios es alrededor de 2 millones los que constituyen el potencial reproductivo de la mujer.
El eje hipotálamo-hipófisis-ovario es activo en el feto. Las neuronas productoras de GnRH se encuentran en el bulbo olfatorio a la sexta semana de la concepción, llegan al hipotálamo en la semana número 9. La hipófisis comienza a secretar gonadotropinas, LH y FSH, a la circulación fetal en la semana 12 (6), llegando a un máximo a las 20–24 semanas de gestación. En la última parte de la gestación, la producción de estrógenos placentarios produce una retroalimentación negativa al eje hipotálamo-hipofisiario causando una disminución en los niveles de FSH y LH (4). Luego del nacimiento, los niveles de gonadotrofinas son bajos y comienzan a aumentar luego de la desaparición de los estrógenos placentarios, su actividad continuará hasta 6 meses post parto en el varón y entre 12 a 24 meses en las niñas. El ovario permanece inactivo hasta el comienzo de la etapa puberal.
Etapa puberalLa iniciación de la pubertad se establece con la pulsatilidad de GnRH (5). Un año antes de la aparición del botón mamario, niñas prepuberales experimentan aumentos en los niveles de LH exclusivamente durante el sueño. Cuando el botón mamario se hace detectable, la amplitud del pico de LH aumenta 10 veces y la amplitud del pulso de FSH se duplica. En este momento se produce un efecto de inducción de GnRH sobre la liberación de LH por el gonadotropo y un aumento en el número de receptores de GnRH en el tejido hipofisiario, la frecuencia de pulsos aumentan en una menor extensión y los pulsos se hacen diurnos y el aumento de estradiol se hace más prolongado. (6).
Fue establecido por Tanner que el inicio de la pubertad, utilizando como indicador la aparición del botón mamario, es a los 10.7 años promedio con una desviación estándar de 1 año (7). La progresión del desarrollo mamario de Tanner 2 a Tanner 3 es marcada por un aumento de la amplitud de los pulsos de LH 20–40 veces de los niveles detectados en las niñas prepuberales. A pesar de que la mayor amplitud de los pulsos es durante el sueño, los niveles de estradiol se hacen detectables a toda hora. Al avanzar al estadio Tanner 4, el patrón de gonadotrofinas no cambia, pero aumentan los niveles de estradiol (8).
El desarrollo del vello axilar y pubiano (adrenarquia) se origina en el estadio Tanner 3 el cual precede a la menarquia, se asocia a la secreción de andrógenos por la zona reticularis de la glándula suprarrenal en donde la DHEA-S es el cetoesteroide predominantemente producido. El promedio de aparición de la menarquia es 12,7 años con una desviación estándar de 1,3 años y ocurre cerca del final del estadio Tanner 4 luego de un año de aumento de estradiol (9). En este momento, niveles elevados de estradiol pueden ejercer una retroalimentación negativa sobre el eje hipotálamo-hipófisis-gónada. En la menarquia, la retroalimentación positiva de estradiol en el eje no ha sido establecida aún por lo que la ovulación es infrecuente. El sangramiento uterino ocurre con la variación de la ciclicidad hasta que el mecanismo de inducción del alza de LH es inducida por el pico de estrógenos y se produce la ovulación.
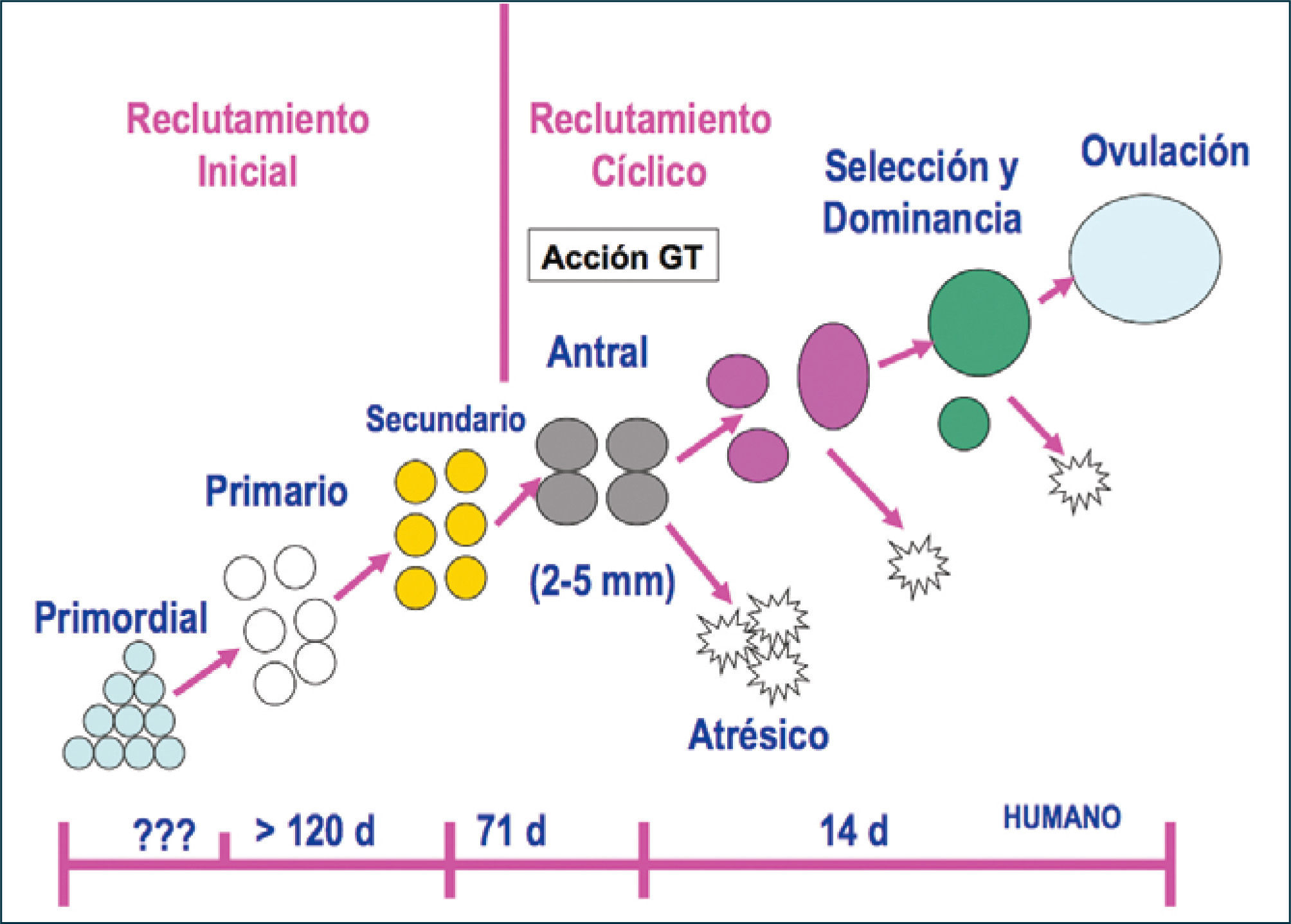
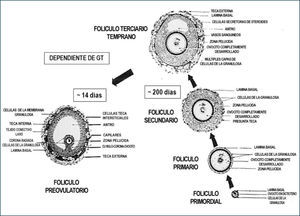
Foliculogénesis y mecanismo de control de la ovulaciónEsta etapa se caracteriza por la generación cíclica de gametos aptos para ser fecundados y la producción de hormonas por parte de las células foliculares, fundamentalmente esteroides. Es necesario que en esta etapa ocurra la foliculogénesis, proceso de crecimiento que experimenta un folículo desde el momento que deja la población de reserva, constituida por folículos primordiales, hasta su ovulación o atresia (10).
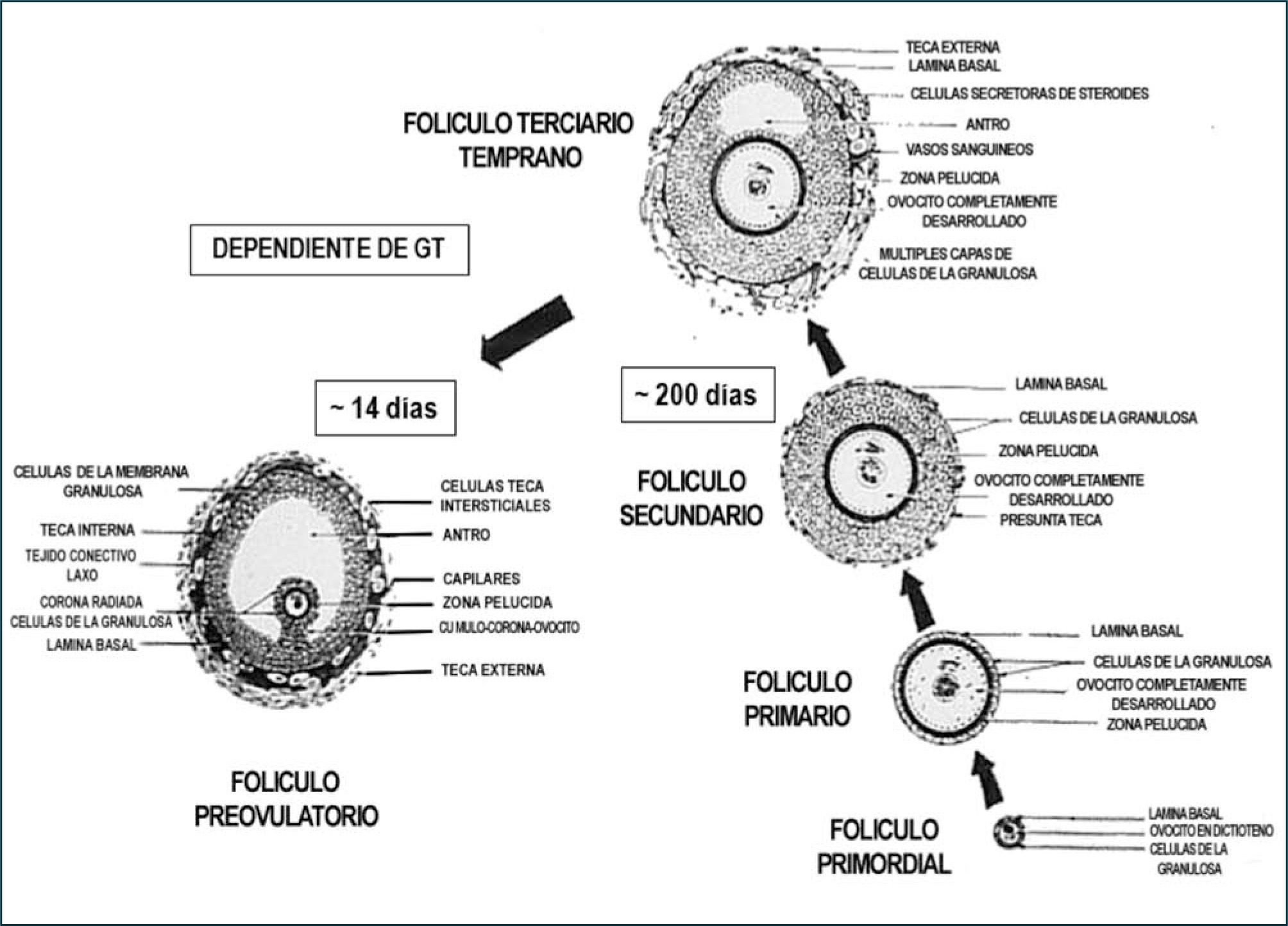
Los folículos ováricos pueden existir en distintos estados de desarrollo. A medida que el folículo se modifica morfológicamente, existen cambios bioquímicos que reflejan el proceso de diferenciación celular. Un factor importante en esta cito-diferenciación es la expresión de receptores que le permiten a las células foliculares responder a distintos estímulos, promoviendo en ellas la síntesis de hormonas peptídicas, esteroidales (progestinas, andrógenos, estrógenos) y de factores de crecimiento. En un ovario postpuberal, los folículos pueden estar en estado de folículos primordiales, primarios, secundarios, terciarios, ovulatorios y atrésicos (Figura 4).
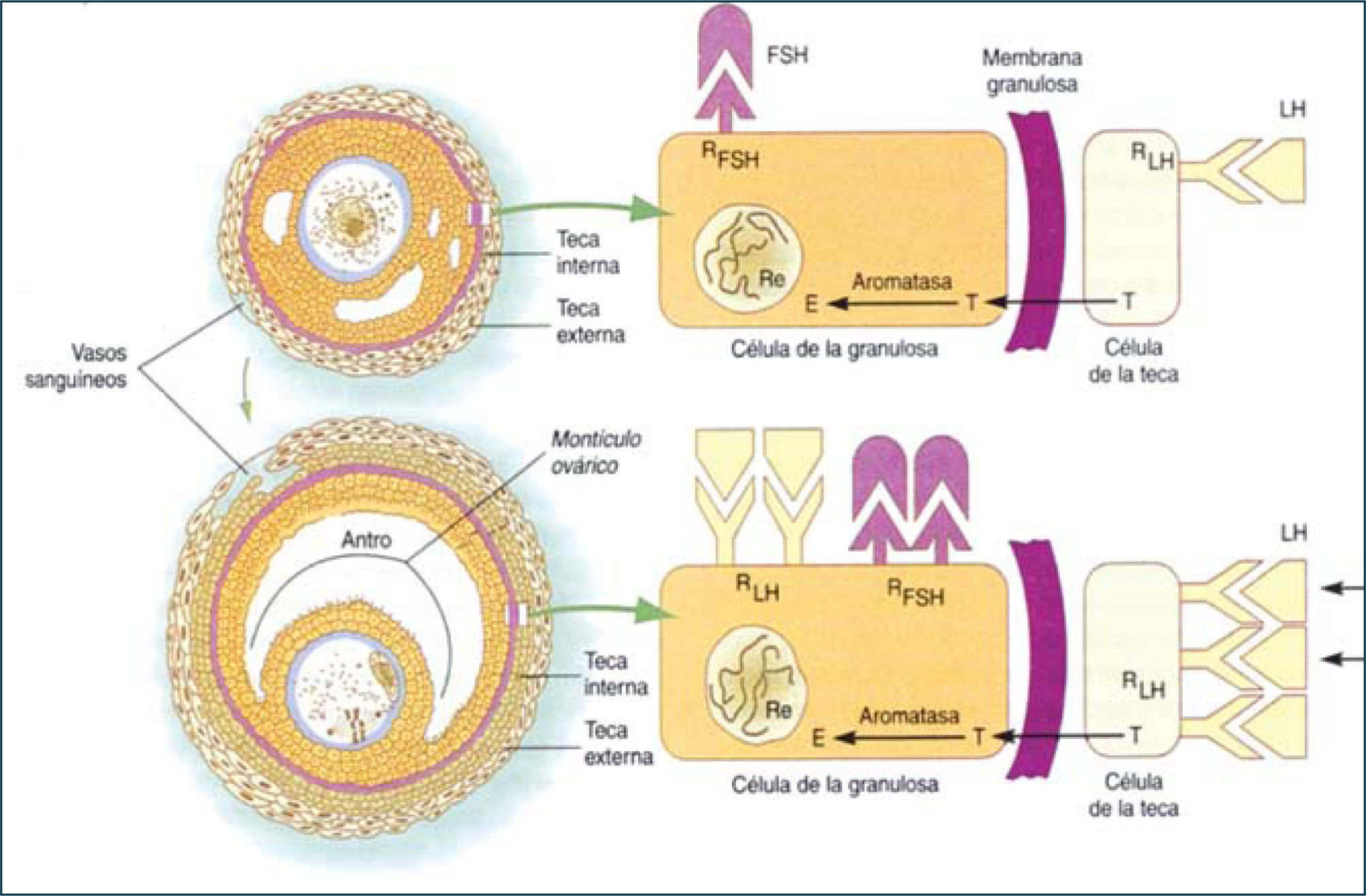
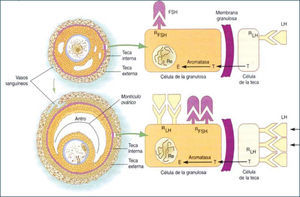
El crecimiento y desarrollo de los folículos a partir de los folículos primarios hasta folículo maduro involucra proliferación de las células de la granulosa (CG) y el crecimiento del ovocito I, con el consiguiente aumento del diámetro folicular. La etapa de crecimiento del ovocito ocurre fundamentalmente hasta la etapa de folículo primario tardío o folículo secundario inicial, aumentando el diámetro de 30μm a 120μm. Durante este periodo se forma la zona pelúcida, material glicoproteico de origen ovocitario, que rodea completamente al ovocito. Además, el número de mitocondrias y ribosomas, así como, de los organelos del ovocito aumentan considerablemente en la etapa de crecimiento, dando cuenta del tamaño de la célula germinal. También, en esta etapa se inicia la expresión de receptores para FSH en las células de la granulosa, alrededor de 1.500 receptores por CG en el folículo secundario, los cuales no están aún activos para regular la síntesis de estradiol. El número de receptores para FSH permanece constante durante el resto del proceso de foliculogénesis. En la etapa de folículo secundario comienzan a expresarse los receptores para estradiol en las CG y el desarrollo de un aporte sanguíneo adecuado, a través del cual llegan al folículo en desarrollo las gonadotrofinas hipofisiarias, factores de crecimiento, iones y otros metabolitos.
Al final del estado secundario, ocurre una migración de células mesenquimáticas desde el estroma ovárico dando origen a las células de la teca interna (TI) como externa (TE), iniciándose la formación de folículo terciario. Coincidente con la adquisición de las células tecales, el folículo terciario inicia la formación del antro, el cual comienza con la acumulación de fluido folicular entre las CG. El fluido folicular está formado por productos de secreción de las CG y transudado de los capilares sanguíneos que irrigan a las células tecales. También, en este estado de desarrollo se inicia la formación de uniones comunicantes o gap en las células tecales, CG entre sí y CG de la corona (CG más cercana al ovocito) con el ovocito, lo cual implica que las CG y el ovocito están eléctrica y metabólicamente acoplados desde esta etapa del desarrollo, permitiendo una sincronización funcional en respuesta a la estimulación por diversos factores (2, 11). Es en esta etapa del desarrollo que los folículos adquieren una gran capacidad para sintetizar andrógenos, específicamente a nivel de las células de la TI, bajo el estímulo de LH. Esto es posible ya que en esta etapa de la foliculogénesis se expresan receptores para LH en dichas células. Por otro lado, el folículo se hace sensible a la acción de la FSH, cuyos receptores se expresan en las CG y su transducción de señal está acoplada a la proteína Gs (estimulatoria) con el consiguiente aumento de los niveles del segundo mensajero AMP cíclico. Esto trae consigo la activación de la proteína quinasa A (PKA), la cual fosforila secuencialmente diversos sustratos, activando procesos celulares, lo que también ocurre en las células tecales por la acción de LH. En el caso de las CG uno de los sustratos es la enzima citocromo P450 aromatasa, encargada de transformar andrógenos en estrógenos, y frente al aporte creciente de andrógenos a la CG, la aromatasa aumenta su actividad inducida por FSH, así como, su expresión, incrementando gradualmente la producción de 17β-estradiol, lo que se refleja a nivel periférico. En las células de la TI, el aumento de los niveles de AMP cíclico, induce la expresión y la actividad de diversas enzimas de la vía esteroidogénica (Figuras 4–5).
La coordinación funcional entre células de la TI y CG permite la producción exitosa de estradiol, además, del crecimiento folicular. La adquisición de los receptores de estradiol es un proceso biológico importante en el desarrollo del folículo ya que le permite a éste responder de manera específica a la acción del estrógeno. Aún más, estradiol tiene un rol permisivo de la acción de FSH, facilitando la formación de AMP cíclico, lo cual es particularmente importante ya que aumenta la sensibilidad de las CG a la concentración relativamente disminuida de FSH presente en el fluido folicular en esta etapa del desarrollo folicular. Por lo tanto, los folículos que responden a las gonadotropinas y mantienen su crecimiento, aumentan de tamaño y se transforman en folículo preovulatorio (25mm de diámetro). Este crecimiento se debe a la acumulación de fluido folicular en el antro y principalmente a la proliferación de las CG. En consecuencia, el desarrollo folicular depende de los efectos tróficos de las gonadotropinas desde la formación de folículos terciarios, generándose una cohorte de folículos en crecimiento de los cuales se seleccionará el folículo dominante. En esta etapa de desarrollo, las CG que ya han expresado receptores para FSH y estradiol, desarrollan además, receptores para LH, inducidos por FSH y estradiol. A diferencia de lo descrito para los receptores de FSH, la concentración de los receptores de LH cambia durante la diferenciación de las CG. De esta manera, las CG de folículos antrales pequeños y medianos no expresan prácticamente receptores para LH; sin embargo, esta situación se revierte al finalizar el crecimiento folicular, observándose aproximadamente 20.000 receptores para LH por CG en un folículo dominante, inmediatamente antes del alza preovulatoria de la concentración plasmática de LH. En este momento, la estructura madura contempla capas de CG que rodean al ovocito denominadas células del cúmulo y a la capa de CG más cercana al ovocito, corona radiada, constituyendo en su conjunto el cúmulo oóforo.
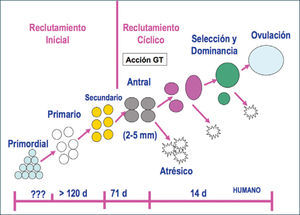
La duración total del proceso de folículogénesis se ha estimado entre 200 a 214 días, lo que significa que el desarrollo de la cohorte de folículos primordiales se inicia 7 a 8 ciclos antes de ser ovulado. En la actualidad se considera que existe un reclutamiento inicial de folículos primordiales independiente de la acción de gonadotropinas y dependiente de factores de crecimiento intraováricos y un reclutamiento cíclico dependiente de gonadotropinas, especialmente de FSH y que involucra a la cohorte de folículos preantrales tardíos o antrales recientes (10). En este caso, se recluta un número determinado de folículos en crecimiento presentes en el ovario durante la fase lútea tardía o folicular temprana, teniendo cada uno de los folículos un ritmo de crecimiento propio. El rescate folicular ocurre cuando algunos folículos de la cohorte están levemente más avanzados en su desarrollo que sus vecinos y se ponen en contacto con concentraciones elevadas de FSH, la cual induce la actividad aromatásica y, por consiguiente, el crecimiento folicular. El folículo con el mayor número de CG es el que responde primero a los niveles plasmáticos crecientes de FSH, es convertido a folículo antral y concentra más FSH en el fluido folicular, favoreciendo la proliferación celular. Por otro lado, aquellos folículos que emergen antes del aumento de FSH en el plasma, permanecen androgénicos y se vuelven atrésicos (Figura 6).
Luego de la etapa de reclutamiento cíclico, ocurre la selección y dominancia folicular, en la cual debido a mecanismos autocrinos y paracrinos intraováricos, se selecciona aquellos folículos que continuarán en desarrollo hasta que sólo uno de ellos sea capaz de completar su maduración.
En los últimos años se ha establecido que la velocidad de crecimiento de los folículos depende de factores secretados por ellos mismos. Uno de estos factores corresponde a la hormona antimulleriana (AMH), la cual se secreta abundantemente por las CG de los folículos pequeños y regula negativamente el crecimiento de los otros folículos de la cohorte. La medición de los niveles de AMH constituye una excelente herramienta para determinar la población de folículos de reserva en el ovario, independiente de gonadotrofinas y, por lo tanto, dando cuenta de la reserva folicular en cualquier momento de la vida de la mujer.
Formación del gameto femenino u ovogénesisEl gameto femenino debe experimentar una serie de cambios morfológicos y funcionales para transformarse en un ovocito fecundable. Por lo tanto, en la etapa pospuberal, el ovocito debe primero crecer y luego, reiniciar meiosis.
Durante la fase de crecimiento, el ovocito incrementa su tamaño de 35μm a 120μm y su volumen en 50 veces aproximadamente. De modo tal, existe una actividad transcripcional intensa con acumulación de RNA y aumento en el número de ribosomas (1000 veces más que en una célula somática). Esto lleva a la acumulación de gran cantidad de RNA mensajero. Es importante hacer notar que la actividad traduccional es menor que la transcripcional en los ovocitos. Además, hay que recordar que en el estado de dictioteno que presenta el ovocito, el núcleo se encuentra quiescente desde el punto de vista meiótico (primer reposo meiótico), pero su actividad transcripcional sigue vigente. En efecto, tanto el núcleo (vesícula germinativa) como el nucleolo de los ovocitos en crecimiento aumentan su tamaño, lo cual indica un periodo de gran actividad de síntesis de RNA ribosomal, reflejando una gran funcionalidad del núcleo del ovocito. La mayoría de los RNA mensajeros son sintetizados en etapas precisas y determinadas de la fase de crecimiento; un porcentaje importante de ellos se almacena en el citoplasma ovocitario para ser traducidos posteriormente, particularmente después de la fecundación, en los primeros estadios del desarrollo embrionario. El ovocito completa su crecimiento muy temprano en el desarrollo folicular, cuando el diámetro del folículo es de 400μm, lo que es un reflejo de la gran actividad metabólica de la célula germinal.
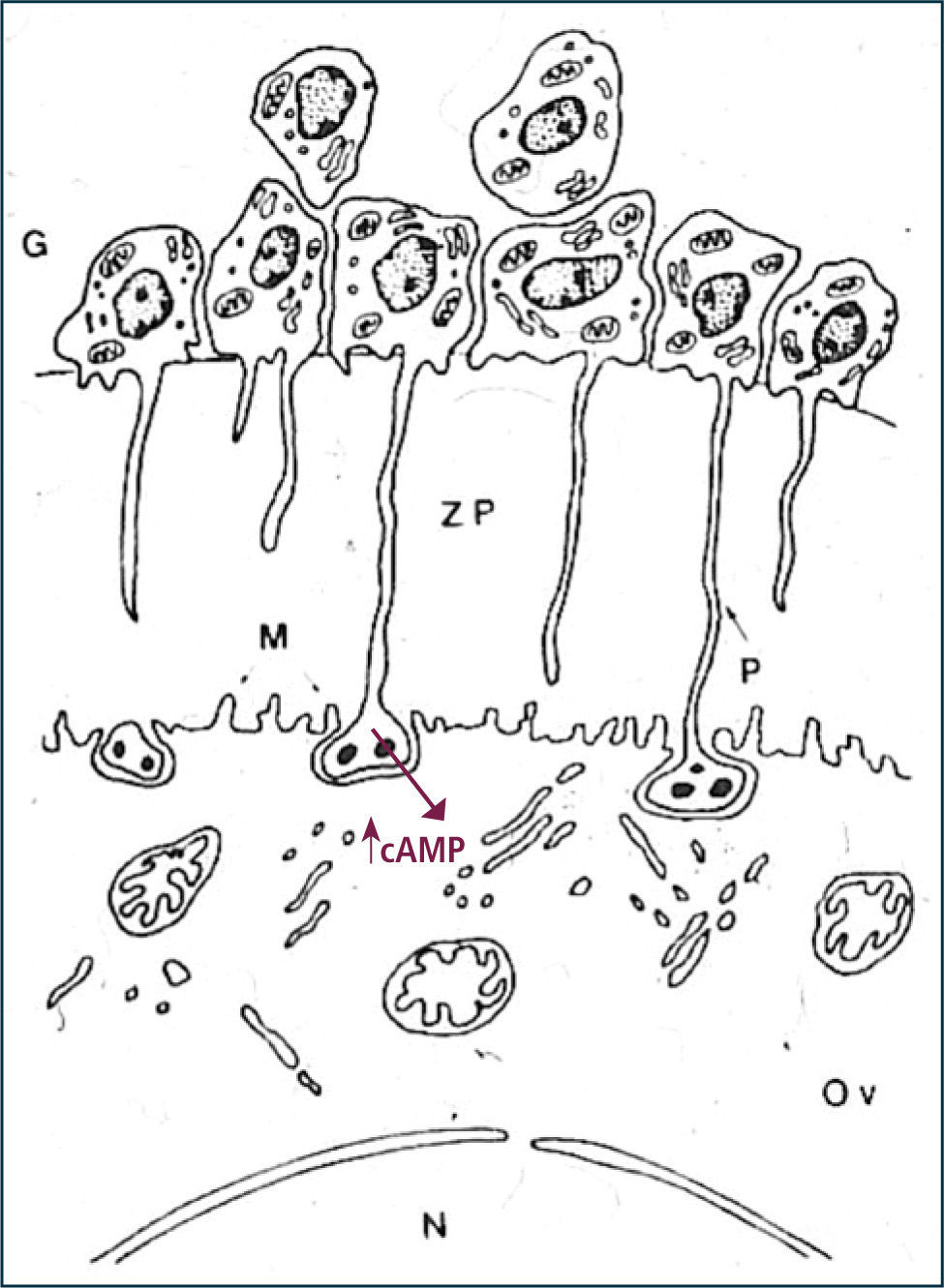
Durante esta etapa de crecimiento, se observan grandes cambios ultraestructurales en el ovocito, incluyendo la aparición de nuevas estructuras, como los gránulos corticales y las glicoproteínas de la zona pelúcida, ambos implicados en el proceso de fecundación. Las proteínas de la zona pelúcida representan un ejemplo de la traducción del mensaje durante la fase de crecimiento del ovocito. También, se observan cambios en las mitocondrias, así mismo, el número de vesículas que se asocian al complejo de Golgi aumenta considerablemente. Los gránulos corticales son pequeños organelos esféricos (300–500nm de diámetro) que contienen enzimas proteolíticas y que comienzan su desarrollo en el folículo secundario temprano. Se ubican cerca de la membrana del ovocito (región cortical), y se fusionan con ella durante la fecundación, liberando su contenido enzimático al especio perivitelino y alterando las propiedades funcionales de las glicoproteínas de la zona pelúcida, lo que se traduce en un bloqueo a la poliespermia. Por otro lado, la zona pelúcida es una capa acelular que rodea completamente al ovocito, se forma durante la fase de crecimiento y es de origen ovocitario. Esta capa está constituida por tres tipos de glicoproteínas (ZP1, ZP2, ZP3) que forman largos filamentos que se entrecruzan y que separan al ovocito de las células foliculares. No obstante, existe contacto entre el ovocito y las células de la corona radiada a través de las prolongaciones citoplasmáticas que estas células emiten y que atraviesan la zona pelúcida y establecen comunicación con la membrana del ovocito a través de uniones comunicantes o gap. Este tipo de interacción reviste una importancia crucial para la reactivación de la meiosis y formación del gameto maduro con capacidad de ser fecundado (Figura 7).
De manera que al completar su crecimiento, el ovocito adquiere la capacidad para reiniciar la meiosis, la cual se completa 4–5 horas antes de la ovulación y después de la descarga masiva de LH. En efecto, poco antes de la ovulación el ovocito adquiere los mecanismos citoplasmáticos requeridos para que la penetración del espermatozoide, decondensación de la cromatina y el bloqueo de la poliespermia, ocurran adecuadamente. Previo a la reactivación de la meiosis propiamente tal, ocurren cambios metabólicos que conducen a la adquisición de la competencia meiótica, la que se caracteriza por la expresión secuencial de transcritos maternos durante la primera profase meiótica. En la mujer, dicha competencia meiótica se logra hacia finales del periodo de desarrollo folicular. Existen una serie de eventos que deben ocurrir en el ovocito antes de completarse la meiosis y uno de los procesos más desconocidos es el desensamblaje de los centríolos durante el periodo de crecimiento.
Como consecuencia de la descarga masiva de LH (24 horas previas a la ovulación), ocurren una serie de cambios en las células foliculares y también en el ovocito. Como ya se mencionó, 4–5 horas antes de la ovulación se reactiva la meiosis y uno de los eventos que primeramente se observa es la migración de la vesícula germinativa desde una posición central o subcentral en el citoplasma, hacia la región cortical del ovocito hasta lograr una localización muy cercana a la membrana plasmática. La migración constituye el primer signo morfológico de maduración ovocitaria. Luego, ocurre la ruptura de la vesícula germinativa, recondensación de los cromosomas y la progresión del proceso meiótico hasta metafase I y luego a metafase II sin la ocurrencia de profase II, trayendo consigo la expulsión del primer corpúsculo polar o polocito I. En el ovocito se observa la separación de los cromosomas homólogos junto con la división asimétrica del citoplasma. El citoplasma del polocito I contiene una cantidad disminuida de organelos y los cromosomas empiezan a degenerar en la telofase I tardía. El ovocito II y polocito I son células haploides que contienen la mitad del complemento cromosómico original. La segunda división meiótica es breve y se detiene al estado de metafase II (segundo reposo meiótico). En la mujer, el ovocito es ovulado en este estado y la segunda división meiótica se completará sólo si el ovocito II es fecundado. En ese momento, se produce la expulsión del segundo polocito y el ovocito se transforma en un cigoto o huevo fecundado.
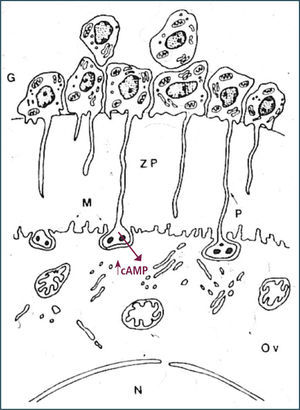
Como consecuencia de la descarga masiva de LH, se observa un desacoplamiento de las uniones comunicantes que forman al folículo lo que se refleja en una expansión del cúmulo, es decir, las células foliculares entre sí y las de la corona con el ovocito se separan (12). Una de la razones de la interrupción de las uniones comunicantes es la disminución de conexina 43 inducida por LH, proteína clave que forma parte de este tipo de unión. Además de la expansión del cúmulo, la LH estimula a las células foliculares a secretar sustancias tipo mucinas (glicosa-aminoglicanos), es decir, ocurre la mucificación del cúmulo formando una matriz extracelular que le permite al folículo mantener su estructura (Figura 8).
El reinicio de la meiosis I está regulada por una serie de factores, de los cuales abordaremos los más reconocidos. En primer lugar, el efecto de LH en la interrupción de las uniones comunicantes es coincidente con la reactivación de la meiosis I, lo que sugiere que las células de la corona a través de compuestos producidos en ellas, tienen un papel crucial en la formación del gameto femenino. Efectivamente, desde hace años se ha demostrado que concentraciones intraovocitarias elevadas de AMP cíclico mantienen al ovocito en reposo meiótico y el desacoplamiento de las uniones gap (después del alza preovulatoria de LH), disminuyen estos niveles, todo lo cual coincide con la reactivación de la meiosis. Existe controversia sobre la capacidad que tiene el ovocito de acumular AMP cíclico, ya que hasta hace pocos años se sabía que el ovocito humano no tenía capacidad de producir AMP cíclico y los altos niveles presentes en la célula germinal eran de exclusiva responsabilidad de la conexión entre las células de la corona y el ovocito. No obstante, utilizando modelos animales se ha reportado recientemente que ovocitos de mamíferos tienen la capacidad de producir AMP cíclico debido a la expresión en la membrana del ovocito de proteínas G acopladas a receptores (G-proteins coupled receptors, GPCRs), los cuales se han descrito como receptores huérfanos, aunque antecedentes experimentales en otros tipos celulares sugerirían que podrían constituir receptores para esteroides. De manera tal, que pareciera que la acumulación intraovocitaria de AMP cíclico va a depender mayoritariamente del aporte de las células foliculares y también de la producción propia del ovocito.
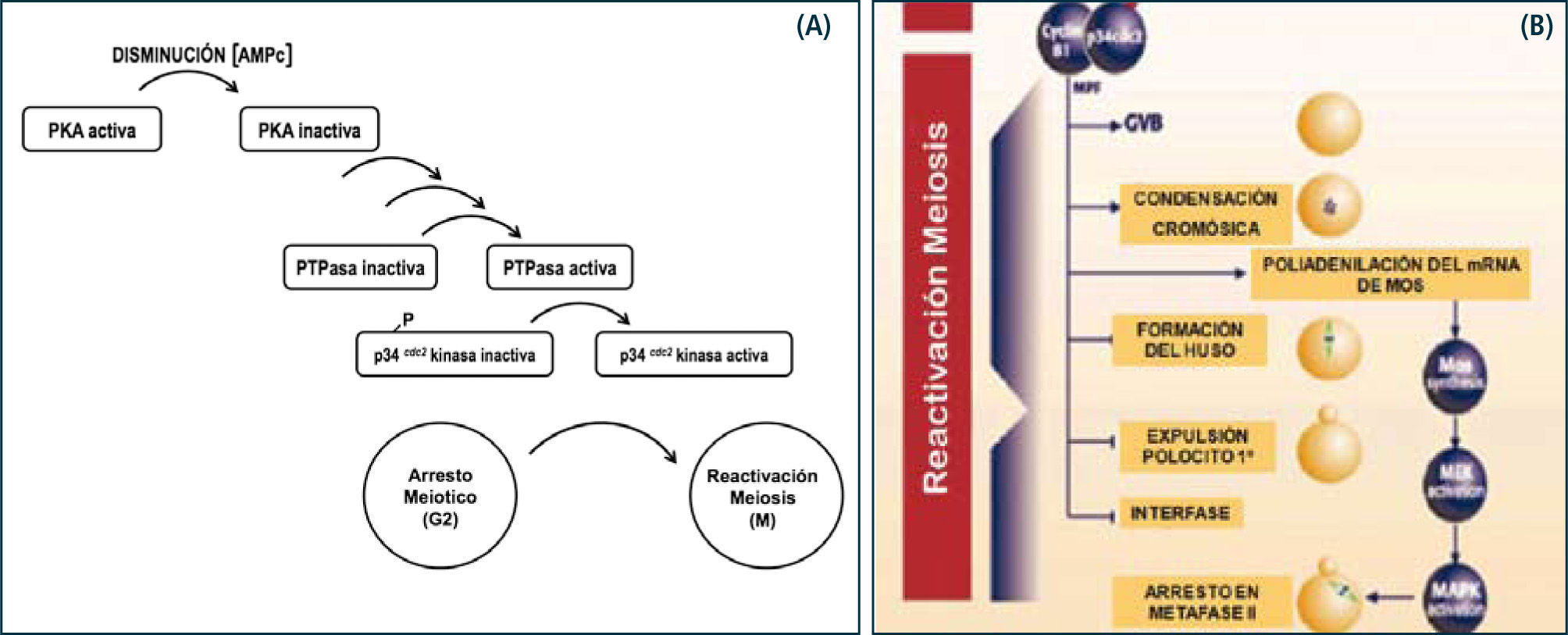
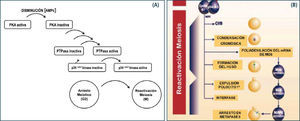
Es interesante preguntarse entonces, ¿cuál es el mecanismo por el cual altos niveles de AMP cíclico mantienen al ovocito en reposo meiótico? La respuesta más acertada es la que contempla la activación del complejo MPF (meiotic promotor factor). El MPF es una quinasa que inicia una cascada de fosforilaciones, las cuales son importantes para la ocurrencia de diversos procesos como la condensación de los cromosomas, polimerización de los microtúbulos del huso, ruptura de la vesícula germinativa y desensamblaje de las proteínas lámina. Se ha demostrado que este factor está presente prácticamente en todos los organismos vivos estudiados, razón por la cual se considera un factor universal y no específico, responsable también de la transición de G2 a M del ciclo celular. El MPF está constituido por dos subunidades proteicas, ciclinaB2 y la quinasa p34cdc2. La ciclina se degrada rápidamente después de cada división celular. En el caso de no degradarse esta subunidad, la actividad de MPF persiste y, por lo tanto, las proteínas permanecen fosforiladas, manteniéndose la condensación de los cromosomas, microtúbulos del huso polimerizados, y no reconstituyéndose la envoltura nuclear. Este sería el mecanismo por el cual el ovocito mantiene el segundo reposo meiótico, como lo veremos más adelante.
En consecuencia, los altos niveles de AMP cíclico en el ovocito activan a la PKA, la cual a través de la activación de su unidad catalítica induce una cascada de fosforilaciones de diversas proteínas que participan en procesos relacionados con el primer reposo meiótico y que ya mencionamos, manteniendo al ovocito al estado de dictioteno en la primera profase meiótica. Como se discutió, en respuesta al alza preovulatoria de LH la concentración de AMP cíclico en el ovocito disminuye y la PKA se inactiva, provocando que secuencialmente las proteínas se defosforilen y finalizando en la activación del MPF.
Recientemente, se ha demostrado en ovocitos de mamíferos que la concentración intraovocitaria de AMP cíclico constituye un mecanismo regulatorio importante para la formación del gameto femenino. En efecto, se ha descrito la presencia de proteínas de anclaje para PKA denominadas AKAPs, las que permiten que la sub-compartamentalización de PKA aumente su eficiencia en la regulación de la meiosis (18). Otro de los mecanismos que regulan la concentración de AMP cíclico es la enzima fosfodiesterasa (PDE) cuya actividad transforma al AMP cíclico en 5' AMP, inactivándolo (12).
La activación del MPF ocurre esencialmente por la defosforilación de la subunidad p34cdc2 (contiene tres sitios de fosforilación), quedando un solo sitio fosforilado en dicha subunidad, todo lo cual ocurre por la activación de la fosfatasa cdc25B. Tal como se mencionó, el MPF activo regula eventos que conducen a la reactivación de la meiosis. Luego de la expulsión del primer polocito, la meiosis progresa hasta metafase II, etapa en la cual experimenta el segundo reposo meiótico. El ovocito II en el estado de metafase II constituye el gameto maduro. Recientemente se ha descrito que el segundo reposo meiótico sería mantenido por la actividad de una Ser/Thr quinasa llamada Mos quinasa, la cual impediría el desensamblaje del huso meiótico y la decondensación de la cromatina, entre otras acciones. La Mos quinasa está presente en las células germinales, tanto femeninas como masculinas, y se ha observado que su concentración intraovocitaria aumenta de manera gradual junto con la activación del MPF. El mecanismo de acción de Mos quinasa es a través de la activación de la vía de las MAPK, las que tienen como acción reorganizar los microtúbulos del huso meiótico de metafase I y estabilizar al huso meiótico en metafase II. La concentración de Mos quinasa disminuye posterior a la fecundación, momento en que se reactiva la meiosis II (13) (Figura 9).
Signos endocrinológicos del envejecimiento reproductivoDesde el punto de vista endocrinológico, luego de la descarga episódica de GnRH por el hipotálamo, la frecuencia de pulsos de LH aumenta significativamente a través de la fase folicular del ciclo ovárico y existe una correlación entre los pulsos de estradiol y LH (14). En mujeres, la marcada respuesta de la hipófisis anterior a GnRH que ocurre en la fase folicular tardía del ciclo, se debe al efecto de “primming” del estradiol secretado por los folículos en desarrollo. El aumento marcado en la amplitud de los pulsos de LH que ocurre a medida que se produce la subida (surge) de LH, se debe parcialmente a la acción de los estrógenos a nivel del gonadotropo hipofisiario. Sin embargo, si es que el alza de LH preovulatoria se debe solamente al aumento de la sensibilidad de la hipófisis anterior, con el hipotálamo jugando un rol permisivo o si se debe a un cambio en la actividad de las neuronas hipotalámicas es controversial (15). En la mayoría de las mujeres, el inicio del pico preovulatorio de LH comienza entre medianoche y las 8:00 am y la ovulación ocurrirá entre 32 y 40 horas luego del inicio del aumento del nivel de LH (16). Luego de la ovulación, el comando de la actividad esteroidogénica del ovario es regulado a través del cuerpo lúteo.
Es ampliamente aceptado que el primer signo endocrinológico del envejecimiento reproductivo que revela la transición menopáusica es un aumento de los niveles de FSH principalmente en la fase folicular inicial. Durante este periodo, la mujer sostiene reglas regulares y no hay signos o síntomas de la perimenopausia (14). Sin embargo, diversos estudios han demostrado una disminución significativa de los niveles de inhibina B durante la fase folicular en mujeres con edad reproductiva avanzada con ciclos ovulatorios, concomitante con el aumento de los niveles de FSH (25, 26). El origen de la inhibina B en la circulación proviene de los folículos preantrales y antrales pequeños (17) y su disminución ha sido atribuida a la disminución del número de folículos en el ovario. Se ha sugerido que la reducción en la retroalimentación negativa de la inhibina sobre la secreción de FSH hipofisiaria puede ser la responsable del aumento de los niveles de FSH en mujeres de edad reproductiva avanzada. Cabe destacar que la ocurrencia de concentraciones normales de estradiol e inhibina en el líquido folicular de folículos preovulatorios de mujeres de edad avanzada sugiere que la reducción de los niveles de inhibina B sérica es el resultado de una disminución en el número de folículos antrales más que por una disminución de la capacidad secretora de las células de granulosa (18). Al estudiar el comportamiento de la AMH durante la vida reproductiva de la mujer, se ha observado que sus niveles serían estables entre los 18–29 años, observándose una disminución del 50% de ella a los 37 años de edad, mientras que se observan cambios mínimos en los niveles de FSH en el mismo período de tiempo (19). Por lo tanto, los cambios en los niveles de AMH serían los primeros en ser observados seguido por los cambios en inhibina sérica y más tardíamente por un aumento en los niveles de FSH (20) en pacientes que presentan falla ovárica parcial. Estos ensayos podrían ser utilizados clinicamente como métodos de evaluación de la reserva ovárica, tal como se mencionó para la AMH. Los niveles de andrógenos también disminuyen con la edad de la mujer, sin embargo, el cambio de los niveles de SHBG son controversiales (21).
Cambios en la regularidad del ciclo menstrual durante la vida reproductivaLos folículos se comportan en forma diferente en respuesta a factores que promueven la proliferación celular en el folículo, su crecimiento, diferenciación y apoptosis y unos pocos llegan a la ovulación (22). Como resultado, el pool de ovocitos/folículos declina exponencialmente con la edad con un marcado aumento en la velocidad de desaparición desde los 37–38 años en adelante. Cuando se llega a la menopausia, el número de folículos se reduce a 1000 o menos, número insuficiente para mantener el proceso hormonal cíclico necesario para la menstruación (23). Hansen sugiere que el decaimiento del número de folículos primordiales, intermedios y primarios es constante y se acelera aproximadamente a los 38 años (24). Al acercarce la mujer a la depleción folicular, y como consecuencia de que el número de folículos primarios y antrales se encuentran por debajo de ciertos límites, inicialmente el largo del ciclo menstrual se acorta debido a una fase folicular y ovulación antes de lo esperado como consecuencia de los cambiods en los niveles de FSH (25), seguido por la ruptura de la ciclicidad menstrual regular con periodos de oligomenorrea asociados a elevación de los niveles de gonadotrofinas (26) y finalmente por la falla ovárica completa o menopausia.
Fertilidad y edad de la mujerChile está en plena etapa de transición de la fecundidad. Su tasa global ha descendido en forma importante desde 1962–1963, período en que llegó a la cifra de 5,4 hijos (as) promedio por mujer, para alcanzar en 2004 un valor de 1,9. Es decir, la fecundidad en el país descendió en aproximadamente el 65% en 42 años. Esta cifra representa en términos demográficos una disminución del tamaño de la población y una edad media cada vez más elevada (27). La mujer chilena en la actualidad tiene mayores posibilidades de educación, desarrollo laboral, por lo cual al igual que en países desarrollados, la mujer ha postergado su maternidad. Estos datos contrastan con evidencias de que la mayor probabilidad de embarazo ocurre en la década de los 20–30 años, luego ocurre una declinacion general de la fertilidad con un mayor decaimiento luego de los 35 años (28, 29). Se ha reportado que la tasa de niño nacido disminuyó de un 43,2% en mujeres menores de 35 años a un 15,1% en mujeres entre 41–42 años a un 5,9% en mujeres mayores de 42 años en mujeres tratadas mediante fertilización asistida (30). En Chile, en un estudio realizado en el Hospital Clínico de la Universidad de Chile, de un total de 540 pacientes con transferencia de embriones, la tasa de embarazo clínico por aspiración fue de 47,5% en mujeres menores de 30 años, 44,5% en pacientes entre 30–30 años y de un 15,2% en pacientes mayores de 40 años (datos no publicados). Por lo tanto, el envejecimiento ovocitario ha sido sugerido como el mayor responsable de la disminución de la fertilidad (31). Esto sugiere que sumado al efecto de la edad sobre el ovocito, la implantación y desarrollo embrionario temprano también son afectados por la edad del la mujer aunque en un grado menor. Adicionalmente, el aumento de la prevalencia de condiciones médicas, con el aumento de la edad puede ser otro factor que contribuya al aumento de los abortos en mujeres mayores. Por lo que se podría concluir que la declinación funcional del ovario con la edad ha sido caracterizado por la depleción gradual de folículos y una reducción de la habilidad de producir ovocitos competentes para ser fertilizados y desarrollados posteriormente (32).
Envejecimiento folicularEl análisis del envejecimiento folicular requiere de algunas consideraciones: El ovocito y la CG de los folículos primordiales permanecen en un estado de “reposo” por un largo período de tiempo, se comportan como células postmitóticas que pueden ser requeridas a comenzar su crecimiento luego de 10–50 años. Sumado a lo anterior, los folículos primordiales y folículos en crecimiento son expuestos a factores ambientales relacionados con el envejecimiento del compartimento somático del ovario. A su vez, el desarrollo de un folículo competente depende de las “conversaciones” que ocurran en los compartimientos intraováricos.
La mayoría de las teorías del envejecimiento comparten el concepto que el malfuncionamiento asociado a la edad resulta de la acumulación fisiológica de biomoléculas que producen un daño irreparable alterando el metabolismo del tejido y con ello demuestran la importancia de la capacidad de reparación defensiva. En este contexto, la teoría más relevante para el envejecimiento ovárico, fue propuesta por Tarin (33), la cual señala una reducción de la habilidad del ovocito y de la CG de contrarrestar las acciones de las especies reactivas del oxigeno (ROS), los cuales son uno de los factores fisiológicos más importantes inductores de lesiones celulares asociadas al envejecimiento.
En observaciones realizadas en CG se muestra que en mujeres mayores de 38 años, dichas células son menos numerosas, producen menos esteroides y glicoproteínas, contienen mayores niveles de DNA mitocondrial (mtDNA), y muestran una disminución de la expresión de enzimas antioxidantes, comparado con mujeres más jóvenes. A su vez, en mujeres mayores, los folículos parecen entrar precozmente a la fase de crecimiento comparado con mujeres mas jóvenes (34).
De acuerdo a la hipótesis más relevante, el aumento de los niveles de FSH que ocurren en la fase folicular inicial durante el envejecimiento reproductivo, puede acelerar la depleción final de la reserva folicular (35). Producto de lo anterior se rescatan folículos ováricos que normalmente estarían excluidos de la selección; sin embargo, el aumento de FSH ocurre en forma tardía en el calendario de eventos del envejecimiento reproductivo. La expresión del receptor de FSH en el folículo primario no es absoluta, con un rango de 21–33% (36), estos cambios sugieren que el número de folículos en desarrollo de mujeres de diferentes edades pueden tener capacidades diferentes de respuesta a los cambios fisiologicos de niveles hormonales asociados al envejecimiento. Estudios recientes en ratones transgénicos, los cuales presentan aumento de los niveles séricos de FSH, se observa que los niveles elevados de la gonadotrofina reducen el porcentaje de ovocitos normales fertilizados y evidencia que hay otros aspectos de cambio en el proceso reproductivo sin cambios en la reserva ovárica.
Por otra parte, se ha observado que con el aumento de la edad de la mujer, existe un aumento de las aneuploidias en el ovocito (37). La relación entre edad materna avanzada y anomalías cromosómicas, particularmente aneuploidias, ha sido bien establecido por múltiples estudios epidemiológicos (38). Pellestor en un estudio de 1397 ovocitos recuperados de FIV confirmó la asociación positiva entre edad materna y el aumento de anormalidades cromosómicas (39, 40). Desde el punto de vista citogenético la ocurrencia de aneuploidias ha sido atribuida a no disyunción cromosómica en meiosis I o II, cualquier desviación del alineamiento cromosómico normal durante el estado de metafase o cualquier anormalidad del huso meiótico, pueden contribuir a la ocurrencia de no disyunción y como resultado aneuploidias (41). Además, la disminución en la formación de quiasmas que resulten en una reducción o pérdida de recombinación cromosómica, pueden también contribuir a una no disyunción meiótica (42). Se han propuesto como causales los mecanismos de: Desbalance hormonal, desarrollo folicular anormal debido al envejecimiento de células somáticas que rodean al ovocito (43) y alteración de la microcirculación perifolicular. Asociado a la teoría de la no disyunción, Angell y cols. postularon la existencia de un mecanismo diferente para la ocurrencia de aneuploidias (44). De acuerdo a su observación, la separación prematura de las cromátidas durante la meiosis podría ser el factor principal que contribuye a la formación de los ovocitos con complemento cromosómico anormal. Más aún, ellos postulan que la degradación constante y relacionada con la edad de cohesina (45) y de otros factores que sostienen a las cuatro cromátides juntas durante la metafase I es el factor de mayor contribución a la declinación de la fecundidad con la edad de la mujer (46).
Con el aumento de la edad de la mujer se han observado algunos cambios morfológicos nucleares, como por ejemplo, la decondensación de la cromatina, desalineación de los cromosomas, y anomalías en el huso meiótico (47). Estas observaciones han llevado al concepto que las aneuploidias ovocitarias representan la consecuencia del compromiso de la maquinaria celular y plantean la hipótesis del envejecimiento ooplasmático. En consecuencia, el ovocito maduro de edad reproductiva avanzada tiene una disminución de las posibilidades de tener una maduración nuclear y citoplasmática que le permita una adecuada mantención de la fertilización y desarrollo embrionario. Junto a lo anterior, observaciones recientes en ratón y humanos sugieren que el envejecimiento puede alterar la acumulación de RNA requerido por el ovocito para procesos específicos del metabolismo normal o para su uso posterior durante el desarrollo embrionario temprano antes de la activación del genoma embrionario (48).
Otro de los factores que participa en el envejecimiento reproductivo es la disfunción mitocondrial. El rol de la disfunción mitocondrial en el proceso de envejecimiento de las células somáticas ha sido discutido en numerosos estudios (49). Esta disfunción se debe al daño producido por las ROS al DNA mitocondrial y a la anormalidad subsecuente en el metabolismo oxidativo y producción de ATP, el cual afecta casi todos los aspectos de la función celular, incluyendo la replicación (50); el mismo mecanismo ha sido involucrado en el envejecimiento del ovocito humano (51, 52). Diferentes estudios han revelado cambios relacionados con la edad en la expresión de genes que participan en la función mitocondrial. Genes codificados en el genoma mitocondrial y que participan en la cadena de transporte de electrones están más expresados en ovocitos viejos, en contraste con genes relacionados a las vías energéticas se observaron más expresados en ovocitos jóvenes. Estas observaciones son concordantes con el hecho que los ovocitos envejecidos contienen menos ATP (53).
Con el aumento de la edad, se ha observado un control de la meiosis alterado, la pérdida de eventos coordinados que llevan a la ovulación pueden ser inducidos por un aumento de los niveles basales de LH durante la fase folicular observados durante la fase tardía del envejecimiento reproductivo, los cuales pueden gatillar la meiosis antes del pico de LH.
Otra teoría propuesta para explicar la declinación de fertilidad en mujeres de mayor edad, es el acortamiento del telómero. Los telómeros son secuencias de DNA repetidas en los extremos del cromosoma, los cuales se acortan gradualmente con divisiones celulares sucesivas (54), una vez que el telómero adquiere un umbral en su longitud, la célula experimenta un proceso de detención, apoptosis e inestabilidad genómica (55), Keeffe y cols., proponen que el daño producido por ROS sería uno de los responsables del acortamiento de los telómeros, éste se produciría debido a una reparación del DNA insuficiente producto del daño oxidativo debido a que el intervalo entre la ovogénesis fetal y la ovulación es excepcionalmente elevado en la mujer, por otra parte la enzima telomerasa, la cual repara los telómeros, está presente sólo en el estado de blastocisto y no en los estadíos previos del desarrollo. Por otra parte, ha sido reportado que la alteración genética del soporte vascular puede tener efectos a largo plazo en la depleción folicular (56). Datos aportados por Ng y cols sugieren que la disminución del flujo del estroma ovárico que ocurre con la edad, es un fenómeno tardío de acuerdo a las observaciones con power doppler y se ve en mujeres mayores o igual a 41 años (57).
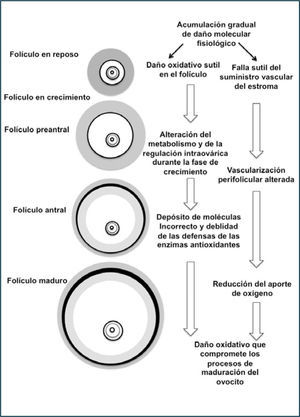
Daño oxidativo en el ovario que envejeceEl estrés oxidativo, definido como un desbalance entre los sistemas oxidativo y antioxidantes, ha sido sugerido que puede jugar un rol en todos los pasos de la reproducción humana, desde la gametogénesis hasta la implantación. Especies reactivas del oxigeno (ROS) juegan un rol en la modulación del espectro fisiológico reproductivo como la maduración ovocitaria, esteroidogénesis ovárica, función del cuerpo lúteo y luteolisis, procesos de fertilización, desarrollo embrionario y embarazo (58). Para asegurar los niveles de ROS, las CG y el ovocito en todos los estados foliculares, como también en el líquido folicular, poseen agentes antioxidantes y enzimas detoxificantes (59). Es importante recordar que el ovocito entra a la primera división meiótica durante la vida fetal y se mantiene detenido hasta la vida adulta, de modo que cuando son seleccionados para su desarrollo en la foliculogénesis, el ovocito y particularmente las mitocondrias, han estado expuestas a ROS con el consiguiente compromiso en la capacidad del ovocito de completar el proceso de la meiosis en forma competente (60).
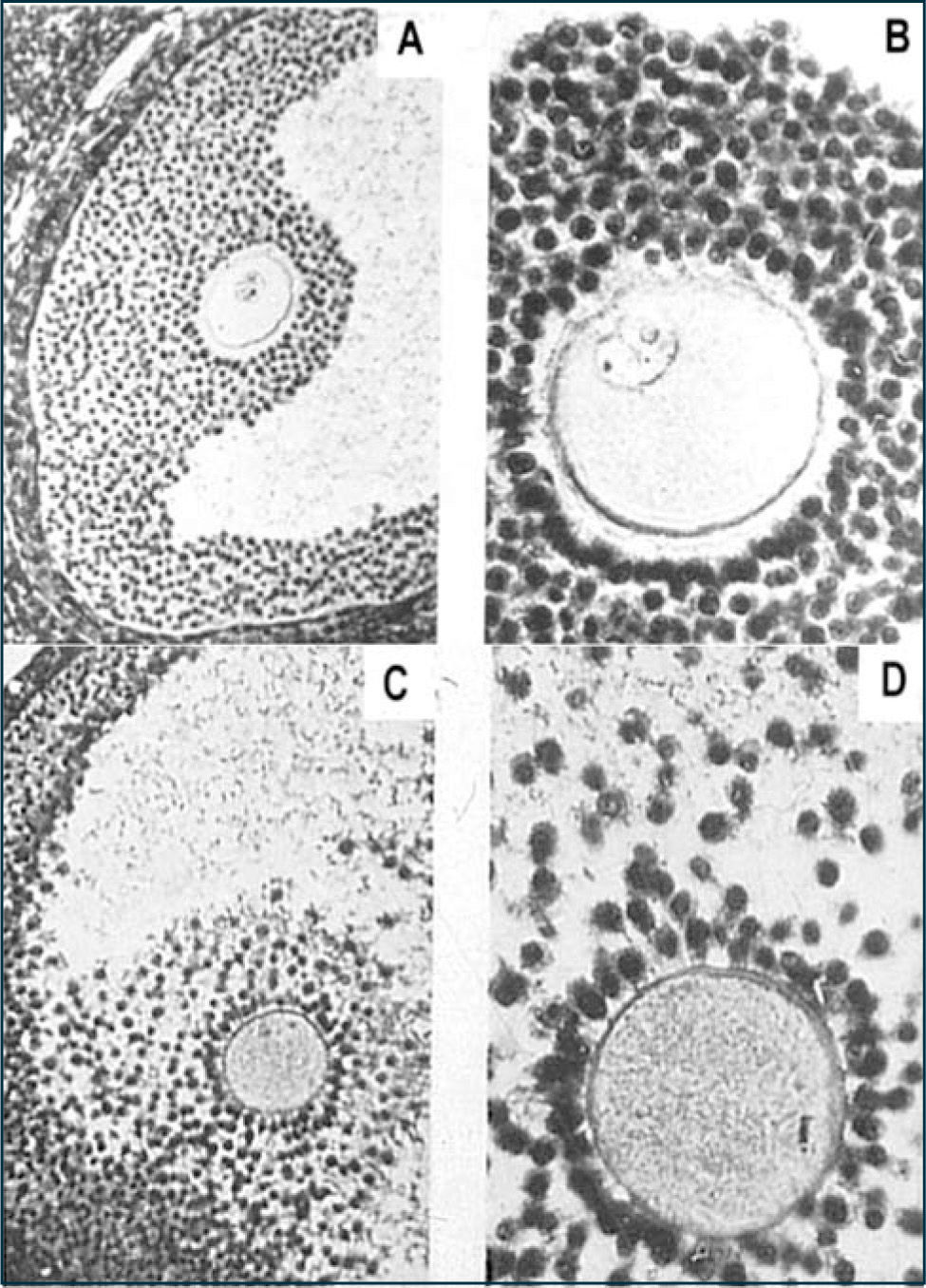
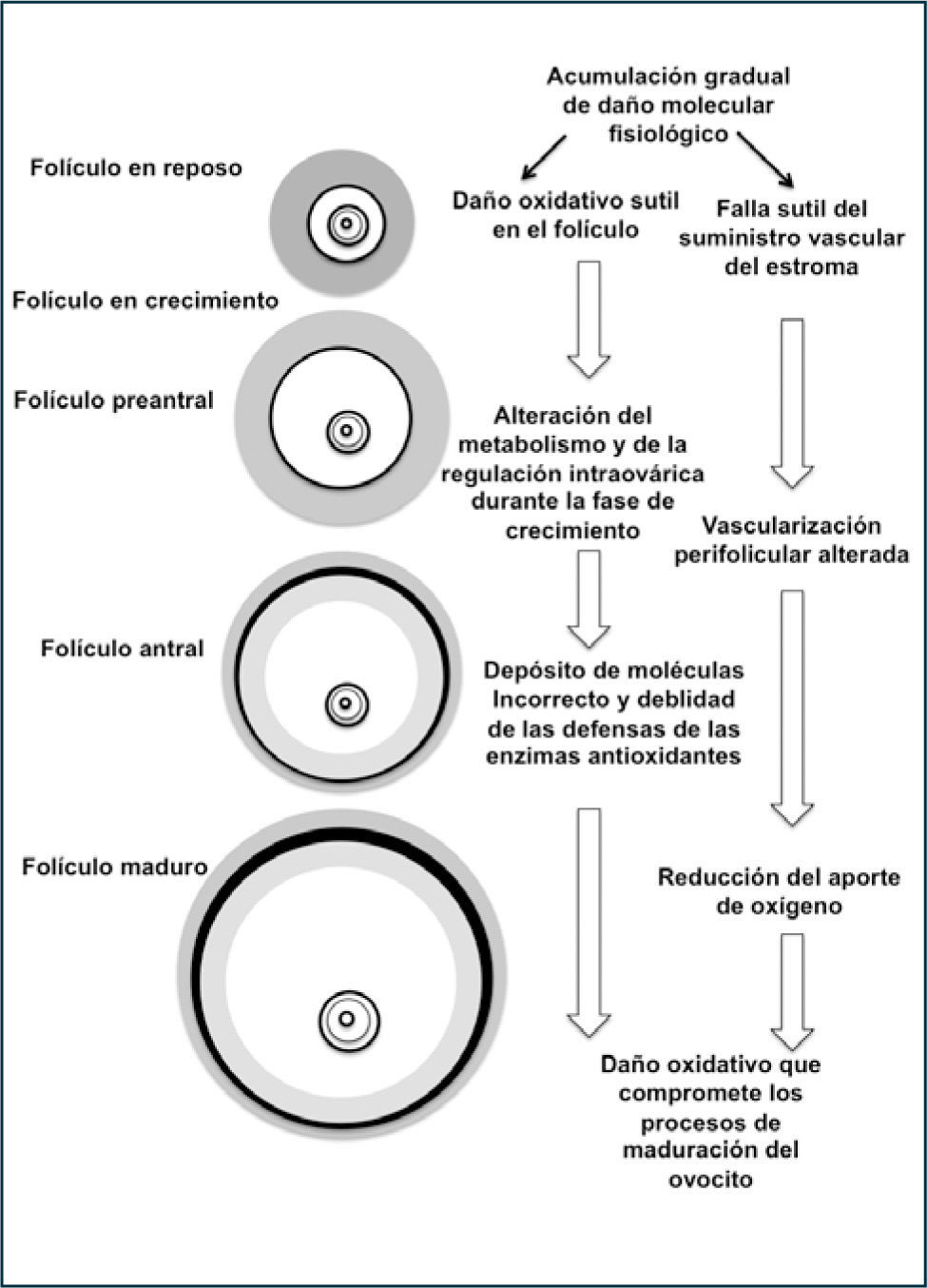
Antecedentes experimentales sugieren tanto en modelos animales como en humanos que los folículos preovulatorios y primordiales sufren de estrés oxidativo asociado a la edad, con una alteración de los mecanismos enzimáticos antioxidantes de defensa. Un factor determinante en el estrés oxidativo asociado al envejecimiento del ovocito puede ser una condición debida a la insuficiencia de crecimiento de los capilares de la teca del folículo maduro (61). Esta hipótesis también se soporta porque en condiciones de hipoxia en el ovario envejecido se observan mitocondrias de las CG con daños estructurales (Figura 10).
En resumen, los cambios fisiológicos con la edad, son consecuencia de cambios sistémicos generales producidos por el envejecimiento, entre los que se destacan cambios a nivel de los mecanismos de defensa relacionados con las ROS, alteraciones de la microcirculación. Estos cambios se deben esencialmente a una depleción de la población folicular en el ovario, la cual al disminuir por debajo de 1000 folículos, el ovario pierde su capacidad de ciclar en forma normal, con la consiguiente disminución en los niveles de esteroides circulantes y sus efectos secundarios en los órganos efectores. Asociado a esta disminución de la población folicular, se producen cambios en la calidad ovocitaria, los cuales determinan la disminución progresiva de la fertilidad en mujeres mayores de 35 años. Entre los cambios más frecuentes se observa aumento de aneuploidias, disfunciones mitocondriales, cambios de la microcirculación y disminución de la capacidad defensiva sobre las ROS, entre otros.
Los autores declaran no tener conflictos de interés, en relación a este artículo.