Actualmente la estenosis aórtica (EA) degenerativa es la valvulopatía adquirida más frecuente en la población mayor, y debido al envejecimiento de ésta su número absoluto continua incrementándose. La obstrucción mecánica a la salida de sangre a través de la válvula estenótica determina una serie de cambios morfo-funcionales del corazón que luego de un período de latencia relativamente largo son sobrepasados apareciendo los síntomas. Una vez que un paciente se hace sintomático, se establece un punto de quiebre tanto en su calidad de vida como en su pronóstico. Tradicionalmente estos pacientes son sometidos a cirugía de reemplazo valvular aórtico, considerando que esta terapia mejora el pronóstico y la calidad de vida. Sin embargo, dado que la población portadora de EA es una población mayor con múltiples co-morbilidades, hasta un 30-60% se considera fuera del alcance quirúrgico. Recientemente se desarrollaron dos dispositivos valvulares biológicos para la corrección de la EA, a través de la implantación valvular aórtica transcatéter (TAVI), procedimiento menos invasivo que la cirugía. Se revisaron los antecedentes que apoyan las bases fisiopatologicas, dispositivos, complicaciones y proyecciones de esta novedosa técnica en pacientes mayores, sintomáticos e inoperables. Este procedimiento no solo constituye un gran adelanto técnico y conceptual, sino que ha permitido abordar pacientes antes considerados inoperables. Los resultados han permitido un crecimiento de las TAVI a nivel mundial de aproximadamente de 10.000 válvulas implantadas el 2010 a más de 90.000 hoy. Un crecimiento como éste en la población de más alto riesgo solo demuestra su eficiencia y seguridad. Probablemente estemos asistiendo a un cambio conceptual en el enfrentamiento de esta patología.
Currently degenerative aortic stenosis is the most common acquired valvular heart disease in the elderly population, and because the aging of this, the absolute patient number continues to increase. Mechanical obstruction to the outflow of blood through the stenotic valve causes a series of morpho-functional changes of the heart after a relatively long latency period are outweighed symptoms appear. Once a patient becomes symptomatic establishing a turning point in terms of quality of life and in its forecast Traditionally, these patients undergo aortic valve replacement surgery, considering that this therapy improves prognosis and improved quality of life. However, given that patient with aortic stenosis is an aging population with multiple co-morbidities, up to 30-60% of them does not undergo surgery. Recently, two heart biological valve devices have been develope for the correction of aortic stenosis through transcatheter aortic valve implantation (TAVI), less invasive procedure than surgery. We reviewed the backgrounds that support the pathophysiological bases, devices, complications and projections of this novel technique in older patients, symptomatic and inoperable. This procedure is not only a technical and conceptual breakthrough, but allowed to treat patients previously considered inoperable. The results have enabled a huge growth in worldwide TAVI approximately 10,000 valves implanted in 2010 to over 90,000 today. Growth like this in the highest risk population only proves its efficiency and safety. We are probably witnessing a conceptual change in dealing with this disease.
La estenosis aórtica degenerativa es la enfermedad valvular cardíaca adquirida, más frecuente en la población de edad avanzada. Su prevalencia en mayores de 80 años es >4%, debido al envejecimiento poblacional, el número absoluto de pacientes continua creciendo. En los pacientes sintomáticos el remplazo valvular aórtico ha sido el tratamiento de elección durante los últimos 40 años (1). Esta terapia quirúrgica se asocia a un mejor pronóstico y una mejoría en la calidad de vida (2). Sin embargo dado que se trata de pacientes generalmente añosos con frecuentes co-morbilidades, el remplazo valvular quirúrgico puede derivar en complicaciones severas. Es así como aproximadamente el 30% de estos pacientes con EA sintomática actualmente no se operan (3). La mortalidad para pacientes con EA severa sintomáticos, es sobre 50 – 60% a 2 años en pacientes de alto riesgo. Así la estenosis aortica severa tiene un pronóstico reservado con terapia médica conservadora (4). Algunas series en adultos mayores describen que un 30-60% (5–7) de los casos son considerados de muy alto riesgo para ser sometidos a una cirugía a tórax abierto.
¿Cuál es la alternativa para un paciente con estenosis ea, con co-morbilidades y mayor de 80 años?La valvuloplastia percutánea con balón fue la primera técnica basada en catéter para resolver este problema. Luego de resultados iniciales promisorios (8, 9), el seguimiento a largo plazo demostró una alta tasa de re-estenosis y una mejoría clínica no significativa de los pacientes (10).
La implantación valvular aórtica transcatéter (tavi) inicialmente descrita por Andersen (11) y fue introducida para pacientes no-operables por Cribier el 2002 (12). Actualmente son principalmente dos tipos de válvulas las que demostraron la viabilidad y eficacia de la prótesis balón-expansible, Sapien EdwardsTM (Edwards Lifesciences LLC, Irvine, CA, USA) (13), así como la válvula auto-expansible CoreValveTM, ahora Medtronic CoreValveTM (MedtronicCoreValve, Irvine, CA, USA) (14–16). La eficacia de esta última también fue confirmada por un gran registro multicéntrico post-marketing de la CoreValve de Medtronic (17). Los promisorios resultados a nivel mundial han determinado una rápida expansión de esta técnica a la práctica clínica diaria con más de 90.000 válvulas implantadas de ambas prótesis disponibles, dando una esperanza de sobrevida y mejor calidad de vida para pacientes mayores, fuera del alcance quirúrgico.
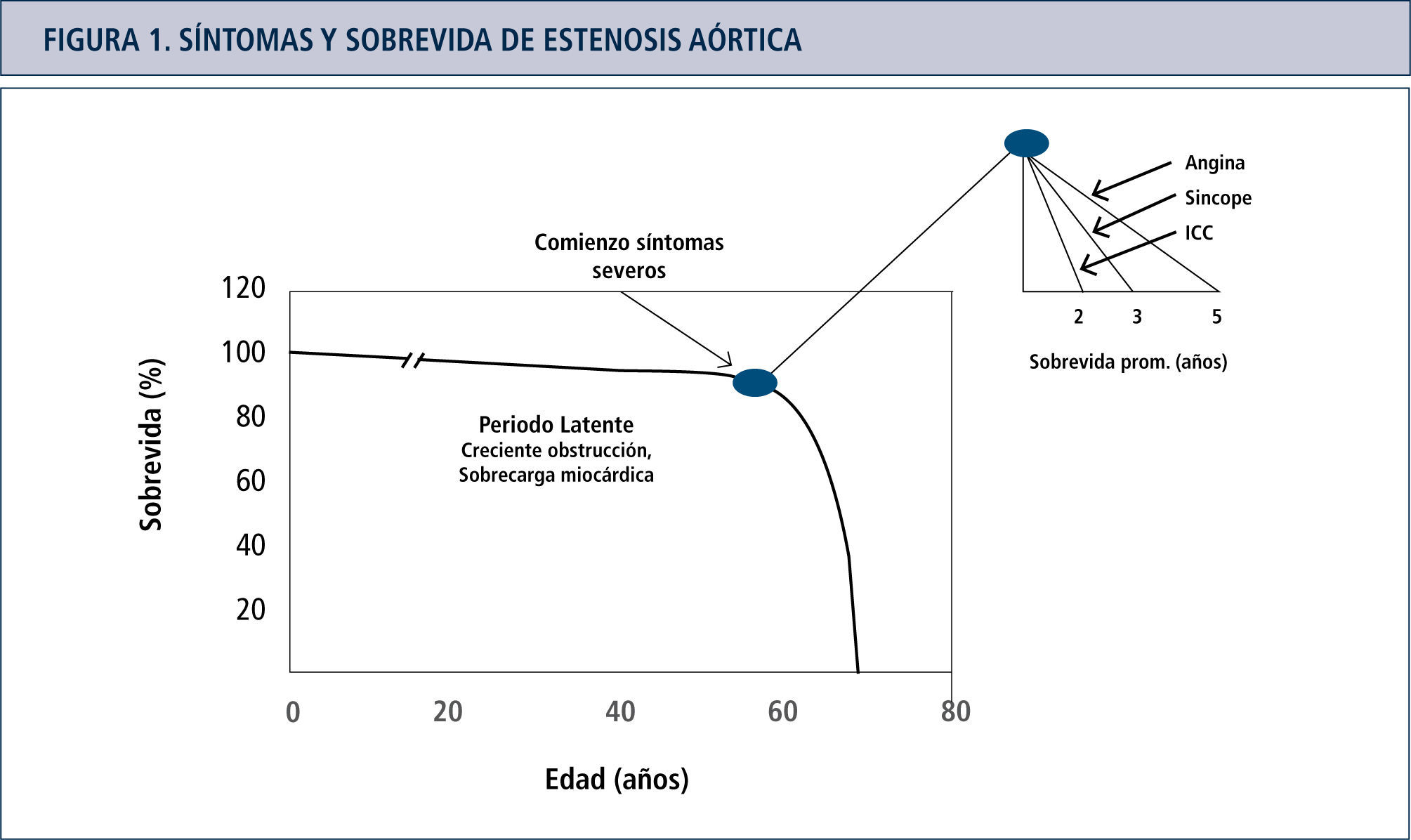
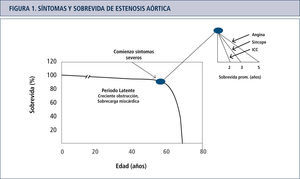
Fisiopatología de estenosis aórticaLa estenosis valvular aórtica se define como un obstáculo al flujo sanguíneo a través de la válvula aórtica durante la eyección ventricular. Esta obstrucción del tracto de salida del ventrículo izquierdo (VI), debido al aumento de la presión sistólica, prolonga el tiempo de eyección, aumenta la presión sanguínea y disminuye la presión aórtica diastólica, se establece una gradiente transvalvular. Estas alteraciones están establecidas cuando el área valvular se reduce al menos en un 50% (18). La sobrecarga de presión es inicialmente compensada por desarrollo de hipertrofia miocárdica, inicialmente sin dilatación de las cámaras cardiacas izquierdas (hipertrofia concéntrica) que es capaz de mantener por varios años la función sistólica normal. El aumento de la presión sanguínea sistólica, de la masa ventricular y del tiempo de eyección, determinan un aumento del consumo de oxígeno por el miocardio. Este mayor consumo de oxígeno contribuye a la isquemia miocárdica y posteriormente al deterioro de la función del ventrículo izquierdo (19). A medida que la enfermedad avanza, desaparecen los mecanismos compensatorios efectivos, lo que se asocia a un desbalance entre la función de la bomba y la poscarga del VI (mismatch de poscarga). En este estado, las cámaras cardiacas se dilatan, la fracción de eyección se reduce y tanto la presión de llenado ventricular como la presión pulmonar aumentan. Este estado generalmente coincide con la aparición de EA severa y el comienzo de síntomas. Usualmente los síntomas en pacientes con EA aparecen alrededor de la 6ta década de la vida, luego de un largo periodo de latencia, caracterizado por engrosamiento progresivo y calcificación de los velos valvulares aórticos, de una disfunción miocárdica progresiva o ambas (Figura 1). En los pacientes en los que la EA es severa y sintomática el pronóstico es malo. Es por esta razón que las guías de la ACC/AHA (20) recomiendan el reemplazo valvular en estos pacientes (Clase I: reemplazo valvular aórtico está indicado para pacientes sintomáticos con EA severa, con un nivel de evidencia B).
Los síntomas en pacientes con EA comienzan alrededor de la 6ta década luego de un largo periodo de latencia y se caracterizan por un engrosamiento progresivo y calcificación de la válvula aórtica o una progresiva disfunción miocárdica o ambas. Sin el reemplazo valvular aórtico o TAVI el pronóstico de los pacientes sintomáticos es extremadamente pobre.
A pesar que la EA es mejor descrita como un continuo su severidad puede ser graduada.
- •
Leve: área 1-1.5cm2, gradiente media <25mmHg o velocidad del jet <3 m/s.
- •
Moderada: área 1-1.5cm2, gradiente media 25-40mmHg o velocidad del jet 3-4 m/s.
- •
Severa: área <1cm2(0.6cm2/m2), gradiente media > 40mmHg o velocidad del jet >4 m/s.
El desarrollo de los síntomas como angina, síncope o insuficiencia cardíaca en un paciente con EA, luego de un periodo de latencia hace cambiar el pronóstico dramáticamente. El desarrollo de síntomas es el punto crítico en la historia natural de la EA. Las decisiones de manejo se basan fundamentalmente en estos hallazgos, muchos clínicos sin embargo aún tratan a los pacientes sintomáticos, especialmente a los mayores en forma conservadora. Claramente la introducción de TAVI está cambiando la manera de enfrentar a estos pacientes. Por una parte los cardiólogos intervencionistas han comenzado a tratar pacientes antes abandonados al limitado tratamiento médico. Por otra, los cirujanos apreciando el buen resultado en estos pacientes también están desplazando sus límites de terapia. Nadie duda de la indicación quirúrgica de los pacientes sintomáticos y el TAVI parece una muy buena alternativa para los pacientes sintomáticos inoperables. La pregunta de los próximos años considerando la morbimortalidad actual y la calidad de las válvulas biológicas actuales que no requieren anticoagulación será si deberemos reemplazar la válvula antes de los síntomas. En ese contexto esperar los cambios morfológicos del VI (re-modelamiento, dilatación), y el desacople mio-fibrilar, procesos que intentamos detener con tratamiento médico durante años, probablemente no será la mejor opción. En el paciente asintomático, todos nuestros esfuerzos terapéuticos están destinados a evitar cambios morfo-funcionales gruesos del ventrículo izquierdo, sin embargo una serie de procesos intracelulares y moleculares ya se han activado con anterioridad, secundariamente a la obstrucción valvular. Parece evidente que frente a una obstrucción fija causada por la válvula estenótica, el énfasis debiera estar en resolver este problema y no en intentar detener las consecuencias de ésta.
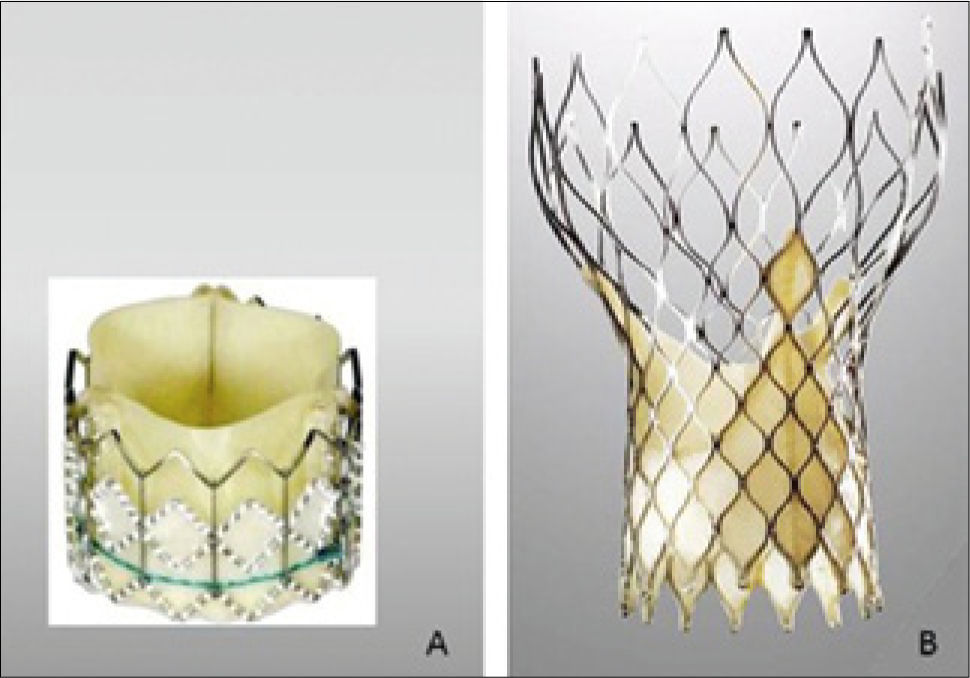
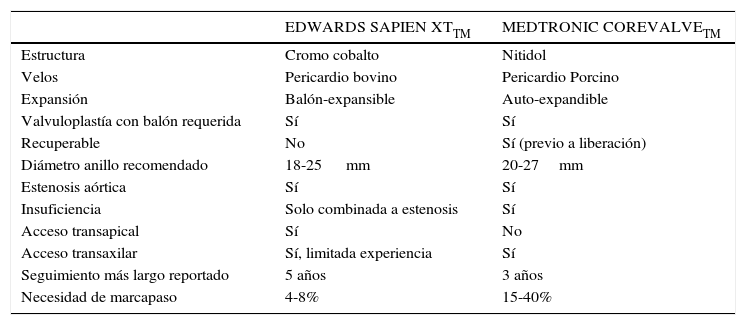
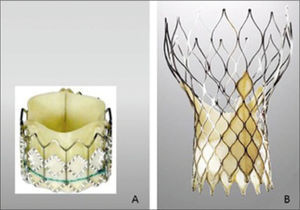
DispositivosActualmente hay dos válvulas disponibles en el mercado que tienen el mayor número de pacientes tratados en el mundo (Figura 2). La válvula cardiaca transcatéter Edwards (THV) (Edwards Lifescience, USA) utiliza un balón expansible de estructura tubular (Figura A). En cambio el sistema “revalving” (Medtronic Inc., Minneapolis, MN, USA) utiliza un sistema auto-expansible, re-capturable (Figura B). Este sistema no solo se ancla en el anillo valvular sino que también se apoya en la aorta supra-coronaria. Ambos dispositivos tienen sistemas de liberación disponibles en perfiles de 18-19 F (Tabla 1). El dispositivo CoreValve (Figura B) se asocia a menos inestabilidad hemodinámica durante la implantación, posicionamiento más controlado y se puede recapturar y re-envainar si su posición no se consideró correcta. El riesgo de obstrucción coronaria por el desplazamiento de los velos nativos es muy bajo. Una tasa relativamente alta de bloqueo de conducción se presenta post procedimiento requiriendo en hasta un 30% de los casos la implantación de un marcapaso definitivo. Las comparaciones en relación a la duración aún son especulativas. En la ausencia de estudios comparativos es difícil determinar diferencias en el potencial beneficio clínico.
Comparación de prótesis valvular aórtica edvvards sapien xt y medtronic corevalveMT
| EDWARDS SAPIEN XTTM | MEDTRONIC COREVALVETM | |
|---|---|---|
| Estructura | Cromo cobalto | Nitidol |
| Velos | Pericardio bovino | Pericardio Porcino |
| Expansión | Balón-expansible | Auto-expandible |
| Valvuloplastía con balón requerida | Sí | Sí |
| Recuperable | No | Sí (previo a liberación) |
| Diámetro anillo recomendado | 18-25 mm | 20-27mm |
| Estenosis aórtica | Sí | Sí |
| Insuficiencia | Solo combinada a estenosis | Sí |
| Acceso transapical | Sí | No |
| Acceso transaxilar | Sí, limitada experiencia | Sí |
| Seguimiento más largo reportado | 5 años | 3 años |
| Necesidad de marcapaso | 4-8% | 15-40% |
El desempeño hemodinámico de las actuales válvulas transcatéter disponibles es comparable al de las válvulas cardiacas quirúrgicas (21–30). Las gradientes medias sistólicas son típicamente alrededor de 10mmHg y el orificio efectivo de apertura es generalmente entre 1.2 y 1.9cm2 dependiendo del tamaño de la prótesis. Las válvulas cardiacas transcatéter (THVs) aparentemente se asocian a una mejor hemodinámica que las bioprótesis quirúrgicas en parte debido al voluminoso anillo suturado. La regurgitación para-valvular debida al incompleto sellado del anillo es común con las THVs. Sin embargo, con las actuales técnicas de implantación, post-dilatación con balón y el posicionamiento más preciso generalmente se logra una insuficiencia trivial a leve y solo ocasionalmente es moderada. Estos “leaks” parecen ser bien tolerados, no empeoran con el tiempo y no se ha reportado hemólisis clínica. La regurgitación severa puede ocurrir, pero es relativamente infrecuente y debe ser corregida, para lo cual existen diversas técnicas. Usualmente debido a errores técnicos debidos a dimensionamiento o posición se producen fugas o “leaks” severos. En tales casos la post-dilatación o el implante de una segunda válvula (valve in valve), puede ser útil. La mayor parte de los pacientes con estenosis aortica tienen regurgitación de base. Sin embargo “leaks” protésicos transvalvulares significativos son infrecuentes post TAVI. En las series actuales grandes el hallazgo general es que la regurgitación aórtica neta (tanto valvular como paravalvular combinadas), no aumentan y generalmente se reducen posterior a TAVI (24, 26, 31).
Estudios de desgaste acelerado de la válvula actualmente disponibles predicen una durabilidad que excede los 10 años. Son diversos los reportes de seguimiento eco-cardiográficos más allá de 1-2 años. Un reporte documenta el funcionamiento después de 5 años de una válvula implantada, la precursora de la válvula SAPIEN (32). El paciente con mayor sobrevida luego de TAVI es de 6.5 años, sin problemas en la prótesis.
Evaluación del pacienteLa evaluación del candidato a TAVI es un proceso complejo que involucra una revisión multidisciplinaria. El trabajo estándar de TAVI incluye una ecocardiografía transtorácica a objeto de confirmar la estenosis aortica, evaluar la lesión valvular, función ventricular y preferentemente el diámetro del anillo. Se requiere una coronariografía, aortografía y eventualmente una angiografía tomográfica para evaluar la aorta y los posibles accesos. En el centro, desde el primer paciente, se conformó un equipo de evaluación de pacientes, compuesto por dos ecocardiografistas y cardiólogos clínicos, dos radiólogos, un cardiocirujano y un cardiólogo intervencionista.
Acceso vascularEl acceso transvenoso fue utilizado para establecer la factibilidad de TAVI, pero la implantación exitosa fue difícil de reproducir y esta ruta fue abandonada. La implantación percutánea es actualmente realizada utilizando un acceso retrógrado desde la arteria femoral (12). Originalmente requiriendo una disección, el acceso vascular es ahora típicamente realizado con punción percutánea y cierre percutáneo. Otras alternativas incluyen accesos quirúrgicos abiertos de arteria iliaca retroperitoneal, arteria subclavia, aorta ascendente o ápex ventricular, todas se han utilizado con éxito. Sin embargo la decisión se debe basar en la vía más adecuada para la válvula, las condiciones del paciente y la experiencia del equipo. Se requiere para este procedimiento un equipo multidisciplinario, compuesto por cardiólogo intervencionista, cardiocirujano, cirujano vascular, ecocardiografista, anestesista y personal de enfermería altamente entrenado y afiatado.
ComplicacionesSon tres las complicaciones más relevantes de este procedimiento, acceso vascular, accidentes cerebrovasculares secundarios al procedimiento e insuficiencia aórtica post implante. También se debe mencionar que un porcentaje importante de pacientes requieren marcapaso definitivo.
Los eventos vasculares del sitio de acceso representan la complicación más frecuente asociada a TAVI (32, 33). El registro del estudio SOURCE y PARTNER B (SAPIEN) reportó una tasa de complicaciones vasculares de 17.9 y 16.2% respectivamente. En forma similar registros CoreValvehan han reportado una tasa de complicaciones de 2-17%. Experiencias más recientes sugieren que la tasa de complicaciones está disminuyendo y se asocian a menor mortalidad (31). Considerando que las principales complicaciones de este procedimiento son el acceso vascular y las hemorragias, nuestro equipo ha optado por el momento por abordar los accesos por denudación, con lo cual no hemos tenido complicaciones vasculares ni hemorrágicas, en los 17 casos realizados a la fecha.
La tasa reportada de accidentes cerebrovasculares (ACV) asociados a TAVI es de 0-10% (24, 26, 29, 31). El estudio SOURCE mostró una tasa de ACV de 2.4% y el PARTNER B de un 5.0%. Los accidentes vasculares relacionados al procedimiento son debidos a embolización de material friable que se encuentra en la válvula aortica enferma como se ha demostrado por doppler transcraneal. Estudios de difusión con Resonancia Nuclear Magnética demuestran un alto porcentaje de aparición de lesiones post-procedimiento, sin embargo, estas no se correlacionan con déficits neurológicos clínicos. Los últimos reportes sugieren una disminución de estos eventos en relación a la mejoría en la técnica lograda. Se están desarrollando diversos dispositivos de protección de embolias. Se plantea el uso de Aspirina y Plavix por tiempos entre 1-3 meses.
Otra de las complicaciones frecuentes y sobre la que se ha discutido mucho es la insuficiencia aórtica post implante, la cual se ha reportado en algunas series hasta en un 72.4%. El exacto diagnóstico de la severidad de la insuficiencia así como su tratamiento son dos de los problemas más desafiantes de TAVI. Los datos disponibles para ambos tipos de prótesis reportan una tasa comparable de insuficiencia aórtica de alrededor de 70% la cual es principalmente leve a moderada (13, 14, 16). Insuficiencia severa se ha reportado solo en un 2.3% en algunas series. Sin embargo, se ha planteado que esta última tasa puede estar subestimando el real problema por dos razones. Primero la insuficiencia severa que se trata en el procedimiento de implantación, ya sea con post dilatación o con implantación de una segunda válvula. En segundo término algunas insuficiencias estimadas como moderadas al inicio en el seguimiento se transforman en severas. Es fundamental definir el sustrato fisiopatológico, dado que solo con este conocimiento se puede decidir una terapia adecuada. La insuficiencia aórtica severa debido a una implantación baja de la CoreValve de MedtronicTM puede ser corregida implantando una segunda válvula o reposicionamiento mediante catéter. Las fugas para valvulares pueden ser tratadas en caso de ser muy severas con dispositivos de cierre.
La necesidad de implantar un marcapaso definito (MPD) post implante valvular es una consideración importante. Al implantar la válvula se puede comprometer aun más el sistema de conducción atrio-ventricular que pasa a través de septum interventricular cerca de la válvula aórtica. Asociándose a nuevos bloqueos de rama o bloqueos completos. El reemplazo valvular quirúrgico requiere el uso de marcapaso definitivo en un 3-18%. En el caso de TAVI la implantación de MPD reportada es de 3-36% (24, 26). La comparación es difícil entre el grupo quirúrgico y TAVI por representar este último un grupo particularmente de alto riesgo. La tasa de CoreValve de 9-36% es mayor que la reportada por Edwards Lifescience 3-12% (24, 26).
Los estudios previos demuestran que la injuria renal aguda post-TAVI se presenta en 12-28% de los casos (24, 26). Experiencias limitadas sugieren que la función renal puede mejorar en respuesta al aumento del gasto cardiaco una vez solucionada la EA. El deterioro renal post procedimiento generalmente es leve y reversible, pero es menos común que en pacientes operados (34).
En relación a la posibilidad de obstrucción de los ostium coronarios, el apoyo de las celdas abiertas de las THV sobre los ostium parece ser bien tolerada, sin embargo la obstrucción coronaria, muy excepcionalmente puede ocurrir a consecuencia del desplazamiento que pueden provocar las válvulas implantadas de los velos nativos sobre el ostium coronario izquierdo.
También se han reportado taponamientos pericárdicos, por lo que se requiere de un set de pericardiocentesis disponible siempre que se va a realizar este tipo de procedimientos. En nuestra experiencia tuvimos un caso de taponamiento que se solucionó con drenaje pericárdico y no determinó mayor complicación para el paciente.
ResultadosLas tasas de éxito (definida como la implantación de una válvula funcional, con el paciente sobreviviendo al procedimiento), se ha incrementado desde un 82% en las experiencias iniciales (22) a más del 95% en las series más recientes (24, 26). En nuestro centro la tasa de éxito actual es de 100%, en 16 pacientes. Con una edad promedio 81 años y un EuroSCORE logístico de 21% (Caorsi et al. manuscrito en preparación). Aparentemente cuando los pacientes son seleccionados adecuadamente, TAVI es un procedimiento reproducible y seguro. En una revisión reciente de 82 reportes, representando 2356 pacientes que recibieron THVs Edwards Lifescience y Medtronic la sobrevida a 30 días fue de 89% similar para ambas válvulas. Esta sobrevida a 30 días continúa mejorando y los últimos reportes la elevan a 93-95% (29). En nuestro centro la sobrevida a 30 días es de 93.7%, con un paciente fallecido por insuficiencia renal en que la familia decidió no dializar post TAVI (92 años de edad).
En el estudio PARTNER B los pacientes rechazados para cirugía fueron considerados prohibitivos debido a sus riesgos, estos fueron monitorizados y analizados por experimentados cirujanos de múltiples centros. A pesar de la rápida generación, sistemas de gran perfil y la mínima experiencia de los operadores con TAVI antes del estudio, la tasa de mortalidad a 30 días fue de 6.4%. Esto se compara favorablemente con el riesgo estimado de la Society of Thoracic Surgeons (STS), estimado en 11.6%. Es más la STS reporta en 46.397 pacientes operados en EE.UU. una mortalidad general de 6.4% (28). Las tasas de sobrevida a 1 año van desde 69 a 85% luego de TAVI (24, 26, 31). La mejoría de la capacidad funcional ha sido reportada en muchas series, mejorando de CF III-IV a I-II post TAVI (24, 26). El seguimiento de esta mejoría funcional a mediano plazo (2-3 años) demuestra que estos beneficios se mantienen y perduran en el tiempo.
ConclusionesLa EA degenerativa-cálcica es la patología valvular más frecuente en la población mayor de 65 años, con una incidencia de 2-7%. La EA causa un desajuste de poscarga asociado a un progresivo deterioro de la función ventricular izquierda. La implantación de una válvula aórtica, elimina la obstrucción del flujo sanguíneo de salida, eliminando el desajuste y permitiendo que la reserva de precarga normalice la fracción de eyección (si el miocardio no está dañado en forma irreversible). El inicio de los síntomas es el punto crucial actualmente en la historia natural de la enfermedad, causando muerte súbita y un dramático deterioro en el pronóstico. No debemos olvidar que pacientes asintomáticos con velocidades peak mayores de 4,5m/s también tienen mal pronóstico. Actualmente TAVI se está transformando en una terapia estándar en pacientes sintomáticos que no son candidatos a cirugía. Aún es controvertido hasta donde se desplazará la línea de indicación de TAVI, sin embargo ya son muchos los registros que han incluido pacientes más jóvenes y cuya indicación se superpone a la quirúrgica. Desde el punto fisiopatológico lo que cabe preguntarse es si actualmente solo tienen indicación de implante o cirugía pacientes sintomáticos. La respuesta a esto se obtendrá de los estudios y registros en los próximos años. Los registros son un método aceptado y recomendable para monitorizar estos procesos, en la medida que proveen información del desempeño de nuevas modalidades de tratamiento en pacientes colectivos de la “vida real” en centros no especializados. La edad promedio de nuestros pacientes en este momento supera los 81 años de edad, por lo que las decisiones se deben tomar evaluando el contexto fisiológico completo de estos pacientes, así como su deseo de mejorar no sus expectativas de vida, sino su calidad de vida. La selección cuidadosa y responsable de los pacientes, infraestructura de alta calidad, entrenamiento y acreditación formal, colaboración multidisciplinaria y la concentración de la experiencia son fundamentales para un pronóstico óptimo.
Esta es la primera vez en la historia de la cardiología intervencional en que un dispositivo se prueba en los pacientes más complejos, es decir los descartados para cirugía por su alto riesgo. De ahí se deriva el hecho que los resultados favorables hayan impactado tan fuertemente en la comunidad cardiológica mundial produciendo un cambio en la forma de evaluar estos pacientes y haciendo que progresivamente revisemos dogmas que parecían establecidos.