El Esófago de Barrett (EB) es una patología adquirida producto del reflujo gastroesofágico crónico que provoca la lesión de la mucosa esofágica normal y su reemplazo por mucosa metaplásica. La importancia clínica del EB radica en que constituye un factor de riesgo para el desarrollo de adenocarcinoma esofágico. La incidencia del adenocarcinoma esofágico se encuentra en aumento y su diagnóstico se realiza generalmente en etapas avanzadas, teniendo un pronóstico sombrío. Actualmente el objetivo es detectar el cáncer en etapas iniciales y eventualmente tratables, para lo cual se han planteado distintos protocolos de vigilancia y numerosas alternativas de tratamiento del epitelio metaplásico del esófago de Barrett. En el siguiente artículo se revisan los conceptos más recientes de manejo.
Barrett's esophagus is an acquired disease caused by chronic gastroesophageal reflux causing the injury of normal esophageal mucosa and its replacement by metaplastic mucosa. The clinical significance of Barrett's esophagus is that it constitutes a risk factor for the development of esophageal adenocarcinoma. The incidence of esophageal adenocarcinoma is increasing and its diagnosis is usually done in advanced stages, with grim prognosis. Currently the goal is to detect cancer in early, treatable stages. Different protocols have been proposed, numerous alternatives for monitoring and treating metaplastic epithelium of Barrett's esophagus. In the following article the latest management concepts are reviewed.
El Esófago de Barrett (EB) es una condición adquirida en la cual el epitelio escamoso estratificado que normalmente recubre el esófago es reemplazado por un epitelio columnar con células caliciformes o metaplasia intestinal especializada. Este tipo específico de metaplasia intestinal tiene potencial oncogénico que predispone al desarrollo de adenocarcinoma de esófago.
El EB se desarrolla como consecuencia de la Enfermedad por Reflujo Gastroesofágico (ERGE).
EPIDEMIOLOGÍAEl EB se diagnostica durante una endoscopia digestiva alta de vigilancia o en un paciente con síntomas de ERGE, la media de edad al diagnóstico es de aproximadamente 55 años. Entre los pacientes adultos que se realizan exámenes endoscópicos debido a los síntomas de ERGE, se encuentra EB largo en 3% a 5%, mientras que 10% a 20% tienen EB corto1. El EB largo es especialmente infrecuente en pacientes sin historia de reflujo. En la población adulta de occidente, la prevalencia de EB (predominantemente de segmento corto) es entre el 1,6% y el 6,8%1,2. Puede presentarse en niños, aunque rara vez ocurre antes de los cinco años. Raro en razas negra y asiática. Los datos acerca de la prevalencia en hispanos son contradictorios. La prevalencia en Estados Unidos varía ampliamente entre 0,4 y 20%, dependiendo de la población estudiada y de las definiciones usadas. La relación hombre-mujer es de aproximadamente 2-3:1. La mayoría de las condiciones asociadas con EB son también factores de riesgo para Adenocarcinoma Esofágico (ADC). Se ha descrito agregación familiar en algunos casos, sin embargo, no está claro si esto se debe a predisposición genética o a factores ambientales.
Seguramente no existe un único factor etiológico responsable del desarrollo del EB, ya que se diagnostica en menos del 10% de los pacientes con ERGE, siendo el reflujo gastroesofágico (RGE) un requerimiento necesario y quizás el más importante para su desarrollo, pero no suficiente. Además el RGE no es un marcador fiable para el EB, ya que muchos pacientes que tienen esta metaplasia no refieren historia de pirosis, especialmente la variedad de segmento corto.
Deben existir otros factores o condiciones, entre los que se incluye la predisposición genética y algunos todavía no bien conocidos, que expliquen la evolución hacia esta complicación. Por otra parte, se han identificado factores protectores para el desarrollo de EB.
TERMINOLOGÍAMetaplasia: Proceso reversible en el cual una célula adulta es reemplazada por otra célula adulta.
Displasia: También llamada neoplasia intraepitelial, es la expresión histológica de alteraciones genéticas que favorecen el crecimiento celular no regulado, se reconoce por anormalidades citológicas y arquitectónicas en biopsias esofágicas, que incluyen:
- 1)
Cambios nucleares como el crecimiento, pleomorfismo, hipercromatismo, estratificación y mitosis atípicas.
- 2)
Pérdida de la maduración citoplasmática.
- 3)
Aglomeración de túbulos y superficies viliformes.
Se clasifica como displasia de bajo grado (DBG) o displasia de alto grado (DAG), dependiendo del grado de anormalidades histológicas, con alteraciones más pronunciadas que reflejarían alteraciones genéticas más graves y mayor potencial de carcinogénesis.
PATOGENIALa secuencia precisa de eventos que llevan al desarrollo de metaplasia intestinal esofágica no está clara. Al igual que otras condiciones premalignas el EB requiere de una predisposición genética asociada a una exposición ambiental. En el EB los cambios metaplásicos son una respuesta protectora del epitelio frente a la inflamación crónica o injuria tisular, provocada por el reflujo hacia el esófago de ácido o bilis ya que las células columnares productoras de mucus parecen ser más capaces de resistir la lesión producida por el RGE que las células epiteliales escamosas nativas.
El reflujo induciría alteraciones en la expresión de factores de transcripción claves del desarrollo que llevarían a la transformación de células escamosas en células columnares o bien a la transformación de células madre (que normalmente se diferencian a células escamosas) en células columnares2.
Investigaciones recientes han sugerido que la metaplasia intestinal podría resultar de la migración proximal de las células madre cardiales3 o de la expansión de un nido de células embrionarias residuales situados en la unión esófago gástrica4.
Estudios in vitro sugieren que la exposición esofágica episódica al ácido, típica de la ERGE, puede causar daños en el ADN, estimular la hiperproliferación, suprimir la apoptosis y esto llevar a la promoción de la carcinogénesis en el EB.
Probablemente la metaplasia se presenta en distintas etapas (distintos tipos de metaplasia) que pueden coexistir en forma de mosaico, con zonas de epitelio con metaplasia cardial, metaplasia intestinal y zonas displásicas, siendo distintos períodos de una única vía, que es la secuencia metaplasia intestinal-DBG-DAG-ADC.
CARACTERÍSTICAS CLÍNICASLa metaplasia intestinal típica de EB no causa síntomas. La mayoría de los pacientes son evaluados inicialmente por síntomas de reflujo gastroesofágico como pirosis, regurgitación y disfagia. El EB largo asociado a ERGE con frecuencia variable, puede complicarse con úlcera esofágica, estenosis y hemorragia. En pacientes con ERGE sintomática, la esofagitis erosiva es un factor de riesgo independiente para EB, que confiere un riesgo cinco veces mayor en el seguimiento a cinco años5.
CRITERIOS DE DIAGNÓSTICOSPara realizar un diagnóstico correcto es necesario conocer los tres hitos que definen el Área Esófago Gástrica:
- I.
Línea Z: Cambio de epitelios o unión escamo columnar.
- II.
Unión esófago gástrica (UEG): Corresponde endoscópicamente al límite proximal de los pliegues longitudinales gástricos en insuflación parcial.
- III.
Contracción o Impronta Hiatal: Corresponde a la impresión que generan los pilares del diafragma.
El diagnóstico se realiza en base a la visualización endoscópica que muestra metaplasia columnar esofágica (en la mucosa proximal al fin de pliegues gástricos) y que se confirma con la biopsia que evidencia metaplasia columnar con células caliciformes.
El examen cuidadoso y detallado con endoscopia de alta definición ha demostrado tener mayor sensibilidad en la identificación de la neoplasia en el EB. Otros avances tecnológicos como la cromoscopia electrónica y magnificación no han demostrado un aporte en el diagnóstico. Herramientas de imagen como la autofluorescencia, endomicroscopia láser confocal y la tomografía de coherencia óptica, plantean beneficios en el diagnóstico y manejo de éstos pacientes, sin embargo, faltan investigaciones para determinar su verdadera utilidad.
La endosonografía tiene un rol establecido en la determinación de la profundidad de la invasión en el adenocarcinoma, sin embargo, estudios recientes han mostrado una limitada precisión en la delimitación del compromiso en pacientes con DAG y ADC intramucoso.
CLASIFICACIONES ENDOSCÓPICAS EN EB- -
Según longitud: Se clasifica en EB largo cuando la longitud de la metaplasia es mayor o igual a 3 centímetros y EB corto si es menor de 3 centímetros6.
- -
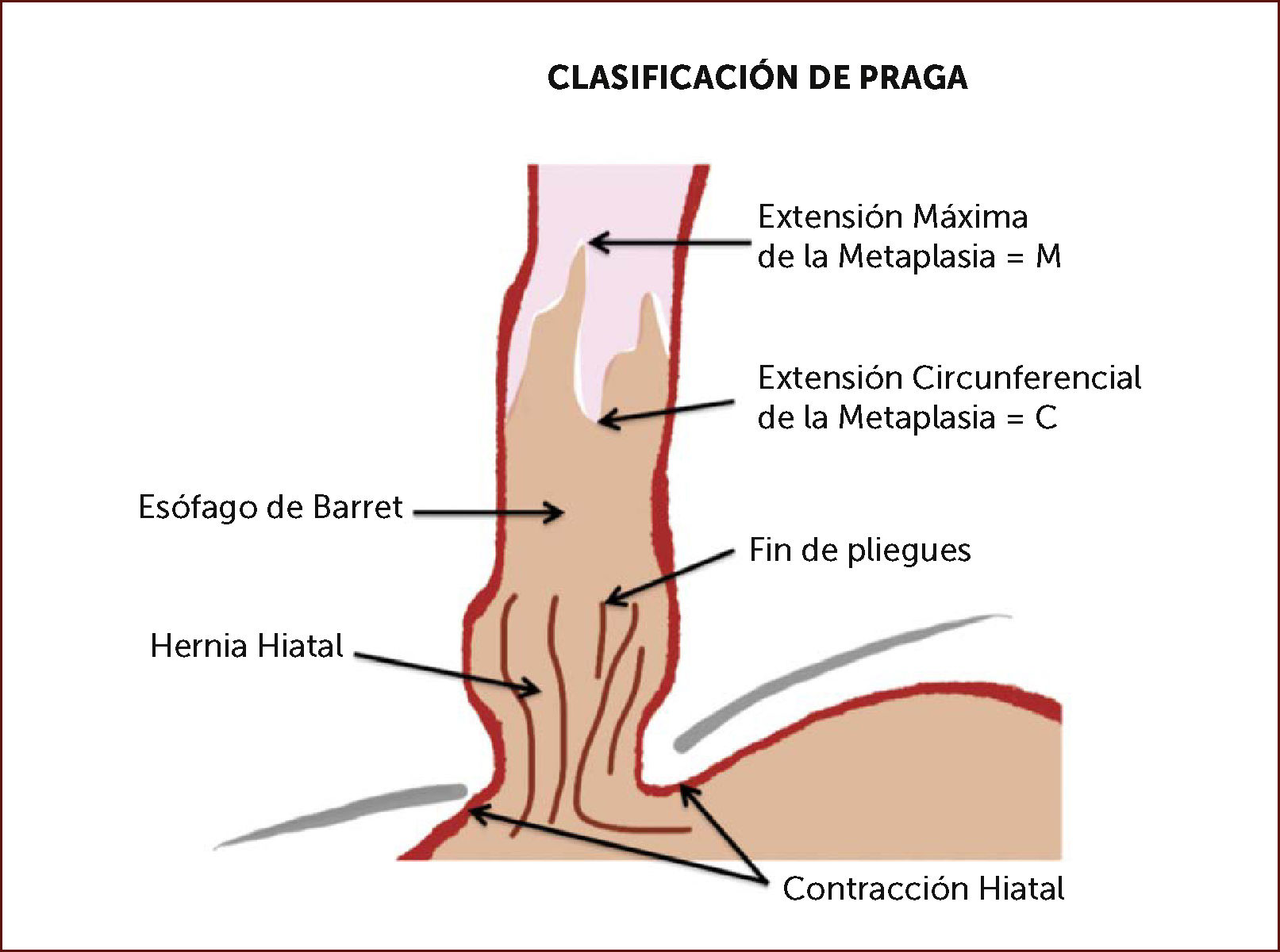
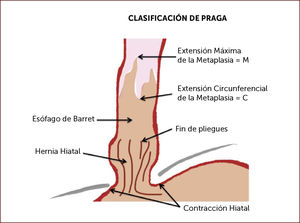
Clasificación de Praga: Caracteriza la extensión de la metaplasia incluyendo la longitud máxima de la lengüeta (M) y la extensión circunferencial (C), de forma tal de poder objetivar la magnitud de la metaplasia y su evolución en el tiempo7 (Figura 1).
- -
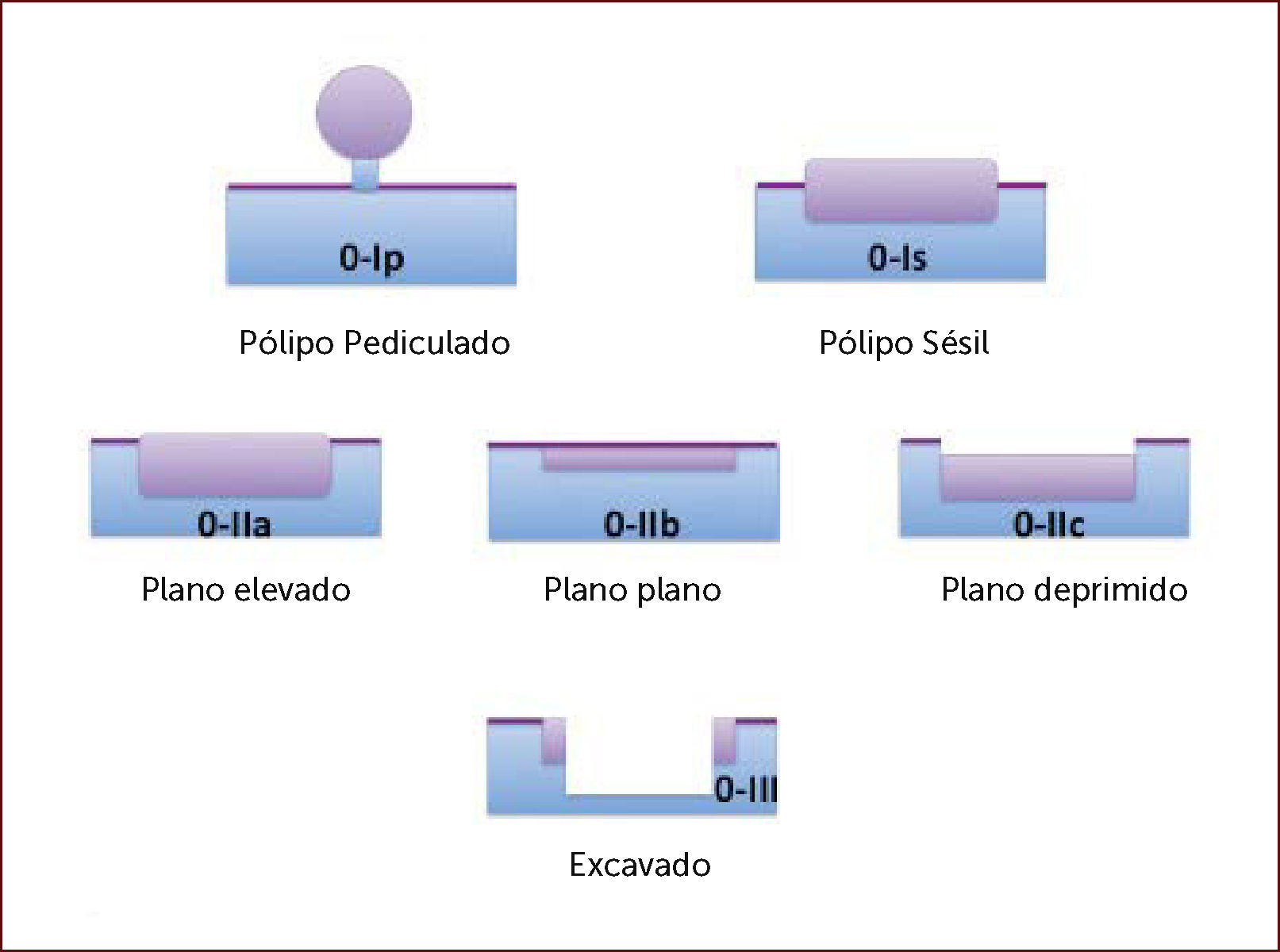
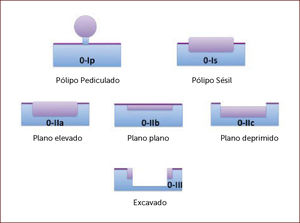
Clasificación de París: Se aplica para caracterizar las lesiones según su morfología, en elevadas, planas o deprimidas8. Todas las lesiones visibles en el segmento de Barrett deben describirse utilizando la clasificación de París (Figura 2).
La importancia de el EB radica en que la presencia de metaplasia columnar intestinal en el esófago predispone al desarrollo de cáncer de esófago.
Pacientes con EB tienen 30 a 125 más riesgo de desarrollar un ADC cuando se comparan con la población general9. Estimaciones de incidencia publicadas varían entre 0,2% y 2,9%10.
La ERGE y el EB son los principales factores de riesgo de ADC, un tumor con alta mortalidad, cuya frecuencia en Estados Unidos ha aumentado más de siete veces las últimas cuatro décadas, período en el que la ERGE y el EB ha aumentado modestamente11,12.
Hay varios factores que podrían contribuir a este aumento, como el aumento de la obesidad central, disminución de la infección por Helicobacter pylori y una dieta con mayor contenido de nitratos, provenientes de fertilizantes.
El riesgo de ADC en pacientes con EB sin displasia es de 0,1 a 0,3% por año.
Al analizar el riesgo individual aparecen otros factores por ejemplo es dos veces mayor en hombres, en segmentos largos de displasia y en pacientes con formas familiares de EB.
Los pacientes con segmentos más largos de metaplasia tienen más células en riesgo de mutación y en teoría serían más propensos a adquirir la combinación crítica de alteraciones de ADN, que resultan en la malignización. Tradicionalmente se ha dicho que el EB largo tiene un riesgo algo mayor de desarrollar un cáncer, sin embargo, no existen pruebas concluyentes13.
El riesgo de desarrollar cáncer de esófago en pacientes con EB se incrementa al menos 30 veces por encima de la población general, pero el riesgo absoluto de desarrollar cáncer es bajo.
Estimaciones de riesgo de cáncer para los pacientes con EB en base a la información disponible exponen lo siguiente:
- -
Para la población general de pacientes con EB, el riesgo de ADC de esófago es de aproximadamente 0,25% anual.
- -
Para los pacientes con DAG, la tasa de desarrollo de cáncer es de 4 a 8% por año.
- -
Para los pacientes con DBG, el riesgo de cáncer es tan mal definido que no es posible proporcionar una estimación precisa. El problema principal radica en que en algunos estudios la DBG se encuentra sobre diagnosticada, dificultando establecer su riesgo real de malignización. Presumiblemente, el riesgo es mayor que el de la población general de pacientes con EB (0,25% anual) y menor que el de los pacientes con DAG (5 a 8% anual).
Respecto a EB largo versus EB corto, datos retrospectivos sugieren fuertemente que el riesgo de cáncer para los pacientes con esófago corto segmento de Barrett es menor que la de los pacientes con enfermedad de segmento largo. Sin embargo, los pacientes con esófago de corto y largo segmento de Barrett actualmente se gestionan de manera similar.
MANEJO DEL ESÓFAGO DE BARRETTEl manejo de los pacientes con EB involucra tres componentes principales:
1. Tratamiento de la ERGE asociada
- a)
Estilo de vida y dieta
- b)
Tratamiento farmacológico
2. Vigilancia endoscópica para detectar displasia
3. Tratamiento de la displasia
- a)
Displasia de bajo grado y EB sin displasia
- b)
Displasia de alto grado
Como en otras patologías también se ha evaluado la quimio prevención para reducir la tasa de transformación maligna.
1. Tratamiento de la ERGE
- a)
Estilo de vida y dieta: Sólo la pérdida de peso y la elevación de la cabecera de la cama mejoran la pHmetría esofágica y/o los síntomas de ERGE14–16. Se sugieren la disminución de peso en pacientes con sobrepeso o que han aumentado de peso y la elevación de la cabecera en pacientes con síntomas nocturnos o laríngeos. Además abstenerse de asumir una posición supina después de las comidas y la ingesta de éstas dos o tres horas antes de acostarse, se utilizan como medidas. La modificación de la dieta no debe recomendarse de forma rutinaria en todos los pacientes con ERGE. Sin embargo, la eliminación selectiva de alimentos grasos, cafeína, chocolate, alimentos picantes, alimentos con alto contenido de grasa, bebidas carbonatadas y menta, pueden ser de ayuda.
- b)
Tratamiento farmacológico: El manejo de la ERGE en pacientes con EB se basa en principios similares a los del tratamiento de los pacientes con ERGE sin EB. Utilizando en la terapia inicial un inhibidor de la bomba de protones (IBP), con la menor dosis necesaria para mantener al paciente asintomático17. Los IBP en general eliminan los síntomas de la ERGE, pero el alivio de los síntomas no refleja con exactitud el nivel de supresión de ácido logrado.
El objetivo de la terapia con IBP, además de controlar los síntomas de reflujo, es prevenir el desarrollo de cáncer, hecho que no se ha establecido en ensayos clínicos y que sólo se basa en conclusiones indirectas, dado que la ERGE es un factor de riesgo bien establecido para el ADC esofágico. Los riesgos y beneficios potenciales de la terapia con IBP a largo plazo, en el tratamiento del EB sin síntomas de reflujo, deben ser discutidos con los pacientes, generalmente indicándose IBP como tratamiento.
Se recomienda manejar los medicamentos de acuerdo a los síntomas que refiere el paciente, no siendo necesario objetivar la presencia o ausencia de ácido en el esófago.
Estudios in vitro sugieren que la exposición esofágica episódica al ácido, típica de la ERGE podría estimular la hiperproliferación, suprimir la apoptosis y promover de esta forma la carcinogénesis en el EB. Estudios clínicos sugieren que la terapia antirreflujo agresiva podría causar regresión parcial de la metaplasia intestinal especializada en el EB, así mismo se ha asociado con un menor riesgo de DAG o ADC5.
2. Vigilancia endoscópica
La recomendación de vigilancia endoscópica en pacientes con EB se basa en el supuesto de que podría reducir la mortalidad, sin embargo, esto no se ha demostrado en ensayos prospectivos aleatorios.
El hecho que el cáncer de esófago es una causa poco frecuente de muerte en pacientes con EB, ha llevado a algunos a cuestionar la importancia de la vigilancia endoscópica, situación que está probablemente relacionada con la edad de la población analizada, ya que estos pacientes fallecen por otras comorbilidades, antes de desarrollar un ADC.
Sin embargo, antes de desestimar la importancia de la vigilancia, es importante analizar el efecto del EB sobre la mortalidad cuando es diagnosticado en pacientes más jóvenes y el dramático e inexplicable aumento en la incidencia de ADC durante las últimas décadas, asociado a las muchas variables que están implicadas, al decidir sobre un beneficio.
• Evidencia a favor de la vigilancia
La vigilancia endoscópica se realiza principalmente para detectar displasia y cánceres incipientes y asintomáticos. La velocidad a la que la metaplasia progresa a displasia y cáncer, no está clara.
Existen guías en relación al screening en pacientes portadores de ERGE que poseen más riesgo de desarrollar un EB, además de la establecida conducta endoscópica en aquellos pacientes con EB, que involucra la toma de biopsias aleatorias por cuadrantes cada 1-2cm., definiendo el seguimiento según los hallazgos de las biopsias esofágicas obtenidas.
Lamentablemente, las técnicas de muestreo de biopsias endoscópicas aleatorias para identificar la displasia, han llevado a la pérdida de toma de biopsias en zonas de displasia. También es sabido que en ocasiones cuando se detecta displasia, pueden pasar desapercibidos focos de cáncer invasivo.
Al evaluar la displasia mediante endoscopia de alta resolución, se han encontrado que ésta se asocia con alteraciones visibles de la mucosa, aunque sutiles en la mayoría de los casos. Por lo tanto, ahora se recomienda que los endoscopistas deben inspeccionar cuidadosamente el EB y biopsiar cualquier anomalía visible, además de la obtención de muestras de biopsias aleatorias.
• Marcadores Moleculares
Se ha propuesto utilizar marcadores moleculares como alternativa a la toma de biopsias al azar para buscar displasia, pero ninguno de ellos ha sido suficientemente probado para uso clínico de rutina.
• Técnicas endoscópicas
La vigilancia endoscópica del EB debe incluir una inspección cuidadosa de epitelio de Barrett con endoscopia de luz blanca y alta resolución. Las técnicas que se han propuesto para mejorar la identificación de las áreas displásicas para toma de biopsias durante la endoscopia incluyen tinción de la mucosa con colorantes vitales (cromoendoscopia), la ecografía, la tomografía de coherencia óptica, confocal y la espectroscopía de reflectancia utilizando absorción, dispersión de iluminación, fluorescencia e imágenes de banda estrecha. Aunque los estudios iniciales son prometedores, ninguna de estas técnicas aún ha demostrado proporcionar suficiente información clínica adicional (más allá de la de alta resolución, luz blanca endoscopia) para justificar su aplicación rutinaria con fines de vigilancia.
3. Tratamiento de la displasia
a) Displasia de bajo grado y EB sin displasia
Las técnicas endoscópicas para la erradicación del EB, incluyendo electrocoagulación multipolar, la terapia fotodinámica y ablación por radiofrecuencia, también se han aplicado a los pacientes con DBG o EB sin displasia. Sin embargo, la eficacia de la ablación endoscópica para la prevención de cáncer en estos pacientes no se ha establecido. Existen muchas preguntas sin respuesta sobre la durabilidad del procedimiento de ablación y la necesidad de vigilancia endoscópica después de la ablación. Debido a esto, no se recomienda el tratamiento endoscópico de rutina para pacientes con DBG o con EB sin displasia. Se sugiere para los pacientes con DBG realizar vigilancia endoscópica a intervalos de 6 a 12 meses21. Para pacientes sin displasia y sin signos endoscópicos de neoplasia se recomienda vigilancia endoscópica cada tres a cinco años.
b) Tratamiento de la displasia de alto grado (DAG) (Neoplasia intraepitelial)
Para los pacientes con DAG confirmada en el EB, en general, hay tres opciones de manejo propuestas:
- I.
Esofagectomía
- II.
Terapias de ablación endoscópica
- III.
Resección mucosa endoscópica
- IV.
Terapia de Erradicación Endoscópica Multimodal (TEEM)
La Asociación Americana de Gastroenterología (AGA) recomienda que los pacientes con DAG en EB se sometan a terapia de erradicación endoscópica con ablación por radiofrecuencia, terapia fotodinámica o resección mucosa endoscópica.
I. Esofagectomía
Consiste en la resección de la lesión premaligna, de la zona displásica y de los ganglios.
Durante décadas, los pacientes con DAG y ADC han sido tratados con cirugía que representa el tratamiento definitivo, ya que es la única terapia que elimina todo el epitelio neoplásico, neoplasia oculta y los ganglios linfáticos regionales.
El 30-50% de los pacientes sometidos a esofagectomía desarrollan al menos una complicación postoperatoria grave como neumonía, arritmia, infarto, insuficiencia cardíaca, infección de herida operatoria y filtración de la anastomosis. La esofagectomía se asocia frecuentemente con problemas a largo plazo, tales como disfagia, pérdida de peso, reflujo gastroesofágico y dumping. Técnicas mínimamente invasivas están asociados con tasas de morbilidad y mortalidad postoperatorias similares, pero con una disminución de la hemorragia, dolor postoperatorio y el tiempo de hospitalización en una unidad de cuidados intensivos. Su papel en el tratamiento del EB con DAG sigue siendo definido, pudiendo ser una opción en centros con experiencia adecuada. En una revisión sistemática que incluyó pacientes con DAG y ADC en EB, sometidos a esofagectomía con disección de los ganglios linfáticos, no se encontraron metástasis en los ganglios linfáticos en pacientes con DAG, las que si aparecieron en el 1,9% de los pacientes con ADC intramucoso. Este estudio sugiere que el riesgo de metástasis en los ganglios linfáticos para la neoplasia de la mucosa en el EB es de aproximadamente 1 a 2%, aumentando a un 20% de metástasis en aquellos tumores que se extienden a la profundidad de la submucosa18. El tratamiento endoscópico no puede curar los tumores con metástasis a los ganglios linfáticos, mientras que la esofagectomía, que por lo general consiste en la extirpación de los ganglios linfáticos locales, tiene el potencial de curar a los pacientes con este tipo de metástasis. Sin embargo, los autores sostienen que el riesgo de metástasis en los ganglios linfáticos por sí solo no garantiza la elección de la esofagectomía sobre la terapia de erradicación endoscópica, porque la esofagectomía tiene una tasa de mortalidad probablemente superior a la tasa de metástasis en los ganglios linfáticos. Además, la esofagectomía no garantiza la curación de un tumor que ya ha hecho metástasis a los ganglios linfáticos.
Debe valorarse la posibilidad de realizar cirugía antirreflujo en aquellos pacientes que tienen un mal control de los episodios de regurgitaciones o presentan manifestaciones extraesofágicas que no pueden ser controladas adecuadamente con tratamiento médico. También son candidatos a cirugía aquellos con buena respuesta a dieta y terapia antisecretora, pero que no desean continuar con ella, teniendo presente que el objetivo primordial es el control sintomático, pues no hay evidencia que la cirugía antirreflujo pueda disminuir el riesgo de progresión a adenocarcinoma.
Con el desarrollo de terapias eficaces endoscópicos, esofagectomía puede ahora a menudo ser evitada.
II. Terapias de ablación endoscópica
El objetivo principal de la terapia endoscópica es prevenir el desarrollo de un ADC invasivo mediante el tratamiento de la lesión displásica, mejorando así la sobrevida del paciente. Sin embargo, los pacientes que desarrollan displasia tienen mayor riesgo de lesiones sincrónicas de éste tipo y de lesiones metacrónicas en el segmento restante de BE, lo que ocurre hasta en el 30% de los pacientes sometidos a terapias de erradicación endoscópica18. Por lo tanto, la ablación completa de todo el segmento de Barrett debe ser la meta de todos los pacientes que desarrollen displasia o cáncer intramucoso, pero no en pacientes con ADC con compromiso submucoso, quienes por el riesgo de metástasis, deben ser sometidos a una esofagectomía12
Dentro de las terapias endoscópicas utilizadas para la erradicación están: terapias de ablación endoscópica que utilizan un fotoquímico, energía de radiofrecuencia térmica para ablación del epitelio anormal (Ejemplo: Láser KTP [Acrónimo del inglés Potassium-titanyl-phosphate laser], láser de argón, láser Nd: YAG [acrónimo del inglés neodymium-doped yttrium aluminium garnet], electrocoagulación multipolar, coagulación con plasma argón).
Después de la ablación del epitelio, los pacientes reciben IBP de manera que la mucosa lesionada se repara con el crecimiento de un epitelio escamoso nuevo. Una preocupación importante es que los procedimientos pueden no erradicar todas las células displásicas. La ablación parcial de la mucosa metaplásica puede ser reemplazada por una capa de epitelio escamoso que esconde el tejido metaplásico “enterrado”, pasando inadvertido en la visión endoscópica, se ha visto el desarrollo de ADC a partir de estos depósitos residuales de metaplasia.
Ablación por Radiofrecuencia (ARF)Consiste en la aplicación de energía térmica circunferencial, controlada, que permite la destrucción de la mucosa sobre la cual se libera. Es altamente eficaz en la erradicación completa de la displasia y metaplasia intestinal en pacientes con BE con DAG y DBG. No hay estudios randomizados que demuestren la eficacia de la ARF en pacientes con EB sin displasia. ARF se puede combinar con resección mucosa endoscópica en pacientes con lesiones visibles18,19.
Ventajas de esta técnica incluyen una entrega precisa y controlada de energía, sencillez y facilidad del procedimiento y una baja tasa de complicaciones (estenosis, hemorragia y perforación).
Terapia FotodinámicaSe basa en la capacidad de agentes químicos, conocidos como foto sensibilizadores, para producir citotoxicidad en presencia de oxígeno después de la estimulación por luz laser con una longitud de onda determinada.
Es una opción de tratamiento para la DAG, sin embargo, es de alto costo, poca disponibilidad y no está libre de complicaciones, siendo la más frecuente la estenosis esofágica (40%). Además, como sucede con otras terapias ablativas, pueden quedar zonas de epitelio metaplásico por debajo del epitelio escamoso regenerado con la posibilidad de evolucionar a un ADC. Es por esto que no constituye la primera línea para el tratamiento de la DAG, quedando reservada para pacientes con alto riesgo quirúrgico luego de discutir otras alternativas terapéuticas.
CrioterapiaLa crioterapia es una técnica sin contacto que consiste en la destrucción de epitelio metaplásico por disrupción intracelular e isquemia que se produce como consecuencia de los ciclos de congelación-descongelación utilizando nitrógeno líquido o dióxido de carbono. Esto se administra a través de un catéter que se puede pasar a través del canal de trabajo de cualquier endoscopio. Múltiples ciclos de congelación y descongelación se inducen en cada segmento del epitelio de Barrett para producir la ablación eficaz. Los ciclos de congelación y descongelación tienden a causar daño intracelular preservando al mismo tiempo la matriz extracelular, lo que produciría mínima fibrosis y menos estenosis. Datos recientes sugieren que la crioterapia es segura y eficaz en el tratamiento de la DAG20.
III. Resección mucosa endoscópica
Desde hace muchos años se realiza la Resección Mucosa Endoscópica (RME) que consiste en resecar un segmento de mucosa mediante la inyección de diferentes soluciones de la submucosa y la sección de ésta con un asa térmica asistida con otros dispositivos logrando obtener una muestra en uno o varios trozos. RME se ha convertido en una herramienta de diagnóstico y tratamiento importante en la evaluación y manejo de las neoplasias relacionadas con el BE.
Posteriormente se desarrolló la Disección Endoscópica Submucosa (DES) que consiste en una técnica de resección a través de las submucosa, que evita la resección por partes y permite obtener una pieza única de mayor tamaño y con límites verticales mejor definidos, mejorando la etapificación a través de la histopatología.
Comparado con la biopsia tradicional, la RME y DES permiten una mejor caracterización histopatológica, lo cual se ha atribuido a una muestra de tejido más grande y con menor distorsión de la arquitectura.
Riesgos reportados para ambas técnicas son: hemorragia en 0 a 46%, perforación en 1 a 5% y estenosis de 2 a 88% de los pacientes sometidos resección mucosa del segmento completo20. El riesgo se incrementa dependiendo del tamaño de la lesión resecada.
Es importante señalar que la mayoría de los estudios de RME para el tratamiento de EB han venido de un grupo de centros muy especializados y no está claro que estos resultados puedan ser duplicados. Además, tumores recurrentes se desarrollan con frecuencia después de la terapia endoscópica, especialmente si el epitelio de Barrett residual no se erradica. Basándose en estos hallazgos, si se elige si la terapia endoscópica para los pacientes con displasia o cáncer temprano en el EB, parece razonable intentar erradicar todo el epitelio de Barrett.
IV. Terapia de erradicación endoscópica multimodal (TEEM)
La TEEM consiste en una combinación de las opciones terapéuticas descritas, como la RME de las lesiones visibles o patrones anormales asociado a la erradicación de la metaplasia intestinal restante mediante el uso de técnicas de ablación de la mucosa.
Se han descrito resultados de erradicación completa en el 94,5% y una respuesta completa a largo plazo en el 94,4%. Predictores de recurrencia de metaplasia intestinal después de una TEEM son EB largo, neoplasia multifocal, resección por partes, pacientes que no recibieron terapia ablativa después de una respuesta completa inicial y la duración de más de 10 meses para lograr respuesta completa20.
Se recomienda que los pacientes con DAG y ADC intramucoso se sometan a RME de lesión visible seguido por ARF al segmento de EB restante para la erradicación completa de metaplasia intestinal.
La elección de candidatos para TEEM se basa en la presencia y grado de displasia que determina el riesgo futuro para el desarrollo de ADC esofágico. La TEEM ha demostrado ser segura y eficaz en el tratamiento de la neoplasia relacionada con EB. Se recomienda a los pacientes que desarrollan DAG y cáncer intramucoso20. ARF es la técnica ablativa preferida después RME inicial de las lesiones visibles en el tratamiento de DAG y ADC intramucoso. No hay evidencia clara de lo que pasa después de la ablación. El número necesario a tratar para prevenir un cáncer se estima en 333 pacientes por año. No está claro si los riesgos de la terapia endoscópica son mayores que los beneficios de la ablación para reducir el ya bajo riesgo de ADC esofágico.
Una complicación de cualquier TEEM es el desarrollo de metaplasia intestinal subescamosa, que continúa poniendo al paciente en riesgo de ADC. Pacientes sometidos a erradicación total de BE están en riesgo de recurrencia de metaplasia intestinal (25%) y de displasia (alrededor del 10 -15% en los pacientes sometidos a RFA) debido a estas razones, la TEEM lamentablemente, no elimina la necesidad de vigilancia.
QuimioprevenciónLos datos epidemiológicos sugieren que la aspirina y otros medicamentos anti-inflamatorios no esteroideos (AINEs), que inhiben la ciclooxigenasa (COX), pueden proteger contra el desarrollo de EB, o en pacientes con EB establecido evitar el desarrollo del cáncer. La metaplasia intestinal especializada aumenta la expresión de la COX y la inhibición de la COX-2ha mostrado que tiene efectos antiproliferativos y proapoptóticos en líneas celulares de ADC de EB. No está claro que el alto costo y los riesgos cardiovasculares de los COX-2 selectivos sean justificados para su uso clínico de rutina. La combinación de los AINEs y las estatinas también parece proporcionar protección adicional contra la progresión neoplásica en pacientes con EB5,22.
ConclusiónEl EB sin complicaciones debe estar sujeto a seguimiento, en donde la aparición de displasia determina la utilización de terapia principalmente ablativa. La presencia de neoplasia maligna focal superficial requiere de la resección de la lesión para su adecuado estudio histopatológico. En estos casos el tratamiento del EB residual es necesario. A pesar del éxito de estas terapias, los pacientes deben ser seguidos endoscópicamente en forma permanente, por el riesgo de reaparición de su enfermedad.
Los autores declaran no tener conflictos de interés, en relación a este artículo.