Siendo el cáncer la segunda causa de muerte en el mundo, las metástasis óseas son su tercera localización más frecuente, junto con la columna vertebral, ocupando el 65% de ellas. Lo anterior, sumado a una población envejeciendo y un abismante progreso en los tratamientos de quimio, radio y hormonoterapia, junto con técnicas quirúrgicas cada vez menos invasivas exige abordar este tema.
Se realiza una revisión narrativa, con la literatura actual y consensos internacionales en el área, describiendo los factores que generan las metástasis vertebrales, sus síntomas de alarma (dolor y compromiso neurológico), métodos de estudio y diagnóstico (Rx, TAC, RMN, cintigrama óseo, Pet CT, biopsia) y método de clasificación de la compresión medular.
Además, se revisan diferentes tipos de puntuación para la toma de decisión quirúrgica y se exponen las técnicas más modernas de tratamiento combinado de cirugía separación más radioterapia esterotáctica que ofrecen menor invasión al paciente con mejores resultados de control local de la enfermedad.
Being cancer the second cause of death in the world, bone metastases are its third most frequent location, along with the spine, occupying 65% of them. The aforementioned, added to an aging population and an abysmal progress in the treatments of Chemo, Radio and Hormone therapy, together with increasingly less invasive surgical techniques requires addressing this issue.
A narrative review is carried out, with current literature and international consensus in the area, describing the factors that generate vertebral metastases, their alarm symptoms (pain and neurological compromise), study and diagnostic methods (Rx, CT Scan, MRI, Bone Scan, PET CT, needle Biopsy) and method of classification of spinal compression.
In addition, different types of punctuation for surgical decision making are revised and the newer combine treatment with less invasive surgery plus Sterotactic High dose radiation is presented as the todaýs gold standard for the best local control for the Metastatic Spine Disease.
El cáncer corresponde a la segunda causa de muerte en el mundo. En EE.UU. se diagnostican un millón de nuevos casos al año, y dos tercios de ellos generará una metástasis ósea en algún momento de la evolución de la enfermedad1.
Las metástasis óseas son la tercera localización más frecuente, después del hígado y pulmón. Un 50% a un 85% de los enfermos de cáncer desarrollarán una metástasis ósea antes de morir. Estas metástasis son 40 veces más frecuentes que los tumores óseos primarios del esqueleto y el 65% de ellas se localizan en la columna vertebral2. De 5% a 10% de estos pacientes presenta algún grado de compresión medular y a su vez, cerca de un 10% de los pacientes con metástasis vertebral (MV) requerirá un tratamiento quirúrgico. Mas aún, como las tasas de sobrevida de diversos tipos de cáncer aumentan debido a nuevos y mejores tratamientos, se hace más probable que la incidencia de la enfermedad metastásica vertebral continúe en aumento. Gracias a los adelantos que vive la medicina actual (cirugía espinal, radiocirugía3 y quimioterapia), junto a nuevos y novedosos scores, que el manejo de la enfermedad metastásica del aparato locomotor y principalmente de la columna vertebral (desde siempre un desafío diagnóstico y terapéutico), que se ha logrado simplificar el camino hacia un mejor tratamiento el cual será específico para cada paciente en particular.
Al tratarse de un paciente que está muriendo, la calidad de vida es relevante y prioritario, por lo tanto, la decisión de manejo debe ser la mejor, pero sin hacer demasiado; esto significa evaluar críticamente desde una gran cirugía hasta el tratamiento paliativo.
Todo paciente portador de cáncer que refiera dolor en algún sitio de su columna vertebral debe ser estudiado en busca de metástasis para iniciar un tratamiento oportuno y manejado por un equipo multidisciplinario (oncólogo, radiólogo, radio terapeuta, cirujano de columna). La evaluación imagenológica se realiza con resonancia magnética nuclear (RMN) y el PET–CT, como estudios de elección, pero la radiología simple y la TAC siguen siendo también de gran utilidad.
Revisiones de autopsias confirman que un 70% de los pacientes con enfermedad metastásica tienen compromiso tumoral espinal al momento de su muerte4. La región toraco-lumbar concentra el 70% de ellas, el segmento lumbosacro el 22% y la columna cervical el 8%5.
Las MV se presentan entre la 5ª y 6ª década de la vida, sin diferencias por sexo, siendo los órganos de origen mama, pulmón, próstata, riñón y tiroides, quedando alrededor de un 13% de los casos en que el tumor primario es desconocido.
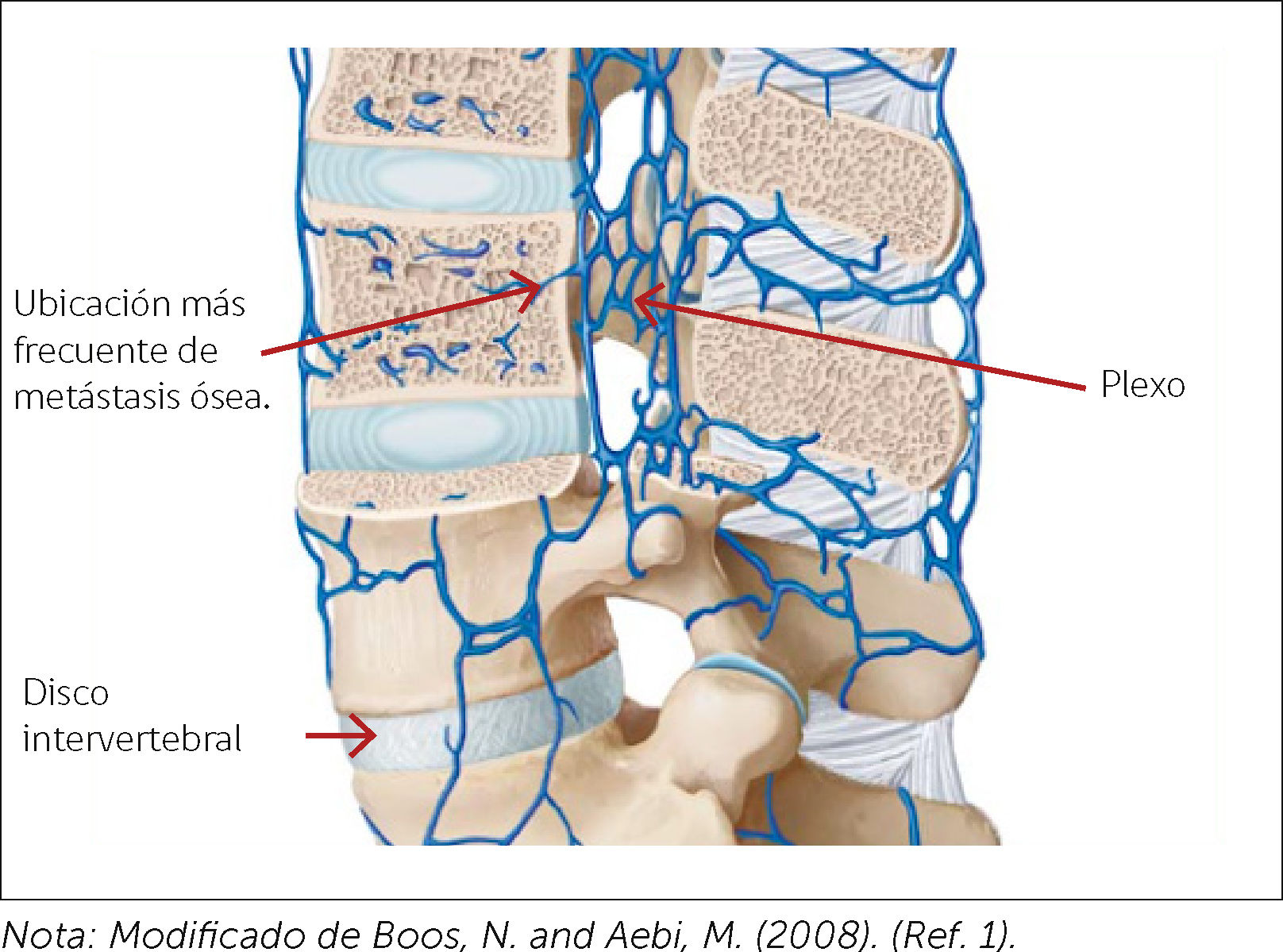
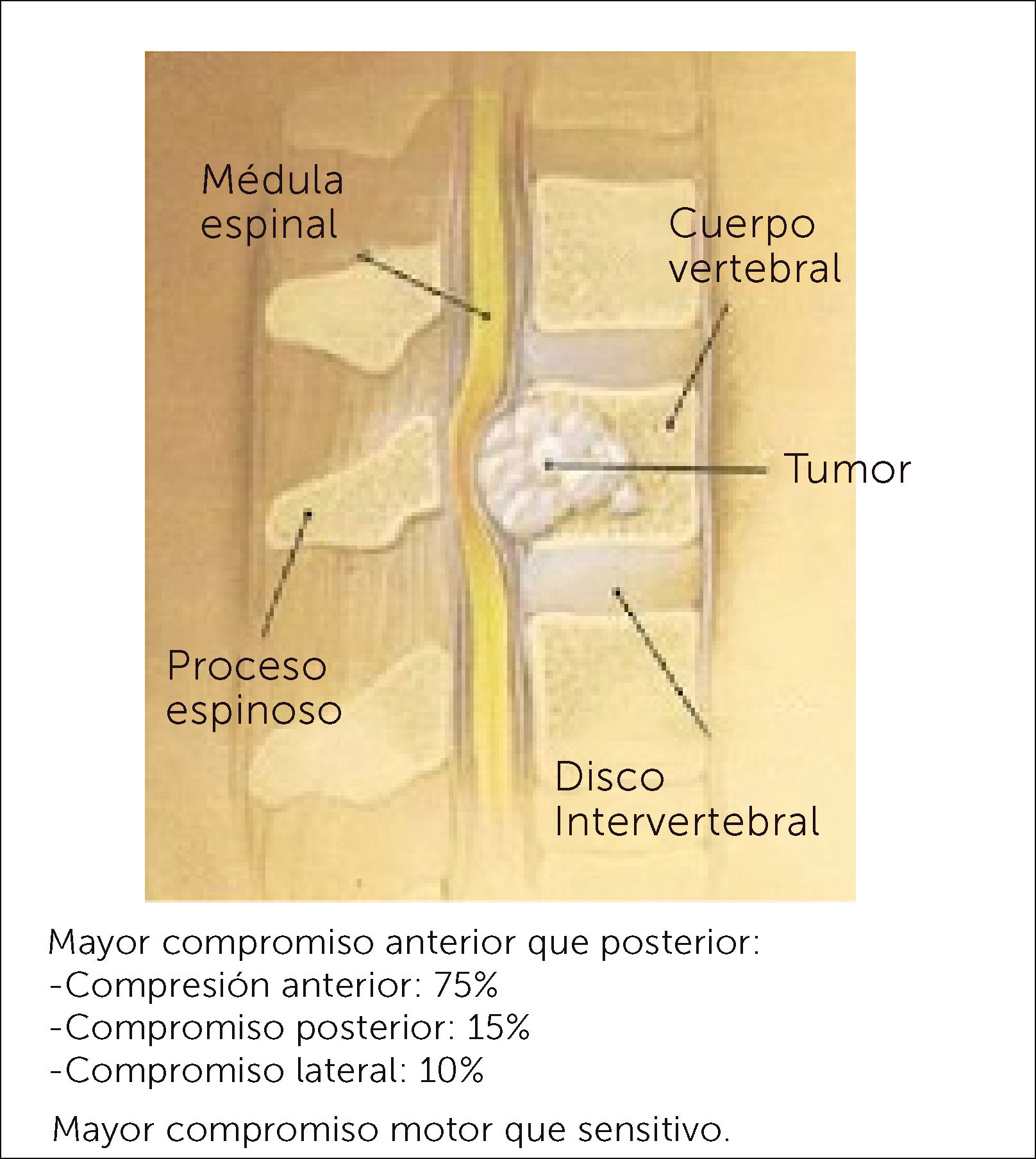
Las MV se producen principalmente por diseminación hematógena, siendo la presión retrógrada que tiene el plexo de Batson la que permite la diseminación de células metastásicas hacia este plexo venoso y de ahí al cuerpo vertebral (Figura 1); es por esto, que la mitad posterior de este último se hace más vulnerable a la invasión tumoral metastásica. Menos frecuente es encontrarlas en el arco posterior, y no existe diferencia alguna en la invasión tumoral de la parte superior y/o inferior del cuerpo vertebral. Es por esta misma razón que el compromiso neurológico, al estar más comprometido el aspecto posterior del cuerpo vertebral, será fundamentalmente compromiso motor, por compresión de los cordones anteriores de la médula espinal6 (Figura 2). También existe metástasis por vía arterial, invasión local y linfática.
2CUADRO CLÍNICO2.1DolorSi bien es cierto, las MV pueden ser asintomáticas por mucho tiempo y aproximadamente un 35% de ellas ser diagnosticadas en forma incidental7, la gran mayoría de los pacientes consultan por dolor, el cual está presente en un 83 a 95% de estos pacientes y típicamente precede al desarrollo de síntomas neurológicos8.
- •
Dolor nocturno
- •
Dolor continuo y localizado en la zona de la lesión
- •
Progresivo en el tiempo
- •
Aumenta con los movimientos y maniobras de valsalva.
- •
Puede tener distribución radicular
El dolor en estos pacientes se produce por tres diferentes mecanismos: crecimiento tumoral intraóseo, extraóseo hacia tejidos vecinos paravertebrales e intracanal (compresión medular o radicular)9. El dolor se genera por el aumento de presión intraósea, expansión perióstica e invasión de tejidos vecinos. Se genera también por fractura en hueso patológico y por inestabilidad vertebral secundaria a la fractura.
El dolor radicular seguirá el dermatoma correspondiente a la raíz nerviosa comprometida con o sin compromiso motor. Si la compresión es a nivel medular, el dolor, el compromiso motor y/o sensitivo dependerá del nivel donde se encuentre el tumor.
El dolor por insuficiencia mecánica es más intenso y varía según las cargas mecánicas del segmento tumoral. Aumenta con la carga axial y con los cambios de posición y disminuye con el reposo. Responde mal a los tratamientos con analgésicos, corticoides o radioterapia (Rt).
El dolor generado por el crecimiento de la masa tumoral es en general manejado por AINES, analgésicos, corticoides y Rt. Sin embargo, el dolor por compresión neurológica o por inestabilidad mecánica generada por la invasión tumoral vertebral debe ser manejado con cirugía.
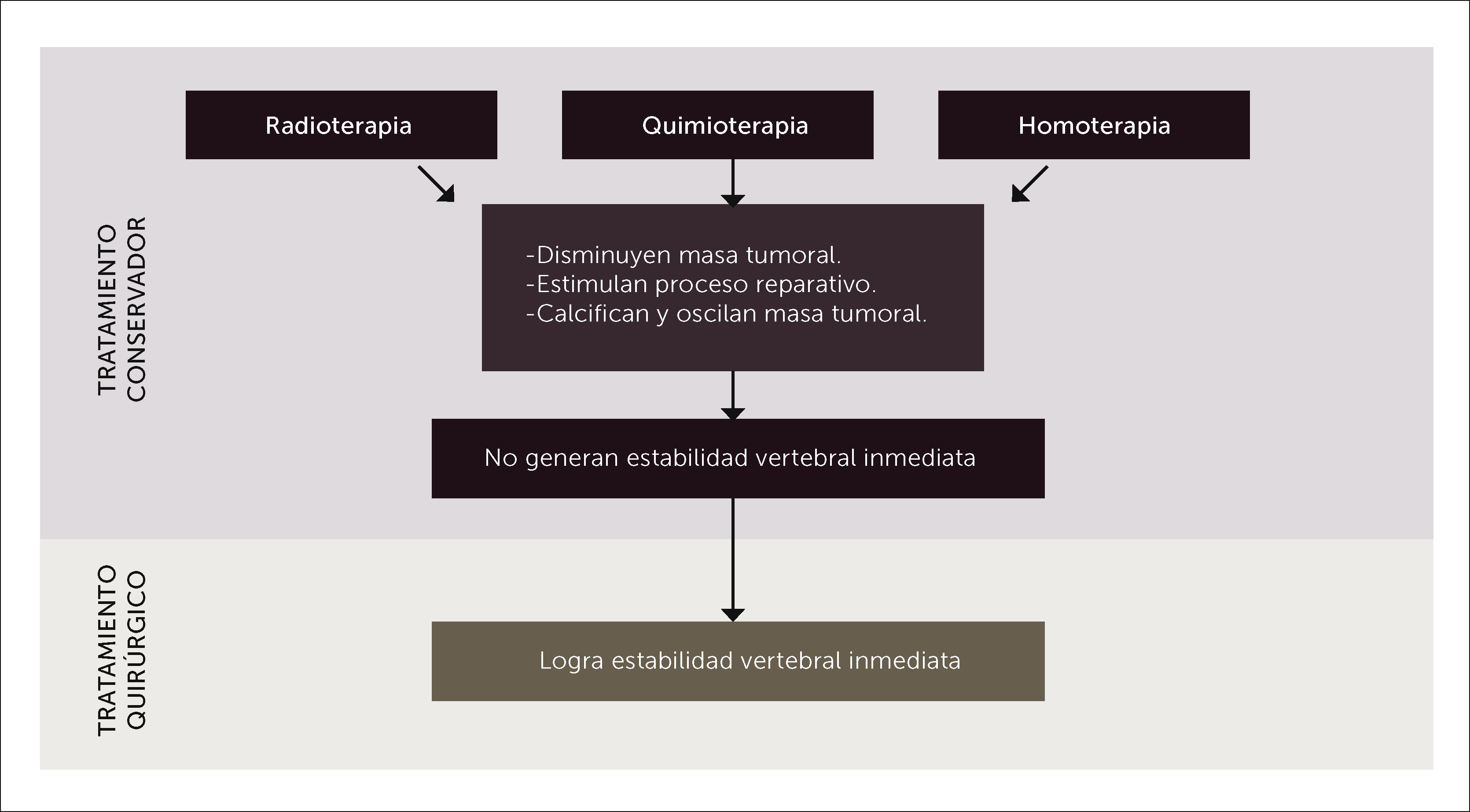
La quimioterapia (Qt), Rt y hormonoterapia si bien es cierto son excelentes armas terapéuticas en el tratamiento de las MV, ellas no generan la estabilidad mecánica que logra la cirugía, ni tampoco logran descomprimir la médula ni las raíces nerviosas.
2.2Compromiso neurológicoAlrededor de un 5–10% de los pacientes con MV generarán una compresión medular y/o radicular; por lo tanto, debe hacerse énfasis en la historia clínica y el examen físico buscando alteraciones sensitivas, motoras, vesicales o esfinterianas, para luego relacionar estos síntomas y signos con la imagenología existente y evaluar así el grado de compresión medular.
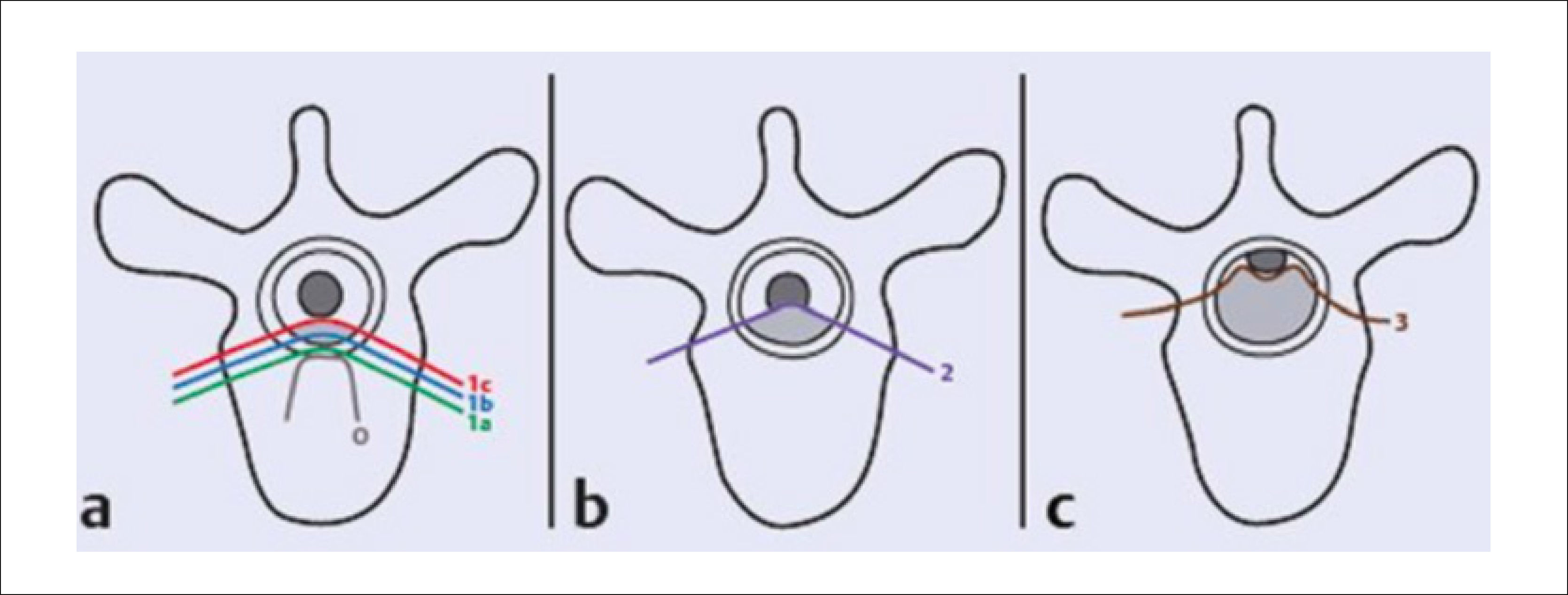
Para clasificar el grado de compresión neurológica, el “Spine Oncology Study Group” (SOSG) de la AOSpine ha desarrollado un esquema de puntuación para describir el grado de compresión medular (Figura 3)10.
Clasificación de la compresión medular, según AOSpine. Se evalúa en corte transversal T2 de RMN en nivel de máxima compresión medular. (a) Grado 0=Tumor intra óseo; Grado 1a=Contacto epidural sin deformación del saco tecal; Grado 1b=Deformación del saco tecal sin contacto medular; Grado 1c=Contacto medular sin compresión. (b) Grado 2=Compresión medular con presencia de LCR peridural. (c) Grado 3=Comp. medular sin LCR visible. Nota: Tomado de Vialle LR. (Ref.10).
A todo lo anterior agregar el compromiso multisistémico de estos pacientes, fiebre, compromiso del estado general, pérdida de peso, sudoración nocturna etc., que obliga también a un manejo multidisciplinario.
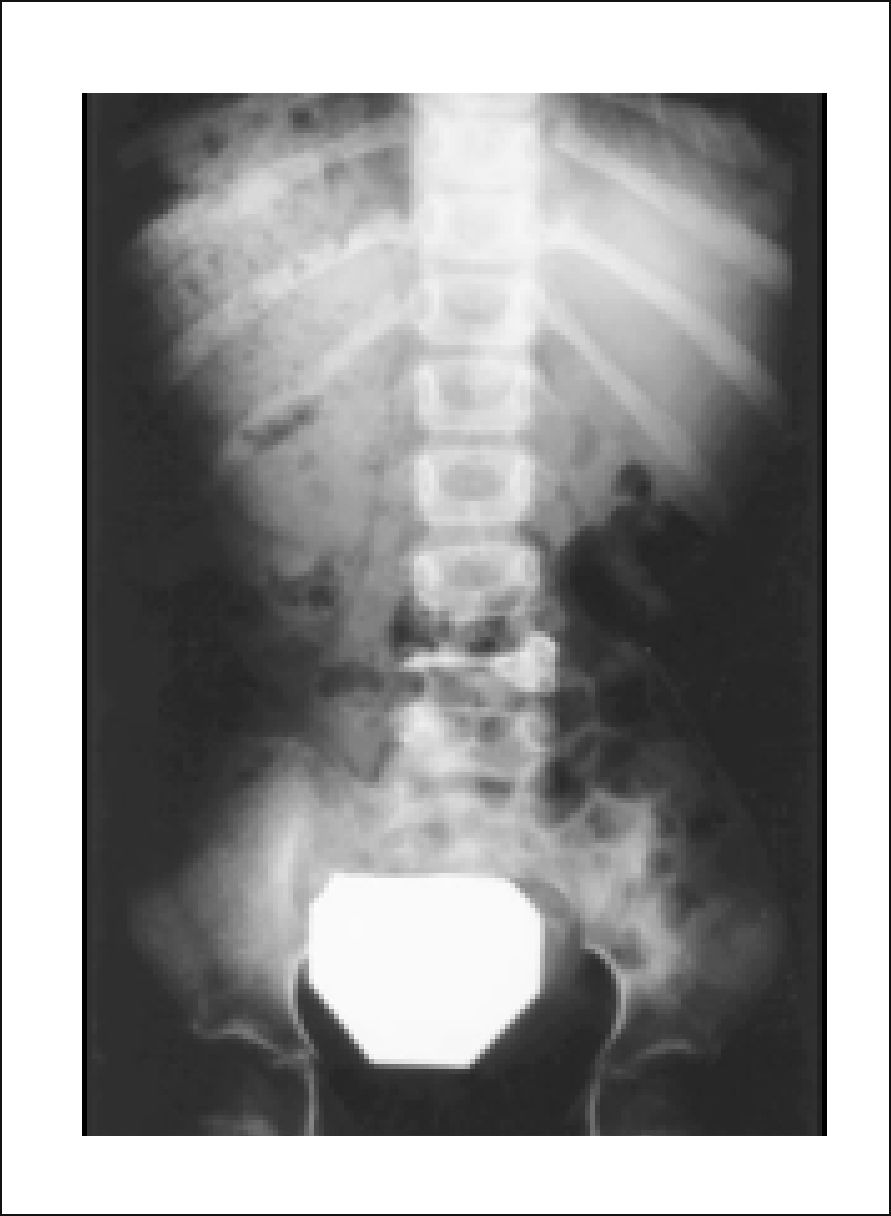
3DIAGNÓSTICO3.1Radiología SimpleLa radiología (Rx) simple requiere entre un 30% a 70% de compromiso tumoral del cuerpo vertebral para poder identificar una lesión lítica vertebral tumoral.
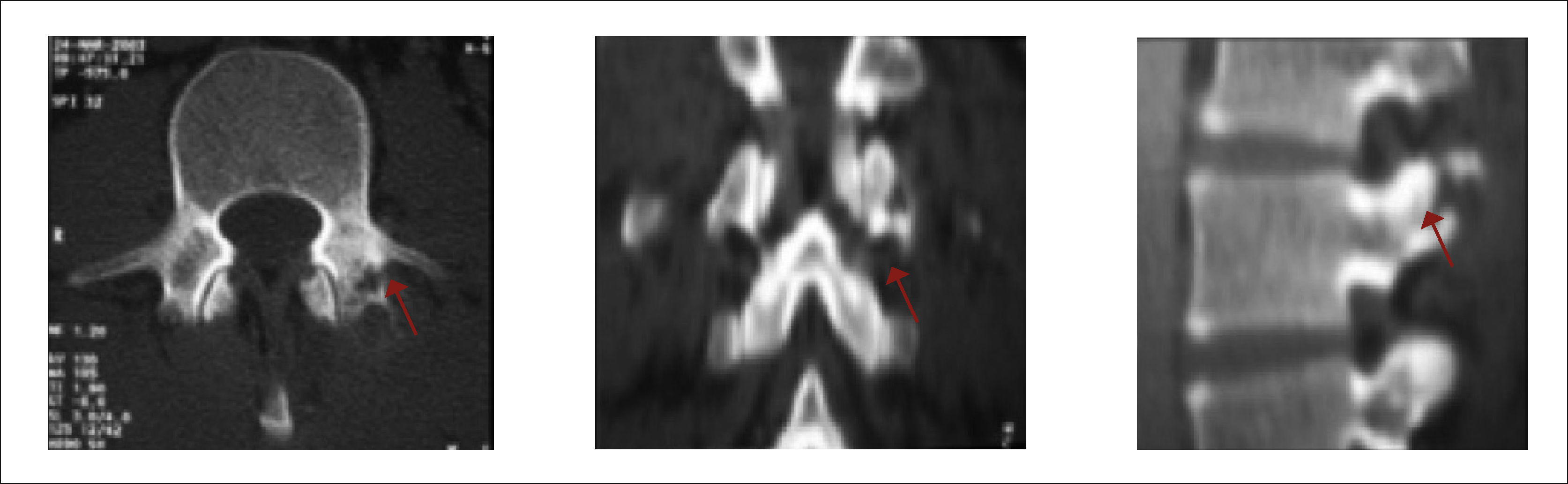
Se describe la clásica imagen del “Búho Tuerto” que es la desaparición de la imagen de un pedículo en la proyección anteroposterior de la Rx (Figuras 4 y 5)12.
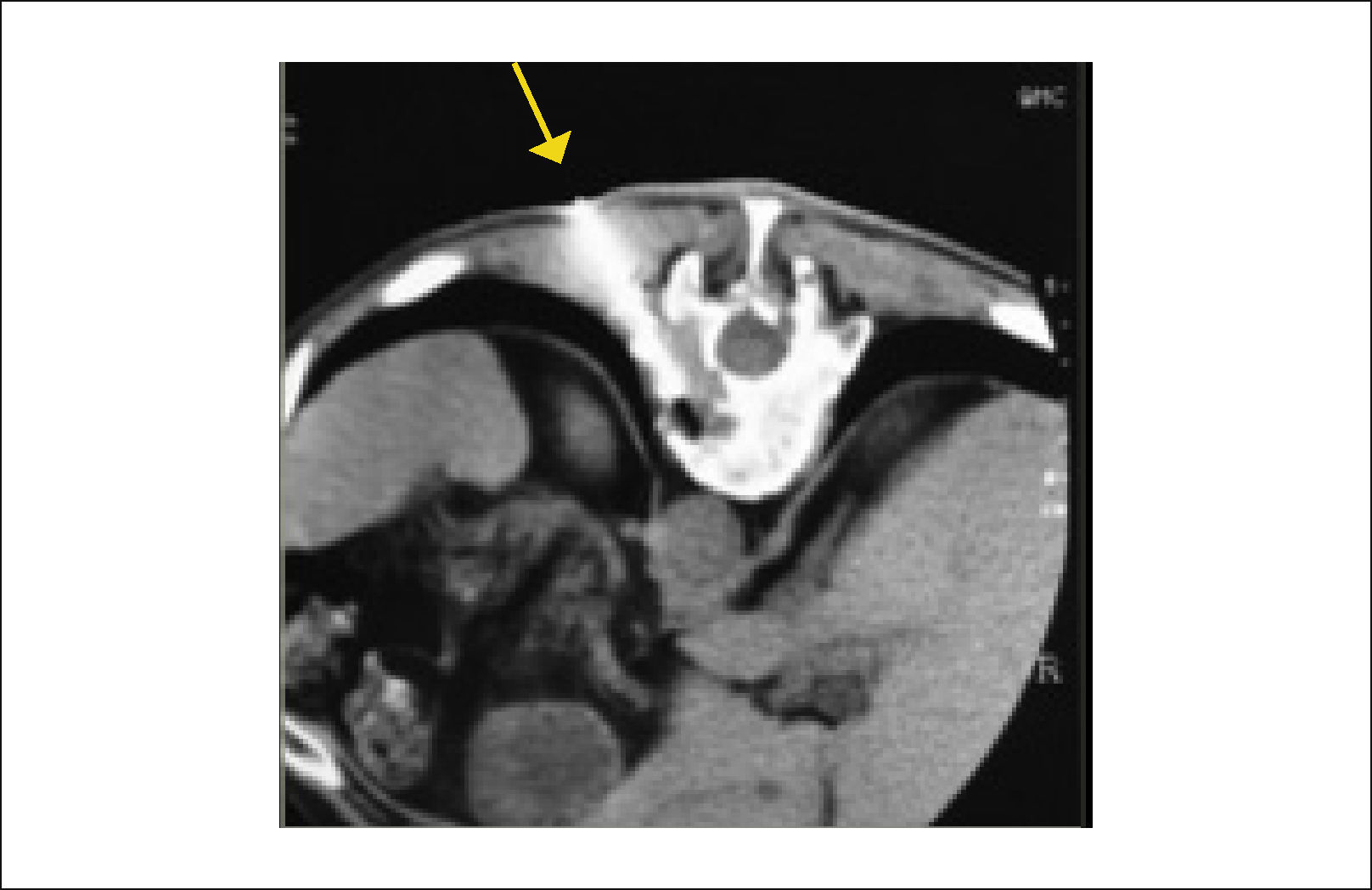
3.2Tomografía ComputadaLa tomografía computada (TC) es de gran utilidad para evaluar la magnitud del compromiso óseo; es mejor que la RMN para confirmar el daño cortical (Figura 6).
En la evaluación de las metástasis vertebrales su mayor utilidad está dada en las reconstrucciones para la planificación quirúrgica y en la guía de biopsia. La TAC tiene una sensibilidad que alcanza solo un 66% y una especificidad de un 89% para lesiones tumorales13. También es utilizada como screening la TC de Tórax, Abdomen y pelvis y muy útil en toma de biopsias y embolizaciones pre operatorias.
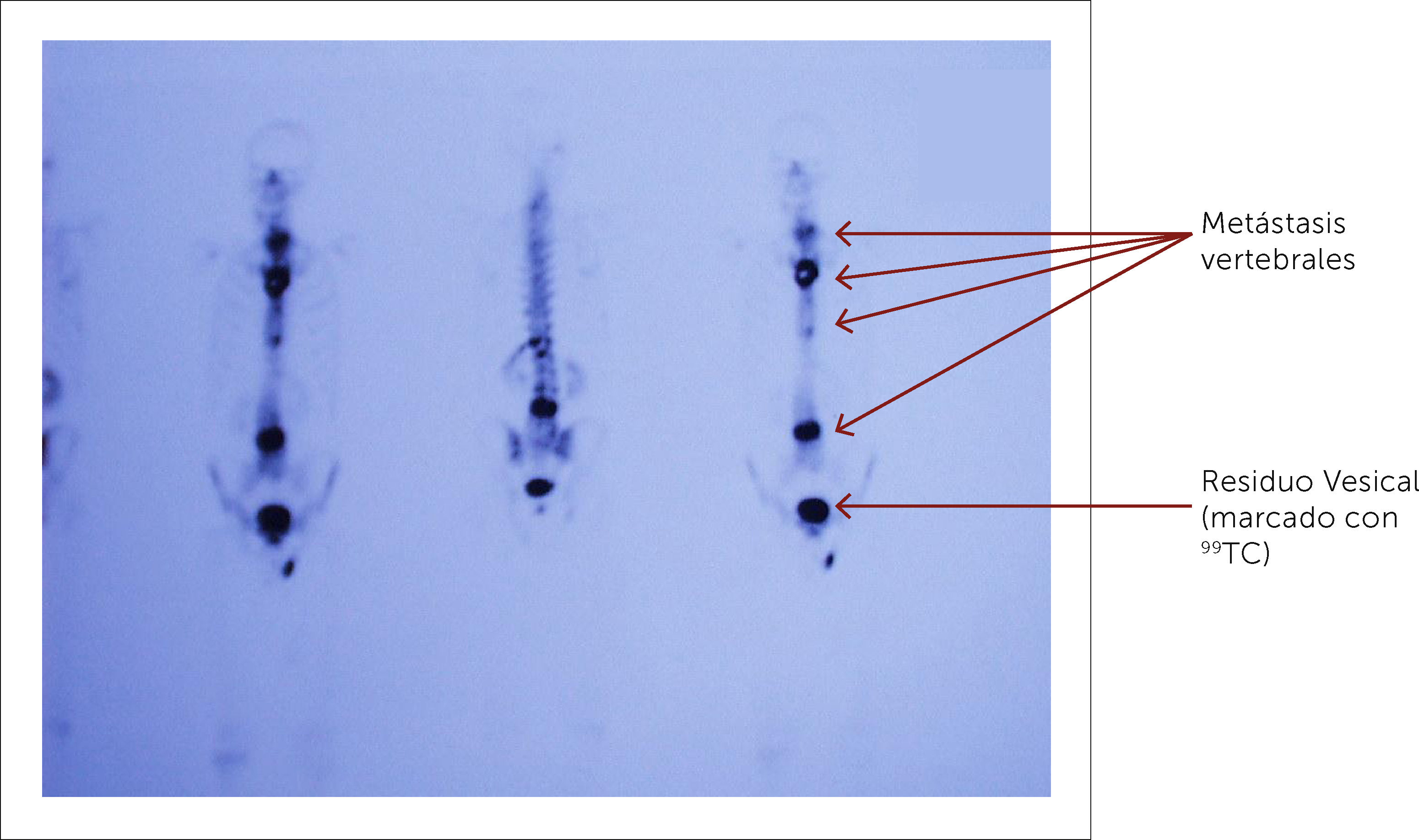
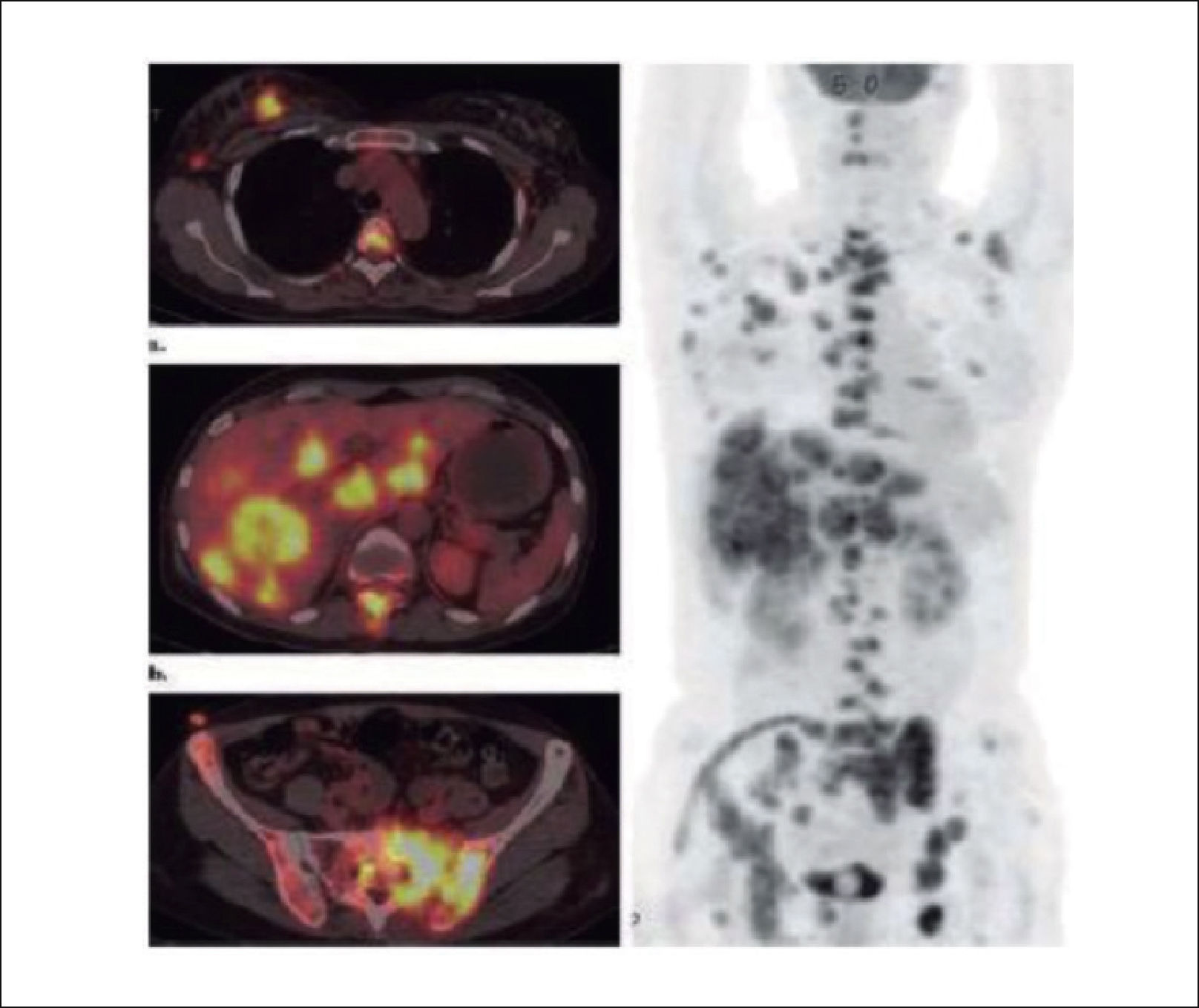
3.3Cintigrafía óseaEl cintigrama óseo aún es muy utilizado para el estudio de metástasis múltiples y para evaluar la respuesta de la enfermedad a los tratamientos con Qt y/o la progresión de la enfermedad. Normalmente precede a la imagen de Rx por alrededor de un año (Figura 7)14. Es también de utilidad para evaluar el tratamiento ya que las metástasis tratadas satisfactoriamente normalizan en la cintigrafía.
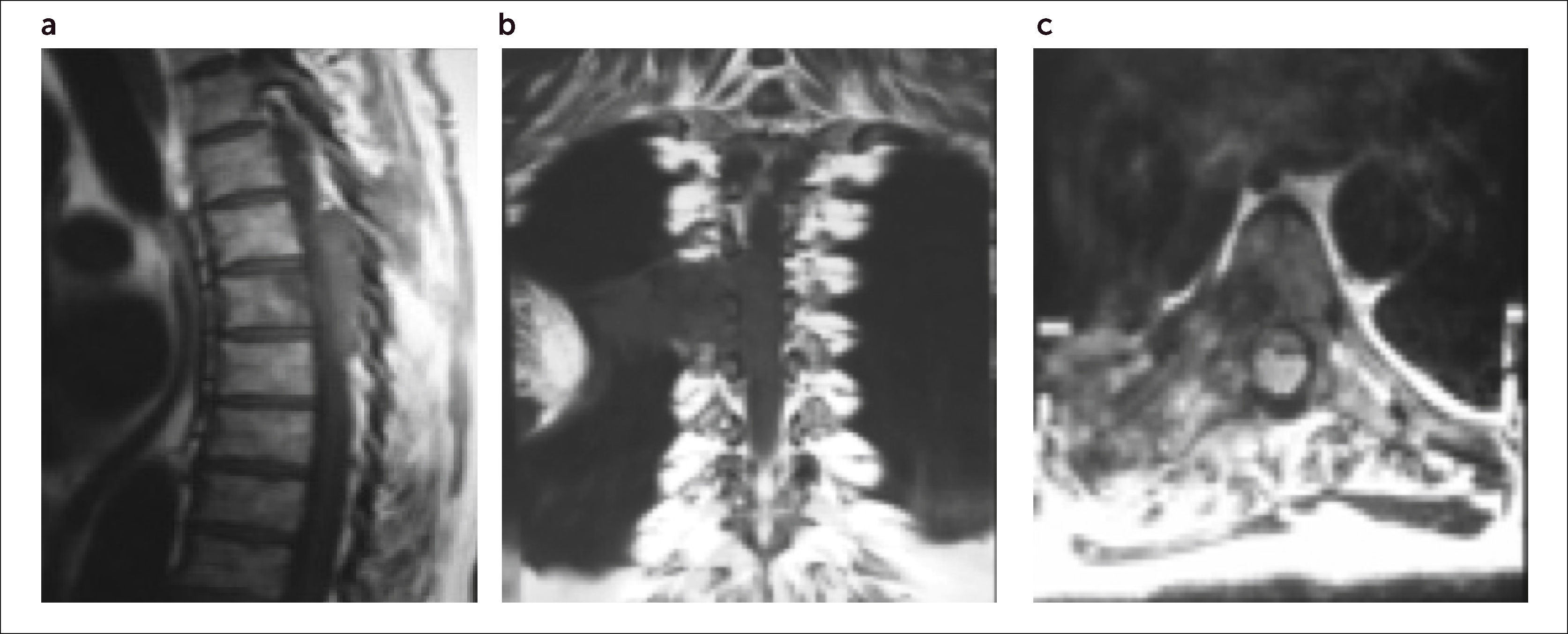
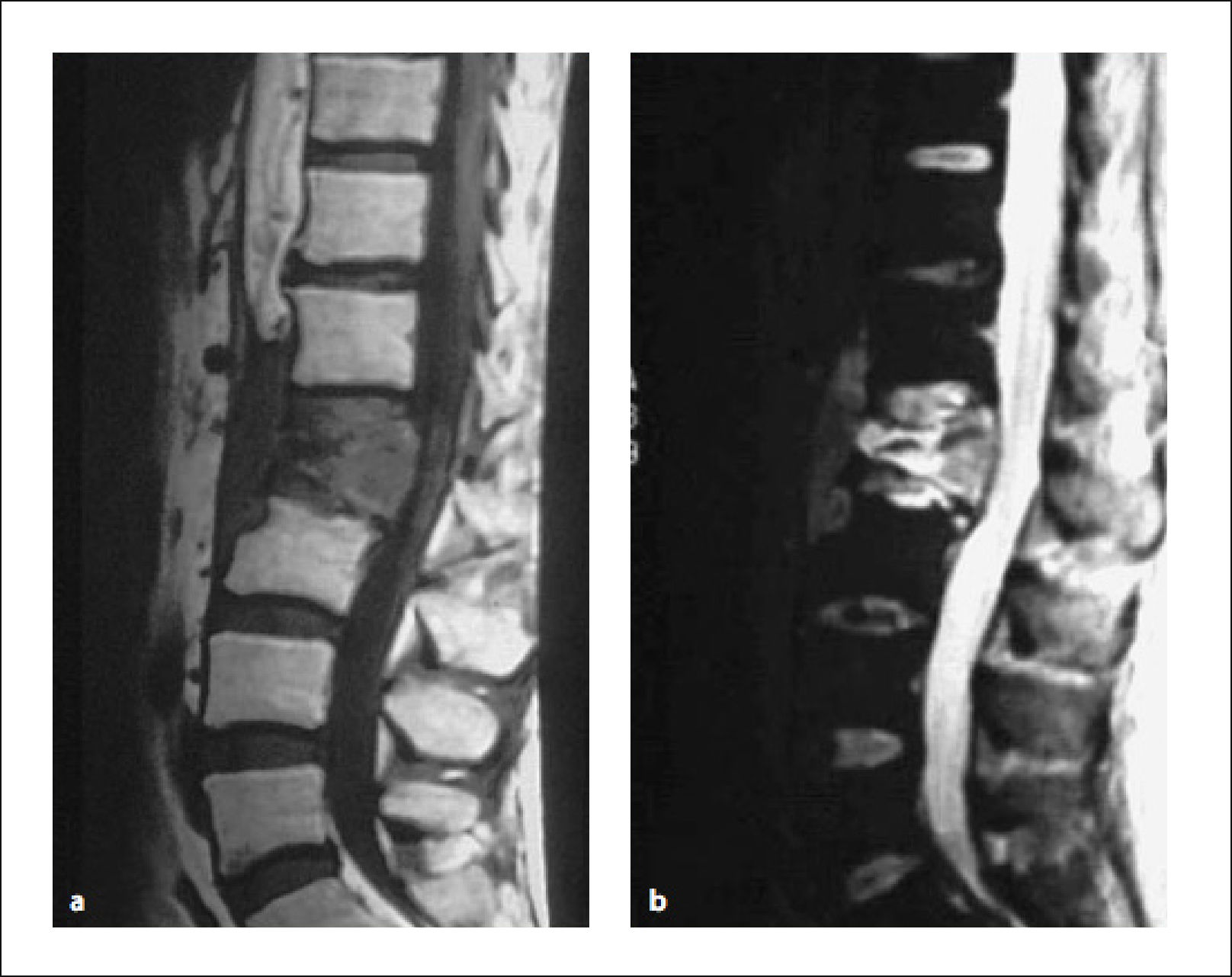
3.4Resonancia Magnética (RMN)Hoy en día es, junto con la aparición del PET–SCAN, el método imagenológico de elección para el diagnóstico, estudio y seguimiento de las metástasis vertebrales13.
Permite, con un examen de escaso disconfort para el paciente, una información de alta sensibilidad y especificidad en el estudio de los tumores del esqueleto.
Da información del tamaño y localización del tumor, destrucción ósea, invasión paravertebral de partes blandas y de los grandes vasos vecinos, número de lesiones metastásicas, e invasión del canal raquídeo y compresión neural (Figura 8).Figura 9
Los signos característicos que sugieren MV en RMN, y este examen tiene una sensibilidad de 98,5% y especificidad de 98,9%.
- •
Reemplazo de la médula ósea con disminución de señal en T1 y aumento en T2
- •
Preservación del disco intervertebral tanto en T1 como en T2
- •
Compresión medular en T1
- •
Compresión del espacio subraranoídeo en T2
- •
Captación del contraste en el cuerpo vertebral.
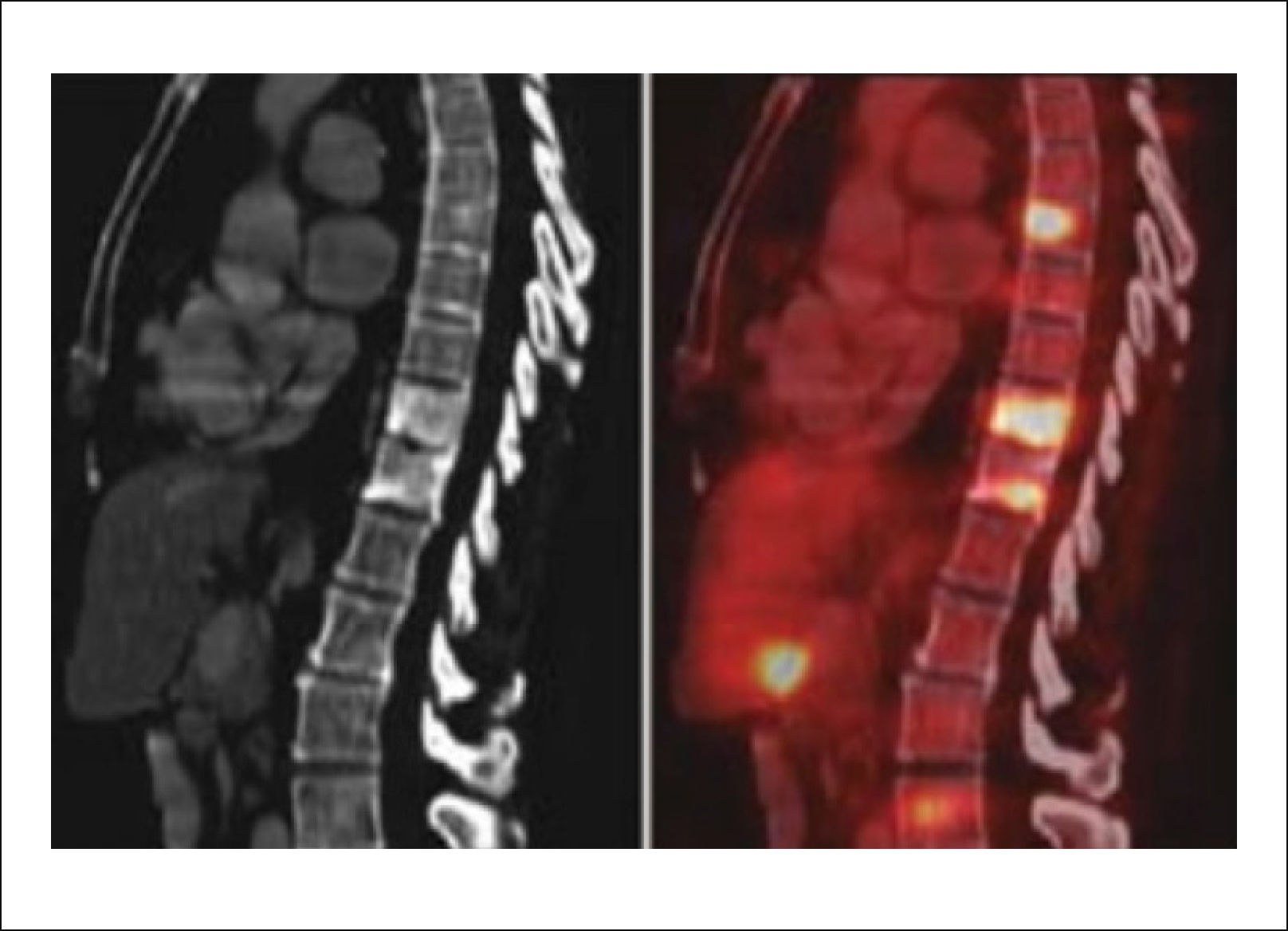
Es similar a la RMN en su sensibilidad, permite evaluar metástasis óseas y viscerales, entrega una imagen corporal que evalúa la diseminación tumoral y es excelente en evaluar la progresión de la enfermedad y de esta forma conocer la respuesta de ella a los tratamientos (Figuras 10 y 11).
3.6BiopsiaEl diagnóstico definitivo será la histología del tumor, para lo cual es ideal saber el órgano de origen y tomar una biopsia de dicha zona, o bien, de la metástasis en otros órganos, ganglios o una biopsia ósea. Esta última puede ser excisional cuando se trata de una lesión limitada al arco posterior, o puede ser abierta, lo cual permite una buena muestra, pero es más contaminante y de preferencia por punción bajo TAC (Figura 12) o bajo navegación16. El diagnóstico definitivo es entregado por la biopsia vertebral.
4TRATAMIENTOLos objetivos del tratamiento de las metástasis vertebrales son:
- •
Calmar el dolor
- •
Mejorar o revertir el compromiso neurológico
- •
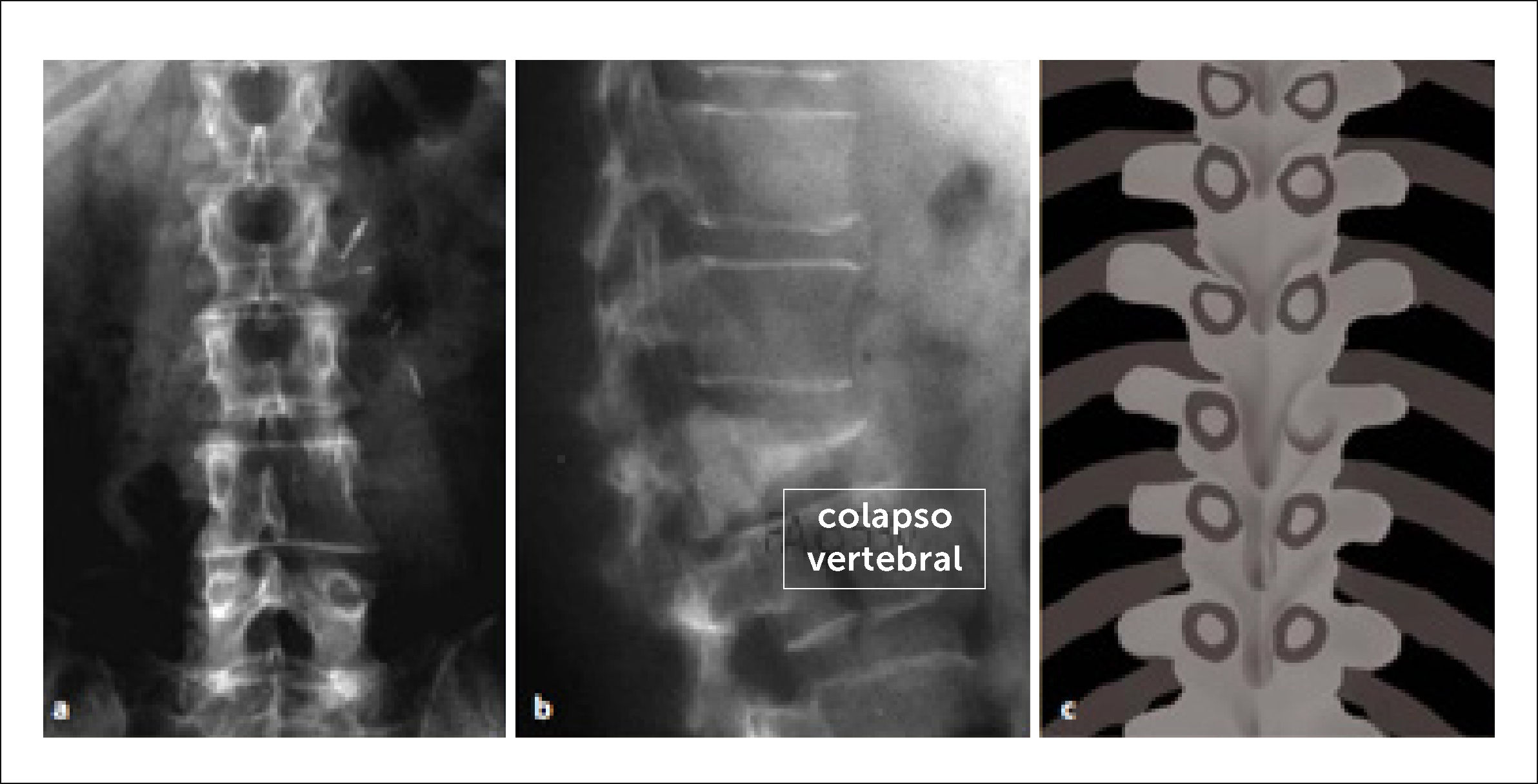
Corregir la inestabilidad y deformidad espinal generada por el colapso vertebral
- •
Mejorar la enfermedad en caso de que sea posible con la Rt y/o Qt (o la cirugía cuando se trata de una MV única)
- •
Mejorar la calidad de vida remanente que le queda al paciente.
Ayudan a mejorar el compromiso neurológico de instalación aguda disminuyendo el edema peritumoral y ayudan al manejo del dolor.
4.2DenosumabEn general los bifosfonatos y en especial el denosumab se utilizan para mejorar la suficiencia ósea de los tumores vertebrales; producen calcificación de la masa tumoral y en algunos casos la disminuyen. Ellos previenen la reabsorción ósea osteoclástica y disminuyen el riesgo de fractura.
4.3RadioterapiaTerapia ampliamente usada en el tratamiento de las metástasis vertebrales, útil en el alivio del dolor en cercano al 80% de los casos y reducción del volumen tumoral en tumores radiosensibles, de lento crecimiento, sin compromiso neurológico y que no existe inestabilidad espinal. La radioterapia convencional paliativa usualmente se ve limitada por la incapacidad de entregar grandes dosis debido a la toxicidad medular. En este aspecto avances significativos y cambios en el paradigma han sido establecidos desde el advenimiento de la radiocirugía estereotáctica (SRS), que permite la entrega de grandes dosis de radiación, evitando la toxicidad medular, con una probada precisión, y que ha prácticamente eliminado la clásica diferenciación entre histologías más o menos radiosensibles. Acá cobra relevancia la cirugía de separación, procedimiento por el cual se separa el saco dural del tumor unos milímetros, permitiendo la administración de radiocirugía estereotáctica de forma segura1,3,10,16.
4.4QuimioterapiaCada vez más específica a células objetivo que permite un tratamiento dirigido y con mejores resultados.
4.5Tratamiento QuirúrgicoEs el tratamiento de elección toda vez que se trata de (Figura 13):
- •
Dolor intratable.
- •
Compromiso neurológico progresivo.
- •
Tumor radio resistente (Rt convencional).
- •
Inestabilidad espinal.
- •
Metástasis única.
- •
Mala respuesta a la Rt y/o Qt.
Todos los tratamientos de la enfermedad tumoral metastásica se basan en un manejo multidisciplinario que incluye a las diferentes terapias, siendo cada una de ellas fundamentales para ofrecer la mejor alternativa al paciente. Sin embargo, hay que tener presente que la cirugía es la única capaz de generar estabilidad espinal inmediata para aquellos pacientes con compromiso neurológico progresivo o inestabilidad espinal.
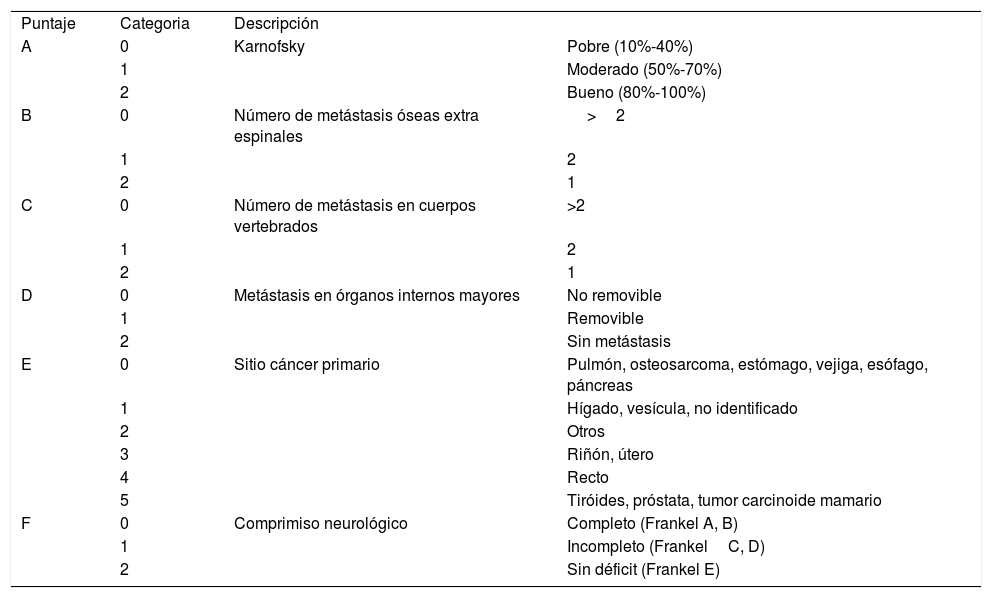
Debido al creciente número de pacientes con metástasis vertebrales, a los múltiples tratamientos existentes y a la necesidad de ofrecer el tratamiento adecuado para cada paciente dependiendo de su condición física y de las expectativas de vida, se han utilizado diferentes clasificaciones, siendo la más utilizada el score de Tokuhashi (Tabla 1) que se basa en seis parámetros1,18,19. (menos utilizado en la actualidad).
- •
Estado general del paciente (Karnofsky)1,20.
- •
Número de MV.
- •
Metástasis en órganos extra espinales.
- •
Metástasis en órganos mayores.
- •
Tumor primario (sobrevida).
- •
Compromiso Neurológico (Frankel).
Score Tokuhashi revisado
| Puntaje | Categoria | Descripción | |
| A | 0 | Karnofsky | Pobre (10%-40%) |
| 1 | Moderado (50%-70%) | ||
| 2 | Bueno (80%-100%) | ||
| B | 0 | Número de metástasis óseas extra espinales | >2 |
| 1 | 2 | ||
| 2 | 1 | ||
| C | 0 | Número de metástasis en cuerpos vertebrados | >2 |
| 1 | 2 | ||
| 2 | 1 | ||
| D | 0 | Metástasis en órganos internos mayores | No removible |
| 1 | Removible | ||
| 2 | Sin metástasis | ||
| E | 0 | Sitio cáncer primario | Pulmón, osteosarcoma, estómago, vejiga, esófago, páncreas |
| 1 | Hígado, vesícula, no identificado | ||
| 2 | Otros | ||
| 3 | Riñón, útero | ||
| 4 | Recto | ||
| 5 | Tiróides, próstata, tumor carcinoide mamario | ||
| F | 0 | Comprimiso neurológico | Completo (Frankel A, B) |
| 1 | Incompleto (FrankelC, D) | ||
| 2 | Sin déficit (Frankel E) |
0-8: Sobrevida >6 meses. 9-11: Sobrevida entre 6 a 12 meses. 12-15: Sobrevida >1 año. Nota: Traducido de Tokuhashi Y et al. (Ref. 19)
En nuestra experiencia una sobrevida menor de seis meses implica solo tratamiento quirúrgico paliativo: calmar el dolor y mejorar o evitar el compromiso neurológico.
Al igual que en la literatura, fue en extremo importante en nuestra casuística21 evitar el compromiso neurológico para ofrecer una mejor calidad de vida a nuestros pacientes en el tiempo de vida remanente. En un trabajo realizado por nuestro equipo, se describió que, del grupo de pacientes neurológicamente indemne al momento de la cirugía, el 65% de ellos desarrolló compromiso neurológico y el 70% de ellos fue deambulante hasta su fallecimiento. Del grupo que presentaron paraparesia al momento de la cirugía, el 25-65% de ellos fue deambulante hasta morir; y de los que presentaron paraplejía al momento de la cirugía, el 25% de ellos fue deambulante hasta morir.
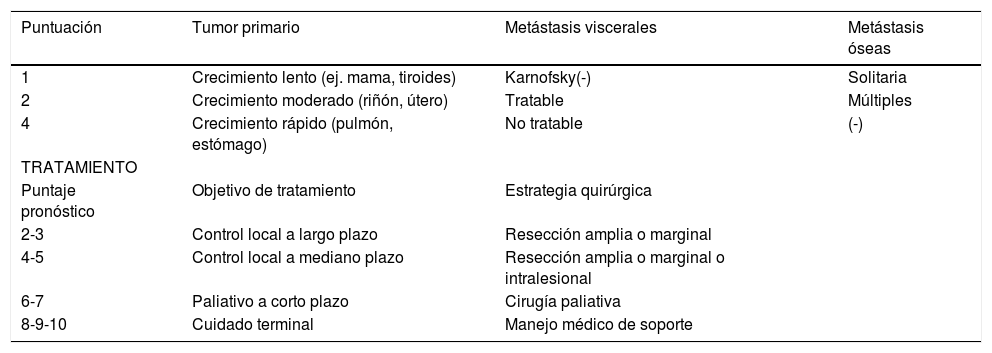
Otro sistema de puntuación para la toma de decisión quirúrgica es el de Tomita (también ya poco utilizado), basado en tres factores pronósticos: grado de malignidad tumoral, número de metástasis viscerales y número de metástasis óseas (Tabla 2)22.
Estrategia quirúrgica propuesta por Tomita el al
| Puntuación | Tumor primario | Metástasis viscerales | Metástasis óseas |
|---|---|---|---|
| 1 | Crecimiento lento (ej. mama, tiroides) | Karnofsky(-) | Solitaria |
| 2 | Crecimiento moderado (riñón, útero) | Tratable | Múltiples |
| 4 | Crecimiento rápido (pulmón, estómago) | No tratable | (-) |
| TRATAMIENTO | |||
| Puntaje pronóstico | Objetivo de tratamiento | Estrategia quirúrgica | |
| 2-3 | Control local a largo plazo | Resección amplia o marginal | |
| 4-5 | Control local a mediano plazo | Resección amplia o marginal o intralesional | |
| 6-7 | Paliativo a corto plazo | Cirugía paliativa | |
| 8-9-10 | Cuidado terminal | Manejo médico de soporte | |
Nota: Traducido de Tomita K et al. (Ref. 22)
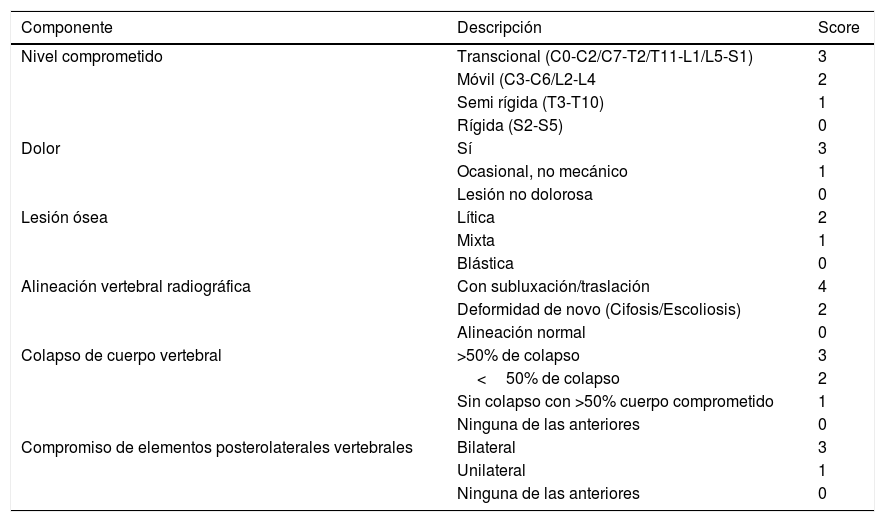
Finalmente, lo más utilizado hoy en día, y esto es más bien resorte del especialista, el Spine Oncology Study Group (SOSG), uno de los “Knowledge Forum” de la AOSPINE ha realizado una descripción de criterios de “inestabilidad espinal” para la toma de decisión quirúrgica denominada “Spine Inestability Neoplastic Score” (SINS) (Tabla 3)23.
Score de inestabilidad espinal neoplásica (SINS)23
| Componente | Descripción | Score |
|---|---|---|
| Nivel comprometido | Transcional (C0-C2/C7-T2/T11-L1/L5-S1) | 3 |
| Móvil (C3-C6/L2-L4 | 2 | |
| Semi rígida (T3-T10) | 1 | |
| Rígida (S2-S5) | 0 | |
| Dolor | Sí | 3 |
| Ocasional, no mecánico | 1 | |
| Lesión no dolorosa | 0 | |
| Lesión ósea | Lítica | 2 |
| Mixta | 1 | |
| Blástica | 0 | |
| Alineación vertebral radiográfica | Con subluxación/traslación | 4 |
| Deformidad de novo (Cifosis/Escoliosis) | 2 | |
| Alineación normal | 0 | |
| Colapso de cuerpo vertebral | >50% de colapso | 3 |
| <50% de colapso | 2 | |
| Sin colapso con >50% cuerpo comprometido | 1 | |
| Ninguna de las anteriores | 0 | |
| Compromiso de elementos posterolaterales vertebrales | Bilateral | 3 |
| Unilateral | 1 | |
| Ninguna de las anteriores | 0 |
0-6: Lesión estable. 7-12: Lesión riesgo de inestabilidad. 13-18: Lesión inestable. Nota: Traducido de Fisher CG. et al. (Ref. 23).
La definición de inestabilidad, según SOSG es “la pérdida de la integridad vertebral como resultado de un proceso neoplásico que se asocia a dolor generado por el movimiento, deformidad sintomática o progresiva y/o compromiso neurológico bajo cargas fisiológicas”. Ésta, a diferencia de las anteriores, se basa solo en la estabilidad espinal y no en otros parámetros clínicos.
Con el advenimiento de le radiocirugía estereotáctica (SRS) han aparecido estudios que demuestran que ésta logra gran control de los tumores vertebrales en términos de reducción del volumen tumoral, como el alivio de los síntomas asociados en cuanto a dolor y compresión neurológica23.
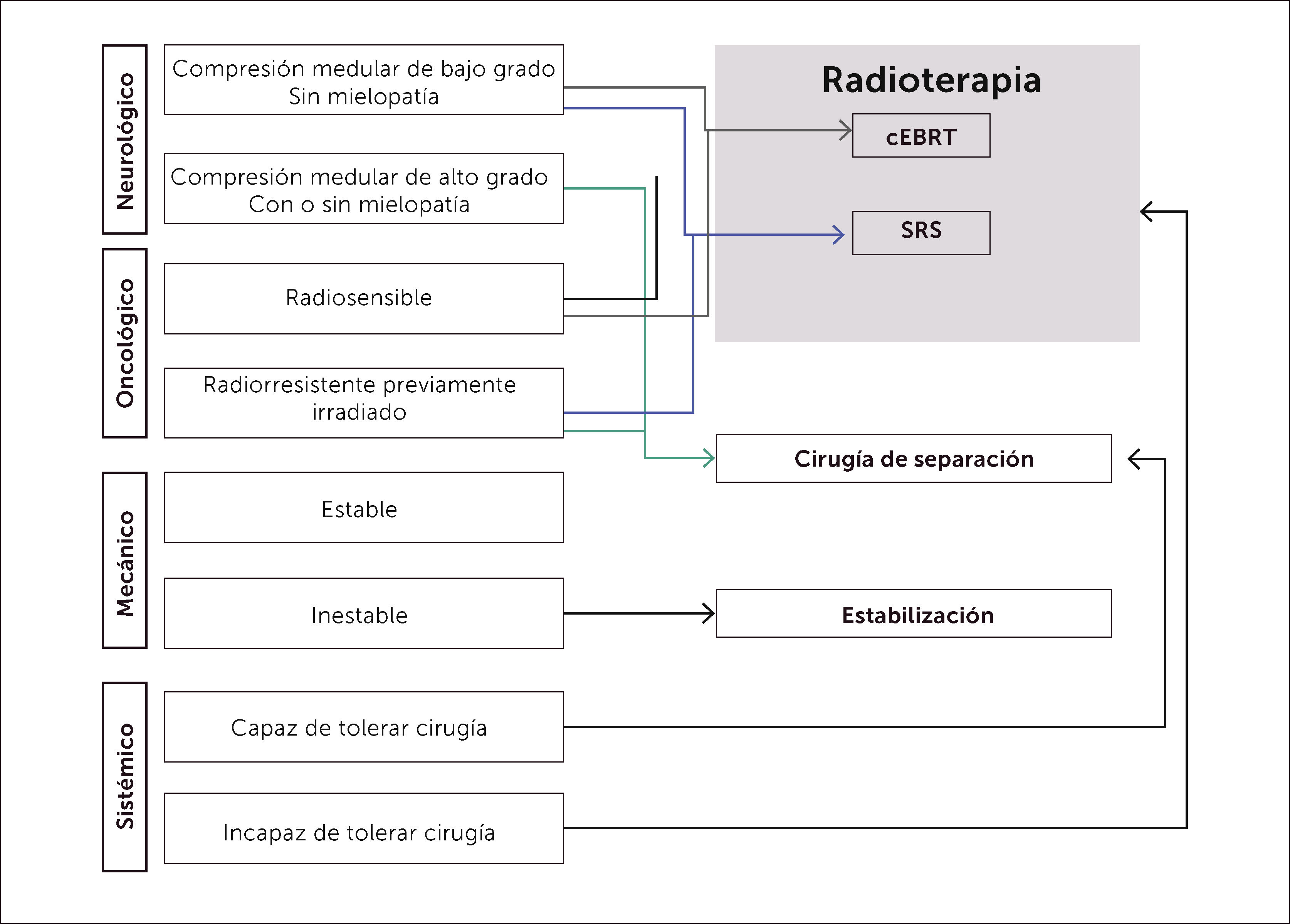
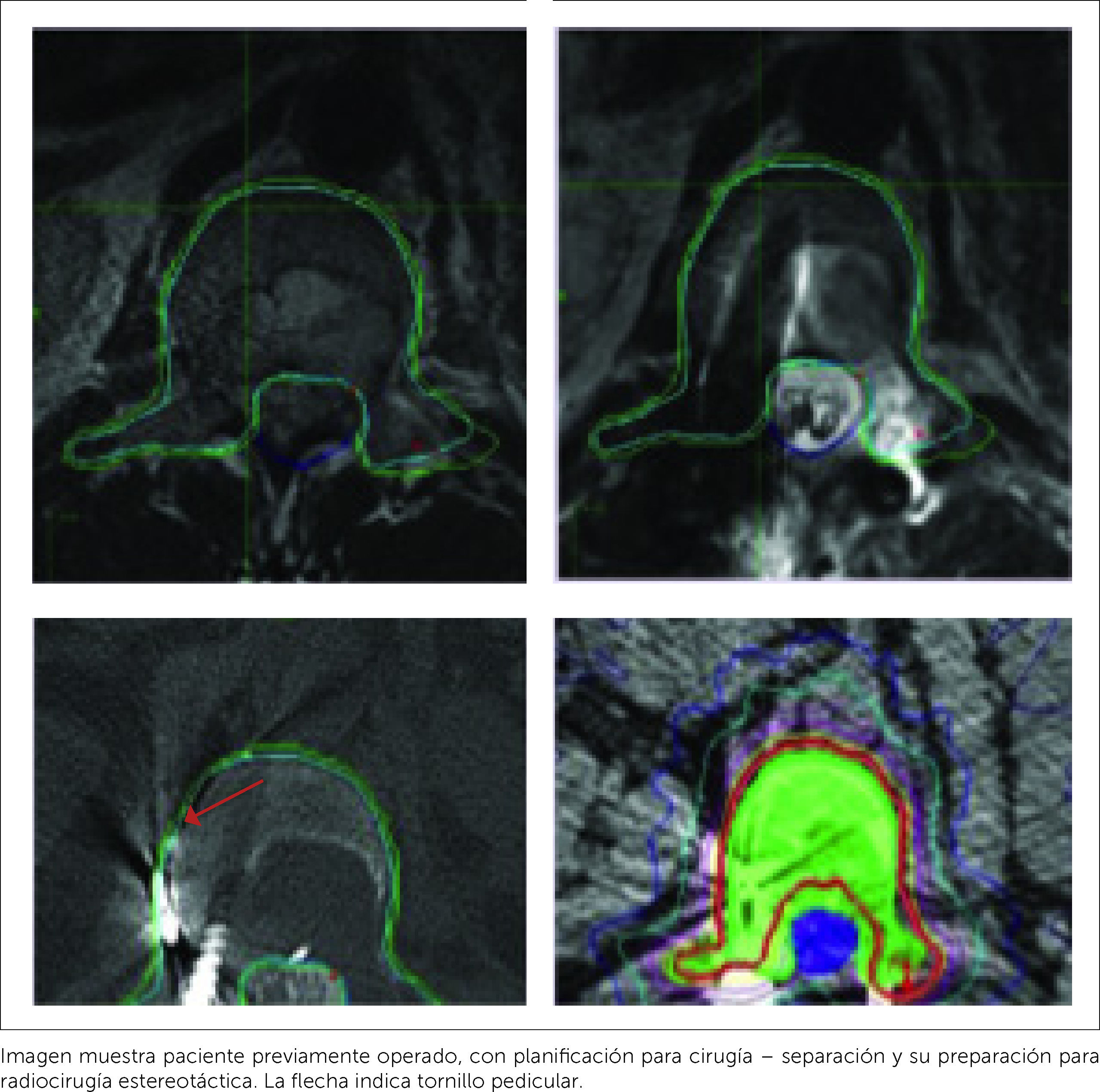
El grupo multidisciplinario de columna del Memorial Sloan-Kettering Cancer Center (MSKCC) ha desarrollado y utilizado un diagrama de flujo para la Enfermedad Espinal Metastásica denominada NOMS–(Neurologic, Oncologic, Mechanical Inestability and Systemic disease). En su estudio con la utilización de una fracción única en altas dosis de SRS, se basa el desarrollo de la “Cirugía–Separación+Radiocirugía Estereotáctica” (Figura 14).
El tratamiento de elección para el manejo de la compresión medular por metástasis epidural es la “terapia híbrida de cirugía de separación más radiocirugía esterotáctica”, donde se realiza (Figura 15):
- •
Resección quirúrgica Circunferencial del tumor epidural.
- •
Con o sin resección parcial del cuerpo vertebral.
- •
Con o sin fijación espinal mediante un abordaje postero–lateral (evitando abordajes combinados anteriores).
- •
Seguido de altas dosis de radiocirugía esterotáctica.
El mejor resultado histórico esta dado por la Cirugía+Rt convencional, siendo algo superior que la radiocirugía estereotáctica pura (SBRt); por lo que la combinación de esta última es el gold standard actual (Tabla 4) (Figura 14): CIRUGÍA SEPARACIÓN+RADIOTERAPIA ESTEROTÁCTICA (SRS).
Principales terapias disponibles
| Efecto del tratamiento | Outcome | Nivel de evidencia | Comentario | Referencia |
|---|---|---|---|---|
| Mejora en tasa de pacientes ambulatorios (6 meses) | 81% (esteroides) v/s 63% (no esteroides) | 1 | - | Esteroides |
| Mejora en tasa de pacientes ambulatorios (6 meses) | 84% c¡(cirugía + Rt) v/s 57% (Rt sola) (Odds ratio 6.2, 95% CI 2.0-19.8; p=0.001) | 1 | - | Cirugía descompresiva |
| Mejora en tasa de pacientes ambulatorios | 68% luego de Rt sola (no randomizado) | 4 | - | cEBRT |
| Mejoria en función neurológica | 81% luego SBRT (no ramdomizado) | 4 | Experiencia de 1 institución, pacientes altamente seleccionados | SBRT |
Abreviaciones: cEBRT: Radioterapia convencional de haz externo; SBRT: Radioterapia estereotáctica; Rt: Radioterapia.
Es importante reforzar el concepto que un paciente con MV es frágil y que está muriendo, por lo tanto, su tratamiento debe ser compartido con un equipo multidisciplinario para ofrecerle desde un cuidado paliativo hasta una gran cirugía.
El tratamiento exitoso consiste en calmar el dolor, mejorar o preservar su condición neurológica y lograr estabilidad espinal; considerando que nuestro objetivo último es su “calidad de vida” en el tiempo que le queda.
6Declaración de conflicto de interésLos autores declaran no tener conflictos de interés.
Referencias no citadas