El dolor durante el embarazo es un doble desafío ya que, el no tratarlo afectará a la madre y su entorno, pero además podría afectar al feto. Sin embargo, iniciar un tratamiento pone en potencial riesgo al feto. En el presente artículo se revisan los síndromes dolorosos más frecuentes que ocurren durante el embarazo y una aproximación a su tratamiento.
Pain in pregnancy is a double edged sword for the physician since not treating it will affect the mother, her environment and potentially the baby. However, treating it may be hazardous for the fetus. In this article we will review the most common painful syndromes occurring during pregnancy and will describe the best analgesic approach for them.
El dolor se define como una experiencia sensitiva y emocional asociada a daño tisular actual o descrito en términos de dicho daño (1). Esta definición ha perdurado en el tiempo sin embargo, la clasificación de los distintos tipos de dolor está evolucionando. Las descripciones originales del dolor se basaban en la evolución temporal, haciendo una distinción entre el dolor agudo y crónico si duraba más de seis meses. Otras miradas más conservadoras e innovadoras proponen considerar sólo un mes como criterio de definición (2). Estas definiciones iniciales no consideraban el mecanismo involucrado en el desarrollo del síntoma. La mirada contemporánea considera la clasificación de dolor de acuerdo a la patología primaria involucrada en la causa del dolor: inflamatoria (aguda) o neuropática (crónica) (3). Este último tipo de dolor puede ser considerado como una enfermedad del sistema nervioso central (SNC) en sí misma y no sólo un síntoma de otra condición (4).
Durante el embarazo el dolor agudo es la categoría de dolor con mayor representatividad, generalmente derivado del trabajo de parto y parto sin embargo, otros síndromes dolorosos han sido descritos como cróni-cos-neuropáticos, agudos-inflamatorios o uno que evoluciona hacia la cronificación. En esta revisión se analizan aquellas situaciones dolorosas que ocurren durante el embarazo, enfocándose en aquellas situaciones dolorosas que pueden perdurar por largo tiempo.
Género, embarazo y vías antinociceptivasVarias revisiones sobre género y dolor han notado que la prevalencia de la mayoría de las condiciones dolorosas parecen ser mayores en mujeres que en hombres (5). El dolor originado en órganos sexo específicos puede ser el resultado de la naturaleza más compleja de la región pelviana femenina y el mayor número de condiciones fisiopatológicas directa o indirectamente relacionadas a las funciones reproductivas femeninas (2). Gran parte de los esfuerzos en investigación han estado dirigidos al dolor somático, aunque buena parte del conocimiento sobre las diferencias sexuales y hormonales también ha aumentado en el campo del dolor originado por órganos internos (6).
Cuando las diferencias sexuales se analizan en términos de respuesta analgésica, las mujeres responden mejor a la analgesia por opioides, tanto por agonistas mu(μ) como por agonistas kappa(κ) (7); y a la analgesia colinérgica, principalmente por el componente nicotínico a nivel espinal (8), tanto en mujeres sanas como en aquéllas con dolor crónico (9). Los hombres, responden mejor a los aintiinflamatorios no esteroi-dales (AINEs) (7). La contribución del sexo y el estado hormonal como factores de la antinocicepción asociada al embarazo está tomando cada vez mayor preponderancia (10). La antinocicepción asociada al embarazo resulta de la interacción de niveles circulantes de progesterona y estrógenos y la activación de dos sistemas analgésicos opioides relativamente menores (delta (δ) y κ)que están latentes en condiciones basales, por medio de los opioides endógenos dinorfina y encefalina (11,12). La modulación de estos sistemas es lograda por vías descendentes inhibitorias al activar receptores α2 adrenérgicos, amplificando sinérgicamente la respuesta antinociceptiva (12). Los beneficios clínicos de esta asociación son disminuir los requerimientos de cada uno de los agentes para lograr igual nivel de analgesia, asociado a un menor riesgo de desarrollar tolerancia para cada tipo de receptor (12).
Si bien los mecanismos aquí descritos pueden controlar algunas formas de dolor durante el embarazo, aún puede aparecer un dolor intercurren-te, dependiendo de su magnitud o incluso de su naturaleza.
Muchas situaciones dolorosas son de particular interés debido a su gran prevalencia, su intensidad o el impacto en las actividades diarias de las madres. Por otra parte, el dolor materno puede potencialmente interferir con el desarrollo fetal y su crecimiento (13), por lo que el alivio de este síntoma beneficiará tanto a la madre como al hijo.
MigrañaLa migraña es un síntoma muy común, con una prevalencia que es mayor en mujeres (18%) que en hombres (6%), con una mayor acumulación entre los 25 y 55 años, correspondientes a los años más productivos y reproductivos de la mujer (14). De acuerdo a la Organización Mundial de la Salud, se asocia a uno de los trastornos crónicos más incapacitantes (15).
La migraña corresponde a la primera categoría de la clasificación de cefaleas y está subdividida en dos categorías: con o sin aura (16). La prevalencia durante el embarazo es entre 15 a 20%, período durante el cual la migraña sin aura habitualmente mejora (17) mientras que la modalidad con aura generalmente no lo hace (18). Estas observaciones apoyan la teoría del rol de las hormonas (estrógenos) como de los opioides endógenos que aumentan progresivamente durante el embarazo en la génesis y modulación de la migraña (17,19). Así, desde un punto de vista antiálgico, el embarazo es un estado fisiopatológico favorable para la madre.
FisiopatologíaLa migraña puede ser considerada como un trastorno primario del cerebro, donde eventos neurales resultan en vasodilatación cerebral, lo que desencadena dolor y mayor activación neuronal, principalmente por la rama oftálmica del nervio trigémino (20). Este sistema trigéminovascular actúa como una red en las paredes de los vasos sanguíneos principales y se proyecta ampliamente por la corteza, duramadre y mesencéfalo (21). El evento gatillante de esta cascada que culmina con el dolor, es desconocido sin embargo, existe evidencia de la activación de neuronas sensitivas trigeminales y liberación de mediadores que modulan la inflamación, vasodilatación y extravasación de proteínas (14). El estrógeno y otras hormonas reproductivas interactúan con el sistema trigéminovascular de manera que la cefalea puede estar influenciada por el embarazo (21).
TratamientoIntervenciones conductualesLas intervenciones conductuales pueden permitir disminuir o evitar intervenciones farmacológicas, especialmente en embarazadas que están altamente motivadas para evitar medicamentos que afecten al feto, que son la mayoría. Hay al menos tres tipos de intervenciones no farmacológicas: entrenamiento de técnicas de relajación, biofeedbacky terapia de manejo de estrés (22).
Holroyd y colaboradores compararon en un metaanálisis la técnica de relajación y biofeedback versus un tratamiento farmacológico con propanolol. Encontraron que con ambas intervenciones se reducía la migraña en 43% de los casos en ambos grupos, sin mejoría en el grupo control (sin tratamiento) y sólo 14% de mejoría en el grupo placebo (23). Durante el embarazo los resultados son aún más optimistas. Marcus y colaboradores mostraron que las técnicas de relajación y feedback biotermal mejoraron la cefalea en un 73% comparada con sólo un 29% en el grupo control (24). Más aún, los efectos benéficos se mantuvieron en dos tercios de las pacientes hasta un año después del parto (25).
Intervenciones farmacológicasEl tratamiento de la cefalea durante el embarazo y período post parto es muy desafiante, ya que existe escasa información sobre el uso de medicamentos para su profilaxis o tratamiento durante el embarazo. Los laboratorios rara vez prueban sus medicamentos en pacientes embarazadas para determinar sus efectos en los fetos (26). Así, la mayoría de las drogas no están etiquetadas para ser usadas en el embarazo, lo que deja a los médicos tratantes con muy poca información disponible para decidir cómo beneficiar a sus pacientes. Cabe mencionar que actualmente no existen analgésicos que sean seguros para el feto o recién nacidos. Los datos científicos disponibles son escasos y se basan principalmente en información anecdótica o estudios observacionales (27).
El acetaminofén es una droga categoría B de la clasificación de la Food and Drug Administration (FDA) (28) y es frecuentemente recomendada para la cefalea durante el embarazo. Otras drogas de la misma clasificación para el tratamiento de la cefalea son: (AINEs), prednisona y metoclopramida. Para la FDA son categoría C los opioides, la cafeína y los beta bloqueadores (28) (tabla 1).
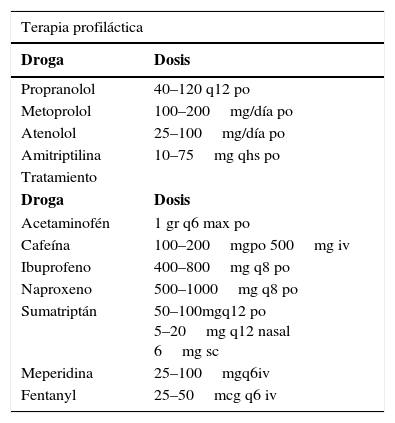
Sugerencia de drogas y dosis para la prevención y tratamiento de la cefalea durante el embarazo
| Terapia profiláctica | |
|---|---|
| Droga | Dosis |
| Propranolol | 40–120 q12 po |
| Metoprolol | 100–200mg/día po |
| Atenolol | 25–100mg/día po |
| Amitriptilina | 10–75mg qhs po |
| Tratamiento | |
| Droga | Dosis |
| Acetaminofén | 1 gr q6 max po |
| Cafeína | 100–200mgpo 500mg iv |
| Ibuprofeno | 400–800mg q8 po |
| Naproxeno | 500–1000mg q8 po |
| Sumatriptán | 50–100mgq12 po 5–20mg q12 nasal 6mg sc |
| Meperidina | 25–100mgq6iv |
| Fentanyl | 25–50mcg q6 iv |
El lumbago es uno de los síndromes dolorosos más comunes de la población general, con una prevalencia durante la vida de 58–84% de todos los adultos (5) y una concentración de los casos en edades jóvenes (29). Durante el embarazo la consulta traumatológica más frecuente es el lumbago, con una prevalencia a nueve meses de 50% (30,31); una prevalencia puntual durante el embarazo de 25%; y una incidencia real de 27% (31).
Ostgaard y colaboradores clasificaron el lumbago en tres categorías: dolor lumbar alto, dolor lumbar bajo y dolor sacro ilíaco (31). Este último grupo también se denomina dolor pélvico posterior, el cual aparentemente está relacionado al dolor pélvico anterior o de la sínfisis púbica (pubalgia, ver abajo) (31,32). Esta diferenciación tiene valor pronóstico ya que el dolor sacroilíaco o pélvico posterior aumenta a medida que avanza el embarazo (31) y es más prevalente e intenso que el dolor lumbar bajo (33). Sin embargo, en el post parto, el dolor sacroilíaco es menos frecuente y menos intenso que el dolor lumbar bajo (33). Los factores de riesgo que se han asociado al lumbago son: lumbago previo al embarazo, multiparidad y sobrecarga de trabajo muscular (30,31,33).
PatogeniaDurante el embarazo hay un aumento en la laxitud ligamentosa (34), probablemente secundario a la influencia hormonal de los estrógenos y la relaxina (35). Además, los cambios en el alineamiento tridimensional de la columna a medida que progresa el embarazo, asociado al aumento de peso normal del embarazo, generarán una sobrecarga mecánica sobre los músculos, ligamentos y discos de la columna, lo que generará fatiga muscular y sobrecarga de las partes blandas, generando dolor (30). Cuando esta condición es suficientemente grave y altera la vida diaria por inestabilidad pélvica o dolor, se denomina relajación de la cintura pélvica sintomática (36). Los diagnósticos diferenciales incluyen hernia discal, espondilolistesis y sacroileítis infecciosa (37).
Cuadro clínicoEl típico motivo de consulta es el dolor lumbar bajo, agravado por la actividad y usualmente aliviado con el reposo estando acostada o sentada. Generalmente es persistente y de intensidad moderada (38). Habitualmente lo ubican sobre la región lumbar, con o sin irradiación a los muslos o el área sacroilíaca, algunas veces hacia los glúteos, los muslos, pero sin irradiación ciática. Esta última forma habitualmente se acompaña de pubalgia (31).
TratamientoComo en muchas situaciones, el tratamiento primario es la prevención. Se ha sugerido que una buena preparación física previo al embarazo, reduce el riesgo de lumbago durante este período (30,39). En el embarazo, una vez que el episodio agudo de dolor cede, se recomienda un programa de ejercicios para mejorar la fuerza muscular, lo que pudiera ayudar a disminuir los síntomas recurrentes de lumbago (38).
El principal foco del tratamiento es reducir la carga de trabajo de la cintura pélvica y del dorso al reducir la actividad física, evitar subir escaleras y reducir el rango de movimiento de las caderas o la espalda (33). Además, el uso de un soporte pélvico no elástico reduce el dolor en más de un 80% de las pacientes (39). El tratamiento farmacológico usualmente se restringe al uso de acetaminofén y AINES. La cirugía está restringida a casos de anomalías estructurales mayores con compromiso neurológico actual.
Con respecto a la duda si la analgesia epidural para el trabajo de parto desencadena o aumenta el dolor lumbar en el post parto, múltiples estudios han mostrado que no hay relación entre ellas. Macarthury colaboradores en un estudio prospectivo, descartaron una asociación positiva entre la analgesia epidural y dolor lumbar crónico a un año post parto (40).
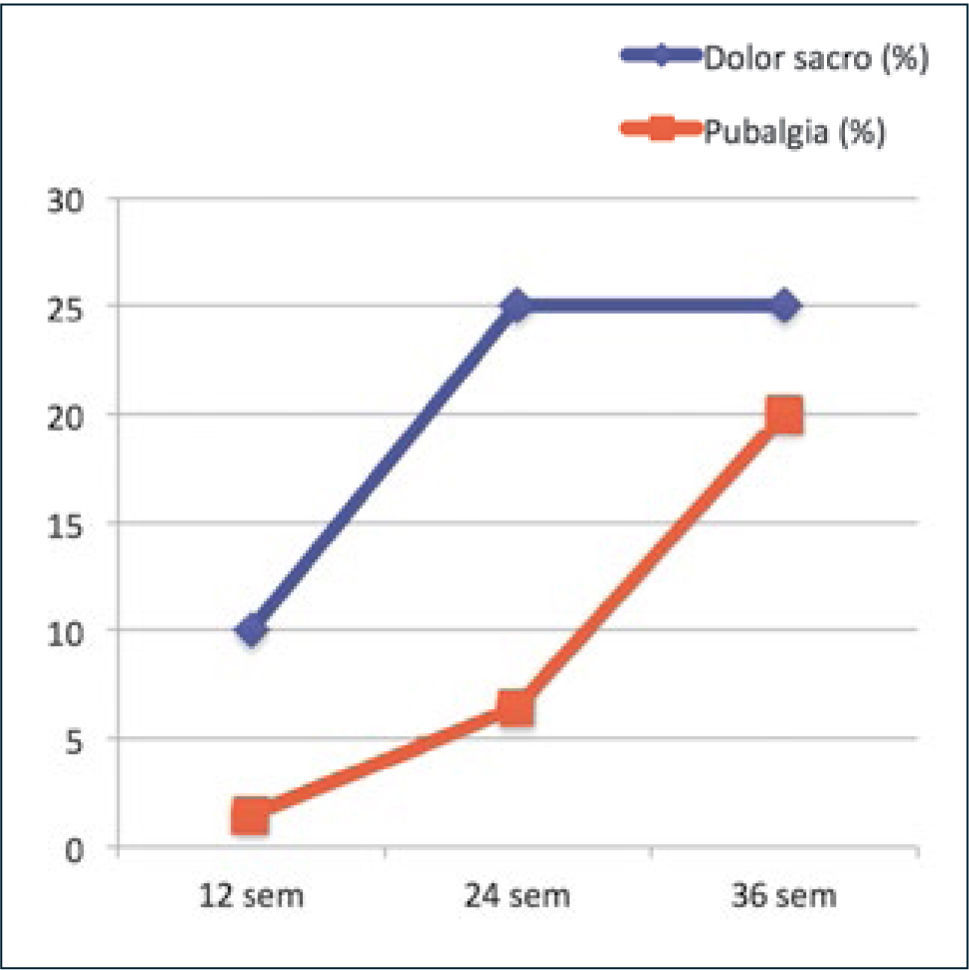
PubalgiaAlgunas embarazadas experimentan dolor pélvico muy intenso en la sínfisis del pubis, que habitualmente se agrava con embarazos subsecuentes y puede persistir por años (36). La prevalencia de la pubalgia y del dolor sacro en cada trimestre se puede ver en la figura 1.
Prevalencia de pubalgia y dolor sacro en cada trimestre del embarazo
La laxitud ligamentosa ocurre durante el embarazo (38). Existe evidencia de correlación pronóstica entre dolor y niveles plasmáticos de rela-xina sin embargo, algunas pacientes pueden tener niveles plasmáticos elevados de la hormona y ser asintomáticas, sugiriendo que los niveles plasmáticos hormonales no serían tan importantes como los niveles de receptores de relaxina (35), o bien, no existe una correlación exclusiva entre la hormona y los síntomas. Lo que sí es constante, es la relación entre la distensión de la sínfisis y el dolor (41).
La sínfisis del pubis es una articulación no sinovial en la confluencia de los huesos púbicos, unidos por tejido fibrocartilaginoso (42). El ensanchamiento de la sínfisis puede producir hiperalgesia y es agravada por el ejercicio. La ruptura de esta articulación (diastasis pubis) es de muy baja ocurrencia sin embargo, hay reportes de separación espontánea diagnosticada por un intenso dolor en una paciente en trabajo de parto, a pesar de estar con analgesia epidural (43).
TratamientoSi la diástasis es menos de un cm. el tratamiento es de soporte con reposo y medidas conservadoras, como la aplicación de hielo y, ocasionalmente, puede ayudar la infiltración con anestésicos locales sin embargo, esto es de corta duración (44). Para separaciones mayores a un cm (criterio diagnóstico para inestabilidad pélvica) (41), se debe realizar reducción ortopédica con un cinturón pélvico, decúbito lateral, reposo absoluto y uso de AINEs (38,43). El tratamiento quirúrgico se reserva para casos con reducción inapropiada, síntomas persistentes o diástasis recurrente (43).
Síndrome de túnel carpiano (STC)Sin considerar el lumbago, el Síndrome de Túnel Carpiano (STC) es el motivo de consulta más frecuente en el embarazo, con incidencias de hasta 62% (45–48). Se puede encontrar disfunción neurológica en hasta la mitad de las embarazadas sintomáticas, luego de ejecutar un examen neurofisiológico (48). Muchos autores han reportado en forma consistente una relación entre edema del embarazo y síntomas de STC (45,46,49,50). Se ha sugerido que el hábito tabáquico y el consumo de alcohol pueden tener un efecto negativo en el desarrollo de los síntomas, posiblemente debido a un efecto deletéreo en la microcirculación de la mano, afectando la evolución del síndrome (48).
PronósticoLa historia natural del STC indica que persisten los síntomas en cerca del 50% de las pacientes, al año del embarazo, sin embargo, la mayoría reportará una mejoría de los síntomas (51), aunque aquellas pacientes con inicio precoz de los síntomas o con un alza en su peso importante durante el embarazo, tienen menor probabilidad de mejorar en el post parto (51). Otros autores han sugerido que aquellas pacientes que debutan con un STC durante el embarazo tienen más riesgo de desarrollarlo en etapas más tardías de la vida (49), apoyando el concepto de que el dolor mal tratado puede dar cabida a dolor crónico neuropático (52).
TratamientoLa mayoría de los tratantes no recomiendan la descompresión del túnel del carpo durante el embarazo aunque sea muy sintomática, ya que un alto porcentaje se resolverá espontáneamente después del parto. Así, las medidas conservadoras son el pilar del tratamiento de esta dolencia durante el embarazo (53). El tratamiento ortopédico de elección es el uso de férulas en el dorso de la mano que mantengan la articulación de la muñeca en posición neutra, para maximizar la capacidad del compartimiento, lo que generalmente da un alivio muy importante (50). La combinación de inmovilización junto a una dieta restringida en sal genera un excelente resultado clínico y electrofisiológico (53). Algunos autores recomiendan el uso de corticoides locales, ya que un 65% de los casos son secundarios a edema sinovial inespecífico (54). Otros tratamientos, como el uso de diuréticos o AINES son no concluyentesy por lo tanto, no se recomiendan.
La corrección quirúrgica se reserva para pacientes con inicio precoz del STC, síntomas graves o alteración neurofisiológica grave, que se asocie a deterioro del tono muscular y de la función motora (54).
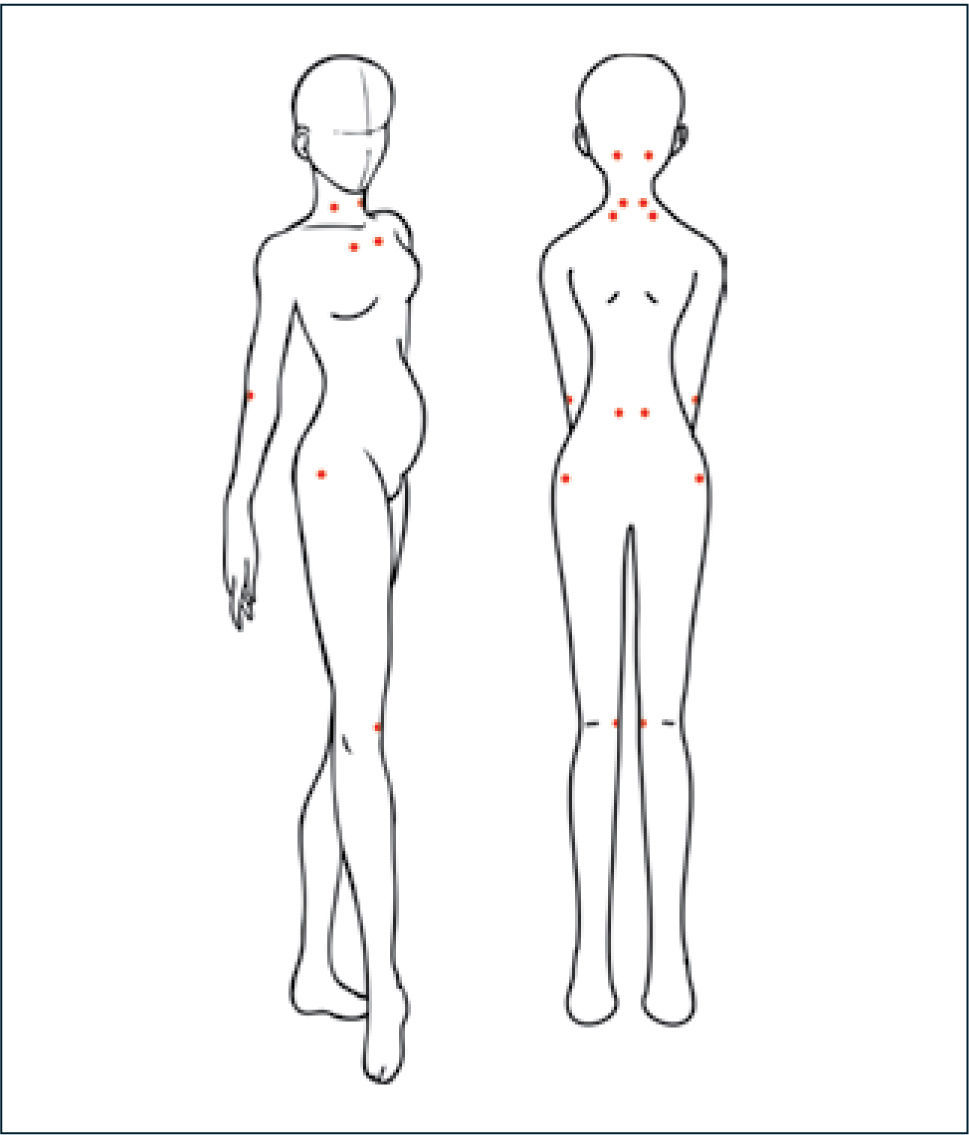
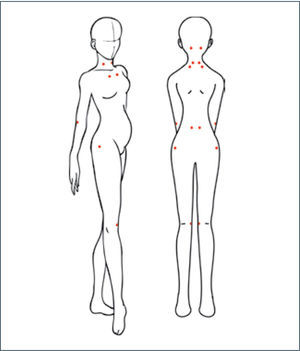
FibromialgiaLa fibromialgia es un síndrome multisintomático (55,56). Su prevalencia global es 2–3%, con predominancia femenina en relación 8–9:1 (57) y que la puede afectar en su edad fértil (55,58). Si bien la fisiopato-logía del síndrome es desconocida, estudios recientes apuntan a un factor genético, en combinación con mecanismos de dolor periféricos y centrales anómalos (sensibilización central) (55). Junto a los factores asociados con el inicio de los síntomas, se encuentran: enfermedades infecciosas, trauma físico/emocional y estrés (55). Al examen, las pacientes con fibromialgia tienen puntos gatillo exquisitamente dolorosos en pares, usualmente simétricos y que se localizan característicamente en el occipucio, trapecio, cuello, pared torácica anterior, epicóndilos, región lumbar, trocánteres y aspecto medial de la rodilla bilateralmente (figura 2) (59). Aparte de estos puntos, el resto del examen debiese ser normal. Similarmente, los resultados de los análisis de laboratorio son igualmente normales por lo que, el diagnóstico es principalmente clínico (60). Así, los criterios diagnósticos son: 1) dolor difuso de al menos tres meses de duración asociado a 2) dolor a la palpación en al menos 11 de los 18 puntos específicos previamente descritos (61).
La fibromialgia durante el embarazo no ha sido bien documentada y unos pocos estudios se han centrado en la descripción de su historia natural en esta condición (62,63). Ostensen y colaboradores realizaron un estudio prospectivo observacional para el cual reclutaron 50 pacientes, quienes fueron distribuidas en dos grupos: mujeres que al momento del parto ya tenían fibromialgia y aquellas que tuvieron el parto antes de que iniciaran su enfermedad (63). Los síntomas reportados por el primer grupo (embarazadas con fibromialgia) fueron: fatiga generalizada, lumbago, debilidad muscular, depresión y sensación de rigidez articular. También reportaron un empeoramiento de los síntomas entre uno a tres meses después del parto y menor capacidad para hacerse cargo de los hijos. A pesar de esto, la mayoría de las pacientes percibieron el embarazo como una experiencia positiva en sus vidas. Entre aquellas mujeres que experimentaron múltiples embarazos, no describieron un aumento en la gravedad de los síntomas en embarazos posteriores comparados con el primero. Las mujeres con fibromialgia dieron a luz a niños sanos, de término y sin diferencias neonatales comparadas con la población general. Casi todas las pacientes con fibromialgia describieron un aumento en los síntomas durante el embarazo, reportando el último trimestre como el peor, dado por mayor incapacidad funcional en el período post parto (63).
TratamientoEl tratamiento más aceptado es un régimen multimodal que incluye educación, terapia ocupacional, ejercicio moderado, analgésicos inductores del sueño (64) y antidepresivos (65). Si bien los resultados iniciales de la terapia multimodal eran alentadores, reportes actuales más realistas muestran que es un síndrome con muy baja tasa de respuesta al tratamiento y de mal pronóstico (65,66).
En el caso del manejo farmacológico del dolor en fibromialgia, es necesario centrarse en los sitios principales de procesamiento de éste, en particular: sitios de generación periférica, sensibilización del asta posterior de la médula, influencias sicológicas y la vías descendentes inhibitorias (56).
En la fibromialgia no hay una patología tisular específica, al menos en los tejidos periféricos sin embargo, el sistema nervioso central está sensibilizado, por lo que los generadores de dolor periféricos no sólo se perciben como más dolorosos sino que prolongan y amplifican la sensibilización central. Los generadores de dolor más comunes en pacientes con fibromialgia son los puntos gatillos miofasciales. Éstos deben ser identificados y tratados elongándolos, mejorando el condicionamiento físico general, utilizando acupresión e infiltración de los puntos dolorosos con anestésicos locales (56) o anestésicos locales asociados a corti-coides (65). LosAINEs son inefectivos en este cuadro (67).
La modulación de la sensibilización central es principalmente farmacológica. Actualmente las únicas drogas aprobadas por la FDA para modular la reactividad central, son aquellas que activan o amplifican el sistema descendente inhibitorio, entre los que se incluyen los antidepresivos tri-cíclicos, opioides y agonistas α2-adrenérgicos (56).
Los antidepresivos tricíclicos en bajas dosis, como por ejemplo la ami-triptilina en dosis de 10–25mg se considera generalmente el tratamiento de elección en fibromialgia (60). Es una droga categoría C en la clasificación de la FDA (tabla 2) y se considera probablemente segura durante la lactancia (28). Sin embargo, a pesar de su amplio uso, sólo un 25–30% de las pacientes mejora y el efecto a largo plazo no se mantiene (56,68).
Categorías de drogas durante el embarazo, de acuerdo a la clasificación de la FDA
| Categoría | Definición |
|---|---|
| A | Estudios controlados en mujeres embarazadas no han mostrado riesgo para los fetos en el primer trimestre y sin evidencia de riesgo en los siguientes. La posibilidad de daño fetal es remota. Ej. multivitamínicos. |
| B | Si bien los estudios de reproducción en animales no han mostrado riesgo fetal, no existen estudios controlados en embarazadas o bien los estudios de reproducción en animales han mostrado algún efecto adverso (diferente a una disminución en la fertilidad), el cual no ha sido confirmado en estudios controlados en embarazadas de primer trimestre y no hay evidencia de riesgo en los siguientes trimestres. Ej. Anestésicos locales, acetaminofén, cafeína, AINES, fluoxetina, prednisona, prednisolona. |
| C | Ya sea en estudios de reproducción en animales que han mostrado efectos adversos al feto (teratogenia, efectos abortivos u otros), no existen estudios en embarazadas o bien no existen estudios en embarazadas ni en animales. Las drogas de esta categoría sólo se debieran recomendar si el beneficio es mayor que el potencial riesgo al feto. Ej. opiáceos*, nifedipino, propanolol, ketorolaco, sumatriptan, gabapentina. |
| D | Hay evidencia positiva de riesgo al feto humano, pero los beneficios de tratar enfermedades graves en la embarazada puede ser aceptable a pesar del riesgo (por ej. si la droga se requiere por una situación de vida o muerte, o una enfermedad grave en que drogas más seguras no pueden ser utilizadas o son inefectivas). Ej. diazepam, fenobarbital, fenitoína, ácido valproico, amitriptilina, citotóxicos. |
| X | Estudios en animales y humanos han mostrado anormalidades fetales o hay evidencia de riesgo basado en experiencia en humanos o ambos; y el riesgo de su uso en humanos supera el beneficio potencial. La droga está contraindicada en mujeres que están embarazadas o pudieran embarazarse. Ej. Ergotamina, talidomida, isotretinoína, cumarínicos. |
Los opioides usualmente se utilizan en el tratamiento de la fibromialgia, pero no han habido estudios clínicos controlados. No debieran ser la primera elección analgésica sin embargo, tampoco debieran ser evitados si otros analgésicos potentes han fallado (56). El tramadol (droga categoría C de acuerdo a la FDA), es un opioide débil con muy bajos efectos colaterales, que ha ganado popularidad en el tratamiento de la fibromialgia (69,70) sin embargo, aún no hay reportes de su uso en embarazadas.
Las drogas α2-adrenérgicas como la tizanidina (droga categoría C de acuerdo a FDA) ha sido utilizada exitosamente en algunos trastornos dolorosos crónicos, aunque no en fibromialgia (56). Las drogas que modulan las vías ascendentes de dolor son menos utilizadas sin embargo, hay evidencia al menos experimental, que bloquear receptores NMDA con ketamina atenúa el dolor en pacientes con fibromialgia (56).
Tratamiento no farmacológicoEl manejo interdisciplinario para la rehabilitación física de los trastornos músculo-esqueléticos, combinados con intervenciones sicológicas, conductualesy educacionales han generado interés en la comunidad, ya que otorgan cierto alivio de los síntomas (66,68), asociado a un perfil de costo-beneficio favorable que lo hace accesible a la paciente promedio (66). Sin embargo, algunos autores no han mostrado beneficios a largo plazo (55) o incluso, ningún beneficio con esta estrategia (71).
Dolor en el período post partoLa operación cesárea es considerada la novena cirugía más dolorosa en el post operatorio, comparada con otros 179 procedimientos quirúrgicos (72), lo que debiera alertar y preocupar de sobremanera en el cuidado de las pacientes.
El dolor en el período post parto habitualmente se localiza en el hemiab-domen inferior, el que es percibido a nivel del SNC en forma recurrente y con intensidad que puede llegar a ser muy alta. Este dolor es más frecuente en multíparas que en primíparas (73), apoyando la idea de que un estímulo doloroso previo genera cambios en la médula espinal y gatilla una reorganización estructural (3), dando pie a hiperalgesia, es decir, una respuesta dolorosa aumentada frente a un estímulo doloroso en eventos dolorosos posteriores. Este mecanismo se define como plasticidad cerebral. Esto sugiere que el embarazo puede generar cambios neurológicos centrales que aumenten la predisposición a percibir dolor en el período post parto, incluso en embarazos posteriores.
Dolor crónico post cesáreaEl dolor persistente post quirúrgico, también denominado síndrome de dolor crónico post operatorio, se define como la presencia de dolor que perdura por más de tres meses de la cirugía, excluyendo la condición preoperatoria u otras causas de dolor (74). La incidencia de dolor crónico neuropático es reconocidamente alta en ciertas situaciones, tales como amputaciones de extremidades, toracotomíasy mastectomías, con incidencias entre 5–80% sin embargo, poco se sabe de su incidencia en operación cesárea.
El dolor post parto es una situación que tiene bases fisiopatológicas claras. El proceso del parto incluye la liberación de sustancias pro inflamatorias en el tejido cervical, entre las que se incluyen prostaglandinas y citokinas, las que reconocidamente sensibilizan los nociceptores (75). Lo anterior, sumado a un aumento en la arborización nerviosa terminal en el cérvix, podría aumentar la probabilidad de desarrollar dolor crónico en el período post parto. Más aún, en una operación cesárea, la tracción de nervios iliohipogástricos e ilioinguinales, además del daño quirúrgico del segmento uterino inferior que ya tiene sus aferencias sensibilizadas, pudieran aumentar el riesgo de desarrollo de dolor (75).
En un estudio nacional reciente, Elgueta y colaboradores reportaron una incidencia de 41% de dolor persistente por más de tres meses post parto, el que se asoció a pacientes que tuvieron más dolor el día después de la cesárea y a más complicaciones quirúrgicas (76). Si bien estas cifras son más altas que las reportadas en la literatura internacional, con cifras cercanas a 20% para dolor crónico post cesárea (77), podrían estar dadas por el uso de definiciones diferentes para el mismo problema, o bien que la población chilena es más susceptible de presentar dolor luego de la operación cesárea. Está demostrado que la variabilidad individual en la intensidad de la percepción de dolor en cesárea está influida por la genética, etnia y variables sicológicas (78).
Un aspecto importante es que aquellas pacientes que han sufrido dolor persistente tuvieron mayor exposición a anestesia general que regional, sugiriendo un rol preventivo de la anestesia neuroaxial frente a la aparición de este síndrome. Se podría especular que el acceso de los estímulos dolorosos al SNC son menores al utilizar anestesia regional que general. Estudios experimentales y clínicos han mostrado que un bombardeo de estímulos nocivos puede generar sensibilización central en neuronas nociceptoras de segundo orden, lo que puede estar asociado a mayor riesgo de dolor crónico persistente (77).
Esto último ha sido confirmado por Lavand’homme y colaboradores en un estudio prospectivo en 100 pacientes cesarizadas. Encontraron una incidencia de dolor crónico de 15% a seis meses de la operación cesárea. Como factores de riesgo identificaron la presencia de infección del tracto genitourinario y mayor dolor agudo post operatorio, probablemente en relación a la sensibilización central (79).
La intensidad del dolor agudo post operatorio es un potente predictor de dolor crónico subsecuente sin embargo, esto no ha sido apropiadamente investigado aún (52). Sólo hay estudios retrospectivos que sugieren tal asociación, haciendo difícil su interpretación al día de hoy. Luijendijk y colaboradores encontraron que el tamaño de la incisión de Pfannenstiel se relaciona al riesgo de dolor crónico post operatorio, posiblemente secundario a mayor riesgo de atrapamiento nervioso, formación de neuromas de amputación o áreas de hipoestesia (80) que pueden ser interpretadas como dolor.
Recientemente Landau y colaboradores mostraron una relación entre el área de hiperalgesia alrededor de la incisión quirúrgica de la cesárea y la intensidad del dolor post operatorio, lo que ha abierto una nueva veta de investigación, ya que sería posible predecir qué pacientes pudieran desarrollar dolor crónico luego de su operación cesárea (78).
TratamientoLa intensidad del dolor postoperatorio y extensión del daño tisular (incluyendo el largo de la incisión quirúrgica) son dos de los factores que se han relacionado directamente al dolor crónico post operatorio (74). Con esto en mente, el tratamiento analgésico agresivo tanto como intra como post operatorio debiera ser implementado lo antes posible, idealmente de forma preventiva, logrando un efecto a nivel de la sensibilización central más que a nivel local. Se han mostrado beneficios al utilizar una estrategia analgésica multimodal pre-incisional para reparación de hernia inguinal al utilizar AINEs, inhibidores de receptores NMDA (ketamina), asociado a la infiltración de la herida con anestésicos locales (81).
Las puérperas son una población muy particular al ser mujeres jóvenes, a cargo de recién nacidos, en quienes favorecer el tratamiento local para reducir los efectos colaterales para la administración de analgésicos y coadyuvantes, es muy deseable. Algunos autores recomiendan la infiltración de la herida operatoria, especialmente en el sitio más sensible (punto gatillo), con anestésicos locales de larga duración (bupivacaína o levobupivacaína, 40–50mg) asociado a corticoides (metilprednisolona 40mg o clonidina 50–75μg) y al uso de acetaminofén y AINEs. Este esquema puede ser repetido hasta tres veces. Si el dolor es suficientemente intenso, el uso de analgésicos potentes como tramadol pueden ser usados como primera línea, en combinación con acetaminofén. Acetaminofén con codeína también es una posibilidad, dejando a la morfina como la última opción (P. Lavand’homme, comunicación personal, 2005).
La mayor parte del tiempo el dolor incluye un componente neuropático. Si las infiltraciones con anestésicos locales no son útiles, el uso de coadyuvantes pueden ser de utilidad, tales como antidepresivos o anticonvulsivantes. Estos últimos actúan mejor en los casos en que el dolor se asocia a sensaciones de descarga eléctrica. Puede ser utilizada la amitriptilina en bajas dosis (el efecto antihiperalgésico se obtiene a menores dosis que el efecto antidepresivo), 25mg hasta un máximo de 75mg antes de dormir. Para los anticonvulsivantes, puede agregarse gabapentina (100mg hasta 1.800mg al día) o pregabalina (75mg hasta 300mg al día). Debe advertirse a las pacientes que pueden aparecer efectos colaterales como mareos y náuseas, por lo que se debe titular la dosis en forma progresiva (P. Lavand’homme, comunicación personal, 2005).
Es muy probable que la aproximación multimodal al dolor post operatorio sea la forma de tratamiento más racional y efectiva, con el beneficio adicional de reducir las dosis y los efectos colaterales. Si bien las técnicas regionales son la base del tratamiento, la evidencia actual apoya fuertemente que combinarlas con AINEs sistémicos pueden ser una alternativa más efectiva (82). Algunos autores han sugerido que la adición de pequeñas dosis de ketamina potencian la analgesia por opioides, previenen la tolerancia de éstos, mejoran la calidad de la analgesia y reducen la hiperalgesia (74).
El autor declara no tener conflictos de interés, en relación a este artículo.