El cáncer gástrico persiste como un problema importante de salud pública a nivel mundial. En Chile es la primera causa de mortalidad por tumores malignos. En 1962 se definió el concepto de cáncer gástrico precoz, pasando a ser una enfermedad curable si era pesquisado en estas etapas, con sobrevida de 90% o más a 5 años. La estrategia implementada en Japón para detectarlo en etapas precoces fue a través de estudios masivos en población presuntamente asintomática. Esta estrategia ha sido exitosa en los cánceres detectados en etapa precoz pero con alto costo y bajo rendimiento, no aplicable en países en desarrollo con alto riesgo. La endoscopía ha desplazado a la radiología en el estudio de las enfermedades del tubo digestivo. Otra forma de enfrentar el problema en países en desarrollo con alto riesgo, es focalizar la endoscopía en sujetos sintomáticos. Desde 1996 se desarrolla un programa de detección de cáncer gástrico mediante esta última estrategia en la comuna de La Florida, Región Metropolitana. Se presenta un análisis preliminar de 12 años de este programa y se comentan las dificultades para un diagnóstico precoz.
Gastric cancer continues to be an important worldwide public health problem. In Chile, it is the first cause of mortality by malignant tumors. In 1962 the concept of early gastric cancer was defined; it became a curable disease if detected at this stage, with a five year survival rate of at least 90%. The strategy implemented in Japan for early detection was through mass survey in asymptomatic population. This strategy was successful in the proportion of cancers detected at an early stage but with high cost and low efficiency, not feasible in developing countries with high risk. Endoscopy has displaced radiology as a way of assessment of digestive tube diseases. Another approach to this problem in developing countries is focusing the endoscopy in symptomatic patients. Since 1996 a gastric detection program has been in place based on this strategy in the municipality of La Florida, in Santiago. A preliminary analysis of 12 years of this program is presented and the difficulties for early diagnosis are discussed.
El cáncer gástrico sigue siendo un problema de salud pública a nivel mundial. La incidencia no presenta un patrón geográfico consistente habiendo diferencias importantes entre países y dentro de un mismo país, cuyas causas no han sido aclaradas aún cuando se han planteado algunas hipótesis dentro de las cuales destacan factores raciales y nivel socioeconómico. A pesar de la declinación en las tasas de mortalidad en el siglo pasado, principalmente en los países desarrollados, actualmente es una importante causa de muertes por tumores malignos en países de Asia del Este, Europa Central y del Este y América Latina. A nivel mundial persiste como la segunda causa de muerte con cifras de fallecidos anualmente sobre 700.000 para ambos sexos (1-3). Chile ocuparía el 5a lugar a nivel mundial entre 50 países seleccionados, en el periodo1986-1988 (4). La tasa de mortalidad en Chile había venido declinando hasta la década de los 80 y desde esa fecha se estabilizó en cifras de alrededor 20 por 100.000 habitantes (5), representando la primera causa de muerte por tumores malignos para ambos sexos y en los hombres, y la tercera causa en mujeres y en números absolutos alrededor de 3000 muertes anuales. Como en otras partes del mundo también en nuestro país presenta importantes variaciones geográficas, con las mayores tasas de mortalidad en la VII, VIII, IX y X región y las menores, en las regiones extremas, con diferencias además en comunas de una misma región (6).
Es el doble más frecuente en el hombre que en la mujer, observación para la cual no ha habido una hipótesis clara. Aún cuando puede presentarse a cualquier edad, su frecuencia bajo los 40 años es muy baja, desde esta edad, comienza a aumentar alcanzando su mayor incidencia en el grupo entre los 60 y 80 años.
En la mayoría de los pacientes el diagnóstico es tardío estimándose la sobrevida a 5 años en alrededor de 20%. Un estudio reciente basado en registro poblacional de cáncer, muestra que la realidad nacional es aún peor, con sobrevida de 12,3% a 5 años, confirmando un estudio previo de una serie hospitalaria (12,2%) (7, 8).
Este sombrío pronóstico ha significado que la búsqueda de estrategias preventivas sean de vital importancia, por un lado identificar aquellos factores de riesgo que permitan una intervención que impida el desarrollo del cáncer, denominada prevención primaria y por otro lado identificar los grupos de mayor riesgo y definir las modalidades de investigación para un diagnóstico y tratamiento precoz, denominada prevención secundaria, cuyos objetivos son incrementar el número de pacientes pesquisados en etapa precoz, mejorar la sobrevida y disminuir la tasa de mortalidad, con métodos diagnósticos y tratamientos que tengan los menores riesgos.
Prevención secundariaLa sobrevida del cáncer gástrico está dada por la profundidad de la lesión, el compromiso ganglionar y la presencia de metástasis. La mayor parte de los pacientes son diagnosticados tardíamente, alrededor de un 40% de pacientes ya están diseminados al momento del diagnóstico y otro porcentaje importante, con lesiones avanzadas, en que a pesar de cirugías radicales, la mayoría fallecen por persistencia y progresión de la enfermedad.
El año 1962 la Sociedad Japonesa de Endoscopía Gastroenterológica estableció el concepto de cáncer gástrico incipiente, que era aquel cáncer cuya profundidad estaba limitada a la mucosa o hasta la submucosa, independiente del compromiso ganglionar, definiendo además las características macroscópicas de estas lesiones precoces, que fueron clasificadas en protruidas, superficiales, a su vez subdividas en tres, y ulceradas, lo que dio origen a lo que se conoce como Clasificación Japonesa de Cáncer Gástrico Incipiente, diferenciándola de la clasificación de Borrmann utilizada para el cáncer gástrico avanzado. Al definir las características macroscópicas de estas lesiones iniciales era posible un diagnóstico y tratamiento precoz, y pasaba a ser una enfermedad curable.
Pesquisa de cáncer gástrico mediante estudios masivosComo una forma de hacer una pesquisa precoz en Japón se comienzan a realizar estudios masivos en población presuntamente asintomática, ya que se pensaba que en etapas precoces los pacientes no tenían síntomas. Los exámenes mayoritariamente son realizados por unidades móviles con equipamiento para realizar radiología contrastada miniaturizada, lo cual permite seleccionar pacientes con lesiones sospechosas y de ahí se derivan a radiología con técnicas de doble contraste y luego a endoscopia y biopsia. Este programa ha tenido bastante éxito en la pesquisa precoz. En 1993 cerca de 6 millones de personas fueron investigadas por estudio masivo, representando alrededor de un 14% de la población sobre 40 años. La tasa de detección de cáncer fue de 0,11% con un 60% de cánceres diagnosticados en etapa precoz. El costo para detectar un cáncer fue de alrededor de 5 millones de Yens y 10 millones para detectar un cáncer en etapa precoz (9). Este programa ha sido muy importante en el desarrollo del conocimiento de esta patología y también en los avances tecnológicos. Sin embargo se trata de un programa de alto costo y bajo rendimiento, imposible de llevar a cabo en países en desarrollo, con alto riesgo y por otro lado la adhesión de la población a este tipo de programas ha sido bajo.
Corea del Sur, con altas tasas de mortalidad por esta causa desde 1999, ha implementado como parte de un plan estratégico de control de cáncer, similar estrategia a la de Japón. Las personas son invitadas a participar en este programa ofreciéndoles la alternativa de radiología o endoscopia, destacando la misma situación de Japón, con bajos porcentajes de adhesión a este tipo de programas. Los factores relacionados con los bajos porcentajes de participación en programas de detección de cáncer gástrico en Corea estarían asociados a nivel de ingresos, nivel educacional, consumo de alcohol y tabaco y actitud de las personas frente a planes preventivos de salud (10).
En Chile en 1976, Hoffemberg desarrolla por primera vez un programa de detección en voluntarios sanos de una industria de la Región Metropolitana, encontrando 2 casos en 849 sujetos con un rendimiento de 0,23% (11). En 1978, Llorens inicia un programa de detección masivo, pesquisando 261 casos hasta 1986, con un rendimiento de 0,43% y 14,7% de incipientes en el grupo asintomático y un rendimiento mayor 1,27% pero con menor porcentaje de incipientes, 11%, en el grupo sintomático (12).
Pesquisa de cáncer gástrico en pacientes sintomáticos mediante endoscopíaLa endoscopia con los importantes avances tecnológicos que ha tenido en los últimos años, mejorando notablemente las imágenes, ha desplazado a la radiología en el examen del tubo digestivo, siendo actualmente el método de elección en el estudio de la patología digestiva.
Es países occidentales se han incrementado en forma importante las unidades de endoscopía y endoscopistas, esto sin embargo, no ha significado una mayor pesquisa de cánceres en etapa precoz. Ni el acceso libre a las unidades de endoscopía de pacientes derivados desde la atención primaria ni la evaluación previa por gastroenterólogos ha permitido mejorar las tasas de diagnóstico precoz.
Desde el punto de vista de la sintomatología, aún cuando las etapas precoces no tienen síntomas específicos, desde hace muchos años se sabe que alrededor de un 50% de los pacientes sometidos a estudios masivos, no eran realmente asintomáticos y presentaban algún tipo de molestias digestivas (13). Por otro lado se sabe que cánceres en etapa precoz pueden tener ciclos de ulceración y cicatrización y que el uso de medicación antiulcerosa podría retardar el diagnóstico (14,15). En consecuencia existe un porcentaje de cánceres incipientes que podrían pesquisarse en etapa precoz en pacientes sintomáticos.
Pesquisa de cáncer en pacientes sintomáticos en comuna de la florida (Comunicación preliminar)Hallissey desarrolló un programa de detección mediante endoscopia en pacientes con dispepsia sobre 40 años y obtuvo un rendimiento de un caso cada 47 endoscopías (2%) con 26% de detección precoz y un 63% de resecabilidad (16).
Resultados preliminaresDesde 1996 se desarrolla un programa de detección de cáncer gástrico mediante endoscopía en personas sintomáticas de 40 años y más, en la comuna de La Florida, Santiago. Los primeros cuatro años de este programa mostraban un rendimiento de 1,7%, mayor en los hombres (4,5%) que en las mujeres (0,7%). Un 20% de las lesiones fueron pesquisadas en etapa precoz y un 60,8% de los pacientes fueron resecados (17).
Una modificación en el programa a partir del año 2001 y concordado con los médicos de la atención primaria, ha sido el cambio de la tradicional hoja de interconsulta por una nueva hoja de derivación que permite unificar el interrogatorio gastroenterológico y una mejor selección de los pacientes a nivel primario, y en la unidad de endoscopía, mejorar la gestión en el otorgamiento de horas, priorizando adecuadamente las solicitudes, siendo las más prioritarias las de aquellos pacientes que nunca han sido sometidos a endoscopía.
Un análisis preliminar y resumen de 12 años, desde la implementación de este programa, confirma que la población derivada para endoscopía sigue siendo preferentemente del sexo femenino (70%). Se corrobora el buen rendimiento endoscópico en la detección de cáncer en pacientes sintomáticos, mejorando incluso a lo publicado anteriormente, tanto en hombre como en mujeres, como para ambos sexos. La detección de cáncer incipiente llega a un 32,5%, siendo superior en las mujeres que en los hombres, tanto en relación al total de cánceres diagnosticados, como porcentaje de los pacientes resecados, 40,3% y 47,5%, con una resecabilidad en las mujeres de un 76,6%, confirmando que, a pesar que el rendimiento en la detección de cáncer es más bajo en las mujeres que en los hombres, la consulta sería más precoz. La sobrevida a 5 años de todos los casos diagnosticados ha sido de 41,5%, siendo mayor en las mujeres que en los hombres (Tabla 1) (18), casi 4 veces a la sobrevida del registro poblacional de Valdivia (12,3%) (7) y superior, aún cuando no son comparables por tratarse de poblaciones diferentes, a la última serie quirúrgica publicada en Chile (33%)(19).
Programa de pesquisa cáncer gástrico comuna de la florida periodo 1996-2008 (DATOS PRELIMINARES)
| Hombres (%) | Mujeres (%) | Total (%) | |
|---|---|---|---|
| Rendimiento endoscópico en detección de cáncer | 5,2 | 1,1 | 2,3 |
| Incipientes / Total de cánceres | 28,7 | 40,3 | 32,5 |
| Frec. absoluta | Frec. absoluta | Frec. absoluta | |
| 45/157 | 31/77 | 76/234 | |
| Resecabilidad | 63,0 | 76,6 | 67,5 |
| Incipientes / Total de resecados La diferencia absoluta de los ca incipientes pesquisados y los que se resecaron son 9. Estos no fueron a resección porque tenían contraindicación médica y rechazaron el tratamiento. | 39,4 | 47,5 | 42,4 |
| Frec. absoluta | Frec. absoluta | Frec. absoluta | |
| 39/99 | 28/59 | 67/158 | |
| Sobrevida a 5 años | 35,9 | 52,8 | 42,5 |
Se puede concluir que la estrategia utilizada en pacientes sintomáticos logra un buen rendimiento en la detección de cáncer, con porcentajes de cánceres incipientes aceptables, especialmente en las mujeres en que los resultados se acercan a los obtenidos por los estudios masivos y que mejora definitivamente la sobrevida. La respuesta de sí, este programa de prevención secundaria ha logrado disminuir la tasa de mortalidad en la comuna, se desconoce.
En el año 2006 el cáncer gástrico fue incorporado en el plan AUGE, con una estrategia similar, que permitió implementar en todo el país la tecnología requerida y el financiamiento para el diagnóstico y tratamiento de los pacientes en plazos definidos, además de asegurar la identificación de los portadores de Helicobacter pylori mediante test de Ureasa y su erradicación, desconociéndose hasta la fecha, los resultados de la implementación de este estrategia a nivel nacional.
Dificultades del diagnósticoDel conocimiento y experiencia adquirida en el desarrollo de este programa se podría concluir que habría al menos tres factores que dificultan el diagnóstico:
-de los pacientes: una forma de comprender la importancia de las latencias entre el inicio del cáncer, aparición de síntomas y el diagnóstico y tratamiento del paciente, es conocer la historia natural del cáncer gástrico. Tsukuma estudia pacientes con diagnóstico de cáncer incipientes que por alguna razón no fueron operados o la cirugía fue postergada, concluyendo que a los 44 meses el 50% de los pacientes había progresado a avanzados (20). Kohli estudia el aumento del volumen tumoral y estima que el tiempo de duplicación tumoral en los incipientes va de 1,6 a 9,5 años y en los avanzados de 69 a 305 días (21). Como conclusión se puede decir que tanto en los avanzados como incipientes habría tumores de crecimiento lento y otros de crecimiento más agresivo.
Un estudio reciente chileno ha mostrado que muchos pacientes tuvieron largos periodos sintomáticos antes de confirmarse el diagnóstico (22), ratificando los hallazgos del registro de Valdivia (7). Una explicación para esta latencia entre la aparición de síntomas y la consulta, podrían ser factores similares a la baja adhesión en los programas de pesquisa desarrollados en Corea como son, bajo nivel socioeconómico, baja escolaridad, alcoholismo y tabaquismo, todos factores de riesgo asociados a cáncer gástrico (10). El éxito de este programa en las mujeres estaría dado además, por la cultura de estas a una mayor receptividad hacia los programas de prevención y control. Por lo tanto un importante avance sería crear conciencia en la población, especialmente masculina, mediante campañas de educación, a consultar precozmente frente a una dispepsia o epigastralgia de intensidad variable que dure más de 15 días y no recibir medicación o automedicarse con drogas antiulcerosa sin tener un diagnóstico endoscópico. Por otro lado las unidades de endoscopía debieran, especialmente las del sector público, mejorar la gestión de sus unidades y lograr seleccionar y priorizar aquellos pacientes que requieren con más urgencia un examen endoscópico.
-calidad de la endoscopía: el diagnóstico de las lesiones precoces es un desafío para el endoscopista ya que son lesiones sutiles y fácilmente no detectadas. El valor del diagnóstico endoscópico descansa en la acuciosidad del endoscopista en observar en detalle las diversas zonas anatómicas y poder detectar cualquier irregularidad de la mucosa. El uso de tinción durante el examen endoscópico ha sido un complemento importante en la detección de estas irregularidades y definir con más precisión el lugar para la toma de biopsia. Los avances tecnológicos desde los equipos de fibra hacia videoendoscopios electrónicos han mejorado ostensiblemente la visión de la mucosa proporcionando imágenes de alta resolución. A pesar del enorme conocimiento acumulado y los importantes avances tecnológicos, estudios realizados en Japón han demostrado que el porcentaje de falsos negativos puede llegar a un 19% (23). Se puede suponer que estas cifras debieran ser mayores en Occidente aún cuando no hay trabajos similares que lo avalen. Uno de los factores que puede influir, es que la mucosa gástrica, a diferencia de otras mucosas del tubo digestivo, presenta muchos cambios inflamatorios e histológicos a través del tiempo, como consecuencia de la alimentación, el consumo de sustancias irritantes, medicamentos, infecciones bacterianas y virales, lo que dificulta el diagnóstico endoscópico.
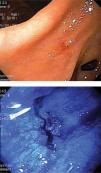
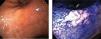
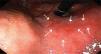
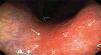
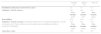
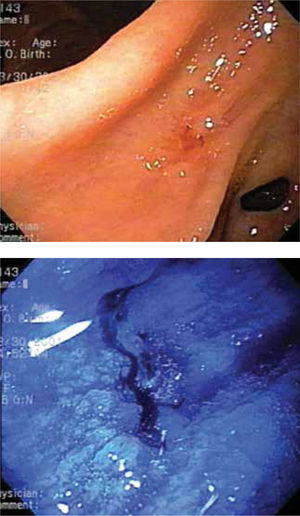
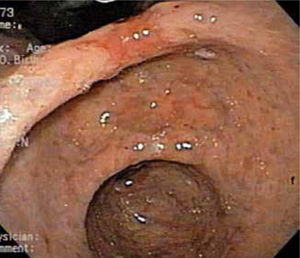
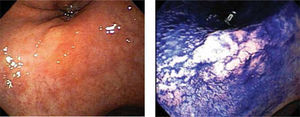
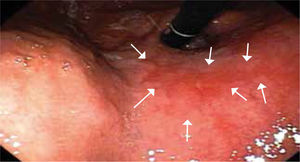
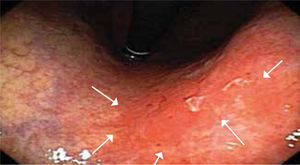
Otra dificultad está dada por las características macroscópicas de las lesiones precoces, algunas como el tipo I y III según la clasificación japonesa son de fácil visualización, aún cuando en este último caso, el diagnóstico diferencial con una úlcera péptica solo es posible mediante el estudio histológico. El tipo IIc definido como semejante a una cicatriz por la convergencia de pliegues, es relativamente fácil de visualizar, pero en algunos casos esta convergencia es muy tenue (Figura 1) o en otros casos y solo se observa un área deprimida (Figura 2). El tipo IIa y especialmente el IIb, son las lesiones que presentan las mayores dificultades de identificar, el primero por ser una lesión plana levemente solevantada (Figura 3) y el segundo por ser plana y solo destaca un cambio de coloración localizado de la mucosa (Figura 4). En estas lesiones la sospecha es mayor cuando además del cambio de color, se observan puntos rojos y/o puntos erosivos (Figura 5).
Un tercer factor se refiere a la localización de las lesiones. A pesar que con los modernos endoscopios es posible no tener zonas ciegas, existen áreas que presentan mayores dificultades. En nuestra serie pudimos determinar que tanto los avanzados como incipiente se originan mayoritariamente en el cuerpo gástrico (16). Un análisis más detallado y con un mayor número de casos en etapa precoz, ya que en los avanzados por el diámetro de las lesiones es difícil precisar el lugar anatómico de origen, hemos podido establecer que existirían áreas de la mucosa gástrica con mayor riesgo de desarrollar cáncer. Estas áreas corresponderían en primer lugar, a la mitad superior del cuerpo gástrico; un 50% de las lesiones diagnosticadas estaban localizadas en esta zona, predominando la cara posterior y en segundo lugar la curvatura menor. El segundo lugar anatómico como área de riesgo sería la zona angular; un 24 % de las lesiones estaban ubicadas en el ángulo, curvatura menor y ambas caras (Tabla 2) (datos no publicados).
-biopsia endoscópica: la confirmación diagnóstica de la sospecha de cáncer es mediante el estudio histológico. Una limitación importante de la biopsia endoscópica es el tamaño de la muestra. En lesiones precoces, no siempre hay correspondencia entre la visión endoscópica y los hallazgos histológicos, existiendo casos con heterogeneidad dentro de la muestra, con atipias celulares y glandulares de diferente grado. Sin embargo el punto de mayor discusión es el criterio utilizado para el diagnóstico histológico de cáncer gástrico y la interpretación de lesiones borderline. Como una forma de aclarar y objetivar estas diferencias fueron invitados a Tokio ocho reconocidos patólogos de EE.UU., Europa y Japón a una reunión donde cada uno debía analizar 35 muestras histológicas obtenidas de biopsias o resecciones endoscopias debiendo fundamentar las razones del diagnóstico de cada lesión. Las muestras incluían desde epitelio reactivo hasta lesiones definitivamente cancerosas. Los resultados se muestran en la Tabla 3, donde se puede apreciar que salvo para el diagnóstico de epitelio reactivo, donde existe concordancia entre patólogos occidentales y japoneses, en el resto de las lesiones las diferencias son marcadas, solo un 20% de las lesiones fueron definitivamente cáncer para los patólogos occidentales contra un 80% de los patólogos japoneses. Para los patólogos japoneses bastaría para el diagnóstico de cáncer solo las alteraciones celulares, en cambio para los patólogos occidentales además de las alteraciones celulares, debieran haber cambios en la estructura glandular.
Diagnóstico histológico: variaciones interobservadores
| Diagnóstico | Criterio Occidental | Criterio Japonés | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| KL | RR | PS | TOTAL | MS | MI | YK | TS | HW | TOTAL | |
| Epitelio Reactivo | 2 | 3 | 1 | 6 (6%) | 1 | 2 | 3 | 3 | 2 | 11 (6%) |
| DBG/Adenoma | 3 | 8 | 9 | 20 (19%) | 1 | 1 | 1 | 1 | 1 | 5 (3%) |
| DAG/Adenoma | 14 | 8 | 17 | 39 (37%) | 1 | 1 | 2 | 2 | 1 | 7 (4%) |
| Sospecha de Ca | 7 | 7 | 5 | 19 (18%) | 0 | 4 | 5 | 3 | 0 | 12 (7%) |
| Definitivamente Ca | 9 | 9 | 3 | 21 (20%) | 32 | 27 | 24 | 26 | 31 | 140 (80%) |
| TOTAL | 35 | 35 | 35 | 105 (100%) | 35 | 35 | 35 | 35 | 35 | 175 (100%) |
Lancet 1997; 349: 1725-1729.
Pero además existirían diferencias entre patólogos con una misma escuela, diferencias que son más marcadas entre los patólogos occidentales corroborando las dificultades del diagnóstico de estas lesiones iniciales.
Las dificultades en la interpretación de la biopsia se confirman al analizar la serie de incipientes diagnosticadas en el programa. Hubo correlación entre la sospecha endoscópica y la confirmación histológica en el 62,3%; el resto requirió 2 o más estudios adicionales para confirmar el diagnóstico. Por otro lado en un 8% el diagnóstico fue hecho por el estudio histológico frente a una lesión presuntamente benigna (Tabla 4) (datos no publicados).
concordancia endoscopía-histológia en cáncer gástrico incipiente. período 1996-2006 (62)
| Endoscopía | Diagnóstico Histológico | ||||||
|---|---|---|---|---|---|---|---|
| Lesión Sospechosa (57) | CA | Displasia Intensa | Displasia Moderada | Atipías | Adenoma | Gastritis Cronica | Metaplasia |
| 1a Endoscopía | 38 | 5 | 4 | 7 | 1 | 2 | |
| 2a Endoscopía | 14 | 2 | 2 | 1 | |||
| 3a Endoscopía | 2 | 2 | 1 | ||||
| 4a Endoscopía | 2 | 1 | |||||
| 5a Endoscopía | 1 | ||||||
| 6a Endoscopía | 1 | ||||||
| LESIÓN BENIGNA (5) | 5 | ||||||
Como consecuencia de esto se ha propuesto una clasificación para la biopsia endoscópica que debiera ser incluida en el informe de la biopsia y permitiría al endoscopista definir que pacientes deben controlarse endoscópicamente hasta tener un diagnóstico preciso (24).
La relación entre patólogos y endoscopistas debiera ser de una estrecha colaboración y tener reuniones conjuntas especialmente de los casos de difícil interpretación y de aquellos pacientes con diagnóstico definitivo de cáncer incipientes en los cuales se plantean tratamientos menos agresivos, donde una parte importante de la decisión es el resultado histológico.
Por último los conocimientos que se entregan en las escuelas de medicina, tanto en pre como postgrado, debieran poner énfasis en la prevención secundaria como así mismo en la prevención primaria. A nivel poblacional fomentar campañas publicitarias que permitan educar en medidas preventivas.
El autor declara no tener conflictos de interés, en relación a este artículo.