Para el diagnóstico de mesotelioma se requiere distinguir entre afectación mesotelial benigna y maligna, y entre mesotelioma maligno y carcinoma metastásico. Para ello son necesarias técnicas inmuno-histoquímicas realizadas sobre biopsias amplias. La toracoscopia es la técnica de elección, aunque la biopsia con aguja usando técnicas de imagen en tiempo real puede ser muy útil si hay marcado engrosamiento nodular. Es improbable que la cirugía radical (pleuroneumonectomía) sea realmente curativa, por lo que está ganando adeptos la reducción de masa tumoral mediante pleurectomía/decorticación, con asociación de quimioterapia y radioterapia a la cirugía (terapia multimodal). Cuando la resección no es factible se plantea quimioterapia, con pleurodesis o colocación de un catéter pleural tunelizado si se requiere el control del derrame pleural y se reserva la radioterapia para tratar la infiltración de la pared torácica. También es esencial un completo control del dolor (que adquiere particular protagonismo en esta neoplasia) en unidades especializadas.
Diagnosis of malignant pleural mesothelioma requires making the distinction between benign mesothelial hiperplasia and true mesothelioma, and between malignant mesothelioma and metastatic pleural adenocarcinoma. This involves immunohisto-chemical techniques applied on large biopsy specimens, and thoracoscopy is the best choice for obtaining them. Real-time image-guided needle biopsy can also be very helpful in presence of marked nodular pleural thickening. Radical surgery (ie, extrapleural pneumonectomy) is unlikely to cure completely the patient, and cyto-reduction surgery with preservation of the underlying lung (pleurectomy/decortication), with addition of chemo and radiation therapy (muiltimodal treatment) is gaining adepts in the last few years. When surgery is not feasible at all, early chemotherapy -with pleurodesis or placement of a indwelling pleural catheter (to control the effusion if necessary)- is advisable. Radiation therapy should be reserved to treat chest wall infiltration in those cases, and complete control of pain in specialized units is also essential in those patients.
El mesotelioma era un raro tumor de la pleura hasta la primera mitad del siglo XX y la incertidumbre sobre su origen y características histológicas hizo que durante años se le incluyera en un grupo de tumores a los que se denominó “Endoteliomas” (cuyo origen se pensaba que residía en el endotelio de pequeños vasos), y posteriormente se estableció su origen mesodérmico. Desde la década de los 50 del pasado siglo se conoce su asociación con el asbesto1, particularmente en sus formas de “amianto azul” (o crocidolita) y “amianto blanco” (crisotilo), y también es bien conocida su relación con la exposición a erionita, que es un contaminante natural del suelo en varias regiones del mundo, particularmente en la región de Capadocia (Turquía), donde se observa incidencia muy elevada de este tumor, probablemente asociada también con una cierta susceptibilidad genética2. En aproximadamente el 80% de los casos de mesotelioma hay una clara relación causa-efecto con exposición laboral a asbesto, con un amplio espectro de profesiones implicadas3. Hay que tener en cuenta también la posible exposición ambiental, en general por vecindad con minas o fábricas donde se manipula el mineral o por contaminación a través de la ropa de trabajadores del asbesto4. Se ha demostrado una relación dosis-respuesta entre exposición acumulada a asbesto (altos niveles de exposición, duración de la exposición, o ambos) y mesotelioma maligno, y no hay ningún umbral por debajo del cual se descarte el riesgo de contraer la enfermedad5–7. El mesotelioma puede aparecer en cualquiera de las estructuras de origen mesodérmico embrionario (pleura, pericardio, peritoneo, “túnica vaginalis” y otras) pero la presentación más frecuente -en más del 90% de los casos- es la pleural. No obstante, su incidencia es relativamente baja y oscila entre los siete casos por millón de habitantes/año en Japón y los 40 en Australia, dependiendo fundamentalmente de la exposición a asbesto que se ha producido en décadas pasadas en esos países8. En Europa se estima la incidencia en 20 casos por millón/año, con notable variación entre países (también en relación con la historia de exposición a asbesto en el pasado), pero en todo caso se prevé un aumento global, en base al largo período de latencia entre exposición y manifestación de la enfermedad, que se sitúa alrededor de los 40 años, con un amplio margen entre los valores extremos (hasta 75 años en la serie de Bianchi y colaboradores)9. Basándose en el consumo de asbesto, se ha estimado que el pico de máxima incidencia de mesotelioma se registrará alrededor del año 2020 en Europa, con marcadas diferencias entre países10.
DIAGNÓSTICO DEL MESOTELIOMA PLEURAL MALIGNOLa sintomatología inicial del mesotelioma suele ser muy poco relevante clínicamente, con aparición de dolor torácico impreciso, persistente y con escasa relación con los movimientos respiratorios. En ocasiones puede presentar disnea, generalmente relacionada con presencia de derrame pleural, y en fases clínicamente tempranas es rara la pérdida de peso o cualquier otro síntoma; más adelante suele aparecer marcada retracción del hemitórax, y el dolor adquiere especial intensidad y persistencia.
Técnicas de imagen para el diagnóstico del mesotelioma pleuralEn primer lugar, la radiografía de tórax nos puede proporcionar información sobre la presencia de derrame y engrosamiento pleural difuso o masas, pero la tomografía computarizada (TC) -preferiblemente con contraste- es esencial para la elección de los pasos diagnósticos a seguir: un engrosamiento pleural difuso y con prominencias nodulares sugiere mesotelioma, especialmente en un paciente con historia de exposición previa a asbesto en cualquiera de sus modalidades11. Por otro lado, se ha sugerido que la estimación del volumen tumoral mediante TC puede ser importante para la toma de decisiones terapéuticas12. La resonancia magnética nuclear (RMN) proporciona un mejor contraste que la TC para definir la invasión de la pared torácica, pero no es capaz de detectar fiablemente la presencia de enfermedad metastásica en otras localizaciones13. Por otro lado, la TC es poco sensible para valorar una posible afectación ganglionar mediastínica -que tiene valor pronóstico relevante14,15- o la existencia de afectación pleural contralateral o peritoneal. Para investigar estos aspectos -y la presencia de posibles metástasis a distancia- es mucho más útil la tomografía de emisión de positrones (PET, positron emission tomography), especialmente si se combina con TC (PET-TC)16. La PET-TC juega un papel relevante en la estadificación preoperatoria del mesotelioma pleural maligno con vistas al pronóstico17,18, en la valoración de la respuesta al tratamiento y en la detección de posibles recidivas19, pero su sensibilidad es relativamente baja para detectar enfermedad N2 en esta enfermedad20. Por otro lado, pueden verse falsos positivos de PET en pleuritis tuberculosa21, empiema22 o en pacientes con historia de pleurodesis previa23. En todo caso, la combinación de varias técnicas puede proporcionar una valiosa información para establecer el pronóstico y la mejor estrategia terapéutica24.
Estudio del líquido pleural en el mesoteliomaLa toracocentesis puede proporcionar algunos datos sugestivos -pero rara vez diagnósticos- de mesotelioma: niveles altos de ácido hialurónico (>100,000 ng/ml) son altamente sugestivos de mesotelioma pleural maligno25, y también se atribuye un marcado valor pronóstico a este parámetro, de modo que un ácido hialurónico elevado se relaciona con mejor supervivencia26.
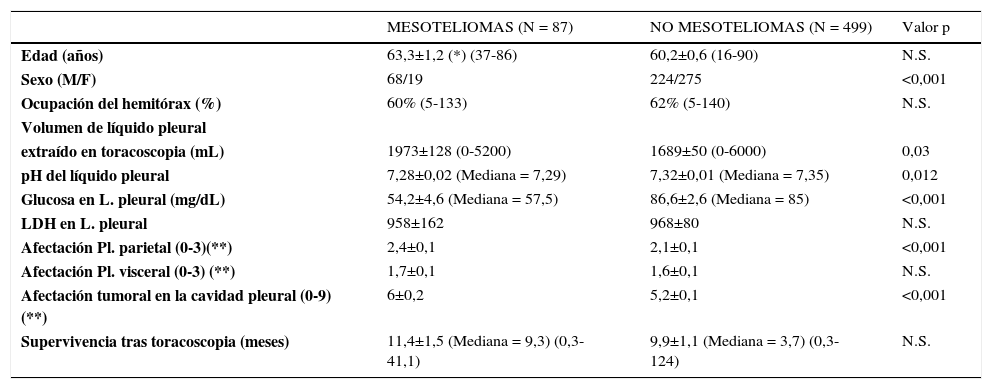
Los valores elevados de LDH en líquido pleural se han correlacionado con peor pronóstico27, con 500 U/L como punto de corte, pero parecen ser más relevantes el pH y la glucosa en el líquido pleural: Un pH y glucosa bajos se han relacionado con supervivencia más corta en derrames pleurales carcinomatosos28–31, y también tienen valor pronóstico en mesoteliomas. Es importante resaltar que el pH y la glucosa pleural son significativamente más bajos en mesoteliomas que en carcinomas metastásicos, como se puede observar en nuestra serie de derrames pleurales malignos sometidos a toracoscopia (ver Tabla 1).
Comparación entre mesoteliomas y carcinomas pleurales metastásicos en nuestra serie de pacientes con derrame pleural maligno y sometidos a toracoscopia
| MESOTELIOMAS (N = 87) | NO MESOTELIOMAS (N = 499) | Valor p | |
|---|---|---|---|
| Edad (años) | 63,3±1,2 (*) (37-86) | 60,2±0,6 (16-90) | N.S. |
| Sexo (M/F) | 68/19 | 224/275 | <0,001 |
| Ocupación del hemitórax (%) | 60% (5-133) | 62% (5-140) | N.S. |
| Volumen de líquido pleural | |||
| extraído en toracoscopia (mL) | 1973±128 (0-5200) | 1689±50 (0-6000) | 0,03 |
| pH del líquido pleural | 7,28±0,02 (Mediana = 7,29) | 7,32±0,01 (Mediana = 7,35) | 0,012 |
| Glucosa en L. pleural (mg/dL) | 54,2±4,6 (Mediana = 57,5) | 86,6±2,6 (Mediana = 85) | <0,001 |
| LDH en L. pleural | 958±162 | 968±80 | N.S. |
| Afectación Pl. parietal (0-3)(**) | 2,4±0,1 | 2,1±0,1 | <0,001 |
| Afectación Pl. visceral (0-3) (**) | 1,7±0,1 | 1,6±0,1 | N.S. |
| Afectación tumoral en la cavidad pleural (0-9) (**) | 6±0,2 | 5,2±0,1 | <0,001 |
| Supervivencia tras toracoscopia (meses) | 11,4±1,5 (Mediana = 9,3) (0,3-41,1) | 9,9±1,1 (Mediana = 3,7) (0,3-124) | N.S. |
(*) Los datos se presentan como media ± error estándar de la media.
(**) La cuantificación de la afectación tumoral se realizó siguiendo la metodología descrita previamente por nuestro Grupo (referencia 30).
Los niveles de adenosin-deaminasa (ADA) pueden encontrarse elevados en pacientes con mesotelioma32, pero -antes de etiquetarlos como falsos positivos del ADA- hay que tener en cuenta que en ocasiones pueden coexistir mesotelioma maligno y pleuritis tuberculosa, y por ello se recomienda hacer cultivo para M. tuberculosis en estos casos33.
La citología del líquido pleural puede sugerir la presencia de mesotelioma, pero con frecuencia plantea problemas entre hiperplasia mesotelial benigna y maligna34 y además es incapaz de demostrar el carácter invasivo del tumor (que actualmente se considera una característica esencial para el diagnóstico definitivo)35. No obstante, en la mayoría de los casos se pueden combinar citología y técnicas de imagen para valorar la invasión extrapleural36. Por otro lado, las técnicas inmunocito/histoquímicas son siempre necesarias para establecer la distinción entre mesotelioma y adenocarcinoma metastásico en la pleura37 y para ello se requiere tejido obtenido mediante biopsia, o bien bloques celulares preparados mediante inclusión en parafina del botón celular tras centrifugado de un volumen suficiente de líquido pleural (> 100ml). La combinación de todos los siguientes supuestos puede proporcionar con suficiente fiabilidad el diagnóstico de mesotelioma: proliferación mesotelial atípica en el líquido pleural + estudios inmunohistoquímicos compatibles con mesotelioma en bloques celulares + engrosamiento pleural difuso con nodulaciones + ausencia de masas en pulmón o cualquier otro órgano que sugieran otro tumor primario38. No obstante y especialmente por las implicaciones legales que supone el diagnóstico de mesotelioma maligno en la mayoría de los casos y también cuando se plantea intervención quirúrgica, hay que intentar siempre obtener muestras amplias de tejido para tipificar con mayor seguridad el tumor39.
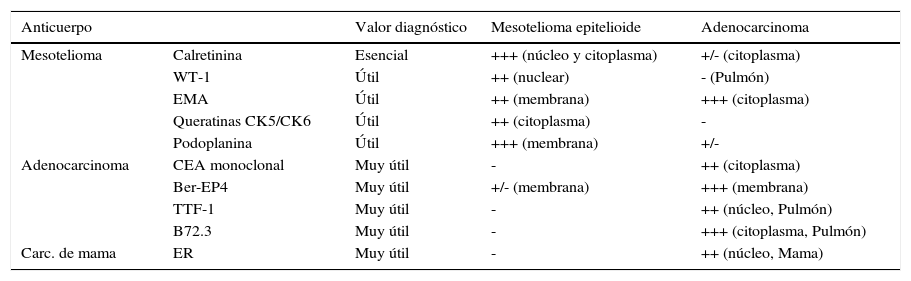
Aspectos histológicos del mesotelioma pleural malignoSe distinguen los tipos epitelioide, sarcomatoso y bifásico en el mesotelioma pleural maligno, pero también hay raros subtipos, como el mesotelioma desmoplásico (que se puede confundir con pleuritis fibrosa benigna), el mesotelioma de células pequeñas y el mesotelioma linfohistiocitoide (que podría confundirse con un linfoma), y los estudios inmunohistoquímicos son claves para establecer la distinción entre ellos. No obstante, no existe ningún marcador con 100% de sensibilidad y especificidad para mesotelioma y por ello es imprescindible acudir a distintos paneles de anticuerpos monoclonales, incluyendo al menos dos marcadores positivos para mesotelioma, en el subtipo epitelioide serían preferibles calretinina (particularmente útil si tiñe núcleo, además del citoplasma), WT-1, (Wilms tumor antigen 1) o EMA (epithelial membrane antigen) o citoqueratinas de amplio espectro y bajo peso molecular, como las CK5 o CK6 - y dos marcadores negativos, como el Ber-EP4 (marcador de membrana) y el TTF-1 (thyroid transcription factor 1, marcador nuclear). El CEA (carcinoembryonic antigen) es muy útil para distinguir carcinoma metastásico -especialmente de origen pulmonar- de mesotelioma (en el que prácticamente siempre es negativo), y en caso de sospecha de mesotelioma en mujer es conveniente testar también la expresión de ER (endoplasmic reticulum), que nunca aparece en mesotelioma y sí en tumores metastásicos de mama (ver Tabla 2). Cuando el tumor presenta un componente sarcomatoso es en muchas ocasiones necesario distinguirlo de tumores metastásicos, como el escamoso de pulmón o el carcinoma de células transicionales. Aunque algunos de los anticuerpos usados para el mesotelioma epiteliode son útiles aquí, con frecuencia hay que apoyarse en otros diferentes, como p63 y MOC 31 (Ver Tabla 3).
Marcadores para diferenciar mesotelioma epitelioide de otros tumores pleurales metastásicos con técnicas de inmunohistoquímica
| Anticuerpo | Valor diagnóstico | Mesotelioma epitelioide | Adenocarcinoma | |
|---|---|---|---|---|
| Mesotelioma | Calretinina | Esencial | +++ (núcleo y citoplasma) | +/- (citoplasma) |
| WT-1 | Útil | ++ (nuclear) | - (Pulmón) | |
| EMA | Útil | ++ (membrana) | +++ (citoplasma) | |
| Queratinas CK5/CK6 | Útil | ++ (citoplasma) | - | |
| Podoplanina | Útil | +++ (membrana) | +/- | |
| Adenocarcinoma | CEA monoclonal | Muy útil | - | ++ (citoplasma) |
| Ber-EP4 | Muy útil | +/- (membrana) | +++ (membrana) | |
| TTF-1 | Muy útil | - | ++ (núcleo, Pulmón) | |
| B72.3 | Muy útil | - | +++ (citoplasma, Pulmón) | |
| Carc. de mama | ER | Muy útil | - | ++ (núcleo, Mama) |
(WT-1 = Wilms tumor antigen 1, EMA = Epithelial membrane antigen, CEA = Carcinoembryonic antigen, TTF-1 = Thyroid transcription factor-1, ER = Endoplasmic reticulum marker). (Adaptado de Scherpereel et al, referencia 39) (Ver texto).
Marcadores para diferenciar mesotelioma sarcomatoide de otros tumores pleurales metastásicos usando técnicas inmunohistoquímicas
| Anticuerpo | Valor diagnóstico | Mesotelioma sarcomatoide | Adenocarcinoma | |
|---|---|---|---|---|
| Mesotelioma | Calretinina | Útil | +++ (núcleo y citoplasma) | + (citoplasma) |
| WT-1 | Útil | ++ (núcleo) | - | |
| Queratinas CK5/CK6 | No útiles | ++ (citoplasma) | +++ (citoplasma) | |
| Carcinoma escamoso | p63 | Muy útil | - | +++ (núcleo) |
| Ber-EP4 | Muy útil | +/- (membrana) | +++ (citoplasma) | |
| MOC 31 | Útil | +/- (membrana) | +++ (membrana) |
(WT-1 = Wilms tumor antigen 1) (Adaptado de Scherpereel et al, referencia 39) (Ver texto).
La biopsia pleural “ciega” (sin uso de técnicas de imagen en tiempo real) es poco satisfactoria para el diagnóstico de mesotelioma, no sólo por la falta de control en cuanto al punto exacto de donde se obtienen las muestras, sino también por el pequeño tamaño de éstas40. Cuando hay engrosamiento pleural nodular difuso, el rendimiento de la biopsia con aguja puede mejorar considerablemente si se realiza con la ayuda de TC41,42 o ecografía en tiempo real43. La toracoscopia (o pleuroscopia) es mucho más rentable porque permite la toma de más y mayores muestras, se puede realizar con anestesia local y analgesia/sedación intravenosa44, y nosotros hemos diagnosticado más de 80 mesoteliomas pleurales con este método45. La VATS (“video-assisted thoracoscopic surgery”) permite una mejor estadificación del tumor (especialmente en el área mediastínica) e incluso hacer pleurectomía/decorticación en casos seleccionados, pero requiere más recursos, incluyendo anestesia general e intubación traqueal46. El rendimiento de la pleuroscopia (también llamada “toracoscopia médica”) es sub-óptimo en el mesotelioma con componente sarcomatoso47, y entonces es preferible obtener muestras más representativas mediante VATS o mini-toracotomía48.
Diagnóstico precoz en el mesotelioma pleural malignoUno de los principales retos con que nos enfrentamos en el mesotelioma radica en el hecho de que, si bien tenemos identificada la población de riesgo (individuos expuestos de una u otra forma a asbesto), carecemos de herramientas para conseguir un diagnóstico suficientemente precoz que permita aplicar tratamiento radical. Esto implica la necesidad de biomarcadores capaces de detectar la enfermedad antes de que se desarrolle derrame o engrosamiento pleural difuso, y por ahora tampoco se dispone de técnicas de imagen con suficiente sensibilidad y especificidad para lograr ese objetivo.
Estudio de biomarcadores en el mesotelioma pleural malignoEl biomarcador que más atención ha recibido en los últimos años es la mesotelina soluble, que guarda una estrecha correlación con el tamaño y progresión tumoral en el mesotelioma de estirpe epitelioide, (no sarcomatoso, en el que suele ser negativo)49. No obstante, sus valores se influyen por la función renal, y uno de sus mayores problemas radica en la elección de un punto de corte adecuado para distinguir entre afectación pleural benigna y maligna50. En todo caso, parece claro que los niveles de mesotelina son más útiles en líquido pleural que en suero, y esto viene a limitar mucho su valor para el diagnóstico precoz en sujetos con historia de exposición a asbesto pero que no presentan derrame pleural. Ante una baja probabilidad pre-test de padecer mesotelioma, niveles bajos de mesotelina pueden ayudar a descartarlo, mientras que niveles altos refuerzan el uso de técnicas diagnósticas más invasivas en un paciente con sospecha de mesotelioma51-53. En todo caso, parece que la mesotelina es más útil para monitorizar el tratamiento que para el diagnóstico diferencial en los derrames pleurales54.
Tratando de superar los problemas de la mesotelina y otros marcadores, se ha publicado recientemente que la fibulina-3 es capaz de distinguir entre personas sanas con historia de exposición a asbesto y pacientes con mesotelioma, e incluso entre mesotelioma y otros procesos malignos o benignos de la pleura55. Estos excelentes resultados iniciales no han sido revalidados por otro estudio realizado recientemente en Australia -país con alta prevalencia de mesotelioma- y en el que se compararon los valores de mesotelina y fibulina-3 en las mismas muestras de plasma y líquido pleural. En este estudio se confirmó un mejor rendimiento diagnóstico de la mesotelina sobre fibulina-3, que sí mostró un buen valor predictivo de la supervivencia cuando sus valores se encontraban altos en el líquido pleural de pacientes con mesotelioma, sobre todo en el de tipo sarcomatoso o mixto56.
PERSPECTIVAS TERAPÉUTICAS DEL MESOTELIOMA PLEURAL MALIGNOEl mesotelioma suele tener escasa respuesta a quimioterapia y a radioterapia y la cirugía es raramente curativa, porque generalmente el tumor se diagnostica demasiado tarde y por ello tiene especial importancia la cuidadosa evaluación de cada paciente antes de elegir la mejor terapéutica. Si se está considerando la cirugía radical es crítico evaluar la función pulmonar y cardíaca, la presencia de otros factores de comorbilidad y el estado físico y psicológico del paciente. La elección entre las distintas opciones terapéuticas viene dictada por la situación clínica y los estudios de extensión tumoral (TNM) mediante técnicas de imagen. No obstante, ninguna de las técnicas disponibles en la actualidad es suficientemente precisa para asegurar la “T” y la “N” en el mesotelioma pleural maligno, y es muy frecuente que la estadificación post-quirúrgica supere ampliamente a la previa57. Hasta que se consiga una estadificación TNM más robusta, se aconseja seguir la establecida por la UICC (“Union Internationale contre le Cancer”)58 (ver Tabla 4).
Estadificación TNM del mesotelioma pleural maligno
| ESTADIO | Extensión tumoral |
|---|---|
| T1 | Infiltración unilateral de la pleura parietal |
| T1a | Infiltración de la pleura parietal, con o sin afectación de la pleura mediastínica o diafragmática, pero sin afectación visible de la pleura visceral |
| T1b | Infiltración de la pleura parietal y afectación focal de la visceral |
| T2 | Infiltración unilateral de la pleura parietal o visceral, con invasión del pulmón subyacente o del músculo del diafragma |
| T3 | Afectación unilateral de cualquier zona de la pleura y con invasión de al menos una de las siguientes estructuras: fascia endotorácica, grasa mediastínica, partes blandas de la pared torácica (focal), o invasión no transmural del pericardio |
| T4 | Afectación de cualquier zona de la pleura y con invasión de al menos una de las siguientes estructuras: cara interna del pericardio (con o sin derrame), peritoneo, estructuras mediastínicas, pleura contralateral, columna vertebral, invasión difusa de la pared torácica (con o sin destrucción costal) |
| N0 | Ausencia de afectación ganglionar |
| N1 | Afectación de ganglios broncopulmonares o hiliares ipsilaterales |
| N2 | Afectación ipsilateral de ganglios mediastínicos, de la a. mamaria interna y/o peridiafragmáticos |
| N3 | Afectación contralateral de cualquiera de las estaciones ganglionares mediastínicas y/o mamaria interna y/o supraclavicular |
| M0 | Ausencia de metástasis extratorácicas |
| M1 | Metástasis extratorácicas, hematógenas o en ganglios no regionales |
| ESTADIO I | T1aN0 (1A); T1bN0 (1B) |
| ESTADIO II | T2N0 |
| ESTADIO III | Cualquier T3, N1 ó N2 |
| ESTADIO IV | Cualquier T4, N3 ó M1 |
(Adaptado de van Meerbeeck et al, referencia 58).
El principal objetivo de la cirugía es resecar macroscópicamente todo el tumor, asumiendo que con ello se obtiene una mejor supervivencia, y que los pacientes en los que quedan restos de tumor visibles macroscópicamente la supervivencia es menor59. Sin embargo, la evidencia acumulada actualmente sugiere que no es posible conseguir una resección completa (macro y microscópica) en el mesotelioma pleural maligno, independientemente de la técnica quirúrgica que se aplique y por ello se acepta hoy que la cirugía se oriente básicamente a controlar localmente la enfermedad, eliminar el derrame pleural, liberar el pulmón atrapado por el tumor, mejorar los trastornos de la ventilación/perfusión y paliar el dolor provocado por la invasión de la pared torácica60. Todas estas consideraciones se aplican especialmente al mesotelioma de tipo epitelioide, ya que el de componente sarcomatoso o bifásico tiene peor pronóstico y es en consecuencia un peor candidato para cualquier tipo de cirugía57.
PleuroneumonectomíaImplica la resección en bloque del pulmón y la pleura parietal, y habitualmente se completa con resección pericárdica y del diafragma de ese lado, además de disección sistemática de las cadenas ganglionares mediastínicas. Aunque la mortalidad perioperatoria se sitúa alrededor del 5% en centros con amplia experiencia, tiene alta morbilidad, incluyendo complicaciones cardíacas, respiratorias (que pueden adquirir especial relevancia por la situación unipulmonar en que queda el paciente tras esta intervención), fístula broncopleural, empiema y sangrado, entre otras61,62. En todo caso, y a causa de la habitual persistencia de residuos macro o microscópicos de tumor, esta intervención se ha de plantear en el marco de una terapia multimodal, que se apoya en el uso combinado de cirugía, quimioterapia y radioterapia63. Ocasionalmente se ha usado también la hipertermia -combinada con quimioterapia- o la terapia fotodinámica locales64. En muchos de los protocolos de terapia multimodal se administra quimioterapia como tratamiento de inducción antes de la cirugía (quimioterapia neoadyuvante), y tras la resección se aplica radioterapia sobre el hemitórax afecto65. No obstante, las guías clínicas más recientes recomiendan descartar la cirugía si se observa progreso de la enfermedad tras la quimioterapia neoadyuvante y, en todo caso, recomiendan que la neumonectomía extrapleural se realice sólo en el contexto de ensayos clínicos bien controlados y por grupos especializados en esta técnica38,39.
Pleurectomía/decorticaciónAunque está asociada a mayor riesgo de recidiva local que la pleuroneumonectomía, presenta menos complicaciones que aquélla66, y se orienta fundamentalmente a liberar el pulmón y la pared torácica de la constricción provocada por el tumor. Los pacientes con presencia macroscópica difusa de tumor en la pleura parietal, pero sólo focal en la visceral, son los mejores candidatos para este tipo de cirugía. Puede realizarse mediante VATS, que presenta la ventaja de minimizar la morbilidad asociada a la toracotomía67,68 y se puede hacer pleurodesis en el mismo acto si la resección completa no es factible.
Aunque la neumectomía extrapleural plantea un abordaje más radical, en los últimos años se han cuestionado mucho sus ventajas sobre la pleurectomía/decorticación69,70, y en un reciente estudio randomizado en el Reino Unido (estudio MARS, “Mesothelioma and Radical Surgery”) no se demostró la superioridad de una sobre otra71. Por otro lado, el estudio MARS ha sido duramente criticado por las importantes desviaciones que se produjeron sobre el protocolo planteado inicialmente y por el número de pacientes que finalmente quedaron incluidos en cada una de las ramas del estudio72. En todo caso, y aunque para algunos grupos con amplia experiencia en ambas técnicas se considera inadecuado dejar restos de tumor macroscópicamente visible (lo que lleva a un peor pronóstico), va ganando adeptos la idea de resecar el mayor volumen posible del tumor pero preservando el pulmón subyacente y combinando en todo caso la cirugía con quimioterapia y radioterapia, en el marco de una terapia trimodal73.
Radioterapia en el mesotelioma pleural malignoLa radioterapia radical aplicada a todo un hemitórax está seriamente limitada por el riesgo de dañar órganos críticos como el pulmón, hígado, corazón, médula espinal y esófago, y para paliarlo se están optimizando las técnicas de aplicación74, aunque no hay evidencias convincentes de que por sí sola prolongue la supervivencia de los pacientes con mesotelioma75. Por otro lado, la radioterapia paliativa juega un papel importante para controlar el dolor provocado por infiltración de la pared torácica76,77. Clásicamente se había recomendado administrar radioterapia profiláctica para evitar la siembra tumoral en las cicatrices de toracoscopia o toracotomía78,79 pero esta práctica no está soportada por las evidencias disponibles y se desaconseja en la actualidad38,39.
Quimioterapia, inmunoterapia y otras terapias personalizadasEn las guías clínicas recientes se recomienda no demorar la administración de quimioterapia y se debería tomar en consideración antes de que aparezca deterioro funcional del paciente38,39. La combinación de varios agentes (incluyendo pemetrexed y compuestos de platino) produce en general mejores resultados que la monoterapia80,81. La tendencia actual se orienta a investigar nuevas dianas terapéuticas centradas en controlar angiogénesis y vías apoptóticas a través de ligandos específicos, incluyendo PDGF (“platelet derived growth factor”, que se sobreexpresa con bastante frecuencia en el mesotelioma y se asocia a peor supervivencia) y mesotelina (que se expresa sólo en el subtipo epitelial) entre otros82,83. También dentro de la terapia multimodal, la inmunoterapia puede jugar un importante papel en el tratamiento del mesotelioma, porque este tumor es capaz de evadir el sistema inmune a través de células T-reguladoras (Treg) y macrófagos M2. Por ello, nuevas estrategias terapéuticas que combinan la citoreducción quirúrgica, quimioterapia, inmunoterapia y radioterapia podrían conseguir un mejor control de la enfermedad84. Desde la inmunoterapia pasiva (usando citoquinas o anticuerpos específicos) hasta la modulación de la respuesta inmune mediante células dendríticas u otras, hay un amplio espectro de posibilidades para conseguir efectos antitumorales marcadamente sinérgicos85–87.
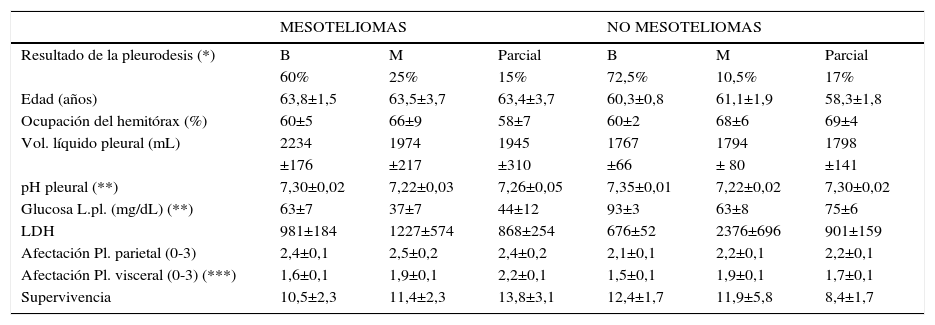
PleurodesisEl control del derrame pleural es prioritario en la mayoría de los pacientes con tumor pleural, incluyendo el mesotelioma y la pleurodesis con talco puede ser una buena opción. No obstante, en nuestra experiencia suelen producirse más fallos de la pleurodesis en este tumor que en otros (ver Tabla 5) y hay posibles explicaciones para ello:
- -
Dificultad para re-expandir adecuadamente el pulmón, enclaustrado por el tumor88. Así, estudios previos de nuestro Grupo evidencian que la extensión del tumor en la cavidad pleural influye negativamente sobre la pleurodesis89. El grado de afectación de la pleura visceral -que implica una mayor dificultad para la re-expansión pulmonar- guarda relación en nuestra serie de derrames pleurales malignos con el resultado de la pleurodesis (ver Tabla 5) y observamos una estrecha correlación entre esa afectación y el pH del líquido pleural (r=-0,402, p<0,001), de modo que un pH bajo hace más probable que la pleura visceral se encuentre afectada difusamente.
- -
Además de los factores mecánicos, es probable que influyan también en la pleurodesis otros factores biológicos no bien conocidos hasta la fecha. Desde hace varias décadas se ha relacionado el pH bajo en el líquido pleural con un peor pronóstico en mesoteliomas90 -y también en otros tumores- y con una peor respuesta a cualquier intento de pleurodesis91, aunque no quedan claros los mecanismos biológicos implicados. En los últimos años se está prestando mucha atención a la regulación del pH intra y extracelular en los tumores, especialmente en los más agresivos92–94 y parece que un pH extracelular ácido (que está muy relacionado con un contexto de hipoxia tisular)95 facilita la agresividad tumoral a través del hipoxia-inducible factor-1 (HIF-1), cuya sobre-expresión desencadena una serie de mecanismos supresores de la apoptosis en las células tumorales96. La aquaporina-1 parece intervenir en la regulación de este proceso97 y ya se están proponiendo algunas iniciativas basándose en estas nuevas dianas terapéuticas98.
- -
Por otro lado, y según recientes experimentos realizados “in vitro” por nuestro Grupo, las células mesoteliales malignas son más resistentes a la acción del talco que otras líneas celulares, y esto se pone de manifiesto tanto en la modulación/bloqueo de la angiogénesis como en la proliferación celular (datos no publicados).
Diferencias entre mesoteliomas y carcinomas pleurales metastásicos en nuestra serie de pacientes con derrame pleural maligno sometidos a toracoscopia y pleurodesis con talco
| MESOTELIOMAS | NO MESOTELIOMAS | |||||
|---|---|---|---|---|---|---|
| Resultado de la pleurodesis (*) | B | M | Parcial | B | M | Parcial |
| 60% | 25% | 15% | 72,5% | 10,5% | 17% | |
| Edad (años) | 63,8±1,5 | 63,5±3,7 | 63,4±3,7 | 60,3±0,8 | 61,1±1,9 | 58,3±1,8 |
| Ocupación del hemitórax (%) | 60±5 | 66±9 | 58±7 | 60±2 | 68±6 | 69±4 |
| Vol. líquido pleural (mL) | 2234 | 1974 | 1945 | 1767 | 1794 | 1798 |
| ±176 | ±217 | ±310 | ±66 | ± 80 | ±141 | |
| pH pleural (**) | 7,30±0,02 | 7,22±0,03 | 7,26±0,05 | 7,35±0,01 | 7,22±0,02 | 7,30±0,02 |
| Glucosa L.pl. (mg/dL) (**) | 63±7 | 37±7 | 44±12 | 93±3 | 63±8 | 75±6 |
| LDH | 981±184 | 1227±574 | 868±254 | 676±52 | 2376±696 | 901±159 |
| Afectación Pl. parietal (0-3) | 2,4±0,1 | 2,5±0,2 | 2,4±0,2 | 2,1±0,1 | 2,2±0,1 | 2,2±0,1 |
| Afectación Pl. visceral (0-3) (***) | 1,6±0,1 | 1,9±0,1 | 2,2±0,1 | 1,5±0,1 | 1,9±0,1 | 1,7±0,1 |
| Supervivencia | 10,5±2,3 | 11,4±2,3 | 13,8±3,1 | 12,4±1,7 | 11,9±5,8 | 8,4±1,7 |
(*) Resultados de la pleurodesis: B (bueno) = Control del derrame pleural durante todo el seguimiento de los pacientes, M (malo) = Recidiva del derrame pleural en cualquier momento del seguimiento, requiriendo evacuaciones repetidas. Parcial = Recidiva del derrame pleural en cualquier momento del seguimiento de los pacientes, pero con volumen inferior al que existía previamente a la pleurodesis y sin requerir evacuación. Los resultados de la pleurodesis fueron significativamente peores en mesoteliomas que en carcinomas pleurales metastásicos.
(**) El pH yl la glucosa pleural fueron significativamente más altos en los casos con pleurodesis eficaz (B), tanto en los mesoteliomas como en carcinomas metastásicos.
(***) La afectación de la pleura visceral fue significativamente menor en los casos con buen resultado de la pleurodesis en ambos grupos de tumores.
Cuando falla la pleurodesis, o si se considera que es poco factible por la presencia de pulmón atrapado masivamente por el tumor, la mejor opción es la inserción de un catéter pleural tunelizado, que permite la evacuación domiciliaria del líquido pleural e induce pleurodesis espontánea en una considerable proporción de casos 99–102.
Es importante tener en cuenta que la realización de pleurodesis previa no impide la resección quirúrgica en el caso del mesotelioma, independientemente de la técnica que se emplee (neumonectomía extrapleural o pleurectomía/decorticación)60.
CONCLUSIONES Y PERSPECTIVAS FUTURASPor lo explicado hasta ahora, es claro que el diagnóstico del mesotelioma pleural maligno se realiza en general demasiado tarde como para poder aplicar un tratamiento curativo, ya que en la gran mayoría de los casos la cirugía no consigue eliminar todo el tejido tumoral y por otra parte el tumor es poco sensible a quimio y radioterapia. Se impone por consiguiente la necesidad de desarrollar técnicas de imagen y biomarcadores más sensibles y específicos que los disponibles hasta ahora y también es necesario optimizar las opciones terapéuticas, con el objetivo final de lograr eliminar completamente el tumor en todas sus localizaciones.
En el momento actual parece que lo más realista sería dedicarse a la búsqueda de marcadores detectables en sangre periférica -especialmente en personas con historia de exposición laboral o ambiental a asbesto- y que posean adecuada sensibilidad y especificidad para detectar precozmente el mesotelioma maligno. Dentro de esta línea, el campo de investigación más prometedor se orienta -junto con el desarrollo de mejores técnicas de imagen- a la búsqueda exhaustiva de marcadores usando técnicas proteómicas, que analizan simultáneamente los perfiles de gran cantidad de proteínas (más de 1000) y permitirán preparar paneles configurados para conseguir la máxima sensibilidad y especificidad diagnósticas103,104.
En los últimos años se está trabajando intensamente en estudios de expresión génica en mesotelioma105, y se pone bastante énfasis en la expresión de determinadas proteínas como la aquaporina-1, que está relacionada con el transporte selectivo de agua a través de la membrana y con la proliferación celular106–108, y también destaca el estudio de micro-RNAs (miRNAs) en mesotelioma. Los miRNAs son RNA cortos (17 a 22 nucleótidos) no codificantes de proteínas, que regulan la expresión génica y juegan un importante papel en la oncogénesis109. Tienen alta especificidad tisular para detectar el origen de un tumor y también para distinguir mesotelioma de otros tumores metastásicos de la pleura110. Por otra parte, la detección de miRNAs en sangre periférica podría convertirlos en excelentes marcadores de mesotelioma en un próximo futuro111.
En muchos casos se ha planteado el uso de terapia génica en el mesotelioma para compensar la escasa eficacia de la inmunoterapia cuando el tumor está localmente muy avanzado. Para ello se acude a diferentes estrategias como el uso de “genes suicidas” (que transfieren al tumor la capacidad de hacerse sensible a determinadas drogas), la administración de genes oncosupresores o la transferencia de genes inmunomoduladores al espacio pleural 112–115. Aunque su aplicación clínica ha obtenido hasta ahora resultados bastante desalentadores, en buena parte por problemas relacionados con los vectores usados y su relativa ineficiencia para controlar una gran masa tumoral, es muy probable que la inclusión de la terapia génica en la estrategia multimodal y su combinación con técnicas basadas en nanotecnología contribuyan muy significativamente a mejorar las perspectivas de tratamiento del mesotelioma pleural maligno en el futuro. Combinando técnicas de biología molecular y nanotecnología, está emergiendo en los últimos años el concepto de “theranostics”, que pretende unir diagnóstico y tratamiento en el mismo procedimiento mediante el uso de drogas dirigidas específicamente a cada fenotipo de neoplasia. Si se consiguiera encontrar los ligandos adecuados, se podrían aplicar para el diagnóstico precoz de mesotelioma mediante PET o SPECT (single photon emission computed tomography)116–118. Se han desarrollado ya sondas combinadas con técnicas biofluorescentes altamente sensibles y que son capaces de detectar tumores en modelos animales119,120, y también hay técnicas basadas en anticuerpos marcados, combinados o no con nanopartículas, para uso con resonancia magnética nuclear121,122. Todo ello presenta un estimulante horizonte para su aplicación en humanos en un futuro no muy lejano.
El autor declara no tener conflictos de interés, en relación a este artículo.