La apnea obstructiva del sueño (AOS) y el síndrome hipoventilación-obesidad (SHO) son patologías que se encuentran estrechamente asociadas a la obesidad como principal factor de riesgo, hasta un 70% de los pacientes con AOS son obesos. Ambas patologías comparten procesos fisiopatológicos comunes, donde destaca la inflamación sistémica, lo que, sumado a la hipoxia crónica intermitente y la fragmentación del sueño característicos de la AOS, aumenta considerablemente el riesgo de presentar comorbilidades metabólicas como síndrome metabólico, alteraciones en el metabolismo de la glucosa (resistencia a la insulina y diabetes mellitus tipo 2), y hígado graso metabólico. En esta revisión narrativa, se describirán los mecanismos identificados en estas asociaciones, así como la prevalencia y la evidencia sobre el tratamiento de la AOS y del SHO.
Obstructive sleep apnea (OSA) and obesity-hypoventilation syndrome (OHS) are pathologies that are closely associated with obesity as the main risk factor, up to 70% of patients with OSA are obese. Both pathologies share common pathophysiological processes, where systemic inflammation stands out, which, added to the intermittent chronic hypoxia and sleep fragmentation characteristic of OSA, considerably increases the risk of presenting metabolic comorbidities such as metabolic syndrome, alterations in the metabolism of the glucose (insulin resistance and type 2 diabetes mellitus), and metabolic fatty liver. In this narrative review, the mechanisms identified in these associations will be described, as well as the prevalence and evidence on the treatment of OSA and OHS.
La apnea obstructiva del sueño (AOS) es una patología frecuente, se estima que alrededor de un billón de adultos entre 35 a 69 años están en riesgo1. Por este motivo, el AOS se ha convertido en un grave problema de salud pública debido a su alta prevalencia, la falta de acceso a exámenes de diagnóstico, y la asociación de AOS con un mayor riesgo de complicaciones a nivel social, laboral y cardiometabólicos.
En este artículo, se hace referencia la asociación entre AOS y obesidad, así como al compromiso del AOS en el metabolismo glucémico y hepático.
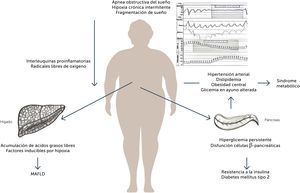
Cambios fisiopatológicos asociados a la hipoxiaLos fenómenos de desaturación de oxígeno e hipoxia crónica intermitente (HCI) generados como consecuencia de la obstrucción respiratoria de la vía alta durante el sueño producen una activación de mediadores inflamatorios que determinan daño en múltiples tejidos y sistemas. En modelos experimentales de laboratorio y en estudios clínicos, se ha logrado establecer distintos mecanismos que dan cuenta de un mayor riesgo de presentar complicaciones metabólicas relacionada al AOS. La obstrucción de la vía aérea y la fragmentación del sueño tienen como consecuencia una alteración en los ciclos de hipoxia y re-oxigenación2. Estas alteraciones producen eventos de isquemia transitoria sobre los tejidos, concepto conocido como hipoxia crónica intermitente (HCI)3. La HCI aumenta las concentraciones de radicales libre de oxígeno (ROS) que actúan como mediadores que aumentan la expresión de distintas interleuquinas (IL) pro-inflamatorias (IL-6, IL-8, IL-12, entre otras), lo que favorece un estado de inflamación sistémica. De manera complementaria, la HCI se asocia a una mayor activación del sistema simpático, favoreciendo la disfunción endotelial, desregulación metabólica y un estado de mayor coagulabilidad4. Todos estos mecanismos han sido identificados como patogénicos en distintos sistemas del organismo en modelos clínicos como experimentales.
Obesidad: el principal predisponenteLa obesidad es uno de los principales factores de riesgo para desarrollar AOS. Se estima que un 50% de los pacientes con obesidad (definida como un índice de masa corporal [IMC] ≥30kg/m2) tiene un diagnóstico de AOS, mientras que hasta un 70% de los pacientes con diagnóstico de AOS son obesos3. En Chile, la prevalencia de obesidad en pacientes con AOS es significativa, en base a los resultados del registro clínico de pacientes con estudio de AOS (SantOSA), desarrollado en Clínica Los Condes, la prevalencia de obesidad (IMC ≥30kg/m2) en la población con AOS moderado y severo es de un 55%5.
La interacción de la obesidad central se asocia con el aumento de tejido graso ectópico, en especial en el tejido subcutáneo cervical, lo que se puede estimar clínicamente con la medición de la circunferencia cervical usando una cinta de medir, un poco por debajo de la manzana de Adán. Este parámetro clínico tiene una alta especificidad para el diagnóstico de AOS en nuestra población. En un estudio chileno, una circunferencia cervical de 43 centímetros o más (talla de camisa XL o 17 pulgadas o más) se asocia a diagnóstico de AOS con una especificidad del 88%6. Otro hallazgo del examen clínico útil para evaluar la presencia de tejido graso ectópico y la relación con la vía área alta es la evaluación según la escala de Mallampati y la implementación del cuestionario STOP-BANG6,7.
Este aumento del tejido graso explica el mayor porcentaje de los fenómenos de colapso de la vía área superior. Esto se debe a que promueve la redistribución de la grasa y alargando la anatomía de la vía área. En estudios morfológicos se ha descrito que el aumento de peso se asocia a una infiltración significativa de grasa en la región para faríngea y de la lengua, lo que hace que el hioides se mueva hacia caudal y alargue las vías respiratorias en los pacientes, lo que se encuentra correlacionado con mayor número de eventos respiratorios8.
Finalmente, a nivel molecular, el tejido graso secreta diversas hormonas y citoquinas con un perfil especifico en condiciones de AOS. La leptina es una hormona secretada por los adipocitos y se asocia al aumento del tejido graso. En pacientes con AOS, se encontró que la HCI se asociaba significativamente con un aumento en la concentración de esta hormona. Mientras que el tratamiento con dispositivos de presión positiva continua (de la abreviación en ingles CPAP) en pacientes obesos con AOS, disminuye significativamente sus concentraciones. Otra hormona secretada por el adipocito es la grelina, esta hormona tiene un control sobre el apetito y la acumulación de tejido graso, actúa de manera fisiológica opuesta a la Leptina. En pacientes obesos con AOS, se encuentran concentraciones mayores que en los grupos controles, lo que sugiere que los pacientes obesos con AOS tienen una ingesta y un gasto calórico aumentado. Por último, la citoquina más estudiada en pacientes obesos con AOS es la adiponectina, en condiciones normales, las concentraciones elevadas de adiponectina se asocian a un menor riesgo cardiovascular, sin embargo, en pacientes obesos con AOS, las concentraciones se encuentran significativamente disminuidas, lo que se traduce en un mayor riesgo de presentar enfermedades cardiovasculares4.
Síndrome metabólico (SM)Los pacientes con AOS tiene un fenotipo clínico muy sugerente de SM, compartiendo factores comunes como la edad, el sedentarismo, determinantes socioculturales, incluso predisponentes genéticos. El SM corresponde al conjunto de factores de riesgo cardiovascular, definidos como la “Adult Treatment Panel III” (ATP III) y que incluye a la resistencia a la insulina, la hipertensión arterial, la dislipidemia y marcadores antropométricos de obesidad abdominal. En estudios poblacionales, como el estudio epidemiológico Hypnolaus, desarrollada en una comunidad en Suiza, la prevalencia de síndrome metabólico en pacientes con diagnóstico de AOS fue de 36% en hombres y 25% en mujeres, mientras que el riesgo de SM en AOS fue de OR 2,8.9 Se postula que la acumulación de grasa visceral, principalmente en el abdomen y el cuello, en conjunto a la inflamación sistémica y los fenómenos de HCI y fragmentación de sueño, serían los principales predisponente para el desarrollo de ambas patologías, favoreciendo el desbalance metabólico. (Figura 1).
Asociación con el metabolismo de la glucosaLa HIC asociado al estado pro-inflamatorio descrito previamente, tiene un impacto negativo en la homeostasis de la glicemia. Se ha demostrado que en los pacientes con AOS, el páncreas presenta una secreción sostenida de insulina, en respuesta a la hipoxia e hiperglicemia, lo que encuentra tanto en individuos obesos como no obesos, postulando que la HCI tiene un rol en el estímulo y de daño directo sobre el metabolismo de la glucosa, lo que aumenta el riesgo de desarrollar resistencia a la insulina y diabetes mellitus tipo 2 (DM2)3,4,10.
Clínicamente, la coexistencia de AOS y DM2 es un predisponente relevante para el desarrollo de enfermedades cardiovasculares y metabólicas, puesto que aumentan el riesgo de eventos cardiovasculares mayores (accidente cerebrovascular, angina inestable, insuficiencia cardíaca, infarto de miocardio y mortalidad CV)11,12. Además, estudios observacionales han reportado que la AOS aumenta la incidencia de DM2, especialmente en aquellos con AOS moderado a severo13. Este grupo tiene un 71% más de riesgo de incidencia de DM2, lo que es independiente de los otros factores de riesgo de DM2, incluidos el IMC y la circunferencia de la cintura14,15. Este riesgo se encuentra elevado en la población hispana/latina, en un estudio reciente, con seguimiento promedio de 7 años, el riesgo de DM2 en pacientes con AOS no tratada fue 2,61 veces más, en comparación con la población sin AOS16.
En Chile, el 15% de los pacientes con AOS moderada a severa tienen como antecedente el diagnóstico de DM25. Además, la combinación de AOS con DM2 se asocia a mayor comorbilidad que cada enfermedad de manera aislada11. Datos de estudios observacionales diseñados para identificar la relación de AOS con DM2, han demostrado que este subgrupo tiene un mayor riesgo de mortalidad cardiovascular, y de eventos cardiovasculares. En un estudio previo de nuestro grupo, incluyendo datos de población chilena, encontramos que el riesgo de mortalidad cardiovascular fue de HR 2,37 (95%-CI, 1,16-4,82, valor p=0,02) en el grupo de AOS+DM2, comparado con un riesgo de HR 0,90 (95%-CI, 0,38-2,12) en el grupo solo AOS; y un HR 1,73 (95%-CI, 0,55-5,42) en el grupo solo DM2. En este mismo estudio, la combinación de AOS y DM2 presento una mayor asociación con otras comorbilidades cardiovasculares, tales como un mayor riesgo de enfermedad coronaria, OR 3,44 (95%-CI, 1,73-5,59, valor p<0,01) y una asociación con el indicador de tiempo con saturación de oxígeno bajo 90% (T90%) durante la prueba de sueño17, lo que sugiere fuertemente que el subgrupo de pacientes con mayor hipoxemia durante la noche se asociaría a un fenotipo clínico diferente de la AOS, y por lo tanto, con peores resultados a largo plazo18,19. Estudios recientes muestran que entre los pacientes con AOS con índice de apnea-hipopnea (IAH) similar, el grupo con hipoxemia severa se asoció de forma independiente con la mortalidad por todas las causas, las comorbilidades cardiovasculares y los resultados relacionados con el cáncer20. Estos hallazgos sugieren que el fenotipo de AOS debería ser un enfoque innovador para explorar diferentes patrones de respuesta a tratamiento y diagnóstico a largo plazo, asociados a coexistencia de DM2.
Asociación apnea de sueño con hígado grasoLa enfermedad por hígado graso metabólico, actualmente denominada MAFLD por su acrónimo en inglés (metabolic dysfunction-associated fatty liver diseases)21, corresponde a un espectro de enfermedades que se caracterizan por el depósito de grasa en el hígado (esteatosis hepática) que puede a su vez estar asociado a inflamación (esteatohepatitis), distintos grados de fibrosis y cirrosis en su etapa más avanzada. Habitualmente se presenta en contexto de otras enfermedades metabólicas como obesidad, insulinoresistencia y diabetes y tiene una alta prevalencia en la población general. A nivel mundial, se estima que una de cada 4 personas presentaría hígado graso22. En Chile, Riquelme y cols., estimaron una prevalencia de 23,4% en adultos, llegando a ser incluso de hasta 36% en mujeres hacia la quinta década de vida23. Habitualmente no presenta síntomas por lo que generalmente se detecta como hallazgo en imágenes como el ultrasonido o cuando se encuentran alteradas las pruebas hepáticas. Su asociación con el AOS es bastante frecuente ya que comparte varios procesos fisiopatológicos comunes con las enfermedades metabólicas antes descritas. Según diversos estudios epidemiológicos, el tener AOS podría aumentar el riesgo de desarrollar MAFLD hasta 3 veces24, y se ha estimado una prevalencia de MAFLD de hasta 90% en pacientes portadores de AOS25. Es más, la severidad del AOS influiría negativamente en la evolución del hígado graso presentando mayor tendencia a la inflamación y a la fibrosis hepática. Se ha encontrado una relación entre presentar una mayor cantidad de episodios de apnea y desaturación, con una mayor probabilidad de alteración de las pruebas hepáticas (elevación de las aminotransaminasas) y con una mayor severidad de la inflamación y fibrosis hepáticas24,25. Esto tiene sentido en la fisiopatología de la enfermedad ya que, si bien el MAFLD tiene diversos gatillantes o “hits” de desarrollo, la hipoxia jugaría un rol clave en la evolución de la misma. Las grasas o lípidos acumulados en el hígado llevarían a un aumento de ácidos grasos libres que, al no lograr ser completamente metabolizados a través de la beta-oxidación mitocondrial, producirían metabolitos lipotóxicos y disfunción mitocondrial induciendo el llamado “estrés oxidativo” con producción de especies reactivas del oxígeno que causan peroxidación lipídica, produciendo radicales libres que dañan la célula activando la cascada inflamatoria26. El fenómeno de hipoxia crónica intermitente del AOS, por otro lado, al reducir la presión parcial de oxígeno en las zonas de tejido hepático que rodean la vena central (zona 3), inducirían la expresión de Factores Inducibles por Hipoxia (HIFs). Estos son una familia de factores de transcripción que responden frente a estímulos de hipoxia. En condiciones normales, los HIFs son hidroxilados y luego ubiquitinizados para ser degradados en la proteosoma, pero frente a condiciones de hipoxia, los HIFs no son hidroxilados y forman dímeros con ARNt. Estos dímeros se traslocan al núcleo donde activan genes de respuesta frente a hipoxia. Estos genes promueven la síntesis de mediadores pro-inflamatorios como IL-6, IL-1b y TNF-α, entre otros y pro-fibróticos como PAI-1, HO1, VEGF, eritropoyetina, ceruloplasmina, entre otros27. Se ha encontrado que, específicamente los HIF-α, jugarían un rol clave en la aparición de la fibrosis hepática al aumentar la expresión de la enzima lisil oxidasa (LOX) por parte de las células estrelladas y fibroblastos del hígado28. Por último, datos recientes relacionan la hipoxia con el aumento de la permeabilidad intestinal y la alteración de la microbiota del tubo digestivo. Esto aumentaría los niveles de lipopolisacáridos en el eje intestino-hígado. Los lipopolisacáridos, especialmente aquellos producidos por bacterias gram negativas, producen una estimulación de receptores Toll-Like 4 (TLR-4) en los hepatocitos, activando por lo tanto la respuesta inflamatoria29.
En un meta-análisis de datos individuales obtenidos a partir de dos estudios de cohorte en Francia, incluyendo un total de 2.120 participantes, el 75% presentaba esteatosis hepática mediante el uso de test no invasivos, siendo la AOS un factor de riesgo significativo para el desarrollo de esteatosis hepática, así como la obesidad, el género masculino y la DM230.
Efectos metabólicos del tratamiento del AOSPara la mayoría de los pacientes con AOS, las claves de la terapia se basan en el tratamiento conservador e incluyen la pérdida de peso, realizar una correcta higiene del sueño, así como identificar factores predisponentes como alteraciones anatómicas, terapias posturales y manejar otras comorbilidades como la congestión nasal y el reflujo gastroesofágico31,32. De acuerdo con las recomendaciones actuales de la Academia Americana de Medicina del Sueño, en aquellos pacientes con AOS moderado o severo se recomienda el uso de CPAP (continuous positive airway pressure). Este dispositivo es considerado el tratamiento más efectivo en reducir el IAH y la somnolencia, demostrado en varios ensayos clínicos aleatorizados (ECAs)33.
El tratamiento de la obesidad y del AOS en su conjunto son los pilares esenciales de todos estos pacientes. El cambio en el estilo de vida y la dieta estricta se asocia a una disminución de 5,65kg, con una caída del IMC de 2,3kg/m2, además, con una disminución de los eventos respiratorios de 4,55 eventos/h. El CPAP por si solo se asocia a una discreta, pero significativa disminución del peso, con caída del IMC y expresión de niveles de leptina34,35. En un meta-análisis de 12 estudios que evaluaron los cambios en el peso e IMC posterior a CPAP, se encontró que el CPAP disminuyo el IMC en -0,13±0,27kg/m2, comparado con el grupo control, -0,01±0,24kg/m2, mientras que la disminución de peso fue de -0,41±0,71kg para CPAP, y -0,09±0,71kg para los controles35. Mientras que los niveles de leptina reportan una disminución de 1,44 unidades (95%-CI, 1,11-1,77, p<0.01) a contar del tercer día de uso de CPAP34.
Respecto al impacto de la cirugía en el control de la obesidad y AOS, existe un ensayo clínico aleatorizado (ECA) de 49 pacientes evaluó la diferencia en el cambio en el IMC y número de IAH entre pacientes sometidos a cirugía con banda gástrica comparado versus CPAP. Se incluyeron pacientes con IMC entre 35-45kg/m2 y AOS moderado a severo. El grupo aleatorizado a banda gástrica presentó una disminución del IMC de 3,2kg/m2 a los 9 meses, comparado con el grupo CPAP de 1,2kg/m2. Sin embargo, la reducción del IAH fue superior en el grupo tratado con CPAP (18,6 eventos/h. en cirugía vs. 28,2 eventos/h. en grupo CPAP), p=0.02 a los 9 meses de seguimiento36.
El tratamiento con CPAP ha demostrado resultados contradictorios en prevenir la progresión de las enfermedades metabólicas. Si bien, existe evidencia de un beneficio del CPAP en la obesidad y la disminución de biomarcadores asociados a hemorragia intracerebral (HIC), los ECAs diseñados para evaluar cambios en pacientes diabéticos, no mostraron beneficios en reducción de la HBA1c, glicemia de ayuno y complicaciones asociadas a la diabetes, como la retinopatía diabética4. Yang et al. estudiaron el efecto de CPAP sobre el control de glicemias en pacientes sin diagnóstico de DM2 y AOS, encontrando que el tratamiento con CPAP se asocia a una disminución de 0,55 (95%-IC, 0,20-0,91) en el test de HOMA37. Respecto al control metabólico en pacientes con DM2 y AOS, en un meta-análisis con un total de 5.953 participantes con seguimiento entre 2,7-16 años, encontraron que pacientes con AOS moderado-severo tienen un riesgo de diabetes RR=1,63 (95%-IC 1,09-2,45) comparado con sanos13. En otro estudio se midió la hemoglobina glicosilada de 60 pacientes con diabetes y sospecha de AOS, encontrando que 77% de los pacientes presentaba un AHI ≥5 eventos/h, mientras que 38% presentaba criterios moderado-severo. Al comparar estos pacientes con el grupo de pacientes diabéticos sin AOS, el promedio de hemoglobina glicosilada del grupo AOS era 1,49% superior al grupo control en los leves y 3,69% en los pacientes con severo38,39. Los ECAs agrupados en revisiones sistemáticas y meta-análisis han demostrado que el uso de CPAP en pacientes con resistencia a la insulina, evaluada mediante el índice HOMA, reportan una significativa reducción del índice HOMA, lo que sugiere que el tratamiento de la resistencia a la insulina, en pacientes no diabéticos, tiene un efecto en prevenir la progresión hacia DM240.
Finalmente, la evidencia derivada desde ECAs respecto al beneficio en el tratamiento con CPAP en pacientes con AOS y MALFD no ha demostrado cambios significativos en reducir las concentraciones de aminotransferasas y de cambios en la severidad evaluados mediante mediciones no invasivas de la fibrosis hepática, sin embargo, la calidad metodológica de los ECAs es muy baja39.
Síndrome de hipoventilación-obesidad (SHO)Como se mencionó previamente, la obesidad es el principal factor de riesgo para el desarrollo de AOS y de obstrucción en la vía aérea superior. Otro fenómeno relevante asociado a interacción entre los fenómenos de obstrucción de la vía aérea y la obesidad hace referencia con los cambios a nivel de ventilación alveolar reportados en esta población, y su implicancia con el síndrome de hipoventilación-obesidad (SHO) (también conocido como síndrome de Pickwick)41. La obesidad produce una disminución del volumen corriente, lo que en el tiempo se traduce en un intercambio gaseoso inefectivo, promoviendo la hipercapnia (retención de CO2), fenómenos característicos del SHO.
Sin embargo, el SHO es una enfermedad clínica distinta, en la que se combina el diagnóstico de trastorno respiratorio del sueño, con hipercapnia diurna y obesidad, una vez excluidas otras causas de hipoventilación (alteraciones de la pared torácica, causas de sistema nervioso central, entre otras)42. Se estima que un 90% de los pacientes con SHO tiene coexistencia de AOS, y un 70% AOS severo, lo que hace que ambas patologías estén estrechamente ligadas42,43.
De manera tradicional, el SHO se asocia a peores desenlaces clínicos y morbimortalidad, con admisiones frecuentes a los servicios de urgencias y requerimientos de ventilación invasiva durante exacerbaciones cardiorrespiratorias, lo que aumenta los costos asociados a atención en salud44. En este grupo, la prevalencia de comorbilidades metabólicas es aún más alta, en el estudio Pickwick, ECA multicéntrico diseñado para evaluar el impacto de la ventilación no invasiva usando CPAP y ventiladores mecánicos no invasivo tipo BiPAP en 16 centros de España, el IMC promedio fue de 42,9kg/m2, la circunferencia cervical fue de 45cm, mientras que la prevalencia de DM2 fue de 41%, dislipidemia 48%, En la fase ambulatoria, dentro de los principales resultados de este estudio, se logró demostrar que el uso de ventiladores CPAP no son inferiores a los BiPAP en términos de morbimortalidad y estadías hospitalarias en un plazo de seguimiento de 5,5 años. Esto se asocia con un menor gasto económico respecto a la adquisición de los equipos45,46.
Proyecciones e investigación futuraA pesar de los resultados del CPAP en desenlaces metabólicos, existen múltiples cuestionamientos respecto al diseño e implementación de los ECAs. Literatura reciente ha sugerido que el uso del IAH como marcador de severidad de la AOS es insuficiente en identificar subtipos de pacientes con distinto riesgo de presentar complicaciones a largo plazo47. Además, la adherencia al CPAP reportada en la mayoría de los ECAs es baja, lo que afecta significativamente los resultados de los estudios48. Se recomienda una adherencia de 4 horas de CPAP efectivo por noche para lograr resultados a largo plazo. En este sentido es clave entender a la AOS como una enfermedad heterogénea, con distintas manifestaciones y comorbilidades asociadas a distinto pronostico, y, por lo tanto, distinto enfoque terapéutico.
Estudios observacionales previos han asociado diferente riesgo de enfermedad cardiovascular incidente y mortalidad cardiovascular con hipoxemia severa4,49. Los fenotipos predominantemente metabólicos están asociados a peor pronóstico y mayor riesgo de eventos cardiovasculares y mortalidad. En Chile, el subgrupo de hombres obesos, con AOS moderada a severa y alta carga de comorbilidades metabólicas tiene un riesgo de muerte cardiovascular5. De manera adicional, en este mismo grupo, la hipoxia nocturna calculada a través de los indicadores oximétricos se asocia con mayor incidencia de mortalidad, por lo que necesitamos incorporar estos hallazgos clínicos y de variables disponibles en los estudios del sueño para enfocar las estrategias terapéuticas siguiendo un enfoque basado en medicina de precisión20.
ConclusiónLa asociación entre la obesidad y AOS es prevalente y se asocia a peores pronósticos a largo plazo, con mayor riesgo de presentar enfermedades metabólicas. Un enfoque multidisciplinario incluyendo los fenotipos de la AOS y sus comorbilidades son claves para un enfoque personalizado, determinando de mejor manera las intervenciones terapéuticas.
Declaración de conflicto de interésLos autores declaramos que no tenemos ningún conflicto de interés.