Los pacientes asmáticos severos corresponden a un grupo heterogéneo de individuos que requieren tratamientos múltiples para lograr el control de su enfermedad. Quienes tratamos a estos pacientes con asma severa, nos enfrentamos a un grupo seleccionado de niños que no permiten establecer conductas homogéneas en su manejo y que determinan enormes costos en salud y una gran carga emocional para ellos y su familia. El enfrentamiento en forma estandarizada de estos pacientes, actualmente llamados problemáticos, permitirá diferenciar a los asmáticos catalogados como de difícil manejo de aquellos verdaderamente severos.
El siguiente artículo tratará de ayudar al clínico a ordenar los conceptos claves para orientar una toma de decisiones más racional y acorde a los conocimientos actualizados.
The most severe asthmatic patients belong to a heterogeneous group of individuals who require multiple treatments to achieve control of there disease. Those who treat patients with severe asthma, are faced up to a selected group of children that do not allow us to establish regular conducts in there treatment, and determine high costs in health and a big emotional burnout not only to the patient but to the family as well. The way to treat these patients that are actually called “problematic” will help us differentiate and cataloged the difficult patients with the real severe ones.
The following article will try to help the clinicians order the key concepts to guide a more rational decision according to their updated knowledge.
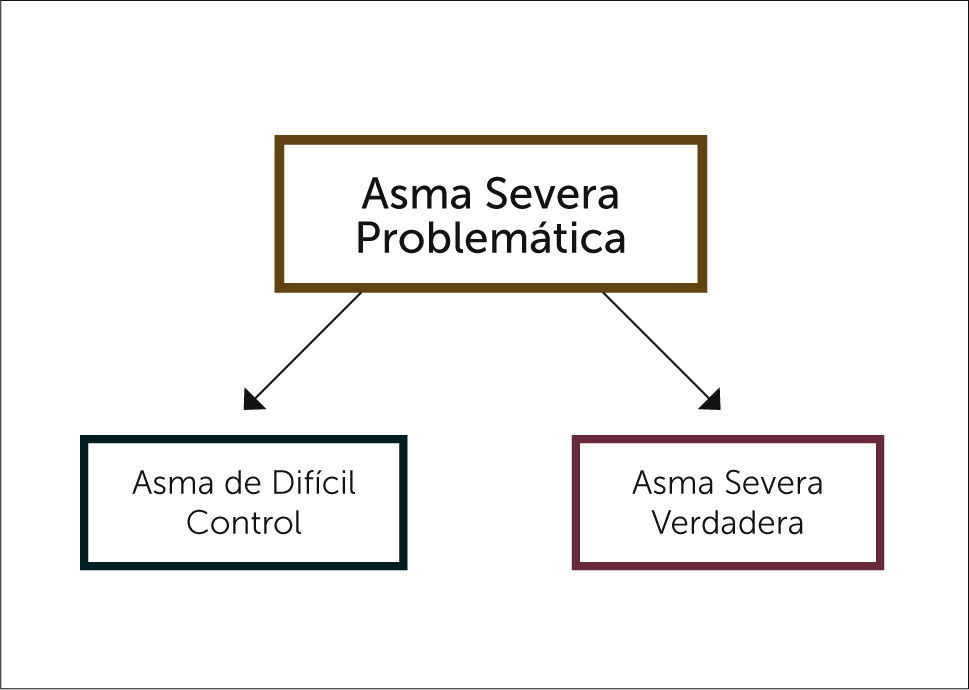
El manejo del paciente asmático, habitualmente se puede lograr el control, con el uso de bajas dosis de corticoides inhalados, sin embargo, existe un subgrupo de pacientes que se mantiene sintomático pese al uso de dosis elevadas de corticoides, etapa 4/5 de las guías Global Initiative for Asthma (GINA), con síntomas persistentes y exacerbaciones, muchas de esas graves, que deterioran su calidad de vida y su condición funcional. A los pacientes que no logran el control después de un tratamiento con máximas terapias se les denomina asma severa problemática1. En este grupo de pacientes se incluyen 2 subcategorías muy diferentes entre sí: la primera denominada Asma difícil control (AD), que contempla a pacientes que tienen dificultad en lograr el control por un manejo terapéutico inadecuado, diagnóstico incorrecto o bien tienen asociadas comorbilidades que empeoran su condición basal. Si estos se identifican y manejan adecuadamente, logran el control de sus síntomas y no se requiere seguir escalando en la terapia. La segunda categoría corresponde a quienes a pesar de una evaluación y manejo estandarizado, con niveles altos de tratamiento no logran el control, incluso con corticoides orales, subcategoría denominada Asma Severa Verdadera (Figura 1).
Para reconocer a este subgrupo de pacientes con asma severa problemática se requerirá de una evaluación estandarizada y protocolizada, distinguiendo primero aquellos que potencialmente son portadores de asma difícil. Se estima que cerca del 60% de los pacientes con asma problemática corresponde a asma difícil y los restantes serían asmáticos verdaderamente severos 2.
Recientemente se publicaron los criterios diagnósticos para asma severa en niños y adultos en el consenso realizado por la Sociedad Europea de Enfermedades Respiratorias y la Sociedad Americana de Tórax 3. Estos criterios permiten seleccionar al subgrupo de pacientes que luego de una evaluación exhaustiva y corrección de factores modificables y comorbilidades persisten sin control (Cuadro 1).
DEFINICIÓN DE ASMA SEVERA > 6 AÑOS
| Asmáticos con terapia 4/5 de GINA (altas dosis de corticoides* asociado a LABA o antileucotrienos o teofilinas, o el uso de corticoides orales) y que no logran el control. |
| El no control debe tener al menos uno de los siguientes criterios |
| 1. Pobre control de síntomas |
| 2. Exacerbaciones severas frecuentes: 2 o más cursos de corticoides orales en el año previo |
| 3. Exacerbaciones graves con hospitalización, ingreso a UCI o uso de VM en el último año |
| 4. Limitación al flujo aéreo |
*Se considera altas dosis de corticoides entre los 6-12 años budesonida >800mcg o fluticasona >500mcg o ciclesonida >160mcg
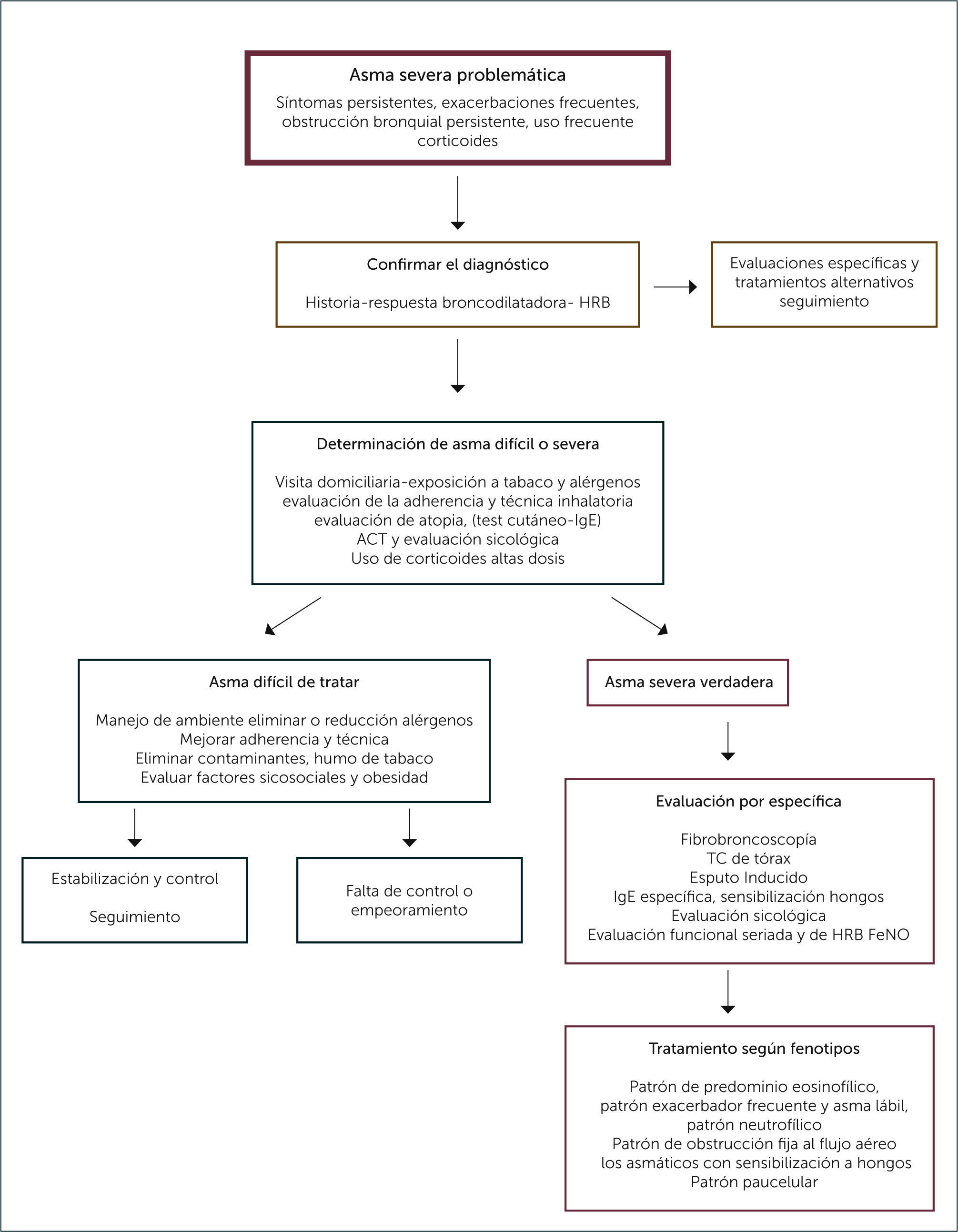
Una vez que el paciente se encuentra tratado con CSI altas dosis asociado a algún otro controlador como LABA o antileucotrienos, o bien con uso de corticoides orales y no logra el control que algunos estiman en al menos 6 meses de tratamiento, se realizará una evaluación sistemática por un equipo multidisciplinario. Esto se realiza habitualmente a nivel terciario de salud, con el fin de determinar si corresponde a un asma difícil y por lo tanto, si se corrigen aquellos factores modificables, lograr el control y permitir bajar las dosis de tratamiento. Sin embargo, si a pesar de corregir aquellos factores potencialmente modificables o bien controlar sus comorbilidades, se logra el control, este es el grupo de pacientes con asma severa verdadera.
EVALUACIÓN DEL PACIENTE CON ASMA SEVERA PROBLEMÁTICA, APROXIMACIÓN A LOS PACIENTES CON ASMA DIFÍCIL1. Confirmación del diagnóstico de asma
El diagnóstico de asma es fundamentalmente clínico. Escalar en el tratamiento del asma aparentemente mal controlado, es ayudado por guías y consensos y se dispone de un buen número de medicamentos únicos o asociados. En Chile, el asma corresponde a una patología GES y está garantizado su acceso y su tratamiento 4, lo que facilita el ascenso en el nivel de tratamiento. Sin embargo, frente a un paciente cuyo control no se alcanza, debemos plantearnos si nuestro diagnóstico de asma es el correcto. Es necesario volver a la historia clínica detallada buscando los síntomas y signos claves, como son la tos, en especial de noche y con el ejercicio, risa o llanto; la disnea variable asociada a opresión torácica, cansancio o sibilancias y, el empeoramiento de los síntomas frente al ejercicio o cambios ambientales, en especial el frío, alérgenos o infecciones virales.
A esto debemos sumar la búsqueda sistemática de la determinación de la obstrucción bronquial y su reversibilidad. En niños habitualmente la función pulmonar basal evaluada por espirometría resulta normal 5, sin embargo, intentaremos documentar elementos como la variabilidad del PEF>13% o el aumento del VEF1 post BD>12% idealmente en condiciones basales o en exacerbaciones, pero también en el control funcional luego de iniciada la terapia. También se pueden encontrar elementos más sutiles en la espirometría que pueden orientar al diagnóstico, como una relación VEF1/CVF bajo con normalización posterior, cambios de los FEF25-75>30% después de 400mcg de B2 6. También se puede recurrir a pruebas que demuestren la hiperreactividad bronquial como los test de ejercicio o de metacolina que son muy útiles cuando la función pulmonar inicial es normal. Una prueba de metacolina negativa hace poco probable el diagnóstico de asma. Junto con lo anterior la determinación de la sensibilización alérgica es clave, pues sobre el 85% de los pacientes asmáticos están sensibilizados al menos a un alérgeno y los más severos se asocian a sensibilización múltiple 7.
Cuando los síntomas no son los característicos o bien no se puede determinar la obstrucción reversible de la vía aérea, hay que tener especial atención a patologías que pueden confundirse con asma (Tabla 1). Si los síntomas se inician desde el período neonatal con estridor, rinorrea persistente, obstrucción sintomática y persistente, se podrá pensar en traqueobronqueomalacia, anillos vasculares, enfermedad pulmonar crónica del prematuro o disquinesia ciliar. En el caso que mantenga una tos húmeda y productiva será la fibrosis quística, bronquiectasias o la aspiración, lo importante a descartar. En el caso de asociación a síntomas digestivos como disfagia, dolor o ardor torácico, falta de incremento de peso, vómitos o regurgitaciones frecuentes, se orientará el diagnóstico a reflujo gastroesofágico, aun cuando es discutible su rol en el asma, compresiones de la vía aérea, duplicaciones del aparato digestivo y malformaciones de la laringe. Si los síntomas respiratorios se asocian a infecciones frecuentes, es mandatorio descartar inmunodeficiencias y fibrosis quística. Si existe el antecedente de infección pulmonar grave en los primeros años de la vida harán sospechar el desarrollo de bronquiolitis obliterante post viral. En adolescentes la disfunción de cuerdas vocales es parte del diagnóstico diferencial la que habitualmente se manifiesta en condiciones de ejercicio o bien asociado a estrés. Por último en la patología del aparato respiratorio del niño, la sospecha de aspiración de un cuerpo extraño, con el desarrollo de patología crónica secundaria es un elemento que jamás debe faltar.
DIAGNÓSTICO DIFERENCIAL
| CARACTERÍSTICA CLÍNICA INFRECUENTE | DIAGNÓSTICO POSIBLE |
| Estridor | Laringomalacia |
| Traqueobronqueomalacia | |
| Anillos vasculares | |
| Tos húmeda o productiva | Fibrosis quística |
| Pólipos | Bronquiectasias |
| Infecciones recurrentes | Inmunodeficiencias |
| Aspiración | |
| Dolor torácico o ardor | Reflujo Gastroesofágico |
| Falla de crecimiento | FQ, cardiopatías, inmunodeficiencias |
| Síntomas desde el nacimiento | Malformaciones pulmonares congénitas |
| Soplo cardiaco | Cardiopatías congénitas con hiperflujo |
| Falla en respuesta a BD | Disfunción de CV |
| Síntomas inicio brusco, sibilancias unilaterales | Cuerpo extraño |
2. FACTORES MODIFICABLES
Una vez establecido el correcto diagnóstico de asma, la gran mayoría de los problemas que generan la falta de control están determinados por factores modificables, los cuales se describen a continuación. La mitad de los pacientes que fallece por asma lo hace sin acceder a atención de salud y solo una cuarta parte de ellos contaba con un plan escrito de manejo. Se estima que de aquellos pacientes que fallecen el 60% tenía factores potencialmente modificables 8.
2.1 Adherencia
Adherir a un tratamiento prolongado habitualmente es complejo y difícil de lograr y está determinado por factores llamados intrínsecos, que son propios de la persona enferma, como de factores externos que son dependientes del medio y los servicios de salud. Conocerlos, evaluarlos y poder entenderlos nos dará una de las claves más relevantes a la hora de generar el control de esta enfermedad. La falta de adherencia puede ser un factor relevante en las muertes por asma 9 como en la falta de control de la enfermedad, la que se presenta igualmente todas las edades 10. Se considera una adherencia aceptable en terapias crónicas con corticoides inhalados el uso de más del 80% de las dosis prescritas, sin embargo, rara vez se alcanza ese nivel y habitualmente oscila entre el 30 al 70% tanto en adultos como en niños 11. En el estudio Childhood Asthma Management Program (CAMP) se encontró que cerca del 75% de los niños tenían adherencias menores del 80% y en el 27% estas eran menores del 50% 12. Si esto ocurre en estudios formales con seguimiento protocolizado, la adherencia en la vida real debe ser mucho menor, donde los enfermos están expuestos a múltiples factores tanto personales como ambientales o dependientes de los servicios de salud que limitan a los pacientes o sus familias. Esto se traduce en exacerbaciones más frecuentes, más hospitalizaciones, visitas al servicio de urgencia y uso de corticoides orales. Se estima que los pacientes adherentes al tratamiento tienen entre 21% a 68% menos riesgo de padecer una exacerbación 13.
La evaluación de la adherencia demuestra enormes discrepancias entre lo informado y lo realmente utilizado, tanto en reporte diarios en estudios de seguimiento, como los auto reportados por los padres o los pacientes. La evaluación directa de la adherencia a través de encuesta a los pacientes no logra obtener un reporte concordante y consistente con la verdadera adherencia. La evaluación mediante métodos electrónicos con aparatos adheridos a los canister de medicamentos y que censan cada vez que se activa un dispositivo, no aseguran la correcta inhalación o el uso real de los medicamentos 14,15.
Múltiples razones explican la pobre adherencia en pacientes pediátricos, como son la complejidad de los régimen terapéuticos, su costo, la percepción de efectos secundarios, en especial del uso crónico de corticoides, la capacidad de entendimiento de la familia y el paciente, su condición socioeconómica, la falta de supervisión parental, acceso a los servicios de salud, la incapacidad de percibir la severidad de su enfermedad, aspectos emocionales y psicosociales, y aspectos gananciales por la falta de control de su enfermedad 14–16.
La falta de adherencia se categoriza en 2 grupos, la intencional y la no intencional. La falta de adherencia intencional se establece por una decisión de cada persona en no tomar sus medicamentos basado en sus creencias, conocimientos o percepción de la medicación y sus verdaderos beneficios 17. En cambio, la falta de adherencia no intencional se debe a factores como la complejidad de cada régimen terapéutico, la incapacidad de entender las indicaciones, a la falta de un plan de acción escrito o a la falta de memoria. Los pacientes pediátricos asmáticos no adherentes corresponden más frecuentemente a este segundo grupo y se beneficiarían de un plan de acción escrito y consentido por el niño y sus familiares. este plan de acción consistiría en recordatorios mediante llamados, mensajes directos o bien la educación establecida y regular como un pilar esencial en el manejo de cada paciente en particular, basado en una relación médico paciente y familia óptima 17.
Las intervenciones que se hagan a este nivel pueden determinar el control de un paciente y por lo tanto evitar el escalamiento de nuevas y más complejas terapias. No existe una medida única o efectiva que asegure una buena adherencia. Sin embargo, se ha observado que los pacientes, como sus familias realizan un cambio significativo cuando se logra demostrar la efectividad de los tratamientos a través de medidas objetivas como la función pulmonar y la respuesta Broncodilatadora, o bien la mejoría o deterioro en la medición del oxido nítrico exhalado, en pacientes asmáticos fundamentalmente atópicos que usan o que suspenden la terapia con corticoides inhalados 18. Se ha observado que, en aquellos pacientes con pobre adherencia del tipo no intencional, el uso de dispositivos electrónicos como teléfonos celulares y sus aplicaciones que permiten realizar recordatorios del uso de los medicamentos, han logrado mejorías en la adherencia entre un 40% y un 54% 19.
Una valoración adecuada de los factores que no adhieren al tratamiento es un desafío muy significativo, la entrevista estandarizada debe evitar elementos punitivos, amenazas o agresiones que solo generarán mayor resistencia. En este aspecto se deben hacer preguntas abiertas y conciliadoras, haciendo entender a los pacientes y sus familias que llevar un tratamiento prolongado es difícil. Iniciativas en el manejo de asma difícil, establecen prioritariamente una entrevista prolongada con el equipo de salud, asociada a una visita domiciliaria, con el fin de reconocer todos estos aspectos. A esto se pueden sumar evaluaciones psicológicas en aquellos pacientes más refractarios o complejos, lo que permitirá establecer respuestas específicas para cada problema encontrado y con ello un mejor manejo del paciente 10,20,21.
2.2 Técnica inhalatoria y tipo de formulación farmacológica
Este aspecto, aunque muy simple, confiere un número significativo de problemas a la hora de tratar a estos pacientes. Se estima que cerca del 80% de los pacientes tiene problemas técnicos a la hora de inhalarse y llevan un sin número de errores que impiden el control de la enfermedad. La elección del dispositivo para la adecuada inhalación, ya sea con la interface boca/nariz o bien con pieza bucal junto con educación y aprendizaje en la técnica inhalatoria para cada edad y condición clínica, son fundamentales 22. Chequear estos aspectos en cada visita del paciente y repasar junto con ellos los pasos técnicos que la inhaloterapia necesita, permitirán un mejor entendimiento de la terapia como a su vez su adecuada utilización, lo que redundará en un mejor control 23. El entrenamiento en la técnica inhalatoria no solo contempla a los familiares que están a cargo del paciente, sino también a los cuidadores o profesores que pasan largas horas en la jornada escolar.
2.3 Exposición ambiental
a) Tabaco
Es fundamental la detección del tabaquismo pasivo o activo en los pacientes con asma difícil de tratar, pues es reconocido el efecto deletéreo que tiene el humo del tabaco sobre las vías aéreas y la resistencia que genera en la respuesta a los corticoides 24. La búsqueda sistemática y objetiva, a través de medios de detección directa como la cotinina en orina o bien la detección de monóxido de carbono, permiten orientar al clínico en el manejo y control de estos pacientes. Las encuestas tanto a los pacientes como a los familiares no dan cuenta real de la exposición al humo de tabaco. Se ha observado que alrededor de 1/3 de los encuestados refiere no estar expuesto o consumir tabaco y la detección de cotinina en orina dirá lo contrario 25. El impacto de medidas de control del tabaquismo como las realizadas en función de disminuir el tabaquismo pasivo a través de legislaciones y control del tabaquismo en ambientes públicos, ha determinado un mejor control de síntomas y de función pulmonar en los pacientes asmáticos 26. Una vez identificado el tabaquismo el equipo de salud buscará todas las formas de eliminar la exposición o reducirla al mínimo. Esto a través de programas multidisciplinarios que ayuden a estas personas a cesar el hábito tabáquico. Es fundamental eliminar el tabaquismo antes de escalar en la terapia farmacológica 27.
b) Alérgenos
La condición alérgica es muy frecuente en los pacientes asmáticos, cerca del 80% de ellos son atópicos y en los sujetos con asma problemática la situación no es diferente 28. Incluso se ha observado que los pacientes con asma severa están más sensibilizados con múltiples alérgenos y con mayor intensidad 29. La asociación entre asma severa y alergias alimentarias es menos potente, ya que es muy difícil aislar el factor precipitante específico de los alimentos que agrava un asma mal controlada. Su diagnóstico no es fácil, pues la sensibilización a alimentos es muy frecuente en pacientes asmáticos y la prueba y contraprueba de exposición es engorrosa y cara, sin embargo, es la única que determina con certeza el diagnóstico. Los pacientes con alergias alimentarias desarrollarán asma en cerca de un 35% y mientras mayor sea la sensibilización a alimentos, mayor será el riesgo de asma 30. La exposición persistente a alérgenos ambientales dificulta el control del asma y determina deterioro clínico y funcional, en especial si se asocia a una infección viral 31. Determinar la exposición no es fácil y no hay medidas objetivas útiles de implementar. Aquí juega un rol clave la visita domiciliaria por parte del equipo de salud, que in situ logrará observar los posibles factores ambientales que podrían ser determinantes a la hora de lograr un mejor control de la enfermedad. La evaluación y en especial la remoción de aquellos alérgenos perennes, como los derivados de mascotas, dermatofagoides y hongos, son muy importantes, porque producen una mayor exposición y por lo tanto un mayor deterioro en el control de estos pacientes 32. Antes de escalar en la terapia del asma, debe haber un control ambiental que disminuya la exposición.
c) Contaminantes Ambientales
La contaminación ambiental es un factor determinante en la salud de las personas, su efecto oxidativo acumulativo en situaciones de aumento agudo, podría determinar síntomas más frecuentes, exacerbaciones y aumento de hospitalizaciones y eventualmente muerte 33. Ante un paciente que no logra control, es necesario determinar posibles fuentes fijas de contaminación como industrias o fábricas, cercanía a calles de alto tráfico, junto con las condiciones ambientales intradomiciliarias. Determinar su asociación específica con el asma problemática es difícil, sin embargo, a todos los asmáticos se les debe asegurar un ambiente lo más limpio y seguro posible.
2.4 Comorbilidades
Una vez descartada la adherencia, la técnica inhalatoria y controlados los factores ambientales como tabaquismo, contaminación y exposición a alérgenos, se debe continuar con la búsqueda de comorbilidades que pueden estar asociadas.
Aunque no está claro la real contribución de las comorbilidades, se estima que alrededor de un tercio de los sujetos con AD tienen asociadas otras condiciones patológicas tales como: rinitis crónica alérgica, obesidad, reflujo gastroesofágico (RGE), disfunción de la respiración, trastornos psicosociales, alergia alimentaria e infecciones 34.
La prevalencia de rinitis alérgica es alta en la población general y la asociación entre asma y rinitis es bien conocida. Se estima que sobre el 80% de los asmáticos padecen de rinitis y el 15% de los riníticos desarrollan síntomas de asma, mediado por mecanismos aún no aclarados 35. El tratamiento concomitante mejoraría los síntomas riníticos y con ello ayudaría al control del asma 36. Asociado o no a rinitis alérgica puede coexistir diferentes grados de obstrucción de la vía aérea superior que incluye desde el niño respirador bucal hasta el SAHOS. En niños esta condición está generalmente determinada por hiperplasia adenoamigdaliana, la que debe ser valorada y tratada según corresponda. Existe asociación entre reflujo gastroesofágico y asma, la que en algunos estudios llega al 80% de los asmáticos más severos, sin embargo, la relación causal es compleja y no se ha establecido con claridad 37. El RGE podría ser un factor agravante o solo coincidir con el asma, podría causar sibilancias por aspiración directa o bien por reflejo secundario a acidificación del esófago distal. Los tratamientos con lanzoprazol no han demostrado mejoría en pacientes tratados, sin embargo, la valoración de los hallazgos encontrados debe realizarse en forma individual, reevaluando a cada paciente hasta optimizar el tratamiento y tratar todas sus comorbilidades 37,38.
La obesidad y el asma tienen una compleja interrelación donde interactúan componentes genéticos y ambientales. Ambas entidades son cada vez más prevalentes y no está claro el real efecto de la obesidad en el asma, incluso la obesidad per se puede dar síntomas similares al asma, como disnea, cansancio y sibilancias 39. La obesidad determina un riesgo significativo para desarrollar asma, estimándose que aquellos individuos con IMC por sobre el precentil 85 tienen el doble de riesgo de desarrollarla 40. La forma de presentación o fenotipo puede variar según edad y género, como los observados en varones con rápido incremento de peso durante los 2 primeros años de vida que ha sido mencionado como un buen predictor de asma a los 7 años 41, o bien mujeres jóvenes que desarrollan obesidad, o mujeres adultas postmenopausicas obesas no atópicas tienen mayor prevalencia de asma que los varones adultos obesos 42. Los pacientes asmáticos y obesos tienden a ser más sedentarios con mayor intolerancia al ejercicio y se hospitalizan más frecuentemente cuando sufren una exacerbación 43. Los mecanismos por los cuales la obesidad podría determinar una mayor susceptibilidad a desarrollar asma se han atribuido sin completa consistencia a las adipokinas como la Leptina, que son hormonas que regulan el peso y la saciedad, pero que a su vez cumplen un rol pro inflamatorio, encontrando incluso receptores de leptina en tejido pulmonar. Además, la leptina podría jugar un rol en el desbalance del tono motor de la vía área a través de la activación de receptores muscarínicos de acetilcolina 44. Junto a lo anterior, la obesidad podría determinar un mal control del asma a través de un mecanismo de resistencia a los corticoides mediado por la reducción de steroid-induced mitogen- activated protein kinase phosphatase-1 45.
Las alteraciones sicosociales como el estrés, depresión y ansiedad son factores muy prevalentes en pacientes asmáticos problemáticos, se estima que el 40% de éstos presenta síntomas ansiosos y que al menos, la mitad de los pacientes con asma difícil o severa presenta trastornos emocionales 46. Los adolescentes asmáticos desarrollan 2 veces más trastornos ansiosos-depresivos que los no asmáticos, lo que a su vez determina mayor morbilidad, empeoramiento clínico y falta de control con un mayor deterioro en su calidad de vida 47,48. A la vez, el asma severa no controlada puede condicionar cambios sicológicos importantes en el enfermo por lo que deben investigarse siempre. Algunos niños, especialmente pacientes crónicos se acostumbran a diferentes grados de obstrucción bronquial y no son capaces de percibir adecuadamente los síntomas de agravamiento, lo cual se le denomina alexitimia y determina falta de consulta o tardanza en el diagnóstico. Todo lo anterior justifica en los casos complejos y refractarios, una evaluación sicológica y social en forma sistematizada, con la inclusión en el equipo multidisciplinario de un profesional idóneo que pueda enfrentar estos problemas 49,50.
Finalmente existe un grupo de pacientes asmáticos que evolucionan con asma problemática, pero que se debe a trastornos del patrón de la respiración, disfunción de cuerdas vocales e hiperventilación. Este trastorno está habitualmente asociado a problemas emocionales, debido a condiciones propias o bien secundarias a la misma severidad del asma y se manifiestan generalmente durante el ejercicio y dan cuenta de síntomas muy significativos 51. Su diagnóstico adecuado y el apoyo del equipo de kinesiólogos y fonoaudiólogos es clave a la hora de enfrentar a estos pacientes, para lograr realizar actividades tan comunes como el ejercicio.
En suma, la evaluación sistemática y estandarizada de este grupo de pacientes permitirá separar a aquellos susceptibles de controlar con medidas que no contemplan el escalamiento de nivel terapéutico del asma, sino un manejo racional ya sea de sus factores modificables y/o de sus comorbilidades, evitando realizar intervenciones más invasivas e innecesarias. Esto redundará en la disminución de los costos tanto para el paciente como para el sistema de salud. Si realizado este proceso no se logra el control, entonces es un paciente verdaderamente severo cuyo manejo contempla estudios y tratamientos personalizados.
No existen protocolos definidos para el estudio de estos pacientes más severos, pero se propone primero determinar la respuesta a corticoides a altas dosis, ya sea orales por al menos 2 semanas o intramusculares con 80mg Triamcinolona lo que asegura la adherencia, y con ello determinar la respuesta a corticoides. La respuesta a corticoides no está bien definida en pacientes pediátricos y en la Tabla 2 se exponen 3 dominios que se usan como criterios aceptados para evaluar la respuesta a corticoides o bien la refractariedad a estos. Se estima como falta de respuesta si no hay mejoría en los tres dominios, una respuesta parcial la mejoría de uno o dos y la respuesta completa a corticoides la normalización de los 3 dominios 52–54.
POSIBLES CRITERIOS DE RESPUESTA A CORTICOIDES EN ASMA SEVERA
| Respuesta clínica síntomas | ACT >20-25 o aumento de más de 5 puntos |
| Respuesta broncodilatadora | FEV1 sobre lo normal (≥−1.96 Z-score) o cambios ≥15% Sin respuesta post broncodilatador |
| Respuesta inflamatoria: | |
| Si es posible obtener esputo inducido | Conteo de eosinófilos en esputo normal (≤2.5%) |
| Si no es posible obtener esputo inducido se puede usar FeNO | Fracción de óxido nítrico exhalado * 115 normal (<24 partes por billón) |
Ref. Traducido de Bush A.et al (55)
Junto con la respuesta a corticoides, se debe evaluar anatómicamente a los pacientes mediante una TC de tórax y una fibrobroncoscopía, con toma de LBA y biopsia bronquial, en especial de aquellos que no tuvieron respuesta a corticoides favorable. Con esto tendremos claridad definitiva de las características anatómicas que ayudarán a descartar otras causas y a la vez determinar el patrón inflamatorio en la vía aérea que será clave para el esquema terapéutico a utilizar. Se propone además realizar IgE total, evaluación de sensibilización a hongos y pHmetría. Con estas evaluaciones podremos determinar el patrón clínico y fenotípico de estos pacientes, tales como: patrón de predominio eosinofílico, patrón exacerbador frecuente y asma lábil, el patrón neutrofílico, el patrón de obstrucción fija al flujo aéreo, los asmáticos con sensibilización a hongos y por último el patrón paucelular. La reevaluación sistemática de estos pacientes requiere de un equipo multidisciplinario que permita abordar situaciones de diferente índole y complejidad que en parte se ha expuesto en esta revisión y que determine un mejor control en pacientes tan complejos como estos 55,56. Ver Figura 2.
COMENTARIO FINALFinalmente, al enfrentar a un paciente con asma aparentemente refractaria al tratamiento, debemos considerar diferentes aspectos tanto del tratamiento, como del propio paciente y su entorno, que debidamente evaluados y ponderados determinarán si estamos frente a un paciente con Asma difícil de tratar y, por lo tanto, al controlar el o los factores modificables podremos generar el control de la enfermedad sin necesidad de escalar en el plan terapéutico. Ahora si luego de una evaluación protocolizada y multidisciplinaria, estamos frente a un paciente con un asma verdaderamente severa, se requerirá de protocolos terapéuticos complejos y personalizados según evidencias anatómicas, funcionales y clínicas que permitan lograr el control y/o disminuir el riesgo futuro.
El autor declara no tener conflictos de interés, en relación a este artículo.