La Fibrilación Auricular (FA) es la arritmia sostenida, más frecuente en la práctica clínica actual. Es considerada una epidemia global con una creciente incidencia y prevalencia, que está asociada a un importante gasto económico en los sistemas de salud pública. Se espera que el número de pacientes con FA continúe en aumento en los próximos años debido a una mejor detección de la FA silente, al envejecimiento de la población y al aumento de factores de riesgo que predisponen a presentar esta arritmia como por ejemplo hipertensión, insuficiencia cardíaca, enfermedad coronaria, obesidad, diabetes mellitus y enfermedad renal crónica. A pesar de los importantes avances en el manejo de la FA, esta arritmia continúa siendo una de las principales causas de Accidentes Cerebro-Vasculares (ACV), insuficiencia cardíaca y morbilidad cardiovascular.
El objetivo de esta revisión es resumir las diferentes estrategias de manejo disponibles para esta condición, incluyendo la prevención de ACVs, control de ritmo y control de frecuencia, con foco en avances recientes que han mostrado tener impacto en el pronóstico de esta arritmia.
Atrial fibrillation (AF) is the most common sustained cardiac arrhythmia in modern clinical practice. It is considered to be a global epidemic, with growing incidence and prevalence, and is associated with a substantial public health and economic burden. The number of patients with AF is expected continue rising in the following years due to better detection of silent AF, widespread population ageing and growing prevalence of predisposing factors such as hypertension, heart failure, coronary artery disease, obesity, diabetes mellitus and chronic kidney disease. Despite important progress in AF management in the past few years, this arrhythmia remains one of the major causes of stroke, heart failure and cardiovascular morbidity.
The purpose of this review is to provide a summary of the different management strategies available, including stroke prevention, rhythm control and rate control, with focus on recent developments that show a promising impact on this condition's prognosis.
La Fibrilación Auricular (FA) es la arritmia sostenida, encontrada con mayor frecuencia en la práctica clínica. Constituye una epidemia creciente, que se asocia a importantes complicaciones como accidentes cerebro vasculares (ACV), insuficiencia cardíaca (IC), y muerte. Debido a sus diversas formas de presentación y a las múltiples alternativas de tratamiento, su manejo es un desafío constante para cardiólogos y médicos no especialistas.
El objetivo de esta revisión es resumir los aspectos más importantes en el manejo de esta arritmia, en sus diferentes contextos clínicos y entregar una actualización de algunos de los avances más recientes.
EPIDEMIOLOGÍALos datos de prevalencia de FA provienen principalmente de países desarrollados de Europa Occidental y América del Norte. No se dispone de datos mundiales fidedignos, sin embargo, las estimaciones actuales sugieren que el 1% de la población en Europa, Estados Unidos y Australia tiene FA (1). En mayores de 40 años, uno de cada 4 adultos desarrollará FA a lo largo de su vida. Al eliminar la insuficiencia cardíaca y los infartos miocárdicos (dos importantes factores de riesgo), el riesgo estimado es uno de cada 6 (2,3). Vale la pena destacar que la insuficiencia cardíaca es un factor predisponerte de FA y en algunos casos es consecuencia de ésta.
La FA puede estar presente en 3-6% de los pacientes hospitalizados por condiciones agudas. En Chile la tasa de hospitalizaciones por FA ha mostrado una tendencia creciente en el tiempo aumentando de 2.2 a 2.8 por cada 10000 habitantes entre los años 2002 y 2007 (4)
La prevalencia real de la enfermedad podría ser considerablemente mayor, dado que muchos pacientes asintomáticos se encuentran sin diagnóstico (5). Se espera que la prevalencia de esta condición siga en aumento, debido a factores como el crecimiento económico que está relacionado a envejecimiento de la población mundial y el aumento de la prevalencia de factores de riesgo para FA, como por ejemplo la hipertensión arterial, en países desarrollados y en países en vías de desarrollo. El envejecimiento de la población es de gran importancia dado que el principal factor de riesgo para presentar FA es la edad. A modo de ejemplo los pacientes mayores de 80 años tienen aproximadamente 9 veces más riesgo de presentar FA que los individuos entre 50 y 59 años.
MECANISMOS FISIO-PATOLÓGICOS Y CLASIFICACIÓNLa característica principal de la FA es la actividad rápida y descoordinada de las aurículas. Esta actividad puede ser causada por focos automáticos de descarga rápida o por mecanismos de reentrada. En general, se requiere de un gatillo que inicie la arritmia. Estos gatillos de descarga espontánea se ubican habitualmente en las venas pulmonares, pero, pueden provenir de otras localizaciones. El mecanismo de mantención de la arritmia esta relacionado a los que ha sido llamado un “sustrato vulnerable”, que se genera por medio de factores genéticos, remodelamiento cardíaco por enfermedad cardiovascular o por alteración de la regulación de factores neurohumorales (autonómicos o tiroídeos).
La clasificación actual de la FA intenta relacionar los mecanismos fisio-patológicos con la presentación clínica para orientar las medidas terapéuticas a utilizar.
La FA paroxística es aquella que termina habitualmente en forma espontánea dentro de 7 días. La FA persistente es la que permanece por más de 7 días, mientras que persistente de larga data se refiere a la FA que está presente por más de un año. Finalmente es clasificada como permanente cuando el paciente y el médico tratante aceptan la arritmia y deciden no realizar más esfuerzos para cardiovertirla.
MANEJO DE LA FIBRILACIÓN AURICULAREl manejo de la FA tiene por objetivo la reducción de los síntomas y hospitalizaciones, así como la disminución de la morbi-mortalidad relacionada a esta condición.
El tratamiento específico se basa en cuatro aspectos principales: Control de frecuencia, control de ritmo, prevención de eventos tromboembólicos y el manejo intensivo de los factores de riesgo modificables como por ejemplo obesidad, apnea obstructiva del sueño y la hipertensión arterial. El control los factores de riesgo podría llevar a una reducción de la carga y severidad de FA.
Evaluación inicialLa primera aproximación a los pacientes con FA recientemente diagnosticada debería enfocarse en la presencia de inestabilidad hemodinámica que resulta por el compromiso del llenado diastólico y el aumento del consumo de oxígeno, particularmente en los pacientes con respuesta ventricular rápida. En caso de presentarse con compromiso hemodinámico, la arritmia debe ser inmediatamente terminada por medio de una cardioversión eléctrica (CVE). En ausencia de compromiso hemodinámico, el manejo de la FA será orientado por la presencia de síntomas y la duración de la arritmia. El foco de esta revisión será el manejo a largo plazo de la arritmia.
Control de frecuenciaEn la presentación aguda de la enfermedad, la mayoría de los pacientes requerirán intervenciones para controlar la respuesta (frecuencia) ventricular. En el manejo crónico de la arritmia, el control de frecuencia es razonable en los pacientes con escasa sintomatología secundaria a la FA. Habitualmente este grupo incluye a los pacientes de mayor edad.
Los objetivos de esta aproximación son reducir los síntomas, mejorar la calidad de vida (QOL) y minimizar el desarrollo de IC. Pareciera que el control estricto de la frecuencia es la mejor opción, sin embargo, los efectos secundarios de las drogas utilizadas han llevado a replantearse este punto. Por ejemplo, la mayoría de estos medicamentos reducen la actividad del nódulo sinusal (NS) y del nódulo aurículo-ventricular (NAV), lo que eventualmente puede llevar al implante de un marcapaso.
En el estudio RACE II se comparó una estrategia de control de frecuencia estricta (FC en reposo <80lpm) contra una más permisiva (FC en reposo <110 lpm), sin encontrarse diferencias en desarrollo de comorbilidad cardiovascular, sintomatología, QOL o mortalidad (6).
Existen diversos agentes disponibles para el control de la respuesta ventricular. Entre ellos están los Beta bloqueadores (BB), bloqueadores de los canales de calcio no-dihidropiridínicos (CCB), los digitálicos y la amiodarona. Esta última debería estar más restringida (para este objetivo), por sus potenciales efectos adversos relacionados a su uso prolongado.
No está claro qué combinación de drogas es la más efectiva para el control de frecuencia, pero pareciera que los BB y CCB (por sí solos) son más efectivos que la Digoxina. Hasta que haya datos de estudios randomizados, la decisión de los agentes a utilizar, está basada en las características individuales de los pacientes, especialmente sus comorbilidades.
En los casos en los que no se logra un adecuado control de la frecuencia con terapia farmacológica, se puede recurrir a la ablación del NAV asociada a el implante de un marcapaso o bien, se puede considerar el cambio a una estrategia de control de ritmo. En una revisión sistemática de que incluyó a 1181 pacientes con FA refractaria a control de frecuencia farmacológico, la ablación del NAV asociada a la estimulación por marcapaso, mejoró la función ventricular (estimada por fracción de eyección), la capacidad de ejercicio y la QOL, sin demostrarse un aumento en la mortalidad (7). En pacientes con disfunción ventricular izquierda que requieran ablación del NAV, la estimulación debe ser por medio de un marcapaso biventricular o resincronizador (CRT).
Control de ritmoUna característica importante de la FA es que tiende a presentar recurrencias, independiente de la intervención utilizada para terminarla y convertirla a ritmo sinusal.
El objetivo principal del control de ritmo es la reducción de los síntomas relacionados a la FA. Es razonable pensar que el control de ritmo puede mejorar el pronóstico de los pacientes con esta condición, sin embargo, hasta el año 2016 y principios de 2017, todos los estudios que han comparado estrategias de control de ritmo contra estrategias de control de frecuencia pos si solas (con anticoagulación adecuada), han tenido resultados neutros en términos de mortalidad, ACV y otros eventos cardiovasculares mayores (8).
El enfoque moderno del control de ritmo incluye la ablación por catéteres, en algunos casos asociada a uso de anti-arrítmicos y ablación como medida de primera línea. Existen varios estudios en curso, que fueron diseñados para evaluar si estas medidas, son capaces de reducir el número de eventos cardiovasculares (EAST – AFNET 4 y CABANA, entre otros).
La terapia farmacológica con drogas anti-arrítmicas (AAD) es la opción más utilizada para el control de ritmo y puede ser dividida en dos aspectos principales según el objetivo de la terapia: A) Uso para conversión a ritmo sinusal o B) Uso para mantención del ritmo sinusal (RS).
A) Drogas utilizadas para conversión a ritmo sinusalLa cardioversión farmacológica (o la eléctrica) está indicada en pacientes con FA de reciente inicio (<48 horas) o en pacientes que persisten sintomáticos a pesar de encontrarse en control de frecuencia. Para pacientes con FA de reciente inicio (<7 días) la tasa de conversión con AAD de la clase IC (Flecainida, Propafenona), clase III (Amiodarona) o drogas con efecto auricular selectivo (Vernakalant), varía entre 34-95%. En pacientes que tienen más de una semana en FA, las drogas de la clase IC y de la clase III, disminuyen su eficacia y sólo logran conversión a RS en un 15-40% (9), por lo que la cardioversión eléctrica (CVE) es preferible en este escenario. En los pacientes que han sido cardiovertidos, el uso de AAD aumenta al doble la probabilidad de mantener el RS al ser comparado con placebo (10).
Propafenona y Flecainida son las drogas de la clase IC más frecuentemente usadas en pacientes sin cardiopatía estructural, sin embargo, están contraindicadas en pacientes con disfunción ventricular (particularmente en aquéllos con enfermedad coronaria). Siempre deben ser indicadas con un fármaco que bloquee el NAV dado que pueden convertir la FA en Flutter Auricular (FLA) con conducción 1:1 por enlentecimiento de la conducción en la aurícula. Amiodarona es la AAD de la clase III más ampliamente disponible en el mundo y puede ser utilizada en pacientes con enfermedad coronaria y en miocardiopatía dilatada o hipertrófica, pero la conversión a RS ocurre varias horas más tarde que con otros agentes. Ibutilide y Dofetilide son dos antiarrítmicos de la clase III, que también son efectivos en la conversión de la FA (e incluso del FLA, en el caso de Ibutilide), pero deben ser administrados bajo monitorización estricta por que producen prolongación del intervalo QT y aumentan el riesgo de taquicardia ventricular polimorfa (Torsades de Pointes).
Vernakalant es un fármaco que sólo se encuentra disponible en preparaciones intravenosas y tiene efecto auricular selectivo (en múltiples canales, principalmente IKur). Es más efectivo que la Amiodarona para la conversión de la FA de reciente inicio, pero su eficacia es limitada en pacientes con FA de duración superior a 7 días.
B) Drogas utilizadas para mantención de Ritmo SinusalEl uso crónico de AADs es útil para prevenir las recurrencias de FA y para mantener el RS en pacientes post cardioversión (farma cológica o eléctrica) o en pacientes post ablación. Dado que el objetivo de la terapia a largo plazo es el control de los síntomas, se debe poner en la balanza el beneficio parcial obtenido con las AADs versus los potenciales riesgos asociados a su uso (8). Al momento de seleccionar la AAD se debe tener en consideración la presencia o ausencia de cardiopatía estructural y el perfil de seguridad de la droga.
Amiodarona reduce la frecuencia ventricular y es segura en pacientes con IC, dado que no aumenta la mortalidad en este escenario. En un estudio se demostró la superioridad de amiodarona para prevenir recurrencias de FA al ser comparada contra sotalol y propafenona. Las tasas de recurrencia con un seguimiento promedio de 468 días fueron de 35% con amiodarona versus 63% con propafenona o sotalol (11). Esta droga puede prolongar el intervalo QT, pero la ocurrencia de Torsades de Pointes es menos frecuente que con otras drogas como sotalol. Los efectos extra cardíacos de este fármaco hacen que sea considerado un agente de segunda línea en pacientes que no tengan contraindicaciones para usar otros fármacos. Dronedarona es un derivado de la amiodarona que no tiene moléculas de yodo, por lo que se ha propuesto que tiene menos efectos adversos pulmonares y tiroídeos que ésta. Es efectiva en la prevención de recurrencias de FA, pero aumenta la mortalidad en pacientes con insuficiencia cardíaca con FE reducida, recientemente descompensada (12). Además su uso está contraindicado en pacientes que han tenido reacciones adversas con Amiodarona. Flecainida y Propafenona son efectivos en la prevención de recurrencias de FA pero no deberían ser utilizadas en pacientes con enfermedad isquémica significativa o IC, dado que aumentan el riesgo de arritmias ventriculares. Son consideradas de primera línea junto con Sotalol, debido a que no tienen tantos efectos extra cardíacos como Amiodarona. Sotalol se asoció a un riesgo de 1% de TDP en el estudio PAFAC (13). Además aumenta la mortalidad en pacientes con disfunción ventricular izquierda post infarto. Quinidida y Disopiramida han sido asociadas a un aumento de la mortalidad global (con un NNH de 109 a un año de seguimiento), por lo que su uso debería evitarse (10).
Finalmente, Dofetilide es un agente que está disponible principalmente en Estados Unidos, que es efectivo y seguro en la prevención de recurrencias de FA en pacientes con IC (8). Existen diversas nuevas drogas en estudio que incluyen algunos nuevos derivados de amiodarona (como Budiodarona o Celivarona), otras drogas con efecto auricular selectivo (una presentación oral de Vernakalant, XEN-D0101, AVE0118) y otros bloqueadores de múltiples canales como Ranolazina y Vanoxerina.
ABLACIÓN PARA FIBRILACIÓN AURICULARLa ablación por catéteres se ha convertido en una alternativa de tratamiento más efectiva que la terapia farmacológica y puede ser usada junto con las AADs. Puede restaurar el ritmo sinusal y prevenir las recurrencias de arritmia en pacientes con FA paroxística, persistente y persistente de larga data que son intolerantes al tratamiento farmacológico o que han tenido recurrencias de arritmia mientras se encontraban recibiendo tratamiento farmacológico. La efectividad de esta terapia (mantención en RS con ausencia de FA) fluctúa entre 60-75% para los pacientes con FA paroxística (14) y un 50% para los pacientes con FA persistente (15). Además ha demostrado ser más efectiva que la terapia farmacológica como terapia de primera línea en pacientes con FA paroxística (16).
El objetivo principal de estos procedimientos es crear lesiones que eliminen los gatillos que inician la FA y en algunos casos, modificar el sustrato que la mantiene. Los primeros gatillos identificados (y los más comunes) se encuentran en las venas pulmonares (17) y la desconexión de estos gatillos o el aislamiento de las venas pulmonares es la base de todo procedimiento ablativo para FA y ha demostrado ser no-inferior a procedimientos más extensos incluso en pacientes con FA persistente. Existen otros gatillos de arritmia localizados en la vena cava superior, el seno coronario, la orejuela izquierda o la vena de Marshall que son menos frecuentes, pero que pueden ser importantes en casos particulares.
La ablación se realiza habitualmente por medio de lesiones creadas con radiofrecuencia, pero existen energías alternativas como la crio-ablación y la ablación con láser. Actualmente estas dos tecnologías utilizan dispositivos con forma de balón que hacen lesiones circunferenciales y acortan los tiempos de procedimiento. Los resultados obtenidos con crio-ablación son similares a los obtenidos con ablación por radiofrecuencia (18).
Hasta un 7% de los pacientes sometidos a ablación, presentará una complicación relacionada al procedimiento y del total de pacientes, un 2-3% presentará complicaciones graves, entre las que se encuentran: ACV (<1%), taponamiento cardíaco (1-2%), lesiones esofágicas (<5%), estenosis de venas pulmonares (<1%) y muerte (<0.2%) (8).
Para la prevención de ACVs durante el procedimiento de aislamiento de venas pulmonares, la anticoagulación oral debe ser mantenida sin cambios (objetivo de INR 2-3 para pacientes usando warfarina) y durante el procedimiento se debe utilizar heparina con un objetivo de ACT >300 segundos. Recientemente fue publicado el estudio RE-CIRCUIT donde se demostró una menor tasa de hemorragias mayores en pacientes sometidos a ablación de FA usando dabigatran (versus warfarina) en el período peri procedimiento (19), sin observarse diferencias en la tasa de eventos trombo-embólicos.
Actualmente no existe una indicación clara de ablación de FA para prevención de eventos cardiovasculares, para suspender la anticoagulación o disminuir el número de hospitalizaciones, por lo que las guías de práctica clínica de las diferentes sociedades, se han enfocado en el control de los síntomas para indicar aislamiento de venas pulmonares. Sin embargo, recientemente se publicó en el congreso de la Sociedad Europea de Cardiología, el estudio CASTLE-AF en el que se demostró una reducción significativa de la mortalidad en pacientes con FA e IC sometidos a ablación por radiofrecuencia.
PREVENCIÓN DE EVENTOS TROMBO-EMBÓLICOSEl riesgo de Accidentes Cerebro Vasculares (ACV) es 5 veces mayor en los pacientes con fibrilación auricular y los accidentes cerebro vasculares secundarios a FA tienen mayores tasas de mortalidad, discapacidad y se asocian hospitalizaciones más prolongadas (20).
El uso de anticoagulación oral con antagonistas de la vitamina K (VKA) como la Warfarina (con objetivo de INR entre 2-3), reduce el riesgo de ACV en un 64% y la mortalidad en un 26% al ser comparado con placebo (21). El uso de Aspirina ya no está avalado por las guías de manejo de FA dado que la evidencia que apoyaba su uso es escasa y provenía de un solo estudio. En la prevención de ACV, la anticoagulación con VKA es superior al uso de Aspirina por sí sola o en asociación con Clopidogrel y esta asociación de antiplaquetarios aumenta el riesgo de sangrado, llegando a tasas similares a las de los anticoagulantes orales (22).
La evaluación del riesgo de ACV es clave al momento de definir la necesidad de anticoagulación en FA, dado que éste no es homogéneo entre todos los individuos con esta condición. La probabilidad de presentar un ACV es dependiente de múltiples factores de riesgo, que han sido recopilados de pacientes que no estaban recibiendo terapia anticoagulante en estudios y cohortes, que en la actualidad son consideradas “históricos”. Estos predictores han sido agrupados en diversos esquemas de clasificación. El más difundido y utilizado de ellos es CHA2DS2-VASc (Tabla 1). Al ser comparado con su predecesor (CHADS2), este esquema agregó los siguientes “nuevos” factores de riesgo a la estratificación: Edad entre 65-74 años, enfermedad vascular (infarto miocárdico previo, enfermedad arterial periférica o placas aórticas complejas) y sexo femenino. El resultado es que tiene un rendimiento similar para identificar pacientes con baja probabilidad de presentar un ACV, pero tiene mejor desempeño en identificar pacientes de alto riesgo (23). El uso de anticoagulación oral está indicado en hombres con un puntaje CHA2DS2-VASc de 1 o más y en mujeres con un CHA2DS2-VASc de 2 o más (8). Esta diferencia se debe principalmente a que el sexo femenino no se asocia a mayor probabilidad de ACV en ausencia de otros factores de riesgo. El uso del ecocardiograma también puede aportar con otros parámetros que predicen la ocurrencia de ACVs, como, por ejemplo: disfunción ventricular izquierda moderada a severa, placas aórticas complejas, contraste espontáneo en la aurícula izquierda y velocidades bajas en la orejuela izquierda. Sin embargo, estos parámetros no están incluidos en los esquemas de clasificación habituales.
Factores de riesgo de ACV en FA. Score CHA2DS2-VASc
| Insuficiencia cardíaca | 1 punto |
| Hipertensión arterial | 1 punto |
| Edad ≥ 75 años | 2 puntos |
| Diabetes mellitus | 1 punto |
| Accidente cerebrovascular, TIA o tromboembolismo sistémico | 2 puntos |
| Enfermedad vascular (infarto miocárdico previo, enfermedad arterial periférica o placa aórtica) | 1 punto |
| Edad 65-74 años | 1 punto |
| Sexo femenino | 1 punto |
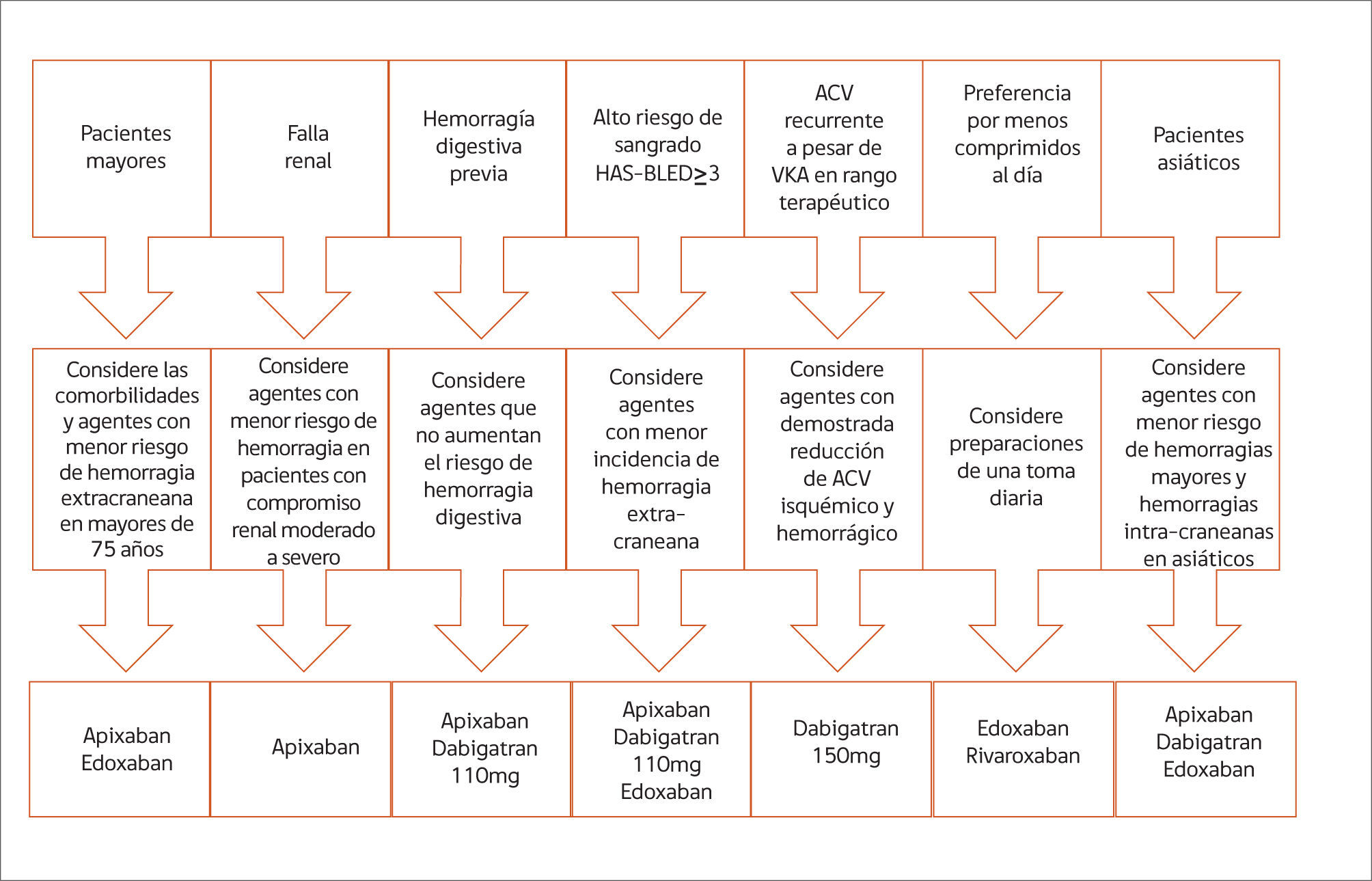
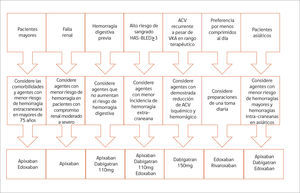
La introducción de los anticoagulantes orales no antagonistas de la vitamina K (NOACs) ha cambiado completamente el escenario de la prevención de ACV en FA en los últimos años. Actualmente existen dos clases de NOACs disponibles: los inhibidores directos de la trombina (Dabigatran) y los inhibidores del factor X activado (Rivaroxaban, Apixaban y Edoxaban). Todos ellos tienen un efecto biológico predecible, por lo que no necesitan monitorización del nivel de anticoagulación y han demostrado su eficacia y seguridad al ser comparados con Warfarina en grandes estudios controlados de fase III. En un meta-análisis que incluyó estos cuatro estudios se demostró que los NOACs, al ser comparados contra Warfarina, disminuyen la tasa compuesta de ACV o embolía sistémica en un 19% (RR: 0.81; 95% CI: 0.73-0.91), principalmente por medio de una disminución del ACV hemorrágico. También reducen la mortalidad global en un 10% (RR: 0.9; 95% CI: 0.85-0.95) y las hemorragias intra-craneanas (RR: 0.48; 95% CI: 0.39-0.59), pero con un aumento de las hemorragias digestivas (24). Las dosis menores de NOACs demostraron efectividad similar a warfarina en la prevención de ACVs o embolías sistémicas. La elección del agente específico dependerá de las características y comorbilidades del paciente, las interacciones farmacológicas y la función renal (Figura 1). La velocidad de filtración glomerular es de particular importancia dado que todos los NOACs tienen un porcentaje de excreción renal de al menos 30% y en todos los estudios de fase III se excluyeron los pacientes con clearance de creatinina <30ml/min. En el caso de apixaban se excluyeron los pacientes con un corte de 25ml/min.
Un punto extremadamente relevante en el uso de los NOACs es la disponibilidad de antídotos específicos que pueden revertir la acción de estos fármacos en corto tiempo. Para dabigatran se dispone de Idarucizumab un anticuerpo humanizado que revierte su efecto en minutos y para los inhibidores del factor X activado, se dispone de Andexanet un factor X activado recombinante que no tiene actividad enzimática, que también revierte el efecto de los anticoagulantes en minutos (25,26). En Chile se dispone de Idarucizumab para revertir el efecto de dabigatran. Para pacientes que presentan hemorragias con NOACs en lugares donde no se dispone de los antídotos específicos, se pueden usar los concentrados de complejos protrombínicos (que son los antídotos de elección en pacientes con hemorragias secundarias a VKA).
Para la prevención de ACVs en pacientes con FA que tienen contraindicaciones para el uso de anticoagulantes (VKA y NOACs), hoy se dispone de dispositivos de cierre de la orejuela izquierda, que son implantados por vía percutánea. Uno de estos dispositivos (Watchman) ha sido evaluado en estudios randomizados y ha sido comparado con warfarina (27,28) resultando ser no-inferior a ésta en la prevención de ACVs. Estos datos fueron confirmados en un meta-análisis de ambos estudios que incluía sus respectivos registros de seguimiento posterior. En un registro europeo de implante de estos dispositivos, se reportó una tasa de éxito de 98% con una tasa de complicaciones de 4% a 30 días (29). Estos resultados parecen alentadores, sin embargo, existe consenso en cuanto a la necesidad de más estudios controlados que evalúen la eficacia de estos dispositivos en pacientes con contraindicaciones absolutas para terapia anticoagulante oral y en pacientes que presentaron ACVs mientras estaban recibiendo anticoagulantes. También debe tomarse en consideración que en los estudios que han evaluado al dispositivo Watchman, los pacientes han sido mantenidos con Warfarina por los primeros 45 días post implante, luego con Aspirina y Clopidogrel hasta el sexto mes post implante y finalmente recibieron Aspirina en forma crónica.
PERSPECTIVAS FUTURASEl tratamiento de la FA es un área que se encuentra en pleno desarrollo y es probable que en los próximos años se disponga de nuevas y mejores alternativas de tratamiento. La única intervención que había logrado demostrar una clara disminución de la mortalidad relacionada a esta arritmia, había sido la anticoagulación con VKA. La incorporación de los NOACs ha representado un importante avance en esa misma dirección, con una mayor reducción de la mortalidad con respecto a los VKAs y con el potencial de aumentar el número de pacientes con FA que reciben tratamiento anticoagulante efectivo.
En el estudio CASTLE AF (recientemente publicado), la ablación por radiofrecuencia demostró una reducción significativa de la mortalidad, en pacientes con insuficiencia cardíaca y FA que se encontraban recibiendo tratamiento anticoagulante oral. Éste es el primer estudio que ha logrado demostrar que la ablación tiene efecto sobre el pronóstico de estos pacientes. Estos resultados son muy alentadores pero deben ser recibidos con cautela en espera de más estudios (como CABANA o EAST-AFNET 4) que corroboren este beneficio sobre la mortalidad o sobre otros eventos cardiovasculares mayores como por ejemplo la tasa de ACVs.
El autor declara no tener conflictos de interés, en relación a este artículo.