Las alteraciones del metabolismo mineral y óseo se inician tempranamente en el desarrollo de la enfermedad renal crónica (ERC), aunque las modificaciones en los niveles séricos de calcio y fósforo sólo se pueden apreciar en las etapas finales de la ERC debido a los mecanismos adaptativos que ocurren inicialmente. Con la pérdida de función renal ocurre retención de fósforo, lo que estimula la producción del factor de crecimiento fibroblástico 23 (FGF-23) por el hueso. Este factor inhibe la reabsorción de fósforo en el túbulo proximal disminuyendo la expresión de los cotransportadores sodio-fósforo 2a y 2c, lo que provoca una respuesta fosfatúrica, y entonces, normalizando los niveles de fósforo sérico, en una respuesta similar a lo que ocurre con la estimulación de paratohormona (PTH). Sin embargo, a diferencia de PTH, el FGF-23 inhibe la enzima 1-α-hidroxilasa y de este modo disminuye los niveles de calcitriol, lo que explica que la primera alteración mineral que se aprecia en los pacientes con ERC es la caída de los niveles de calcitriol, previo al aumento de PTH, y muy anterior al incremento en los niveles de fósforo sérico. Los eventos cardiovasculares constituyen la principal causa de muerte en pacientes con enfermedad renal crónica, tanto en prediálisis como en diálisis crónica, con una mortalidad en hemodiálisis crónica 10–20 veces mayor a la observada en la población general. Se ha demostrado que las alteraciones del metabolismo mineral y óseo son un componente importante en el riesgo cardiovascular de los enfermos con ERC. Hiperfosfemia, PTH e hipercalcemia son factores independientes de riesgo cardiovascular y mortalidad. A su vez, la calcificación vascular en la población con ERC ocurre en forma precoz y progresa rápidamente, en paralelo con una elevada tasa de enfermedad cardiovascular prematura. En el curso de la ERC se ha demostrado que no sólo los niveles de 1,25-(OH)2-vitaminaD (calcitriol) se encuentran disminuidos, sino también existe insuficiencia de 25-(OH) vitaminaD (calcidiol). Se considera deficiencia de vitamina D (25(OH)vitD) a concentraciones séricas < 15ng/ml e insuficiencia a valores entre 15 y 30ng/ml. Deficiencias tanto de calcitriol como de calcidiol han sido asociados a progresión de ERC y riesgo aumentado de mortalidad en estadíos 3–4 de ERC. Niveles subóptimos de vitamina D contribuyen al desarrollo de HPT2° a través de una reducción en la absorción intestinal de calcio, aumento de la producción de PTH y proliferación de la célula paratiroidea. Se ha considerado un nivel sérico óptimo de vitamina D niveles superiores a 30ng/ml. La administración de vitamina D y/o agonistas del receptor de vitamina D (VDRA) en pacientes en diálisis como en estadíos 3–4 logran mejoría en la sobrevida de los enfermos con ERC.
Disturbances in mineral and bone metabolism are highly prevalent among chronic kidney disease (CKD) patients and occur early in the development of the disease. However, hyperphosphatemia and hypocalcemia will be present only in the late stage as consequence of adaptative mechanisms. Recent studies indicate that in early CKD, the phosphate retention induces the production of the phosphaturic hormone fibroblast growth factor 23 (FGF-23). FGF-23 is primarily produced in the bone and directly acts on the kidney to down regulate the expression of the 2a and 2c sodium-phosphate co transporters in the proximal tubule in response to phosphate overload. Growing evidence indicates that rising FGF23 levels in early stages of CKD are partially responsible for maintaining phosphatemia within the normal range. Its phosphaturic actions are similar to PTH activities on kidney; however, FGF-23, opposite to PTH, concomitantly inhibits 1a-hydroxylase activities, thereby lowering the 1,25(OH)2D3 levels. In early CKD stages, patients have low calcitriol levels previously to PTH and phosphate increases. Cardiovascular disease (CVD) remains the leading cause of morbidity and mortality in patients with CKD. Both in dialysis and in non-dialysis patients, CVD remains the leading cause of death. The cardiovascular mortality in dialysis patients is greater than 10–20 times to general population. Elevated levels of serum phosphate, serum calcium and PTH are independent risk factors. Moreover, the presence of arterial calcifications in CKD patients is strongly predictive of outcome and demonstrates that vascular calcification is a powerful and independent prognostic marker for all-cause and CV mortality in chronic dialysis patients. It has been recognized that CKD patients have both vitamin D deficiencies, 1,25-(OH)2-vitaminD (calcitriol) and 25-(OH)vitaminD (calcidiol). 25-(OH) vitaminD levels below 15ng/ml are considered as deficiency, while levels between 15 and 30ng/ml as insufficient levels. Calcitriol and calcidiol deficiencies have been associated to kidney disease progression and higher mortality risk in early CKD stages. In addition, reduction in calcium intestinal absorption due to low vitamin D levels induces secondary hyperparathyroidism. Although still controversial, a 25(OH) vitamin D level greater than 30ng/ml has been considered optimal in CKD patients. The administration of vitamin D or vitamin D receptor agonist (VDRA) improves the survival of CKD patients.
La enfermedad renal crónica (ERC) es un problema de salud pública mundial, con un aumento creciente de pacientes con insuficiencia renal terminal y que en Chile ha alcanzado una incidencia de alrededor de 850 pacientes nuevos por año que ingresan a un programa de diálisis crónica y una prevalencia actual de aproximadamente 13.625 enfermos en este programa (1). Tal como sucede en países desarrollados, las principales causas de ERC son Diabetes Mellitus e Hipertensión arterial. Del mismo modo, las tasas de mortalidad aproximadas de 15% anual se mantienen sin variación. En Estados Unidos la población con ERC pre-diálisis se ha estimado en 16 millones; destaca en esta población, que <10% de los sujetos con filtrado glomerular menor a 60ml/min conocían su condición (2). En Chile, a diferencia de la información que disponemos de pacientes en terapia de sustitución renal, no tenemos datos de la población con ERC pre-diálisis. Si extrapolamos los datos obtenidos en Estado Unidos por el Third National Health and Nutrition Examination Survey (NHANES III) (3), la población chilena con clearance de creatinina < 60ml/min sería de alrededor de 500.000 sujetos. Al analizar los datos aportados por la Encuesta de Salud realizada por el MINSAL en 2003 (4), que estudió a 3.619 sujetos chilenos, se puede apreciar que un 5.9% tenía un filtrado glomerular estimado < a 60ml/min, con un 0.18% bajo 30ml/min (estadío 4). Estos datos nos permiten sospechar que alrededor de 900.000 chilenos tienen ERC lo que representa un inmenso desafío de salud pública.
La principal causa de muerte en pacientes con enfermedad renal crónica, tanto en prediálisis como en diálisis crónica, es eventos cardiovasculares, con una mortalidad en hemodiálisis crónica 10–20 veces mayor a la observada en la población general (5). Un estudio de seguimiento de pacientes con ERC previo a diálisis permitió observar que la mitad de los enfermos en estadío 4 (filtrado glomerular entre 30 y 15ml/min) fallecían antes de ingresar a un programa de diálisis crónica (6). Los mecanismos que expliquen este exceso de muertes por causa cardiovascular no han sido del todo dilucidadas. Los factores de riesgo, bien caracterizados para la población general, no explican por sí solos este incremento en la mortalidad (7). Diferentes estudios observacionales han sugerido que las alteraciones del metabolismo mineral y óseo son un componente importante en el riesgo cardiovascular de los enfermos con enfermedad renal crónica (8). Se ha demostrado que la hiperfosfemia, hormona paratiroidea (PTH) e hipercalcemia son factores independientes de riesgo cardiovascular y mortalidad (9–14). La calcificación vascular en la población con insuficiencia renal crónica ocurre en forma precoz y progresa rápidamente, en paralelo con su elevada tasa de enfermedad cardiovascular prematura (15). Estudios de autopsias en 120 niños urémicos revelaron la presencia de calcificación en tejidos blandos en más del 60% de los casos y de ellos el 60% tenía calcificación vascular (16).
Desde muy temprano en el desarrollo de la nefrología clínica, el estudio de la denominada Osteodistrofia Renal tuvo una marcada relevancia, determinado fundamentalmente por la severa morbilidad observada en los pacientes en diálisis crónica. Desde entonces el hiperparatiroidismo secundario (HPT2°) ha sido objeto de estudio extenso, tanto en su patogenia como en su manejo en la ERC. Hoy sabemos que el HPT2° no es la única afección que aqueja a los pacientes con ERC, y que en enfermos en estadío 5 el trastorno de bajo remodelamiento (enfermedad ósea adinámica) parece ser más frecuente. Sin embargo, en enfermos con ERC en estadíos más precoces el desarrollo de HPT2° es primariamente la afección ósea más frecuente. Recientemente, algunos datos apuntarían a que el tratamiento con vitamina D en enfermos con ERC mitigaría el efecto del HPT2° sobre la mortalidad. La deficiencia de 1,25-dihidroxi-vitaminaD (1,25(OH)2vitD3 o calcitriol) que ocurre durante el desarrollo de ERC se debe a que la etapa de hidroxilación de 25-hidroxivitaminaD (25-OH-vitD3 o calcidiol) a calcitriol es mediado por la 1α-hidroxilasa renal. El déficit de calcitriol tiene un rol mayor en la génesis del HPT2°, ya que su deficiencia promueve una mayor síntesis de la PTH y crecimiento de la glándula paratiroidea (hiperplasia). Aunque la disminución de 1α-hidroxilasa renal por la progresión de la ERC es el factor principal en el déficit de calcitriol, éste no es el único factor involucrado. Otros factores, como la deficiencia de sustrato (25-OH-vitD3) pueden contribuir a este déficit hormonal. Diversos estudios han mostrado que hasta el 85% de los pacientes con ERC tienen niveles deficientes de 25-OH-vitD3 (< 30png/ml). Importante información sobre el comportamiento mineral en ERC fue obtenido del estudio SEEK, acrónimo del Study to Evaluate Early Kidney Disease. En este estudio reciente, que abarcó más de 1.800 enfermos con ERC pre-diálisis, se demostró que los niveles de calcitriol comienzan a disminuir precozmente en el desarrollo de la ERC, luego de leves reducciones de la tasa de filtración glomerular, y antes de que se observe un incremento en la PTH (que aparece con filtrado glomerular menor a 50ml/min) mientras los niveles de calcio y fósforo sérico se mantienen normales. Aún más, Levin et al no encontraron una correlación entre calcidiol y calcitriol; así, aproximadamente el 45% de los pacientes con bajos niveles de calcitriol tenían niveles normales de calcidiol. Por otra parte, desde hace tiempo se conoce que la disminución de calcitriol y la aparición de HPT2° se producen cuando aún no ha ocurrido retención de fósforo sérico e incluso, en etapas tempranas de ERC la fosfemia tiende a estar reducida comparada con sujetos normales. Esta condición fue conocida como la hipótesis “tradeoff” del HPT2°, donde la retención de fósforo estimulaba la secreción de PTH, y ésta, como consecuencia de su acción fosfatúrica, normalizaba la fosfemia pero a expensas de un nivel cada vez más elevado de PTH. En el estudio antes citado, pese a la alta prevalencia de HPT2° en pacientes con estadío 4, la ocurrencia de hiperfosfemia ocurrió raramente. Ya el paradigma clásico de la regulación del fósforo sérico a través sólo de las dos hormonas calcitrópicas fundamentales: PTH y vitamina D, fue puesto en duda cuando en algunas condiciones patológicas se vio que los niveles de fósforo estaban alterados sin cambios significativos en los niveles de PTH o calcitriol, lo que hacía sugerir que otros factores estarían participando en su regulación.
Rol del FGF-23La evidencia de que factores humorales estarían participando de la regulación del fósforo, más allá de PTH y calcitriol, vino de condiciones patológicas como el síndrome de osteomalacia tumoral, donde se observa marcada hipofosfatemia por pérdida urinario de fósforo y su asociación con tumores mesenquimáticos, ya que la fostaturia desaparece cuando son los tumores son extirpados indicando la existencia de un factor circulante. Por otra parte, el modelo animal del trastorno de raquitismo hipofosfémico ligado a X, el ratón Hip, fue también otra evidencia de la existencia de un factor circulante. En este caso se pudo inducir pérdida urinaria de fósforo en un ratón normal poniéndolo en parabiosis con un ratón Hip o cuando un riñón de ratón normal es trasplantado en un ratón Hip. De estos factores circulantes, denominados fosfatoninas, el mejor estudiado es el factor de crecimiento fibroblástico 23 (FGF-23). El FGF-23 es un factor de 251 aminoácidos, con un peso molecular de 32 kDa perteneciente a la misma familia de los otros 22 factores de crecimiento fibroblástico. Es producido primariamente por los osteocitos en el hueso, y en menor magnitud por los osteoblastos, por lo que consideramos ahora al tejido óseo no sólo como blanco de las hormonas participantes del metabolismo mineral, sino también como uno de los principales reguladores de los niveles de fósforo sérico y en segunda medida del resto de las hormonas calciotrópicas.
Se han descrito 4 tipos de receptores para FGF: FGFR 1, 2, 3 y 4, con sus diferentes subtipos. El FGF-23 se une con alta afinidad al FGFR1 (IIIC), que se expresa en el túbulo renal, pero primariamente en el túbulo distal, mientras que la acción fosfatúrica del FGF-23 ocurre en el túbulo proximal. Hasta ahora se desconoce la vía de señalización desde el túbulo distal al proximal. Por otra parte, para poder actuar sobre su receptor específico, el FGF-23 necesita unirse a una proteína transmembrana conocida como Klotho. La expresión de Klotho en un tejido determina la acción sitio específica de FGF-23. Al igual que PTH, el FGF-23 determina pérdida urinaria de fósforo o acción fosfatúrica, por decremento de la presencia de cotransportadores sodio/fosfato NaPi-2A en la superficie apical de las células del túbulo proximal. Sin embargo, a diferencia de PTH que estimula la 1α-hidroxilasa y de este modo eleva los niveles de calcitriol, el FGF-23 inhibe a la 1α-hidroxilasa. Así, ratones con sobre expresión de FGF-23 se caracterizan por hipofosfemia y niveles disminuidos de calcitriol sanguíneo. Por el contrario, ratones knock-out para FGF-23 o Klotho se presentan con hiperfosfemia, niveles elevados de calcitriol y marcado desarrollo de calcificaciones heterotópicas (18–22).
En el estudio transversal de Levin et al antes comentado (17), se demostró que el descenso de calcitriol ocurría precozmente en la ERC, antes de que se elevara la PTH y que los niveles de fósforo sérico se mantenían normales hasta muy avanzada la ERC. Que la disminución de calcitriol no era dependiente de un déficit de sustrato podemos entenderlo ahora como consecuencia de una elevación del FGF-23 con el fin de mantener regulado el fósforo sérico como se demostró por otros autores. Shigematsu et al estudiaron 62 pacientes pre-diálisis (23) y los dividieron en 3 grupos dependiendo de su filtrado glomerular: Grupo I: >80ml/min, Grupo II: 80 a 30ml/min, Grupo III: <30ml/min. Los niveles séricos de FGF-23 se midieron utilizando un ensayo ELISA de doble anticuerpos que no detecta los fragmentos biológicamente inactivos que se acumulan en insuficiencia renal. Los niveles de FGF-23 se incrementaron exponencialmente con la disminución del clearance de creatinina. También se observó una correlación estrecha de los niveles séricos de FGF-23 con los niveles de PTH intacta (PTH1-84 + PTH 7-84) como de PTH 1-84, mientras que con calcitriol se encontró una correlación exponencial negativa. El estudio de Gutiérrez et al en 80 pacientes con ERC (21) concluyó que el incremento de FGF-23 a medida que la ERC avanza contribuye a mantener los niveles normales de fósforo a costa de un empeoramiento en el déficit de calcitriol. Fliser et al han propuesto al FGF-23 como predictor de la progresión de la ERC (24, 25). En una cohorte de 227 pacientes no diabéticos con ERC encontraron una correlación inversa entre tasa de filtrado glomerular y niveles de FGF-23. A 177 de estos pacientes los siguieron prospectivamente por 53 meses. En 65 de ellos observaron una duplicación de la creatinina sérica y/o insuficiencia renal terminal. FGF-23 fue un predictor independiente de progresión de ERC tras ajustes por edad, sexo, filtrado glomerular inicial, proteinuria, calcemia, fosfemia y PTH. Los mecanismos para entender la participación en la progresión de la ERC no son del todo claros. Ha sido reconocido que en hasta un 50% de los sujetos con ERC hay inflamación activa, como se puede apreciar por la elevación de IL-6 y PCRus y que ésta tiene relación con trastornos del metabolismo mineral (26). Navarro-González et al estudiaron una cohorte de 133 pacientes con ERC pre-diálisis, que no recibían qelantes de fósforo, suplementos de calcio ni vitamina D (27). Mientras análisis de regresión múltiple demostraron que la tasa de filtrado glomerular y el fósforo sérico se asociaron independientemente con IL-6 y PCR, análisis de regresión logística, usando la presencia de estado inflamatorio como variable presente/ausente, mostró a la tasa de filtrado glomerular como factor protector, mientras que el fósforo fue un factor de riesgo independiente para la presencia de un estado inflamatorio. Sin embargo este estudio no midió los niveles de FGF-23 ni de calcitriol. Zendher et al mostraron que los marcadores de inflamación y la infiltración renal por macrófagos estaban inversamente correlacionadas con los niveles séricos de calcitriol (28). Estudio in vitro reveló que la 1,25(OH)2D3 atenuó la expresión de MCP-1 inducida por TNF en células humanas de túbulo proximal. Estos datos parecen sugerir que el efecto inflamatorio del fósforo no sólo puede estar determinado por un efecto directo sino también por la disminución de 1,25(OH)2D3 provocado por elevación del FGF-23 inducido por la retención de fósforo.
Un estudio reciente del grupo de investigadores de Sao Paulo reveló la importancia del manejo precoz del FGF-23 en los estadíos tempranos de la ERC (29). La hipótesis de estos autores fue que pese a que los pacientes con estadíos 3–4 mantenían niveles séricos normales de fósforo, esto era a costa de niveles elevados de FGF-23 y por tanto, responsable de niveles disminuidos de calcitriol. El aporte de quelantes de fósforos con el fin de disminuir la “carga” de fósforo en estos pacientes disminuiría los niveles de FGF-23 y aumentaría los de calcitriol. Cuarenta pacientes fueron seguidos durante 8 semanas y fueron randomizados a recibir sevelamer o acetato de calcio a dosis crecientes de 1.6, 3.2 y 6.4g/día y 1.32, 2.64 y 5.28g/día, respectivamente. Sus niveles de fósforo sérico fueron normales (3.53±0.6mg/dl), con una ingestión de fósforo relativamente baja para nuestra población (739±253mg/d), lo que se refleja en una fosfaturia de 491±151mg/d. Sin embargo, tenían una elevada fracción excretada de fósforo (59.7±32.4%) y PTH (101pg/ml, con rango de 70 a 130). Los niveles de 1,25(OH)2vitD fueron 31.3±21ng/ml. Todos los enfermos, excepto 5, tenían niveles elevados de FGF-23 (valor normal: 8.2−54.3pg/ml) con un promedio de 97pg/ml (rango 64 a 142). Después del tratamiento con quelantes de fósforo hubo una progresiva disminución de PTH, fosfato urinario, y de la fracción excretada de fósforo sin observarse cambios en los niveles plasmáticos de calcio o fósforo. En este corto período de estudio se logró observar en el 60% de los pacientes que recibieron sevelamer, un incremento en los niveles plasmáticos de calcitriol. Esto ocurrió en asociación a una disminución significativa de los niveles de FGF-23 (107 vs 54pg/ml, p<0.5). Curiosamente en el grupo con acetato de calcio hubo también una tendencia a la disminución pero no alcanzó diferencias significativas. No se tiene aún una explicación para este fenómeno. Estos datos demuestran que en estadíos tempranos de la ERC, pese a tener fosfemia normal es necesario un control más agresivo del fósforo y usar más el concepto de “carga” de fósforo que el nivel plasmático. Para ello podría ser suficiente controlar a los enfermos con fosfaturia en orina de 24 horas tal como hacemos con la urea en orina con el fin de determinar consumo de proteínas.
ERC y déficit de vitamina DDiferentes estudios observacionales en pacientes con ERC han mostrado que no sólo los niveles de 1,25-(OH)2-vitaminaD (calcitriol) se encuentran disminuidos, sino también existe un importante número de enfermos, hasta 86%, con insuficiencia de 25-(OH)vitaminaD (calcidiol) e incluso, en un estudio se observó que 14% y 26% de los pacientes en estadíos 3 y 4 respectivamente tenían franca deficiencia (<10ng/ml) (30). Ambas situaciones han sido asociados a progresión de ERC y riesgo aumentado de mortalidad en estadíos 3-4 de ERC (31). La administración oral o inyectable de vitamina D y/o agonistas del receptor de vitamina D (VDRA) (Tablas 1 y 2) en pacientes en diálisis como en estadíos 3–4 han sido correlacionados con mejoría en la sobrevida (32, 33). Todavía es motivo de debate que se considera deficiencia de vitamina D (calcidiol y calcitriol). En general, se considera deficiencia de vitamina D (25(OH)vitD) a concentraciones séricas <15ng/ml e insuficiencia a valores entre 15 y 30ng/ml. Niveles subóptimos de vitamina D contribuyen al desarrollo de HPT2° a través de una reducción en la absorción intestinal de calcio, aumento de la producción de PTH y proliferación de la célula paratiroidea. La administración de formas inactivas de vitamina D, ergocaciferol (vitamina D2) y colecalciferol (vitamina D3), aumentaron significativamente los niveles de 25-(OH)-vitD y 1,25-(OH)2-vitD en pacientes con ERC en estadíos 3 y 4, con supresión significativa de PTH (34). Los VDRA no selectivos (calcitriol) y selectivos (paricalcitol) y las prohormonas (alfacalcidol y doxercalciferol) suprimieron PTH de una manera dosis dependiente, independiente del estadío de la ERC (35, 36). Un estudio reciente, randomizado, controlado, de 3 meses de duración, comparó la efectividad de un suplemento de vitamina D (colecalciferol) versus una prohormona (doxercalciferol) en suprimir PTH en pacientes con ERC estadíos 3–4 (37). Se incluyeron pacientes en ERC estadío 3 con PTH >100pg/ml y pacientes en estadío 4 con PTH >150pg/ml, pero ambos grupos con PTH máxima <400pg/ml y niveles de 25(OH)vitD <20ng/ml. Veinte y dos pacientes recibieron colecalciferol a dosis de 4.000 UI diarias el primer mes y luego 2.000 UI diarias y 25 enfermos recibieron doxercalciferol (0.5ug diarios). No se observó diferencia en larespuesta supresora de PTH. Como era de esperar, hubo un significativo aumento en los niveles de calcidiol en el grupo tratado con colecalciferol (14±6 a 37±10ng/ml, p<0.001). Tampoco hubo diferencia en los niveles de calcio sérico y urinario entre los grupos tratados.
Vitamina D2 - D3 Y Sus Derivados
| D2 y derivados | D3 y derivados | Terminología | |
|---|---|---|---|
| Compuesto | |||
| Abreviación | D2 | D3 | D |
| Nombre | Vitamina D2 | Vitamina D3 | Vitamina D |
| Sinónimo | Ergocalciferol | Colecalciferol | |
| Producto de 1° hidroxilación | |||
| Abreviación | 25(OH)D2 | 25(OH)D3 | 25(OH)D |
| Nombre | 25-hidroxivit D2 | 25-hidroxivit D3 | 25-hidroxivit D |
| Sinónimo | Ercalcidiol | Colecalcidiol | Calcidiol |
| Producto de 2° hidroxilación | |||
| Abreviación | 1,25(OH)2D2 | 1,25(OH)2D3 | 1,25(OH)2D |
| Nombre | 1,25-dihidroxivit D2 | 1,25-dhidroxivit D3 | 1,25-dihidroxivit D |
| Sinónimo | Ercalcitriol | Colecalcitriol | Calcitriol |
Vitamina D y Activadores del Receptor de Vitamina D (VDRA) Selectivos y No Selectivos
| Vitamina D2 | Ergocalciferol | Ergocalciferol (Lab. Chile, amp 2ml, 600.000 UI) |
| Vitamina D3 | Calciferol | no disponible en Chile |
| Prohormona | ||
| 1-(OH)D3 | Calcidiol | Etalpha® (Lab. Leo, Pentapharma, caps. 0.25 y1.0ug) |
| 1-(OH)D2 | Doxercalciferol | Hectorol@ (Lab. Genzyme, comp. 0.25ug) |
| VDRA no selectivo | ||
| 1,25(OH)2D3 | Calcitriol | Rocaltrol® (Lab. Roche, comp. 0.25 y 0.50ug) |
| Caleobrol® (Lab. Recalcine, comp. 0.25 y 0.50ug) | ||
| Calcijex® (Lab. Abbott, ampolla 1.0ug) | ||
| VDRA selectivo | ||
| 19nor,1,25(OH)2D3 | Paricalcitol | Zemplar@ (Lab. Abbott, ampolla 0.5ug) |
| 22oxa,1,25(OH) 2D3 | Maxacalcitol | no disponible en Chile |
La dosis óptima de vitamina D para alcanzar niveles séricos “adecuados” ha estado sujeto a controversia, como también cuál es el nivel sérico óptimo, aunque la mayoría considera actualmente niveles de 30ng/ml. Sin embargo, niveles de esta magnitud parecen ser insuficientes para suprimir PTH en pacientes con ERC y pese a que la recomendación actual para la población general es de 600 a 800 UI de colecalciferol diario, dosis de 4.000 UI diarias han demostrado ser seguras y adecuadas para frenar PTH en ERC (38). Un estudio evaluó el impacto de la suplementación de ergocalciferol sobre los niveles de 25(OH)vitaminaD y la supresión de PTH en pacientes con ERC estadío 3 y 4 (39). La pauta de dosificación de ergocalciferol usada fue la sugerida por las guías K/DOQI (Tabla 3). Después de un período de tratamiento de alrededor de 7 meses, alrededor del 60% de los enfermos en estadíos 3 y 4 alcanzaron niveles >30ng/ml. El aumento en los niveles de 25(OH)vitaminaD se observó en el 50% de los pacientes en estadío 3 y en el 20% de aquellos en estadío 4, con un incremento en los niveles de 1,25(OH)2vitamina D. Los niveles de PTH disminuyeron significativamente en los pacientes en estadío 3, pero no en aquellos en estadío 4. Curiosamente no hubo asociación estrecha entre quienes lograron normalizar su concentración de 25(OH) vitamina D, ya que no todos los pacientes lograron reducir significativamente PTH, y eso probablemente estuvo relacionado a que aquellos enfermos fueron quienes pese a mejoría en los niveles de 25(OH) vitamina D no lograron incremento importante en 1,25(OH)2 vitamina D por lo avanzado de la insuficiencia renal. Este estudio tampoco evaluó si aquellos enfermos que respondieron menos favorablemente a la suplementación con ergocalciferol tuvieron una mayor carga de fósforo y mayores niveles de FGF-23.
Dosis de Ergocalciferol de Acuerdo a Niveles Sanguíneo de Calcidiol [25(OH)Vitaminad]
| Nivel de 25(OH)vitD, ng/ml | Dosis |
|---|---|
| < 15 | 50.000 UI semanal × 4; mensual × 3; 1.200 UI diarias |
| >15, < 25 | 50.000 UI semanal × 4; 1.200 UI diarias |
| > 25 | 1.200 – 2.000 UI diarias |
Modificado deref. 31.
En 2003 la National Kidney Foundation estableció la Kidney Disease Outcomes Quality Initiative (KDOQI) con el objetivo de proveer de una guía para el manejo de los pacientes con ERC (40). Recientemente un grupo de expertos mundiales del equipo de trabajo de Kidney Disease: Improving Global Outcomes (KDIGO) actualizó e hizo nuevas recomendaciones para el manejo de las alteraciones minerales y óseas en la enfermedad renal crónica (AMO-ERC) (41). En general, datos de estudios randomizados, prospectivos, controlados, son escasos y la mayoría de ellos en población de ERC en diálisis, por lo que las sugerencias de manejo en el paciente pre-diálisis han estado basadas primariamente en opiniones. Más aún, el grado de desconocimiento y cumplimiento de metas propuestas en las guías para la población con ERC es mayor, especialmente en población pre-diálisis. El grupo de estudio español OSERCE en un estudio de encuesta en nefrólogos observó que los objetivos terapeúticos de las guías K/DOQI eran desconocidos en una alta proporción (42).
Reconocimiento de AMO-ERCEl término Osteodistrofia Renal ha sido reservado sólo para los trastornos del remodelamiento óseo observado en uremia y su reconocimiento es exclusivamente por biopsia ósea, que es el “patrón de oro” para la clasificación de la enfermedad ósea en la uremia. La presencia de alteraciones en marcadores bioquímicos, radiológicos, cintigráficos, ha sido denominado alteraciones minerales óseas observadas en enfermedad renal crónica (AMO-ERC). Las alteraciones bioquímicas se evalúan mediante tests de laboratorio que incluyen: calcemia, fosfemia, PTH, fosfatasas alcalinas, bicarbonato plasmático, niveles séricos de 25(OH)vitD y 1,25(OH)2vitD. La medición de PTH intacta (PTHi) incluye la hormona total (PTH 1–84) más el fragmento 7–84. La medición de PTHi biológica o total (solo PTH 1–84) no está aún disponible en el país. En el espectro de enfermedad ósea en la ERC temprana, al igual que en la avanzada o terminal, se puede observar una enfermedad de alto remodelamiento (osteítis fibrosa, por elevación de PTH) o enfermedad ósea de bajo remodelamiento (osteomalacia y enfermedad ósea adinámica). En general, los métodos diagnósticos no invasivos para diagnosticar estado del remodelamiento óseo, resorción ósea mediante el telopeptido carboxilo terminal del colágeno tipo 1 (CTX) o la isoforma 5b de la fosfatasa ácida resistente a tartráto (TRACP5b) para y formación ósea mediante la fosfatasa alcalina específica ósea (BALP) o el propéptido aminoterminl intacto del procolágeno tipo 1, pierden validez a medida que la ERC progresa dado la acumulación de metabolitos. Estudios de asociación entre isoformas de fosfatasa alcalina óseo específica (BALP), incluyendo la isoforma B1x que sólo se observa en uremia, y otros marcadores de remodelamiento óseo (43) permitirían una mejor aproximación diagnóstica al estado de remodelamiento óseo de estos pacientes. Actualmente los nefrólogos usan la PTH como elemento diagnóstico diferenciador de remodelado óseo. Aunque aún los diferentes ensayos de PTH no son óptimos, en pacientes con estadío 5 en diálisis, un nivel de PTHi <100pg/ml asociado a un nivel de fosfatasa alcalina total disminuida es altamente probable de Enfermedad Ósea Adinámica, mientras que niveles superiores a 600pg/ml y fosfatasas alcalinas total aumentadas son muy sugerentes de Enfermedad Ósea de alto remodelamiento. Lamentablemente, valores de PTHi entre esos valores no permiten diferenciar con certeza el tipo de remodelado óseo. Más aún, con las dificultades metodológicas en la medición de PTH sérica debido a la acumulación de fragmentos de PTH y variabilidad interensayo, las nuevas guías KDIGO (41) establecen que en ERC estadíos 2 a 4 no hay valores de PTHi predictores de remodelado óseo y que el incremento de la PTH observado en la etapas iniciales de la ERC corresponde a una respuesta adaptativa a las alteraciones minerales, por lo que aconsejan que si los niveles de PTH superan el límite normal alto para el ensayo, evaluar hiperfosfemia, hipocalcemia y déficit de de vitamina. Por lo tanto, la corrección de estas anormalidades serán suficientes en la gran mayoría de los casos para disminuir los niveles de PTH.
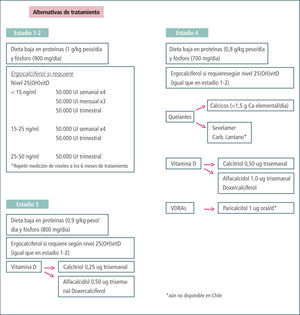
Control de CA, P, PTH y 25(OH)vitDTodos los enfermos con ERC deben tener medición de niveles plasmáticos de calcio, fósforo, PTH y 25(OH)vitD al momento del diagnóstico (en nuestro país aún no tenemos disponibilidad de medición de 1,25(OH)2vitD). La frecuencia de medición posterior dependerá de la presencia y magnitud de los trastornos encontrados y de la progresión de la ERC (Tabla 4).
En estadío 3: calcio y fósforo cada 6–12 meses, y para PTH de acuerdo al nivel basal y comportamiento del calcio y fósforo.
En estadío 4: calcio y fósforo cada 3–6 meses, PTH cada 6–12 meses y fosfatasa alcalina anual o más frecuente si PTH está elevada.
Frecuencia De Medición De Calcio, Fósforo, PTH Y 25(OH) VITD
| Calcemia | Fosfemia | PTHi | 25(OH)vitD | |
|---|---|---|---|---|
| Estadio 2 | Basal y anual | Basal y anual | Basal y anual | Basal y a los 6 meses |
| Estadio 3 | Basal y c/6-12 meses | Basal y c/6-12 meses | Basal y de acuerdo a Ca-P | Basal y a los 6 meses |
| Estadio 4 | Basal y c/3-6 meses | Basal y c/3-6 meses | Basal y c/6-12 meses | Basal y a los 6 meses |
| Fosfaturia | Nitrógeno ureico urinario | |||
| Basal y c/6-12meses Objetivo: < 800–700mg/24 horas | Basal y c/6-12meses Objetivo: < 8–9g/24 horas (*para individuos 70kg.) | |||
Si los niveles de 25-(OH)vitD están disminuidos (<30ng/ml) o francamente insuficientes (<15ng/ml) deben recibir suplementación con colecalciferol o ergocalciferol. Desafortunadamente en Chile no existe una fácil disponibilidad de estos compuestos, los que en su mayoría se encuentran asociados a calcio y otras vitaminas. La dosis a usar son 2.000–4.000 UI diarias o 30.000 UI mensual o bimensuales hasta rellenar los depósitos (Tabla 5).
Manejo de calcio y fósforoLas guías de K/DOQI para estadíos 2 a 4 establecieron el uso de quelantes de fósforo cuando el nivel de fósforo plasmático fuera mayor a 4.6mg/dl. Sin embargo, las recomendaciones de KDIGO son mantener calcemia y fosfemia en niveles normales. Sin embargo, la presencia de fósforo sérico en niveles normales no garantiza que esté en curso serias alteraciones minerales, con disminución de calcitriol debido a FGF-23 y aumento de PTH. Más aún, KDIGO establece que no conocemos cuál es el nivel óptimo o adecuado de fosfemia para estos niveles de ERC y que se debería lograr el menor nivel de fosfemia posible. Probablemente se debiera ser más enérgico en el manejo del fósforo dietético, bajando la carga de fósforo reconociendo las cargas de fósforo “ocultas” en los alimentos (44) y eventual uso de quelantes aún en presencia de fósforo plasmático “normal” pero con una fosfaturia >700mg/d y/o fracción excretada >55%.
Se recomienda reducir ingesta de fósforo a <800mg/día y medir fosfaturia como objetivo terapeútico (29). Si pese a la restricción dietética la fosfaturia se mantiene por sobre 700mg/día se puede agregar quelantes de fósforo, evitando aquellos que contengan aluminio. El aporte de quelantes cálcicos o no cálcicos dependerá de las condiciones particulares de cada enfermo, sus niveles de calcio plasmático, y control adecuado de la carga de fósforo sin llegar a cargas excesivas de calcio (>2g/d). Russo et al estudiaron un grupo pequeño de enfermos con ERC no en diálisis y evaluaron la progresión de las calcificaciones coronarias que tenían estos pacientes (45). Ha sido demostrado previamente que los enfermos con ERC estadíos tempranos tienen más calcificación de arterias coronarias que los sujetos de su misma edad con función renal normal. Los autores dividieron a los enfermos en 3 grupos: aquellos con sólo restricción dietética de fósforo, otro grupo que se agregó carbonato de calcio y otro que se agregó sevelamer. Todos los grupos tenían fosfemia normal pero en su rango alto (entre 3.9 y 4.6mg/dl) e ingesta de fósforo alrededor de 690mg/día con fosfaturia entre 367 y 496mg/día. El grupo que sólo recibió la restricción dietética fue el que tuvo la mayor progresión de las calcificaciones coronarias, pero fue también el único donde la fosfaturia no disminuyó, e incluso aumentó comparado al inicio (46).
Manejo de PTHLos niveles óptimos para PTH en estadíos 3 y 4 no son conocidos y por lo tanto no pueden darse guías para un nivel determinado. Es conveniente observar evolución de los niveles séricos y cuando superen el límite normal alto para el ensayo usado y sean progresivos, es conveniente evaluar cuidadosamente al paciente para detectar hiperfosfatemia, hipocalcemia y déficit de vitamina D con el fin de tratar estas alteraciones. Una vez corregido estos factores y si hay persistencia y progresión de los niveles de PTH puede iniciarse tratamiento con activadores del receptor de vitamina D (Tablas 1 y 2). Hay que tener presente que en enfermos con ERC en diálisis la recomendación es mantener niveles de PTH entre 2 a 9 veces el valor límite normal del ensayo (130–585pg/ml) dado que bajo los niveles sugeridos previamente por KDOQI (150–300pg/ml) hasta un 40% de los enfermos tenían enfermedad ósea adinámica (44). En las Tablas 5 y 6 se muestran esquemas de manejo para pacientes con ERC en estadíos 1 a 4.
Niveles Óptimos En Los Diferentes Estadíos De ERC
| Niveles óptimos en los diferentes estadios de ERC | ||
|---|---|---|
| Estadío 1 | 25(OH)vitD≥30ng/ml | Ca=8.4 − 9.5mg/dl |
| PTHi<65pg/ml | P=2.7 − 4.6mg/dl | |
| Estadío 2 FG: 60–89ml/min) | 25(OH)vitD≥30ng/ml | Ca=8.4 − 9.5mg/dl |
| PTHi<65pg/ml | P=2.7 − 4.6mg/dl | |
| Estadío 3 FG: 30–59ml/min) | 25(OH)vitD≥30ng/ml | Ca=8.4 − 9.5mg/dl |
| PTHi<65pg/ml | P=2.7 − 4.6mg/dl | |
| Estadío 4 FG: 15–29ml/min) | 25(OH)vitD≥30ng/ml | Ca=8.4 − 9.5mg/dl |
| PTHi<110pg/ml | P=2.7 − 4.6mg/dl | |
Las alteraciones del fósforo y calcio sólo se aprecian en el desarrollo tardío de la ERC debido a los fenómenos adaptativos que ocurren en los estadíos tempranos. El objetivo terapéutico debe estar enfocado en prevenir las consecuencias de las alteraciones óseo-minerales y para ello las acciones deben ser tomadas al inicio de la ERC, cuando se hacen presente los mecanismos adaptativos que permiten una “normalización” de calcio y fósforo, a expensas de un ascenso de PTH y disminución de los niveles de vitamina D. Es importante disminuir la carga de fósforo que recibe un paciente con ERC, aunque tenga fosfemia normal, y su monitorización, en ausencia de medición en nuestro medio de 1,25(OH)2vitaminaD y FGF-23, se puede lograr a través de la medición de fósforo urinario.
El autor declara no tener conflictos de interés, en relación a este artículo.